医疗器械质量记录(全套表格)(doc59页).doc
医疗器械质量检测记录表

医疗器械质量检测记录表
1. 引言
本文档为医疗器械的质量检测记录表,用于对医疗器械的质量进行检验和记录。
通过对医疗器械的外观、尺寸、功能性能、安全性能、材料成分和寿命进行测试,以保证医疗器械的质量符合相关标准和要求。
2. 检测项目及标准
3. 检测方法
- 外观检查:对医疗器械的外观进行检查,确保无明显缺陷。
- 尺寸测量:使用相应的测量工具对医疗器械进行尺寸测量,
确保符合标准尺寸。
- 功能性能测试:根据医疗器械的说明书进行功能性能的测试,确保其正常运行。
- 安全性能测试:根据医疗器械的说明书进行安全性能的测试,确保其无安全隐患。
- 材料成分分析:对医疗器械的材料成分进行分析,确保符合
相关要求。
- 寿命测试:根据医疗器械的说明书进行寿命测试,确保其使用寿命符合要求。
4. 检测记录
5. 结论
根据医疗器械质量检测记录表的检测结果,医疗器械的质量符合相关标准和要求,可以正常使用。
6. 参考文献
[1] 医疗器械质量管理要求. GB/T -2016
[2] 医疗器械质量检验检测通则. YY/T 0287-2017
[3] 医疗器械寿命试验指南. YY/T 0644-2014。
医疗器械经营企业记录表格(质量记录表格)
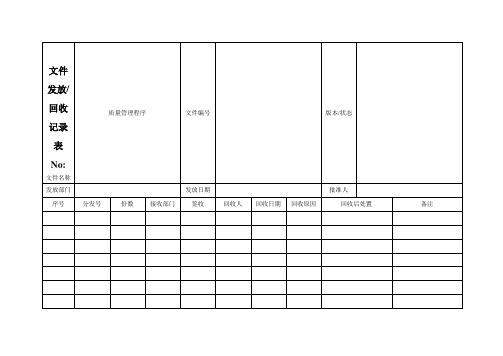
医疗器械质量信息反馈单编号: 反馈部门:
首营企业审批表
审核表应附资料:
1.医疗器械经营许可证或医疗器械生产许可证(复印件加盖红章)。
2.营业执照、税务登记证、组织机构代码证(复印件加盖红章)。
3.授权委托书原件。
首营品种审批表
编号:
注: 附医疗器械生产/经营企业许可证、营业执照、医疗器械产品注册证、质量标准、出厂检验报告、委托书及业务员身份证复印件、样品、价格批文等资料。
医疗器械购进记录
医疗器械退货记录表
医疗器械入库验收单
医疗器械拒收单
医疗器械养护、检查表
医疗器械养护处理记录
医疗器械质量复检通知单
医疗器械质量查询函
近效期医疗器械预警表
医疗器械客户资格审核表
医疗器械销售记录表
医疗器械产品出库复核记录
医疗器械售后服务记录
质量问题追踪表
医疗器械产品质量查询、投诉记录表
医疗器械用户访问处理意见表
质量事故报告单
质量事故确认处理记录表
可疑医疗器械不良事件报告表
医疗器械销售退回申请单
医疗器械退回验收记录
医疗器械退回记录
医疗器械召回事件报告表补救无害化处理销毁
医疗器械召回计划实施情况报告
报告单位: (盖章)负责人: (签字)报告人: (签字)报告日期: 不合格品医疗器械确认表
不合格医疗器械报损审核表
不合格医疗器械产品处理记录表
不合格医疗器械销毁记录表
医疗器械培训计划表
年度培训记录表
年度体检汇总表档案
医疗器械员工健康档案表
医疗器械设施设备一览表
质量管理制度执行情况自查考试记录。
医疗器械质量记录(全套表格)

医疗器械质量记录(全套表格)医疗器械质量管理记录表格包括以下内容:1.文件修订申请表这个表格记录了对文件进行修订的申请。
在这个表格中,可以记录申请的原因、修订的内容以及修订的日期等信息。
这个表格可以帮助管理者追踪文件修订的历史和原因。
2.文件发放记录表这个表格记录了向哪些人员发放了文件。
在这个表格中,可以记录发放的日期、发放的人员、发放的文件名称等信息。
这个表格可以帮助管理者追踪文件的流向和发放情况。
3.文件回收记录表这个表格记录了哪些文件被回收了。
在这个表格中,可以记录回收的日期、回收的人员、回收的文件名称等信息。
这个表格可以帮助管理者追踪文件的回收情况。
4.文件销毁申请表这个表格记录了对哪些文件进行销毁的申请。
在这个表格中,可以记录申请的原因、销毁的文件名称、销毁的日期等信息。
这个表格可以帮助管理者追踪文件销毁的历史和原因。
5.文件销毁记录表这个表格记录了哪些文件被销毁了。
在这个表格中,可以记录销毁的日期、销毁的人员、销毁的文件名称等信息。
这个表格可以帮助管理者追踪文件的销毁情况。
6.质量管理体系问题改进和措施跟踪记录这个表格记录了质量管理体系中出现的问题和采取的措施。
在这个表格中,可以记录问题的描述、解决方案、实施时间等信息。
这个表格可以帮助管理者追踪质量管理体系中的问题和解决情况。
13、员工健康档案表员工健康档案表是一份重要的文档,它记录了员工的健康状况和医疗史。
在这个表格中,我们需要填写员工的个人信息、体检记录、病史、药物过敏史等内容。
这些信息对于企业管理者来说非常重要,因为它们可以帮助我们更好地了解员工的身体状况,为员工提供更好的保健服务。
14、员工健康检查汇总表员工健康检查汇总表是一份汇总员工体检结果的文档。
在这个表格中,我们需要记录员工的体检项目、检查结果、医生建议等内容。
这些信息可以帮助企业管理者更好地了解员工的身体状况,及时发现健康问题,采取措施预防疾病,保障员工的身体健康。
医疗器械记录表格(可打印修改)

A.患者资料 1.患者姓名: 4.预期治疗疾病:
2.年龄: 3.性别:□ 男 □ 女
5.并发疾病:
6.既往疾病:
B.不良事件情况
7.事件后果
□ 死亡
(时间) □ 危胁生命
□ 机体功能结构永久伤害 □ 需要治疗避免永久损伤 □ 其它
8.事件发生日期: 年 月 日 9.事件报告日期: 年 月 日
品名
规格
数量
生产批号
退货日期
退
货
原
因
质检员签字:
年月日
领 导 批 示
负责人签字:
年月日
处
理
结
果
经办人签字:
年月日
6
华晨宏业(天津)科技有限公司安装调试维修记录
使用 单位 供货 单位 生产 厂家 产品 名称
地址 地址 地址 规格 型号
电话 电话 电话 机器 编号
联系 人
联系 人
联系 人
生产 日期
生产、经营企业许可证 号
10.不良事件的发生地点:
□ 医院
□ 诊所 □ 家庭 □ 其它
9
1.事件的陈述:(至少包括器械使用地点、时间、使用目的、使用依据、使用情况、出现 的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)
报告人:
医师□
技师□
护士□
其他□
联系地址:
邮编:
联系电话:
编码:□□□□□□□□□□□
C.医疗器械情况 12.产品名称:
品名:
规格:
计量单位:
凭证号
摘
要
入库
数量
金额
发出
医疗器械质量记录文本[[全套]表格]
![医疗器械质量记录文本[[全套]表格]](https://img.taocdn.com/s3/m/b2d93117376baf1ffc4fad40.png)
医疗器械质量管理记录1、文件修订申请表 (3)2、文件发放记录表 (4)3、文件回收记录表 (5)4、文件销毁申请表 (6)5、文件销毁记录表 (7)6、质量管理体系问题改进和措施跟踪记录 (8)7、医疗器械群体不良事件基本信息表 (9)8、医疗器械不良反应/事件报告表 (10)9、质量查询、投诉、服务记录 (11)10、质量事故调查、处理表 (12)11、医疗器械质量投诉处理记录 (13)12、质量事故处理跟踪记录 (14)13、员工健康档案表 (15)14、员工健康检查汇总表 (16)15、年度质量培训计划表 (17)16、培训签到表 (18)17、培训实施记录表 (19)18、员工个人培训教育档案 (20)19、设施设备台帐 (21)20、设施设备运行维护使用记录 (22)21、计量器具检定记录 (23)22、医疗器械养护质量情况分析季度报表 (24)23、医疗器械质量信息反馈表 (25)24、医疗器械质量信息传递处理单 (26)25、医疗器械召回记录 (27)26、医疗器械追回记录 (28)27、不合格医疗器械台帐 (29)28、不合格医疗器械报损审批表 (30)29、不合格医疗器械报损销毁审批表 (31)30、质量管理制度执行情况自查及整改记录表 (32)31、质量管理制度执行情况检查和考核记录表 (33)32、医疗器械采购记录 .......................................................................................................................................... .3433、医疗器械收货记录 (35)34、医疗器械验收记录 (33)35、医疗器械出库记录 (37)36、温湿度记录表 (33)37、计算机系统权限授权审批记录表 (33)38、车辆日常保养及卫生检查表 (40)39、月卫生检查记录表 (41)40、设施设备检修维护记录 (42)41、医疗器械质量监控检查记录 (33)42、医疗器械质量复查报告单 (33)43、医疗器械停售通知单 (33)44、医疗器械解除停售通知单 (33)45、医疗器械拒收通知单 (33)46、合格供货方档案表 (33)47、储存作业区来访人员登记表 (33)48、首营企业审批表 (50)49、首营品种审批表 (33)50、全体人员情况表 (33)51、供货企业质量体系评定表 (33)52、质量保证体系调查表 (33)53、医疗器械质量档案表 (33)54、医疗器械质量信息汇总表 (56)1、文件修订申请表编号:JYBN-QXJL-001-012、文件发放记录表编号:JYBN-QXJL-002-013、文件回收记录表编号:JYBN-QXJL-003-014、文件销毁申请表编号:JYBN-QXJL-004-015、文件销毁记录表编号:JYBN-QXJL-005-016、质量管理体系问题改进和措施跟踪记录编号:JYBN-QXJL-006-01编号:JYBN-QXJL-007-01报告日期:年月日编号:JYBN-QXJL-008-01首次报告□跟踪报告□报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□9、质量查询、投诉、售后服务记录编号:JYBN-QXJL-009-0110、质量事故调查、处理表11、医疗器械质量投诉处理记录编号:JYBN-QXJL-011-0112、质量事故处理跟踪记录编号:JYBN-QXJL-012-0113、员工健康档案表编号: JYBN-QXJL-013-01注:应将历次体检结果证明文件存入档案14、员工健康检查汇总表编号: JYBN-QXJL-014-01专业知识分享15、年度培训计划表编号:JYBN-QXJL-015-01质管部:行政部:审批人:专业知识分享WORD格式整理16、培训签到表编号:JYBN-QXJL-016-0117、培训实施记录表编号:JYBN-QXJL-017-01专业知识分享18、员工个人培训教育档案编号:JYBN-QXJL-018-01记录人:专业知识分享19、设施设备台帐编号:JYBN-QXJL-019-0120、设施设备运行维护使用记录编号:JYBN-QXJL-020-0121、计量器具检定记录编号:JYBN-QXJL-021-0122、医疗器械养护情况汇总分析季度报表编号:JYBN-QXJL-022-01养护员:汇总日期:年月日23、医疗器械质量信息反馈表编号:JYBN-QXJL-023-0124、医疗器械质量信息传递处理单编号:JYBN-QXJL-024-0125、医疗器械召回记录编号:JYBN-QXJL-025-01专业知识分享26、医疗器械追回记录编号:JYBN-QXJL-026-01专业知识分享27、不合格医疗器械台帐编号:JYBN-QXJL-027-01专业知识分享WORD格式整理28、不合格医疗器械报损审批表编号:JYBN-QXJL-028-0129、不合格医疗器械报损销毁审批表编号:JYBN-QXJL-030-01部门:年月日编号:JYBN-QXJL-031-0132、医疗器械采购记录编号:JYBN-QXJL-032-01专业知识分享33、医疗器械收货记录编号:JYBN-QXJL-033-01专业知识分享34、医疗器械验收记录编号:JYBN-QXJL-034-0135、医疗器械出库记录专业知识分享专业知识分享WORD格式整理36、温湿度记录表编号:JYBN-QXJL-036-01年月37、计算机系统权限授权审批记录表编号:JYBN-QXJL-037-0138、车辆日常保养及卫生检查表编号: JYBN-QXJL-038-0139、月卫生检查记录表编号:JYBN-QXJL-039-01 检查日期:年月日的符合或不符合的□内打√。
医疗器械质量记录

医疗器械质量管理记录1、文件修订申请表32、文件发放记录表43、文件回收记录表54、文件销毁申请表65、文件销毁记录表76、质量管理体系问题改进和措施跟踪记录87、医疗器械群体不良事件基本信息表98、医疗器械不良反应/事件报告表109、质量查询、投诉、服务记录1210、质量事故调查、处理表1311、医疗器械质量投诉处理记录1512、质量事故处理跟踪记录1613、员工健康档案表1814、员工健康检查汇总表1915、年度质量培训计划表2016、培训签到表2217、培训实施记录表2418、员工个人培训教育档案2519、设施设备台帐2720、设施设备运行维护使用记录2821、计量器具检定记录2922、医疗器械养护质量情况分析季度报表3123、医疗器械质量信息反馈表3224、医疗器械质量信息传递处理单3325、医疗器械召回记录3526、医疗器械追回记录3627、不合格医疗器械台帐3828、不合格医疗器械报损审批表3929、不合格医疗器械报损销毁审批表4030、质量管理制度执行情况自查与整改记录表4131、质量管理制度执行情况检查和考核记录表4232、医疗器械采购记录.3433、医疗器械收货记录3534、医疗器械验收记录4235、医疗器械出库记录3736、温湿度记录表4237、计算机系统权限授权审批记录表4238、车辆日常保养与卫生检查表4039、月卫生检查记录表4140、设施设备检修维护记录4241、医疗器械质量监控检查记录4242、医疗器械质量复查报告单4243、医疗器械停售通知单4244、医疗器械解除停售通知单4245、医疗器械拒收通知单4246、合格供货方档案表4247、储存作业区来访人员登记表4248、首营企业审批表5049、首营品种审批表4250、全体人员情况表4251、供货企业质量体系评定表4252、质量保证体系调查表4253、医疗器械质量档案表4254、医疗器械质量信息汇总表561、文件修订申请表编号:JYBN-QXJL-001-012、文件发放记录表编号:JYBN-QXJL-002-013、文件回收记录表编号:JYBN-QXJL-003-014、文件销毁申请表编号:JYBN-QXJL-004-015、文件销毁记录表编号:JYBN-QXJL-005-016、质量管理体系问题改进和措施跟踪记录编号:JYBN-QXJL-006-017、医疗器械群体不良事件基本信息表编号:JYBN-QXJL-007-018、医疗器械不良反应/事件报告表编号:JYBN-QXJL-008-01首次报告□ 跟踪报告□报告类型:新的□ 严重□ 一般□报告单位类别:医疗机构□经营企业□ 生产企业□ 个人□ 其他□9、质量查询、投诉、售后服务记录编号:JYBN-QXJL-009-0110、质量事故调查、处理表编号:JYBN-QXJL-010-0111、医疗器械质量投诉处理记录编号:JYBN-QXJL-011-0112、质量事故处理跟踪记录编号:JYBN-QXJL-012-0113、员工健康档案表编号:JYBN-QXJL-013-01注:应将历次体检结果证明文件存入档案14、员工健康检查汇总表编号: JYBN-QXJL-014-0119 / 7615、年度培训计划表编号:JYBN-QXJL-015-0120 / 76质管部:行政部:审批人:21 / 7616、培训签到表编号:JYBN-QXJL-016-0117、培训实施记录表编号:JYBN-QXJL-017-0124 / 76核准:记录:18、员工个人培训教育档案编号:JYBN-QXJL-018-0125 / 76记录人:26 / 7619、设施设备台帐编号:JYBN-QXJL-019-0120、设施设备运行维护使用记录编号:JYBN-QXJL-020-0121、计量器具检定记录编号:JYBN-QXJL-021-0122、医疗器械养护情况汇总分析季度报表编号:JYBN-QXJL-022-01养护员:汇总日期:年月日23、医疗器械质量信息反馈表编号:JYBN-QXJL-023-0124、医疗器械质量信息传递处理单编号:JYBN-QXJL-024-0125、医疗器械召回记录编号:JYBN-QXJL-025-0135 / 7626、医疗器械追回记录编号:JYBN-QXJL-026-0136 / 7637 / 7627、不合格医疗器械台帐编号:JYBN-QXJL-027-0138 / 7628、不合格医疗器械报损审批表编号:JYBN-QXJL-028-0129、不合格医疗器械报损销毁审批表编号:JYBN-QXJL-029-0130、质量管理制度执行情况自查与整改记录表编号:JYBN-QXJL-030-01部门:年月日31、质量管理制度执行情况检查和考核记录表编号:JYBN-QXJL-031-01被检查部门:日期32、医疗器械采购记录编号:JYBN-QXJL-032-0144 / 7645 / 7633、医疗器械收货记录编号:JYBN-QXJL-033-0146 / 7634、医疗器械验收记录编号:JYBN-QXJL-034-0147 / 7635、医疗器械出库记录编号:JYBN-QXJL-035-0148 / 7649 / 7636、温湿度记录表编号:JYBN-QXJL-036-01年月。
医疗器械质量管理表格

医疗器械产品质量查询、投诉记录表
医疗器械产品质量信息档案
不合格品处理记录表
供应商档案
填写人:登记日期:年月日
用户档案
产品召回记录表
记录表编号:
可疑医疗器械不良事件报告表
报告日期:年月日
报告来源:□生产企业□经营企业□使用单位
单位名称:联系地址:邮编:
报告人:医师□技师□护士□其他□
报告人签名:
国家食品药品监督管理局监制
首营企业首营品种审批表
医疗器械质量跟踪记录。
11
欢迎您的下载,
资料仅供参考!
致力为企业和个人提供合同协议,策划案计划书,学习资料等等
打造全网一站式需求。
医疗器械质量管理记录

医疗器械企业质量管理记录全套表格1.首营企业审批表BRJL-0012.首营品种审批表BRJL-0023.医疗器械购进、验收、入库记录BRJL-0034.出库单BRJL-0045.入库单BRJL-0056.产品出库、复核、销售记录BRJL-0067.商品投诉、质量查询报告单BRJL-0078.医疗器械商品养护记录BRJL-0089.温湿度记录表BRJL-00910.售后服务登记表BRJL-01011.医疗器械售后服务反馈登记表BRJL-01112.质量问题跟踪表BRJL-01213.产品质量投诉处理记录BRJL-01314.年度员工培训记录BRJL-01415.不合格品处理记录表BRJL-01516.不良事件报告记录BRJL-01617.医疗器械销售产品召回记录BRJL-01718.程序文件执行情况自查情况表BRJL-01819.不良事件报告记录BRJL-01920.设施设备定期检查、维修、保养记录BRJL-0201:医疗器械经营许可证或医疗器械生产许可证复印件2、营业执照复印件3、委托书原件4、销售人员身份证复印件1、《营业执照》;2、《医疗器械生产企业许可证》或《医疗器械经营企业许可证》;3、企业法定代表人的委托授权书原件,委托授权书应明确授权范围及有效期;4、销售人员身份证明;5、医疗器械产品注册证书及附件;6、产品合格证明;7、产品质量标准;8、检验报告书;9、质量保证协议;10包装、标签、说明书批件和实样。
以上资料除不能提供原件外,复印件需加盖原单位红色印章医疗器械购进、验收、入库记录年度精选范本出库单入库单精选范本制单日期:验收员签字:精选范本产品出库、复核、销售记录精选范本商品投诉、质量查询报告单精选范本医疗器械商品养护记录精选范本.温湿度记录表(年月)库区:适宜湿度范围:0~30℃适宜相对湿度范围45~75%售后服务登记表编号:精选范本医疗器械售后服务反馈登记表编号:精选范本质量问题跟踪表产品质量投诉处理记录年度员工培训记录不合格品处理记录表不良事件报告记录.精选范本医疗器械销售产品召回记录程序文件执行情况自查情况表不良事件报告记录.精选范本设施和设备安装、维修、调试及定期检查、保养记录。
2020全套医疗器械质量管理记录表格
签字:年月日
质量事故发生报告单
质量事故确认处理报告单
编号:XXXX-QM(QX)-013-XXXX
第1页
共1页
修订号
版号
XXXX
XXXX年XX月XX日发布XXXX年XX月XX日实施
事故报告部门
日期
事故调查、核实、确认:
经办人:日期:
事故损失认定:
损失认定部门:日期:
部门负责人对事故损失认定的意见:
质管员: 日期:
处理结果
保管员: 日期:
养护员: 日期:
近效期医疗器械催销表
编号:XXXX-QM(QX)-007-XXXX
第1页
共1页
修订号
版号
XXXX
XXXX年XX月XX日发布XXXX年XX月XX日实施
序号
商品编号
商品名称
规格/
型号
单位
生产
厂家
包装数
批号/灭菌批号
生产日期
有效期至
数量
件数
显示货位
供货单位
存放货位
购进日期
有效期
购进单位
复查原因:
验收员/养护员:年月日
处理意见:
质量管理人员:年月日
医疗器械拒收单
编号:XXXX-QM(QX)-010-XXXX
第1页
共1页
修订号
版号
XXXX
XXXX年XX月XX日发布XXXX年XX月XX日实施
医疗器械拒收单
日期:年月日
品名
规格/型号
供货单位
生产企业
批号/灭菌批号
序号
文件名称
编号
分发号
版本
发放记录
回收记录
医疗器械质量管理记录表格(横表)
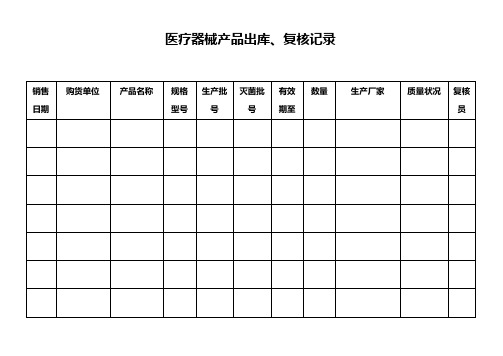
供货单位
产品名称
规格
型号
数量
生产
批号
注册
证号
灭菌
批号
效期
生产单位
质量
状况
验收
结论
验收人
出库单
购货单位:日期:
购货单位
产品名称
规格型号
数量
生产日期
灭菌日期
生产厂家
注册证号
质量情况
有效期
保管员:复核员:
入库单
制单日期:
产品名称
规格型号
数量
生产厂家
生产批号
灭菌批号
注册证号
有效期
验收员签字:
商品投诉、质量查询记录
医疗器械效期产品管理记录
序号
日期
产品名称
规格型号
生产厂家
生产批号
数量
有效期至
产品状态
处理结果
库管员签字
用户访问联系记录表
业务员:年度
日期
访问客户
访问结果(客户意见)
答复被访客户(时间及内容)
时间
访问项目
客户名称
联系电话
日期
客户名称
投诉内容
投诉
产品
生 产
批号
效期
生产厂家
投诉内容
医疗器械产品养护、检查记录
养 护
日期
品名
规格
数量
供货
单位
生产厂家
生产
批号
效期
温度
湿度
外观质量
测试
结果
养护员
医疗器械售后服务反馈登记表
编号:
反馈单位
部门
姓名
职务
详细地址
电话
医疗器械质量记录(全套表格)(DOC59页)

医疗器械质量管理记录1、文件修订申请表 (3)2、文件发放记录表 (4)3、文件回收记录表 (5)4、文件销毁申请表 (6)5、文件销毁记录表 (7)6、质量管理体系问题改进和措施跟踪记录 (8)7、医疗器械群体不良事件基本信息表 (9)8、医疗器械不良反应/事件报告表 (10)9、质量查询、投诉、服务记录 (11)10、质量事故调查、处理表 (12)11、医疗器械质量投诉处理记录 (13)12、质量事故处理跟踪记录 (14)13、员工健康档案表 (15)14、员工健康检查汇总表 (16)15、年度质量培训计划表 (17)16、培训签到表 (18)17、培训实施记录表 (19)18、员工个人培训教育档案 (20)19、设施设备台帐 (21)20、设施设备运行维护使用记录 (22)21、计量器具检定记录 (23)22、医疗器械养护质量情况分析季度报表 (24)23、医疗器械质量信息反馈表 (25)24、医疗器械质量信息传递处理单 (26)25、医疗器械召回记录 (27)26、医疗器械追回记录 (28)27、不合格医疗器械台帐 (29)28、不合格医疗器械报损审批表 (30)29、不合格医疗器械报损销毁审批表 (31)30、质量管理制度执行情况自查及整改记录表 (32)31、质量管理制度执行情况检查和考核记录表 (33)32、医疗器械采购记录 .......................................................................................................................................... .3433、医疗器械收货记录 (35)34、医疗器械验收记录 (33)35、医疗器械出库记录 (37)36、温湿度记录表 (33)37、计算机系统权限授权审批记录表 (33)38、车辆日常保养及卫生检查表 (40)39、月卫生检查记录表 (41)40、设施设备检修维护记录 (42)41、医疗器械质量监控检查记录 (33)42、医疗器械质量复查报告单 (33)43、医疗器械停售通知单 (33)44、医疗器械解除停售通知单 (33)45、医疗器械拒收通知单 (33)46、合格供货方档案表 (33)47、储存作业区来访人员登记表 (33)48、首营企业审批表 (50)49、首营品种审批表 (33)50、全体人员情况表 (33)51、供货企业质量体系评定表 (33)52、质量保证体系调查表 (33)53、医疗器械质量档案表 (33)54、医疗器械质量信息汇总表 (56)1、文件修订申请表编号:JYBN-QXJL-001-012、文件发放记录表编号:JYBN-QXJL-002-013、文件回收记录表编号:JYBN-QXJL-003-014、文件销毁申请表编号:JYBN-QXJL-004-015、文件销毁记录表编号:JYBN-QXJL-005-016、质量管理体系问题改进和措施跟踪记录编号:JYBN-QXJL-006-017、医疗器械群体不良事件基本信息表编号:JYBN-QXJL-007-01报告日期:年月日8、医疗器械不良反应/事件报告表编号:JYBN-QXJL-008-01首次报告□跟踪报告□报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□9、质量查询、投诉、售后服务记录编号:JYBN-QXJL-009-0110、质量事故调查、处理表审批人:11、医疗器械质量投诉处理记录编号:JYBN-QXJL-011-0112、质量事故处理跟踪记录编号:JYBN-QXJL-012-0113、员工健康档案表编号:JYBN-QXJL-013-01注:应将历次体检结果证明文件存入档案14、员工健康检查汇总表编号:JYBN-QXJL-014-011615、年度培训计划表编号:JYBN-QXJL-015-01质管部:行政部:审批人:1716、培训签到表编号:JYBN-QXJL-016-0117、培训实施记录表编号:JYBN-QXJL-017-0118、员工个人培训教育档案19编号:JYBN-QXJL-018-01记录人:2019、设施设备台帐编号:JYBN-QXJL-019-0120、设施设备运行维护使用记录编号:JYBN-QXJL-020-0121、计量器具检定记录编号:JYBN-QXJL-021-0122、医疗器械养护情况汇总分析季度报表编号:JYBN-QXJL-022-01养护员:汇总日期:年月日23、医疗器械质量信息反馈表编号:JYBN-QXJL-023-0124、医疗器械质量信息传递处理单编号:JYBN-QXJL-024-0125、医疗器械召回记录编号:JYBN-QXJL-025-012726、医疗器械追回记录编号:JYBN-QXJL-026-01282927、不合格医疗器械台帐编号:JYBN-QXJL-027-013028、不合格医疗器械报损审批表编号:JYBN-QXJL-028-0129、不合格医疗器械报损销毁审批表编号:JYBN-QXJL-029-0130、质量管理制度执行情况自查及整改记录表编号:JYBN-QXJL-030-01部门:年月日31、质量管理制度执行情况检查和考核记录表编号:JYBN-QXJL-031-01被检查部门:日期32、医疗器械采购记录编号:JYBN-QXJL-032-013533、医疗器械收货记录编号:JYBN-QXJL-033-0136编号:JYBN-QXJL-034-01373836、温湿度记录表编号:JYBN-QXJL-036-01年月37、计算机系统权限授权审批记录表编号:JYBN-QXJL-037-0138、车辆日常保养及卫生检查表编号:JYBN-QXJL-038-01车牌号:填表日期:年月4039、月卫生检查记录表编号:JYBN-QXJL-039-01检查日期:年月日的符合或不符合的□内打√。
医疗器械质量管理记录表格(横表)
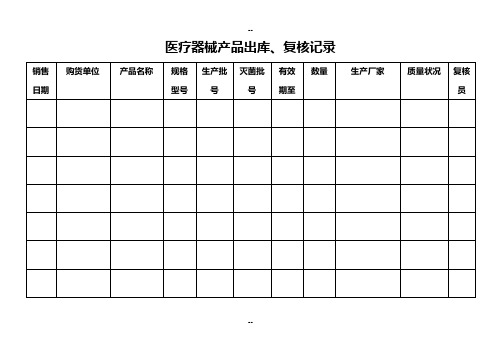
医疗器械产品出库、复核记录
销售
日期
购货单位
产品名称
规格
型号
生产批号
灭菌批号
有效
期至
数量
生产厂家
质量状况
复核员
医疗器械产品购进记录
购进日期
供货单位
产品名称
规格
型号
数量
生产批号
灭菌批号
效期
生产单位
经办人
医疗器械产品销售记录
销售日期
客户名称
产品名称
规格
型号
数量
生产批号
灭菌批号
效期
生产单位
经办人
医疗器械产品验收/检验记录
到货日期
供货单位
产品名称
规格
型号
数量
生产
批号
注册
证号
灭菌
批号
效期
生产单位
质量
状况
验收
结论
验收人
出库单
购货单位: 日期:购货单位产品名称Fra bibliotek规格型号
数量
生产日期
灭菌日期
生产厂家
注册证号
质量情况
有效期
保管员: 复核员:
入库单
制单日期:
产品名称
规格型号
数量
生产厂家
生产批号
灭菌批号
注册证号
有效期
验收员签字:
商品投诉、质量查询记录
日期
客户名称
投诉内容
投诉
产品
生 产
批 号
效 期
生产厂家
投诉内容
医疗器械产品养护、检查记录
养 护
日 期
品名
规 格
数量
供货
医疗器械经营企业质量管理记录

医疗器械经营企业质量管理记录首营企业审批表企业名称:企业地址:社会统一信用代码:许可证号:有效期限:法定代表人:联系人:销售人员:传真:联系身份证号:注册资金:发证日期:经营方式:类别:器械生产企业 / 器械经营企业(生产企业略)经营或生产范围:拟购进品种:采购意见(签字):年月日审核意见:质量负责人(签字):年月日审批意见:法人或企业负责人(签字):年月日审批表应附资料(均应加盖供方原印章):1、医疗器械经营许可证(第二类经营备案凭证)或医疗器械生产许可证(第一类生产备案凭证)复印件;2、营业执照复印件;3、销售人员授权书原件;4、销售人员身份证复印件;5、供货方随货同行单样本。
首营品种审批表产品名称:型号规格:产品性能:结构及组成:产品适用范围:产品禁忌症:生产企业名称:生产地址:供货企业名称:业务联系人:法定代表人:联系法定代表人:联系注册证号(备案凭证号):储运条件:供货企业生产或经营范围:采购意见(签字):年月日审核意见:审批意见:审批表应符资料(均应加盖供货方原印章):1、医疗器械产品注册证(变更文件)或备案凭证;2、产品外包装、标签、说明书;3、样品或宣传彩页;4、采购合同或协议(含质量保证协议);法人或企业负责人(签字):年月日质量负责人(签字):年月日医疗器械采购记录序号购货日期名称规格(型号)产品注册证号或(备案凭证编号)单位数量单价金额供货单位生产厂家备注医疗器械验收记录年度有效期或失效期生产企业供货者到货数量到货日期验收合格数量验收结果验收人员验收日期备注序号名称规格(型号)注册证号或备案凭证号批号或序列号生产日期医疗器械在库养护、检查记录年度检查日期名称规格(型号)注册证号或备案凭证号批号或序列号生产日期有效期或失效期生产企业数量外观是否完好包装有无破损处理结果养护员签字备注医疗器械出库、复核记录年度出库日期购货者名称规格型号注册证号或备案凭证编号批号或序列号生产日期有效期或失效期生产企业数量质量状况复核员备注医疗器械运输记录年度序号送货日期购货者送货地址销售清单(随货同行单)号出发时间送达时间送货车辆接收人送货人备注日期供货者购货者名称号(备案凭证编号)退货原因备注医疗器械销售记录(批发)年度008:本文记录了医疗器械批发销售的详细信息,包括销售日期、名称、规格、型号、注册证号或备案凭证编号、数量、单价、金额、批号或序列号、生产许可证、有效期、生产企业号或备案凭证编号、经营许可证、购货者名称号(备案凭证编号)、经营地址联系方式等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医疗器械质量管理记录1、文件修订申请表2、文件发放记录表3、文件回收记录表4、文件销毁申请表5、文件销毁记录表6、质量管理体系问题改进和措施跟踪记录7、医疗器械群体不良事件基本信息表8、医疗器械不良反应/ 事件报告表109、质量查询、投诉、服务记录1210、质量事故调查、处理表1311、医疗器械质量投诉处理记录1412、质量事故处理跟踪记录1513、员工健康档案表1714、员工健康检查汇总表1815、年度质量培训计划表1916、培训签到表2017、培训实施记录表2118、员工个人培训教育档案2219、设施设备台帐2320、设施设备运行维护使用记录2421、计量器具检定记录2522、医疗器械养护质量情况分析季度报表2623、医疗器械质量信息反馈表2724、医疗器械质量信息传递处理单2825、医疗器械召回记录2926、医疗器械追回记录3027、不合格医疗器械台帐3228、不合格医疗器械报损审批表3329、不合格医疗器械报损销毁审批表3430、质量管理制度执行情况自查及整改记录表3531、质量管理制度执行情况检查和考核记录表3632、医疗器械采购记录.3433、医疗器械收货记录3534、医疗器械验收记录3635、医疗器械出库记录3736、温湿度记录表3637、计算机系统权限授权审批记录表3638、车辆日常保养及卫生检查表4039、月卫生检查记录表4140、设施设备检修维护记录4241、医疗器械质量监控检查记录3642、医疗器械质量复查报告单3643、医疗器械停售通知单3644、医疗器械解除停售通知单3645、医疗器械拒收通知单3646、合格供货方档案表3647、储存作业区来访人员登记表3648、首营企业审批表5049、首营品种审批表3650、全体人员情况表3651、供货企业质量体系评定表3652、质量保证体系调查表3653、医疗器械质量档案表3654、医疗器械质量信息汇总表561、文件修订申请表编号:JYBN-QXJL-001-01文件编号文件名称版本号使用部门申请人修订原因:修订内容:所在部门意见:签名: 日期:2、文件发放记录表编号:JYBN-QXJL-002-013、文件回收记录表编号:JYBN-QXJL-003-014、文件销毁申请表编号:JYBN-QXJL-004-015、文件销毁记录表编号:JYBN-QXJL-005-016、质量管理体系问题改进和措施跟踪记录编号:JYBN-QXJ L-006-01存在问题及原因:预防及纠正措施:接受部门负责人意见负责人: 实施情况反馈:日期: 验证:实施负责人:要求完成时间: 日期: 考核人:实际完成时间:日期:文件发出部门收件部门收件人发出人发出日期7、医疗器械群体不良事件基本信息表编号:JYBN-QXJL-007-01群体不良事件过程描述及处理情况(可附页)报告日期:注册号或 者备案凭 证号医疗器械名称规格(型号)批号(序 列号)生产企业供货者并 品 器戒注册号或者备案凭证号医疗器械名称生产企业批号(序列号)本栏所指器戒是与怀疑医疗器械冋时使用且可能与群体不良事件相关的注射器,输液 器等医疗器戒。
首例用药日期:首例发生日期:日日不良事件表现:年 月年 月报告单位意见: 报告人信息 电话:电子邮箱: 签名: 报告单位信息报告单位:联系人: 电话:发生地区:发生不良事件人数:使用单位: 严重不良事件人数:使用人数: 死亡人数:&医疗器械不良反应/事件报告表不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页)停药或减量后,反应/事件是否消失或减轻? 是口 否口 不明□ 未停药或未减量口再次使用可疑医疗器械后是否再次出现同样反应/事件? 是口 否口 不明□未再使用口 对原患疾病的影响: 不明显□ 病程延长口 病情加重口导致后遗症□ 导致死亡口报告人评价: 肯定□ 很可能□ 可能□ 可能无关口 待评价□ 无法评价口 签名: 报告单位评价:肯定□很可能□可能□可能无关口待评价□ 无法评价口 签名:医 疗 器 械 注册号或 者备案凭 证号医疗器 械名称规格(型号) 生产企业批号(序 列号)用法用量(次剂量、途径、日次数)用药起止时间 用药原因怀 疑 器 械并 用 器 械其他□不良反应/事件名称: 不良反应/事件发生时间: 年 月 日相关重要信息:吸烟史□ 饮酒史□ 妊娠期□ 肝病史□ 肾病史□ 过敏史□患者姓名: 原患疾病:编号:JYBN-QXJL-008-01首次报告口 报告类型:新的口 企业□ 个人□ 其他□性别:男□女□跟踪报告口 严重□ 一般□出生日期:年 月曰或年龄:医院名称: 病历号/门诊号:报告单位类别:医疗机构□民族:体重(kg ):经营企业口生产联系方式:既往医疗器械不良反应/事件:有口 家族医疗器械不良反应/事件:有口无口不详□ 无口不详□不良反应/事件的结果:痊愈□死亡□好转□ 直接死因:未好转□ 不详□ 有后遗症口 表现: ___________________死亡时间:年 月 日关联性评价联系电话:职业:医生□ 药师□ 护士□ 其他□报告人信息电子邮箱:签名:报告单位信息单位名称:报告日期: 联系人: 电话: 年 月 日9、质量查询、投诉、售后服务记录编号:JYBN-QXJL-009-0110、质量事故调查、处理表编号:JYBN-QXJL-010-01事故发生描述:报告人:调查事实记录:备注质量管理部:处理意见: 销售部: 经办人: 日期:质量管理部: 销售部: 经办人: 日期:事故原因 事故性质 事故部门 事故日期 医疗器械名称 规格(型号) 注册证号或 备案凭证号 数量 单位 生产企业 事故责任人损失金额处理人日期:批号(序处理结果:质量管理部:销售部:经办人:日期:11、医疗器械质量投诉处理记录编号:JYBN-QXJL-011-01投诉人性别联系电话邮编单位或地址投诉方式规格投诉时间接待人投诉内容:调查情况:处理内容12、质量事故处理跟踪记录编号:JYBN-QXJL-012-0113、员工健康档案表编号:JYBN-QXJ L-013-01建档时间14、员工健康检查汇总表编号:JYBN-QXJ L-014-011815、年度培训计划表编号:JYBN-QXJL-015-0119质管部: 行政部: 审批人:20编号:JYBN-QXJL-016-01培训日期培训内容内容概要: 16、培训签到表地点讲师姓名22编号:JYBN-QXJL-017-01核准:17、培训实施记录表记录:18、员工个人培训教育档案编号:JYBN-QXJL-018-012319、设施设备台帐编号:JYBN-QXJL-019-0120、设施设备运行维护使用记录编号:JYBN-QXJL-020-0121、计量器具检定记录编号:JYBN-QXJL-021-0122、医疗器械养护情况汇总分析季度报表编号:JYBN-QXJL-022-01汇总日期:年月曰养护员:23、医疗器械质量信息反馈表编号:JYBN-QXJL-023-01医疗器械名称规格(型号)单位数量批号(序列号)供应商生产企业质量情况:反馈人: 日期:反馈部门意见:负责人: 日期:质管员意见:经办人: 日期:主管领导意见: 处理结果追踪:签字: 日期: 质管员: 日期:24、医疗器械质量信息传递处理单编号:JYBN-QXJL-024-0125、医疗器械召回记录编号:JYBN-QXJL-025-013026、医疗器械追回记录编号:JYBN-QXJL-026-01313227、不合格医疗器械台帐编号:JYBN-QXJL-027-013328、不合格医疗器械报损审批表编号:JYBN-QXJL-028-0129、不合格医疗器械报损销毁审批表编号:JYBN-QXJL-029-01年月日30、质量管理制度执行情况自查及整改记录表31、质量管理制度执行情况检查和考核记录表编号:JYBN-QXJL-031-01被检查部门:日期32、医疗器械采购记录编号:JYBN-QXJL-032-01编号:JYBN-QXJL-033-01编号:JYBN-QXJL-034-0135、医疗器械出库记录编号:JYBN-QXJL-035-014136、温湿度记录表编号:JYBN-QXJ L-036-01 年月37、计算机系统权限授权审批记录表编号:JYBN-QXJ L-037-0138、车辆日常保养及卫生检查表编号:JYBN-QXJ L-038-01车牌号:填表日期:年月39、月卫生检查记录表编号:JYBN-QXJL-039-01检查日期:年月日序号检查项目标准要求检查结论1周边环境无污染源,无易生虫花草,卫生状况良好。
□符合□不符合2库内内环境墙壁屋顶平整、洁白无污染,地面平整,库内无生活杂物,环境整洁,营业、生活区域分开。
□符合□不符合3医疗器械存放条件陈列用货架、地台齐备,能满足医疗器械陈列、分类存放和经营需要,分类标志醒目。
□符合□不符合4医疗器械设施设备有检测和调控库内温湿度的设备,如温湿度计、空调或风扇,有防鼠设备,如鼠夹。
□符合□不符合5库内安全情况库内门窗牢固,结构严密,电源线路无裸露,无安全隐患□符合□不符合6卫生状况货柜、货架、及医疗器械包装清洁卫生,无灰尘,人员卫生状况良好。
□符合□不符合综合检查结果□符合GSP对医疗器械陈列环境和存放条件的要求□不符合GSP对医疗器械陈列环境和存放条件的要求不合格情况处理措施和处理结果注:按制度规定时间,按期对医疗器械陈列环境和陈放条件进行综合检查,并在检查情况的符合或不符合的□内打2。
检查人:40、设施设备检修维护记录编号:JYBN-QXJ L-040-0141、医疗器械质量监控检查记录编号:JY BN-QXJL-041-0142、医疗器械质量复查报告单编号:JY BN-QXJ L-042-014843、医疗器械停售通知单编号:JYBN-QXJL-043-014944、医疗器械解除停售通知单编号:JYBN-QXJL-044-0150。
