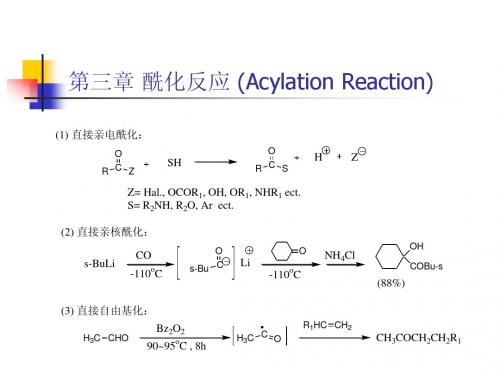
第三章 酰化反应
第三章 酰化反应

N
RCOOH + N S S N
2,2-二吡啶二硫化物
NO2
Ph3P Ph3P=O Et3N
RCOOH +
O N S C Cl
O N S C R
RCOCl + N SH
吡啶硫酚
Et3N
2-吡啶硫醇酯
优点:对仲、叔醇以及有位阻的伯醇效果较好;缺点: 硫醇酯具有特殊气味及毒性,应用受到限制。
CH3 H3C CH3 CH 3 (CH3)3COH/CH3CN/CuCl2 r.t. , 12min (96%) H3C CH3 COCl N SH H3C
CH3 CO CH3 S N
COOC(CH3)3
b.羧酸吡啶酯
OH HO(CH3)nCOOH I N CH3 (CH2)n O C O N CH3 O X Et3N , 7.5~8h I N CH3 O (CH2)n C O
c.羧酸三硝基苯酯 d. 羧酸异丙烯酯
3. 酸酐为酰化剂 酸酐是一个强酰化剂,反应具有不可逆性。酸酐多用 在反应困难或位阻较大的醇羟基的酰化上。 ①催化剂 酸性催化剂:硫酸、对甲苯磺酸、三氟化硼、氯化锌、 氯化钴 碱性催化剂:羧酸钠、吡啶、三乙胺、喹啉、N、N-二 甲基苯胺,作用:a.除掉氯化氢;b.催化作用。
C2H5
喹诺酮类抗菌药依诺沙星中间体 ③转变成其它基团
CH3 AlCl3/CS2 5℃, 3h CH3 COCH3 CH3COCl
CH(CH3)2
CH(CH3)2
(2)药物结构修饰 )
S OAc COO NHCOCH3 F3C N CH2CH2CH2 N (1) CH2OCOCH2CH2COOH CO HO OH NHCOCHCl2 CH OH O (3) O2N (4) CH CH2OCOC15H31 (2) N CH2CH2OCOC6H13
药物合成反应第三章酰化反应

+ CH3OH
O O C(CH2)3CH3
+ H2O
CH=CH-COOCH3
COOH
对甲苯磺酸
TsOH
+ C12H25OH Xylene
HO
OH
OH
COOC12H25
HO
OH
OH
(c) DCC 二环己基碳二亚胺
R-N=C=N-R
CH3-N=C=N-C(CH3)3 CH3CH2-N=C=N-(CH2)3-NEt2 (CH3)2CH-N=C=N-CH(CH3)2
OH O=C-R
+OH R-C-OC(CH3)3
属于SN1机理
-H+
O
R-C-OC(CH3)3
按SN1机理进
行反应,是烷 氧键断裂
* 3oROH按此反应机理进行酯化。 * 由于R3C+易与碱性较强的水结合,不易与羧酸结合,
故逆向反应比正向反应易进行。所以3oROH的酯化 反应产率很低。
该反应机理也 从同位素方法 中得到了证明
②羧酸的结构
R带吸电子基团-利于进行反应;R带给电子不利于反应 R的体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进行 羰基的a位连有不饱和基和芳基,除诱导效应外,还有共轭效应,使酸性增强
③催化剂 i提高羧酸反应活性
(a)质子酸催化法: 浓硫酸,氯化氢气体,磺酸等
O
H+
R C OH
O R''OH + R C OH R'
O R'' HO C R ' - H+
R'' OH
H O
O
C
第三章酰化反应-药物合成反应gcz

v 1 0.84 0.84 0.64 0.68 0.47 0.026
10
叔醇由于其立体位阻大且在酸性介质中易脱去羟基形成正碳 离子,同时形成的酯也已发生脱酯氧基而形成正碳离子,正碳 离子的稳定性使得反应不易生成酯。
C OH+H C + RCOOH
C OH2
C +H2O
O
C O CR +H
与叔醇一样,苄醇、烯丙醇由于脱羟基形成稳定的碳正离子,碳正离子与水 作用而恢复成醇的趋向大于形成酯的趋向,故同样酰化较为困难。
配 位 键 (增 加 C的 正 电 性 )
O AlCl3
OAlCl3
R
R
OH -HCl
OAlCl2
OAlCl3 R
OAlCl2
B F 3 / E t 2 O
H O O C C H C H C O O H + C H 3 O H2 0 hH 3 C O O C C H C H C O O C H 3
C O 2 H + C H 3 O HB F 3
C O 2 C H 3
对于不稳定的酸和醇(如含双键)不能用质子酸催化,而
这类催化剂尤其是BF3可避免双键的分解或重排。
15
(3) 酸性树脂(Vesley)催化法: 采用强酸型离子交换树脂加硫酸钙法,此法可加
快反应速度、提高收率。
而且此法后处理简单。
V esley法
C H 3C O O H+C H 3O H
O O
21
第三章 酰化反应
氧原子上的酰化反应(酯的制备)
由于三苯基鏻的位阻较大,所以形成醇-三苯基鏻活泼中间体 的能力与醇的大小有很大关系,这一点可以用来对不同取代的 醇进行选择性酯化。
P h 3 P + E tO O C -N + N -C O O E t
第三章 酰化反应 (Acylation Reaction)
RCOOR1
N N N N C O O C 2H 5 CH3 C H COOCH3
R C O O R 1=
C O O C 2H 5 OCH3
(9 9 % )
(9 7 % )
(9 7 % )
4. 酰氯为酰化剂
RCOCl 反应机理: R 1O H RCOCl
N O R H C OR N N COR
o
OAc C 9H 19
HO
C H 2O A c
(6 8 % ) Py
AcO C H 2O A c
HO
C H 2O H
(6 2 % )
(1)羧酸-三氟乙酸混合酸酐
RCOOH (C F 3 C O ) 2 O
O R F 3C C O C O
RCO O CO CF3
C F 3C O O H
OH
H
R F 3C
R 1O
M eO O C
COOMe O O
i- P r O O C
C O O P r -i O O
i-P rO H
T i(O P r-i) 4 70 C , 3h
o
(9 1 % )
M eO O O
C 12H 25
OH Ar
DM AP
O Ar O O
C 12H 25
A r-= 1 -萘 基
O COOMe Ph OH
Ph OCOPh O TM S OCOPh
B u 2 S n O /T o l re flu x
Ph O O S nB u2
PhC O C l r.t., 1 h
TM SCl r.t., 1 ~ 2 h
Ph
O TM S
(9 8 % )
药物合成反应-第三章---酰化反应

第二节 氧原子的酰化反应
O ROH + R' C L
O R' C
OR + HL
• 是一类形成羧酸酯的反应 • 是羧酸的酯化反应 • 是羧酸衍生物的醇解反应
一、醇的氧酰化
•1) 羧酸为酰化剂
R-OH + R'COOH
• 提高收率:
R'COOR + H2O
第三章 酰化反应
Chapter 3
Acylation Reaction
概述
• 1 定义: 有机物分子中O、N、C原子上导入 酰基的反应
O
R C L + Nu-H
酰化剂
被酰化物
O R C Nu + HL
L: X, OCOR, OH, OR', NHR Nu: R'O(O), R''NH(N), Ar(C)
仅有少量空阻大的羧酸按此反应机理进行
(3)影响因素
① 醇结构影响
•醇的结构对酰化反应的影响 •立体影响因素:伯醇>仲醇>叔醇、烯丙醇 •叔碳正离子倾向与水反应而逆转
• 电子效应的影响 • 羟基a位吸电子基团通过诱导效应降低O上
电子云密度, 使亲核能力降低 • 苄醇、烯丙醇由于p-p共轭, 使活性降低
O
I
96%
ii 用来提高醇的反应活性
偶氮二羧酸酯法(活化醇制备羧酸酯)
Mitsunobu reaction.
Mechanism
(4)应用特点
•① 伯醇酯的制备
• ② 仲醇酯的制备 薄荷醇
• ③ 叔醇酯的制备
• 2.羧酸酯为酰化剂 • (1)反应通式
第三章++酰化反应

RCOCl O R C N HOR'
N
N COR Cl
Cl
N H
Cl
+ RCOOR'
28
H3C
N CH3
CH3 N CH3 OH OBz
OH
OH
TMEDA + BzCl -78oC, 2h
99%
Bu-t OH Cl + Cl Bu-t O O
DMAP AlCl3 reflux
Bu-t O Cl Bu-t O O AlCl3
O R C OR'' OR'
RCOOR' + R''O
RCOOR'' -R'O
MeO O O
C12H25 +
OH DMAP Ar
O Ar O O
C12H25
Ar = 1-Naphtyl 97%
14
为了提高酯的酰化能力,开发了许多酰化能力比较强的活性 酯,以用于合成较为复杂的化合物,如肽、大环内酯等,这 里重点介绍几类活性酯。
NMe2 DMF/POCl3
NMe2 CHNMe2 Cl H2O
NMe2 CHO
2
酰化反应的难易由被酰化物结构和酰化剂(acylating agents) 活性决定 总的来说:
RCH2 > RNH > RO > RNH2 > ROH
RCOX > (RCO)2O > RCOOR', RCOOH > RCONHR'
+ CH3COCH3
92%
20
(5)1-羟基苯并三唑(HOBt)的羧酸酯(温和条件下面反应)
《药物合成反应》-闻韧主编第三章酰化反应-知识点总结

#2.11打卡# 完成学习目标第三章酰化反应Acylation Reaction1 定义:有机物分子中O、N、C原子上导入酰基的反应.2 分类:根据接受酰基原子的不同可分为:氧酰化、氮酰化、碳酰化3 用途:药物本身有酰基活性化合物的必要官能团结构修饰和前体药物羟基、胺基等基团的保护。
酰化机理:加成-消除机理加成阶段反应是否易于进行决定于羰基的活性:若L的电子效应是吸电子的,不仅有利于亲核试剂的进攻,而且使中间体稳定;若是给电子的作用相反。
根据上述的反应机理可以看出,作为被酰化物质来讲,无疑其亲核性越强越容易被酰化。
具有不同结构的被酰化物的亲核能力一般规律为;RCH2->R—NH->R—O->R—NH2>R—OH。
在消除阶段反应是否易于进行主要取决于L的离去倾向:L-碱性越强,越不容易离去,Cl- 是很弱的碱,-OCOR的碱性较强些,OH-、OR-是相当强的碱,NH2-是更强的碱。
RCOCl>(RCO)2O>RCOOH 、RCOOR′ >RCONH2>RCONR2′R: R为吸电子基团利于进行反应;R为给电子基团不利于反应R的体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进行酸碱催化碱催化作用是可以使较弱的亲核试剂H-Nu转化成亲核性较强的亲核试剂Nu-,从而加速反应。
酸催化的作用是它可以使羰基质子化,转化成羰基碳上带有更大正电性、更容易受亲核试剂进攻的基团,从而加速反应进行。
氧原子的酰化反应是一类形成羧酸酯的反应,是羧酸和醇的酯化反应,是羧酸衍生物的醇解反应醇的结构对酰化反应的影响伯醇(苄醇、烯丙醇除外)>仲醇>叔醇1) 羧酸为酰化剂:提高收率:(1)增加反应物浓度(2)不断蒸出反应产物之一(3)共沸除水、添加脱水剂或分子筛除水。
(无水CuSO4,无水Al2(SO4)3,(CF3CO)2O,DCC。
)加快反应速率:(1)提高温度(2)催化剂(降低活化能)催化剂(1)质子酸催化法: 无机酸:浓硫酸,氯化氢气体,有机酸:苯磺酸,对甲苯磺酸等。
酰化反应

定义:有机化合物分子中引入
酰基的反应称为酰化反 应。
用途1:活性化合物的必要官能团
O2N OHNH2 C C CH2OH H H OHNHCOCHCl2 C C CH2OH H H Cl2CHCO2Me
O2N
降低氨基毒性
COOH OCOCH3
O N H
N N S SO2NH2
用途2:结构修饰和前体药物
H N Cl N O O O Cl N H N O OH
用途3:羟基、胺基等基团的保护
H2N Me Ac2O
AcHN
Me
KMnO4
AcHN
CO2H
H2O/H+
H2N
CO2H
防止氧化副反应
酰化反应
直接酰化反应 间接酰化反应
主要发生在碳、氧、氮、硫原子上
反应类型
•亲电酰化反应 •亲核酰化反应
•自由基酰化反应
COOH
+
OH PPA/DCC COO 12h NO2 90% NO2
COOH +
OH
H2SO4/H3BO3 COO 24h 100%
Ac-TMH
Ac-TMH
• 3.1.8 羟基保护
方法:
• 甲酸酯
• 乙酸酯
• 苯甲酸酯及其衍生物
3.1.8.1.甲酸酯保护基
• 特点是易于形成,并可以在乙酰基及其他酰基存在
• 3.1.1.3 Vesley法:强酸性阳离子交换树脂
3.1.1.4 DCC及其类似物脱水法
• DCC (二环己基碳二亚胺)
R C
O O H O
+
N C N NH + R' O H N O N C N H H
药物合成反应第三章酰化反应

在有机合成中的应用
1
酰化反应是有机合成中的一种重要反应类型,可 用于合成各种具有特定结构的化合物。
2
酰化反应可以用于合成羧酸、酯、酰胺等有机化 合物,这些化合物在化学工业、农药、染料等领 域具有广泛的应用。
3
酰化反应在有机合成中还常用于合成复杂化合物 和天然产物的全合成。
在材料科学中的应用
酰化反应在材料科学中也有一定的应用,主要用于合成高分子材料和功能材料。
药物合成反应第三章 酰化反应
目录
CONTENTS
• 酰化反应概述 • 常用酰化试剂 • 酰化反应的应用 • 酰化反应的实验操作与注意事项 • 案例分析
01 酰化反应概述
定义与重要性
定义
酰化反应是一种有机化学反应,涉及 醇或酚与羧酸或其衍生物在催化剂的 作用下,通过酯化或酰胺化形成酯或 酰胺的过程。
羧酸酯
总结词
羧酸酯是一种酰化试剂,可以通过羧酸 与醇的酯化反应制备,其在药物合成中 应用广泛。
VS
详细描述
羧酸酯是羧酸与醇通过酯化反应生成的化 合物,其结构中包含一个羰基和一个酯基 。在酰化反应中,羧酸酯可以与醇或酚反 应生成相应的酯或酚酯,广泛应用于药物 合成中。由于羧酸酯的反应活性较低,通 常需要在酸性或碱性条件下进行反应。
羧酸酯的合成与性质
总结词
羧酸酯的合成通常采用羧酸与醇在酸性或碱性条件下进行酯化反应得到,其性质主要取 决于酯基和羰基的结构。
详细描述
羧酸酯的合成通常采用羧酸与醇在酸性或碱性条件下进行酯化反应得到。在酸性条件下, 羧酸与醇反应生成酯和水;在碱性条件下,羧酸与醇反应生成酯和盐。羧酸酯的性质主 要取决于酯基和羰基的结构,如取代基的性质、空间位阻等都会影响羧酸酯的反应活性。
酰化反应

RCO2- H+
R'OH
17
DCC 和有机碱(DMAP,4-吡咯烷基吡啶:PPY)合 用可用于增强反应的活性,可使反应在室温下进行。
18
应用实例
(酰化能力弱,因为可形成分子内氢键)
19
(5)偶氮二羧酸酯活化醇(重点)
合成大环内酯类化合物,使得反应条件温和,收率高。
29
(2)羧酸吡啶酯法
(羧酸/Et3N) 活性羧酸酯
n = 5 89% n = 11 69%
30
(3)羧酸三硝基苯酯法
活性羧酸酯
31
应用
32
活性羧酸酯应用的本质
本质:将羧酸中难以离去的羟基转化为易离去的基团
33
3. 酸酐作为酰化剂
酸酐是与羧酸和酯相比,是一类活性更强的酰化剂,
12
(1)质子酸催化法
无机酸:浓硫酸,氯化氢气体
有机酸:苯磺酸,对甲苯磺酸等
一些内酯的合成常用有机酸如苯磺酸、对甲苯磺酸作催化剂
13
(2)Lewis酸催化法
常用的Lewis酸:AlCl3, SnCl4, FeCl3, BF3等。 Lewis酸适用于高级不饱和脂肪酸、杂环酸的酯化, 可避免双键的分解或重排。
6
(2)间接酰化法:将酰基的等价体与有机化合物相结
合,结构中潜在的被隐蔽的酰基经过处理可以恢复成 酰基。 一些酰基核酰化:
8
3. 被酰化物和酰化剂
被酰化物的反应活性取决于被酰化原子的亲核能力; 一般被酰化物: R2CH-> RCH2 - > RO - > RNH2 > ROH 酰化剂的酰化能力取决于离去基团的离去能力与具体的 反应条件; 酰化剂: RCO-X > (RCO)2O > RCOOR', RCOOH > RCONHR'
第三章酰化反应

COCH3
②分子内的酰化反应 不饱和脂肪烃和脂环烃通过分子内酰化反也可以制备 不饱和环酮。例如:
COCl BF3/Et2O heat CO
(60%)
③烯硅烷的酰化反应 烯硅烷得酰化反应得定位具有区域专一性,由于受三甲基硅 基的影响,作为亲电试剂得酰基优先攻击硅原子所连的碳原 子而形成烯酮。例如:
得到酰化产物(107)。
X X H2C Y
O
B
HC (105) Y
O R
R
Z + HC
X Y
O Z R
X CH Y
C (106)
C (107)
+
Z
CHXY
(3)影响因素 ①活性亚甲基化合物的影响 活性亚甲基化合物的活性与其所连的两个吸电子基的种 类有关,吸电子基的吸电子能力越强,其α位的氢原子酸 性则越强,越容易发C Cl
O O
AlCl3 /CH2Cl2 0℃
CH3 CH3 (88%)
三、羰基化合物α位的C-酰化反应
羰基化合物α位的氢原子由于受相邻的羰基的影响而显 一定的酸性,α位的C原子比较活泼,可与酰化剂发生C酰化反应生成1,3-二羰基化合物。
1.活性亚甲基化合物的C-酰化 (1)反应通式
(2)反应机理
酰氯在AlCl3作用下生成羧基络合物(99)或酰基正离子 (101),然后(101)对烯烃进行亲电进攻得中间体(102), (102)脱质子得酰化产物不饱和酮(104),同时(102) 也可能与氯负离子作用得中间体β-氯代酮(103),(103) 再经脱氯化氢得产物不饱和酮(104)。
二、烯烃的C-酰化
烯烃与酰氯在AlCl3等Lewis酸催化下也可 以发生C-酰化反应,亦可以把它看成是脂 肪碳原子的Friedel-Crafts反应。 (1)反应通式
药物合成反应(第三版_闻韧)第三章 酰化反应

Organic Reactions for Drug Synthesis
例:抗胆碱药溴美喷酯(宁胃适)的合成
O C OH
HO CH3CH2ONa N CH3
60-80℃,45min
C-OCH2CH3 +
C OH
O C-O N CH3
O CH3Br C OH C-O N CH3 · Br CH3 (77%)
n-C4H9 CH Zn 175℃
2+
R'OH
O RCOR'
n-C4H9 n-C18H37 C COOH + H3C C
CH2 CH3
n-C18H37 C
COO C
n-C7H15 n C18H37 OH/H △ ,6min
+
n-C7H15 n-C4H9 COO C18H37-n + O H3C C CH3
Organic Reactions for Drug Synthesis
叔醇的酯化:SN1机理。
Organic Reactions for Drug Synthesis
SN1
O ' R-C-L
慢
O R-OH + R'-C
O R'-C + L O 快 R'-C-OR
SN2
O ' R-OH + R-C-L O ' + L R-O--C-R H
n-C18H37 C
n-C7H15
Organic Reactions for Drug Synthesis
3、酸酐为酰化剂
•与酸和酯作酰化剂相比,酸酐的酰化活性较强, 而且酰化反应是不可逆的。 •酰化反应过程可以被酸(硫酸等质子酸以及三氟 化硼等Lewis酸)和碱(主要为醋酸钠以及三乙胺 等有机碱)所催化。 •当酸酐难于制备时,也可采用混酸酐法。常用 的混酸酐有磺酸酐、磷酸酐和碳酸酐。
第三章 酰化反应

NH2 + CH3COCl CH3COONa NHCOCH3 99%
40
用作保护基:
NH2 Ac2O NHAc CH3I H3C NAc H2O NHCH3
选择性酰化:
H2N Ac2O AcHN 84% pH4.15 CH2NH2 Ac2O pH11.25 H2N 85% CH2NHAc
O CH2OH O O + I CH2O COOH DCC/DMAP 25 oC O O 96% I
8
2. 羧酸酯(ester)作为酰化剂—酯交换反应
RCOOR' + R''OH RCOOR'' + R'OH
醇解 酸解 酯交换
9
反应机理
酸催化:硫酸、TsOH
碱催化:醇钠
RCOOR' + R''O O R C OR'' OR' RCOOR'' -R'O
10
该反应是可逆反应,采用除去生成的醇以打破平 衡; 适用于活性较小的羧酸以及结构复杂的醇; 常用甲酯或乙酯合成高级酯。
MeO O O
C12H25 +
OH DMAP Ar
O Ar O O
C12H25
Ar = 1-Naphtyl 97%
11
局麻药丁卡因的合成
12
抗胆碱药溴美喷酯的合成
13
为了提高酯的酰化能力,开发了许多酰化能力比较强的活性 酯,以用于合成较为复杂的化合物,如肽、大环内酯等,这 里重点介绍几类活性酯。
20
4. 酰氯(Acid chloride)为酰化剂
第三章-酰化反应

PPh3
三苯基磷
R1
R1
R1
Ph3P HO
例:
DEAD
R2
RCOOH
R3
Ph3P O
RCOO
O
Байду номын сангаасR2
R3
R3 R2
O
C
R
构型反转
OH DEAD/PPh3/PhCO2H
OCOPh
OH
K2CO3/MeOH
O
O
O
可以对光学活性的仲醇进行构型的转化
(4) 应用特点 ① 伯醇酯的制备
O
NH
HO
NO O
+
OH
OH
CH2CONH
S
CH2COCl +
N
S
O
CH2OAc
COOH
0oC, 2.5h
N O
CH2OAc
COOH
二、芳胺的N-酰化反应
(1)反应通式
存在p-p共轭,使N原子上的 电子云分散到苯环上,电子 去密度降低,亲核性减弱
须用强酰化剂:酰氯、酸酐、活性酯
(4) 应用特点 ① 酰氯为酰化剂
② 酸酐为酰化剂
酰化反应
Acylation Reaction
酰化反应的定义
在有机物分子结构中的碳、氮、氧或硫等原子上导 入酰基的反应称为酰化反应。
酰化剂
被酰化物
Y= C 烃 N胺 O醇 S 硫醇
产物
酮(醛) 酰胺 酯 硫醇酯
X
酰卤(酰氯、酰溴)
酸酐
Z=
酰化剂
OH
OR
NH2 NHR NR2
羧酸 酯
酰胺
用途
◆ 酰基作为药效基团 ◆ 改变药物的理化性质、降低毒副作 用、改善药物的体内代谢、提高疗效等 ◆ 羟基、胺基等基团的保护
药物合成反应酰化

CH3
DMAF
例
OH + Ac2O
回流
CH3 C3H7 C OH +
CH3
O
C O
C
O
Et3N TEA
CH3 OAc
O CO
CO
CH3 C C3H7 CH3
OH
H3CN CH3
位阻较大的醇采用DMAF:对 二 甲 氨 基 吡 啶
23
第一节 氧原子的酰化反应
一 醇的氧酰化
3)酸酐为酰化剂
CH3
29
第一节 氧原子的酰化反应
一 醇的氧酰化
5)酰胺为酰化剂(活性酰胺)
O RC
R' N R''
N的 共 轭 效 应 使 酰 胺 酯 化 作 用 弱
O
N
RC N
O N
RC N
将氮固定在缺电子环上
活性酰胺制备方法
O N
RC N N
O N
NC N
N
+ RCOOH
CDI碳 酰 二 咪 唑
O RC N
(2)Lewis酸催化法: (AlCl3, SnCl4,FeCl3,等)
优点:收率高,产品纯度高,并可避免双键分解或重排 缺点:对位阻大的叔醇酯反应结果不理想。
O R C OH
AlCl3
AlCl3 O 配位键(增加C的正电性)
R C OH
(3)酸性树脂(Vesley)催化法: 采用强酸型离子交换树 脂加硫酸钙法,
R-OH + R'COOH
R'COOR + H2O
提高收率: (1)增加反应物浓度
(2)不断蒸出反应产物之一
第三章 酰化反应

O C O CH2CH2N(C2H5)2 + C2H5OH
(3)反应条件
水容易使酯水解,因此反应需要在无水条件下进 行,还要防止其他酯类在乙醇中重结晶。例:抗胆碱 药溴美喷酯(宁胃适)的合成
HO C OH CH3 COOCH2CH3 + N CH3CH2ONa 60-80℃,45min
C OH
COO N CH3
攻,而且使中间体稳定;若是给电子的作用相反。
根据上述的反应机理可以看出,作为被酰化物质 ( 醇 ) ,
其亲核性越强越容易被酰化。具有不同结构的被酰化物的 亲核能力一般规律为; RCH2 - > R-NH- > R-O - > R-NH2 >R-OH。(难酯化的醇需AlCl3催化)
在消除阶段
反应是否易于进行主要取决于 L的离去倾向。L—碱性 越强,越不容易离去, Cl— 是很弱的碱,—OCOR的碱性 较强些,OH— 、OR—是相当强的碱,NH2—是更强的碱。
O ROH + R' C L R' O C OR + HL
醇的结构对酰化反应的影响 伯醇(苄醇、烯丙醇除外)>仲醇>叔醇
一 、醇的氧酰化 (一) 酰氯为酰化剂
RCOCl + R'OH
RCOOR' + HCl
酰氯常用于空间位阻大的醇,如叔醇的酰化:
(CH3)3COH + C6H5CH=CHCOCl (CH3)3COOCHCH=CHC6H5
醇的结构对酰化反应的影响 立体影响因素:伯醇>仲醇>叔醇、烯丙醇 叔碳正离子倾向与水反应而逆转
电子效应的影响
羟基a位吸电子基团通过诱导效应降低O上电子云
密度,使亲核能力降低
苄醇、烯丙醇由于p-p共轭,使活性降低
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O R C O R C O R C
第一节 氧、氮原子上的酰化反应
第二节 碳原子上的酰化反应
第一节 氧、氮原子上 的酰化反应
活性:胺基>羟基
脂胺>芳胺
伯胺>仲胺 醇>酚 伯醇>仲醇>叔醇
常用的酰化试剂:
酰胺、酯、羧酸、 酸酐、酰卤、烯酮
• 烯酮作酰化剂
R2C C O + R'OH R2C C OH OR' R2CH O C OR'
• 醇的卤置换 • 酚的卤置换
• 醚的卤置换 • 羧酸的卤置换 • 卤化物的卤置换
一、醇的卤置换:亲核取代
ROH + HX
• 醇羟基活性:
RX + H2O
• 卤化剂:HX, PX3, PX5, SOCl2等
烯丙基醇>苄醇>叔醇>仲醇>伯醇
• HX活性:HI>HBr>HCl>HF
亲核取代机理
ROH + HX SN1: ROH2
Cl
CCl2 H CCl2 O
O CHCl2 H2O
CHO
Vilsmeier甲酰化反应
芳香化合物、杂环化合物及活泼 烯烃化合物用二取代甲酰胺及氧氯化 磷处理得到醛类的反应称Vilsmeier甲 酰化反应。是芳香环的甲酰化反应最 普通的方法。
ArH + R1 R2 N C H O POCl3 R1 ArCHO + NH R2
酚类、酚醚及许多杂环化合物如 吡咯、吲哚、呋喃和噻吩等可反应。
CH3O AlCl3 HCN,HCl HO CHO OH Zn(CN) 2 HCl OH CHO
Hoesch反应
腈类化合物与HCl在ZnCl2催化下, 与具有羟基或烷氧基的芳烃进行反应 生成酮亚胺盐,水解成具有羟基或烷 氧基的芳香酮的反应称为Hoesch反应。
机理
R1 R2 N C H + POCl3 O R1 R2 Cl N C H OPOCl3 R1 R2 Cl N C H OPOCl3
R3 N
R4 + R1 R2 Cl N C H
R3 N
R4 H CH N Cl R4 N CHO + HN R1 R2 H R1 R2
R3 N
R4 CH N Cl R1 R2 H2O
eg:
CH3 CH COOC2H5 + CH2 C O OH H2SO4 CH3 CH COOC2H5 OCOCH3 t BuOH + CH2 C O
(98%)
CH3COOBu t
(89%)
• 酰卤作酰化剂
O RC X + R'NH2 RCONHR' + HX
吡啶,三乙胺,N,N-二甲基苯胺等缚酸剂
•-烷氧基乙酰化
•烷氧羰基化 •邻苯二甲酰化(氨基保护)
第二节
碳原子上 的酰化反应
一、芳烃的C-酰化
二、烯烃的C-酰化 三、羰基化合物的-位C-酰化 四、“ 极性反转”的应用
一、芳烃的C-酰化
1.羧酸衍生物在Lewis酸催化下对
芳烃的直接亲电酰化反应 2.通过某些具有碳正离子活性的中 间体对芳烃进行亲电取代后再经 分解转化为酰基的间接酰化反应
对双键、羰基、烷氧基、酯基影响很少
•草酰氯(COCl)2用于结构中有对酸 敏感的官能团或结构的羧酸。
O OH (COCl)2 O OH COCl
PhH r.t CO2K O O CO2H
Cl C C Cl/PhH r.t, 12h OAc
COCl
OAc
~97%
Ph CH CH CO2H
SOCl2 , 60min
+ +
快
+
ROH2 + X
+
-
慢 快
R + H2O RX
形成R+离子,∴叔醇、苄醇、烯丙醇为SN1
R +X
-
SN2:
+ ROH2+ X
-
X R OH2
X R + H2O
伯 醇
过渡态
• 高活性叔醇、苄醇可用浓盐酸或HCl反 应 CH CH
3
CH3 C OH CH3
HCl
3
CH3 C Cl CH3
Friedel-Crafts酰化反应
酰卤、酸酐、羧酸、羧酸酯、
烯酮等酰化剂在Lewis酸催化下对 芳烃进行亲电取代而生成芳香酮类
的反应称为Friedel-Crafts酰化反应。
它是制备芳酮的最重要的方法之一。
+ RCOZ
Lewis酸
COR + HZ
Z=X, R’COO-, R”O-, HO-等
Lewis酸有:AlCl3,FeCl3,BF3,SnCl4
60~70℃, 0.5hr
三、醚的卤置换
R O R' HX RX + R'OH
HX:HI, HBr, KI/H3PO4
eg:
KI/H3PO4/P2O5 O , 3hr ICH2CH2CH2CH2I
1,4-二碘丁烷
四、羧酸的卤置换
O R C OH
卤化剂
O R C X
卤化剂:PX3, PX5, POX3,SOX2
Br2/NaOH 或NaOBr H2O
O (CH3)3CCCBr3
(CH3)3CCOOH + HCBr3
溴仿
五、羧酸衍生物的-卤取代
亲电取代机理
RCOX, RCN, (RCO)2O, CH2
COOC2H5 COOC2H5
eg:
CH2
COOC2H5 COOC2H5 Br CH
Br2, CCl4
COOC2H5 COOC2H5
Ph CH CH COCl SOCl2 CH2COCl 。 CH2CO2Me 30~40 , cker(汉斯狄克)反应
羧酸银盐和溴或碘反应,脱去 CO2,生成比原反应物少一个C的
卤代烃。
RCO2Ag + X2 RX + AgX + CO2
R3
H3C H3C
N
DMF/POCl3 H3C H3C Ph N N H COOC 2H5 CH3
N
CHO
84%
/POCl3
CHO ,1h
CHO N H COOC 2H5
99.5%
二、烯烃的C-酰化
烯烃与酰氯在AlCl3存在下可发生脂肪 碳原子的Friedel-Crafts反应,从而生成C-
酰化物。
Dieckmann分子内酯缩合反应
己二酸、庚二酸和辛二酸酯用金属 钠处理时,发生分子内Claisen酯缩合
分别得到5,6,7员环化合物的反应称为 Dieckmann分子内缩合反应。
-NR2为-N(CH3)2, -N=C(NMe2)2,
N
• 酸酐作酰化剂
混 H3C 合 酸 酐 法
CH3 H3C (CF3CO)2O r.t. 10min CH3 H3C COO CH3 H C 3 Cl CH3(CH2)2 CH COOH + t CH3 (CH3)2N 1.5h N CH3(CH2)2 CH COOBu CH3 t BuOH + Cl COCl Cl COOH + HO CH3 H3C H3C
CH2(COCl)2 + 2 (CH3)3COH C6H5N(CH3)2 CH2[COOC(CH3)3]2 。 30 ,4h
(84%)
COCl
HN(CH3)2
CON(CH3)2
(89%)
4-取代氨基吡啶催化剂
NR2 + RCOX N R'OH
NR2 H N OR'
O C NR2 RCOOR' + N H X R
• 伯醇常用Lucas试剂(浓HCl+ZnCl2反应)
浓HCl CH3(CH2)2CH2Cl CH3(CH2)2CH2OH ZnCl2
二、酚的卤置换
酚羟基活性小,必须用PCl5, POCl3, 而不用 HX, SOCl2
CH3 POCl3 N OH OH , 0.5hr N Cl Br CH3
Ph3PBr2 CH3CN
第三章 酰化反应
• 碱催化机理
C C H O OH C C O X X OH 慢 (-H 2O) C C O X2 C C
快 X O ( -X )
卤仿反应
乙醛或甲基酮(CH3CO-)在 碱性条件下与过量卤素作用, -H全被X取代生成少一个碳原 子的酸和卤仿。
O (CH3)3CCCH3
-甲基酮
活性:脂肪羧酸>芳香羧酸
芳香羧酸:推电子取代基>无取代
>吸电子取代基
• PCl5活性大,适用于吸电子基芳酸
O2N COOH PCl5 O2N , 0.5hr COCl
• PBr3/PCl3活性较小,一般用于脂肪羧酸
PBr3 COOH COBr
• SOCl2是由羧酸制备酰氯常用试剂
RCOOH + SOCl2 RCOCl + SO2 + HCl
+ Ph3P O N S C R O
(2)羧酸吡啶酯
+ HOOC N CH3.I CH2 OH n O C O C O + ( CH2 )n O Cl CH2 Et3N, OH 7.5~8h n
N CH3.I
N CH3
O
n=5 (89%) n=11 (69%)
羟基及氨基的保护
•甲酰化
•乙酰化 •卤代乙酰化
(97%)
(95%)
• 羧酸作酰化剂
DCC脱水法(二环己基碳化二亚胺)
