100种有机化学反应集锦18页
(版)经典有机人名反应

有机化学人名反响1.拜耳维利格Baeyer----Villiger 反响〔p317〕反响机理(不要求)过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反响-O-O-基团中与羰基碳原子直接具有光学活性的3---苯基丁酮和过酸反响,重排产物手性碳原子的枸型保持不变,说明反响属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
重要有机反响及机理集锦耿思聪反响实例康尼查罗Cannizzaro反响〔p321〕凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反响生成与醛相当的酸(成盐)及醇的混合物。
此反响的特征是醛自身同时发生氧化及复原作用,一分子被氧化成酸的盐,另一分子被复原成醇:脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反响,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
第1页〔共27页〕重要有机反响及机理集锦耿思聪具有α-活泼氢原子的醛和甲醛首先发生羟醛缩合反响,得到无α-活泼氢原子的β-羟基醛,然后再与甲醛进行交叉Cannizzaro反响,如乙醛和甲醛反响得到季戊四醇:反响机理醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
反响实例3.克莱森许密特Claisen—Schmidt反响〔交叉羟醛缩合〕〔p314〕一个无氢原子的醛与一个带有氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反响,并失水得到不饱和醛或酮:第2页〔共27页〕重要有机反响及机理集锦耿思聪反响机理反响实例3.Claisen重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
有机化学反应方程式大全

有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH CH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3+CH 3CH 3X +CH 3CH 3+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】2CH33H323H32 CH CH2CH32CH CH=CH(CH3CH2CH2)3-H3CH2CH2C22CH3CH2B OCH2CH2CH33CH2CH2C2CH2CH3+O H-OHB-OCH2CH2CH3CH2CH2CH3H3CH2CH2B OCH2CH2CH3CH2CH2CH32CH2CH3HOO-B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO32【例】CH31)BH32)H2O2/OH-CH3HHOH3、X2加成C CBr2/CCl4C CBrBr【机理】CCC CBrBr CBr+C CBrOH2+-H+C CBrOH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
考研必备_100种有机化学反应2(51-100)
MgSO4 或 MgCl2 催化,起还原作用的甲酸经常是过量,每摩尔羰基化合物需 2~4mol 甲
酸。
54. Lieben 碘仿试验 P289
55. Lossen 降解
氧肟酸或其酰基衍生物,在惰性溶剂或最好在亚硫酰氯、乙酸酐、P2O5 存在下加热分解
O
O
R
+NH2OH
R
H
R-N=C=O
OR 而得到异氰酸酯。
67. Prins 反应
在酸催化下,甲醛与烯烃加成,生成 m-二噁烷类和 1,3-二醇类。反应中也可生成不饱
H3C
CH2 CH3
CH2O, H+ H3C H2O
CH2 CH2
H3C OH H3C
H3C
OH
CH2 CH2
和醇。
2CH2O, H+
O
O
CH2
稀硫酸是最好的催化剂。
磷酸、BF3 也可用。叔基取代烯烃和不对称烯烃,如丙烯或 1-丁烯最容易反应,m-二 噁烷通过酸解可以转变成 1,3-二醇类,再经脱水即可形成共轭二烯类。 68. Reformatsky 合成法 P322 69. Reimer-Tiemann 合成法
在碱性水溶液中,苯酚与氯仿作用,产生邻、对位取代醛类。两种产物的比例取决于取 代基和溶剂,如果在吡啶中进行,仅产生邻位醛,产率 20~30%,很少超过 50%。酚本
OH
OH
HO
+ CHCl3
身可得到 60%水杨醛。
CHO 苯环上有吸电
子取代基,如-SO3H、-CN、-COOH、-NO2 能使苯环钝化,产率大约降为 25%。 只有含有游离酚式羟基的化合物,才能转变成醛。溴仿、碘仿及三氯乙酸同氯仿一样,
有机化学反应列表

• • • • • • • • • • • • • • • • • • • • • • • • • • • • •
• • • • • • • B • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • •
ቤተ መጻሕፍቲ ባይዱ
Asinger 反应(Asinger reaction) Asscher-Vofsi 反应 (Asscher-Vofsi reaction) Atherton-Openshaw-Todd 合成(Atherton-Openshaw-Todd synthesis) Auwers 合成、von Auwers 黄酮醇合成 (Auwers flavonol synthesis) von Auwers 1- 茚酮合成(von Auwers indane-1-one synthesis) Auwers 重排反应、von Auwers 重排反应 (von Auwers rearrangement) von Auwers-Inhoffen 重排反应 (von Auwers-Inhoffen rearrangement)
• Barbier-Wieland 递 降 反 应 、 Barbier-Locquin-Wieland 递 降 反 应 (Barbier-Wieland degradation) • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • Bardhan-Sengupta 菲合成 (Bardhan-Sengupta phenanthrene synthesis) Bargellini 反应 (Bargellini reaction) Bargellini 成环反应 (Bargellini ring-closure) Barger 去甲基化反应(Barger demethylation) Barry 反应(Barry reaction) Bart 反应、Bart-Schmidt 反应 (Bart reaction; Bart-Schmidt reaction) Bartlett-Condon-Schneider 反应(Barlett-Condon-Schneider reaction) Bartoli 吲哚合成 (Bartoli indole synthesis) Barton 反应(Barton reaction) Barton 苯基化反应(Barton phenylation) Barton 脱氨反应(Barton deamination) Barton 脱羧反应(Barton decarboxylation) Barton-Kellogg 烯烃合成 (Barton-Kellogg olefination) Barton-McCombie 去氧反应(Barton-McCombie deoxygenation) Barton-Zard 吡咯合成 (Barton-Zard pyrrole synthesis) Baudart 合成(Baudart synthesis) Baudart 酮醇合成(Baudart acyloin synthesis) Baudisch 反应(Baudisch reaction) Baum 苯甲酰基化反应(Baum benzoylation) Baumann-Fromm 合成(Baumann-Fromm synthesis) Baylis-Hillman 反应、 Baylis-Hillman-Morita 反应 (Baylis-Hillman reaction) Béchamp 反应 (Béchamp reaction) Béchamp 还原反应 (Béchamp reduction) Beckmann 重排反应 (Beckmann rearrangement) Beckmann-Chapman 重排反应 (Beckmann-Chapman rearrangement) Bedoukian 反应(Bedoukian reaction) Béhal-Sommelet 合成 (Béhal-Sommelet synthesis) Behrend 重排反应 (Behrend rearrangement) Behrend-Roosen 合成 (Behrend-Roosen synthesis) Belluš-Claisen 重排反应 (Belluš-Claisen rearrangement) Belousov-Zhabotinsky 反应、B-Z 反应 (Belousov-Zhabotinsky reaction) Benary 反应 (Benary reaction) Benet 合成 (Benet synthesis) Benkeser 反应(Benkeser reaction) Benkeser 还原反应(Benkeser reduction) Berchtold 反应 (Berchtold reaction) Bergman 反应、 Bergman 环化反应、 Bergman-Masamune 环化反应 (Bergman reaction) Bergmann 二氢恶唑酮肽合成 (Bergmann azlactone peptide synthesis) Bergmann 递降反应 (Bergmann degradation) Bergmann 蒽合成 (Bergmann anthracene reaction) Bergmann-Schotte 反应 (Bergmann-Schotte reaction) Bergmann-Zevars 法 ( 多 肽 合 成 中 用 氯 代 甲 酸 苯 甲 酯 保 护 氨 基 ) (Bergmann-Zevars
高中有机化学反应方程式总结(较全)

高中有机化学反应方程式总结(较全)
简介
这份文档总结了高中有机化学中常见的反应方程式,旨在帮助学生更好地理解和记忆有机化学反应。
以下是一些常见的有机化学反应类型及其方程式。
1. 烷烃类反应
1.1 烷烃燃烧反应
烷烃 + 氧气→ 二氧化碳 + 水
例如:甲烷 + 氧气→ 二氧化碳 + 水
1.2 烷烃与卤素反应
烷烃 + 卤素→ 卤代烷 + 氢卤酸
例如:甲烷 + 溴→ 溴代甲烷 + 氢溴酸2. 烯烃类反应
2.1 烯烃与卤素反应
烯烃 + 卤素→ 二卤代烷
例如:乙烯 + 光→ 过氧化氢 + 氯乙烷3. 醇类反应
3.1 醇脱水反应
醇→ 烯烃 + 水
例如:乙醇→ 乙烯 + 水
3.2 醇氧化反应
醇 + 氧气→ 酮/醛 + 水
例如:乙醇 + 氧气→ 乙酸 + 水
4. 酮类反应
4.1 酮的高温还原反应
酮 + 还原剂→ 伯胺
例如:丙酮+ NaBH4 → 正丙胺
5. 羧酸类反应
5.1 羧酸与醇酸酐化反应
羧酸 + 醇酸酐→ 酯 + 水
例如:乙酸 + 乙酸酐→ 乙酸乙酯 + 水
5.2 羧酸与碱反应
羧酸 + 碱→ 盐 + 水
例如:乙酸 + 氢氧化钠→ 乙酸钠 + 水
6. 醛类反应
6.1 醛还原反应
醛 + 还原剂→ 一级醇
例如:乙醛+ NaBH4 → 乙醇
以上是高中有机化学反应方程式的一些简单总结。
更详细的反应方程式及反应条件请参考有机化学教材或咨询化学老师。
注意:文档中的所有反应方程式仅供参考,请在实验操作时遵循正确的操作规程和安全注意事项。
有机化学反应方程式大全

有机化学反应方程式大全有机化学一、烯烃1、卤化氢加成(1)【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排(2)【特点】反马氏规则【机理】自由基机理(略)【注】过氧化物效应仅限于HBr、对HCl、HI无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】2、硼氢化—氧化【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】【例】 3、X 2加成【机理】【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
【特点】反式加成 4、烯烃的氧化1)稀冷高锰酸钾氧化成邻二醇。
3H 33H3稀冷KMnO433M n OOH 2O 3H 33H 32)热浓酸性高锰酸钾氧化3)臭氧氧化4)过氧酸氧化5、烯烃的复分解反应【例】6、共轭二烯烃1)卤化氢加成2)狄尔斯-阿德尔(Diels-Alder)反应【描述】共轭二烯烃和烯烃在加热的条件下很容易生成环状的1,4加成产物。
【例】二、脂环烃1、环丙烷的化学反应【描述】三元环由于张力而不稳定,易发生加成反应开环,类似碳碳双键。
【特点】环烷烃都有抗氧化性,可用于区分不饱和化合物。
【注】遵循马氏规则【例】2、环烷烃制备1)武兹(Wurtz)反应【描述】通过碱金属脱去卤素,制备环烷烃。
【例】2)卡宾①卡宾的生成A、多卤代物的α消除B、由某些双键化合物的分解②卡宾与烯烃的加成反应【特点】顺式加成,构型保持【例】③类卡宾【描述】类卡宾是一类在反应中能起到卡宾作用的非卡宾类化合物,最常用的ZnI。
类卡宾是ICH2【特点】顺式加成,构型保持【例】三、炔烃1、还原成烯烃1)、顺式加成2)、反式加成2、亲电加成1)、加X2【机理】中间体Br+R2 R1【特点】反式加成2)、加HXRRHBr R Br(一摩尔的卤化氢主要为反式加成)3)、加H2O【机理】【特点】炔烃水合符合马式规则。
(完整版)有机化学反应机理详解(共95个反应机理)

一、Arbuzow反应(重排)亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则Arbuzow反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 S N2 进行的分子内重排反应:反应实例二、Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
100种有机化学人名反应(有机化学)

1. ArndtEistert反应醛、酮与重氮甲烷反应失去氮并重排成多一个CH2基的相应羰基化合物这个反应对于环酮的扩环反应很重要。
OCH2N2O-CH2NNN2重排O2. BaeyerVilliger氧化应用过氧酸使酮氧化成酯。
反应中在酮的羰基和相邻的碳原子之间引人一个氧原子。
如由樟脑生成内酯OCH3CH3CH3OOCH3CH3H2SO5有时反应能生成二或多过氧化物但环状酮转变为内酯能得到单一的预期产物。
合适的酸为过硫酸Caro’s 酸、过氧苯甲酸、三氟过氧乙酸。
除环酮外无环的脂肪、芳香酮也可发生此反应。
二酮生成酸酐类、α、β不饱和酮得到烯醇酯类。
3. Bechamp还原可用于工业制备在铁、亚铁盐和稀酸的作用下芳香族硝基化合物能还原成相应的芳香胺。
C6H5-NO2 2Fe 6HCl C6H5-NH2 2FeCl3 2H2O。
当某些盐FeCl2、FeCl3、FeSO4、CaCl2等存在时所用酸无论是过量还是少量甚至在中性溶液中都能够进行这种还原。
此方法适用于绝大部分各种不同结构的芳香族化合物有时也用来还原脂肪族硝基化合物。
4. Beckmann重排醛肟、酮肟用酸或路易斯酸处理后最终产物得酰胺类。
单酮肟重排仅得一种酰胺混酮肟重排得两种混合酰胺。
但一般质子化羟基的裂解和基团R的转移是从相反的位置同时进行的。
NOHRRRNHRONRROHRNHRO 无论酯酮肟和芳酮肟都会发生此反应。
环酮肟重排得内酰胺这在工业生产上很重要利用此反应可帮助决定异构酮肟的结构。
5. Beyer喹啉类合成法芳香伯胺与一分子醛及一分子甲基酮在浓盐酸或ZnCl2存在下反应生成喹啉类化合物。
NH2NHRRHNRRRCHORCOCH3HCl H2这是对Doebner-Miller喹啉合成法的改进。
Doebner-Miller合成法由芳胺和不饱和醛或酮反应得到喹啉衍生物。
NH2NHCH3HNCH3 H2CH3O2CH3CHO 6. Blanc氯甲基化反应芳香族化合物苯、萘、蒽、菲、联苯及衍生物在ZnCl2或NH4Cl、AlCl3、SnCl4、H2SO4、H3PO4 存在下用甲醛和极浓盐酸处理发生芳香化合物的氯甲基化反应。
(完整版)有机化学反应方程式汇总

浓硫酸△ 有机物类别官能团 主要化学性质 烷烃——取代反应:CH 4+Cl 2CH 3Cl +HCl烯烃碳碳双键加成反应: CH 2=CH 2+HBr催化剂 △CH 3-CH 2Br ,(还可与Br 2、H 2O 、H 2在一定条件下发生加成反应)加聚反应:nCH 2=CH 2催化剂-[CH 2-CH 2氧化反应:使酸性KMnO 4溶液褪色(同时生成CO 2)炔烃碳碳三键同烯烃 芳香烃苯——取代反应: FeBr 3加成反应:苯的 同系物——取代反应:氧化反应:使酸性KMnO 4溶液褪色(与苯环相连的C 上有H 时统一被氧化为苯甲酸)卤代烃 —X取代反应:CH 3CH 2Br+NaOHH 2OCH 3CH 2OH+NaBr消去反应:CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O 醇—OH与活泼金属反应:2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑取代反应:CH 3CH 2OH+HBr△CH 3CH 2Br+H 2O 消去反应:CH 3CH 2OH浓硫酸 170℃CH 2=CH 2↑+H 2O氧化反应:2CH 3CH 2OH+O 2催化剂 △2CH 3CHO+2H 2O醛—CHO还原反应(加成反应):CH 3CHO+H 2催化剂 △CH 3CH 2OH氧化反应:2CH 3CHO+O 2催化剂 △2CH 3COOHCH 3CHO+2Ag(NH 3)2OH△CH 3COONH 4+2A g ↓+3NH 3+H 2OCH 3CHO+2C u (O H )2 +NaOH△CH 3COONa+Cu 2O ↓+3H 2O羧酸 —COOH 酸的通性:如CH 3COOH+NaHCO 3CH 3COONa+H 2O+CO 2↑酯化反应:CH 3COOH+ CH 3CH 2OH 浓H 2SO 4CH 3COOCH 2CH 3+H 2O 酯—COO —水解反应:CH 3COOCH 2CH 3+H 2OCH 3COOH+ CH 3CH 2OH酚弱酸性:取代反应: 光照+HNO 3—NO 2 +H 2O浓硫酸 △OHOH + NaOH ONa + H 2O OH+3Br 2OHBrBrBr+3HBr↓ 乙醇+HBr+Br 2 Br —CH 3 +3HNO 3 CH 3NO 2O 2N NO 2+3H 2O +3H 2Ni反应试剂有机物类别或官能团反应类型反应方程式举例X2氯气、液溴CH4+Cl2CH3Cl+HCl浓溴水苯酚取代反应溴水或溴的四氯化碳溶液“C=C”或“C≡C”加成反应H2C=CH2 + Br2 BrH2C-CH2BrHX “C=C”或“C≡C”加成反应H2C=CH2+HBr催化剂△H3C-CH2Br醇取代反应CH3CH2OH+HBr△CH3CH2Br+H2OH2O “C=C”或“C≡C”加成反应H2C=CH2+H2O催化剂△H3C-CH2OH酯水解反应CH3COOCH3+H2O催化剂△CH3COOH+CH3OHNa 醇、苯酚、—COOH置换反应2CH3CH2OH+ 2Na 2CH3CH2ONa+H2↑NaOH 苯酚、—COOH中和反应HCOOH+NaOH HCOONa+H2O酯水解反应CH3COOCH3+ NaOH CH3COONa+CH3OH卤代烃取代反应CH3CH2Br+NaOH△CH3CH2OH+NaBr消去反应CH3CH2Br+NaOH CH2= CH2↑+NaBr+H2ONa2CO3苯酚、—COOH复分解反应NaHCO3—COOH 复分解反应HCOOH+NaHCO3==HCOONa+CO2↑+H2OH2“C=C”或“C≡C”加成反应H2C=CH2+H2催化剂△H3C-CH3苯环加成反应羰基、醛基加成反应(还原反应)CH3CHO +H2催化剂△CH3CH2OH银氨溶液、新制Cu(OH)2醛、葡萄糖氧化反应略O2醛、醇氧化反应2CH3CHO+O2催化剂△2CH3COOH 大多数有机物氧化反应大多数有机物可燃烧生成CO2和H2O酸性KMnO4溶液醛、醇、酚、“C=C”、“C≡C”苯的同系物氧化反应略乙醇OH+3Br2OHBrBrBr+3HBr↓光照取代反应烷烃、苯环+3H2Ni。
基础有机化学反应总结
R
+
+
AlCl3
AlCl 4
+
+
R H
CH2
+
R
CH2
+
H
+ +
R
R
+ +
R
+
AlCl 4
+
+
第 9 页 共 73 页
HCl
+
AlCl 3
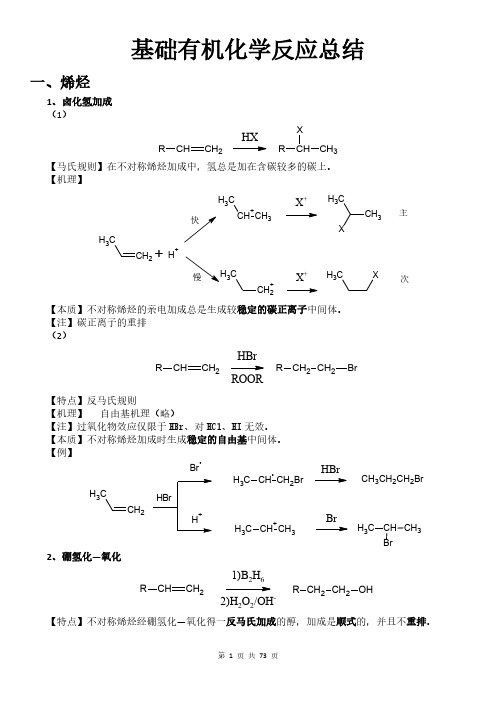
【注】碳正离子的重排,苯环上带有第二类定位基不能进行傅-克反应。 【例】
CH3
+
H3C
AlCl3
Cl CH3
CH3
+
CH3 H3C H3C Cl
AlCl3
Cl3CH/NaOH Cl Cl Br Br Br3CH/KOC(CH3)3 H3C CH3 HOC(CH3)3 H H3C H CH3
相转移催化剂
③类卡宾 【描述】 类卡宾是一类在反应中能起到卡宾作用的非卡宾类化合物, 最常用的类卡宾是 ICH2ZnI。
CH2I2
+ Cu(Zn)
第 5 页 共 73 页
基础有机化学反应总结
一、烯烃
1、卤化氢加成 (1 )
X R CH CH3
HX
R CH CH2
【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】
H3C 快 H3C CH2 CH CH3 X
+
X+
H3C CH3 主
+ H+
慢 H3C
+ CH2
X+
H3C
X
次
【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2 )
有机化学反应方程式汇总

催化剂
氧化反应: 2CH 3CH 2OH+O 2 △
2CH பைடு நூலகம்CHO+2H 2O
催化剂
还原反应(加成反应) : CH3CHO+H 2 △
CH 3CH 2OH
催化剂
氧化反应: 2CH 3CHO+O 2 △
2CH 3 COOH
△
CH 3CHO+2Ag(NH 3) 2OH
CH 3COONH 4+2A g↓ +3NH 3+H2O
醛、醇
氧化反应
大多数有机物
氧化反应
醛 、 醇 、 酚 、 氧化反应
“ C=C ”、“ C≡ C”
苯的同系物
催化剂
CH 3CHO +H 2
△
CH 3CH 2OH
略
催化剂
2CH3 CHO+O 2 △
2CH 3COOH
大多数有机物可燃烧生成 CO 2 和 H 2O
略
反应条件 浓硫酸
稀硫酸
NaOH 水溶液 NaOH 醇溶液
催化剂
H2C=CH 2+HBr
△
H 3C-CH 2Br
△
CH 3CH 2OH+HBr
CH3CH2Br+H 2 O
催化剂
H2C=CH 2+H 2O
△
H 3C-CH 2OH
催化剂
CH 3COOCH 3+H 2O △
CH3 COOH+CH 3OH
2CH3 CH2OH+ 2Na
2CH 3CH2ONa+H 2 ↑
H2、催化剂 催化剂、[ O ] Cl 2( Br 2) /Fe Cl 2( Br 2) /光照
有机化学反应方程式大全

有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCHCH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3CH +CH 3CH 3X +CH 3CH 3X+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则【机理】自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH BrCH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】CH2CH 33H 323H 32CH CH 2CH 3HBH 2CH CH=CH (CH 3CH 2CH 2)3B-H 3CH 2CH 2C22CH 3CH 2B OCH2CH 2CH 3H 3CH 2CH 2CCH 2CH 2CH 3+OH -OHB-OC H 2CH 2CH 3CH 2CH 2CH 3H 3CH 2CH 2OBOC H 2CH 2CH 3CH 2CH 2CH 3OC H 2CH 2CH 3HOO -B(OCH 2CH 2CH 3)3B(OCH 2CH 2CH 3)3+3NaOH 3NaOH3HOC H 2CH 2CH 33+Na 3BO 32【例】CH 31)BH 32)H 2O 2/OH-CH 3HH OH3、X 2加成C CBr /CClCC BrBr【机理】CC CC Br BrC CBr +CC Br OH 2+-H +CC Br OH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
有机化学反应方程式大全

有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCHCH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3CH +CH 3CH 3X +CH 3CH 3X+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体. 【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体. 【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH BrCH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】CH2CH 33H 323H 32CH CH 2CH 3HBH 2CH CH=CH (CH 3CH 2CH 2)3B-H 3CH 2CH 2C22CH 3CH 2B OCH 2CH 2CH 3H 3CH 2CH 2CCH 2CH 2CH 3+OH -OHB-OC H 2CH 2CH 3CH 2CH 2CH 3H 3CH 2CH 2OBOC H 2CH 2CH 3CH 2CH 2CH 3OC H 2CH 2CH 3HOO -B(OCH 2CH 2CH 3)3B(OCH 2CH 2CH 3)3+3NaOH 3NaOH3HOC H 2CH 2CH 33+Na 3BO 32【例】CH 31)BH 32)H 2O 2/OH-CH 3HH OH3、X 2加成C CBr /CClCC BrBr【机理】CC CC Br BrC CBr +CC Br OH 2+-H +CC Br OH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. Arndt -Eistert 反应醛、酮与重氮甲烷反应,失去氮并重排成多一个CH 2基的相应羰基化合物,这个反应对于环酮的扩环反应很重要。
2. Baeyer -Villiger 氧化应用过氧酸使酮氧化成酯。
反应中在酮的羰基和相邻的碳原子之间引人一个氧原子。
如由樟脑生成内酯:OCH 3CH 3CH 3OOCH 3CH 3H SO 有时反应能生成二或多过氧化物,但环状酮转变为内酯能得到单一的预期产物。
合适的酸为过硫酸(Caro’s 酸)、过氧苯甲酸、三氟过氧乙酸。
除环酮外,无环的脂肪、芳香酮也可发生此反应。
二酮生成酸酐类、α、β-不饱和酮得到烯醇酯类。
3. Bechamp 还原(可用于工业制备)在铁、亚铁盐和稀酸的作用下,芳香族硝基化合物能还原成相应的芳香胺。
C 6H 5-NO 2+ 2Fe + 6HCl C 6H 5-NH 2 + 2FeCl 3 + 2H 2O 。
当某些盐(FeCl 2、FeCl 3、FeSO 4、CaCl 2等)存在时,所用酸无论是过量还是少量,甚至在中性溶液中都能够进行这种还原。
此方法适用于绝大部分各种不同结构的芳香族化合物,有时也用来还原脂肪族硝基化合物。
4. Beckmann 重排醛肟、酮肟用酸或路易斯酸处理后,最终产物得酰胺类。
单酮肟重排仅得一种酰胺,混酮肟重排得两种混合酰胺。
但一般质子化羟基的裂解和基团R 的转移是从相反的位置同时进行的。
OHR'RRNHR'ON R'RR'NHR O无论酯酮肟和芳酮肟都会发生此反应。
环酮肟重排得内酰胺,这在工业生产上很重要,利用此反应可帮助决定异构酮肟的结构。
5. Beyer 喹啉类合成法芳香伯胺与一分子醛及一分子甲基酮在浓盐酸或ZnCl 2存在下,反应生成喹啉类化合物。
NH 2H++R'CHORCOCH这是对Doebner-Miller 喹啉合成法的改进。
Doebner-Miller 合成法由芳胺和不饱和醛或酮反应得到喹啉衍生物。
6. Blanc 氯甲基化反应芳香族化合物苯、萘、蒽、菲、联苯及衍生物,在ZnCl 2(或NH 4Cl 、AlCl 3、SnCl 4、H 2SO 4、H 3PO 4 )存在下,用甲醛和极浓盐酸处理,发生芳香化合物的氯甲基化反应。
+++HCHO HClZnCl 2H 2OCH 2Cl对于取代烃类,取代基的性质对反应能力影响很 亲电取代,烷基,烷氧基一般使反应速度增加,而卤素、羧基特别是硝基 用乙醛得到氯乙基化。
在某些情况下用相应当醛可有氯丙基 代替HCl ,溴甲基化以及在特殊情况下的碘甲基化都可发生。
氯甲基化试剂除HCHO/HCl 外,也可用H 2C(OMe)2/HCl 或MeOCH 2Cl 来代替。
这个反应在有机合成上甚为重要,因导入氯甲基后进一步可转化为-CH 2OH,-CHO,-CH 2CN,-CH 2NH 2及-CH 3等基团。
7. Bouvealt 合成法N,N-二烷基甲酰胺与一分子格氏试剂在干醚的存在下发生作用,生成的中间产物再经水解,可得醛类化合物,R’MgX 中R’基团越大,醛的产率越高。
8. Bouvealt -Blanc 还原法酯用金属钠和乙醇还原得到伯醇,脂肪酸酯类易被还原,α、β-不饱和酯类产生相应的饱和醇类。
R 'OC 2H 5OHNa RCH 2OH R'OH+常用乙醇作溶剂,但要维持较高沸点,可用丁醇。
也可用LiAlH 4来还原。
9. Bucherer 反应在亚硫酸盐或酸式亚硫酸盐水溶液存在下,萘、酚、萘胺中的羟基在加热加压时,能发生可逆的交换作用。
10. Cannizzaro 反应(见P291-292) 11. Chichibabin 吡啶类合成法醛、酮类与氨或胺类在Al 2O 3等催化剂存在下,加压加热,脱氢脱水,生成吡啶类化合物。
NCH 33CH 3CHO+++NH 33H 2O H 2此法不易得纯产物,还有其他化合物生成。
12. Chichibabin 对称合成法碳酸二乙酯与三分子格氏试剂反应,中间产物经水解得到对称叔醇类。
H 5C 2O2H 5O+3RM gXROHR如果格氏试剂用量不足,与一分子RMgX 反应生成酸,与二分子RMgX 反应生成酮。
13. Chichibabin 胺化反应含氮杂环碱类,如吡啶,喹啉或其衍生物与金属胺基化物在一起加热,则起胺化反应,生成氨基衍生物。
产率一般为50%~100%。
NNNHNaNNH 2NaNH 2 溶剂105- 110℃, 66- 76%H 2O 水解反应中副产物很多:4-氨基吡啶,2,6-二氨基吡啶,2,4,6-三氨基吡啶,2,2’-联吡啶等。
产物随温度、溶剂性质、氨基钠用量而异。
Bechamp 还原法不适用于制备氨基吡啶类,因为吡啶类在一般情况下很难硝化,所以此反应是吡啶环中直接引入氨基的有效方法。
14. Chugaev 反应该反应制备烯烃类。
黄原酸酯在120~200℃时热解,顺利产生烯烃,相应 醇和氧硫化碳。
黄原酸酯在热解前制备不须离析 除黄原酸酯外,其他的酯氨基甲酸酯,碳酸酯和羧酸酯 热解。
特别是使用大分子量的羧酸酯(棕榈酸酯)的烯烃提供了有利条件。
因为这些酯本身沸点高,而热解温度较低(约300℃),在液相中简单加热即可。
15. Claisen 重排烯醇或酚类的烯丙醚在加热时,易起重排反应。
烯丙基由氧原子上转移到碳原子上,这与弗利斯重排有相似之处。
CH 2CH=CH2OHOC H 2CH=CH2200℃OC H 2CH=CH2OHCH 2CH=CH2200℃;ClOC H 2CH=CH2OHCH 2CH=CH2250℃醚分子中,如临位未被取代则不起重排反应,产生复杂的热分解作用。
此反应是在苯环引入丙基的简易方法,因为烯丙基可还原成丙基。
16. Claisen 缩合反应(P352~354) 17. Claisen -Schmidt 反应(P287) 18. Clemmensen 还原(P291) 19. Cope 消除反应这个反应是由氧化叔胺消除羟胺来产生烯烃。
反应在低温进行且产量较高,当加热到120℃时,具有光学活性的纯氧化叔胺1-(N,N-二甲氨基)-3-苯基丁烷就得到具有旋光性的纯3-苯基丁烯-1,而且总是定量进行。
20. Criegee 氧化法乙二醇类在稀醋酸或苯溶液中,室温时用四乙酸铅进行很温和的氧化,两个相连的各带有游离羟基的碳原子之间的碳链就断裂,得到定量的醛酮类。
此法用于研究醇类结构及制备醛酮类且产率很高。
21. Curtius 降解库尔修斯降解是羧酸的迭氮化合物经加热脱氮重排成异氰酸酯,再经水解得伯胺类。
若反应在惰性溶剂中进行,可以得到异氰酸酯,并能将它分离出来。
22.Darzens-Claisen反应在无水惰性溶剂中,在碱性缩合剂的作用下,酸性强的α-卤代脂肪酸酯作为亚甲基部分和醛、酮反应,首先生成氯代醇酸酯,随即裂解放出氯化氢得到2,3-环氧酸酯,其再经水解脱羧便得到醛:O+H2CClCOHHCClCOOR-HClC CHCOOR C CHCOOHCH CHO-CO2除α-氯代酸酯外,其他的C-H酸性化合物如邻和对硝基甲苯,环戊二烯等也能作为亚甲基部分与醛、酮反应。
无水惰性溶剂为醚、苯或二甲苯。
醛、酮可以是脂肪族、芳香族,也可以是α、β-不饱和醛酮,此反应对于形成C-C键的制备上很重要。
23.Delepine反应六亚甲基四胺与卤代烷反应,生成季胺盐。
在稀酸作用下,其水解为伯胺。
C6H12N4 + RCH2[ RCH2-NC6H12N3 ] I3HCl, C2H5OH22-NH3I + 6HCHO + 3NH4ClRCH2-NH2NH2溶剂为氯仿。
卤代烷的反应活性为:RI>RBr>RCl,水解用95%乙醇和稀盐酸,最后能得到纯伯胺。
24.Dieckmann缩合含有δ或ε位活泼亚甲基的二羧酸二酯在碱性催化剂存在下,分子内起“Claisen缩合”反应,环化成β-酮酸酯类,其再经水解、脱羧而生成环酮类,当n=2,3时收率最高,高级二羧酸酯的缩合产率很低。
25.Diels-Alder反应P83-8426.Etard反应具有侧链的芳烃,特别是甲基芳烃,在CS2中用二分子铬酰氯氧化,中间产物经水解得芳醛。
CH3CHOCrO2Cl2如果分子中有多个甲基,只可氧化一个,这是本反应的特征。
27.Favorskii重排α-卤代酮用碱处理,消除卤素重排得羧酸:X-CH2-COR + NaOH2-COOH + NaX环状α-卤代酮也可得到羧酸,同时缩环:O HH COOHNaOH -NaC l 环氧醚类和羟基缩酮类为副产物。
在此条件下,二卤代酮也可发生重排,产生α、β-不饱和酸 28. Feist -Benary 合成法此法用来合成呋喃类化合物,在吡啶或氨存在下,α-氯化羰基化合物或α,β-氯醚类与1,3-二羰基化合物发生缩合反应,生成呋喃类化合物。
29. Fischer 吲哚类合成法醛和酮的苯腙类与ZnCl 2一起加热,发生重排,分子内缩合,脱氨环化等作用,最后生成吲哚类化合物。
N HCH H 2CR HCR 2CCH R C R大量脂肪醛酮和醛酸、酮酸及其酯的芳腙都能发生这个反应。
但用这个方法,由乙醛的苯腙不能制得吲哚。
通常,β-酮酯的苯腙的能得到吡唑啉酮。
ZnCl 2、CuCl 和溴代物或其他重金属卤代物,H 2SO 4、HCl-酒精溶液或冰醋酸都可用作催化剂。
30. Friedel -Crafts 酰基化反应P276, P131-132 31. Friedel -Crafts 烷基化反应P130-131芳烃与烷基卤试剂在路易斯酸存在下,生成烷基芳烃。
RCl+AlCl 3R+HCl烷基化试剂除卤代烷外,醇类、烯烃、甲苯磺酸烷基酯亦可。
各种路易斯酸的催化效应:AlCl 3>FeCl 3> SbCl 5>SnCl 4>BF 3>TiCl 4>ZnCl 2。
醇类至少需1mol 路易斯酸作催化剂。
因为反应中生成的水使等摩尔的催化剂失去活性,对于卤代烷和烯烃来说,催化量就已足够。
酚类的反应较令人满意(P258~259),而低碱度的芳烃如硝基苯、吡啶都不能反应。
32. Fries 重排在当量数AlCl 3存在下,加热脂肪或芳香羧酸苯基酯,酰基发生重排反应,脂肪酸苯基酯比芳香酸苯基酯更易进行。
根据反应条件,重排可以到邻位,也可以到对位。
在低温(100℃以下)时主要形成对位产物,在高温时一般得到邻位产物。
催化剂除AlCl 3外,也可用BF 3、ZnCl 2、FeCl 3。
催化剂不同,生成邻、对位异构体的比例也不同。
用硝基苯作溶剂有利于重排,可在低温时进行。
