中药提取物备案列表
中药产品物料名称
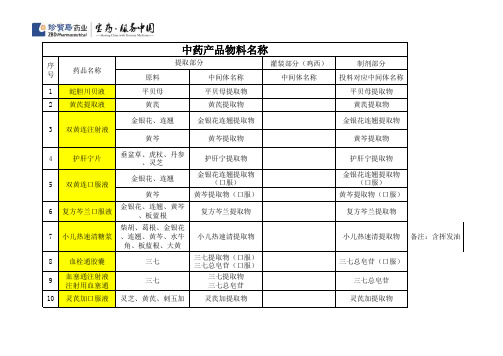
序 号 1 2 3 提取部分 药品名称 蛇胆川贝液 黄芪提取液 双黄连注射液 黄芩 4 护肝宁片 垂盆草、虎杖、丹参 、灵芝 金银花、连翘 黄芩 6 复方芩兰口服液 金银花、连翘、黄芩 、板蓝根 柴胡、葛根、金银花 、连翘、黄芩、水牛 角、板蓝根、大黄 三七 三七 灵芝、黄芪、刺五加 黄芩提取物 护肝宁提取物 金银花连翘提取物 (口服) 黄芩提取物(口服) 复方芩兰提取物 黄芩提取物 护肝宁提取物 金银花连翘提取物 (口服) 黄芩提取物(口服) 复方芩兰提取物 原料 平贝母 黄芪 金银花、连翘 中间体名称 平贝母提取物 黄芪提取物 金银花连翘提取物 灌装部分(鸡西) 中间体名称 制剂部分 投料对应中间体名称 平贝母提取物 黄芪提取物 金银花连翘提取物
5
双清糖浆 血栓通胶囊 血塞通注射液 注射用血塞通 灵芪加口服液
小儿热速清提取物 三七提取物(口服) 三七总皂苷(口服) 三七提取物 三七总皂苷 灵芪加提取物
小儿热速清提取物 三七总皂苷(口服) 三七总皂苷 灵芪加提取物
备注:含挥发油
中药产品物料名称
11 舒血宁注射液 银杏叶 银杏叶提取物 银杏叶提取液半制品 银杏叶提取液 刺五加提取液半制品 刺五加提取液 银杏叶提取液
12 13
刺五加注射液 益母草膏
刺五加 益母草 穿心莲内酯 丁二酸酐 无水亚硫酸钠 吡啶 碳酸氢钾 碳酸氢钠
刺五加提取物 益母草提取物
刺五加提取液 益母草提取物
14
注射用炎琥宁
炎琥宁
炎琥宁
2010年药典统计-以植物提取物投料中药制剂

1 2 3 4 5 6 7 8
十一味能消丸 沙棘膏 十滴水软胶囊 桉油 小儿清热片 薄荷素油
38g 31.25g 0.47G 150ml、30ml 45ml
以大黄素和大黄酚的总量 计,不得不于1.8mg/丸 含樟脑53.0-71.8mg;含桉 油精≥15.7mg 以连翘苷计≥0.55mg/块 以甘草酸计≥1.8mg/ml
青风藤提取 物 龙胆科植物 秦艽的干燥 根提取物
清热解毒,止咳,祛痰。胜于咽喉肿痛,扁 桃体炎,慢性支气管炎。 活血散瘀,温经镇痛。用于寒湿瘀阴经络所 致风湿关节痛及关节扭伤 化痰止咳,用于痰浊阴肺,咳嗽痰多;急、 慢性支气管炎见上述证候者。 清热解毒、燥湿止痢。用于湿热蕴结所致的 肠炎、痢疾;亦用于乳腺炎、疖肿、外伤发 炎、胆囊炎
小儿止咳糖浆 甘草流浸膏、桔 梗流浸膏 川贝枇杷糖浆 川贝母流浸膏 薄荷素油、桉油 正金油软膏 、樟油、丁香罗 北芪五加片 伤湿止痛膏 刺五加浸膏 芸香浸膏、薄荷 脑、颠茄流浸膏
含薄荷脑≥0.2mg/ml 含樟脑0.06-0.1g/g;含薄 120g/30g/80g/30g 荷脑0.16~0.22g/g 50g 以黄芪甲苷计≥0.3mg/片 12.5g/20g/30g 每粒含槐花以芦丁计≥ 12mg
12g/6.4g/40g/8g
0.4g/支/10ml
18 19 20
夏天无滴眼液 夏天无提取物 益心酮片 银杏叶片 山楂叶提取物 银杏提取物 32g 40g/80g
21
银杏叶胶囊
银杏提取物
40g
22
银杏叶滴丸
银杏提取物
16g
含夏天无提取物以原阿片 碱计,应为0.32~0.43mg每 ml 每片含金丝桃苷≥0.13mg, 含山楂提取物32mg 总黄酮醇苷(1)≥9.6mg (2)≥19.2mg; 萜类内酯 (1)≥2.4mg(2)≥ 总黄酮醇苷(1)≥9.6mg (2)≥19.2mg; 萜类内酯 (1)≥2.4mg(2)≥ 总黄酮醇苷 3.84mg~5.84mg; 萜类内酯 0.96mg~.8mg 绿原酸≥1.7mg/ml;黄芩 苷≥18mg/ml
农业部公布具备中药提取物加工资质的企业名录
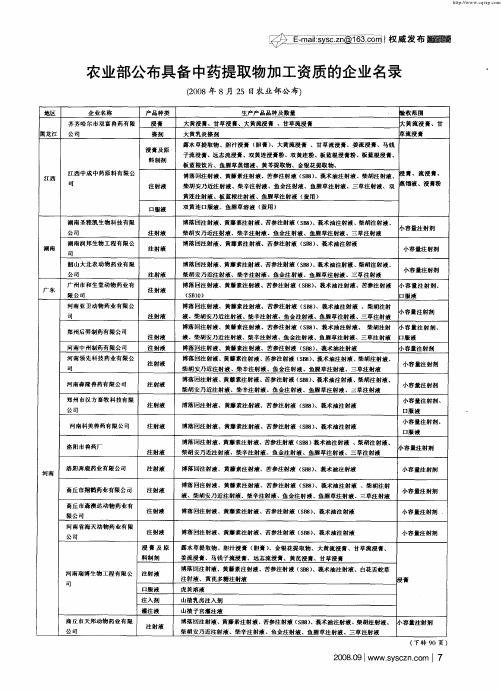
小 容 量注 射 剂 小容 量 注 射剂
河南森隆兽药有 限公 司
注 射液
博落 回注射液、 黄藤素注射液、 苦参注射液 ( B ) 莪术油注射液、 SS 、 柴胡注 射液 、 柴 胡 安 乃 近注 射 液 柴 辛 注 射 液 、鱼 金注 射液 、鱼腥 草 注 射 液 、三 草 注 射液
注射液
注
射 液
小 容 量注 射 剂
韶 山大北农动物药业有限 公司
广 东 广 州 市和 生 堂 动 物 药 业 有 限 公 司 河南 亚 卫 动 物 药 业 有 限 公 司 郑 州后 羿制 药 有 限 公 司
注射液
注 射 液
博落回注射液、黄藤素注射液、 苦参注射液 ( B ) 莪术油注射液 、 SS 、 柴胡注射液、 柴胡安乃近注射液、柴辛注射液 、鱼金注射液 、鱼腥草注射液 、三草注射液
注射液
河 南 中 州 制药 有 限 公司 河 南 领 先 科 技 药 业 有 限公 司 注 射 液 注 射液
液、柴胡安乃近注射液、紫辛注射液、 鱼金注射液、鱼腥草注射液、三草注射液 口 服液
博 落 回注 射 液 、 黄藤 素注 射液 、苦 参注 射 液 ( B ) S S 、莪 术油 注 射 液 博 落 回注 射 液 、黄 藤 素注 射 液 、苦参 注 射液 ( B 、莪 术 油注 射 液 、柴 胡 注 射 液 、 SS) 柴 胡 安乃 近 注射 液 柴辛注射液、鱼金注射液 、鱼腥草注射液、三草注射液
生产产品品种及数量 大黄浸青、甘草浸 青、大黄流浸青 、甘草流浸青 大黄乳炎搽剂 露水 草提取物、胆汁浸青 ( 胆青 ) 、大黄流浸 青 、甘草流浸青、姜流浸青、马钱 子流浸青、远志流浸青、双黄连浸青粉、双黄连粉、板蓝根浸青粉 、板蓝根浸青、
备案所需原料
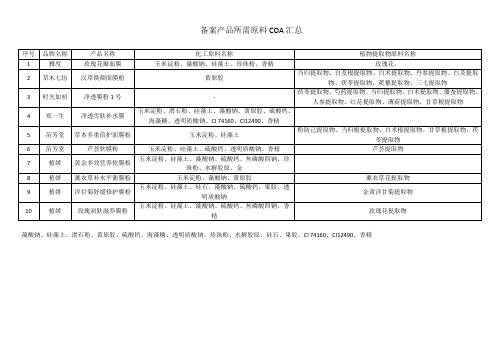
郑一生
净透雪肤补水膜
玉米淀粉、滑石粉、硅藻土、藻酸钠、黄原胶、硫酸钙、海藻糖、透明质酸钠、CI 74160、CI12490、香精
5
苗芳堂
草本多重倍护面膜粉
玉米淀粉、硅藻土
粉防己提取物、当归根提取物、白术根提取物、甘草根提取物、茯苓提取物
6
苗芳堂
芦荟软膜粉
玉米淀粉、硅藻土、硫酸钙、透明质酸钠、香精
芦荟提取物
7
植娇
黄金多效营养软膜粉
玉米淀粉、硅藻土、藻酸钠、硫酸钙、焦磷酸四钠、珍珠粉、水解胶原、金
8
植娇
薰衣草补水平衡膜粉
玉米淀粉、藻酸钠、黄原胶
薰衣草花提取物
9
植娇
洋甘菊舒缓修护膜粉
玉米淀粉、硅藻土、硅石、藻酸钠、硫酸钙、果胶、透明质酸钠
金黄洋甘菊提取物
10
植娇
玫瑰润肤滋养膜粉
玉米淀粉、硅藻土、藻酸钠、硫酸钙、焦磷酸四钠、香精
玫瑰花提取物
藻酸钠、硅藻土、滑石粉、黄原胶、硫酸钙、海藻糖、透明质酸钠、珍珠粉、水解胶原、硅石、果胶、CI 74160、CI12490、香精
备案产品所需原料COA汇总
序号
品牌名称
产品名称
化工原料名称
植物提取物原料名称
1
雅度
玫瑰花瓣面膜
玉米淀粉、藻酸钠、硅藻土、珍珠粉、香精
玫瑰花、
2
草木七坊
汉Hale Waihona Puke 焕颜面膜粉黄原胶当归提取物、白芨根提取物、白术提取物、丹参提取物、白及提取物、茯苓提取物、蒺藜提取物、三七提取物
3
时光如初
净透膜粉1号
-
茯苓提取物、芍药提取物、当归提取物、白术提取物、僵蚕提取物、人参提取物、红花提取物、薄荷提取物、甘草根提取物
中药提取物使用备案的流程

中药提取物使用备案的流程1. 简介中药提取物是指从中草药中提取并纯化出的有活性成分的产品,被广泛应用于中医药领域。
为了确保中药提取物的质量和安全性,相关法规要求在使用中药提取物时进行备案。
本文将介绍中药提取物使用备案的流程。
2. 中药提取物使用备案的流程概述中药提取物使用备案的流程主要包括以下几个步骤:2.1. 准备备案材料•准备中药提取物的详细信息,如提取物的名称、来源等。
•准备中药提取物的生产工艺和质量控制标准。
•准备中药提取物的临床研究报告和毒理学研究报告等相关文件。
2.2. 编制备案申请报告•根据相关法规要求,编制中药提取物使用备案申请报告。
•报告应包括中药提取物的基本情况、生产工艺、质量控制标准、临床研究报告、毒理学研究报告等内容。
2.3. 提交备案申请•将编制好的备案申请报告提交给相关部门进行备案申请。
•根据不同地区的法规要求,备案申请可能需要通过在线系统或邮寄等方式提交。
2.4. 审核备案申请•相关部门将审核备案申请报告。
•审核内容包括对中药提取物的生产工艺、质量控制标准、临床研究报告、毒理学研究报告等进行评估。
2.5. 备案发放•经过审核合格后,相关部门将发放中药提取物使用备案证书。
•备案证书是中药提取物使用时必须具备的合法文件。
3. 中药提取物使用备案的注意事项在进行中药提取物使用备案时,需要注意以下几点:3.1. 合规性确保备案申请报告中提供的中药提取物信息、生产工艺、质量控制标准等内容符合相关法规的要求。
3.2. 材料准备备案申请报告所需的临床研究报告、毒理学研究报告等文件要真实、完整地呈现,确保数据的准确性和可靠性。
3.3. 审核时限备案申请审核的时限则需要遵守相关法规要求。
4. 总结中药提取物使用备案的流程需要准备备案材料、编制备案申请报告、提交备案申请、审核备案申请以及备案发放等步骤。
在备案过程中,要保证申请报告的合规性,准备相关材料,并且遵守审核时限的法规要求。
只有通过备案审核并获得备案证书,中药提取物的使用才合法有效。
国药准字号管理的中药

国药准字号管理的中药1西红花提取物国药准字Z200200402蚕砂提取物国药试字Z20000001 国药准字Z200300873雷公藤提取物国药准字Z430204734女贞叶乙醇提取物国药准字Z200001145皖贝母提取物国药准字Z200301036栀子提取物国药准字Z200400537龙胆总苷国药准字Z200301008 苁蓉总苷国药准字Z200502159雪上一枝蒿总生物碱国药准字Z5302073010骨碎补总黄酮国药试字Z2002000211葛根总黄酮国药准字Z2006042812 三七三醇皂苷国药准字Z2003010813雪胆素国药准字Z5302067414薄荷脑国药准字Z3402000215冰片国药准字Z4302044216穿心莲内酯国药准字Z3202043617灯盏花素国药准字Z5302011818环维黄杨星D 国药准字Z3202125219积雪草总甙国药准字Z4402386620岩白菜素国药准字Z5302150421薄荷素油国药准字Z3202027322肉桂油国药准字Z5302134723红花黄色素国药准字Z2005014524三七总皂甙国药准字Z5302001325莪术油国药准字Z2005300205版药典一部收载的其他植物油脂和提取物1 丁香罗勒油国药准字Z350202442大黄流浸膏国药准字Z530202113八角茴香油国药准字Z610216804广藿香油未查到文号5水牛角浓缩粉国药准字Z350204036甘草流浸膏国药准字Z620204847甘草浸膏国药准字Z650200048当归流浸膏国药准字Z620206969远志流浸膏国药准字Z5102069210连翘提取物未检索到文号11 牡荆油未检索到文号12 松节油国药准字Z5302149513刺五加浸膏国药准字Z2302217914茶油未检索到文号15香果脂未检索到文号16姜流浸膏国药准字Z4602010517莪术油国药准字H3302175918桉油国药准字Z32020275 国药准字Z3202024919益母草流浸膏国药准字Z3302025820黄芩提取物未检索到文号21银杏叶提取物未检索到文号22蓖麻油国药准字Z3702086423麻油未检索到文号24满山红油未检索到文号25颠茄流浸膏国药准字Z3702017226颠茄浸膏1 月见草油国药准字H220249252鬼臼毒素国药准字H109601713亚油酸国药准字H230227554橙皮苷国药准字H440244025 咖啡酸国药准字H200640226槐定碱国药准字H200516827 甘草次酸国药准字H150212348靛玉红国药准字H110220339丹皮酚国药准字H3102053510莪术油国药准字H3302175911 芦丁国药准字H1502003512甘草酸二铵国药准字H1094002213 齐墩果酸国药准字H5302011114水飞蓟宾国药准字H2004033615水飞蓟素国药准字H4302077516黄芩苷国药准字H5102346617 薯蓣皂苷国药准字H5102338018醋柳黄酮国药准字H5102392619 苦豆子总碱国药准字H6402028820苦参总碱国药准字H6402028521人参茎叶总皂苷国药准字H6302022122白芍总苷国药准字H2005452123青叶胆提取物国药准字H5302180424甘草提取物粉国药准字H650204161煅石膏国药准字Z51022580 2石膏( 国药准字Z51022579 3蜂蜜国药准字Z35020101 4红粉国药准字Z42020193 5滑石粉国药准字Z53021179 6环维黄杨星D 国药准字Z32021252 7建曲国药准字Z53020097 8六神曲国药准字Z51022538 9鹿角霜国药准字Z23021054 10浓缩水牛角片国药准字Z4402316711青黛国药准字Z51021282 12轻粉国药准字Z42020194 13水牛角浓缩粉国药准字Z13022016 14芒硝国药准字Z51022578 15冰片( 国药准字Z43020442 )16人工牛黄( 国药准字Z10950015 ) 17人工麝香( 国药准字Z20040042 ) 18西洋参茎叶总皂苷( 国药准字Z20030072 ) 19龙血竭( 国药准字Z10950114 )20熊胆粉( 国药准字Z10980024 ) 21法制半夏曲( 国药准字Z53020500 ) 22半夏曲( 国药准字Z51020025 ) 23保宁半夏曲( 国药准字Z51022530 ) 24六一散( 国药准字Z35020388 ) 25午时茶( 国药准字Z33020386 ) 26樟脑( 国药准字H32020590 ) 27阿胶( 国药准字Z13020248 ) 28鹿角胶( 国药准字Z23020051 ) 29龟甲胶( 国药准字Z23020052 ) 30黄明胶( 国药准字Z37021224 ) 31海龙胶( 国药准字Z37021272 ) 32鲜竹沥( 国药准字Z33021094 )。
中药提取物使用备案表(样表)

中药提取物使用备案表
编号:XX0000001
声明
我们保证:
①本次备案遵守《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》和《药品注册管理办法》等法律、法规和规章的规定;
②备案内容及所有备案资料均真实、来源合法、未侵犯他人的权益;
③一并提交的电子文件与打印文件内容完全一致。
如有不实之处,我们承担由此导致的一切法律后果。
备案事项
备案类型
□√初次 □变更
备案事由
根据食药监药[2014]135号“食品药品监督总局关于加强中药生产中提取和提取物监督管理的通知”,对川贝枇杷糖浆使用薄荷脑进行备案
备案资料
□证明性文件彩色影印件
□使用中药提取物的中成药国家药品标准复印件
□中药提取物购销合同书彩色影印件
□中药提取物生产企业质量评估报告
年 月 日
□自产自用 □购买使用
□自产自用 □购买使用
□自产自用 □购买使用
历次备案信息(变更备案填写)
序号
使用备案顺序号
备案时间
变更原因概述
备案机构信息
中文名称
组织机构代码
法定代表人
注册地址
生产地址
通讯地址
备案负责人
职位
联系人
职位
电话
传真
电子邮箱
手机
药品生产许可证编号
GMP证书编号
法定代表人(签名)
(加盖公章处)
□中药提取物生产企业供应商审计报告
□中药提取物关键工艺资料
□其他资料:
具体资料名称:
药品信息(使用中药提取物的中成药品种信息)
通用名称
川贝枇杷糖浆
剂型
糖浆剂
中药提取物生产项目可行性研究报告(申请备案案例)

中药提取物生产项目可行性研究报告(申请备案案例)摘要:本文对一家中药提取物生产项目进行可行性研究,主要包括项目背景、项目内容、项目市场分析、项目投资分析、项目风险分析等内容。
通过对相关数据的收集和分析,得出结论:该项目具有较为明确的市场需求,投资回报率较高,但同时也面临一定的风险。
因此,该项目具有一定的可行性,值得进一步研究和投资。
一、项目背景随着人们健康意识的提高和中医药的逐渐普及,中药提取物的市场需求逐渐增大。
中药提取物作为中医药行业的重要生产环节,具有广泛的应用前景和商业潜力。
因此,开展中药提取物生产项目具有一定的市场竞争力。
二、项目内容该项目主要包括中药提取物的生产工艺设计、原料采购、设备投资、厂房布局、工艺流程控制等。
项目将按照国家相关法律法规和行业标准进行生产,保证产品的质量和安全性。
三、市场分析根据市场调研数据显示,当前中药提取物市场需求旺盛,市场规模持续扩大。
随着人们对健康保健品和中医药的认可度提高,中药提取物作为中药资源的高附加值产品受到广泛关注。
目前,市场上存在一定的供需缺口,项目具有较好的市场前景。
四、投资分析根据初步估算,该项目总投资约为XXX万元,其中包括固定资产投资、流动资金等。
根据市场需求和产能分析,项目年销售收入约为XXX万元,年净利润约为XXX万元。
根据投资回报率和投资回收期的计算,该项目具有较高的投资回报率和较短的投资回收期。
五、风险分析1.市场风险:中药提取物生产市场竞争激烈,产品质量和安全性对市场影响较大。
项目需要建立良好的品牌形象和市场渠道,以保持市场竞争力。
2.技术风险:中药提取物生产工艺涉及到多个环节,需要保证生产工艺流程的稳定和产品质量的一致性。
3.政策风险:中药行业受国家政策的影响较大,需要关注相关政策的变化,以避免项目受到不利影响。
六、项目建议综合以上分析,本研究认为中药提取物生产项目具备一定的可行性,可以进一步进行研究和投资。
同时,项目方需要注重产品质量和市场竞争力的提升,规避项目风险。
保健食品备案原料名单

保健食品备案原料名单
1.天然草本植物:
(1)洋甘菊:洋甘菊花、洋甘菊根、洋甘菊叶总物质(2)金银花:金银花花、金银花叶、金银花根总物质(3)杜仲:杜仲英子、杜仲根、杜仲叶总物质
(4)苦瓜:苦瓜花、苦瓜叶、苦瓜根总物质
(5)金银花组合物:金银花组合物
2.普通食品:
(1)大豆:大豆蛋白
(2)小麦:小麦胚芽、小麦胚乳
(3)荞麦:荞麦粉
(4)芝麻:芝麻酱油
(5)燕麦:燕麦片
3.不可食用动物和植物提取物:
(1)鸡胸肉:鸡胸肉蛋白
(2)蜂蜜:蜂蜜总物质
(3)蛤蜊:蛤蜊提取物
(4)海藻:海藻碱
(5)海参:海参提取物
4.不可食用植物提取物:
(1)枸杞:枸杞提取物
(2)黄精:黄精提取物
(3)石斛:石斛提取物
(4)紫苏:紫苏提取物
(5)当归:当归提取物
5.合成成分:
(1)维生素A:维生素A醇
(2)维生素E:维生素E醋酸酯
(3)胆固醇:胆固醇
(4)烟酸:烟酸氢钠
(5)叶酸:叶酸
6.食用菌提取物:
(1)酵母:酵母提。
植物提取物的许可认证

植物提取物的许可认证植物提取物被广泛应用于药品、食品、化妆品、添加剂、保健用品等领域,因而加工企业需根据其用途或行业管理或国家法规等办理相应的许可资质,大致分以下几类:1、作为药品原料的应进行备案;2、加工为食品的需办理食品生产许可(SC),食品类别:固体饮料、保健食品、食品添加剂;3、作为饲料添加剂使用,应办理饲料添加剂生产许可;4、产品出口销售的,出口生产企业应备案。
其次,植物提取行业自愿性认证达30多项,包括体系认证(ISO)、产品认证(Kosher、HALAL等)、生产规范认证(GMP)、有机认证(中国有机认证)以及实验室认证(CNAS、CMA)等。
以下将对植物提取物应用于药品、食品、化妆品、保健用品等领域需要开展的许可认证进行阐述。
一、作为中药提取物中药提取物备案的主体是提取物生产企业,提取物生产企业应取得含中药提取物生产范围的《药品生产许可证》,符合药品GMP要求,且向中成药生产企业提供提取物产品。
中药提取物生产企业的备案资料应包括:1、企业的基本信息和提取物的技术信息;2、《药品生产许可证》、《营业执照》复印件等证明性文件;3、生产提取物用中药材、中药饮片的信息,包括产地、基原、来源、执行标准、炮制规范,以及对供应商资质和生产质量保证体系的审计报告;4、提取物详细的生产工艺,包括工艺路线图,关键参数,主要设备等;5、提取物内控质量标准或提取物的国家药品标准等。
2014年7月29日,国家局下发的食药监药化监〔2014〕135号《食品药品监管总局关于加强中药生产中提取和提取物监督管理的通知》要求“对中成药国家药品标准处方项下载明,且具有单独国家药品标准的中药提取物实施备案管理。
”备案成功的植提企业应按照药品GMP要求组织生产,保证其产品质量,其日常监管由所在地省(区、市)食品药品监督管理局负责。
按照通知要求有47个中药提取物可进行备案管理,即企业即可自己生产,也可外购,其他的必须企业自己提取。
产品目录(植物提取物)
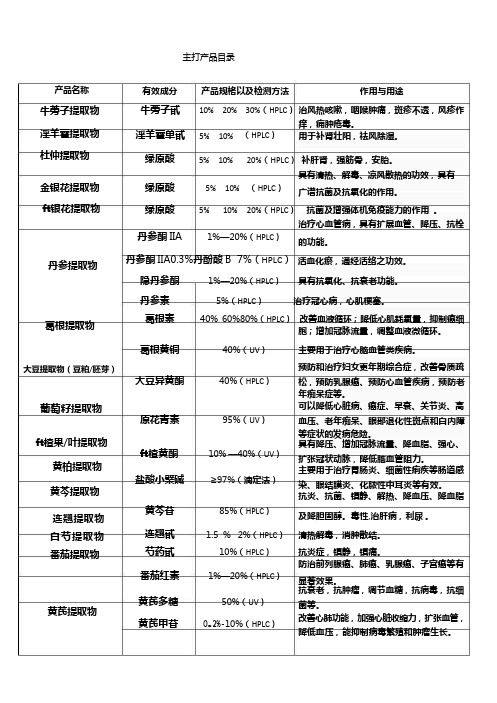
主打产品目录产品名称牛蒡子提取物淫羊藿提取物杜仲提取物有效成分产品规格以及检测方法作用与用途牛蒡子甙10% 20% 30%(HPLC)治风热咳嗽,咽喉肿痛,斑疹不透,风疹作淫羊藿单甙5% 10% (HPLC)痒,痈肿疮毒。
用于补肾壮阳,祛风除湿。
绿原酸5% 10% 20%(HPLC)补肝肾,强筋骨,安胎。
具有清热、解毒、凉风散热的功效,具有金银花提取物绿原酸5% 10% (HPLC)广谱抗菌及抗氧化的作用。
ft银花提取物丹参提取物葛根提取物大豆提取物(豆粕/胚芽)葡萄籽提取物ft楂果/叶提取物黄柏提取物黄芩提取物连翘提取物白芍提取物番茄提取物绿原酸5% 10% 20%(HPLC)抗菌及增强体机免疫能力的作用。
治疗心血管病,具有扩展血管、降压、抗栓丹参酮IIA 1%—20%(HPLC)的功能。
丹参酮IIA0.3%丹酚酸B7%(HPLC)活血化瘀,通经活络之功效。
隐丹参酮1%—20%(HPLC)具有抗氧化、抗衰老功能。
丹参素5%(HPLC)治疗冠心病,心肌梗塞。
葛根素40% 60%80%(HPLC)改善血液循环;降低心肌耗氧量,抑制癌细胞;增加冠脉流量,调整血液微循环。
葛根黄铜40%(UV)主要用于治疗心脑血管类疾病。
预防和治疗妇女更年期综合症,改善骨质疏大豆异黄酮40%(HPLC)松,预防乳腺癌、预防心血管疾病,预防老年痴呆症等。
可以降低心脏病、癌症、早衰、关节炎、高原花青素95%(UV)血压、老年痴呆、眼部退化性斑点和白内障等症状的发病危险。
具有降压、增加冠脉流量、降血脂、强心、ft楂黄酮10% —40%(UV)扩张冠状动脉,降低脑血管阻力。
主要用于治疗胃肠炎、细菌性痢疾等肠道感盐酸小檗碱≥97%(滴定法)染、眼结膜炎、化脓性中耳炎等有效。
抗炎、抗菌、镇静、解热、降血压、降血脂黄芩苷85%(HPLC)及降胆固醇。
毒性,治肝病,利尿。
连翘甙 1.5 %2%(HPLC)清热解毒,消肿散结。
芍药甙10%(HPLC)抗炎症,镇静,镇痛。
2024-保健品原料-新资源食品原料-(最新)

一、既是食品又是药品的物品名单(87种)按拼音依次排列87种 B 八角茴香、白芷、白果、白扁豆、白扁豆花、百合、薄荷。
C 赤小豆。
D 丁香、刀豆、代代花、淡竹叶、淡豆豉。
E 阿胶。
F 佛手、茯苓、蜂蜜、榧子、蝮蛇、覆盆子。
G 甘草、枸杞子、高良姜、葛根。
H 花椒、荷叶、黄芥子、黄精、黑芝麻、黑胡椒、槐米、槐花、藿香。
J 决明子、鸡内金、金银花、姜(生姜、干姜)、桔红、桔梗、菊花、菊苣、橘皮。
K 昆布。
L 龙眼肉(桂圆)、罗汉果、莱菔子、莲子。
M 马齿苋、木瓜、火麻仁、牡蛎、麦芽。
P 胖大海、蒲公英。
Q 芡实、青果。
R 肉豆蔻、肉桂。
S 山药、山楂、沙棘、砂仁、桑叶、桑椹、酸枣仁。
T 桃仁。
W 乌梢蛇、乌梅。
X 小茴香、小蓟、杏仁(甜、苦)、香橼、香薷、鲜白茅根、鲜芦根、薤白。
Y 玉竹、余甘子、郁李仁、鱼腥草、益智仁、薏苡仁。
Z 枣(大枣、酸枣、黑枣)、枳椇子、栀子、紫苏、紫苏籽。
二、新增中药材物质(15种)1 人参人参2 山银花华南忍冬红腺忍冬灰毡毛忍冬黄褐毛忍冬3 芫荽芫荽4 玫瑰花玫瑰5 松花粉马尾松6 油松同属种植物7 粉葛甘葛藤8 布渣叶破布叶9 夏枯草夏枯草10 当归当归11 山奈山奈12 西红花藏红花13 草果草果14 姜黄姜黄15 荜茇荜茇……………………………………………征求看法中,未正式公布……………………………………………三、可用于保健食品的物品名单(114种)按拼音依次排列114种 B 巴戟天、北沙参、白及、白术、白芍、白豆蔻、补骨脂、柏子仁、荜茇、鳖甲。
C 川牛膝、川贝母、川芎、车前子、车前草、苍术、赤芍、侧柏叶、刺五加、刺玫果。
D 大蓟、丹参、地骨皮、当归、杜仲、杜仲叶、党参。
F 番泻叶、蜂胶。
G 龟甲、骨碎补、蛤蚧。
H 红花、红景天、怀牛膝、厚朴、厚朴花、胡芦巴、黄芪、湖北贝母、槐实。
J 金荞麦、金樱子、姜黄、绞股蓝、韭菜子、积雪草、蒺藜。
K 诃子、苦丁茶。
L 罗布麻、芦荟。
中药提取物使用备案办事指南

中药提取物使用备案办事指南一、受理范围本办事指南规定了药品监督管理部门依法办理医疗机构应用传统工艺配制中药(民族药)制剂备案的程序和要求,适用于医疗机构在云南省行政区域内应用传统工艺配制中药(民族药)制剂的备案管理。
医疗机构应用传统工艺配制中药(民族药)制剂备案,是指医疗机构依照法定程序、条件和要求,将表明应用传统工艺配制的中药(民族药)制剂的安全性、有效性、科学性、合理性、必要性和质量可控性的材料提交省药品监督管理局,由省药品监督管理局审查后核发备案号方可进行配制,并进行公示、备查的过程。
本办事指南所规定的传统中药(民族药)制剂包括:(一)由中药饮片(民族药药材)经粉碎或仅经水或油提取制成的固体(丸剂、散剂、丹剂、锭剂等)、半固体(膏滋、膏药等)和液体(汤剂等)传统剂型;(二)由中药饮片(民族药药材)经水提取制成的颗粒剂以及由中药饮片(民族药药材)经粉碎后制成的胶囊剂;(三)由中药饮片(民族药药材)用传统方法提取制成的酒剂、酊剂。
医疗机构所备案的传统中药(民族药)制剂应与其《医疗机构执业许可证》所载明的诊疗范围一致。
属于下列情形之一的,不得备案:(一)《医疗机构制剂注册管理办法(试行)》中规定的不得作为医疗机构制剂申报的情形;(二)与市场上已有供应品种相同处方的不同剂型品种;(三)中药配方颗粒;(四)其他不符合国家有关规定的制剂。
申请人配制传统中药制剂应当取得《医疗机构制剂许可证》,未取得《医疗机构制剂许可证》或者《医疗机构制剂许可证》无相应制剂剂型的,可委托取得相应剂型《药品生产质量管理规范》认证证书的药品生产企业或取得相应剂型《医疗机构制剂许可证》的医疗机构进行配制,但须同时向委托方所在的地省级药品监督管理部门备案。
已取得批准文号并符合《云南省食品药品监督管理局关于印发云南省医疗机构制剂再注册和标准整顿工作方案的通知》(云食药监注〔2017〕8号)要求的传统中药(民族药)制剂,符合备案要求的,在该批准文号有效期届满后,不予再注册,按规定进行备案;对此前已受理的此类制剂注册申请,申请人可撤回申请,改向省药品监督管理局备案。
实施批准文管理的中药材中药饮片

实施批准文管理的中药材中药饮片This model paper was revised by the Standardization Office on December 10, 2020实施批准文号管理的中药材、中药饮片(2009-03-1818:40:52) 1煅石膏国药准字(Z)2石膏(国药准字Z)3蜂蜜(国药准字Z)4红粉(国药准字Z)5滑石粉(国药准字Z)6环维黄杨星D(国药准字Z)7建曲(国药准字Z)8六神曲(国药准字Z)9鹿角霜(国药准字Z)10浓缩水牛角片(国药准字Z)11青黛(国药准字Z)12轻粉(国药准字Z)13水牛角浓缩粉(国药准字Z)14芒硝(国药准字Z)15冰片(国药准字Z)16人工牛黄(国药准字Z)17人工麝香(国药准字Z)18西洋参茎叶总皂苷(国药准字Z) 19龙血竭(国药准字Z)20熊胆粉(国药准字Z)21法制半夏曲(国药准字Z)22半夏曲(国药准字Z)23保宁半夏曲(国药准字Z)24六一散(国药准字Z)25午时茶(国药准字Z)26樟脑(国药准字H)27阿胶(国药准字Z)28鹿角胶(国药准字Z)29龟甲胶(国药准字Z)30黄明胶(国药准字Z)31海龙胶(国药准字Z)32鲜竹沥(国药准字Z)33雄黄实施批准文号管理的中药饮片、中药提取物目录(目前最全)1西红花提取物国药准字Z2蚕砂提取物国药试字Z国药准字Z3雷公藤提取物国药准字Z4女贞叶乙醇提取物国药准字Z5皖贝母提取物国药准字Z6栀子提取物国药准字Z7龙胆总苷国药准字Z8苁蓉总苷国药准字Z9雪上一枝蒿总生物碱国药准字Z10骨碎补总黄酮国药试字Z11葛根总黄酮国药准字Z12三七三醇皂苷国药准字Z13雪胆素国药准字Z14薄荷脑国药准字Z15冰片国药准字Z16穿心莲内酯国药准字Z17灯盏花素国药准字Z18环维黄杨星D国药准字Z19积雪草总甙国药准字Z20岩白菜素国药准字Z21薄荷素油国药准字Z22肉桂油国药准字Z23红花黄色素国药准字Z24三七总皂甙国药准字Z25莪术油国药准字Z05版药典一部收载的其他植物油脂和提取物1丁香罗勒油国药准字Z2大黄流浸膏国药准字Z3八角茴香油国药准字Z4广藿香油未查到文号5水牛角浓缩粉国药准字Z6甘草流浸膏国药准字Z7甘草浸膏国药准字Z8当归流浸膏国药准字Z9远志流浸膏国药准字Z10连翘提取物未检索到文号11牡荆油未检索到文号12松节油国药准字Z13刺五加浸膏国药准字Z14茶油未检索到文号15香果脂未检索到文号16姜流浸膏国药准字Z17莪术油国药准字H18桉油国药准字Z国药准字Z 19益母草流浸膏国药准字Z20黄芩提取物未检索到文号21银杏叶提取物未检索到文号22蓖麻油国药准字Z23麻油未检索到文号24满山红油未检索到文号25颠茄流浸膏国药准字Z26颠茄浸膏1月见草油国药准字H2鬼臼毒素国药准字H3亚油酸国药准字H4橙皮苷国药准字H5咖啡酸国药准字H6槐定碱国药准字H7甘草次酸国药准字H8靛玉红国药准字H9丹皮酚国药准字H10莪术油国药准字H11芦丁国药准字H12甘草酸二铵国药准字H13齐墩果酸国药准字H14水飞蓟宾国药准字H15水飞蓟素国药准字H16黄芩苷国药准字H17薯蓣皂苷国药准字H18醋柳黄酮国药准字H19苦豆子总碱国药准字H20苦参总碱国药准字H21人参茎叶总皂苷国药准字H 22白芍总苷国药准字H23青叶胆提取物国药准字H 24甘草提取物粉国药准字H。
中药提取 植物

中药提取植物
1、金银花提取物
主要成分:绿原酸
提取来源:忍冬科植物金银花的干燥花蕾或带初开的花
主要功效:抗病毒、清热解毒、清咽利喉。
主治传染性病毒性呼吸道疾病、流行性感冒等
2、连翘提取物
主要成分:连翘甘
提取来源:木犀科植物连翘的干燥果实。
主要功效:清热解毒,消肿散结。
温病发热,疮黄肿毒。
3、兽用黄芪提取物
主要成分:黄芪多糖
提取来源:豆科植物蒙古黄芪的干燥根为原料。
主要功效:扶正祛邪、补气固表。
防治免疫前后应激以及各种病毒性流行性疾病
4、兽用甘草提取物
主要成分:甘草酸、甘草苷
提取来源:豆科植物甘草的干燥根及根茎。
主要功效:补脾益气,祛痰止咳,和中缓急,解毒,调和诸药,缓解药物毒性、烈性
5、兽用大青叶提取物
主要成分:靛玉红
提取来源:十字花科植物菘蓝的干燥叶
主要功效:清热解毒,凉血消斑。
热病发斑,咽喉肿痛,热痢,黄疸,臃肿,丹毒。
中药提取物备案目录

备案品种:
2010年药典植物油脂和提取物:47个品种
1、丁香罗勒油、八角茴香油、松节油、桉油、广藿香油、满山红油、牡荆油、肉桂油、茶油、莪术油、蓖麻油、薄荷素油、薄荷脑、麻油
2、岩白菜素、灯盏花素、环维黄杨星D、香果脂、黄藤素、穿心莲内酯
3、三七三醇皂苷、三七总皂苷、人参总皂苷、人参茎叶总皂苷、积雪草总苷
4、丹参总酚酸提取物、丹参酮提取物、北豆根提取物、山楂叶提取物、茵陈提取物、连翘提取物、银杏叶提取物、黄芩提取物
5、刺五加浸膏、大黄流浸膏、大黄浸膏、姜流浸膏、当归流浸膏、浙贝流浸膏、甘草浸膏、益母草流浸膏、甘草流浸膏、肿节风浸膏、远志流浸膏、颠茄流浸膏、颠茄浸膏
6、水牛角浓缩粉
以往国家标准品种:24个
药典2000:薄荷油
药典85:芸香草油
药典77:艾叶油、砂仁叶油、松节油、椰馏油
药典63 :橙皮油、丁香油(部标维药)、桂皮油、花生油、可可豆油、棉子油、杏仁油、亚麻油
药典53:柯柯豆油、松溜油、鱼肝油、樟脑(蒙药)
其他:红花子油(部标维药)、黄荆油(部颁中药)、鲜竹沥(部颁中药)、洋橄榄油(部标维药)、豨莶液(Z2-287、WS3-B-0456-90) 、贝母花流浸膏(Z6-35 、WS3-B-1104-92)、桔梗流浸膏(WS3-B-2205-96)。
吉林省中药提取物备案流程

吉林省中药提取物备案流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!吉林省中药提取物备案流程如下:1. 准备资料在进行中药提取物备案之前,需要准备以下资料:- 《营业执照》副本复印件;- 《药品生产许可证》或《药品经营许可证》副本复印件;- 《药品生产质量管理规范》或《药品经营质量管理规范》认证证书复印件;- 中药提取物生产工艺流程及技术参数;- 中药提取物质量标准;- 原料药材来源证明文件;- 产品说明书;- 标签和使用说明书样张;- 其他相关文件。
中药提取物备案资料

(一)《中药提取物使用备案表》原件。
(二)证明性文件彩色影印件。
包括有效的《药品生产许可证》、《营业执照》、《药品GMP证书》、使用中药提取物的中成药品种批准证明文件及其变更证明文件等。
(三)使用中药提取物的中成药国家药品标准复印件。
(四)中药提取物购销合同书彩色影印件。
购销合同书应明确质量责任关系。
(五)对中药提取物生产企业的质量评估报告。
重点包括评估中药提取物生产企业的生产条件、技术水平、质量管理、中药提取物原料、生产过程和提取物质量等方面。
(六)对中药提取物生产企业的供应商审计报告。
(七)中药提取物关键工艺资料。
第七条中药提取物使用备案,中药提取物使用企业应通过中药提取物备案信息平台,填写《中药提取物使用备案表》(附2),向所在地省(区、市)食品药品监督管理局提交完整的资料(PDF格式电子版),并对资料真实性负责。
第八条中药提取物使用备案应提交以下资料:(一)《中药提取物使用备案表》原件。
(二)证明性文件彩色影印件。
包括有效的《药品生产许可证》、《营业执照》、《药品GMP证书》、使用中药提取物的中成药品种批准证明文件及其变更证明文件等。
(三)使用中药提取物的中成药国家药品标准复印件。
(四)中药提取物购销合同书彩色影印件。
购销合同书应明确质量责任关系。
(五)对中药提取物生产企业的质量评估报告。
重点包括评估中药提取物生产企业的生产条件、技术水平、质量管理、中药提取物原料、生产过程和提取物质量等方面。
(六)对中药提取物生产企业的供应商审计报告。
(七)中药提取物关键工艺资料。
(八)其他资料。
第九条中成药国家药品标准处方项下含多种中药提取物的,应填写同一《中药提取物使用备案表》,一同备案。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目前保健食品原料得中药提取物,尚无正规得批准文件,绝大多数就是以固体饮料得QS证,打擦边球。
保健品所用到得中药提取物,都在“既就是食品又就是药品得名单”与“可用于保健食品原料得名单”上,可以按食品原料来管理,就没必要去按中药提取物备案。
中药提取物备案管理细则终出台委托加工被禁止备案范围明确为中成药国家药品标准处方项下载明,且具有单独国家药品标准得中药提取物。
这表明,一方面备案对象仅为中成药中使用得提取物;另一方面,只有单独药品标准得提取物,中成药生产企业才可购买,才有备案意义。
总局要求实施生产及使用双备案,明确了生产、使用企业各自得责任;同时也将中药提取物生产、使用链纳入药品质量全过程监管范畴。
自产自用提取物分别备案,则可避免个别中成药生产企业利用法规空隙而逃避检查。
中药提取物生产企业应在符合药品GMP要求下组织生产,保证其产品质量。
《通知》中没有采用必须具有GMP证书得提法,虽然按GMP要求对提取物生产企业检查但不发GMP 证书。
具体操作中,对中药提取物生产企业采用现行药品GMP标准检查,通过检查并取得生产许可后方可申请备案。
中医药监管此前喊了很多年,但一直“只见打雷,不见下雨”,然而,日前国务院法制办就《中华人民共与国中医药法(征求意见稿)》(以下简称“征求意见稿”)向社会公开征求意见,在“征求意见稿”公布没多久之后,关于中药提取及提取物监管得规定细则(以下简称“细则”)在8月4日正式公布了,细则最终重点集中在三方面:即生产中成药得企业必须要有自己得提取车间及相应得生产能力;取消委托加工;备案提取物得生产企业,不再核发《药品生产许可证》,中药提取物不再按批准文号管理。
国家食药监总局表示,中药提取与提取物就是保证中药质量可控、安全有效得前提与物质基础,由于中药提取或外购中药提取物环节存在得问题给中药得质量安全带来隐患,自2016年1月1日起,凡不具备中药提取能力得中成药生产企业,一律停止相应品种得生产。
同时,对于不属于备案管理得中药提取物,规定必须自行提取。
据了解,目前委托加工就是行业内得普遍现象,取消委托加工对行业得影响较大。
北京某药企总经理对南都记者表示,现在对于委托外单位得中药提取物加工彻底取消,主要就是基于近年来某些中药问题频出而采取得对产品质量得控制与监管对策,对于这个行业来讲,大得药企、医药集团或者有自己得生产线,或者可以新建生产线并收购生产企业,但就是有大量以中药提取委托加工为主业得小企业,则大部分可能要关门歇业。
据业内人士测算,新建中药原料生产线得成本很高,新车间得投入至少要500万元,按照新版GMP标准还需要追加至少300万元得投资,提取设备最基本配置至少要300万元,工艺流程得标准化还需要投入两三百万,这样总共成本算下来,总投资接近1500万元。
对于一家每年原料采购金额2000万元得企业来说,她们至少需要两年以上得利润用于原料厂得投资,而不少小得中药企业每年用于原料药得采购金额只有几百万,成本反而会高于之前外购,基本就是亏本。
此外,值得注意得就是,相对于之前得征求意见稿,正式得管理规定明确提出了中药提取物将不再按批准文号管理(按新药批准得中药有效成分与有效部位除外)。
分析人士表示,一直以来,部分药企因为没有中药提取物得生产批准文号而不能生产,拥有文号得,有得产量小,有得不生产,这也造成委托加工成为行业普遍现象。
放开批准文号管理,既鼓励有能力得企业自行提取,又能缓解叫停委托加工之后带来得冲击。
以下附关于加强中药生产中提取与提取物监督管理得通知及中药提取物备案管理实施细则全文国家局颁发文件对中药生产中提取与提取物严加管理关于加强中药生产中提取与提取物监督管理得通知食药监药化监〔2014〕135号各省、自治区、直辖市食品药品监督管理局:中药提取与提取物就是保证中药质量可控、安全有效得前提与物质基础。
近年来,随着中药生产得规模化与集约化发展,中药提取或外购中药提取物环节存在得问题比较突出,给中药得质量安全带来隐患。
为加强中药提取与提取物得监督管理,规范中药生产行为,保证中成药质量安全有效,现将有关规定通知如下:一、中药提取就是中成药生产与质量管理得关键环节,生产企业必须具备与其生产品种与规模相适应得提取能力。
药品生产企业可以异地设立前处理与提取车间,也可与集团内部具有控股关系得药品生产企业共用前处理与提取车间。
二、中成药生产企业需要异地设立前处理或提取车间得,需经企业所在地省(区、市)食品药品监督管理局批准。
跨省(区、市)设立异地车间得,还应经车间所在地省(区、市)食品药品监督管理局审查同意。
中成药生产企业《药品生产许可证》上应注明异地车间得生产地址。
三、与集团内部具有控股关系得药品生产企业共用前处理与提取车间得,该车间应归属于集团公司内部一个药品生产企业,并应报经所在地省(区、市)食品药品监督管理局批准。
跨省(区、市)设立共用车间得,须经双方所在地省(区、市)食品药品监督管理局审查同意。
该集团应加强统一管理,明确双方责任,制定切实可行得生产与质量管理措施,建立严格得质量控制标准。
共用提取车间得中成药生产企业《药品生产许可证》上应注明提取车间得归属企业名称与地址。
四、中成药生产企业应对其异地车间或共用车间相关品种得前处理或提取质量负责,将其纳入生产与质量管理体系并对生产得全过程进行管理,提取过程应符合所生产中成药得生产工艺。
提取过程与中成药应批批对应,形成完整得批生产记录,并在贮存、包装、运输等方面采取有效得质量控制措施。
共用车间所属企业应按照《药品生产质量管理规范》(以下简称药品GMP)组织生产,严格履行双方质量协议,对提取过程得质量负责。
五、中成药生产企业所在地省(区、市)食品药品监督管理局负责异地车间或共用车间相应品种生产过程得监督管理,对跨省(区、市)得异地车间或共用车间应进行延伸监管,车间所在地省(区、市)食品药品监督管理局负责异地车间或共用车间提取过程得日常监管。
六、自本通知印发之日起,各省(区、市)食品药品监督管理局一律停止中药提取委托加工得审批,已经批准得,可延续至2015年12月31日。
在此期间,各省(区、市)食品药品监督管理局应切实加强对已批准委托加工得监督管理,督促委托方按照药品GMP得要求切实履行责任,制定可行得质量保证体系与管理措施,建立委托加工提取物得含量测定或指纹图谱等可控得质量标准,对委托加工全过程得生产进行质量监控与技术指导,并在运输过程中采取有效措施,以保证委托加工质量。
凡不符合要求得一律撤销其委托加工得审批,并不得另行审批。
自2016年1月1日起,凡不具备中药提取能力得中成药生产企业,一律停止相应品种得生产。
七、对中成药国家药品标准处方项下载明,且具有单独国家药品标准得中药提取物实施备案管理。
凡生产或使用上述应备案中药提取物得药品生产企业,均应按照《中药提取物备案管理实施细则》(见附件)进行备案。
八、中成药生产企业应严格按照药品标准投料生产,并对中药提取物得质量负责。
对属于备案管理得中药提取物,可自行提取,也可购买使用已备案得中药提取物;对不属于备案管理得中药提取物,应自行提取。
自2016年1月1日起,中成药生产企业一律不得购买未备案得中药提取物投料生产。
;九、备案得中药提取物生产企业应按照药品GMP要求组织生产,保证其产品质量,其日常监管由所在地省(区、市)食品药品监督管理局负责。
自本文印发之日起,对中药提取物生产企业一律不予核发《药品生产许可证》与《药品GMP 证书》,已核发得,有效期届满后不得再重新审查发证。
十、中成药生产企业使用备案得中药提取物投料生产得,应按照药品GMP要求对中药提取物生产企业进行质量评估与供应商审计。
中成药生产企业所在地省(区、市)食品药品监督管理局应按照药品GMP有关要求与国家药品标准对中药提取物生产企业组织开展延伸检查,并出具检查报告,确认其就是否符合药品GMP要求。
十一、对中药提取物将不再按批准文号管理,但按新药批准得中药有效成份与有效部位除外。
对已取得药品批准文号,按本通知规定应纳入备案管理得中药提取物,在原批准文号有效期届满后,各省(区、市)食品药品监督管理局不再受理其再注册申请。
十二、中药材前处理就是中药生产得重要工序,中药生产企业与中药提取物生产企业应当具备与所生产品种相适应得中药材前处理设施、设备,制定相应得前处理工艺规程,对中药材进行炮制与加工。
外购中药饮片投料生产得,必须从具备合法资质得中药饮片生产经营企业购买。
十三、中成药生产企业违反本通知第七条规定,使用未备案得中药提取物投料生产得,应依据《中华人民共与国药品管理法》第七十九条进行查处。
十四、中成药生产企业未按药品标准规定投料生产,购买并使用中药提取物代替中药饮片投料生产得,应依据《中华人民共与国药品管理法》第四十八条第三款第二项按假药论处。
十五、本通知自印发之日起执行,此前印发得相关文件与本通知不一致得,以本通知为准。
以上请各省(区、市)食品药品监督管理局通知行政区域内相关药品生产企业并遵照执行。
在本文件执行过程中如有问题与建议,请及时向总局反映。
附件:中药提取物备案管理实施细则第一条为加强中成药生产监督管理,规范中药提取物备案管理工作,保证使用中药提取物得中成药安全、有效与质量可控,制定本细则。
第二条本细则所指中药提取物,就是中成药国家药品标准得处方项下载明,并具有单独国家药品标准,且用于中成药投料生产得挥发油、油脂、浸膏、流浸膏、干浸膏、有效成份、有效部位等成份。
本细则所指中药提取物不包括:中成药国家药品标准中附有具体制法或标准得提取物;按新药批准得中药有效成份或有效部位;冰片、青黛、阿胶等传统按中药材或中药饮片使用得产品;盐酸小檗碱等按化学原料药管理,并经过化学修饰得产品。
第三条本细则所指中药提取物备案,就是中药提取物生产企业按要求提交中药提取物生产备案资料,以及中药提取物使用企业按要求提交使用备案资料得过程。
第四条中药提取物生产备案,中药提取物生产企业应通过中药提取物备案信息平台,填写《中药提取物生产备案表》(附1),向所在地省(区、市)食品药品监督管理局提交完整得资料(PDF格式电子版),并对资料真实性负责。
第五条中药提取物生产备案应提交以下资料:(一)《中药提取物生产备案表》原件。
(二)证明性文件彩色影印件,包括有效得《营业执照》等。
(三)国家药品标准复印件。
(四)生产该提取物用中药材、中药饮片信息。
包括产地、基原、执行标准或炮制规范。
:(五)关键工艺资料。
包括主要工艺路线、设备,关键工艺参数等,关键工艺资料应提供给中药提取物使用企业。
(六)内控质量标准。
包括原料、各单元工艺环节物料及过程质量控制指标、提取物成品检验标准,以及完整工艺路线、详细工艺参数等。
用于中药注射剂得中药提取物应提交指纹或特征图谱检测方法与指标等质量控制资料。
