常见的电池的电极反应式书写教师版j
实用文档之电池电极反应式或总反应式的书写

实用文档之〃电池电极反应式或总反应式的书写〃1 ?铝一^电池(负极一Al,正极一Ni,电解液-NaCl溶液、0:)负极:4A1 — 12e =4A 『•正极:30: +6 比0+12 己=120H :总反应式:4A1 + 30: +6H: O=4A1(OH M2?镁一铝电池(负极一A1,正极一Mg,电解液一K0H溶液)负极:2A1+80H — 6e =2A10r+4Hc0 ;正极:6H : 0+6 亡=3 比 f +60H :总反应离子方程式:%1+tOH -2艮0=%10r+3H厂3?锂电池一型(负极一Li,正极一石墨,电解液-LiAlCl : -SOCL)已知电池总反应式:4Li + 2S0Cl=S0c t +4LiCl + So试写出正、负极反应式:负极:4Li — 4e =4Li ;正极:2S0CL + 4e =S0: i +S + 4C14?铁一^电池(负极一Fe,正极-NiO=,电解液一KOH溶液) 放由已知Fe+Ni03+2H30 备恩Fe (OH) 3+Ni (OH) 2,则:负极:Fe-2e' + 20H =Fe(0H)2;由极:Fe (0H): +2e =Fe + 20H :NiO=+2H : O+2e =Ni(0H) : +20H .阳极:Ni (0H) s~2e +20H =NiO:+2H : Oc5. LiFePO,电池(正极一LiFePO。
负极一Li,含Li*导电固体为电解质) 已知FePO: +Li 黠LiFePO.,贝Ij正极:FePOi+Li +e =LiFePO ; o负极:阻极:Li '+e =Li :LiFePOi-e =FePO; +Li*o6?高铁电池(负极一Zn,正极一石墨,电解质为浸湿的固态碱性物质) 放由已知:3Zn+2K=FQ+8 比0 策!| 3Zn (OH) 3+2Fe (OH) 3+4K0H,贝ij :负极:3Zn-6e" + 60H =3Zn(0H) s;正极:2FeO26e +8H : 0=2Fe (OH)100H o阴极:3Zn(0H) 4-6e =3Zn+60H~ ;阳极:2Fe(0H)s-6e +100H =2Fe&+8HO7. 氢氧燃料电池(1) 电解质是KOH溶液(碱性电解质)负极:2比一4亡+40H =4比0:正极:0=+2H : 0+4e =40H :总反应方程式:2庄+0二=2比0。
常见原电池电极反应式

常见原电池电极反应式一、一次电池1、伏打电池:(负极—Zn,正极—Cu,电解液—H2SO4)负极:正极:总反应离子方程式 Zn + 2H+ == H2↑+ Zn2+2、铁碳电池(析氢腐蚀):(负极—Fe,正极—C,电解液——酸性)负极:正极:总反应离子方程式 Fe+2H+==H2↑+Fe2+3、铁碳电池(吸氧腐蚀):(负极—Fe,正极—C,电解液——中性或碱性)负极:正极:总反应化学方程式:2Fe+O2+2H2O==2Fe(OH)2; (铁锈生成过程) 4.铝镍电池:(负极—Al,正极—Ni,电解液——NaCl溶液)负极:正极:总反应化学方程式: 4Al+3O2+6H2O==4Al(OH)3 (海洋灯标电池)5、普通锌锰干电池:(负极——Zn,正极——碳棒,电解液——NH4Cl糊状物)负极:正极:总反应化学方程式:Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3+H2O6、碱性锌锰干电池:(负极——Zn,正极——碳棒,电解液KOH糊状物)负极:正极:总反应化学方程式:Zn +2MnO2 +2H2O == Zn(OH)2 + MnO(OH)7、银锌电池:(负极——Zn,正极--Ag2O,电解液NaOH )负极:正极:总反应化学方程式: Zn + Ag2O == ZnO + 2Ag8、镁铝电池:(负极--Al,正极--Mg,电解液KOH)负极(Al):正极(Mg):总反应化学方程式: 2Al + 2OH-+ 2H2O = 2AlO2-+ 3H2↑9、高铁电池(负极--Zn,正极--碳,电解液KOH和K2FeO4)正极:总反应化学方程式:3Zn + 2K2FeO4 + 8H210、镁/H2O2酸性燃料电池正极:负极:总反应化学方程式:Mg+ H2SO4+H2O2=MgSO4+2H2O二、充电电池1、铅蓄电池:(负极—Pb 正极—PbO2 电解液—稀硫酸)负极:正极:总化学方程式 Pb+PbO2 + 2H2SO4==2PbSO4+2H2O2、镍镉电池(负极--Cd 、正极—NiOOH、电解液: KOH溶液)放电时负极:正极:总化学方程式 Cd + 2NiOOH + 2H2O===Cd(OH)2 + 2Ni(OH)2三、燃料电池1、氢氧燃料电池:总反应方程式:2H2 + O2 === 2H2O(1)电解质是KOH溶液(碱性电解质)负极:正极:(2)电解质是H2SO4溶液(酸性电解质)负极:正极:(3)电解质是NaCl溶液(中性电解质)负极:正极:2、甲醇燃料电池(注:乙醇燃料电池与甲醇相似)(1)碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应化学方程式:2CH3OH + 3O2 + 4KOH=== 2K2CO3 + 6H2O(2)酸性电解质(铂为两极、电解液H2SO4溶液)正极:负极:总反应式 2CH3OH + 3O2 === 2CO2 + 4H2O3、CO燃料电池(铂为两极、电解液H2SO4溶液)正极:负极:总反应方程式为: 2CO + O2 = 2CO24、甲烷燃料电池(1)碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应方程式: CH4 + 2KOH+ 2O2 === K2CO3 + 3H2O(2)酸性电解质(铂为两极、电解液H2SO4溶液)正极:负极:总反应方程式 CH4 + 2O2 === CO2 + 2H2O5、肼(N2H4)燃料电池(电解质溶液是20%~30%的KOH溶液)正极:负极:总反应方程式: N2H4+ O2 === N2 +2H2O四、非水电池1、氢氧电池:一极为H2,另一极为空气与CO2的混合气,电解质为熔融K2CO3(盐)负极:正极:总反应方程式 2H2 + O2 === 2H2O2、CO电池(一极为CO,另一极为空气与CO2混合气,Li2CO3和Na2CO3的熔融盐作电解质)正极:负极:3、一次性锂电池:(负极--金属锂,正极--石墨,电解液:LiAlCl4-SOCl2)负极:正极:总反应化学方程式 8Li+ 3SOCl2 === Li2SO3 + 6LiCl + 2S4、Li-Al/FeS电池(一级是Li-Al合金,一极是粘有FeS石墨,电解质是Li2CO3熔融盐)正极:负极:总反应方程式:2Li+FeS=Li2S+Fe5、镁电池(一极是Mg,一极是粘有Mo3S4的石墨,电解质是MgSO4熔融盐)正极:负极:总反应方程式:x Mg+Mo3S4=Mg x Mo3S46、新型燃料电池(一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体)正极:负极:总反应方程式:2C4H10+13O2=8CO2+10H2O7、固体酸燃料电池(一极通入空气,另一极通入H2;电解质是CsHSO4固体传递H+)负极:正极:总反应方程式 2H2 + O2 === 2H2O常见原电池电极反应式答案一、一次电池1、伏打电池:负极: Zn–2e-==Zn2+正极: 2H++2e-==H2↑2、铁碳电池(析氢腐蚀):负极: Fe–2e-==Fe2+正极:2H++2e-==H2↑3、铁碳电池(吸氧腐蚀):负极: 2Fe–4e-==2Fe2+OH正极:O2+2H2O+4e-==4-4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;2Fe(OH)3==Fe2O3 +3 H2O4.铝镍电池:负极: 4Al–12e-==4Al3+OH正极:3O2+6H2O+12e-==12-5、普通锌锰干电池:负极:Zn–2e-==Zn2+正极:2MnO2+2NH4++2e-==Mn2O3 +2NH3+H2O6、碱性锌锰干电池:负极:Zn + 2OH– 2e-== Zn(OH)2正极:2MnO2 + 2H2O + 2e-==2MnO(OH) +2OH-7、银锌电池:负极:Zn+2OH-–2e-== ZnO+H2O正极:Ag2O + H2O + 2e-== 2Ag + 2OH-8、镁铝电池:负极(Al): 2Al + 8OH-+6e-= 2AlO2-+4H2O正极(Mg): 6H2O + 6e-= 3H2↑+6OH–9、高铁电池正极:2FeO42- + 8H2O +6e-==2Fe(OH)3 + 4OH–负极: 3Zn + 6OH– 6e-== 3Zn(OH)210、镁/H2O2酸性燃料电池正极:2H++H2O2=2H2O负极:Mg–2e-== Mg 2+二、二次电池(蓄电池或充电电池)1、铅蓄电池:放电时:负极: Pb-2e-+SO42-==PbSO4正极: PbO2+2e-+4H++SO42-==PbSO4+2H2O2、镍镉电池放电时负极: Cd -2e—+ 2 OH– == Cd(OH)2正极: 2NiOOH + 2e—+ 2H2O == 2Ni(OH)2+ 2OH–三、燃料电池1、氢氧燃料电池(1)电解质是KOH溶液(碱性电解质)负极:2H2– 4e- + 4OH— === 4H2O正极:O2 + 2H2O + 4e- === 4OH—(2)电解质是H2SO4溶液(酸性电解质)负极:2H2–4e- === 4H+正极:O2 + 4H+ + 4e- === 2H2O(3)电解质是NaCl溶液(中性电解质)负极:2H2– 4e- === 4H+正极:O2 + 2H2O + 4e- === 4OH—2、甲醇燃料电池(1)碱性电解质正极:3O2 + 12e- + 6H2O=== 12OH-负极:2CH3OH – 12e-+ 16OH—=== 2CO32-+12H2O(2)酸性电解质正极:3O2 + 12e-+ 12H+ == 6H2O负极:2CH3OH –12e-+2H2O==12H++2CO23、CO燃料电池正极: O2 + 4e-+ 4H+ == 2H2O负极: 2CO – 4e- + 2H2O== 2CO2 +4H+4、甲烷燃料电池(1)碱性电解质正极: 2O2 + 4H2O + 8e- == 8OH—负极: CH4 + 10OH—-8e- == CO32- + 7H2O(2)酸性电解质正极: 2O2 + 8e-+ 8H+ == 4H2O负极: CH4- 8e- + 2H2O == 8H+ + CO25、肼(N2H4)燃料电池正极: O2 + 2H2O + 4e- == 4OH—负极: N2H4+ 4OH—– 4e-=== N2 +2H2O四、非水体系电池1、氢氧燃料电池负极:2H2– 4e-+2CO32- === 2CO2↑+2H2O正极:O2 + 4e-+2CO2 === 2CO32—2、CO电池(一极为CO,另一极为空气与CO2的混合气,Li2CO3和Na2CO3熔融盐作电解质)正极: O2 + 4e-+ 2CO2 = 2CO32-负极: 2CO+2CO32-– 4e-==4CO23、一次性锂电池:负极:8Li -8e-=8 Li +正极:3SOCl2+8e-=SO32-+2S+6Cl-4、Li-Al/FeS电池正极:2Li++FeS+2e—=Li2S+Fe负极: 2Li-2e-=2Li +5、镁电池正极:x Mg2++Mo3S4+2x e-=== Mg x Mo3S4负极:x Mg-2x e-===x Mg2+6、新型燃料电池正极:13O2+ 52e-==26O2-负极:2C4H10+26O2- – 52e-==8CO2+10H2O7、固体酸燃料电池负极:2H2–4e- === 4H+正极:O2 + 4H+ + 4e- === 2H2O欢迎您的下载,资料仅供参考!致力为企业和个人提供合同协议,策划案计划书,学习资料等等打造全网一站式需求。
电池电极反应式或总反应式的书写

电池电极反应式或总反应式的书写1.铝—镍电池(负极—Al,正极—Ni,电解液—NaCl溶液、O2)负极:4Al-12e-===4Al3+;正极:3O2+6H2O+12e-===12OH-;总反应式:4Al+3O2+6H2O===4Al(OH)3。
2.镁—铝电池(负极—Al,正极—Mg,电解液—KOH溶液)负极:2Al+8OH--6e-===2AlO-2+4H2O;正极:6H2O+6e-===3H2↑+6OH-;总反应离子方程式:2Al+2OH-+2H2O===2AlO-2+3H2↑。
3.锂电池一型(负极—Li,正极—石墨,电解液—LiAlCl4—SOCl2)已知电池总反应式:4Li+2SOCl2===SO2↑+4LiCl+S。
试写出正、负极反应式:负极:4Li-4e-===4Li+;正极:2SOCl2+4e-===SO2↑+S+4Cl-。
4.铁—镍电池(负极—Fe,正极—NiO2,电解液—KOH溶液)已知Fe+NiO2+2H2O 放电充电Fe(OH)2+Ni(OH)2,则:负极:Fe-2e-+2OH-===Fe(OH)2;正极:NiO2+2H2O+2e-===Ni(OH)2+2OH-。
阴极:Fe(OH)2+2e-===Fe+2OH-;阳极:Ni(OH)2-2e-+2OH-===NiO2+2H2O。
5.LiFePO4电池(正极—LiFePO4,负极—Li,含Li+导电固体为电解质)已知FePO 4+Li 放电充电LiFePO4,则负极:Li-e-===Li+;正极:FePO4+Li++e-===LiFePO4。
阴极:Li++e-===Li;阳极:LiFePO4-e-===FePO4+Li+。
6.高铁电池(负极—Zn,正极—石墨,电解质为浸湿的固态碱性物质)已知:3Zn+2K2FeO4+8H2O 放电充电3Zn(OH)2+2Fe(OH)3+4KOH,则:负极:3Zn-6e-+6OH-===3Zn(OH)2;正极:2FeO2-4+6e-+8H2O===2Fe(OH)3+10OH-。
完整版电池电极反应式或总反应式的书写

电池电极反应式或总反应式的书写1. 铝一镍电池(负极一Al ,正极一Ni ,电解液一NaCI 溶液、Q )负极:4AI — 12e ===4AI ;正极:3Q + 6H2O + 12e _ ===120H ;总反应式:4AI + 3Q + 6fO===4AI (OH )3。
2. 镁一铝电池(负极一AI ,正极一Mg 电解液一KOH 溶液)负极:2AI + 80H — 6e _ ===2AIO + 4H0;正极:6H2O+ 6e _ ===3H f + 6OH —;总反应离子方程式: 2AI + 2OH + 2fO===2AlO + 3H4。
3. 锂电池一型(负极一Li ,正极一石墨,电解液一LiAICI 4—SOC2)已知电池总反应式: 4Li + 2SOCb===SOf + 4LiCI + S 。
试写出正、负极反应式:负极:4Li — 4e _ ===4Li +; 正极:2SOC2+ 4e _ ===SOf + S + 4CI _。
4. 铁一镍电池(负极一Fe ,正极一NiO2,电解液一KOH 溶液)放申已知 Fe + NiO2+ 2fO 充电 Fe (OH )2+ Ni (OH )2,则:负极:Fe — 2e _ + 2OH ===Fe(OH);正极:Ni6+ 2fO+ 2e _ ===Ni(OH)2+ 2OH 。
阴极:Fe(OH )2+ 2e _ ===Fe+ 2OH ;阳极:Ni(OH) 2 — 2e _ + 2OH ===NiQ + 2fO 。
5. LiFePO 4电池(正极一LiFePO4,负极一Li ,含Li +导电固体为电解质) 「川 放电 … 已知 FePO + Li 充电 LiFePO4,贝U 负极: Li — e _===Li + ;正极: FePQ + Li ++ e _ ===LiFePQ 。
阴极: Li + + e _ ===Li ; 阳极: LiFePO4 — e _ ===FeP(4+ Li。
高中化学常见的电池的电极反应式的书写汇总完整版

高中化学常见的电池的电极反应式的书写汇总标准化管理处编码[BBX968T-XBB8968-NNJ668-MM9N]书写过程归纳:列物质,标得失(列出电极上的物质变化,根据价态变化标明电子得失)。
选离子,配电荷(根据介质选择合适的离子,配平电荷,使符合电荷守)。
巧用水,配个数(通常介质为水溶液,可选用水配平质量守恒)一次电池1、伏打电池:(负极—Zn、正极—Cu、电解液—H2SO4)负极: Zn–2e-==Zn2+ (氧化反应) 正极: 2H++2e-==H2↑ (还原反应)离子方程式 Zn + 2H+ == H2↑+ Zn2+2、铁碳电池:(负极—Fe、正极—C、电解液H2CO3弱酸性)负极: Fe–2e-==Fe2+ (氧化反应) 正极:2H++2e-==H2↑ (还原反应)离子方程式 Fe+2H+==H2↑+Fe2+ (析氢腐蚀)3、铁碳电池:(负极—Fe、正极—C、电解液中性或碱性)负极: 2Fe–4e-==2Fe2+ (氧化反应) 正极:O2+2H2O+4e-==4OH (还原反应)化学方程式 2Fe+O2+2H2O==2Fe(OH)2(吸氧腐蚀) 4Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3 H2O (铁锈的生成过程)4.铝镍电池:(负极—Al、正极—Ni 电解液 NaCl溶液、O2)负极: 4Al–12e-==4Al3+ (氧化反应) 正极:3O2+6H2O+12e-==12OH(还原反应)化学方程式 4Al+3O2+6H2O==4Al(OH)3(海洋灯标电池)5、普通锌锰干电池:(负极—Zn、正极—C 、电解液NH4Cl、MnO2的糊状物)负极:Zn–2e-==Zn2+ (氧化反应) 正极:2MnO2+2H++2e-==Mn2O3+H2O (还原反应)化学方程式 Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3↑6、碱性锌锰干电池:(负极—Zn、正极—C、电解液KOH 、MnO2的糊状物)负极:Zn + 2OH– 2e-== Zn(OH)2(氧化反应)正极:2MnO2 + 2H2O + 2e-==2MnOOH +2 OH-(还原反应)化学方程式 Zn +2MnO2 +2H2O == Zn(OH)2+ MnOOH7、银锌电池:(负极—Zn、正极--Ag2O、电解液NaOH )负极:Zn+2OH––2e-== Zn(OH)2(氧化反应)正极:Ag2O + H2O + 2e-== 2Ag + 2 OH- (还原反应)化学方程式 Zn + Ag2O + H2O == Zn(OH)2+ 2Ag8、铝–空气–海水(负极--铝、正极--石墨、铂网等能导电的惰性材料、电解液--海水)负极:4Al-12e-==4Al3+ (氧化反应)正极:3O2+6H2O+12e-==12OH-(还原反应)总反应式为: 4Al+3O2+6H2O===4Al(OH)3(铂网增大与氧气的接触面)9、镁---铝电池(负极--Al、正极--Mg 电解液KOH)负极(Al): 2Al + 8 OH–- 6e- = 2AlO2–+4H2O (氧化反应)正极(Mg): 6H2O + 6e- = 3H2↑+6OH–(还原反应)化学方程式: 2Al + 2OH– + 2H2O = 2AlO2–+ 3H210、锂电池一型:(负极--金属锂、正极--石墨、电解液LiAlCl4 -SOCl2)负极:8Li -8e-=8 Li + (氧化反应)正极:3SOCl2+8e-=SO32-+2S+6Cl-(还原反应)化学方程式 8Li+ 3SOCl2 === Li2SO3+ 6LiCl + 2S,二次电池(又叫蓄电池或充电电池)1、铅蓄电池:(负极—Pb 正极—PbO2电解液—浓硫酸)放电时负极: Pb-2e-+SO42-=PbSO4(氧化反应)正极: PbO2+2e-+4H++SO42-=PbSO4+2H2O (还原反应)充电时阴极: PbSO4 + 2H+ + 2e-== Pb+H2SO4(还原反应)阳极: PbSO4 + 2H2O - 2e-== PbO2+ H2SO4+ 2H+ (氧化反应)总化学方程式 Pb+PbO2 + 2H2SO4充电放电2PbSO4+2H2O2、铁--镍电池:(负极-- Fe 、正极—NiO2、电解质溶液为KOH溶液)放电时负极: Fe-2e—+ 2 OH– == Fe (OH)2(氧化反应)正极: NiO2 + 2H2O + 2e—== Ni(OH)2+ 2 OH–(还原反应)充电时阴极: Fe (OH)2+ 2e—== Fe + 2 OH–(还原反应)阳极: Ni(OH)2-2e—+ 2 OH– == NiO2+ 2H2O (氧化反应)总化学方程式 Fe + NiO2+ 2H2O放电 Fe (OH)2+ Ni(OH)23、LiFePO4电池(正极—LiFePO4,负极—石墨,含Li+导电固体为电解质)放电时负极: Li - e— ==Li + (氧化反应)正极: FePO4 + Li+ + e—== LiFePO4(还原反应)充电时:阴极: Li+ + e—== Li (还原反应)阳极: LiFePO4-e—== FePO4+ Li+ (氧化反应)总化学方程式 FePO4 + Li充电放电 LiFePO44、镍--镉电池(负极--Cd、正极—NiOOH、电解质溶液为KOH溶液)放电时负极: Cd-2e—+ 2 OH– == Cd(OH)2(氧化反应)正极: 2NiOOH + 2e — + 2H 2O == 2Ni(OH)2+ 2OH–(还原反应)充电时 阴极: Cd(OH)2 + 2e —== Cd + 2 OH – (还原反应)阳极:2 Ni(OH)2 -2e —+ 2 OH – == 2NiOOH + 2H 2O (氧化反应)总化学方程式 Cd + 2NiOOH + 2H 2O 放电Cd(OH)2 + 2Ni(OH)25、氢--镍电池:(负极-LaNi 5储氢合金、正极—NiOOH 、电解质KOH+LiOH )放电时 负极: LaNi 5H 6-6e —+ 6OH –== LaNi 5 + 6H 2O (氧化反应)正极: 6NiOOH +6e —+ 6H 2O ==6 Ni(OH)2 + 6OH – (还原反应)充电时 阴极: LaNi 5 +6e —+ 6H 2O== LaNi 5H 6+ 6OH – (还原反应)阳极: 6 Ni(OH)2 -6e —+ 6OH –== 6NiOOH + 6H 2O (氧化反应)总化学方程式 LaNi 5H 6 + 6NiOOH放电LaNi 5 + 6Ni(OH)26、高铁电池:(负极—Zn 、正极---石墨、电解质为浸湿固态碱性物质)放电时 负极:3Zn -6e - + 6 OH –== 3 Zn(OH)2 (氧化反应)正极:2FeO 42— +6e -+ 8H 2O ==2 Fe (OH)3 + 10OH – (还原反应)充电时 阴极:3Zn(OH)2 +6e -==3Zn + 6 OH – (还原反应)阳极:2Fe(OH)3 -6e -+ 10OH –==2FeO 42—+ 8H 2O (氧化反应)Ni(OH)2+Cd(OH)2总化学方程式 3Zn + 2K2FeO4+ 8H2O放电3Zn(OH)2+ 2Fe(OH)3+ 4KOH7、锂电池二型(负极LiC6、正极含锂的二氧化钴LiCoO2、充电时LiCoO2中Li被氧化,Li+还原以Li原子形式嵌入电池负极材料碳C6中,以LiC6表示)放电时负极: LiC6 – xe- = Li(1-x)C6+ x Li+ (氧化反应)正极: Li(1-x)CoO2+ xe- + x Li+ == LiCoO2(还原反应)充电时阴极: Li(1-x)C6+ x Li+ + xe- =LiC6(还原反应)阳极: LiCoO2 – xe-= Li(1-x)CoO2+ x Li+(氧化反应)总反应方程式 Li(1-x)CoO2+ LiC6 充电放电LiCoO2+ Li(1-x)C6燃料电池根据题意叙述书写常见于燃料电池,由于燃料电池的优点较多,成为了近年高考的方向。
高中常见原电池电极反应式书写总结演示教学

高中常见的原电池电极反应式的书写1、伏打电池:(负极—Zn,正极—Cu,电解液—H2SO4)负极:Zn–2e-==Zn2+(氧化反应)正极:2H++2e-==H2↑(还原反应)总反应离子方程式Zn + 2H+ == H2↑+ Zn2+2、铁碳电池(析氢腐蚀):(负极—Fe,正极—C,电解液——酸性)负极:Fe–2e-==Fe2+(氧化反应)正极:2H++2e-==H2↑(还原反应)总反应离子方程式Fe+2H+==H2↑+Fe2+3、铁碳电池(吸氧腐蚀):(负极—Fe,正极—C,电解液——中性或碱性)负极:2Fe–4e-==2Fe2+(氧化反应)正极:O2+2H2O+4e-==4-OH(还原反应)总反应化学方程式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)3 ;2Fe(OH)3==Fe2O3 +3 H2O (铁锈的生成过程)4.铝镍电池:(负极—Al,正极—Ni,电解液——NaCl溶液)负极:4Al–12e-==4Al3+(氧化反应)正极:3O2+6H2O+12e-==12-OH(还原反应)总反应化学方程式:4Al+3O2+6H2O==4Al(OH)3 (海洋灯标电池)5、铝–空气–海水(负极--铝,正极--石墨、铂网等能导电的惰性材料,电解液--海水)负极:4Al-12e-==4Al3+ (氧化反应)正极:3O2+6H2O+12e-==12OH-(还原反应)总反应式为:4Al+3O2+6H2O===4Al(OH)3(铂网增大与氧气的接触面)(海洋灯标电池)6、普通锌锰干电池:(负极——Zn,正极——碳棒,电解液——NH4Cl糊状物)负极:Zn–2e-==Zn2+(氧化反应)正极:2MnO2+2NH4++2e-==Mn2O3 +2NH3+H2O(还原反应)总反应化学方程式:Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3+H2O7、碱性锌锰干电池:(负极——Zn,正极——碳棒,电解液KOH糊状物)负极:Zn + 2OH– 2e-== Zn(OH)2(氧化反应)正极:2MnO2 + 2H2O + 2e-==2MnO(OH) +2OH-(还原反应)总反应化学方程式:Zn +2MnO2 +2H2O == Zn(OH)2 + MnO(OH)8、银锌电池:(负极——Zn,正极--Ag2O,电解液NaOH )负极:Zn+2OH-–2e-== ZnO+H2O(氧化反应)正极:Ag2O + H2O + 2e-== 2Ag + 2OH-(还原反应)总反应化学方程式:Zn + Ag2O == ZnO + 2Ag9、镁铝电池:(负极--Al,正极--Mg,电解液KOH)负极(Al):2Al + 8OH-+6e-=2AlO2-+4H2O(氧化反应)正极(Mg):6H2O + 6e-=3H2↑+6OH–总反应化学方程式:2Al + 2OH-+ 2H2O =2AlO2-+ 3H2↑10、一次性锂电池:(负极--金属锂,正极--石墨,电解液:LiAlCl4-SOCl2)负极:8Li -8e-=8 Li + 正极:3SOCl2+8e-=SO32-+2S+6Cl-总反应化学方程式8Li+3SOCl=== Li SO+6LiCl +2S放电时:负极:Pb-2e-+SO42-==PbSO4正极:PbO2+2e-+4H++SO42-==PbSO4+2H2O总化学方程式Pb+PbO2 + 2H2SO4==2PbSO4+2H2O2、镍镉电池(负极--Cd、正极—NiOOH、电解液: KOH溶液)放电时负极:Cd-2e—+ 2 OH– == Cd(OH)2Ni(OH)2+Cd(OH)2正极:2NiOOH + 2e—+ 2H2O == 2Ni(OH)2+ 2OH–总化学方程式Cd + 2NiOOH + 2H2O===Cd(OH)2 + 2Ni(OH)2精品文档3、铁--镍电池:(负极-- Fe 、正极—NiO2、电解质溶液为KOH溶液)放电时负极:Fe-2e—+ 2 OH–== Fe (OH)2(氧化反应)正极:NiO2+ 2H2O + 2e—== Ni(OH)2 + 2 OH–(还原反应)充电时阴极:Fe (OH)2+ 2e—== Fe + 2 OH–(还原反应)阳极:Ni(OH)2-2e—+ 2 OH–== NiO 2+ 2H2O (氧化反应)总化学方程式Fe + NiO 2+ 2H2O === Fe (OH)2+ Ni(OH)24、LiFePO4电池(正极—LiFePO4,负极—石墨,含Li+导电固体为电解质)放电时负极:Li -e—==Li +(氧化反应)正极:FePO4+ Li++ e—== LiFePO4(还原反应)充电时阴极:Li++ e—== Li (还原反应)阳极:LiFePO4-e—== FePO4+ Li+(氧化反应)总化学方程式FePO4 + Li====== LiFePO45、氢--镍电池:(负极-LaNi5储氢合金、正极—NiOOH、电解质KOH+LiOH)放电时负极:LaNi5H 6-6e—+ 6OH–== LaNi5+ 6H2O (氧化反应)正极:6NiOOH +6e—+ 6H2O ==6 Ni(OH)2+ 6OH–(还原反应)充电时阴极:LaNi5+6e—+ 6H2O== LaNi5H 6+ 6OH–(还原反应)阳极:6 Ni(OH)2-6e—+ 6OH–== 6NiOOH + 6H2O (氧化反应)总化学方程式LaNi5H 6+ 6NiOOH LaNi5+ 6Ni(OH)26、高铁电池:(负极—Zn、正极---石墨、电解质为浸湿固态碱性物质)放电时负极:3Zn -6e- + 6 OH–== 3 Zn(OH)2(氧化反应)正极:2FeO42—+6e-+ 8H2O ==2 Fe (OH)3+ 10OH-(还原反应) 充电时阴极:3Zn(OH)2 +6e-==3Zn + 6 OH–(还原反应)阳极:2Fe(OH)3-6e-+ 10OH–==2FeO42—+ 8H2O (氧化反应) 总化学方程式3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH7、锂电池二型(负极LiC6、正极含锂的二氧化钴LiCoO2、充电时LiCoO2中Li被氧化,Li+还原以Li原子形式嵌入电池负极材料碳C6中,以LiC6表示)放电时负极: LiC6–xe-=Li(1-x)C6+ x Li+(氧化反应)正极:Li(1-x)CoO2+ xe-+ x Li+== LiCoO2(还原反应)充电时阴极:Li(1-x)C6+ x Li++ xe-=LiC6(还原反应)阳极:LiCoO2–xe-=Li(1-x)CoO2+ x Li+(氧化反应)+ LiC LiCoO+ Li(1-x)C总反应方程式Li(1-x)CoO1、氢氧燃料电池氢氧燃料电池一般是以惰性金属铂(Pt)或石墨做电极材料,负极通入H2,正极通入O2,总反应为:2H2+ O2 === 2H2O电极反应特别要注意电解质,有下列四种情况,但总反应式均相同:(1)电解质是KOH溶液(碱性电解质)负极:2H2–4e-+ 4OH—=== 4H2O 正极:O2+ 2H2O + 4e-=== 4OH—总反应方程式: 2H2+ O2=== 2H2O(2)电解质是H2SO4溶液(酸性电解质)负极:2H2–4e-=== 4H+正极:O2+ 4H++ 4e-=== 2H2O总反应方程式2H2+ O2=== 2H2O(3)电解质是NaCl溶液(中性电解质)负极:2H2–4e-=== 4H+正极:O2+ 2H2O + 4e-=== 4OH—总反应方程式2H2+ O2=== 2H2O精品文档(4)电解质为熔融K2CO3(盐)负极:2H2–4e-+2CO32-=== 2CO2↑+2H2O 正极:O2+ 4e-+2CO2=== 2CO32—总反应方程式2H2+ O2=== 2H2O说明:1、碱性溶液反应物、生成物中均无H+ 2、水溶液中不能出现O2-3、中性溶液反应物中无H+ 和OH-—4、酸性溶液反应物、生成物中均无OH-2、甲醇燃料电池(注:乙醇燃料电池与甲醇相似)(1)碱性电解质(铂为两极、电解液KOH溶液)正极:3O2 + 12e-+ 6H2O=== 12OH-负极:2CH3OH –12e-+ 16OH—=== 2CO32-+12H2O 总反应化学方程式:2CH3OH + 3O2 + 4KOH=== 2K2CO3 + 6H2O总反应离子方程式:2CH3OH + 3O2 + 4OH-=== 2CO32-+ 6H2O(2)酸性电解质(铂为两极、电解液H2SO4溶液)正极:3O2 + 12e-+ 12H+ == 6H2O 负极:2CH3OH –12e-+2H2O==12H++2CO2总反应式2CH3OH + 3O2 === 2CO2 + 4H2O3、CO燃料电池(总反应方程式均为:2CO +O2 =2CO2)(1)熔融盐(铂为两极、Li2CO3和Na2CO3的熔融盐作电解质,CO入负极,空气与CO2的混合气入正极)正极:O2 +4e-+2CO2 =2CO32-负极:2CO+2CO32-–4e-==4CO2(2)酸性电解质(铂为两极、电解液H2SO4溶液)正极:O2 + 4e-+ 4H+ == 2H2O 负极:2CO –4e-+ 2H2O== 2CO2+4H+4、肼燃料电池(铂为两极、电解液KOH溶液)正极:O2+ 2H2O + 4e-== 4OH—(还原反应)负极:N2H4+ 4OH—- 4e-== N2+ 4H2O (氧化反应)总反应方程式N2H4+ O2=== N2+ 2H2O4、甲烷燃料电池1.碱性电解质(铂为两极、电解液KOH溶液)正极:2O2+ 2H2O + 8e-== 8OH—负极:CH4+ 10OH—-8e-== CO32-+ 7H2O总反应方程式:CH4+ 2KOH+ 2O2=== K2CO3+ 3H2O2、酸性电解质(铂为两极、电解液H2SO4溶液)正极:2O2+ 8e-+ 8H+ == 4H2O 负极:CH4-8e-+ 2H2O == 8H+ + CO2总反应方程式CH4+ 2O2=== CO2+ 2H2O5、丙烷燃料电池(铂为两极、正极通入O2和CO2、负极通入丙烷、电解液有三种)1.电解质是熔融碳酸盐(K2CO3或Na2CO3)正极:5O2+ 20e-+ 10CO2== 10CO32- (还原反应)负极:C3H8-- 20e-+ 10CO32-== 3CO2+ 4H2O (氧化反应)精品文档。
常见化学电源电极反应式书写)

常见化学电源1、银-锌电池:(电解质溶液:KOH溶液)总反应:Zn + Ag2O=2Ag + ZnO正极:负极:2、Ni-Cd电池:(电解质溶液:KOH溶液)总反应:Cd +2 NiO(OH) + 2H2O=Cd(OH)2 + 2Ni(OH)2正极:负极3、铅蓄电池:(电解质溶液:硫酸)总反应:Pb + PbO2 + 2H2SO4=2PbSO4 + 2H2O正极:负极4、锌锰干电池(1)酸性(电解质:NH4Cl等)总反应:Zn + 2NH4Cl=ZnCl2 + 2 NH3 + H2正极:负极(2碱性(电解质KOH)总反应式:负极:正极:5、锂电池:(正极材料为LiMnO2)总反应:Li + MnO2=LiMnO2正极:负极6、氢-氧电池:总反应:2H2 + O2=2H2O(1)电解质溶液若为硫酸:正极:________________________________,负极:________________________________(2)电解质溶液若为KOH溶液:正极:________________________________,负极:________________________________ 7、甲烷电池:(电解质溶液:KOH溶液)总反应:CH4 +2 KOH + 2O2=K2CO3 + 3H2O正极:负极8、乙烷电池:(电解质溶液:KOH溶液)总反应:2C2H6 + 8KOH +7O2=4K2CO3 + 10H2O正极:负极9、甲醇燃料电池(40%KOH溶液)负极:正极:总反应式:10、Fe-Ni电池(爱迪生电池):(电解质溶液:KOH溶液)总反应:Fe + NiO2 + 2H2O=Fe(OH)2 + Ni(OH)2正极:负极11、铝-空气海水电池:(电解质溶液:海水)总反应:4Al + 6H2O + 3O2=4A l(O H)3正极:负极12、熔融盐电池:(电解质:熔融Li2CO3、Na2CO3)总反应:2CO + O2=2CO2正极:负极13、反应式为:的原电池。
(完整版)电极反应式书写大全,推荐文档
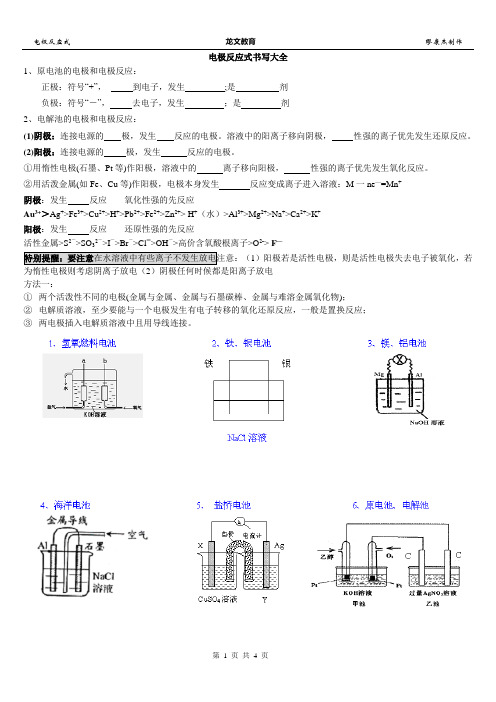
电极反应式书写大全1、原电池的电极和电极反应:正极:符号“+”,到电子,发生;是剂负极:符号“-”,去电子,发生;是剂2、电解池的电极和电极反应:(1)阴极:连接电源的极,发生反应的电极。
溶液中的阳离子移向阴极,性强的离子优先发生还原反应。
(2)阳极:连接电源的极,发生反应的电极。
①用惰性电极(石墨、Pt等)作阳极,溶液中的离子移向阳极,性强的离子优先发生氧化反应。
②用活泼金属(如Fe、Cu等)作阳极,电极本身发生反应变成离子进入溶液:M一ne—=Mn+阴极:发生反应氧化性强的先反应Au3+>Ag+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+> H+(水)>Al3+>Mg2+>Na+>Ca2+>K+阳极:发生反应还原性强的先反应活性金属>S2->SO32->I->Br->Cl->OH->高价含氧酸根离子>O2-> F—特别提醒:要注意在水溶液中有些离子不发生放电注意:(1)阳极若是活性电极,则是活性电极失去电子被氧化,若为惰性电极则考虑阴离子放电(2)阴极任何时候都是阳离子放电方法一:①两个活泼性不同的电极(金属与金属、金属与石墨碳棒、金属与难溶金属氧化物);②电解质溶液,至少要能与一个电极发生有电子转移的氧化还原反应,一般是置换反应;③两电极插入电解质溶液中且用导线连接。
由甲醇和氧气以及强碱作电解质溶液的新型手机电池。
解析:CH3OH+O2→CO2+H2O 但:CO2在碱性环境中不存在,会与OH-反应生成CO32-总反应:正极反应式为:由于电解质溶液为碱性,所以正极的产物不再进一步反应,则负极的反应式为总反应方程式减去正极的反应式得到负极反应式为:16、a、b、c、d都为惰性电极,填空:M为极,N为极,a极上的电极反应为:b 极上的电极反应为:总方程式为:c极上的电极反应为: d极上的电极反应为:总方程式为:17、右图为以惰性电极进行电解:(1)写出A 、B、C、D各电极上的电极反应式和总反应方程式:A:____ _,B:_______________,总反应方程式:__________ _;C:__________ _,D:______________,总反应方程式:___________________________;18、甲烷-氧气燃料电池,该电池用金属铂片插入KOH溶液中作电极,在两极上分别通甲烷和氧气。
常见化学电源电极反应式书写)

常见化学电源1、银-锌电池:(电解质溶液:KOH溶液)总反应:Zn + Ag2O=2Ag + ZnO正极:负极:2、Ni-Cd电池:(电解质溶液:KOH溶液)总反应:Cd +2 NiO(OH) + 2H2O=Cd(OH)2 + 2Ni(OH)2正极:负极3、铅蓄电池:(电解质溶液:硫酸)总反应:Pb + PbO2 + 2H2SO4=2PbSO4 + 2H2O正极:负极4、锌锰干电池(1)酸性(电解质:NH4Cl等)总反应:Zn + 2NH4Cl=ZnCl2 + 2 NH3 + H2正极:负极(2碱性(电解质KOH)总反应式:负极:正极:5、锂电池:(正极材料为LiMnO2)总反应:Li + MnO2=LiMnO2正极:负极6、氢-氧电池:总反应:2H2 + O2=2H2O(1)电解质溶液若为硫酸:正极:________________________________,负极:________________________________(2)电解质溶液若为KOH溶液:正极:________________________________,负极:________________________________ 7、甲烷电池:(电解质溶液:KOH溶液)总反应:CH4 +2 KOH + 2O2=K2CO3 + 3H2O正极:负极8、乙烷电池:(电解质溶液:KOH溶液)总反应:2C2H6 + 8KOH +7O2=4K2CO3 + 10H2O正极:负极9、甲醇燃料电池(40%KOH溶液)负极:正极:总反应式:10、Fe-Ni电池(爱迪生电池):(电解质溶液:KOH溶液)总反应:Fe + NiO2 + 2H2O=Fe(OH)2 + Ni(OH)2正极:负极11、铝-空气海水电池:(电解质溶液:海水)总反应:4Al + 6H2O + 3O2=4A l(O H)3正极:负极12、熔融盐电池:(电解质:熔融Li2CO3、Na2CO3)总反应:2CO + O2=2CO2正极:负极13、反应式为:的原电池。
电池电极反应式或总反应式的书写Word版

电池电极反应式或总反应式的书写1.铝—镍电池(负极—Al,正极—Ni,电解液—NaCl溶液、O2)负极:4Al-12e-===4Al3+;正极:3O2+6H2O+12e-===12OH-;总反应式:4Al+3O2+6H2O===4Al(OH)3。
2.镁—铝电池(负极—Al,正极—Mg,电解液—KOH溶液)负极:2Al+8OH--6e-===2AlO-2+4H2O;正极:6H2O+6e-===3H2↑+6OH-;总反应离子方程式:2Al+2OH-+2H2O===2AlO-2+3H2↑。
3.锂电池一型(负极—Li,正极—石墨,电解液—LiAlCl4—SOCl2)已知电池总反应式:4Li+2SOCl2===SO2↑+4LiCl+S。
试写出正、负极反应式:负极:4Li-4e-===4Li+;正极:2SOCl2+4e-===SO2↑+S+4Cl-。
4.铁—镍电池(负极—Fe,正极—NiO2,电解液—KOH溶液)已知Fe+NiO2+2H2O 放电充电Fe(OH)2+Ni(OH)2,则:负极:Fe-2e-+2OH-===Fe(OH)2;正极:NiO2+2H2O+2e-===Ni(OH)2+2OH-。
阴极:Fe(OH)2+2e-===Fe+2OH-;阳极:Ni(OH)2-2e-+2OH-===NiO2+2H2O。
5.LiFePO4电池(正极—LiFePO4,负极—Li,含Li+导电固体为电解质)已知FePO4+Li 放电充电LiFePO4,则负极:Li-e-===Li+;正极:FePO4+Li++e-===LiFePO4。
阴极:Li++e-===Li;阳极:LiFePO4-e-===FePO4+Li+。
6.高铁电池(负极—Zn,正极—石墨,电解质为浸湿的固态碱性物质)已知:3Zn+2K2FeO4+8H2O 放电充电3Zn(OH)2+2Fe(OH)3+4KOH,则:负极:3Zn-6e-+6OH-===3Zn(OH)2;正极:2FeO2-4+6e-+8H2O===2Fe(OH)3+10OH-。
常见的原电池电极反应式书写汇总

常见的原电池电极反应式书写汇总一次电池1、伏打电池:(负极一Zm 正极Yu 电解液:H2SO4)负极:Zn -2c === Zn*(氧化反应)正极:2H+ + 2c ===比f (还原反应)离于方程式:Zn + 2屮==H. f + Zir^2、铁碳电池:(负极一Fc正极一C 电解液:H2CO3弱酸性)负极:Fc - 2c === F D*(氣化反正极:2H* + 2c- === H2 f (还原反应)离于方程式:Fc + 2H H2 T + Fc"(析氢腐蚀)3、铁碳电池:(负极一Fc正极一C 电解液:中性或碱性)负极:2Fc-4c === 2Fc^* 化反应)正极:()2 + 2出()+ 4c' === 4()H'(还原反应)化学方程式:2Fc + (L+2H2O === 2F D(()H)2(吸氧腐蚀)4F C(()H)2 +()2 + 2出()===4F U(()H)3 2Fe(()H)3=== + 3出()(铁锈的生成过程)4•铝镰电池:(负极一Ah正极一Ni 电解液:NoCl溶液、(冷负极:4A1 -12c- === 4A严(氧化反应)正极:3()2+ 6出()+ 12c === 12()H•(还原反应)化学方程式:4A1 + 3()2 + 6HQ === 4A1(()H)3(海洋灯标电池)5、普通锌猛干电池:(负极一Zm正极Y 电解液:NH/X MnO.的糊状物)负极:Zn - 2c === ZiF气氧化反应)正极:2Mn()2 + 2H・ + 2c === Mn.O^ + H.O (还原反应)化学方程式:Zn + 2NH4CI + 2Mn(). === ZnCU + Mn.O^ + 2NH316、碱性锌猛干电池:(负极一Zm正极Y 电解液:KOH. MnO.的糊状物)负极:Zn + 2()H--2c- === Zn(()Hh (氧化反应)正极:2Mn()2 + 2H2()+2C === 2Mn(X)H + 2()H-(还原反应)化学方程式:Zn + 2Mn()2 + 2出()===Zn(()Hh+ MnOOH7、银锌电池:(负极一Zn、正极“AM)电解液:NaOH)负极:Zn + 2()H・-2c- === Zn(()H)2 (氧化反应)正极:AgQ + H2()+ 2c ===2Ag+2()H・(还原反应)化学方程式:Zn + A也0 + HX) === Zn(()H)2 + 2Ag8、铝-空气-海水(负极-铝、正极-石墨、钳网等能导电的情性材料电解液:海水)负极:4Al・12u" === 4AP* (<化反应)正极:3()2 + 6H2()+12c- === 12()H-(还原反应)总反应式为:4A1 + 3()2 + 6HQ === 4A1(()H)3 (钳网增大与氧气的接触面)9、镁…铝电池(负极-Al、正极一Mg 电解液:K()H )负极(Al): 2A1 + 8()H・-6c- === 2A1()2- + 4比()(氣化反应)正极(Mg): 6出()+ 6c === 3H2 f +6<)H-(还原反应)化学方程式:2A1 + 2()H・+ 2出()===2AR)2'+ 3出f正极:F C P()4 + Li* + c- === LiFcP()4 (还原反应) 阳极:LiFcP ()4-c ===F cP()4 + Li+ (氧化反应) 10.锂电池一型:(负极-金厲锂、正极“石墨 电解液:LiAlCL …SOCh )负极:8Li - 8c === 8Li^ (氧化反应)充电时 阴极:tr + C- === Li (还原反应)正极:3S()C12 + 8c"=== SC*- +2S + 6C 广(还原反应)化学方程式:8Li + 3S()C12 === Li^SO^ + 6LiCi + 2S二次电池(又叫蓄电池或充电电池)1、铅薔电池:(负极一Pb 、正极一Pb ()2 电解液:浓硫酸)放电时 负极:Pb-2c-+s ()r- === Pbs <)4 (氧化反应)正极:Pb()2 + 2c" + 4H++ S()j-=== PbS(h+ 2H2()(还原反应)充电时 阴极:PbS<)4 + 2H" + 2c === Pb + H2S()4 (还原反应)阳极:PbS (h + 2出()-2e=== Pb ()2 + HSh + 2H ・(氧化反应)总化学方程式:Pb + Pb()2 + 2H2S()4 -慕-2PbS()4 + 2HQ2、铁••镰电池:(负极・・民、正极一Z ()2 电解质:K ()H 溶液)放电时负极: Fe - 2c + 2()H - === Fu(()H)2 (氧化反应)正极: Ni()2 + 2出()+ 2 厂===Ni(()H)2 + 2()H'(还原反应)充电时阴极: F U (()H)2 + 2c === Fc + 2()H '(还原反应)阳极: Ni(( )H)2 - 2c + 2( )H ・===Ni(\ + 2Hn (氧化反应)总化学方程式:Fc + NiO, + 2HX )允电3. LiFepOq 电池(正极一LiFcPO,负极一石墨电解质:含Li ■导电固体) 放电时负极:Li - C===Li* (氧化反应)4、镣-镉电池(负极“Cd.正极一NiOQH 电解质:K()H 溶液)放电时 负极:Cd ・2J+2()H ・=HCd(()H)2 (氧化反应)正极:2Ni(X)H + 2c + 2H2() === 2Zi(()H)2 + 2()H'(还原反应)充电时 阴极:Cd(()H)2 + 2c ===Cd + 2OH-(还原反应)阳极:2Zi(()H)2 - 2e + 2()H === 2Ni()()H + 2比()(氧化反应)总化学方程式:Cd + 2Ni()OH + 2比()烷暑-Cd(()H), + 2Ni(()H)25、氢一镰电池:(负极-LaNi, ftS 氢合金、正极一Ni()()H 电解质:KOH + LiOH ) 放电时 负极:LaNi,H,-6c- + 6()H'=== LaNi, + 6兄()(氧化反应)正极:6NiO()H + 6厂 + 6H2()=== 6Ni(()H)2 + 6()H'(还原反应)充电时 阴极:LAh + 6u ・ + 6Hn===SNiH + 6()H-(还原反应)阳极:6Ni(()H)2 — 6厂+6()H ・===6Ni()()H + 6H2()(氣化反应)总化学方程式:LaNi,H^ + 6Ni()()H 充电 LaNi, + 6Ni(()H)26、高铁电池:(负极一Zn 、正极…石墨 电解质:浸湿固态碱性物质) 放电时 负极:3Zn - 6c +6()HP==3Zn(()H)2 (氧化反应)正极:2Fe()4-' + 6e+ 8H2()=== 2F C (()H)3 + 1()()H'(还原反应)充电时 阴极:3Zn(()H)2 + 6c === 3Zn + 6()H"(还原反应)阳极:2F C (OH)3-6C ' + 10()H'=== 2Fe<)4^+ «比()(氧化反应)放电总化学方程式:3Zn + 2K2F C ()4 + 汨2()「充电-3Zn(()H)2 + 2Fc((旧人 + 4I«)H 总化学方程式:F C P()4 + Li7L 电LiFcP()47、锂电池二型(负极LiC"正极含锂的二氧化钻LiC()()2、充电时LiCoO,中Li被氧化,L广还原以Li原于形式嵌入电池负极材料碳G中,以LiG耒示)放电时负极:LiCh - XC === Li,;i^)Cfi + xLi (氧化反应)正极:Li gCoQj + xc' + xLi" === LiC(》()2 (还原反应)充电时阴极:LigG +小广+ 2 H= uq (还原反应)阳极:LiC<)()2 - XC === Li(i・0C()()2 + xLi* (氧化反应)总反应方程式:LigC()()2 + Lie,充电LiCo()2 + LigG燃料电池氢氧燃料电池氢氧燃料电池一般是以惰性金属钳(PV)或石墨做电极材料,负极通入兄,正极通入O"总反应为:2H, + O, === 2HX)电板反应特别要注意电解质,有下列三种情况: 1、电解质是K()H溶液(碱性电解质)负极:H, - 2& + 2()H一===2H2()(氧化反应)正极:()2 + 2出()+ 4c === 4()H一(还原反应)总反应方程式:2出+()2 === 2比()2、电解质是HPQ溶液(酸性电解质)负极:H2-2C・H=2H+(氧化反应)正极:()2 + 4H" + 4c === 2比()(还原反应)总反应方程式:2出+()2 === 2出()3、电解质是NaCl溶液(中性电解质)正极:()2 + H2()+ 4c === 4()H-负极:H. - 2c- === 2H^ (氧化反应)总反应方程式:2H2+O2= = =2H2()说明:1、碱性溶液反应物、生成物中均无H・2、水溶液中不能出现(尸3、中性溶液反应物中无H■和()H・4、酸性溶液反应物、生成物中均无()H・二.甲»燃料电池1 •碱性电解质(钳为两极、电解液KOH溶液)正极:3()2 + 12c + 6出()===12()H・(还原反应)负极:2CH3()H-12C- + 16()H-=== 2C(V+ 12HX)(氧化反应)总反应方程式:2CH3()H + 3()2+ 4K()H === 2K2C()3 + 6出()2•酸性电解质(钳为两极、电解液HSOj溶液)正极:3()2 + 12c + 12H・===6凡()(还原反应)(注:乙醇燃料电池与甲醇燃料电池原理基本相同)负极:2CH3()H-12C+2H2()==12H J2C()2(氣化反应)总反应式:2CH3()H + 3()2 === 2C()2 + 4H2()(氣化反应)三、CO燃料电池(总反应方程式均为:2C() + a = 2C(b) 1、熔融盐(钳为两极、U2C()3和NM()3的熔融盐作电解质,CO为负极燃气,空气与C()2的混合气为正极助燃气)正极:d +4c- + 2C()2 = 2C(F・(还原反应)2、酸性电解质(钳为两极、电解液比久)4溶液)负极:2C() + 2C(V-4c-=== 4C(X (氧化反应)正极:()2 + 4c + 4H+ === 2比()(还原反应)负极:2C() - 4c' + 2比()2C()2 + 4H* (氧化反应)四、腓燃料电池(钳为两极、电解液K()H溶液)正极:()2 + 2已()+ 4c === 4(旧一(还原反应)负极:N2H4+ 4(〉H一・4c === N, + 4出()(氧化反应)总反应方程式:N2H4 + ()2 === N. + 2比()五、甲烷燃料电池1.碱性电解质(钳为两极、电解液KOH溶液)正极:2(), + 2HX)+ 8c- === 一(还原反应)负极:CH」+ 1()()H"•牝• === C(V' + 7H2()(氧化反应)总反应方程式:CH」+ 2I«)H + 2(). === K2CO3 + 3H2() 2、酸性电解质(钳为两极、电解液H3S()4溶液)正极:2()2 + 8c + 8H+ === 4HX)(还原反应)负极:CH」-8c + 2Hn === 8才+ CO.(氧化反应)总反应方程式:CH, + 2()2 === C()2 + 2出()六.丙烷燃料电池(钳为两极、正极通入()2和C()2、负极通入丙烷、电解液有三种)1、电解质炬熔融碳酸盐(KK()3或Zi2C()3)正极:5()2 + 20c + 1()C()2 === 1()C(屮(还原反应)负极:CH - 2()c + WCOs' === 3C()2 + 4H2()(氧化反应)总反应方程式:C;H, + 5()2 === 3C()2 + 4比()2、酸性电解质(电解液H3S ()4溶液)正极:5()2 + 2()c + 2()H・===lOHQ (还原反应)负极:GH. - 2()c + 6出()===3C()2 + 20H" «化反应)总反应方程式:GH, + 5()2 === 3C()2+ 4比() 3、碱性电解质(钳为两极、电解液K()H 溶液)正极:5()2 + 20c + 10HX)=== 2()()H一(还原反应)负极:GH K - 2()c + 26( )H一=== 3COf + HH.O (氧化反应)总反应方程式:GH, + 5()2 + 6K()H === 3K2C()3 + 7H2()七.乙烷燃料电池(钳为两极、电解液K()H溶液)正极:7()2 + 2牝・+14H2()===28()H"(还原反应)负极:2C2Hr 28c +36()H一=== ACCV + 24比()(氧化反应)总反应方程式:2C:H A + 7()2 + 8K()H === 4K2C()3 + lOH.O。
常见的电极反应方程式的书写

一次电池1、伏打电池:(负极—Zn、正极—Cu、电解液—H2SO4)负极:Zn–2e-==Zn2+(氧化反应)正极: 2H++2e-==H2↑(还原反应)离子方程式Zn + 2H+ == H2↑+ Zn2+2、铁碳电池:(负极—Fe、正极—C、电解液H2CO3 弱酸性)负极: Fe–2e-==Fe2+(氧化反应)正极:2H++2e-==H2↑(还原反应)离子方程式 Fe+2H+==H2↑+Fe2+ (析氢腐蚀)3、铁碳电池:(负极—Fe、正极—C、电解液中性或碱性)负极: 2Fe–4e-==2Fe2+(氧化反应)正极:O2+2H2O+4e-==4 (还原反应)化学方程式2Fe+O2+2H2O==2Fe(OH)2 (吸氧腐蚀)4Fe(OH)2+O2+2H2O==4Fe(OH)3 2Fe(OH)3==Fe2O3 +3 H2O(铁锈的生成过程) 4.铝镍电池:(负极—Al、正极—Ni电解液 NaCl溶液、O2)负极: 4Al–12e-==4Al3+ (氧化反应)正极:3O2+6H2O+12e-==12(还原反应)化学方程式4Al+3O2+6H2O==4Al(OH)3(海洋灯标电池)5、普通锌锰干电池:(负极—Zn、正极—C 、电解液NH4Cl、MnO2的糊状物) 本文来自化学自习室!负极:Zn–2e-==Zn2+ (氧化反应)正极:2MnO2+2H++2e-==Mn2O3+H2O(还原反应) 本文来自化学自习室!化学方程式Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3↑6、碱性锌锰干电池:(负极—Zn、正极—C、电解液KOH、MnO2的糊状物)负极:Zn + 2OH– 2e-== Zn(OH)2(氧化反应)正极:2MnO2 + 2H2O + 2e-==2MnOOH +2 OH-(还原反应)化学方程式Zn +2MnO2 +2H2O == Zn(OH)2+ MnOOH 本文来自化学自习室!7、银锌电池:(负极—Zn、正极--Ag2O、电解液NaOH )负极:Zn+2OH––2e-== Zn(OH)2 (氧化反应)正极:Ag2O + H2O + 2e-== 2Ag + 2 OH-(还原反应)化学方程式Zn + Ag2O + H2O == Zn(OH)2 + 2Ag8、铝–空气–海水(负极--铝、正极--石墨、铂网等能导电的惰性材料、电解液--海水)负极:4Al-12e-==4Al3+ (氧化反应)正极:3O2+6H2O+12e-==12OH-(还原反应)总反应式为: 4Al+3O2+6H2O===4Al(OH)3(铂网增大与氧气的接触面)本文来自化学自习室!9、镁---铝电池(负极--Al、正极--Mg电解液KOH)本文来自化学自习室!负极(Al): 2Al + 8 OH–- 6e- = 2AlO2–+4H2O(氧化反应)正极(Mg): 6H2O + 6e- = 3H2↑+6OH–(还原反应)化学方程式: 2Al + 2OH–+ 2H2O = 2AlO2–+ 3H210、锂电池一型:(负极--金属锂、正极--石墨、电解液LiAlCl4 -SOCl2)负极:8Li -8e-=8 Li +(氧化反应)正极:3SOCl2+8e-=SO32-+2S+6Cl-(还原反应)化学方程式8Li+ 3SOCl2 === Li2SO3 + 6LiCl + 2S,二次电池(又叫蓄电池或充电电池)1、铅蓄电池:(负极—Pb正极—PbO2电解液—浓硫酸)放电时负极: Pb-2e-+SO42-=PbSO4(氧化反应)正极: PbO2+2e-+4H++SO42-=PbSO4+2H2O(还原反应)充电时阴极: PbSO4 + 2H+ +2e-== Pb+H2SO4(还原反应)阳极: PbSO4 + 2H2O -2e-== PbO2 + H2SO4 + 2H+(氧化反应)总化学方程式Pb+PbO2 + 2H2SO42PbSO4+2H2O2、铁--镍电池:(负极-- Fe 、正极—NiO 2、电解质溶液为KOH溶液)放电时负极: Fe-2e—+ 2 OH– == Fe (OH)2(氧化反应)正极:NiO2 + 2H2O + 2e—== Ni(OH)2 + 2 OH–(还原反应) 本文来自化学自习室!充电时阴极: Fe (OH)2+ 2e—== Fe+ 2 OH–(还原反应)阳极: Ni(OH)2-2e—+ 2 OH–== NiO 2 + 2H2O(氧化反应) 本文来自化学自习室!总化学方程式Fe + NiO 2+ 2H2O Fe (OH)2 + Ni(OH)23、LiFePO4电池(正极—LiFePO4,负极—石墨,含Li+导电固体为电解质)本文来自化学自习室!放电时负极:Li - e— ==Li +(氧化反应) 本文来自化学自习室!正极:FePO4+ Li+ + e—== LiFePO4(还原反应)充电时:阴极:Li+ + e—== Li(还原反应) 本文来自化学自习室!阳极:LiFePO4-e—== FePO4 + Li+(氧化反应)总化学方程式FePO4 + Li LiFePO44、镍--镉电池(负极--Cd、正极—NiOOH、电解质溶液为KOH溶液)放电时负极: Cd-2e—+ 2 OH– == Cd(OH)2(氧化反正极: 2NiOOH + 2e—+ 2H2O == 2Ni(OH)2+ 2OH–(还原反应) 本文来自化学自习室!充电时阴极: Cd(OH)2+ 2e—==Cd + 2 OH–(还原反应) 本文来自化学自习室!阳极:2 Ni(OH)2-2e—+ 2 OH–== 2NiOOH + 2H2O(氧化反应)总化学方程式Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2本文来自化学自习室!5、氢--镍电池:(负极-LaNi5储氢合金、正极—NiOOH、电解质KOH+LiOH)放电时负极: LaNi5H 6-6e—+ 6OH–== LaNi5 + 6H2O(氧化反应)正极: 6NiOOH +6e—+ 6H2O ==6 Ni(OH)2 + 6OH–(还原反应)充电时阴极:LaNi5+6e—+ 6H2O== LaNi5H 6+ 6OH–(还原反应)阳极: 6 Ni(OH)2 -6e—+ 6OH–== 6NiOOH + 6H2O(氧化反应)总化学方程式LaNi5H 6 + 6NiOOH LaNi5 + 6Ni(OH)26、高铁电池:(负极—Zn、正极---石墨、电解质为浸湿固态碱性物质)放电时负极:3Zn -6e- + 6 OH–== 3 Zn(OH)2(氧化反应)正极:2FeO42—+6e-+ 8H2O ==2Fe (OH)3 + 10OH–(还原反应)充电时阴极:3Zn(OH)2 +6e-==3Zn + 6 OH–(还原反应)阳极:2Fe(OH)3-6e-+ 10OH–==2FeO42—+ 8H2O (氧化反应)总化学方程式3Zn + 2K2FeO4 + 8H2O3Zn(OH)2 + 2Fe(OH)3 + 4KOH7、锂电池二型(负极LiC6、正极含锂的二氧化钴LiCoO2、充电时LiCoO2中Li被氧化,本文来自化学自习室!Li+还原以Li原子形式嵌入电池负极材料碳C6中,以LiC6表示)放电时负极:LiC6– xe- =Li(1-x)C6+x Li+(氧化反应)正极: Li(1-x)CoO2 +xe-+x Li+ == LiCoO2(还原反应)充电时阴极: Li(1-x)C6 +x Li+ +xe- =LiC6(还原反应)阳极: LiCoO2 – xe-= Li(1-x)CoO2+ x Li+(氧化反应) 本文来自化学自习室!总反应方程式Li(1-x)CoO2 + LiC6 LiCoO2+ Li(1-x)C6燃料电池根据题意叙述书写常见于燃料电池,由于燃料电池的优点较多,成为了近年高考的方向。
高中常见的电池的电极反应式的书写

电池电极反应式的书写书写过程归纳:列物质,标得失(列出电极上的物质变化,根据价态变化标明电子得失)。
选离子,配电荷(根据介质选择合适的离子,配平电荷,使符合电荷守)。
巧用水,配个数(通常介质为水溶液,可选用水配平质量守恒)一次电池1、铁碳电池:(负极—Fe、正极—C、电解液H2CO3 弱酸性)负极: Fe–2e-==Fe2+ (氧化反应) 正极: (还原反应)离子方程式 Fe+2H+==H2↑+Fe2+(析氢腐蚀)2、铁碳电池:(负极—Fe、正极—C、电解液中性或碱性)负极: 2Fe–4e-==2Fe2+ (氧化反应) 正极: (还原反应)化学方程式 2Fe+O2+2H2O==2Fe(OH)2(吸氧腐蚀) 4Fe(OH)2+O2+2H2O==4Fe(OH)3 2Fe(OH)3==Fe2O3 +3 H2O (铁锈的生成过程)3、碱性锌锰干电池:(负极—Zn、正极—C、电解液KOH 、MnO2的糊状物)负极: (氧化反应)正极:(还原反应)化学方程式 Zn +2MnO2 +2H2O == Zn(OH)2 + 2MnOOH酸性锌锰干电池:(负极—Zn、正极—C、电解液NH4Cl 、MnO2的糊状物)负极: (氧化反应)正极:(还原反应)化学方程式 Zn +2MnO2 +2NH4+== Zn2++ Mn2O3+2NH3+H2O4、银锌纽扣电池:(负极—Zn、正极--Ag2O、电解液NaOH )负极: (氧化反应)正极: (还原反应)化学方程式 Zn + Ag2O + H2O == Zn(OH)2 + 2Ag5、Mg–AgCl–海水电池 Mg–H2O2酸性–海水电池负极: (氧化反应) 负极: (氧化反应)正极:(还原反应) 正极:(还原反应)总反应式为: Mg+2AgCl==MgCl2+2Ag 总反应式为:6、镁---铝电池(负极--Al、正极--Mg 电解液KOH)负极(Al): (氧化反应)正极(Mg):(还原反应)化学方程式: 2Al + 2OH– + 2H2O = 2AlO2–+ 3H27、锂电池一型:(负极--金属锂、正极--石墨、电解液LiAlCl4 -SOCl2)负极:8Li -8e-=8 Li + (氧化反应)正极:(还原反应)化学方程式 8Li+ 3SOCl2 === Li2SO3 + 6LiCl + 2S二次电池(又叫蓄电池或充电电池)1、铅蓄电池:(负极—Pb 正极—PbO2 电解液—浓硫酸)放电时负极: Pb-2e-+SO42-=PbSO4(氧化反应)正极: (还原反应)充电时阴极:(还原反应)阳极: (氧化反应) 总化学方程式 Pb+PbO2 + 2H2SO4放电2PbSO4+2H2O2、铁--镍电池:(负极-- Fe 、正极—NiO 2、电解质溶液为KOH溶液)放电时负极: Fe-2e—+ 2 OH– == Fe (OH)2 (氧化反应)正极: (还原反应) 充电时阴极: (还原反应) 阳极: (氧化反应)总化学方程式 Fe + NiO 2+ 2H2O 放电Fe (OH)2 + Ni(OH)23、锂离子电池(正极—LiFePO4,负极—石墨烯,含Li+导电固体为电解质)放电时负极: (氧化反应) 正极: (还原反应) 充电时:阴极: (还原反应) 阳极: (氧化反应)总化学方程式 Li(1-x)FePO4 + Li x C6放电 LiFePO4 + 6C4、钠—二氧化碳电池(负极—钠、正极—碳纳米管、电解质为非水溶液)放电时负极:(氧化反应)正极: (还原反应)充电时阴极:(还原反应)阳极: (氧化反应) 总化学方程式 4Na+3CO2放电2Na2CO3+ C5、氢--镍(NiMH)电池:总化学方程式 MH+ NiOOH 放电M+ Ni(OH)2(M表示储氢金属或合金,金属化合价均为0)放电时负极: (氧化反应)正极:(还原反应)充电时阴极: (还原反应)阳极: (氧化反应)6、高铁电池:(负极—Zn、正极---石墨、电解质为浸湿固态碱性物质)放电时负极:(氧化反应)正极:(还原反应)充电时阴极:3Zn(OH)2 +6e-==3Zn + 6 OH– (还原反应)阳极: (氧化反应)总化学方程式 3Zn + 2K2FeO4 + 8H2O 放电3Zn(OH)2 + 2Fe(OH)3 + 4KOH7、锂离子电池(负极石墨烯、正极含锂的二氧化钴LiCoO2、)总反应方程式 Li(1-x)CoO2 + Li x C 放电LiCoO2 + C放电时负极: (氧化反应)(C的化合价不变的)正极: (还原反应)充电时阴极: (还原反应)阳极: (氧化反应)燃料电池根据题意叙述书写常见于燃料电池,不一定两极是两根活动性不同的电极,也可以用相同的两根电极。
高中常见的原电池电极反应式的书写

高中常见的原电池电极反应式的书写原电池电极反应式的书写一次电池1、条叶踢电池:(负极―zn、负极―cu、电解液―h2so4)总离子方程式:负极:正极:2、铁碳电池:(负极―fe、正极―c、电解液稀硫酸)总离子方程式:负极:负极:3、铁碳电池:(负极―fe、正极―c、电解液弱酸性或中性或碱性)负极:正极:总化学方程式:4.铝镍电池(海洋灯标电池):(负极―al、负极―ni电解液nacl溶液、o2)负极:负极:总化学方程式:5、普通锌锰干电池:(负极―zn、正极―c、电解液nh4cl、mno2的糊状物)总化学方程式:zn+2nh4cl+2mno2=zncl2+mn2o3+2nh3↑+h2o负极:正极:6、碱性锌锰干电池:(负极―zn、负极―c、电解液koh、mno2的糊状物)总化学方程式:zn+2mno2+2h2o==zn(oh)2+2mnooh负极:负极:7、银锌电池:(负极―zn、负极--ag2o、电解液naoh)总化学方程式:zn+ag2o+h2o==zn(oh)2+2ag负极:负极:8、铝c空气ckoh(负极--铝、正极--石墨、铂网等能导电的惰性材料、电解液-koh 溶液)负极:负极:总化学方程式:9、镁---铝电池(负极--al、正极--mg电解液koh)负极:正极:总化学方程式:10、锂电池一型:(负极--金属锂、负极--石墨、电解液lialcl4-socl2)总化学方程式:8li+3socl2===li2so3+6licl+2s负极:负极:二次电池(又叫做蓄电池或充电电池)1、铅蓄电池:(负极―pb正极―pbo2电解液―浓硫酸)第1页共4页总化学方程式pb+pbo2+2h2so4振动电池2pbso4+2h2o放电时负极:正极:2、铁--镍电池:(负极--fe、负极―nio2、电解质溶液为koh溶液)总化学方程式:fe+nio2+2h2o放电时负极:正极:振动电池振动电池fe(oh)2+ni(oh)23、lifepo4电池(正极―lifepo4,负极―石墨,含li+导电固体为电解质)总化学方程式:fepo4+lilifepo4放电时负极:正极:4、镍--镉电池(负极--cd、负极―niooh、电解质溶液为koh溶液)总化学方程式cd+2niooh+2h2o放电充电cd(oh)2+2ni(oh)2振动时负极:负极:5、氢--镍电池:(负极-lani5储氢合金、正极―niooh、电解质koh+lioh)总化学方程式:lani5h6+6niooh振动电池lani5+6ni(oh)2放电时负极:正极:6、高铁电池:(负极―zn、负极---石墨、电解质为淋湿固态碱性物质)总化学方程式:3zn+2k2feo4+8h2o放电充电3zn(oh)2+2fe(oh)3+4koh振动时负极:负极:7、锂电池二型(负极lic6、正极含锂的二氧化钴licoo2、充电时licoo2中li被氧化,li+还原以li原子形式嵌入电池负极材料碳c6中,以lic6表示)总反应方程式li(1-x)coo2+lic6振动电池licoo2+li(1-x)c6放电时负极:正极:8、全钒氧化还原液流电池总反应方程式燃料电池根据题意描述书写常见于燃料电池,由于燃料电池的优点较多,沦为了近年中考的方向。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见的原电池电极反应式的书写一次电池:1.锌铜原电池:(负极—Zn、正极—Cu、电解液—H2SO4)负极:Zn–2e-=Zn2+ (氧化反应)正极:2H++2e-=H2↑ (还原反应)离子方程式: Zn + 2H+ = H2↑+ Zn2+2.铁碳电池:(负极—Fe、正极—C、较强酸性电解液)负极:Fe–2e-=Fe2+ (氧化反应)正极:2H+ + 2e-=H2↑ (还原反应)离子方程式: Fe+2H+=H2↑+Fe2+ (析氢腐蚀)3.铁碳电池:(负极—Fe、正极—C、电解液中性或碱性)负极:2Fe–4e-=2Fe2+ (氧化反应)正极:O2+2H2O+4e-=4OH (还原反应)化学方程式: 2Fe+O2+2H2O=2Fe(OH)2 (吸氧腐蚀)4.铝镍电池:(负极—Al、正极—Ni 电解液 NaCl溶液、O2)负极:4Al–12e-=4Al3+ (氧化反应)正极:3O2+6H2O+12e-=12OH-(还原反应)化学方程式: 4Al+3O2+6H2O=4Al(OH)3 (海洋灯标电池)5.普通锌锰干电池:(负极—Zn、正极—C 、电解液NH4Cl、MnO2的糊状物)负极:Zn–2e-=Zn2+ (氧化反应)正极:2MnO2+2NH4++2e-=Mn2O3+H2O+2NH3↑(还原反应)化学方程式: Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3↑6.碱性锌锰干电池:(负极—Zn、正极—C、电解液KOH 、MnO2的糊状物)负极:Zn + 2OH-– 2e-= Zn(OH)2(氧化反应)正极:2MnO2 + 2H2O + 2e-=2MnO(OH) +2 OH-(还原反应)化学方程式: Zn +2MnO2 +2H2O = Zn(OH)2 + 2MnOOH7.银锌电池:(负极—Zn、正极-Ag2O、电解液NaOH )负极:Zn+2OH––2e-= Zn(OH)2 (氧化反应)正极:Ag2O + H2O + 2e-= 2Ag + 2 OH- (还原反应)化学方程式: Zn + Ag2O + H2O = Zn(OH)2 + 2Ag8.铝空气海水电池:(负极-铝、正极-石墨、铂网等能导电的惰性材料、电解液-海水)负极:4Al-12e-=4Al3+ (氧化反应)正极:3O2+6H2O+12e-=12OH-(还原反应)总反应式为: 4Al+3O2+6H2O=4Al(OH)3(铂网增大与氧气的接触面)9.镁铝电池:(负极-Al、正极-Mg 电解液KOH)负极(Al):2Al + 8 OH -- 6e - = 2AlO 2–+4H 2O (氧化反应)正极(Mg ):6H 2O + 6e - = 3H 2↑+6OH –(还原反应)化学方程式: 2Al + 2OH – + 2H 2O = 2AlO 2–+ 3H 2↑二次电池(又叫蓄电池或充电电池)1.铅蓄电池:(负极—Pb 正极—PbO 2 电解液— 浓硫酸)放电时 负极: Pb -2e -+SO 42-=PbSO 4 (氧化反应)正极: PbO 2+2e -+4H ++SO 42-=PbSO 4+2H 2O (还原反应)充电时 阴极: PbSO 4 + 2e -= Pb+ SO 42-(还原反应)阳极: PbSO 4 + 2H 2O - 2e -= PbO 2 + SO 42-+ 4H + (氧化反应)总化学方程式: Pb +PbO 2 + 2H 2SO 4 2PbSO 4+2H 2O2.铁-镍电池:(负极-Fe 、正极—NiO 2、电解质溶液为KOH 溶液)放电时 负极: Fe -2e —+ 2OH – = Fe (OH)2 (氧化反应)正极: NiO 2 + 2H 2O + 2e —= Ni(OH)2 + 2 OH – (还原反应)充电时 阴极: Fe (OH)2 + 2e —= Fe + 2 OH –(还原反应)阳极: Ni(OH)2 -2e —+ 2 OH –= NiO 2 + 2H 2O (氧化反应)总化学方程式: Fe + NiO 2+ 2H 2O Fe(OH)2 + Ni(OH)23.LiFePO 4电池(正极—LiFePO 4,负极—石墨,含Li +导电固体为电解质) 放电时 负极: Li - e — =Li + (氧化反应)正极: FePO 4 + Li + + e —= LiFePO 4 (还原反应)充电时: 阴极: Li + + e —= Li (还原反应)阳极: LiFePO 4-e —= FePO 4 + Li +(氧化反应)总化学方程式: FePO 4 + Li LiFePO 44.镍--镉电池(负极--Cd 、正极—NiOOH 、电解质溶液为KOH 溶液) 放电时 负极: Cd -2e —+ 2OH –= Cd(OH)2 (氧化反应)正极: 2NiOOH + 2e — + 2H 2O = 2Ni(OH)2+ 2OH–(还原反应)充电时 阴极: Cd(OH)2 + 2e —= Cd + 2OH –(还原反应)阳极:2 Ni(OH)2 -2e —+ 2OH –= 2NiOOH + 2H 2O (氧化反应)总化学方程式: Cd + 2NiOOH + 2H 2O 充电放电Cd(OH)2 + 2Ni(OH)25.氢--镍电池:(负极-LaNi 5储氢合金、正极—NiOOH 、电解质KOH+LiOH )放电时 负极: LaNi 5H 6-6e —+ 6OH –= LaNi 5 + 6H 2O (氧化反应)正极: 6NiOOH +6e —+ 6H 2O =6 Ni(OH)2 + 6OH – (还原反应) 充电时 阴极: LaNi 5 +6e —+ 6H 2O = LaNi 5H 6+ 6OH – (还原反应)阳极: 6 Ni(OH)2 -6e —+ 6OH –= 6NiOOH + 6H 2O (氧化反应)总化学方程式: LaNi 5H 6 + 6NiOOH 放电LaNi 5 + 6Ni(OH)26.高铁电池:(负极—Zn 、正极-石墨、电解质为浸湿固态碱性物质)Ni(OH)2+Cd(OH)2放电时 负极:3Zn -6e - + 6 OH –= 3 Zn(OH)2 (氧化反应)正极:2FeO 42— +6e -+ 8H 2O =2 Fe (OH)3 + 10OH– (还原反应) 充电时 阴极:3Zn(OH)2 +6e -=3Zn + 6 OH –(还原反应) 阳极:2Fe(OH)3 -6e -+ 10OH –=2FeO 42—+ 8H 2O (氧化反应)总化学方程式: 3Zn + 2K 2FeO 4 + 8H 2放电3Zn(OH)2 + 2Fe(OH)3 + 4KOH7.锂电池二型(负极LiC 6、正极含锂的二氧化钴LiCoO 2、充电时LiCoO 2中Li 被氧化,Li +还原以Li 原子形式嵌入电池负极材料碳C 6中,以LiC 6表示)放电时 负极: LiC 6 – xe - = Li (1-x)C 6 + x Li +(氧化反应)正极: Li (1-x)CoO 2 + xe -+ x Li + = LiCoO 2 (还原反应)充电时 阴极: Li (1-x)C 6 + x Li + + xe -=LiC 6 (还原反应) 阳极: LiCoO 2 – xe -= Li (1-x)CoO 2 + x Li +(氧化反应)总反应方程式 Li (1-x)CoO 2 + LiC 6 充电放电LiCoO 2 + Li (1-x)C 6燃料电池一、氢氧燃料电池1.电解质是KOH 溶液(碱性电解质)负极:H 2 – 2e - + 2OH —= 2H 2O (氧化反应)正极:O 2 + 2H 2O + 4e - = 4OH —(还原反应)总反应方程式 2H 2 + O 2 = 2H 2O2.电解质是H 2SO 4溶液(酸性电解质) 负极:H 2 –2e - = 2H +(氧化反应)正极:O 2 + 4H + + 4e -= 2H 2O (还原反应)总反应方程式 2H 2 + O 2 = 2H 2O3.电解质是NaCl 溶液(中性电解质) 负极:H 2 – 2e - = 2H +(氧化反应)正极:O 2 + 2H 2O + 4e - = 4OH —总反应方程式 2H 2 + O 2 = 2H 2O二、甲醇燃料电池1.碱性电解质(铂为两极、电解液KOH 溶液)正极:3O 2 + 12e - + 6H 20= 12OH -(还原反应)负极:2CH 3OH – 12e - + 16OH —= 2CO 32-+12H 2O (氧化反应)总反应方程式 2CH 3OH + 3O 2 + 4KOH = 2K 2CO 3 + 6H 2O2. 酸性电解质(铂为两极、电解液H 2SO 4溶液)正极:3O 2 + 12e -- + 12H += 6H 2O (还原反应)负极:2CH 3OH –12e - +2H 2O =12H ++2CO 2 (氧化反应)总反应式 2CH 3OH + 3O 2 = 2CO 2 + 4H 2O三、CO 燃料电池 (总反应方程式均为: 2CO + O 2 = 2CO 2)1.熔融盐(铂为两极、Li2CO3和Na2CO3的熔融盐作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气)正极: O2 + 4e-+ 2CO2 = 2CO32- (还原反应)负极: 2CO+2CO32-– 4e-=4CO2 (氧化反应)2.酸性电解质(铂为两极、电解液H2SO4溶液)正极: O2 + 4e-+ 4H+ = 2H2O (还原反应)负极: 2CO – 4e- + 2H2O = 2CO2 +4H+ (氧化反应)四、肼燃料电池(铂为两极、电解液KOH溶液)正极: O2 + 2H2O + 4e-= 4OH— (还原反应)负极: N2H4 + 4OH—- 4e-= N2 + 4H2O (氧化反应)总反应方程式 N2H4 + O2= N2 + 2H2O五、甲烷燃料电池1.碱性电解质(铂为两极、电解液KOH溶液)正极: 2O2 + 2H2O + 8e-= 8 OH— (还原反应)负极: CH4 + 10OH—- 8e-= CO32- + 7H2O (氧化反应)总反应方程式 CH4 + 2KOH + 2O2= K2CO3 + 3H2O2、酸性电解质(铂为两极、电解液H2SO4溶液)正极: 2O2 + 8e-+ 8H+ = 4H2O (还原反应)负极: CH4- 8e- + 2H2O = 8H+ + CO2 (氧化反应)总反应方程式 CH4 + 2O2= CO2 + 2H2O六、丙烷燃料电池(铂为两极、正极通入O2和CO2、负极通入丙烷、电解液有三种)1.电解质是熔融碳酸盐(K2CO3或Na2CO3)正极: 5O2 + 20e-+ 10CO2 = 10CO32- (还原反应)负极: C3H8 - 20e-+ 10CO32-= 3CO2 + 4H2O(氧化反应)总反应方程式 C3H8 + 5O2 = 3CO2 + 4H2O2.酸性电解质(电解液H2SO4溶液)正极: 5O2 + 20e-+ 26H+ = 10H2O (还原反应)负极: C3H8 - 20e- + 6H2O = 3CO2 + 20 H+ (氧化反应)总反应方程式 C3H8 + 5O2 = 3CO2 + 4H2O3.碱性电解质(铂为两极、电解液KOH溶液)正极: 5O2 + 20e-+ 10H2O = 20OH— (还原反应)负极: C3H8 -20e-+ 26 OH—= 3CO32-+ 17H2O(氧化反应)总反应方程式 C3H8 + 5O2 +6KOH = 3K2CO3 + 7H2O七、乙烷燃料电池(铂为两极、电解液KOH溶液)正极: 7O2 + 28e-+ 14H2O = 28OH— (还原反应)负极: 2C2H6 -28e-+ 36 OH—= 4CO32-+ 24H2O(氧化反应)总反应方程式 2C2H6 + 7O2 +8KOH =4K2CO3 + 10H2O。
