头孢克肟杂质经验总结分享
头孢克肟颗粒杂质检测的均匀设计及优化

头孢克肟颗粒杂质检测的均匀设计及优化吴建伟$!!余俊先">"$:浙江莎普爱思药业股份有限公司研发部!浙江平湖!=$E"##$":首都医科大学附属北京友谊医院药学部!北京!$###<##中图分类号!?@"C 文献标志码!A 文章编号!$BC"D"$"E ""#"##$#D $"$B D #<G H I !$#J $E##@K L :+00-:$BC"4"$"EJ "#"#J $#J #$C摘!要!目的+采用均匀设计和]T S 软件快速优化头孢克肟颗粒有关物质检测的方法!使系统适应溶液中已知杂质分离度达到基线分离%方法+采用均匀设计和]T S 软件!根据模型提出检测方法的设计空间!以保留时间之差&!?’作为考察指标%结果+通过均匀设计和]T S 软件处理!得到流动相可行的设计空间为7\l BJ <m #J "<!乙腈"=hm "h !"<h 四丁基氢氧化铵$#i $=O (!分离度较好%结论+采用均匀设计和]T S 模型处理可以快速优化头孢克肟颗粒有关物质检测的方法!优化后的方法快捷有效%关键词!头孢克肟*均匀设计*]T S 软件*设计空间U *.6)%>I $’./*-*0H #&.>.Q -&.)*6)%O >#+%.&3I $&$:&.)*)6($6.".>$?%-*+2$bX ]+’-‘5+$&c X ])-d +’-"#$:G 57*:,1?505’2Q 6’-.G 5&5(,7O 5-*&^65L +’-3V6’7)’+0+S 6’2O ’Q 5)*+Q ’(8,:&Z *.&^65L +’-3S +-36)=$E"##&86+-’%":G 57*:,1S 6’2O ’Q /&U 5+L +-3a 2+5-.06+7\,07+*’(A 11+(+’*5.*,8’7+*’(T 5.+Q ’(X -+&520+*/&U 5+L +-3$###<#&86+-’$1A E 7F 1(7!H U ]%8W I 9%"X -+1,2O.50+3-’-.]T S0,1*‘’25‘525’.,7*5.*,f)+Q e(/,7*+O +k 5*65.5*5Q *+,-O 5*6,.,125(’*5.0)[0*’-Q 50+-Q 51+d +O 57’2*+Q (50&0,*6’**650/0*5OQ ’-’.’7**,*65250,()*+,-,1e-,‘-+O 7)2+*+50*,’Q 6+5&5[’05(+-5057’2’*+,-:T %W \H G V "X -+1,2O.50+3-’-.]T S0,1*‘’25‘525’.,7*5.&.50+3-07’Q 5,1.5*5Q *+,-O 5*6,.[’05.,-*65O ,.5(‘’072,7,05.&’-.)05*65.+11525-Q 5+-25*5-*+,-*+O 5#!?$’0*65+-075Q *+,-+-.+Q ’*,2:%VX Z W V "W 62,)36)-+1,2O.50+3-’-.]T S0,1*‘’2572,Q 500+-3&*6515’0+[(5.50+3-07’Q 51,2O ,[+(576’05‘’07\l BJ <m#J "<&’Q 5*,-+*2+(5"=h m"h &"<h *5*2’[)*/(’O O ,-+)O 6/.2,d +.5$#4$=O (&‘+*63,,.250,()*+,-:8H ;8Z X VI H ;V "X 0+-3)-+1,2O.50+3-’-.]T SO ,.5(72,Q 500+-3Q ’-f)+Q e(/,7*+O +k 5*65.5*5Q *+,-O 5*6,.,125(’*5.0)[0*’-Q 50,1Q 51+d +O 57’2*+Q (50&*65,7*+O +k 5.O 5*6,.+0f)+Q e ’-.5115Q *+&54!G <H F I E !851+d +O 5%X -+1,2O.50+3-%]T S0,1*‘’25%G 50+3-07’Q 5!工程师’研究方向"新药研发’%4O ’+("k L 0/$E=BP$B=:Q ,O >通信作者"主任药师&博士’研究方向"药物制剂和临床药学’%4O ’+("L )-d +’-/)PQ Q O ):5.):Q -!!头孢克肟为第=代口服头孢菌素&临床上用于敏感菌引起的呼吸道感染*胆道感染及尿道感染等-$.’+中华人民共和国药典"二部,#"#$<年版$-".首次收载了头孢克肟及其制剂&美国药典#E#版$-=.*欧洲药典#FJ #版$-E .均有收载&欧洲药典提供了有关杂质名称#A*U *8*G *%和a $及其结构式&但未提供分离各已知杂质的色谱参数’本课题组前期研究建立了有关杂质的检测方法&但是在检测影响因素#B#u 放置=#.&E#u 放置=#.$样品时&出现了未知杂质&其中一个未知杂质与杂质U 分离度无法基线分离&另外系统适应性溶液中已知杂质分离度不能完全达到基线分离&仍有优化空间’本研究采用均匀设计优化了方法&并通过]T S 软件-<4F .&建立模型&根据模型提出可行的设计空间’JK 材料与方法JN JK 药品与试剂待测样品"头孢克肟待测样品#纯度@FJCh &批号为_$F#"#$a &莎普爱思药业股份有限公司$’标准品"头孢克肟对照品#纯度F@J#h &批号为Y bY $C#"#C@&自标$&杂质A 对照品#纯度@FJ#h &批号为S I U Y b4A &S 6’2O ’Q 5)*+Q ’(865O +0*2/Z ’[,2’*,2/8,:&Z *.&X VA $&杂质U 对照品#纯度@"J $h &批号为"C<C4#"$A $$&W Z 8S 6’2O ’Q 5)*+Q ’(V*’-.’2.0Z *.&8A ;$&杂质8对照品#纯度@FJ#h &批号为S A 84#EC4$#&A ,k 5’(852*+1+5.V*’-.’2.0&I -Q &X VA $&杂质G 对照品#纯度@Fh &批号为S I W U Y b4G &S 6’2O ’Q 5)*+Q ’(Q 65O +0*2/Z ’[,2’*,2/8,:&Z *.&X VA $&杂质%对照品#纯度@@J $h &批号为$C$""$4"&S 6’2O ’Q 5)*+Q ’(865O +0*2/Z ’[,2’*,2/8,:&Z *.&X VA $&杂质a 对照品#纯度@FJ<h &批号为A 4#"&S 6’2O ’Q 5)*+Q ’(Q 65O +0*2/Z ’[,2’*,2/8,:&Z *.&X VA $’乙腈#色谱纯&批号为$F#$<#@C &W5.+’8,:&I-Q&X VA$%磷酸二氢钾#分析纯&批号为"#$C#"$#&北京化工厂$%氢氧化钠#分析纯&批号为"#$C#<$F&北京化工厂$%"<h四丁基氢氧化铵#W U A&分析纯&批号为"#$F#$$=&天津光复精细化工研究所$’JN CK仪器Z84"#A G4S G A型高效液相色谱仪#日本岛津公司$% S G A"#A型高效液相色谱仪#日本岛津公司$&紫外检测器&光电二极管检测器%A U$=<4V型十万分之一电子天平#T%W W Z%? W H Z%G H公司$%U VA$"EV48b型千分之一电子天平#赛多利斯科学仪器有限公司$%a_4=$"4##$K a_4=$"4##"型7\计#雷磁科学仪器有限公司$’CK方法CN JK色谱条件及溶液配制"J$J$!色谱条件"V+(M255-色谱柱#"<#O O v EJ B O O&<&O$&柱温E#u&流速$J#O(K O+-&进样体积$#&(&紫外检测波长"<E-O’"J$J"!溶液配制"#$$磷酸盐缓冲液#7\l CJ#$&取磷酸二氢钾#J BF3&加#J$O,(K Z氢氧化钠溶液"@J$O(&用水稀释至$##O(&即得’#"$杂质定位母液&取杂质A1a各适量&精密称定&分别用溶剂溶解并稀释制成每$O(约含杂质A*U*8* G*%及a各$##&3’#=$杂质定位溶液&精密量取杂质定位母液各$O(&分别置于$#O(容量瓶中&用溶剂稀释至刻度&摇匀’#E$空白辅料溶液&精密称取空白辅料约@<#O3&置于<#O(容量瓶中&加溶剂溶解并稀释至刻度&摇匀&过滤&即得’#<$系统适用性溶液&精密称取对照品约$#O3&精密量取杂质A1a定位溶液各$O(&置于同一$#O(容量瓶中&加溶剂溶解并稀释至刻度&摇匀&即得’#B$供试品溶液&取E#*B#u的=#.样品适量&加溶剂溶解并稀释制成每$O(约含头孢克肟$O3的溶液&作为供试品溶液’取上述溶液各$#&(&分别注入液相色谱仪’"J$J=!均匀试验设计"+中华人民共和国药典,收载的头孢克肟有关物质方法色谱柱为8$F柱&流动相为W U A溶液#取$#h 的W U A溶液"<O(&加水$###O(&用磷酸调节7\为CJ#$4乙腈#7w7l C"w"F$’头孢克肟结构中有"个羧基&根据文献-@.& 7Y’$l"J$##针对羧基$*7Y’=l=J C=#针对羧基甲氧基亚氨基$&7\g其7Y’"个单位时&羧基均解离&在溶液中带负电荷&与W U A形成离子对&头孢克肟及其杂质可能由于羧基的7Y’不同&流动相的W U A浓度不同而提供不同的选择性&另外有机相比例也会对各物质保留及分离产生影响’故选择7\*W U A 及乙腈比例为考察因素&见表$’表JK因素及水平表7-;JKR-:&)%-*02$T$2&-;2$因素水平7\<J<<J F BJ$BJ E BJ C CJ#W U A K O(=<C@$$$=乙腈K h$<"#"<"F=#="!!设计的流动相条件见表"&考察可能对分离度影响较大的=个因素"7\*W U A及乙腈’表CK均匀试验设计7-;CKU*.6)%>$"#$%.>$*&-20$’./*试验编号7\W U A K O(乙腈K h$<J<<"<"<J F@="=BJ$$="#E BJ E==#<BJ C C$<B CJ#$$"FLK结果选择分离度为考察指标&但不同色谱条件下&峰顺序可能发生变化&分离度均为正数&在模型上无法反映出峰顺序颠倒’通常两色谱峰保留时间差g"O+-可以较好的分离&暂选择不易分离的关键峰对&其保留时间之差#!?$作为考察指标’系统适用性中杂质峰的出峰时间*供试品中与杂质U相邻的未知杂质出峰时间及关键峰对的保留时间之差见表=’表LK保留时间或保留时间差">.*#7-;LKF$&$*&.)*&.>$)%%$&$*&.)*&.>$0.66$%$*:$">.*#编号未知杂质杂质A$杂质A"杂质U杂质8杂质G杂质%杂质a主峰!?#主峰4杂质G$!?#杂质U4未知杂质$!?#杂质a4杂质%$ $=CJ F@C ECJ$#E<#J=<=CJ##$<<J"""==J="@E<J@<=EEJ CEB==J BE D#J=$$D#J F@B D$J"#C "$=J$<E="J F$==CJ"C"$=J B$E<"J@FC$@J E=$$"J ECE$=J E"=$FJ@E"#J EF@#J EB#J@E@=@J@E"E"J"$<EBJ BC=$BJ E"@<$J EE=CJ BF"=J#EB"FJ<"$=EJ B@""J@FF BJ EFC<J EC<E$#J CCC"=J#"$"=J#"$$=J#$B"@J"E<$FJ=<$$J"#@$<J$#C$BJ F@$$J E<@"J"=@=J F@F<$"J@#==BJ@$$=@J EC"$=J<"@=<J#BC==J B$C$EJ$"$$"J#=<"EJ$<C@J EB#J B"B D"J#FBB$EJ$F"FJ$FF"FJ$FF$EJ$C<="J F@F"<J@=<$"J@C@$<J E$"$@J E@C BJ E=F D#J##<"J E==!!注"杂质A$*杂质A"为杂质A的异构体;,*5"+O7)2+*/A$’-.+O7)2+*/A"’25*65+0,O520,1+O7)2+*/A!!主峰及杂质G*杂质U及未知杂质*杂质%及杂质a保留时间接近&不易分析&将这=对作为关键峰对&其保留时间之差分别表示为!#主峰4杂质G$*!?#杂质U4未知杂质$*!?#杂质a4杂质%$’采用]T S软件以标准最小二乘法回归分析’各回归模型见图$’可见&!?#主峰4杂质G$主要受7\影响&!?#杂质U4未知杂质$主要受W U A用量及乙腈交互作用影响&!?#杂质a4杂质%$影响因素为各因素主效应及W U A用量与乙腈的交互作用’各影响因素的影响曲面图见图"1E’7\为影响!?#主峰4杂质G$的显著因素&7\在<J<i C 时&7\越大&!?#主峰4杂质G$越大&见图"’7\与W U A交互作用为影响!?#杂质U4未知杂质$的显A:!?#主峰4杂质G$模型参数%U:!?#杂质U4未知杂质$模型参数%8:!?#杂质a4杂质%$模型参数A:!?#T’+-75’e4I O7)2+*/G$O,.5(7’2’O5*520% U:!?#I O7)2+*/U4X-e-,‘-I O7)2+*/$O,.5(7’2’O5*520% 8:!?#I O7)2+*/a4I O7)2+*/%$O,.5(7’2’O5*520%图JK模型回归参数R./JK9)0$2%$/%$’’.)*#-%->$&$%’图CK!F"主峰\杂质I#曲面图R./CKE+%6-:$/%-#8)6!F"9-.*#$-_\O>#+%.&3I#图LK!F"杂质A\未知杂质#曲面图R./LKE+%6-:$/%-#8)6!F"O>#+%.&3A\U*_*)5*O>#+%.&3#著因素&W U A用量低时&乙腈比例越高%W U A用量高时&乙腈比例越高&!?#杂质U4未知杂质$越大&见图=’7\*W U A*乙腈及W U A*乙腈的交互作用为影响!?#杂质a4杂质%$的显著因素&当固定7\l BJ<&W U A用量低时&乙腈比例越高%W U A用量高时&乙腈比例越高&!?#杂质a4杂质%$越大&见图E’当!?#主峰4杂质G$*!?#杂质U4未知杂质$* !?#杂质a4杂质%$均g"O+-时&等高线图见图<1C’W U A为$=O(时&在白色区域中-模型预测!?#主峰4杂质G$*!?#杂质U4未知杂质$*!?#杂质a4杂质%$均g"O+-.可选择7\l BJ<*乙腈"=h为中点&设计空间为7\l BJ<m#J"<%乙腈为"=hm"h&见图<’W U A为$#O(时&在白色区域中-模型预测!?#主峰4杂质G$*!?#杂质U4未知杂质$*!?#杂质a4杂质%$均g"O+-.可选择7\l BJ<*乙腈"=h为中点&设计空间为7\l BJ<m#J"<%乙腈为"=hm"h&见图B’W U A为F O(时&模型预测!?#主峰4杂质G$*!?#杂质U4图MK !F "杂质R \杂质!#曲面图R ./MKE +%6-:$/%-#8)6!F "O >#+%.&3R \O >#+%.&3!#图SK7A 1JL >2等高线图R ./SK()*&)+%>-#)67A 1JL >2未知杂质$*!?#杂质a 4杂质%$均g "O +-的区域已不存在’综上&流动相可行的设计空间之一为7\l BJ <m #J "<&乙腈为图XK7A 1JD >2等高线图R ./XK()*&)+%>-#)67A 1JD >2图aK7A 1‘>2等高线图R ./aK()*&)+%>-#)67A 1‘>2"=hm "h &W U A 为$#i $=O (&见图C ’采用7\l BJ <&乙腈"=h &W U A $=O (&分离度较好&见图F 1@’图‘K 优化后系统适用性图R ./‘KE 3’&$>’+.&-;.2.&30.-/%->-6&$%)#&.>.Q -&.)*上曲线为B#u*=#.样品%下曲线为E#u*=#.样品)7752Q)2&5+-.+Q’*500’O7(5‘+*6B#u’-.=#.%(,‘52Q)2&5+-.+Q’*500’O7(5‘+*6E#u’-.=#.图cK影响因素样品色谱图R./cKE->#2$:8%)>-&)/%->)6.*62+$*:.*/6-:&)%’MK讨论在新药研究领域&工艺优化*处方筛选的过程中需要对多影响因素及水平进行比较&考察其对结果的影响并优化’目前的相关研究多采用正交设计*均匀设计和效应面法对条件进行优化’正交设计是利用一套系统的正交表将多因素和多水平进行组合均匀搭配&合理安排&从而减少实验次数&同时提供较多的信息-$#.’均匀设计&又称均匀设计试验法&或空间填充设计&是基于数论方法推导出来的一种实验设计方法-$$4$<.’效应面法是利用实验设计并通过实验得到一定数据&采用多元二次方程来拟合因素和效应值之间的函数关系&通过对回归方程的分析来寻求最优工艺参数&解决多变量问题的一种统计方法-$B4$C.’从整体评价来看&效应面法要优于均匀设计法和正交设计法&均匀设计法优于正交设计法&效应面法在多因素*多水平的试验方面比均匀设计法更全面&比正交试验法更简化’均匀设计与正交设计相比&更适用于多因素多水平的试验&进一步增强正交设计实验点在空间具有(均匀分散性)的优点&与效应面法相比对一般效应值出现在最佳实验条件区域附近的变化较为灵敏’根据均匀设计法在这一方面的突出特性&本研究将均匀设计应用到头孢克肟颗粒的杂质检测&得到了方法可行的设计空间’本研究结果表明&采用均匀设计和]T S模型处理可以快速优化头孢克肟颗粒有关物质检测的方法&且优化后的方法快捷有效’参考文献-$.邢美云&张丽娜:头孢克肟治疗小儿急性支气管炎的临床效果分析-].:中国医药科学&"#$<&<#$F$"EC4E@-".国家药典委员会:中华人民共和国药典"二部-V.:"#$<年版:北京"中国医药科技出版社&"#$<""<<4"<F:-=.W65X-+*5.V*’*50S6’2O’Q,7+5+’(8,-&5-*+,-:W65X-+*5.V*’*50 S6’2O’Q,75+’-V.:E#*6%.+*+,-:Q51+d+O5&"#$C"=B"<-E.%)2,75’-S6’2O’Q,7,5+’8,-&5-*+,-:%)2,75’-S6’2O’Q,7,5+’-V.:FJ#*6%.+*+,-:Q51+d+O5&"#$E"$C@@4$F##-<.苏颖&白杰&蔡正军&等:运用]T S软件的试验设计对甲钴胺片进行处方研究-].:中南药学&"#"#&$F#<$"CF$4CFE:-B.刘苗&刘道洲&成颖&等:纳米结构脂质载体防晒凝胶的处方及制备工艺-].:解放军药学学报&"#$F&=E#$$"$<4$F:-C.a)T&S52(O’-T&Z)N&5*’(:S6’2O’Q5)*+Q’(0,(+.40*’*5e+-5*+Q 0*’[+(+*/+-&50*+3’*+,-[/)0+-3O,+0*)254O,.+1+5.A2265-+)05f)’*+,-’-.]T S0*’*+0*+Q’(0,1*‘’25-].:]S6’2OU+,O5.A-’(&"#$<&$#C"=C#4=CC:-F.V’0I-0*+*)*5:]T S$#T,.5(+-3’-.T)(*+&’2+’*5T5*6,.0-T.:VA V I-0*+*)*5I-Q&"#$":-@.国家药品监督管理局药品审评中心:药品体外溶出试验信息库"头孢克肟-%U K H Z.:-"#$#4#$4"C.#"#"#4#@4#"$:6**7"K K‘‘‘:Q.5:,23:Q-K25Q,O O5-.:.,4O5*6,.l&+5‘n+.l<=C:-$#.!刘其星&丛艳伟&普绍平&等:正交试验法优化洛铂的合成工艺-].:中国药物化学杂志&"#"#&=##E$""#E4"#F:-$$.!谢伟杰&张永萍&徐剑:均匀设计筛选吲哚美辛亲水凝胶贴剂的基质处方-].:中国药房&"#$C&"F#$#$"$=F"4$=F<:-$".!周丽萍&李国春&章宸一瑜&等:基于均匀设计法评价柴胡4黄芩的配伍比例及抗抑郁机制-].:中国实验方剂学杂质志&"#$@&"<#$=$""F4=E:-$=.!刘慧勤&严正人&王利杰&等:均匀设计在氟氯西林钠工艺优化中的应用-].:中国抗生素杂志&"#$F&E=#$"$"$<$E4$<$C:-$E.!周飞&李红山:基于均匀设计的红景天苷4姜黄素组合防治非酒精性脂肪性肝病剂量优化配比研究-].:中华中医药杂志&"#$F&==#B$""BEB4"BE@:-$<.!刘天竹&王帅&李天娇&等:基于均匀设计法东北天南星治疗肺癌药效组分配伍优化研究-].:时珍国医国药&"#$C&"F#F$""#"=4"#"<:-$B.!于秋菊&王晓丽:效应面法优化吲哚美辛纳米乳的制备工艺及其透皮性能研究-].:西北药学杂志&"#"#&=<#=$"E$C4E"$:-$C.!谭栀恩&曾佩琴&陀海燕&等:星点设计4效应面法优化复方二甲双胍缓释片的制备工艺-].:中国新药杂志&"#$@&"F#$"$"$E@#4$E@@:#收稿日期""#"#4#@4#"$。
头孢克肟胶囊剂的制备及其质量研究

3 单因素试验选择处方工艺 343 原辅料相互作用试验 头孢克肟为淡黄色结 晶性粉末,几乎不溶于水,提示制剂中应加入若干辅 料。制剂处方中的辅料必须与主药能够相互配伍, 才能够制造出高质量高稳定性的产品。因此在处方 设计前,按照中国药典@AAA年版药物稳定性指导原 则中影响因素的实验方法,我们选择微晶纤维素、预 胶化淀粉、5%’/&,+%)DDDN!G、微粉硅胶等常用辅料 与头孢克肟原料药进行相互作用试验。结果表明主 药与以上常用辅料无相互作用。 345 处方的选择 头孢克肟原料粉极细,流动性较 差,经初步试验,在处方中添加流动性较好的微晶纤 维素、预胶化淀粉、微粉 硅 胶 及 5%’/&,+%)DDDN!G
等辅料。本品规格为每粒?AA’7。 346 工艺的选择 经初步稳定性试验表明,采用湿 法制粒工 艺 制 备 的 头 孢 克 肟 胶 囊 剂 的 含 量 下 降 较
快,提示头孢克肟易受湿热影响。本实验直接将原
辅料采用等量递加法混合均匀,经检验合格后,充填
胶囊,包装,即得成品。
5 样品的质量评价 543 装量差异的测定 按照中国药典@AAA年版二 部制剂通 则 检 查 装 量 差 异,结 果 均 符 合 要 求。L 批 样品装量差异限度均在BF9<=以内。 545 溶出度的测定 取本品,照溶出度测定法(中 国药典@AAA年版二部附录 HS 第一法)测定,以磷 酸盐缓冲液(/MF9A);AA’Z 为溶剂,转速为?AA&· ’,-V?,依法操作。 经 ><’,-,取 溶 液 ?<’Z,立 即 经 A9D!’ 微孔滤膜滤过,精密量取续滤液<’Z,用磷 酸盐缓冲液(/MF9A)稀释成每?’Z 中约含头孢克 肟?A!7的溶液;另取头孢克肟对照品适量,用磷酸 盐缓冲液(/MF9A)溶解并定量稀释制成每?’Z 中 含?A!7的溶液(必要时超声处理)。取上述两种溶 液,照分光光度法(中国药典@AAA年版二部附录[\ N)在@DD-’ 波长处分别测定吸收度,计算每粒的溶 出量。结果表明,本品在><’,-时的溶出度达;<= 以上。
头孢克肟口服固体制剂质量探讨

2020年11月 第21期综合医学论坛头孢克肟口服固体制剂质量探讨张迪平浙江创新生物有限公司,浙江 绍兴 312000【摘要】目的:探讨头孢克肟口服固体制剂的质量标准及存在的问题。
方法:通过随机抽检等方式得到500批头孢克肟口服固体制剂,通过法定检验法、探索性检验法对其实施检测,由此分析头孢克肟口服固体制剂的质量标准。
并通过液相色谱-质谱联合发对制剂中的杂质展开定性分析,利用苛刻实验、考察调研等手段分析杂质类型,然后按照药物制备方法分析其杂质结构。
结果:在500批样品中,有493批质量合格(98.60%),7批质量不合格(1.40%),不合格的原因是相关物质及含量。
通过实验研究得出,制剂中的相关物质来自于原料生产、运输期间出现的降解反应。
结论:头孢克肟片剂、胶囊及颗粒剂的现行标准合格,而头孢克肟分散片、干混悬剂等标准亟待提升[1]。
【关键词】头孢克肟;质量分析;相关杂质[中图分类号]R944 [文献标识码]A [文章编号]2096-5249(2020)21-0229-02头孢克肟是一种口服的第III代头孢菌素抗生素,其主要对肺炎球菌、流感轩菌、肺炎杆菌等发挥抗菌功效。
其固体制剂包括片剂、胶囊、颗粒剂、分散片和干混悬剂等。
1987年,日本药研所正式成功制备出头孢克肟,随后,我国在1995年之后开始生产头孢克肟口服制剂,由于该药物的临床效果显著,其在临床上得到广泛应用。
若要确保患者临床用药安全,本文通过要求安全性、有效性、质量可控性等层面对头孢克肟口服固体制剂展开全方位地质量分析,为增强其药品质量、实现有效监管等提供指导和帮助。
1 材料及仪器1.1材料 通过随机抽检等方式得到500批头孢克肟口服固体制剂,总计包括5种剂型,覆盖20个省市的56家生产企业。
其中,片剂120批、胶囊195批、颗粒剂94批、干混悬剂68批、分散片23批。
其中,片剂和胶囊有三个规格,即0.1g、0.2g和0.5g;分散片、颗粒剂和干混悬剂的规格有两个,即0.1g和0.5g。
分子排阻色谱法测定头孢克肟干混悬剂中高分子杂质的含量

分子排阻色谱法测定头孢克肟干混悬剂中高分子杂质的含量石海英;陈修毅;王金虎【摘要】目的采用分子排阻色谱法检查头孢克肟干混悬剂中的高分子杂质.方法色谱柱为TSK-GEL(R)G2500PWXL色谱柱(7.8mm×300mm,7μm),流动相为磷酸盐缓冲液(pH7.0)[0.05mol/L磷酸氢二钠溶液和0.05mol/L磷酸二氢钠溶液(61:39)],流速为0.33mL/min,检测波长为254nm,以头孢克肟对照品外标法计算高分子杂质的含量.结果头孢克肟在2.0~2000μg/mL的浓度范围内,面积与浓度呈良好的线性关系(r=0.9996);最小检出浓度为0.7μg/mL;高分子杂质与头孢克肟峰能有效分离,并先于主峰流出,方法专属性良好;高分子杂质在溶液中不稳定,样品需要临用现配.结论建立的方法快速准确,适用于头孢克肟干混悬剂高分子杂质的测定.【期刊名称】《中国抗生素杂志》【年(卷),期】2016(041)002【总页数】3页(P122-124)【关键词】分子排阻色谱;头孢克肟;干混悬剂;高分子杂质【作者】石海英;陈修毅;王金虎【作者单位】山东省药学科学院,山东省化学药物重点实验室,济南250101;山东大学药学院,济南250012;山东大学药学院,济南250012;山东大学药学院,济南250012【正文语种】中文【中图分类】R978.1头孢克肟是一种口服的第三代头孢菌素,抗菌谱广,临床上已广泛使用。
头孢克肟治疗儿童细菌感染痊愈率、总有效率优于阿莫西林克拉维酸钾[1],头孢克肟治疗小儿急性细菌性肠炎疗效总有效率显著高于头孢克洛[2-3],头孢克肟已经成为儿科门诊常用抗菌药物。
但是已有文献报道,第三代头孢菌素不良反应发生率呈增多趋势[4]。
多年来的研究已证明引发头孢类抗生素过敏反应的主要是其中的高分子杂质[5-6],高分子聚合物是分子量大于药物本身杂质的总和,它可能是聚合度不同的多组分混合体。
说说头孢用药的那些事——一个执业药师的日常总结

说说头孢用药的那些事——一个执业药师的日常总结说说头孢用药的那些事,你中招了没?一个执业药师的日常总结李长青写在开篇前的感受参加2015执业药师资格考试顺利通关,在朋友圈里晒出自己的成绩单,高兴的显摆了一下。
朋友们纷至沓来的线上祝贺,起初觉得没什么,自己幻想着回头领到证书可以挂出去,多赚点人民币。
可后来,我感觉身上的担子重了些。
在班车上、在洗澡时、在家人生病时、或者在朋友圈里,认识我的朋友们,同事们会问及我一些用药问题。
“店员推荐我换这个药,行吗?”“孩子感冒了该不该吃消炎药啊?”“这药说明上写着一天三顿,我可不可以少吃一顿?”等等。
虽然自己初出茅庐,药师水平尚停留在“纸上谈兵”,但看着那些信任的眼神,“不知道”的字眼难以吐口。
于是我赶紧翻书,赶紧查资料,尽最大的努力给大家找到科学依据。
今天总结了一些头孢用药的那些事吧!分享给大家,希望我的点滴努力能够换来亲朋好友的早日康复。
一、听说吃头孢类消炎药,都不能喝酒吗?问这个问题的朋友是我老家的妹夫,他曾经感冒后喝了酒,后来在药店买了头孢吃,当天晚上就头晕、胸闷、呼吸憋气、迷迷糊糊的、好像濒死的感觉。
事后才知道是因为吃头孢药喝酒造成的。
这种反应在药学里专业名词叫“双硫仑样反应”。
头孢菌素母核(7-ACA)上如果存在双硫仑分子结构,那么在服药期间或者之后的5-7天内饮酒、服用含有乙醇的药物比如藿香正气水,中药酒剂,食物(比如豆腐乳,啤酒鸭等)以及外用乙醇均可以抑制乙醛脱氢酶的活性,使乙醛代谢为乙酸的路径受阻,导致乙醛的过量堆积,引起双硫伦样反应。
临床表现为颜面部及全身皮肤潮红,眼结膜发红、发热感、头晕、头痛、胸闷、气急、出汗、呼吸困难、言语混乱、话语多,视物模糊、步态不稳、狂躁、意识障碍、晕厥、腹痛、腹泻、咽喉刺痛、震颤感、口中有大蒜味、还可以出现心动过塑、血压下降、烦躁不安、濒死感等等严重的症状出现。
但并不是所有头孢都会出现以上反应,如果分子结构中没有双流仑类似结构的头孢菌素比如头孢拉定、头孢氨苄、头孢呋辛酯等等则无此反应。
头孢类抗生素中微量不稳定杂质研究

Reflection on strategy and methods on trace unstable lactam antibiotics impurities of βHU Changqin1 ,JIANG Yu2 ,ZHANG Jingpu3 ,ZHANG Zhefeng2 ,LI Jin1 , 3 QIAN Jianqin1, ,LI Yaping1 ,ZHANG Dousheng1 ( 1 National Institute for Food and Drug Control,Beijing 100050 ,China; 2 Center for Drug Evaluation SFDA, Beijing 100038 ,China; 3 Institute of Medicinal Biotechnology,Chinese Academy of Medical Sciences & Peking Union Medical College,Beijing 100050 ,China) [ Abstract] The safety of drug therapy is closely related to the quality of drugs. The impurity profiling has lactam become the most important activity in assuring the high quality of drugs. However,the impurity profiles of β antibiotics are found with a great multiplicity as the structure of β lactams is unstable, which made it difficult to use routine methods. Based on published technical requirements and guidance,and combining our experience,we dislactam antibiotcussed the strategy and technique used in impurity profiling study on trace unstable impurities in β ics with emphasis on impurity determination,impurity identification as well as impurity qualification. [ Key words] β lactam antibiotics; impurity; impurity profile; impurity determination; impurity identification; impurity qualification 杂质是反映药品质量的重要指标, 追溯人们对 , 药品中杂质控制理念的变迁 可概括为 3 个主要阶 段: 纯度控制、 限度控制和杂质谱控制
国产头孢克肟口服固体制剂质量分析

文章编号:1001-8689(2014)08-0594-04 分析质控与制剂国产头孢克肟口服固体制剂质量分析王海波邓鸣朱荣陈宁周李浩朱斌*(广西食品药品检验所,南宁530021)摘要:目的考察现行质量标准的科学性,评价国产头孢克肟口服固体制剂的质量现状及存在问题。
方法按照2012年度国家评价性抽验计划总体要求,采用法定检验方法结合探索性研究进行样品检验,统计分析检验结果对国产头孢克肟口服固体制剂的质量现状进行评价。
采用液相色谱-飞行时间质谱联用法对各企业主要杂质进行定性,结合苛刻试验、考察调研等方式确定杂质的来源,并通过在实验室中进行制备的方式确定杂质的结构。
结果法定检验显示486批样品中481批合格(98.97%),5批(1.03%)不合格,不合格项主要为有关物质和含量。
经研究发现,制剂中的有关物质来源于原料及生产和贮存过程中发生的反应。
结论片剂、胶囊及颗粒剂的现行标准基本可行,干混悬剂及分散片的标准急需提高。
本品国内仿制生产企业应进一步优化处方工艺,加强原料药的生产管理,提高本品的安全性。
关键词:头孢克肟;评价性抽验;质量分析;有关物质中图分类号:R978.1+1文献标志码:ADOI:10.13461/ki.cja.005397Quality analysis of domestic oral solid preparation of ce fi ximeWang Hai-bo, Deng Ming, Zhu Rong, Chen Ning-zhou, Li Hao and Zhu Bin(Guangxi Institute for Food and Drug Control, Nanning 530021)Abstract Objective To evaluate the suitability of statutory standard and the quality condition of domestic oral solid preparation of ce fi xime. Methods According to the general requirement of national assessment programs in 2012, statutory testing methods combining with the exploratory research were used to examine sample. Statistical analysis of the results were used to evaluate the quality status of domestic oral solid preparation of c e fi xime. QTOF LCMS were used to analysis the main impurities. The stressing test and the investigation were used to determine the source of the impurity whose structure was determined by preparation in the laboratory. Results In 486 batches of samples, 481 batches were quali fi ed (98.97%), 5 groups (1.03%) were unquali fi ed, and content and related substances were the main causes of failure. The study found that the impurities came from raw material, degradation reaction in manufacturing or storage. Conclusion Current standard could basically control the quality of tablets, capsules and granules, but the standard of dry suspension agents and dispersible tablets needed to be improved immediately. The domestic enterprise should further optimize the productive technology, strengthen the production management to improve the security of the drug.Key words Ce fi xime; Evaluative testing; Quality analysis; Related substances头孢克肟(cefixime)为国家基本药物,主要用于敏感菌引起的呼吸道感染、胆道感染、尿道感染、猩红热、中耳炎、鼻旁窦(副鼻窦)炎[1-2]。
头孢克肟干混悬剂中有关物质的定性与定量分析

头孢克肟干混悬剂中有关物质的定性与定量分析于可欣;管一娜;郑锦世;李清【期刊名称】《沈阳药科大学学报》【年(卷),期】2024(41)3【摘要】目的建立头孢克肟干混悬剂中的有关物质定性与定量分析方法。
方法采用HPLC⁃TOF⁃MS法结合PeakView、MasterView等软件对头孢克肟干混悬剂中有关物质的结构进行初步鉴定,采用HPLC法,乙腈⁃四丁基氢氧化铵为流动相梯度洗脱,柱温40℃,流速1.0 mL·min^(-1),检测波长254 nm,测定头孢克肟干混悬剂中有关物质的含量。
结果根据对照品对照和文献提供的质谱信息初步鉴定了6个有关物质,分别为杂质A、杂质B、杂质D、杂质E、杂志H和头孢克肟叔丁酯。
头孢克肟干混悬剂中含有其中5个,分别为杂质A、杂质B、杂质D、杂质E和头孢克肟叔丁酯。
使用该HPLC方法各杂质均能达到基线分离,杂质E和降解产生的杂质H的质量浓度在0.2121~21.21μg·mL^(-1)和0.2053~20.53μg·mL^(-1)内线性关系良好,r分别为0.9999和1.0000;回收率为105.0%和93.2%(RS D≤2.3%)。
结论建立的HPLC方法简便、准确、快速,能同时测定头孢克肟干混悬剂中的有关物质,可有效对其质量进行控制。
【总页数】9页(P314-322)【作者】于可欣;管一娜;郑锦世;李清【作者单位】沈阳药科大学药学院【正文语种】中文【中图分类】R917【相关文献】1.闪蒸/气相色谱/质谱法定性定量分析烟叶中香味物质的研究2.基于U PLC-MS/MS技术对蓝莓中花青苷类物质的定性定量分析3.高级氧化体系中活性氧化物质的定性和半定量分析方法研究进展4.吡拉西坦原料药及注射液中3种有关物质定性及定量分析5.盐酸厄洛替尼及其片剂中5种有关物质的定性及定量分析因版权原因,仅展示原文概要,查看原文内容请购买。
头孢菌素类抗生素高分子杂质分析探讨

头孢菌素类抗生素高分子杂质分析探讨作者:黄肖民来源:《科技创新与应用》2013年第21期摘要:头孢菌素类抗生素中的高分子杂质是引起过敏反应的过敏原,也是该类药物分析研究的重点。
高分子杂质分为外源性杂质和内源性杂质,而内源性聚合物是目前药物质量控制的重点。
本文对近年来头孢菌素中高分子杂质的杂质分类、来源、聚合特性、结构特点和分离分析方法研究进行了综述。
关键词:抗生素;头孢菌素;高分子杂质头孢菌素属于β-内酰胺类抗生素,该类抗生素具抗菌谱广、有高效、低毒、耐酶、耐酸等特点。
头孢菌素类抗生素一般较为安全,但用于特异体质的患者则可能发生如过敏性休克的不良反应,这就导致在临床此类药物中受到很大的限制。
目前已证实半合成β-内酰胺类抗生素,如青霉素V、氨苄西林、阿莫西林、头孢唑肟钠、头孢替唑钠、头孢噻啶、头孢噻吩、头孢美唑钠等,能够形成聚合物,从而引发过敏性反应。
为了保证临床用药的安全性和有效性,本文就头孢菌素类抗生素过敏性反应的发生机制、头孢菌素类抗生素高分子杂质的定义、来源、分类、分离分析技术等方面进行综述。
1 过敏反应的发生机制过敏反应也称抗原抗体反应,主要指药物分子降解或聚合形成的杂质进入体内,与体内的大分子如多肽、蛋白质及多糖等发生不可逆的结合,引起的不良反应。
头孢菌素类抗生素是指母核为7-氨基头孢烷酸,含有两个侧链活性取代基R1和R2。
头孢菌素类抗生素水解后的主要产物是侧链R1的衍生物,因此推断头孢菌素的过敏反应的主要抗原决定簇是侧链的R1,这一推测目前已被许多学者所证实。
但是,头孢菌素类抗生素本身与其降解产物都是单价半抗原,这样的结构并不会引起过敏反应,而当这些产物与大分子载体如多肽或蛋白等结合就可形成多价抗原,这样这些产物就具有了抗原性。
此外,头孢菌素类抗生素自身在一定的条件下就能够聚合成高分子聚合物,这些聚合物也是引起过敏反应的主要原因。
2 高分子杂质分类和来源药物杂质中相对分子质量比药物分子相对分子量大的杂质称为高分子杂质,这些杂质通常相对分子质量为1000~5000。
头孢克肟相关杂质
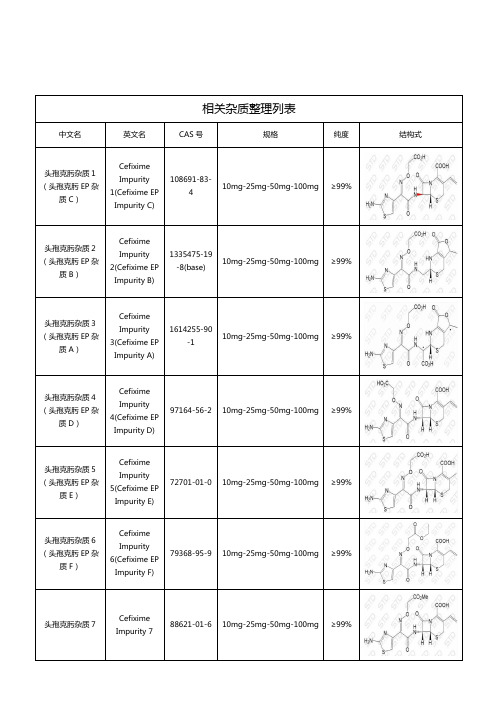
相关杂质整理列表中文名英文名CAS号规格纯度结构式头孢克肟杂质1(头孢克肟EP杂质C)CefiximeImpurity1(Cefixime EPImpurity C)108691-83-410mg-25mg-50mg-100mg ≥99%头孢克肟杂质2(头孢克肟EP杂质B)CefiximeImpurity2(Cefixime EPImpurity B)1335475-19-8(base)10mg-25mg-50mg-100mg ≥99%头孢克肟杂质3(头孢克肟EP杂质A)CefiximeImpurity3(Cefixime EPImpurity A)1614255-90-110mg-25mg-50mg-100mg ≥99%头孢克肟杂质4(头孢克肟EP杂质D)CefiximeImpurity4(Cefixime EPImpurity D)97164-56-2 10mg-25mg-50mg-100mg ≥99%头孢克肟杂质5(头孢克肟EP杂质E)CefiximeImpurity5(Cefixime EPImpurity E)72701-01-0 10mg-25mg-50mg-100mg ≥99%头孢克肟杂质6(头孢克肟EP杂质F)CefiximeImpurity6(Cefixime EPImpurity F)79368-95-9 10mg-25mg-50mg-100mg ≥99%头孢克肟杂质7CefiximeImpurity 788621-01-6 10mg-25mg-50mg-100mg ≥99%头孢克肟杂质23CefiximeImpurity 2379368-92-6 10mg-25mg-50mg-100mg ≥99%湖北扬信医药科技有限公司经营上万种杂质对照品(优势供应硫酸羟氯喹杂质、硝苯地平杂质、沙丁胺醇杂质、达格列净杂质、厄贝沙坦杂质、阿莫西林克拉维酸钾杂质、利伐沙班杂质、阿托伐他汀钙杂质、西格列汀杂质、利格列汀杂质等),并代理销售中检所、STD、LGC、TLC、EP、USP、TRC等多个品牌产品,提供上万种标准品对照品,真诚为您服务。
头孢类抗生素生产过程中的废渣处理

头孢类抗生素生产过程中的废渣处理作者:刘彦宏来源:《科学与财富》2015年第24期摘要:头孢类抗生素是人们经常使用的一种抗生素类药物,在头孢生产的过程中会产生很多的废渣,而这种废渣的含量会直接影响到头孢的疗效,在实际的生产中,废渣会对环境造成不利的影响,同时也对其生产会产生一定的阻碍。
本文主要分析了头孢类抗生素生产过程中的废渣处理问题,以供参考和借鉴。
关键词:头孢噻肟钠;2-硫醇基苯并噻唑;二硫化二苯并噻唑;回收利用头孢类抗生素在上个世纪实际上就已经研制成功,这种药物有着非常好的疗效,当前,其已经发展到了第四代的产品,头孢噻肟钠等是头孢的第三类产品,而这些药物是一种非常好的抗生素类药物,在这一过程中也能够展现出非常好的发展前景。
但是头孢类的抗生素在生产的过程中也会产生一定的废渣,必须要在这一过程中对其予以控制。
1、基本原理1.1 M的提取M是一种不溶于水的物质,但是M的钠盐却可以有很好的水溶性,使用M的钠盐和废渣当中其他成分的溶解性有非常显著的差异,所以在这一过程中可以很好的将废渣彻底的分离出来。
在对其进行除杂处理之后,再对其进行重结晶处理。
1.2 DM合成在对物质进行纯化之后的M和亚硝酸盐中加入了适量的硫酸,同时在其反应的过程中,应该将反应的温度控制在60℃左右,而在这一过程中也可以通过一氧化氮进行适当的氧化,从而也就可以得到一个更加符合相关标准和要求得到DM。
2、工艺试验部分2.1原料(1)废渣:取自某制药厂头孢噻肟钠生产车间,呈棕色粘稠状;(2)碳酸钠:工业纯,质量分数≥98%;(3)硫酸:工业纯,质量分数≥95%;(4)亚硝酸钠:工业纯,质量分数≥98%;(5)乙醇:工业纯,质量分数≥95%。
2.2废渣的主要成份经初步分析和物料衡算,得废渣中主要成份的比例,见表1。
表1废渣中主要成份的比例2.3工艺流程在生产的过程中,首先在浸取装置当中加入适量的浸取液,浸取液通常就是2mol/L的碳酸钠溶液而当其加热到60℃的时候按照恰当的比例投入废渣,同时还要对其进行全方位的搅拌,在对其浸泡了半个小时之后,将料浆直接经过过滤器对其进行处理,将M进行适当的处理之后将其过滤的液体直接放在储罐当中,而剩余的废渣放回到浸取装置当中,经过若干次的处理之后废渣已经呈现出了较为松散的状态,同时还要想液体当中加入浓度为2mol/L的硫酸,同时还要将溶液的PH值控制在3.5左右,这样也就使得M重新析出,在对其进行了过滤处理之后,在对其进行了干燥处理之后就可以得到M的结晶体,这样就得到了M的精制品,而在这一过程中可以重新的将乙醇液体处理和回收。
头孢菌素类抗生素高分子杂质分析研究

头孢菌素类抗生素高分子杂质分析研究头孢菌素类抗生素中高分子杂质会引起患者的过敏反应,因此,对其的分析显得很重要。
高分子杂质包括外源性杂质及内源性杂质两种,目前药物质量控制重点是内源性聚合物。
标签:头孢菌素类抗生素;高分子杂质;分析头孢菌素具有抗菌谱广、高效、低毒和耐酶耐酸等特性,头孢菌素类抗生素安全性高,但是用在体质比较特殊的患者身上,则会出现过敏性休克、头晕头痛等不良反应,致使此类药物无法在临床中广泛应用。
为了确保临床用药中的安全性及有效性,本文研究了头孢菌素类抗生素的过敏性反应的发生机制、头孢菌素类抗生素高分子杂质的分类和来源及其分离分析技术等内容。
1.头孢菌素类的抗生素的过敏反应机制过敏反应的本质就是抗原抗体的反应,药物降解后的杂质被人体吸收后,会与人体内部的大分子载体出现不可逆的结合,出现抗原一抗体的反应,严重的患者还会出现休克,甚至死亡。
抗生素聚合物的免疫原性较弱,而多价半抗原,会引发出速发型过敏反应。
头孢菌素母核为7·氨基头孢烷酸(7-ACA),其有3位与7位的2个活性取代基,若头孢菌素被碱或胺水解后,其产物大部分是降解的产物,它主要属于侧链7位,故各种头孢菌素侧链7位,都会变成过敏反应的主要抗原决定簇。
头孢菌素类抗生素之间发生交叉的过敏反应的情况,与其侧链结构的相似性和抗接点的抗体有关。
日本药厂实行了迟发型及速发型过敏反应的动物试验,得出头孢替安与7位侧链结构相异的头孢噻啶、头孢唑啉、青霉素G和氯苄西林等没有发生交叉性过敏反应。
因此,国内药厂可通过改造头孢菌素类抗生素的侧链结构,增加或者保持本身药物的抗菌作用,产生定量的空间位阻作用,达到修饰或者改变抗原决定族的特异性,阻止其出现交叉过敏反应[1]。
2.孢菌素类的抗生素高分子杂质的分类及来源高分子杂质是药品中比药物分子的相对分子质量大的一种杂质,其相对分子的质量约在1000-5000。
个别分子质量会达到10000以上。
抗菌药物中的高分子杂质通化工和生化领域内的高分子化合物本质上存在区别,前者按照来源可分为两大类:外源性的杂质和内源性的杂质。
头孢克肟分散片质量标准的探讨

头孢克肟分散片质量标准的探讨摘要】目的:提高头孢克肟分散片的质量标准。
方法:采用C18(250mm×4.6,5μm)色谱柱,按头孢克肟分散片的质量标准进行试验,并与《中国药典》2010年版二部头孢克肟含量测定项下的方法进行比较。
结果:采用《中国药典》方法测定头孢克肟分散片含量柱效高,分离度和系统适用性试验均符合要求。
结论:该方法可用于头孢克肟分散片的质量控制。
【关键词】头孢克肟分散片质量标准含量测定【中图分类号】R927 【文献标识码】A 【文章编号】2095-1752(2013)12-0372-01Discussion of cefminox dispersible tablets quality standard【Abstract】Objective To improve the quality standard of cefminox dispersible tablets.METHODS According to the quality standard of cefminox tablets, tested it compared with the methods in the appendix Ⅱof Chinese Pharmacopoeia (2010 edition) of cefminox under content determination, running on C18 (250 mm x 4.6, 5 microns) chromatographic columns. Results Took the method for determining contentof cefminox tablets of Chinese Pharmacopoeia, it promised high efficiency. The resolution and system suitability conformed to the demands. Conclusion The method can be used to the quality control of cefminox dispersible tablets.【Key words】cefminox dispersible tablets quality standard content determination 通过对市场调查抽样,发现《中国药典》2010年版二部未收载头孢克肟分散片,该药目前使用的质量标准为国家食品药品监督管理局标准(YBH22012005)。
国产头孢克肟口服固体制剂有关物质研究

国产头孢克肟口服固体制剂有关物质研究邓鸣;陈宁周;李浩;王海波;朱斌【摘要】目的对国产头孢克肟口服固体制剂有关物质进行分析,对其中的主要有关物质来源、结构进行初步研究.方法建立HPLC方法对头孢克肟口服固体制剂有关物质进行了考察,采用LC-Q-TOF/MS技术对主要杂质结构进行了初步鉴定.结果国产头孢克肟口服固体制剂共检出20个有关物质,其中,杂质7、14、16、17是主要杂质.486批样品的有关物质最大单个杂质含量在0.1%~4.1%之间,总杂质含量在0.1%~9.8%之间.结论制剂中的有关物质来源于原料及降解反应,建议企业优化生产工艺,严格控制原料的质量及生产、运输和贮存环境.【期刊名称】《中国抗生素杂志》【年(卷),期】2016(041)007【总页数】7页(P541-546,封3)【关键词】头孢克肟;有关物质;高效液相色谱;飞行时间质谱【作者】邓鸣;陈宁周;李浩;王海波;朱斌【作者单位】广西食品药品检验所,南宁530021;广西食品药品检验所,南宁530021;广西食品药品检验所,南宁530021;广西食品药品检验所,南宁530021;广西食品药品检验所,南宁530021【正文语种】中文【中图分类】R917头孢克肟是第三代口服头孢菌素,临床上用于敏感菌引起的呼吸道感染、胆道感染、尿道感染、猩红热、中耳炎、鼻旁窦(副鼻窦)炎等。
2010版《中国药典》二部首次收载了头孢克肟及其制剂,美国药典(34版)、英国药典(2012版)均收载有头孢克肟,英国药典提供了头孢克肟中部分有关物质的化学结构式及名称,但是没有提供色谱行为参数[1-3]。
头孢菌素结构不稳定,在生产及储存过程中遇酸、碱、光、热、辐射和β-内酰胺酶等均会发生降解反应,形成一系列的降解物及聚合物,使其失去抗菌活性,甚至产生毒副反应,因此明确杂质结构和产生机理,对改进生产工艺,提高产品质量具有重大意义[4]。
目前关于头孢克肟杂质研究的文章多见于测定方法的建立[5-7],文献[8]采用LC-MS/MS分析头孢克肟原料及制剂的杂质并鉴定了部分杂质结构,未见对国产头孢克肟制剂杂质谱、杂质含量分布及杂质来源的研究。
一种头孢克肟杂质及其合成方法[发明专利]
![一种头孢克肟杂质及其合成方法[发明专利]](https://img.taocdn.com/s3/m/eef310ddeefdc8d377ee32bb.png)
专利名称:一种头孢克肟杂质及其合成方法专利类型:发明专利
发明人:翁韶潮,陈帮昱
申请号:CN202010616624.1
申请日:20200701
公开号:CN111689988A
公开日:
20200922
专利内容由知识产权出版社提供
摘要:本发明公开了一种头孢克肟杂质及其合成方法,该方法包括如下步骤:a.用碱将头孢地尼的β‑内酰胺水解得到中间体1;b.用酸与中间体1反应得中间体2;c.将中间体2用Boc酸酐保护氨基得中间体3;d.中间体3与溴乙酸甲酯反应得中间体4;e.用三氟乙酸将中间体4脱保护得目标杂质。
本发明合成反应物料易得、成本低、反应操作简单、反应设备要求不高、反应条件温和,合成目标产物含量高,在目前该头孢克肟杂质市场价格较高且不能买到的情况下,为头孢克肟杂质研究提供了相对便捷可靠的获得渠道,并大大降低了其成本,对于更深入广泛的研究头孢克肟相关用药安全性、可靠性、稳定性以及生产过程中的质量控制有着很大的促进作用。
申请人:心邀(深圳)生物科技有限公司
地址:518000 广东省深圳市龙岗区龙城街道五联社区友谊路27号三楼
国籍:CN
代理机构:深圳市正德知识产权代理事务所(特殊普通合伙)
代理人:周善勇
更多信息请下载全文后查看。
