600267浙江海正药业股份有限公司关于比卡鲁胺片通过仿制药一致性评价2021-03-10
国家药监局关于发布仿制药参比制剂目录(第四十一批)的通告-国家药品监督管理局通告2021年第29号

国家药监局关于发布仿制药参比制剂目录(第四十一批)的通告正文:----------------------------------------------------------------------------------------------------------------------------------------------------国家药品监督管理局通告2021年第29号国家药监局关于发布仿制药参比制剂目录(第四十一批)的通告经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第四十一批)。
特此通告。
附件:仿制药参比制剂目录(第四十一批)国家药监局2021年4月26日附件仿制药参比制剂目录(第四十一批)序号药品通用名称英文名称/商品名规格备注1备注241-1拉坦噻吗滴眼液Latanoprost and Timolol Maleate Eye Drops每1ml溶液含50μg拉坦前列素和6.8mg马来酸噻吗洛尔Pfizer SA国内上市的原研药品原研进口41-2甲磺酸奥希替尼片Osimertinib Mesylate Tablets/ Tagrisso(泰瑞沙)80mgAstraZeneca AB国内上市的原研药品原研进口41-3枸橼酸伊沙佐米胶囊Ixazomib Citrate Capsules/Ninlaro(恩莱瑞)2.3mg(按C14H19BCl2N2O4计)Takeda Pharma A/S国内上市的原研药品原研进口41-4枸橼酸伊沙佐米胶囊Ixazomib Citrate Capsules/Ninlaro(恩莱瑞)3mg(按C14H19BCl2N2O4计)Takeda Pharma A/S国内上市的原研药品41-5枸橼酸伊沙佐米胶囊Ixazomib Citrate Capsules/Ninlaro(恩莱瑞)4mg(按C14H19BCl2N2O4计)Takeda Pharma A/S国内上市的原研药品原研进口41-6吲哚美辛凝胶Indometacin Gel/Vantelinkowa(万特力)每克含吲哚美辛0.01克与l-薄荷醇0.03克Kowa Company,Ltd.国内上市的原研药品原研进口41-7醋酸阿比特龙片(II)Abiraterone Acetate Tablets/Yonsa125mgSun Pharma Global FZE未进口原研药品美国橙皮书41-8丁酸氯维地平注射用乳剂Clevidipine Injectable Emulsion/Cleviprex 25mg/50ml(0.5mg/ml)Chiesi USA INC未进口原研药品美国橙皮书41-9丁酸氯维地平注射用乳剂Clevidipine Injectable Emulsion/Cleviprex50mg/100ml(0.5mg/ml)Chiesi USA INC未进口原研药品美国橙皮书41-10碳酸司维拉姆干混悬剂Sevelamer Carbonate Powder for oral suspension/ Renvela 2.4gGenzyme Corporation未进口原研药品美国橙皮书41-11碳酸司维拉姆干混悬剂Sevelamer Carbonate Powder for oral suspension/ Renvela 0.8gGenzyme Corporation未进口原研药品美国橙皮书41-12钆贝葡胺注射液Gadobenate dimeglumine Injection /Multihance15ml:7.935g(529mg/ml)Bracco Diagnostics Inc未进口原研药品美国橙皮书41-13琥珀酸舒马普坦萘普生钠片Sumatriptan and Naproxen Sodium Tablets/Treximet85/500mgCurrax Pharmaceuticals LLC未进口原研药品美国橙皮书41-14盐酸达克罗宁局部溶液剂Dyclonine Topical Solution/Dyclopro0.50%Novocol Inc国际公认的同种药品美国橙皮书41-15盐酸达克罗宁局部溶液剂Dyclonine Topical Solution/Dyclopro1%Novocol Inc国际公认的同种药品美国橙皮书41-16克霉唑含片Clotrimazole Troche10mgHikma Pharmaceuticals USA INC国际公认的同种药品美国橙皮书41-17蒙脱石混悬液Montmorillonite Suspension3gIpsen Pharma / Ipsen Consumer Healthcare未进口原研药品欧盟上市41-18ω-3鱼油中长链脂肪乳/氨基酸(16)/葡萄糖(30%)注射液ω-3 Fish Oil Medium and Long Chain Fat Emulsion/Amino Acids (16)/Glucose (30%) Injection 1250mlB.Braun Melsungen AG未进口原研药品欧盟上市41-19甲磺酸奥希替尼片Osimertinib Mesylate Tablets/ Tagrisso40mgAstraZeneca AB未进口原研药品欧盟上市41-20肠内营养乳剂(SP)Enteral Nutritional Emulsion(SP)/ Survimed OPD500mlFresenius Kabi Deutschland GmbH未进口原研药品欧盟上市41-21匹可硫酸钠滴剂Sodium Picosulfate Drops7.5 mg/ml帝人ファーマ株式会社未进口原研药品日本上市41-22布美他尼注射液Bumetanide Injection1ml:0.5mg第一三共株式会社未进口原研药品日本上市41-23盐酸纳呋拉啡口崩片Nalfurafine Hydrochloride OD Tablets/Remitch OD Tablets 2.5μg東レ株式会社未进口原研药品日本上市41-24来特莫韦注射液Letermovir Injection/Prevymis20mg/ml(240mg:12ml)MSD株式会社未进口原研药品日本上市41-25来特莫韦片Letermovir Tablets/Prevymis240mgMSD株式会社未进口原研药品日本上市41-26克立硼罗软膏Crisaborole Ointment/Staquis(舒坦明)2%(30g、60g)Anacor Pharmaceuticals, Inc.国内上市的原研药品原研进口41-27司来帕格片Selexipag Tablets/Uptravi(优拓比)0.4mgActelion Pharmaceuticals Ltd国内上市的原研药原研进口41-28曲安奈德注射液Triamcinolone Acetonide Injectable Suspension /Kenalog-1010mg/mlApothecon Inc Div Bristol Myers Squibb未进口原研药品美国橙皮书41-29坎地沙坦酯氢氯噻嗪片Candesartan Cilexetil and Hydrochlorothiazide Tablets/Atacand HCT 16mg/12.5mgANI Pharmaceuticals INC/Astrazeneca未进口原研药品美国橙皮书41-30注射用米卡芬净钠Micafungin Sodium for Injection /Mycamine50mgAstellas Pharma US Inc未进口原研药品美国橙皮书41-31注射用哌拉西林钠他唑巴坦钠Piperacillin And Tazobactam/Zosyn4.5gWyeth Pharmaceuticals LLC未进口原研药品美国橙皮书41-32盐酸托莫西汀胶囊Atomoxetine Hydrochloride Capsules/Strattera 10mg(以托莫西汀碱计)Eli Lilly And Co未进口原研药品美国橙皮书41-33盐酸托莫西汀胶囊Atomoxetine Hydrochloride Capsules/Strattera 25mg(以托莫西汀碱计)Eli Lilly And Co未进口原研药品美国橙皮书41-34盐酸托莫西汀胶囊Atomoxetine Hydrochloride Capsules/Strattera 40mg(以托莫西汀碱计)Eli Lilly And Co未进口原研药品美国橙皮书41-35熊去氧胆酸胶囊Ursodeoxycholic Acid Capsules / Actigall300mgAllergan Sales LLC未进口原研药品美国橙皮书41-36碳酸镧咀嚼片Lanthanum Carbonate Chewable Tablets/FosrenolEq 500mg BaseShire Development LLC/Takeda Pharmaceuticals USA INC 未进口原研药品美国橙皮书41-37钆布醇注射液Gadobutrol Injection/Gadavist6.0472g/10ml (604.72mg/ml)Bayer Healthcare Pharmaceuticals Inc未进口原研药品美国橙皮书41-38阿昔洛韦胶囊Aciclovir Capsules0.2gApotex Inc国际公认的同种药品美国橙皮书41-39他达拉非片Tadalafil Tablets/Adcirca20mgEli Lilly CO未进口原研药品美国橙皮书41-40他达拉非片Tadalafil Tablets/Cialis2.5mgEli Lilly Nederland B.V.未进口原研药品欧盟上市41-41米氮平片Mirtazapine Tablets / Norset15mgMSD France未进口原研药品欧盟上市41-42醋酸阿托西班注射液Atosiban Acetate Injection /Tractocile 0.9ml:7.5mg/ml(以阿托西班计)Ferring Pharmaceuticals A/S未进口原研药品欧盟上市41-43醋酸阿托西班注射液Atosiban Acetate Injection /Tractocile5ml:7.5mg/ml(以阿托西班计)Ferring Pharmaceuticals A/S未进口原研药品欧盟上市41-44盐酸普拉克索片Pramipexole Dihydrochloride Tablets/Sifrol0.5mgBoehringer Ingelheim International GmbH未进口原研药品欧盟上市41-45中长链脂肪乳/氨基酸(16)/葡萄糖(16%)注射液Medium and Long Chain Fat Emulsion/Amino Acids(16)/Glucose(16%)Injection 1250mlB.Braun Melsungen AG未进口原研药品欧盟上市41-46二甲双胍维格列汀片(III)Metformin Hydrochloride and Vildagliptin Tablets / Eucreas每片含盐酸二甲双胍1000mg和维格列汀50mgNovartis Europharm Limited未进口原研药品欧盟上市41-47伊立替康脂质体注射液Irinotecan Liposome injection/Onivyde43mg/10mlLes Laboratoires Servier未进口原研药品欧盟上市41-48吡拉西坦注射液Piracetam Injection12g/60mlUCB Pharma未进口原研药品欧盟上市41-49阿加曲班注射液Argatroban Injection/Novastan2mL:10mg田辺三菱製薬株式会社未进口原研药品日本上市41-50玻璃酸钠滴眼液Sodium Hyaluronate Eye Drops/ Hyalein 0.1%(0.4ml:0.4mg)参天制药株式会社未进口原研药品日本上市41-51苯甲酸阿格列汀片Alogliptin Benzoate Oral Tablet/Nesina 6.25mg武田薬品工業株式会社未进口原研药品日本上市41-52苯甲酸阿格列汀片Alogliptin Benzoate Oral Tablet/Nesina 25mg武田薬品工業株式会社未进口原研药品日本上市41-53马来酸曲美布汀片Trimebutine Maleate Tablets / Cerekinon 100 mg田边三菱制药株式会社未进口原研药品日本上市41-54盐酸昂丹司琼片Ondansetron Hydrochloride Tablets/Zofran 4mgNovartis Pharmaceuticals Corp未进口原研药品德国上市41-55盐酸昂丹司琼片Ondansetron Hydrochloride Tablets/Zofran 8mgNovartis Pharmaceuticals Corp未进口原研药品德国上市1-33阿立哌唑口崩片Aripiprazole Orally Disintegrating tablets/Abilify10mgOtsuka Pharmaceutical Europe Ltd./Otsuka Pharmaceutical Netherlands B.V. 欧盟上市持证商发生变更,增加持证商Otsuka Pharmaceutical Netherlands B.V.10-6氨酚双氢可待因片Paracetamol and Dihydrocodeine Tartrate Tablets/Co-dydramol对乙酰氨基酚500mg;酒石酸双氢可待因10mgActavis UK Limited/Accord UK Ltd欧盟上市(上市国家:英国;产地:英国)持证商发生变更,增加变更后持证商Accord UK Ltd10-220枸橼酸托法替布片Tofacitinib Citrate Tablets/ Xeljanz5mgPF Prism C.V./Pfizer Limited/Pfizer Europe MA EEIG原研进口持证商发生变更,增加变更后持证商Pfizer Limited/Pfizer Europe MA EEIG12-4交沙霉素片Josamycin Tablets50mgAstellasPharma Inc./LTL ファーマ株式会社未进口原研药品持证商发生变更,增加持证商LTL ファーマ株式会社12-5交沙霉素片Josamycin Tablets200mgAstellasPharma Inc./LTL ファーマ株式会社未进口原研药品持证商发生变更,增加持证商LTL ファーマ株式会社22-104羟乙基淀粉130/0.4电解质注射液Hydroxyethyl Starch 130/0.4 and Electrolyte Injection/Volulyte 6% Soluzione per Infusione 500mlFresenius Kabi Deutschland GmbH/Fresenius Kabi ltaliaS.r.l.未进口原研药品持证商发生变更,增加持证商Fresenius Kabi ltaliaS.r.l.,不限定上市国23-267注射用头孢哌酮钠Cefoperazone Sodium For Injection/Cefobid2.0g(以头孢哌酮计)Pfizer Italia S.R.L./Pfizer, Spol. S R.O/Pfizer, Austria Ges.m.b.H未进口原研药品持证商发生变更,增加持证商Pfizer, Spol. S R.O; Pfizer, Austria Ges.m.b.H23-284碳酸镧咀嚼片Lanthanum Carbonate Chewable Tablets/FosrenolEq 750mg BaseShire Development LLC/Takeda Pharmaceuticals USA INC未进口原研药品持证商发生变更,增加持证商Takeda Pharmaceuticals USA INC23-286碳酸镧咀嚼片Lanthanum Carbonate Chewable Tablets/FosrenolEq 1gm BaseShire Development LLC/Takeda Pharmaceuticals USA INC未进口原研药品持证商发生变更,增加持证商Takeda Pharmaceuticals USA INC27-249氨己烯酸口服溶液用散Vigabatrin Powder for Oral Solution /Sabril;Sabrilex500mgSanofi未进口原研药品药品通用名称更正为氨己烯酸口服溶液用散,英文名称更正为Vigabatrin Powder for Oral Solution。
170825总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)

总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)颁布时间:20170825为做好仿制药质量和疗效一致性评价工作(以下简称一致性评价),现就有关事宜公告如下:一、为便于企业选择参比制剂,国家食品药品监督管理总局将把《关于落实〈国务院办公厅关于开展仿制药质量和疗效一致性评价的意见〉有关事项的公告》(2016年第106号)所附289个品种的原研企业药品列出清单并向社会公布,供企业选择参比制剂时参考。
清单分为已在中国境内上市和未在中国境内上市两类。
建议企业按以下顺序选择其一作为参比制剂备案:(一)原研药品:进口原研药品、经审核确定的原研企业在中国境内生产上市的药品、未进口原研药品;(二)在原研企业停止生产的情况下,可选择美国、日本或欧盟获准上市并获得参比制剂地位的药品。
对国家食品药品监督管理总局已公布的参比制剂,建议企业按照公布的参比制剂开展研究,未备案的无需再备案;对已公布的参比制剂存疑的,可向国家食品药品监督管理总局药品审评中心提出异议并说明理由,国家食品药品监督管理总局召开专家咨询委员会会议公开审议,并公开审议结果。
二、企业报国家食品药品监督管理总局备案的参比制剂全部向社会公开。
对国家食品药品监督管理总局未公布参比制剂的品种,由国家食品药品监督管理总局组织专家咨询委员会讨论后区别情况提出如下指导性意见:(一)可以确认符合参比制剂条件的;(二)存疑的;(三)明显不符合条件的。
对于(二)(三)两种情况是否继续进行研究或重新选择参比制剂,由企业自主决定并承担相应的责任。
三、企业自行从境外采购的参比制剂产品,在提交一致性评价资料时需提供购买凭证、产品包装及说明书等材料,或以其他适当方法证明所用参比制剂是标明企业的产品。
企业发现所使用的参比制剂产品为假冒产品的,应终止正在进行的研究工作,已申报的,应及时向国家食品药品监督管理总局药品审评中心报告并撤回一致性评价申请,视情况免于责任;监管部门发现企业使用的参比制剂产品为假冒产品的,应及时通报相关企业,终止审评审批;已批准上市的要撤销批准文件并向社会公开信息,责成企业作出解释并根据情况立案调查。
比卡鲁胺片人体生物等效性研究

比卡鲁胺片人体生物等效性研究孙莹莹;韦阳;王恪申;邵庆翔【期刊名称】《国际药学研究杂志》【年(卷),期】2010(037)001【摘要】目的研究国产比卡鲁胺片在健康人体的药代动力学特征,比较其与同规格进口片剂的生物等效性.方法 20名健康男性志愿者单剂量交叉口服两种比卡鲁胺片,在每次服药前,服药后1、3、4、6、9、12、16、20、24、28、32、36、40、48 h,3、7、14、2l、28 d分别采集血样,用HPLC法测定血浆中药物浓度,用3P97软件拟合药代动力学参数,并用SAS软件进行等效性检验.结果试验组口服国产比卡鲁胺片50 mg后,平均Cmax为691.50μg/L,平均Tmax为20.65 h,平均AUCo-∞为148 124μg·h/L,平均消除半衰期为127.46 h;对照组口服进口比卡鲁胺片Casodex 50 mg后,平均cmax为697.30μg·L-1,平均Tmax为24.10 h,平均AUCo-∞为153 782μg·h/L,平均消除半衰期为131.06 h.统计分析表明两种制剂生物等效,受试制剂与参比制剂的相对生物利用度为99.43%.结论两种比卡鲁胺片剂具有生物等效性.【总页数】4页(P43-46)【作者】孙莹莹;韦阳;王恪申;邵庆翔【作者单位】310013,杭州,浙江省医学科学院药物所药代动力学研究室;310013,杭州,浙江省医学科学院药物所药代动力学研究室;310013,杭州,浙江省医学科学院药物所药代动力学研究室;310013,杭州,浙江省医学科学院药物所药代动力学研究室【正文语种】中文【中图分类】R969.1【相关文献】1.盐酸舍曲林片、分散片人体生物等效性研究 [J], 郭喆;魏振满;丁晋彪;贺江平;顾景凯;张月梅2.氯氮平口腔崩解片与普通片的人体生物等效性研究 [J], 郑庆梅;廖日房;温预关3.罗红霉素片和胶囊在健康人体的药代动力学及人体生物等效性研究 [J], 林建阳;冯婉玉;陈之光4.坎地沙坦西酯片人体药动学和与必洛斯片的生物等效性及坎地沙坦吸收机制的研究 [J], 于万水;胡广云5.比卡鲁胺胶囊/片健康人体生物等效性研究(英文) [J], 王冰;王本杰;魏春敏;孔祥麟;郭瑞臣因版权原因,仅展示原文概要,查看原文内容请购买。
小康说药:比卡鲁胺片对前列腺癌有哪些作用?能提高生存率吗?

小康说药:比卡鲁胺片对前列腺癌有哪些作用?能提高生存率吗?比卡鲁胺是一种常用于前列腺相关问题的治疗用药,相信不少朋友对于这个药并不熟悉,或者可能在使用过程中存在一些用药疑惑。
所以这期小康将会结合相关的资料,帮助大家更好的了解使用这个药。
一、认识比卡鲁胺通用名称:比卡鲁胺商品名称:朝晖先、康士得、双益安等,虽然通用名和商品名叫法不同,但是都是属于同一种药物,功效作用都是类似的。
适应症:比卡鲁胺主要是和与促黄体生成素释放激素(LHRH)类似物或外科睾丸切除术联合应用于晚期前列腺癌的治疗。
对于局限在前列腺包膜以内(T1b、T2期)的癌可以行根治性前列腺切除术,也是治疗前列腺癌的最佳方法,但仅适于年龄较轻,能耐受手术的病人。
但在晚期(T3、T4期)前列腺癌以内分泌治疗为主,可行睾丸切除术,每月皮下注射一次促黄体释放激素类似物(LHRH-A)缓释剂,配合抗雄激素制剂如比卡鲁胺(tilealutamide)、氟硝丁酰胺(flutamide)等间歇治疗可提高生存率。
所以治疗前列腺癌时配合比卡鲁胺是能提高其晚期生存率的,并且内分泌疗法使用合理对于多数病人可望获得5年以上的生存率,这也是使用比卡鲁胺的主要目的。
二、比卡鲁胺的药理作用目前对于前列腺癌的研究表明,前列腺癌大多数为雄激素依赖型,即前列腺肿瘤的发生和发展与雄激素关系密切。
而比卡鲁胺属于非甾体类抗雄激素药物,它能和雄激素受体结合而不激活基因表达,从而抑制了雄激素的刺激,能诱导前列腺肿瘤的萎缩。
三、适用/禁忌人群1、适用人群晚期前列腺癌患者;2、禁忌人群过敏人群禁用;有中、重度肝损害的病人应慎用;3、关于孕妇、哺乳期妇女、老年人、儿童的使用比卡鲁胺禁用于妇女、儿童;老年人则正常使用。
四、常见用药疑问解答1、比卡鲁胺应该怎么使用?通常来说,成年男性包括老年人是一片(50mg),一天口服一次,并且治疗时应与LHRH类似物或外科睾丸切除术治疗同时开始。
但由于治疗应该个体化才能取得更好的效果,因此具体使用剂量应以个体情况以及医生的用药方案为准,不建议大家擅自用药。
药物一致性评价介绍

确定参比制剂遴选原则
参比制剂原则上首选原研药品,也可以选用国际公认的同种药品。 仿制药是指与被仿制药具有相同的活性成分、剂型、给药途径和治疗作
用的药品。
参比制剂是指用于仿制药质量和疗效一致性评价的对照药品,通常为被
仿制的对象,如原研药品或国际公认的同种药物。参比制剂应为处方工 艺合理、质量稳定、疗效确切的药品。
化学药品新注册分类实施前批准上市的其他仿制药,自首家品种通过 一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致 性评价;逾期未完成的,不予再注册。
8 | Presentation Title | Presenter Name | Date | Subject | Business Use Only
各国对于生物等效性的评价标准不同主要国家/地区 对于药代动力学参数的规定
国家/地区 90% CI
AUC0-t % Cmax%
加拿大 90-112
美国
80-125
欧盟90-1Leabharlann 1 澳大利亚 80-125
日本
80-125
中国
80-125
80-125 80-125 90-111 80-125 80-125 70-143
同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采
购等方面不再选用未通过一致性评价的品种。
通过一致性评价药品生产企业的技术改造,在符合有关条件的情况下,
可以申请中央基建投资、产业基金等资金支持。
7 | Presentation Title | Presenter Name | Date | Subject | Business Use Only
在相似的试验条件下单次或多次 给予相同剂量的试验药物后,受 试制剂中药物的吸收速度和吸收 程度与参比制剂的差异在可接受 范围内。生物等效性研究方法按 照研究方法评价效力,其优先顺 序为药代动力学研究、药效动力 学研究、临床研究和体外研究。
产城会-比卡鲁胺产业链研究报告

比卡鲁胺产业链研究报告珞珈投资发展(深圳)有限公司一、节点简介比卡鲁胺是由阿斯利康开収的一款抗肿瘤药物,主要用于前列腺癌的治疗,1995年上市销售,幵于1999年引入我国。
近几年比卡鲁胺整体市场规模维持较快增长速度,2016年样本医院市场规模达到2.94亿元,同比增长10.49%。
目前比卡鲁胺竞争格局良好,同时拥有制剂和原料批文的企业只有3家,振东制药的胶囊为独家剂型。
2016年振东制药的比卡鲁胺占据11.49%的市场份额,仅次于原研企业阿斯利康,未来进口药替代速度将会加快。
二、产业链图谱三、智能行业透视(1)行业规模行业规模数据来源:中泰证券标题:恒瑞医药:抗pd-1单抗拟纳入优先审评,前列腺癌靶向药进入III期临床发布时间:2018-04-16摘要:AR受体拮抗剂SHR3680拟用于去势治疗失败或者采用传统的激素治疗方法失败的前列腺癌的治疗。
目前全球已有比卡鲁胺(第一代)、恩杂鲁胺(第二代)和Apalutamide(新一代)等5个AR拮抗剂上市,2017年全球市场规模约32.77亿美元;国内仅有第一代AR拮抗剂获批上市,2017年市场规模约1.09亿美元。
(2)竞争格局竞争格局数据来源:雪球财经标题:userfield医药百股百评(7):复星医药发布时间:2019-01-06摘要:朝晖药业:比卡鲁胺2011年整合入万邦,2011-2016年销售收入CAGR 超过63%,目前市场排名第3位。
数据来源:新浪医药标题:阿比特龙高速增长或成前列腺癌领头羊发布时间:2017-08-11摘要:数据显示,2016国内重点城市场公立医院比卡鲁胺用药金额2.6亿元,同比上一年增长10.78%。
TOP3的生产厂商,阿斯利康的康士得片占据78.22%,山西振东制药股份的比卡鲁胺胶囊岩列舒占据12.31%,上海朝晖药业的朝晖先占8.45%,其它两面三家份额较少。
(3)发展历史与趋势发展历史与趋势数据来源:新浪医药标题:一文尽识:前列腺癌疾病&靶点&药物进展发布时间:2019-04-03摘要:比卡鲁胺,AZ研发,1995年2月在英国首次获批,1995年10月获美国FDA批准上市,1999年3月获日本PMDA批准上市,由AZ在美国上市销售,商品名为Casodex?。
比卡鲁胺项目报告

bicalutamide商品名:;进口商品中文名:;CAS Registry Number: 90357-06-5是英国Zeneca阿斯利康制药公司开发的一个较新的非甾体抗雄激素类药物,1995年在英国率先上市,我国于1999年批准进口比卡鲁胺片剂规格:50mg,进口许可证号为:X-1999-0358, 它是一个纯抗雄激素药物,作用特异性强,口服有效,给药方便,耐受性好,且有较长的半衰期;由于其独特的疗效,在国内外多用于晚期前列腺癌的联合治疗;目前,国外已核准150mg剂量的比卡鲁胺用于治疗早期前列腺癌;适应证:与黄体生成素释放激素LHRH类似物或外科睾丸切除术联合应用于晚期前列腺癌的治疗;作用特点:非甾体类抗雄激素药物;通过与前列腺癌细胞表面雄激素受体结合,抑制癌细胞摄取雄激素,阻断雄激素引起癌细胞增殖信号传导,从而抑制癌细胞增殖,导致前列腺萎缩;本品对前列腺癌的疗效优于氟他胺,耐受性好,不良反应少,对性功能很少产生不良影响;比卡鲁胺具有单纯的抗雄激素作用,无雄激素、雌激素、糖皮质激素或盐皮质激素等活性,几乎不影响血清黄体生成素和睾酮水平;本品是消旋物,其抗肿瘤激素作用仅仅出现在R-异构体上;口服吸收良好,食物对生物利用度无影响;口服50mg达峰时间长达48小时;血浆蛋白结合率高,血浆消除缓慢,半衰期约为一周;用法用量:口服,一日一次,一次1片50mg,用比卡鲁胺治疗应与LHRH类似物或外科睾丸切除术治疗同时开始;不良反应:比卡鲁胺一般来说有良好的耐受性,少有因不良反应停药的情况,本品主要的副反应为其药理作用而引起的某些预期反应,包括面色潮红、瘙痒、乳房触痛和男性乳房女性化,可随睾丸切除术减轻;市场价格:上市国家:阿根廷1999,澳大利亚1996,巴西1999,欧盟1997,冰岛2000,日本1999,挪威2000,南非2000,泰国1998,瑞典2000,意大利1996,丹麦1996,西班牙1996,爱尔兰1996,美国1996,英国1995国内生产厂家:进口厂家:在审评:原料药:国内有山西振东,浙江海正;TEVA的产品目录上没有,但是曾申报过制剂,可以和teva进一步沟通咨询;撤市信息:加拿大,奥地利,希腊,葡萄牙,英国,150mg剂量的比卡鲁胺撤出市场;由于安全性问题,有报道称150mg的比卡鲁胺会增加致死率;专利情况:原研专利:1)专利号:EP 100172没有进入中国专利题目:Amide derivatives 酰胺衍生物专利申请:专利权人:Imperial Chemical Industries PLCLondon,England摘要:化合物专利在中国申请的专利:2)专利号:无权专利题目:用于递送增加的稳态血浆水平的比卡鲁胺PCT进入国家阶段日期:专利权人:阿斯利康瑞典摘要:3)专利号:专利题目:纯化和分离rac-比卡鲁胺的方法PCT进入国家日期:专利权人:特瓦药厂还有8个关于比卡鲁胺在中国的专利见附件;比卡鲁胺市场:前列腺癌在欧美的发病病率较高,为男性死亡率第二的癌症,在全球七大市场有约180万前列腺癌患者,因此比卡鲁胺的欧美市场销售较好,阿斯利康公司的Casodex在2003年的全球销售就达到了亿美元,在激素类抗癌药物中占据重要在位置;前列腺癌在我国的发病率较低,据2003年的癌症死亡率统计,前列腺癌不在十大发病率最高的前十位癌症之列;较早期的对北京、上海前列腺癌死亡率的统计显示在男性中的死亡率约为100,000,我们估且按每10万男性中1人患前列腺癌,则我国每年约有6500人死于前列腺癌;阿斯利康公司的比卡鲁胺片商品名:康士得1999年进口,规格为50mg/ 片,每盒28片,价格为1600元左右,在2002-2005年康士得在样本医院中的销售金额在100万左右徘徊没有显着增长,在国内的抗肿瘤用药市场属于是小品种;目前关于前列腺癌的治疗方法简介近代,前列腺癌的发病率逐年上升,但真正通过手术彻底切除肿瘤者却寥寥无几,在有关前列腺癌的病因学说中,最被推崇的一种,便是性激素学说;即以睾酮为代表的雄激素,对前列腺发生了异乎寻常的刺激作用,加强了前列腺组织内上皮细胞的不正常生长过程,最终发展成癌症;在此学说的基础上,当今推出了治疗前列腺癌的“杀手锏”,即全力阻断雄激素疗法;所谓全力阻断雄激素,指的是千方百计地“封杀”雄激素对前列腺的刺激,采取各种方法或药物,把人体内的雄激素水平减到最低限度,甚至进入“零存在”状态,或者大力对抗雄激素,让其发挥“零作用”;可采用的阻断雄激素药物有如下三大类:第一类:抗雄激素类;有如下几种:1.比卡鲁胺商品名康士得也属于非甾体类抗雄激素药物;常用剂量为每次100毫克,一日1次,口服;或每次50毫克,一日2次口服;康士得的优点是无明显肝脏损害,但仍有乳房增大、面色潮红等不良反应;2. 氟硝丁酰胺商品名:氟他胺等属于非甾体类抗雄激素药物;常用剂量为每次250毫克,一日3次,口服;主要不良反应是轻度肝脏损害,表现为氨基转移酶升高,停药后可恢复;此外,还偶有乳房增大、恶心、呕吐等现象;第二类:黄体生成素释放激素类;有如下几种:1. 醋酸亮丙瑞林商品名抑那通、利普安等此药开始使用时,血液内睾酮反而会增加,但使用一阶段以后,可以完全阻止睾丸生产睾酮;常用剂量为每次毫克,每月1次,皮下注射;由于开始使用时睾酮反而增加,病人症状会一度加重,例如骨骼疼痛明显,应加以注意;以后随着睾酮分泌受到抑制,症状又会缓解;此类药物价格昂贵;2. 戈舍瑞林商品名诺雷德一般用于晚期前列腺癌病人;是生物膜微粒胶囊,常用剂量为每次毫克,每月1次,采用注射植入的方式,种植于腹壁皮下组织内;或每次毫克,每3个月1次,同样方式植入腹壁皮下;偶有性功能减退、皮疹、潮红等不良反应;同样,此类药物价格也十分昂贵;第三类:雌激素类;有如下几种:1. 己烯雌酚:目前已经较少应用;2.溴醋己烷啡酚由于目前国内多数前列腺癌病人失去了行根治性前列腺切除术的机会,所以仍以施行双侧睾丸切除术者为多;即使施行了双侧睾丸切除,仅仅是阻止了睾丸生产睾酮这一个环节,阻断了体内占极大部分的雄激素,但来自双侧肾上腺生产的少量雄激素依然存在,问题并没有彻底解决;因此在作完双侧睾丸切除术后,还得长期服用氟硝丁酰胺等抗雄激素药物,有时甚至是终身服用,这对于全力阻断雄激素来说,才能保证万无一失;。
仿制药质量和疗效一致性评价品种分类的指导意见

附件仿制药质量和疗效一致性评价品种分类的指导意见(征求意见稿)为了进一步推动仿制药质量和疗效一致性评价(以下简称一致性评价)工作的开展,现对289 品种的分类情况提出如下指导意见:一、原研进口品种。
无需开展一致性评价,经仿制药质量和疗效一致性评价专家委员会审核确定和食品药品监管总局发布后,可选择为参比制剂。
二、原研企业在中国境内生产上市的品种(一)上市前按照与原研药品质量和疗效一致原则申报和审评的, 可列为参比制剂。
由企业在规定时间内,参照《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)》,向食品药品监管总局一致性评价办公室提交相关资料及证明性文件。
一致性评价办公室安排食品药品监管总局药品审评中心(以下简称药审中心)审核并出具意见,需进行研制现场检查、生产现场检查、临床试验核查的,由药审中心提出,食品药品监管总局食品药品审核查验中心具体实施,并反馈给药审中心。
依据药审中心意见,一致性评价办公室提出审批意见,报食品药品监管总局审核发布。
所提交资料不足以证明与原研药品质量和疗效一致的,可补充相关试验研究。
(二)未按照与原研药品质量和疗效一致原则申报和审评的,需按照有关规定开展一致性评价。
三、进口仿制品种。
上市前按照与原研药品质量和疗效一致原则申报和审评的,按照上述第二条第一款规定的程序执行;上市前未按照与原研药品质量和疗效一致原则申报和审评的,需按有关规定开展一致性评价。
四、国内仿制品种。
上市前按照与原研药品质量和疗效一致原则申报和审评的,按照上述第二条第一款规定的程序执行;未按照与原研药品质量和疗效一致原则申报和审评的,需按照有关规定开展一致性评价。
五、改规格、改剂型、改盐基的仿制品种需按照食品药品监管总局发布的相关指导原则开展一致性评价。
(一)改规格品种。
按照《仿制药质量和疗效一致性评价改规格药品评价一般考虑》(待发布)的要求,对不改变用法、用量、适应症的,且在治疗剂量范围内,药物呈现线性药代动力学特征,以改规格药品和参比制剂以相同剂量给药(单次给药剂量不超过最大给药剂量),进行生物等效性试验;对不满足上述条件的,应参照《仿制药质量和疗效一致性评价临床有效性试验一般考虑》(待发布,以下简称临床有效性试验一般考虑)的要求,开展临床有效性试验研究。
通过视同通过质量和疗效一致性评价仿制药第三批
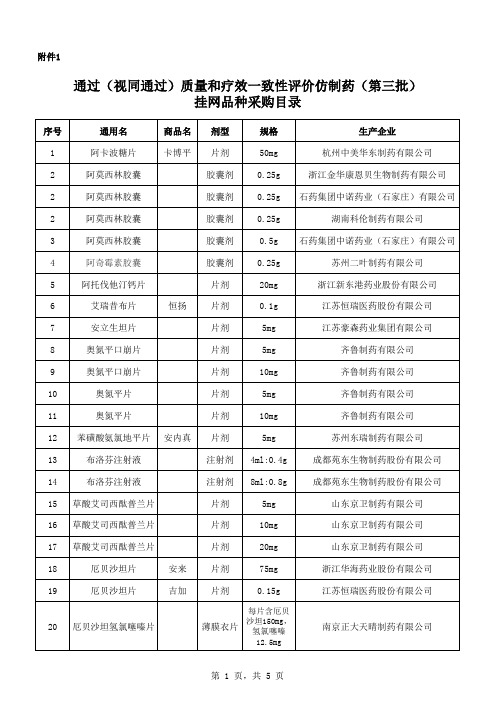
胶囊剂 0.15g
浙江华海药业股份有限公司
浙江华海药业股份有限公司 江苏恒瑞医药股份有限公司
山东裕欣药业有限公司 浙江华海药业股份有限公司
浙江华海药业股份有限公司
江苏德源药业股份有限公司 广东华南药业集团有限公司 上海上药中西制药有限公司 重庆药友制药有限责任公司 四川科伦药业股份有限公司 重庆药友制药有限责任公司 四川科伦药业股份有限公司
齐鲁制药有限公司
江苏恒瑞医药股份有限公司
江苏恒瑞医药股份有限公司
江苏恒瑞医药股份有限公司
四川科伦药业股份有限公司 广东东阳光药业有限公司
浙江华海药业股份有限公司 深圳信立泰药业股份有限公司 浙江华海药业股份有限公司
第 2 页,共 5 页
附件1
通过(视同通过)质量和疗效一致性评价仿制药(第三批) 挂网品种采购目录
浙江华海药业股份有限公司
51
缬沙坦片
片剂
以缬沙坦 (C24H29N5 O3)计80mg
52
缬沙坦片
53
盐酸氨溴索片
贝莱
53
盐酸氨溴索片
54
盐酸多奈哌齐片
55
盐酸多奈哌齐片
56 盐酸二甲双胍缓释片
片剂 片剂 片剂 片剂
片剂
片剂
以缬沙坦 (C24H29N5
O3)计 160mg
30mg
30mg
按 C24H29NO3 ·HCl计
咀嚼片
上海安必生制药有限公司(药品上市许
4mg
可持有人);杭州民生滨江制药有限公
司(受托生产企业)
41 孟鲁司特钠咀嚼片
咀嚼片
上海安必生制药有限公司(药品上市许
5mg
可持有人);杭州民生滨江制药有限公
比卡鲁胺致心力衰竭1例

比卡鲁胺致心力衰竭1例
王君君;石红兵;赵蓉;孙柏;胡文蔚
【期刊名称】《中国现代医生》
【年(卷),期】2024(62)4
【摘要】比卡鲁胺是非甾体类抗雄激素药物,常与黄体生成素释放激素类似物联合用于晚期前列腺癌的治疗。
本文报道1例服用比卡鲁胺后致心力衰竭患者,旨在提示应加强临床用药前的心功能评估,避免心力衰竭等严重不良事件的发生。
【总页数】2页(P131-132)
【作者】王君君;石红兵;赵蓉;孙柏;胡文蔚
【作者单位】苏州大学附属第三医院肿瘤科;苏州大学附属第三医院心血管内科【正文语种】中文
【中图分类】R737
【相关文献】
1.比卡鲁胺致肝损害一例并文献复习
2.比卡鲁胺致血小板减少1例
3.比卡鲁胺与氟他胺治疗晚期去势抵抗性前列腺癌的对比
4.比卡鲁胺联合手术去势及经尿道双极等离子前列腺电切术治疗晚期前列腺癌致下尿路梗阻患者的回顾性分析
5.基因多态性对比卡鲁胺药代动力学的影响并比较不同剂型比卡鲁胺的药代动力学特征
因版权原因,仅展示原文概要,查看原文内容请购买。
国产十大仿制药龙头股票有哪些

国产十大仿制药龙头股票有哪些国产十大仿制药龙头股票目前来看有以下几只:1. 恒瑞医药(600276):恒瑞医药是国内领先的仿制药企业,主要生产抗肿瘤、抗感染等药品。
公司市值高达数千亿元,是国内仿制药行业的龙头股。
2. 石药集团(600422):石药集团是中国最早的制药企业之一,也是国内医药工业的龙头企业。
公司主要生产抗生素、抗癌药等产品,具有较强的研发和生产能力。
3. 上海医药(601607):上海医药是国内最大的医药流通企业之一,也是仿制药行业的领军企业之一。
公司业务涵盖药品流通、制剂生产、研发创新等。
4. 华东医药(000963):华东医药是国内知名的医药贸易企业,也是仿制药行业的重要参与者之一。
公司主要从事医药产品贸易、研究开发等业务。
5. 格力地产(002309):格力地产是中国知名的医药产业投资公司,也是仿制药行业的知名企业之一。
公司主要从事医药产品研发、生产和销售等业务。
6. 康泰生物(300601):康泰生物是国内领先的生物制品企业,主要从事疫苗、血液制品等产品的研发、生产和销售。
公司具备较强的研发和生产实力。
7. 信达生物(300624):信达生物是国内领先的生物制品企业,主要从事疫苗和生物制品的研发、生产和销售。
公司具有较强的研发实力和市场竞争力。
8. 广济药业(000952):广济药业是国内知名的医药企业,主要从事仿制药和原研药的研发、生产和销售。
公司具备较强的研发和生产能力。
9. 华北制药(600812):华北制药是国内龙头药企,主要从事仿制药和创新药的研发、生产和销售。
公司业务覆盖抗肿瘤、抗感染等领域。
10. 云南白药(000538):云南白药是中国知名的中成药企业,也是国内仿制药行业的重要参与者之一。
公司主要从事中药的研发、生产和销售。
+。
比卡鲁胺治疗雄激素非依赖性前列腺癌的应用及疗效评价

53
三阶梯止痛疗法中西药的镇痛效果。观察组镇痛后的 生活质量评分显著高于对照组,观察组患者疼痛改善 效果优于对照组,观察组患者被疼痛困扰引起的情绪 改变、睡 眠 障 碍 等 问 题 减 少,所 以 生 活 质 量 得 到 提高 。 [10]
关键词 雄激素非依赖性前列腺癌,比卡鲁胺,毒副反应,疗效分析 中图分类号:R979.1+9 文献标识码:A 文章编号:10065687(2018)03005303
雄激素非依赖性前列腺癌(AIPCa)又称去势后复 发前列腺癌,为欧美国家男性群体最常见的一种恶性 肿瘤,是当下前列腺癌临床治疗中的难症之一[1]。早 期前列腺癌为雄激素依赖性前列腺癌(AIPC),但经过 14~30个月保守治疗后,ADPC逐渐发展成对内分泌 治疗无效的 AIPCa,AIPCa发病机制复杂,当下临床上
收稿日期:20180419 通讯作者:刘晓聪,E-miai:745118789@qq.com。
尚未作出定论,普遍认为其和肿瘤异质性、雄激素基因 突变、癌基因表达异常以及信号传导通路改变相关[2]。 由于激素敏感型 AIPC对改变激素治疗方式具有一定 敏感性,故此,二线内分泌治疗成为该病首选方案。比 卡鲁胺为常用的一种二线内分泌治疗药物,在欧美国 家 AIPCa患者临床治疗中取得一定效果。但国内相关
观察[J].中国生化药物杂志,2014,34(2):104-105 7 明学海.复方苦参注射液治疗胃癌疼痛的临床观察[J].湖北中医杂
志,2013,35(7):17-18 8 吴喜庆,张敏.癌性疼痛的中医研究进展[J].现代中西医结合杂志,
2016,25(3):339-342 9 赵春花.复方苦参注射液联合止痛药物治疗中晚期癌痛[J].天津药
《化学仿制药参比制剂目录(第四十五批)》(征求意见稿)

Indivior Europe Limited
未进口原研药品
欧盟上市
45-43
丁丙诺啡纳洛酮舌下片
Buprenorphine Hydrochloride and Naloxone Hydrochloride Sublingual Tablets
丁丙诺啡8mg/纳洛酮2mg(均以碱基计)
原研进口
45-2
恩他卡朋双多巴片(Ⅱ)
Entacapone,Levodopa and Carbidopa Tablets(Ⅱ)
左旋多巴100mg,卡比多巴25mg,恩他卡朋200mg
Orion Corporation
国内上市的原研药品
原研进口
45-3
结构脂肪乳注射液(C6~24)
Structural Fat Emulsion Injection(C6~24)/Structolipid(力文)
125mg
Actelion Pharmaceuticals Ltd
未进口原研药品
美国橙皮书
45-33
盐酸肾上腺素注射液/肾上腺素注射液
Epinephrine Injection/Epinephrine(Copackaged)
1mg/10mL(0.1mg/mL)
Hospira Inc
未进口原研药品
美国橙皮书
Indivior Europe Limited
未进口原研药品
欧盟上市
45-44
盐酸氮卓斯汀滴眼液
Azelastine Hydrochloride Eye Drops/Allergodil
0.5mg/ml(6ml)
MEDA Pharma GmbH & Co. KG
国家药监局关于发布仿制药参比制剂目录(第三十九批)的通告

国家药监局关于发布仿制药参比制剂目录(第三十九
批)的通告
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2021.03.01
•【文号】国家药品监督管理局通告2021年第20号
•【施行日期】2021.03.01
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药品监督管理局通告
2021年第20号
国家药监局关于发布仿制药参比制剂目录(第三十九批)的
通告
经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第三十九批)。
特此通告。
附件:仿制药参比制剂目录(第三十九批)
国家药监局
2021年3月1日附件
仿制药参比制剂目录(第三十九批)。
天津市医疗保障局关于执行第五批国家组织药品集采品种比卡鲁胺片替补供应结果的通知

天津市医疗保障局关于执行第五批国家组织药品集采品种比卡鲁胺片替补供应结果的通知
文章属性
•【制定机关】天津市医疗保障局
•【公布日期】2022.08.08
•【字号】津医保办发〔2022〕41号
•【施行日期】2022.08.08
•【效力等级】地方规范性文件
•【时效性】现行有效
•【主题分类】医政医管
正文
天津市医疗保障局关于执行第五批国家组织药品集采品种比
卡鲁胺片替补供应结果的通知
津医保办发〔2022〕41号
各有关单位:
根据《国家组织药品联合采购办公室关于确定第五批国家组织药品集采品种比卡鲁胺片部分地区替补供应企业的通知》要求,我市比卡鲁胺片供应企业调整为山西振东制药股份有限公司。
落实国家组织药品集中带量采购相关配套政策按照《关于落实第五批国家组织药品集中采购和使用工作的通知》(津药集采发【2021】7号)执行。
2022年8月8日。
比卡鲁胺 机制

比卡鲁胺的机制比卡鲁胺(Bicalutamide)是一种非甾体类抗雄激素药物,广泛用于治疗前列腺癌。
它通过抑制雄激素的作用而达到抗癌的效果。
本文将详细介绍比卡鲁胺的机制。
雄激素和前列腺癌在理解比卡鲁胺的机制之前,首先需要了解雄激素和前列腺癌的关系。
雄激素是男性体内的主要性激素,其中睾酮是最主要的雄激素。
睾酮通过与细胞内的雄激素受体(AR)结合,进入细胞核并激活相应的基因表达,从而发挥作用。
前列腺癌是一种依赖于雄激素的肿瘤,也被称为雄激素依赖性前列腺癌。
在前列腺癌细胞中,雄激素受体异常活跃,导致细胞增殖和生长。
因此,抑制雄激素受体的活性成为治疗前列腺癌的重要策略之一。
比卡鲁胺的作用机制比卡鲁胺是一种选择性的非甾体类雄激素受体拮抗剂(Antiandrogen),它通过与雄激素受体结合,阻断睾酮与受体的结合,从而抑制雄激素受体的活性。
具体来说,比卡鲁胺与雄激素受体的结合是可逆的,它结合在受体的配体结合口袋上,阻止睾酮进入受体并激活基因表达。
这种结合可以竞争性地取代睾酮与受体的结合,从而抑制雄激素受体信号通路的激活。
比卡鲁胺的效果比卡鲁胺通过抑制雄激素受体的活性,达到以下效果:1.抑制前列腺癌细胞的增殖:前列腺癌细胞依赖于雄激素的刺激生长,比卡鲁胺的抗雄激素作用可以抑制细胞增殖,减缓肿瘤的生长速度。
2.降低前列腺特异性抗原(PSA)水平:PSA是前列腺癌常用的生物标志物,比卡鲁胺治疗可以降低血清中的PSA水平,作为治疗效果的指标之一。
3.缓解前列腺癌相关症状:前列腺癌可以导致尿频、尿急、排尿困难等症状,比卡鲁胺的治疗可以缓解这些症状,提高患者的生活质量。
比卡鲁胺的用法和副作用比卡鲁胺常用于前列腺癌的治疗,通常以口服药物的形式使用。
剂量和疗程根据患者的具体情况而定,一般需要长期使用。
与其他药物一样,比卡鲁胺也有一些副作用。
常见的副作用包括乳房增大、乳房敏感、性功能障碍等。
少数患者可能会出现肝功能异常、皮疹、恶心、呕吐等不良反应。
昂利康:关于公司头孢克洛缓释片通过仿制药一致性评价的公告

证券代码:002940 证券简称:昂利康公告编号:2020-047浙江昂利康制药股份有限公司关于公司头孢克洛缓释片通过仿制药一致性评价的公告近日,浙江昂利康制药股份有限公司(以下简称“公司”或“本公司”)通过国家药品监督管理局网站获悉,本公司头孢克洛缓释片(规格0.375g)已通过仿制药质量和疗效一致性评价。
现将有关情况公告如下:一、药品基本信息药品名称:头孢克洛缓释片规格:0.375g(按C15H14ClN3O4S计)批准文号:国药准字H20020456注册分类:化学药品申请人:浙江昂利康制药股份有限公司申请事项:仿制药质量和疗效一致性评价受理号:CYHB1950388国审批结论:本品通过仿制药质量和疗效一致性评价截至本公告披露日,国家药品监督管理局网站已公示,公司暂未收到批件。
二、药品的其他相关信息头孢克洛缓释片是第二代头孢菌素类药物,原研厂商为美国礼来公司。
该药品临床适用于敏感病原菌所致的下列感染:急性支气管炎和慢性支气管炎急性发作、咽炎、扁桃体炎、肺炎、鼻窦炎、单纯性下尿路感染、皮肤软组织感染。
头孢克洛缓释片已被列入《国家医保目录(2019年版)》,类别为乙类药品。
公司就该药品于2019年04月22日向国家药品监督管理局药品审评中心递交补充申请,于2019年05月21日获得受理。
公司为头孢克洛缓释片国内首家通过仿制药质量和疗效一致性评价的企业。
截至本公告披露日,公司对该药品一致性评价累计研发投入金额约为人民币1,731.61万元(未经审计)。
三、对公司的影响公司头孢克洛缓释片(0.375g)通过一致性评价,有利于提升该产品的市场竞争力,同时为公司后续产品开展仿制药一致性评价工作积累经验。
由于医药行业的特殊性,药品的销售容易受到国家政策、市场环境变化等因素影响,具体销售情况存在较大不确定性。
敬请广大投资者审慎决策,注意投资风险。
特此公告。
浙江昂利康制药股份有限公司董事会2020年07月25日。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
股票简称:海正药业股票代码:600267 公告编号:临2021-20号债券简称:16海正债债券代码:136275
浙江海正药业股份有限公司
关于比卡鲁胺片通过仿制药一致性评价的公告
近日,浙江海正药业股份有限公司(以下简称“公司”或“海正药业”)收
到国家药品监督管理局(以下简称“国家药监局”)核准签发的比卡鲁胺片的《药
品补充申请批准通知书》,公司的比卡鲁胺片已通过仿制药质量和疗效一致性评
价。
现就相关情况公告如下:
一、该药品的基本情况
药品名称:比卡鲁胺片
剂型:片剂
规格:50mg
注册分类:化学药品
上市许可持有人:浙江海正药业股份有限公司
生产企业:浙江海正药业股份有限公司
受理号:CYHB2050263
通知书编号:2021B00499
原药品批准文号:国药准字H20073877
申请内容:一致性评价申请
审批结论:根据《中华人民共和国药品管理法》、《国务院关于改革药品医疗
器械审评审批制度的意见》(国发[2015]44号)和《关于仿制药质量和疗效一致
性评价工作有关事项的公告》(2017年第100号)规定,经审查,本品通过仿制
药质量和疗效一致性评价。
二、该药品的相关情况
比卡鲁胺片主要适用于晚期前列腺癌的治疗。
比卡鲁胺片原研产品康士得由阿斯利康公司研发,目前为国家医保目录乙类品种。
目前,国内主要生产厂商有上海朝晖药业有限公司、上海复旦复华药业有限公司等。
据统计,比卡鲁胺片2020年全球销售额约为39,494.92万美元,其中中国销售额约为11,244.81万美元(数据来源于IMS数据库)。
2020年5月7日,国家药监局受理了公司递交的比卡鲁胺片一致性评价申请。
截至目前,公司针对该药品仿制药质量和疗效一致性评价已投入约1,000.76万元人民币。
三、对上市公司影响及风险提示
根据国家相关政策,通过一致性评价的药品品种在医保支付及医疗机构采购等领域将获得更大的支持力度,因此公司的比卡鲁胺片通过仿制药一致性评价,有利于扩大该药品的市场份额,提升市场竞争力。
由于医药产品的行业特点,各类产品/药品的具体销售情况可能受到国家政策、市场环境变化等因素影响,具有较大不确定性,敬请广大投资者注意投资风险。
特此公告。
浙江海正药业股份有限公司董事会
二○二一年三月十日。
