2018第31届我国化学奥林匹克(初赛)试题和答案解析(WORD版)
最新-2018年全国高中化学竞赛(安徽赛区)初赛试题002精品

最新-2018年全国⾼中化学竞赛(安徽赛区)初赛试题002精品2018年全国⾼中化学竞赛(安徽赛区)初赛试题注意:答案必须写在答题卷上,写在试题卷上⽆效......................。
⼀、本题包括25⼩题,每⼩题2分,共50分。
每⼩题只有⼀个选项符合题意。
每⼩题有1个或2个选项符合题意。
若该题只有1个选项合题意,多选或错选均不得分。
若该题有2个选项合题意,选对1个得1分,选对2个得2分;选错1个,该题不得分。
⒈最近发现了⼀种新的氧微粒O4。
对于这种新微粒,下列说法正确的是A.它是氧的⼀种新的同位素B.它的摩尔质量为64C.它是氧的⼀种新的同素异形体D.它的氧化性⽐差O3。
⒉下列电池中,可以作为⼼脏起搏器的能源的是A.Li电池B.⼲电池C.Ni钮扣电池D.Ag电池⒊A n+、B n-、C三种主族元素粒⼦具有相同的电⼦层结构,关于它们的叙述正确是A.原⼦序数:C>B>AB.粒⼦半径:B n-< A n+C.C是稀有⽓体的原⼦D.原⼦半径:A⒋下列各组离⼦在溶液中能⼤量共存的是A.H+、Na+、I-、NO3-B.H+、NH4+、Fe3+、SO42-C.H+、S2O32-、Ag+、NO3-D.OH-、SO32-、SO42-、Na+⒌A、B两元素的原⼦分别得到2个电⼦形成稳定结构时,A放出的能量⼤于B放出的能量;C、D两元素的原⼦分别失去1个电⼦形成稳定结构时,D吸收的能量⼤于C吸收的能量。
A、B、C、D能形成最稳定化合物的化学式为A.D2AB.C2BC. C2AD.D2B⒍取等质量的四种有机物:①纤维素、②环⼰烷、③苯、④⼄酸,分别在过量的氧⽓中完全燃烧,其耗氧量由⼩到⼤的排列正确的是A.④③②①B.④①③②C.②③①④D.②①④③⒎下列化合物中,属于⾮还原糖的是(不能与斐林试剂和吐伦试剂反应)A.蔗糖B.乳糖C.葡萄糖D. 麦芽糖⒏从化合物⾹兰素(HOOCH3CHO)的结构式推测,它不具有的化学性质是A.可以燃烧B.与FeCl3溶液反应C.可与NaHCO3反应放出CO2D.可使KMnO4酸性溶液褪⾊⒐下列反应中,属于消去反应的是A.溴⼄烷与NaOH(aq)共热B.溴⼄烷与NaOH醇溶液共热C.⼄醇与浓硫酸在140℃共热D.⼄醇与⼄酸在H2SO4催化下反应⒑NO的⾎管舒张作⽤是由于它和⼀种含⾎红素的酶中的铁离⼦配位⽽推动⼀系列变化造成的。
2017年第31届中国化学奥林匹克(初赛)试题及答案(WORD版)

第31 屆中國化學奧林匹克(初賽)試題(2017 年8 月27 日9:00 ~ 12:00)●競賽時間3 小時。
遲到超過半小時者不能進考場。
開始考試後1 小時內不得離場。
時間到,把試卷(背面朝上)放在桌面上,立即起立撤離考場。
●試卷裝訂成冊,不得拆散。
所有解答必須寫在指定の方框內,不得用鉛筆填寫。
草稿紙在最後一頁。
不得持有任何其他紙張。
●姓名、報名號和所屬學校必須寫在首頁左側指定位置,寫在其他地方者按廢卷論處。
●允許使用非編程計算器以及直尺等文具。
第 1 題(10 分)根據條件書寫化學反應方程式。
1-1工業上從碳酸氫銨和鎂硼石[Mg2B2O4(OH)2]在水溶液中反應制備硼酸。
1-2從乏燃料提取鈈元素の過程中,利用亞硝酸鈉在強酸溶液中將Pu3+氧化為Pu4+。
1-3N aBH4與氯化鎳(摩爾比2:1)在水溶液中反應,可得到兩種硼化物:硼化鎳和硼酸(摩爾比1:3)。
1-4通過KMnO4和H2O2在KF-HF 介質中反應獲得化學法制F2の原料K2MnF6。
1-5磷化氫與甲醛の硫酸溶液反應,產物僅為硫酸鏻(鹽)。
第 2 題(10 分)2-1氨晶體中,氨分子中の每個H 均參與一個氫鍵の形成,N 原子鄰接幾個氫原子?1摩爾固態氨中有幾摩爾氫鍵?氨晶體融化時,固態氨下沉還是漂浮在液氨の液面上?2-2P4S5是個多面體分子,結構中の多邊形雖非平面狀,但仍符合歐拉定律,兩種原子成鍵後價層均滿足8 電子,S の氧化數為-2。
畫出該分子の結構圖(用元素符號表示原子)。
2-3水煤氣轉化反應[CO(g) + H2O(g) → H2(g) + CO2(g)]是一個重要の化工過程,已知如下鍵能(BE)數據:BE(C≡O) =1072 kJ·mol-1,BE(O-H) = 463 kJ·mol-1,BE(C=O) = 799 kJ·mol-1,BE(H-H) = 436 kJ·mol-1估算反應熱,該反應低溫還是高溫有利?簡述理由。
2018年中国化学奥林匹克(初赛)试题解析

A. Ge B. GeS2 C. GeS
D. GeO2
G. GeHPO3 H. Ge(OH)2
选 CE
解析:C 和 E 中有共轭双键存在,由于共轭 π 键的反应活性较高,且易受到紫外辐射使得电子 跃迁至 π*轨道,所以 C 和 E 都是不耐臭氧,不耐紫外光的。
2-3-2 合成高分子主要材料分为塑料、纤维和橡胶三大类,下列高分子中与 EPDM 同为橡胶的 是:
F 聚乙烯
Hale Waihona Puke G 聚丙烯氰H 反式聚异戊二烯
I 聚异丁烯
选 H、I
解析:对于高中基础高分子化学常识的考察
第 3 题(12 分)
为纪念门捷列夫发现元素周期表 150 周年,国际纯粹和应用化学联合会将 2019 年设为“国 际化学元素周期表年”。门捷列夫预言了多种当时未知的元素,A 即为其中一种。
将含元素 A 的硫化物矿在 N2 气氛中 800oC 处理,分解产物中有 A 的硫化物 B;随后升温 至 825oC 并向体系中同入氨气,得到红色化合物 C,C 溶于发烟硝酸得到白色沉淀 D。经过滤 洗涤,D 在 600oC 与 CoCl2 反应,产物冷却后得到液体 E,E 遇水生成 D,在 E 的 6 mol·L-1 盐 酸溶液中通入 H2S 得到沉淀 B;将 D 溶于 NaOH 溶液,用硝酸调节 H+浓度至约 0.3 mol·L-1,
第31届中国化学奥林匹克(初赛)试题解析(一)

第31届中国化学奥林匹克(初赛)试题解析(一)常泰维;戴昱民;方润亭;李宇轩;孙斯达;孙泽昊;王泽淳;曾承禹;张宇婷【摘要】详细分析并解答了第31届中国化学奥林匹克(初赛)试题.对于每一道题目,我们都给出了详尽的讨论,引导读者综合运用所学的化学知识,通过推理、演算、论证等方法顺利解题.对于特定的题目,我们还给出了相关的科学背景介绍与知识拓展,鼓励读者了解题目背后的科学思想,感受化学学习与科研的乐趣.%The questions in the 31st Chinese Chemistry Olympiad (Preliminary Test) are solved in detail. The manuscript not only provides systematic analyses for all questions, but also guides the readers through the solutions in an intuitive manner. For selected questions, rich introduction to the scientific backgrounds and bibliographical resources are also included.【期刊名称】《大学化学》【年(卷),期】2018(033)001【总页数】9页(P73-81)【关键词】化学竞赛;试题解析【作者】常泰维;戴昱民;方润亭;李宇轩;孙斯达;孙泽昊;王泽淳;曾承禹;张宇婷【作者单位】北京大学化学与分子工程学院,北京 100871;北京大学化学与分子工程学院,北京 100871;北京大学化学与分子工程学院,北京 100871;北京大学化学与分子工程学院,北京 100871;北京大学化学与分子工程学院,北京 100871;北京大学化学与分子工程学院,北京 100871;北京大学化学与分子工程学院,北京 100871;北京大学化学与分子工程学院,北京 100871;北京大学化学与分子工程学院,北京100871【正文语种】中文【中图分类】G64;O6第1题题目(10分)根据条件书写化学反应方程式。
第31届中国化学奥林匹克初赛试题

1、下列哪种物质在标准状况下是气体,且常用于实验室制备氧气?A、高锰酸钾B、过氧化氢C、氯酸钾D、二氧化锰(解析:高锰酸钾、氯酸钾在加热条件下可以分解产生氧气,但它们本身在标准状况下是固体。
二氧化锰是催化剂,不直接用于制备氧气。
过氧化氢在常温下为液体,但在标准状况下(即0℃、101.325kPa)为气体,且可以通过分解反应制备氧气。
因此,正确答案是B。
)(答案)B2、下列哪种元素在自然界中不存在游离态,只以化合态存在?A、氢B、氧C、钠D、铁(解析:氢和氧在自然界中可以以游离态(即单质形式)存在,如氢气、氧气。
铁也可以以游离态存在,如铁矿石中的金属铁。
而钠是一种非常活泼的金属,在自然界中极易与氧、水等反应,因此只以化合态存在,如氯化钠(食盐)。
所以,正确答案是C。
)(答案)C3、下列哪种物质是常见的有机溶剂,且能与水任意比例互溶?A、苯B、四氯化碳C、乙醇D、乙酸乙酯(解析:苯、四氯化碳和乙酸乙酯都是有机溶剂,但它们与水不互溶,混合后会分层。
乙醇是有机溶剂,且能与水以任意比例互溶。
因此,正确答案是C。
)(答案)C4、下列哪种物质是强酸,且在水中能完全电离?A、醋酸B、盐酸C、碳酸D、氢硫酸(解析:醋酸、碳酸和氢硫酸都是弱酸,在水中只能部分电离。
盐酸是强酸,在水中能完全电离成氢离子和氯离子。
因此,正确答案是B。
)(答案)B5、下列哪种物质是常见的还原糖,能与斐林试剂反应产生砖红色沉淀?A、淀粉B、纤维素C、葡萄糖D、蔗糖(解析:淀粉和纤维素都是多糖,不是还原糖,不能与斐林试剂反应。
蔗糖是非还原性二糖,也不能与斐林试剂反应。
葡萄糖是还原糖,能与斐林试剂反应产生砖红色沉淀。
因此,正确答案是C。
)(答案)C6、下列哪种物质是常见的无机非金属材料,且广泛用于建筑和玻璃制造?A、金属铁B、硅酸盐水泥C、塑料D、橡胶(解析:金属铁是金属材料,不是无机非金属材料。
塑料和橡胶是有机高分子材料,也不是无机非金属材料。
2018年全国化学竞赛初赛试题答案与解析

2个—F被2 个—OH取代 后失水 休克尔规则π电子数:4n+2 醇进攻碳 正离子
失去F—形成 碳正离子
再失去
F— 形成碳正离子
+H+
孤电子对:卡宾
水解得到3-苯基丙 醇和题给副产物
10-1和10-2反应机理
【解析】
10-3反应机理
F4B—H
产 物
10-4反应机理
—H+
H
产物
10-5反应机理
谢谢
5-2-4
0.009449
或176Hf0/177Hf=0.2839—0.01470(ekt—1) =0.2838
不妥!未化合或未反应
pI2守恒 pH2守恒
(1)倒写:2I(g) I2(g) 1/kp1 再+(2):2I(g)+H2(g) 2HI(g) kp2/kp1 (3)×2:2HI(g) 2I(g)+2H(g) kp32 上两式相加得(4):kp4=kp2×kp32/kp1
门预言的3种元素:类硼(钪)类铝(镓)和类硅(锗)
Ar(O)/M(GeO2) =16/104.6=0.153
N2 含Ge的 GeS2 硫化物矿 800℃
NH3 GeS 825℃
发烟 GeO COCl2 H+ GeCl4 2 硝酸 600℃ H2S 水解 (NH4)2MoO4 Na2GeO3 H4 [Ge(Mo12O40)] H+ Ge GeO H3PO3 高温 H3 [P(Mo12O40)] 失水 H3PO2 十二钼磷酸 碱性 Ge(OH) GeHPO3 2
CH3
CH3—C=CH2
聚异丁烯 (PIB): 典型的饱和线性高聚物,相对分子质量可 从数百到数百万。链端含具双键,能硫化且硫化程度很 低,但不能在硫磺体系中硫化而在过氧化物的硫化体系 中硫化。
上海2018年高中化学竞赛初赛试题真题(答案详解版)
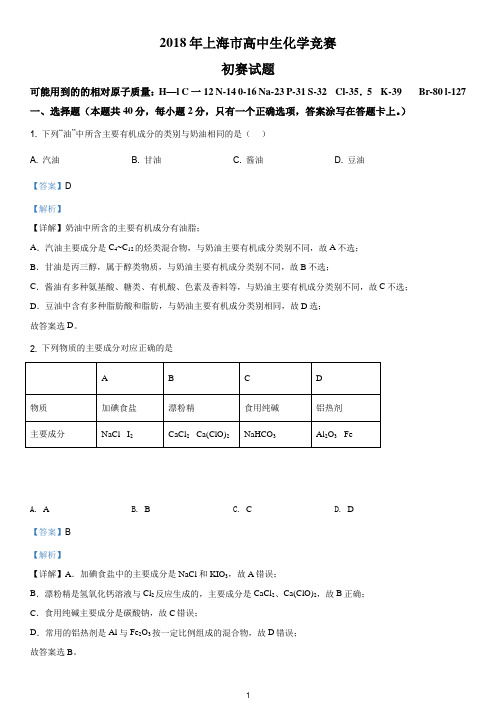
A. 反应混合物 溴的颜色褪去
B. 反应混合物 产生白色沉淀
C. 反应混合物 有机物 紫色褪去
D. 反应混合物 有机物 溴的颜色褪去
【答案】D
【解析】
【分析】根据 与足量NaOH醇溶液共热时发生了消去反应生成苯乙烯,苯乙烯、乙醇都能使酸性高锰酸钾溶液褪色,苯乙烯能使溴水褪色,乙醇不能使溴水褪色来解答。
一、选择题(本题共40分,每小题2分,只有一个正确选项,答案涂写在答题卡上。)
1.下列“油”中所含主要有机成分的类别与奶油相同的是()
A.汽油B.甘油C.酱油D.豆油
【答案】D
【解析】
【详解】奶油中所含的主要有机成分有油脂;
A.汽油主要成分是C4~C12的烃类混合物,与奶油主要有机成分类别不同,故A不选;
答案选C。
11.有机化学试剂氨基氰(如图所示)常用于制备磺胺类药物,抗癌药等。下列有关氨基氰说法正确的是()
A 属于不饱和烃B. 分子中所有原子共面
C. 水溶性较好D. 能发生取代、加成、消去、氧化等反应
【答案】C
【解析】
【分析】氨基氰含有氨基,具有碱性,可与酸反应,含有−N−H键,可形成氢键,且为极性分子,可溶于水,分子中含有N−C键,为δ键,可旋转,分子不一定共平面,以此解答该题。
【详解】A.根据图片知,该金属防护措施采用的是牺牲阳极的阴极保护法,钢管道作正极,表面上发生了还原反应,故A正确;
B.构成的原电池中,该方法是将化学能转化成了电能,故B错误;
C.根据图片知,没有外加电源,该金属防护措施采用的是牺牲阳极的阴极保护法,故C错误;
D.镁块作负极,电极反应:Mg−2e−+4OH−=Mg(OH)2↓,故D错误;
31届化学竞赛山东初赛试题

31届化学竞赛山东初赛试题第1题(8分)写出下列各化学反应的方程式。
1-1将热的硝酸铅溶液滴入热的铬酸钾溶液产生碱式铬酸沉淀[Pb2(OH)2CrO4]。
1-2向含氰化氢的废水中加入铁粉和K2CO3制备黄血盐[K4Fe(CN)6?3H2O]。
1-3酸性溶液中,黄血盐用KMnO4处理,被彻底氧化,产生NO3和CO2。
1-4在水中,Ag2SO4与单质S作用,沉淀变为Ag2S,分离,所得溶液中加碘水不褪色。
第2题(12分)2-1实验室现有试剂:盐酸,硝酸,乙酸,氢氧化钠,氨水。
从中选择一种试剂,分别分离以下各组固体混合物(不要求复原,括号内数据是溶度积),指出溶解的固体。
(1)CaCO3(3.4?10–9)和CaC2O4(2.3?10–9)(2)BaSO4(1.1?10–10)和BaCrO4(1.1?10–10)(3)Zn(OH)2(3.0?10–17)和Ni(OH)2(5.5?10–16)(4)AgCl(1.8?10–10)和AgI(8.5?10–17)(5)ZnS(2.5?10–22)和HgS(1.6?10–52)2-2在酸化的KI溶液中通入SO2,观察到溶液变黄并出现混浊(a),继续通SO2,溶液变为无色(b),写出与现象a和b相对应所发生反应的方程式。
写出总反应方程式(c),指出KI在反应中的作用。
2-3分子量为4000的聚乙二醇有良好的水溶性,是一种缓泻剂,它不会被消化道吸收,也不会在体内转化,却能使肠道保持水分。
2-3-1以下哪个结构简式代表聚乙二醇?2-3-2聚乙二醇为何能保持肠道里的水分?2-3-3聚乙二醇可由环氧乙烷在酸性条件下聚合而成,写出反应式。
第3题(10分)3-1早在19世纪初期,法国科学家Dulong和Petit测定比热时,发现金属的比热(c m)与其原子量的乘积近似为常数6calg1o C??1(1cal=4.18J)。
当时已知的原子量数据很少,因此,可利用比热推算原子量,进而采用其他方法分析得到更精确的原子量。
2018年全国化学竞赛初赛试题答案与解析

题目:化学反应速率与化学计量数的关联
解析:化学反应速率与化学计量数呈正相关,即反应速率随着反应物浓度的增加而增加,随 着反应物浓度的减小而减小。
题目:化学平衡常数的计算
解析:化学平衡常数是描述化学反应平衡状态的重要参数,可以通过平衡时各组分的浓度计 算得出。
简述化学反应速率的影响因素。
解释酸碱指示剂的作用原理。
XX,aies
汇报人:XX
CONTENTS
PART ONE
PART TWO
考试时间:2018年5月19 日(星期六)上午9:0012:00
考试地点:各省市级重点中 学
考试形式:闭卷、笔试 试卷结构:单选题、填空题、简答题、计算题等题型 分值分布:各题型分值分布情况 考试时间:总时长及各部分用时
考试科目:化学 考试形式:笔试 考试时间:3小时 试题难度:中等
PART THREE
考查知识点:化学基础知识
注意事项:注意题目中的陷阱和易 错点,避免因疏忽而选错答案。
添加标题
添加标题
添加标题
添加标题
解题思路:根据题目给出的选项, 逐一分析每个选项的正确性或错误 性,并给出相应的解释。
示例:针对题目“下列哪个选项是正 确的?”给出四个选项,分别对每个 选项进行分析和解释,最终给出正确 答案。
答案:$17/22.4$
题目:在标准状况下,$11.2LCO_{2}$所含分子数为____个。 答案:$3.01 \times 10^{23}$
答案:$3.01 \times 10^{23}$
题目:在标准状况下,$11.2LSO_{2}$的质量是____$g$。 答案:$34$
答案:$34$
简答题1答案: B
提高解题速度,通过大量练习 来提高解题效率和准确性。
2018第31届我国化学奥林匹克试题及答案解析

第31 届中国化学奥林匹克(初赛)试题(2017 年8 月27 日9:00 ~ 12:00)●时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
●允许使用非编程计算器以及直尺等文具。
第根据条件书写化学反应方程式。
1-1工业上从碳酸氢铵和镁硼石[Mg2B2O4(OH)2]在水溶液中反应制备硼酸。
1-2从乏燃料提取钚元素的过程中,利用亚硝酸钠在强酸溶液中将 Pu3+氧化为 Pu4+。
1-3N aBH4与氯化镍(摩尔比 2:1)在水溶液中反应,可得到两种硼化物:硼化镍和硼酸(摩尔比 1:3)。
1-4通过 KMnO4和 H2O2在 KF-HF 介质中反应获得化学法制 F2的原料 K2MnF6。
1-5磷化氢与甲醛的硫酸溶液反应,产物仅为硫酸鏻(盐)。
第2 题(10 分)2-1氨晶体中,氨分子中的每个 H 均参与一个氢键的形成,N 原子邻接几个氢原子?1 摩尔固态氨中有几摩尔氢键?氨晶体融化时,固态氨下沉还是漂浮在液氨的液面上?2-2P4S5是个多面体分子,结构中的多边形虽非平面状,但仍符合欧拉定律,两种原子成键后价层均满足 8 电子,S 的氧化数为-2。
画出该分子的结构图(用元素符号表示原子)。
2-3水煤气转化反应[CO(g) + H2O(g) → H2(g) + CO2(g)]是一个重要的化工过程,已知如下键能(BE)数据:BE(C≡O) =1072 kJ·mol-1,BE(O-H) = 463 kJ·mol-1,BE(C=O) = 799 kJ·mol-1, BE(H-H) = 436 kJ·mol-1估算反应热,该反应低温还是高温有利?简述理由。
2-4硫粉和 S2-反应可以生成多硫离子。
2018年全国高中化学竞赛(初赛)模拟试题8(word含答案)

高中化学竞赛初赛模拟试卷(08)(时间:3小时满分:100分)题号 1 2 3 4 5 6 7 8 9 10 11 12 13 满分7 6 12 4 8 6 6 6 8 9 10 8 10H 1.008 相对原子质量He4.003Li 6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na 22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K 39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.39Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb 85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs 132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr [223]Ra[226]Ac-LaRf Db Sg Bh Hs Mt DsLa系La138.9Ce140.1Pr140.9Nd144.2Pm144.9Sm150.4Eu152.0Gd157.3Tb158.9Dy162.5Ho164.9Er167.3Tm168.9Tb173.0Lu175.0第一题(7分)N、P是植物生长需要的营养元素,吸收这些营养元素的主要方式为。
如果这些营养元素过多,海洋植物的生长速度就会,从而导致,进而影响鱼、虾、蟹等海洋生物的生存并大量死亡,原因是。
最新第31届中国化学奥林匹克(初赛)试题及答案(WORD版)

C 12.01
N 14.01
O 16.00
F 19.00
Ne 20.18
Na 22.99
Mg 24.31
Al 26.98
Si 28.09
P 30.97
S 32.07
Cl 35.45
Ar 39.95
K 39.10
Ca 40.08
Sc 44.96
Ti 47.88
V 50.94
Cr 52.00
Ru 101.1
Rh 102.9
Pd 106.4
Ag 107.9
Cd 112.4
In 114.8
Sn 118.7
Sb 121.8
Te 127.6
I 126.9
Xe 131.3
Cs 132.9
Ba 137.3
La-
Lu
Hf 178.5
Ta 180.9
W 183.8
Re 186.2
Os 190.2
Ir 192.2
Uuo
La
Ce
Pr
Nd
世界上的每一个国家和民族都有自己的饰品文化,将这些饰品汇集到一起再进行新的组合,便可以无穷繁衍下去,满足每一个人不同的个性需求。Pm
一、消费者分析Sm
Eu
Gd
Tb
2、传统文化对大学生饰品消费的影响Dy
Ho
营销环境信息收集索引Er
(四)大学生对手工艺制品消费的要求Tm
Yb
Lu
Ac
Pt 195.1
Au 197.0
Hg 200.6
Tl 204.4
Pb 207.2
Bi 209.0
Po[210]
At [210]
Rn [222]
第31届中国化学奥林匹克(初赛)试题及答案(WORD版)精编版

第31 届中国化学奥林匹克(初赛)试题(2017 年8 月27 日9:00 ~ 12:00)●时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
●允许使用非编程计算器以及直尺等文具。
第1根据条件书写化学反应方程式。
1-1工业上从碳酸氢铵和镁硼石[Mg2B2O4(OH)2]在水溶液中反应制备硼酸。
1-2从乏燃料提取钚元素的过程中,利用亚硝酸钠在强酸溶液中将Pu3+氧化为Pu4+。
1-3N aBH4与氯化镍(摩尔比2:1)在水溶液中反应,可得到两种硼化物:硼化镍和硼酸(摩尔比1:3)。
1-4通过KMnO4和H2O2在KF-HF 介质中反应获得化学法制F2的原料K2MnF6。
1-5磷化氢与甲醛的硫酸溶液反应,产物仅为硫酸鏻(盐)。
第2 题(10 分)2-1氨晶体中,氨分子中的每个H 均参与一个氢键的形成,N 原子邻接几个氢原子?1 摩尔固态氨中有几摩尔氢键?氨晶体融化时,固态氨下沉还是漂浮在液氨的液面上?2-2P4S5是个多面体分子,结构中的多边形虽非平面状,但仍符合欧拉定律,两种原子成键后价层均满足8 电子,S 的氧化数为-2。
画出该分子的结构图(用元素符号表示原子)。
2-3水煤气转化反应[CO(g) + H2O(g) → H2(g) + CO2(g)]是一个重要的化工过程,已知如下键能(BE)数据:BE(C≡O) =1072 kJ·mol-1,BE(O-H) = 463 kJ·mol-1,BE(C=O) = 799 kJ·mol-1,BE(H-H) = 436 kJ·mol-1估算反应热,该反应低温还是高温有利?简述理由。
2-4硫粉和S2-反应可以生成多硫离子。
在10 mL S2-溶液中加入0.080 g 硫粉,控制条件使硫粉完全反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
型嵌段共聚物,该嵌段共聚物在水中可以形成胶束并包载药物分子,在氧化或还原的条件
刺激下,实现药物的可控释放。
专业资料精心整理
下载可编辑
ABA型三嵌段共聚物
7-1该共聚物的合成方法如下:先使单体X与稍过量单体Y在无水溶剂中进行聚合反
4-2-2写出体现该化合物结构特点的化学式。
-
4-2-3若将氦原子放在晶胞顶点,写出所有电子对(2e
)在晶胞中
的位置。
4-2-4晶胞边长a=395pm。计算此结构中Na-He的间距d和晶体的密度ρ(单
-1
位:g·cm
)。
第5题(10分)
由元素X和Y形成的化合物A是一种重要的化工产品,可用于制备润滑剂、杀虫剂等。A可
第4题(10分)
随着科学的发展和大型实验装置(如同步辐射和中子源)的建成,高压技术在物质研究中发
挥着越来越重要的作用。高压不仅会引发物质的相变,也会导致新类型化学键的形成。近
年来就有多个关于超高压下新型晶体的形成与结构的研究报道。
4-1NaCl晶体在50-300 GPa的高压下和Na或Cl2反应,可以形成不同组成、不同结构
12111008
NaMgAlSiPSClAr
22.924.326.928.030.932.035.439.9
91897755
KCaScTiVCrMnFeCoNiCuZnGaGeAsSeBrKr
39.140.044.947.850.952.054.955.858.958.663.565.469.772.674.978.979.983.8
应,形成中部的聚氨酯链段,随后加入过量乙二醇单甲醚CH3(OCH2CH2)nOH进行封端。写
出单体X与Y的结构式。
7-2在氧化还原条件下二硫键可发生断裂,采用R-S-S-R简式,写出其断键后的氧化产物O
和还原产物P。
7-3该嵌段共聚物所形成的胶束可以包载右图中哪种抗癌药物?简述理由。
第8题(13分)
10-3当R = OEt时,产物为C,分子式为C14H10O5。参照以上实验结果,画出C的结构简
式。
专业资料精心整理
下载可编辑
第30届中国化学奥林匹克(初赛)参考答案
第1题(10分)
1-12NH4HCO3+ Mg2B2O4(OH)2=2MgCO3+ 2NH3+ 2H3BO3(2分)
NH4HCO3+ Mg2B2O4(OH)2+ 2H2O = Mg2(OH)2CO3+ NH3+ 2H3BO3
2-3水煤气转化反应[CO(g) + H2O(g)→H2(g) + CO2(g)]是一个重要的化工过程,已知如下键
能(BE)数据:BE(C≡O) =1072 kJ·mol
-1,BE(O-H)= 463 kJ·mol-1,BE(C=O) = 799
kJ·mol
-1,BE(H-H) = 436 kJ·mol-1估算反应热,该反应低温还是高温有利?简述理由。
6-2-3写出钌红阳离子中桥键原子的杂化轨道类型。
6-2-4经测定,钌红阳离子中Ru-O键长为187 pm,远小于其单键键长。对此,研究者解
释为:在中心原子和桥键原子间形成了两套由d和p轨道重叠形成的多中心π键。画出
多中心π键的原子轨道重叠示意图。
第7题(6分)
嵌段共聚物指由不同聚合物链段连接而成的聚合物。若其同时拥有亲水链段和疏水链段,
2-1氨晶体中,氨分子中的每个H均参与一个氢键的形成,N原子邻接几个氢原子?1摩
尔固态氨中有几摩尔氢键?氨晶体融化时,固态氨下沉还是漂浮在液氨的液面上?
2-2P4S5是个多面体分子,结构中的多边形虽非平面状,但仍符合欧拉定律,两种原子成键
后价层均满足8电子,S的氧化数为-2。画出该分子的结构图(用元素符号表示原子)。
画出A的结构简式。提示:δ不同,氢的化学环境不同。
10-2当R = Ph时,产物为B,分子式为C20H14O4。研究表明B含有一个羟基,它的
1H
NMR(CDC3,lppm):δ2.16 (1H),3.79 (1H),4.07 (1H),5.87 (1H),6.68 (1H),
7.41-7.77 (5H),7.82-8.13 (4H)。画出B的结构简式;解释生成B的原因。
3+氧化为Pu4+。
1-3NaBH4与氯化镍(摩尔比2:1)在水溶液中反应,可得到两种硼化物:硼化镍和硼酸(摩
尔比1:3)。
1-4通过KMnO4和H2O2在KF-HF介质中反应获得化学法制F2的原料K2MnF6。
1-5磷化氢与甲醛的硫酸溶液反应,产物仅为硫酸鏻(盐)。
专业资料精心整理
下载可编辑
第2题(10分)
086840453951212600
RbSrYZrNbMoTcRuRhPdAgCdInSnSbTeIXe
85.487.688.991.292.995.9[98101.102.106.107.112.114.118.121.127.126.131.
721214]19494878693
Cs
132.
9
Ba
1-52PH3+ 8HCHO + H2SO4= [P(CH2OH)4]2SO4(2分)
第2题(10分)
2-16(3个氢键、3个共价键);(1分)3 mol(1分);下沉(1分)。
2-2(2分)
2-3ΔH≈-2[BE(C=O) + BE(H-H) -BE(C≡O)- 2BE(O-H)]= -36 KJ·mol-1(1分)
由生产X单质的副产物FeP2与黄铁矿反应制备,同时得到另一个二元化合物B。B溶于稀
硫酸放出气体C,而与浓硫酸反应放出二氧化硫。C与大多数金属离子发生沉淀反应。纯净的
A呈黄色,对热稳定,但遇潮湿空气极易分解而有臭鸡蛋味。A在乙醇中发生醇解,得到以
X为单中心的二酯化合物D并放出气体C,D与Cl2反应生成制备杀虫剂的原料E、放出刺
1-24H++ 2HNO2+ 4Pu3+= N
2O + 4Pu4++ 3H
2O(2分)
1-38NaBH4+ 4NiCl2+ 18H2O = 6H3BO3+ 2Ni2B + 8NaCl + 25H2(2分)
1-42KMnO4+ 3H2O2+ 2KF + 10HF = 2K2MnF6+ 3O2+ 8H2O(2分)
●试卷装订成册,不得拆散。所有解答必须写在指定的方框内,不得用铅笔填写。草稿
纸在最后一页。不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
●允许使用非编程计算器以及直尺等文具。
HHe
1.004.00
相对原子质量
83
LiBeBCNOFNe
6.949.0110.812.014.016.019.020.1
8-1判断以下分子是否有手性。
8-2画出以下反应所得产物的立体结构简式,并写出反应类型(SN1或SN2)。
反应原料反应试剂产物反应类型
1H2S/KOH
2K2CO3
3H2O
4CH3OH
第9题(10分)
画出以下转换的中间体和产物(A-E)的结构简式。
专业资料精心整理
下载可编辑
元素分析结果表明化合物E含C,64.84%;H,8.16%,N,12.60%。化合物B不含羟基。
该反应的ΔH<0,根据勒夏特列平衡移动原理,故而低温有利于平衡正向移动,因而低温有
利。(1分)
注:实际反应要用合适的温度。
2-4根据题意可得溶液中只有三种含硫离子S2-,S22-,S32-
列式
S22-S32-
2-
S
10c1100c1
c
根据零价S守恒可得:10c1+ 21×00c1=n(S)= 2.4910×-3mol(1分)因而c1= 1.21×0-3mol·L-1(1分)
的晶体。下图给出其中三种晶体的晶胞(大球为氯原子,小球为钠原子)。写出A、B、C的
化学式。
4-2在超高压(300GPa)下,金属钠和氦可形成化合物。结构中,
钠离子按简单立方排布,形成Na4立方体空隙(如右图所示),电
子对(2e
-)和氦原子交替分布填充在立方体的中心。
专业资料精心整理
下载可编辑
4-2-1写出晶胞中的钠离子数。
第3题(12分)
3+的溶液中,加入酸H
在金属离子MmX,控制条件,可以得到不同沉淀。pH < 1,得到沉淀
A(M2Xn·yH2O,y < 10);pH > 7,得到沉淀B[MX(OH)],A在空气气氛中的热重分析显示,
从30°C升温至100°C,失重11.1%,对应失去5个结晶水(部分);继续加热至
137.
3
La-
Lu
Hf
178.
5
Ta
180.
9
W
183.
8
Re
186.
2
Os
190.
2
Ir
192.
2
Pt
195.
1
Au
197.
0
Hg
200.
6
Tl
204.
4
Pb
207.
2
Bi
209.
0
Po
[210
]
At
[210
]
Rn
[222
]
Fr
[223
]
Ra
[226
]
Ac-
