第3章电位分析法仪器分析
仪器分析-电位分析法

若 E电池 0表示电池反应不能自发进行,该电池为电解池
2014年2月25日星期二
15
原电池与电解池的对比
原电池 电子 流动 方向 电极 名称 电极 反应 由负极流向正极 电解池 由阳极流向阴极
负极
电子流出极 氧化反应
正极
电子流入极 还原反应
பைடு நூலகம்阴极
阳极
接电源负极 接电源正极 还原反应 氧化反应
2014年2月25日星期二
谱分析法。
2014年2月25日星期二 5
电化学分析法的特点
1. 灵敏度、选择性和准确度很高,适用面广 2. 由于测定过程中得到的是电信号,因而易 于实现自动化、连续化和遥控测定,尤其 适用于生产过程的在线分析 3. 电化学分析法可以测量到的是元素或化合 物的某一种价态,能进行价态及形态分析 4. 电化学方法测定的是待测物的活度而不是 浓度。
2014年2月25日星期二
7
铜-锌化学电池装置 电解池 原电池
负极 阳极
2014年2月25日星期二
正极 阴极
负极 阴极
正极 阳极
8
1.1.1.1电化学电池
(1)当电池工作时,电流必须在电池内部和外部流通,构成 回路。 (2)电流是电荷的流动,外部电路是金属导体,移动的是带 负电荷的电子。电池内部是电解质溶液,移动的是分别带 正、负电荷的离子。 (3)为使电流能在整个回路中通过,必须在两个电极的金属 /溶液界面处发生有电子跃迁的电极反应,即离子从电极 上取得电子,或将电子交给电极。 通常将发生氧化反应的电极(离子失去电子)称为阳极, 发生还原反应的电极(离子得到电子)称为阴极。 原电池:外电路电子流出的电极为负极,电子流入的电极为 正极。 电解池:与电源正极相连为正,与电源负极相连的为负。 注意电子流动方向和电流方向相反。
仪器分析练习题及答案

1。
简述仪器分析法的特点。
答:1.仪器分析法灵敏度高。
2.仪器分析法多数选择性较好.3.仪器分析法分析速度较快,利于批量样品分析。
4.易于使分析工作自动化。
5.相对误差较大。
6.设备复杂、价格昂贵,对仪器工作环境要求较高。
第二章电分析导论1.计算[Cu2+]= 0.0001 mol/L时,铜电极的电极电位(EθCu2+ /Cu=0.337V)2。
已知电极反应Ag++ e—=Ag的EθAg+,Ag为0.799V,电极反应Ag2C2O4+ 2e—=Ag + C2O42-的标准电极电位EθAg2C2O4,Ag为0。
490V,求Ag2C2O4的溶度积常数。
3。
已知电极反应Zn2++ 2e—=Zn的EθZn2+,Zn=-0.763V,Zn(CN)42-的稳定常数为5×1016。
求电极反应Zn(CN)42—+ 2e—=Zn + 4 CN—的标准电极电位EθZn(CN)2—,Zn.4答案:1。
计算[Cu2+] = 0。
0001 mol/L时,铜电极的电极电位(EθCu2+ /Cu=0。
337V)解:电极反应为:Cu2++ 2e—=Cu按照能斯特方程,铜电极的电位为:E Cu2+ /Cu = EθCu2+ /Cu +RT/nF ln[αCu2+ /αCu]金属的活度为常数,作为1,在非精度的情况下,可以认为αCu2+=[Cu2+]。
则求得(25℃时)E Cu2+ /Cu = EθCu2+ /Cu +RT/nF ln[Cu2+]=0。
344+(0.059/2)•lg0.0001=0.226V2。
已知电极反应Ag++ e-=Ag的EθAg+,Ag为0。
799V,电极反应Ag2C2O4+ 2e—=Ag + C2O42-的标准电极电位EθAg2C2O4,Ag为0.490V,求Ag2C2O4的溶度积常数.解:根据能斯特方程:EθAg2C2O4,Ag= E Ag+,Ag=EθAg+,Ag + 0.059lg[Ag+]= EθAg+,Ag + 0.059lg(Ksp/[C2O42-])1/2已知EθAg2C2O4,Ag为0.490V,EθAg+ ,Ag为0。
仪器分析学习课件 第3章 电位分析法

+ 0 .2 8 2 8
+ 0 .2 4 3 8
温度校正,对于SCE,t ℃ 时的电极电位为:
Et= 0.2438- 7.6×10-4(t-25) (V)
银-氯化银电极:
银丝镀上一层AgCl沉淀,浸在一定浓度 的KCl溶液中即构成了银-氯化银电极。
电极反应:AgCl + e- == Ag + Cl-
电极内溶液的Cl-活度 一定,甘汞电极电位固定。
参比电极
表 甘汞电极的电极电位( 25℃)
0 .1 m o l/L 甘 汞 电 极标 准 甘 汞 电 极 (N C E ) 饱 和 甘 汞 电 极 (S C E )
K C l浓 度
0 .1m o l/L
1 .0m o l/L
饱 和 溶 液
电 极 电 位 ( V ) + 0 .3 3 6 5
参比电极
甘汞电极 电极反应:Hg2Cl2 + 2e- = 2Hg + 2 Cl半电池符号:Hg,Hg2Cl2(固)KCl 电极电位(25℃):
EH2gCl/H gEH O22gCl/H g0.025l9ga2(aH (H)g2agC 2(2C l)l) EH2gCl/H gEH O22gCl/H 0 g.05lg 9a(Cl)
第二类电分析化学法是以电物理量的突变作为滴定分 析中终点的指示,所以又称为电容量分析法。属于这类分 析方法的有:电位滴定,电导滴定,电流滴定等。
第三类电分析化学法是将试液中某一个待测组分通过 电极反应转化为固相,然后由工作电极上析出物的质量来 确定该组分的量。称为电重量分析法(电子做“沉淀剂” ),即电解分析法。
1、直接电位法: 零电流条件下测量指示电极相 对于参比电极的电位,据电位 与浓度的关系计算被测物含量。
厦门大学仪器分析-直接电位法

电极作指示电极,以饱和甘汞电极作参比电极,组成的测量电池为
氟离子选择电极︱试液‖SCE 如果忽略液接电位,电池的电动势为
即电池的电动势与试液中氟离子活度的对数成正比,氟离子选择电极 一般在1~10-6 mol.L-1范围符合能斯特方程式。
E b 0.0592log F-
氟离子选择电极性能
2、标准曲线法 :
在5只100 mL容量瓶中,用10.00 mL移液管移取0.100 moL.L-1 F-标准溶液 于第一只100 mL容量瓶中,加入TISAB10.0 0mL,去离子水稀释至标线,
摇匀,配成1.00×10-2 mol.L-1 F-溶液;在第二只100mL容量瓶中,加入
1.00×10-2 mol.L-1 F-溶液10.00mL和TISAB9.00mL,去离子水稀释至标线, 摇匀,配成1.00×10-3 mol.L-1 F-溶液。按上述方法依次配制1.00×10-6~
工作电池 电动势E与待测物含量(活度a)关系
E W - R f ( a ) - const . F ( a )
Nernst方程
RT EK ln a nF 常数 f (a)
Walther Nernst 1864-1941
工作电池的电动势E仅与待测物质的含量(活度a)有关
1.00×10-4 mol.L-1 F-标准溶液。
将适量F-标准溶液(浸没电极即可)分别倒入5只塑料烧杯中,放入磁 性搅拌子,插入氟离子选择电极和饱和甘汞电极,连接好离子计,开启电磁
搅拌器,由稀至浓分别进行测量,在仪器指针不再移动或数字显示在±1 mV
内,读取电位值。再分别测定其他F-浓度溶液的电位值。 准确吸取自来水样50.0 mL于100 mL容量瓶中,加入TISAB 10.00mL, 去离子水稀释至标线,摇匀。全部倒入一烘干的烧杯中,按上述实验方法测 定电位值,记为E1(此溶液继续做下一步实验),平行测定三份。
《仪器分析》——电位法及永停滴定法

2.303RTlga内’, +
F
a外
2.303RTlg a外
F
a内
K1 = K2 a外 =a内
0
∵a内固定
jm K
2.303 RT lg a
外
F
2015/3/9
26
整个玻璃电极的电位:
j
j
j
AgCl/Ag
m
j AgCl/Ag
(K'
2.303RT lg F
外)
(j AgCl/Ag
K')
2.303RT pH F
银-氯化银电极
(silver-silver chloride electrode)
均属于金属-金属难溶盐电极
2015/3/9
19
1. 饱和甘汞电极
• 组成 金属汞、甘汞(Hg2Cl2)和KCl溶液
汞 汞-甘汞糊 石棉
• 电极表示 • 电极反应 • 电极电位
Hg|Hg2Cl2|KCl溶液
Hg2Cl2 +e
Ag|AgCl|Cl-
AgCl + e
Ag+ +Cl-
j = j - 0.059 lgcCl-
( 25℃)
C KCl 0.1mol/L
j (V) 2015/3/9
0.2880
1.0mol/L 0.2223
饱和 0.1990
第三节 直接电位法
指示电极 参比电极 待测溶液
测量原电池 的电动势
由Nernst方程 式直接求出待 测溶液浓度
34
残余液接电位及其消除
残余液接电位的产生
标准缓冲溶液
饱和甘汞电极 (SCE)
待测溶液
减小残余液接电位
仪器分析 电位分析法

二、玻璃膜(非晶体膜)电极
玻璃电极使用前,必须在水溶液中浸泡,生成三层结构, 即中间的干玻璃层和两边的水化硅胶层:
水化硅胶层厚度:0.01~10 μm。在水化层,玻璃上的 Na+与溶液中H+发生离子交换而产生相界电位。 水化层表面可视作阳离子交换剂。溶液中H+经水化层扩 散至干玻璃层,干玻璃层的阳离子向外扩散以补偿溶出的离 子,离子的相对移动产生扩散电位。 两者之和构成膜电位。
1.膜电位及其选择性
RT E膜 K ln a阳离子 nF
RT E膜 K ln a阴离子 nF
共存的其它离子对膜电位产生有贡献吗? 若测定离子为 i,电荷为 zi;干扰离子为 j,电荷为zj。 考虑到共存离子产生的电位,则膜电位的一般式可写成为:
ni 2.303RT K lg[ ai K i , j a j nj ] ni F
敏 感 膜 由 LaF3 单 晶片制成,其组成 为 : 少 量 0.1% ~ 0.5%EuF2 和 1% ~ 5%CaF2, 晶 格 点 阵 中 La3+ 被 Eu2+ , Ca2+ 取代,形成较多的 晶格空穴,增加导 电性。
氟离子选择性电极的特点
导电性:LaF3的晶格中有空穴,在晶格上的F-可 以移入晶格邻近的空穴而导电。 选择性:对于一定的晶体膜,离子的大小、形 状和电荷决定其是否能够进入晶体膜内,故 膜电极一般都具有较高的离子选择性。 抗干扰性:为氟离子量的1000倍的Cl-、Br-、I、SO42-、NO3-等的存在无明显的干扰。
玻璃膜电位
膜内
膜相
溶液(外)
内
外
溶液(内)
膜 外 内 a内
膜外
a外
a外′
仪器分析--电位分析法习题 +答案

姓名:班级:学号:电位分析习题一.单项选择题( ) 1、在直接电位法中,指示电极的电位与被测离子活度的关系为______A.无关B.成正比C.与其对数成正比D.符合能斯特公式( )2、电位分析法中作为参比电极,应满足的要求之一是:A.其电位应与温度无关B.其电位应等于零C.测量过程中即使有微小电流通过,其电位仍保持恒定D.不存在液接电位( )3、采用pH 的实用定义主要是因为:A.单个离子的活度目前用电化学方法不能测量B.液体接界电位的变化和理论上难以计算C.K'不能准确的测定和计算,并经常发生变化D.不对称电位可能随时间而变化( )4、氟化镧单晶膜氟离子选择电极的膜电位的产生是由于_______A.氟离子在晶体膜表面氧化而传递电子B.氟离子进入晶体膜表面的晶格缺陷而形成双电层结构C.氟离子穿透晶体膜而使膜内外氟离子产生浓度差而形成双电层结构D.氟离子在晶体膜表面进行离子交换和扩散而形成双电层结构( )5、电位滴定是以测量电位的变化情况为基础,下列因素影响最大的是:A.外参比电极电位B.液接电位C.不对称电位D.被测离子活度( )6、电位滴定法比直接电位法更准确,这是因为:A.直接电位法在用能斯特方程计算时有误差B.电位滴定法选用了比直接电位法更灵敏的电极C.电位滴定法是以测量电位的相对变化为基础的D.电位滴定法比直接电位法的干扰因素少( )7、由电动势测量误差看,如用同一仪器测下列离子,最不宜用直接电位法测定的是:A.H +B.NO 3 -C.Ca 2+D.B 3+( )8、氟离子选择电极在使用前需用低浓度的氟溶液浸泡数小时,其目的A.清洗电极B.检查电极的好坏C.活化电极D.检查离子计能否使用( )9、用pH 玻璃电极测定pH 约为12 的碱性试液,测得pH 比实际值A.大B.小C.两者相等D.难以确定( )10、用氟离子选择性电极测定饮用水中F - 含量时,Al 3+ ,Fe 3+ 的干扰属于:A.直接与电极膜发生作用B.与共存离子在电极膜上反应生成一种新的不溶性化合物C.与被测离子形成配合物D.与被测离子发生氧化还原反应( )11、某离子选择电极对一价的A 和B 离子都有响应,但a B 100 倍于a A 时,B 离子提供的电位与A 离子提供的相等。
仪器分析第3章-电位分析法

0 .0592 lg a A 电位分析法的基本公式: 常数+ zA
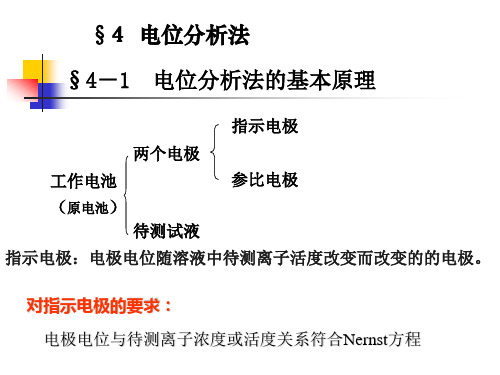
电池---两个电极 指示电极---电极电位随被测物质活度变化(如ISE) 参比电极---(如SCE)
2
二、分类---电位法和电位滴定法
1、电位法:
选用适当的指示电极浸入被测试液,测量其相对于参比电 极的电位,根据测出的电位,直接求出被测物质的浓度。 平衡体系,测得的是物质游离离子的量。如:F-电极测F-
=常数- 0.0592 pH
pH玻璃电极的电位由膜电位,内参比电极电位以及不对称 电位等组成。 所以,玻璃电极的电位与试液pH值的关系表示为:
g k 0 .0592 pH
k为常数,包括敏感膜的不对称电位和内参比电极电位。
12
一般常用的pH玻璃电极,只能适用于pH为1~10的溶液,超出 了这一范围,测得的pH值就会偏离实际数值。
22
(4)铜、铅、镉离子选择电极 它 们 的 敏 感 膜 分 别 由 Ag2S-CuS 、 Ag2S-PbS 和 Ag2S-CdS粉末混匀压片制得。膜内电荷的传递是 Ag+,而M2+不参与电荷的传递。电极电位为:
检测下限与各自的溶度积Ksp有关。
ቤተ መጻሕፍቲ ባይዱ
23
晶体膜电极的选择性和检测限:
* 对于 Ag2S 和 Ag2X ( X - = Cl - 、 Br - 、 I - )以及 Ag2S 和 MS ( M2+=Cu2+ 、 Pb2+ 、 Cd2+ )制成的晶体膜离子选择电 极,其干扰主要不是由于共存离子进入膜相参与响应,而 是来自晶体表面的化学反应,即共存离子与晶格离子形成 难溶盐或络合物,从而改变了膜表面的性质。例如,Br- 或I-能影响AgCl敏感膜对Cl-的响应,是由于Br-或I-能 与膜物质中的Ag+ 生成较 AgCl更难溶解的AgBr 或 AgI 难溶 盐所致。所以,电极的选择性与构成膜的物质的溶度积及 共存离子和晶格离子形成沉淀的溶度积的相对大小有关。 *晶体膜电极的检测限则取决于膜物质的溶解度。
《仪器分析》课后习题答案参考

《仪器分析》课后习题答案参考第一章电位分析法1~4 略5.(1)pMg x=5.4(2)3.65×10-6– 4.98×10-66. -17%7. 4.27×10-4%8.(1)=5.4×10-4lg=-2.31=5.0×10-3(2) Cl- =1.0×10-2 mol/L9. pH x ==5.74R入=1011Ω10. Cx=8.03×10-4 mol/L第二章电重量分析和库仑分析法1. 1.64 V2. -1.342,0.2383. 1.08 V,0.4V,7333 s4. Co先析出,阴极电位应维持在-0.313 – -0.795V之间阴极电位应维持在-0.455 – -0.795V之间5 Bi:0.283-0.190V(vs.SHE);-0.005 - -0.098(vs. Ag/AgCl)Cu:0.310-0.159V(vs.SHE);0.022 - -0.129(vs. Ag/AgCl)Ag:0.739-0.444V(vs.SHE);0.451 – 0.156(vs. Ag/AgCl)控制阴极电位大于0.310V(vs.SHE),可以使Ag分离,Cu2+和BiO+不能分离。
6 ,7 , ,89.10. t= 4472s11 6.1×10-4 mol/Lpt阴极产生OH-,改变pH使副反应发生,故pt阴极应用玻璃砂芯套管隔离第三章 伏安法和极谱分析法1~3 略4. 当pH=7时,当pH=5时,5. (1) 线性回归方程: y =6.0733x + 0.3652(2)0.536 mmol/L6. M C x 41023.2-⨯=7. 22.7 μA8. 0.0879. 1.75 ×10-3mol/L10. -0.626 V11. 5.9×10-3第四章气相色谱法1~14 略15. 8.5%,20.6%,60.9%16. 2.15%,3.09%,2.75%,6.18%,85.84%17. (1)4.5, (2)48mL,(3)5.4min,(4)103,(5)1866,(6)1.07nm18. (1)8.6,(2)1.4419. (1)n有效(A) = 636.59n有效(B) = 676(2) 2 m20.(1)0.45 ,(2)7111121.(1)4,(2)4,(3),22. (1)3236,2898,2820,3261,(2)3054(3)0.33m第五章高效液相色谱法1~16 略17. 26.24%,27.26%18. 1600,6.7,7.3,1.1,0.8,7 m19. 0.63,2.38,2.65,4.034021,3099,2818,3394,595,1535,1486,217820. 5.1%21. 0.47%第六章原子发射光谱仪1~8 略9. 2.57 eV10. 0.573%。
仪器分析电位分析法

若参比电极的电极电位能保持不变,则测得电池的 电动势就仅与指示电极有关,进而也就与被测离子活 度有关。
理论基础:能斯特方程式
对于氧化还原体系: Ox + ne- = Red
E
EO Ox/Red
RT nF
ln
aOx aRe d
对于金属电极(还原态为金属,活度定为1):
E
EO Mn/M
电位分析法的实质是通过在零电流条件下测定两电 极间的电位差(即所构成原电他的电动势) 进行分析测 定。
由于电位法测定的是一个原电池的平衡电动势值, 而电池的电动势与组成电池的两个电极的电极电位密 切相关,所以我们一般将电极电位与被测离子活度变 化相关的电极称指示电极,而将在测定过程中其电极 电位保持恒定不变的另一支电极叫参比电极。
CO2,NH3,NH4+,CN-,F-,S2-,I-,NO2-
第二节 离子选择电极性能参数
线性范围和检测限
响应:电极的电位随离子活度变化的特征
通过实验可绘制任一离子选择性电极的E ~lga关系曲线
曲线的直线部分所对应的离子 活度范围称为离子选择电极响应 的线性范围。直线的斜率称为实 际响应斜率
S实
E电池= SCE- 玻+ 不对称+ 液接
= SCE - AgCl/Ag- 膜+ 不对称+ 液接
在测定条件下, SCE、 不对称、 液接及 AgCl/Ag
可视为常数,合并为K,于是上式写为
E电池 = K - 0.059VlgaH+
或
E电池 = K + 0.059V pH
E电池 = K + 0.059VpH 由于式中K无法测量,在实际测定中,溶液的 pHx是通过与标准缓冲溶液的pHs相比较而确定 的。
仪器分析课件

仪器分析课件第1章:仪器分析概述1.1 仪器分析的定义1.1.1 仪器分析的概念1.1.2 仪器分析的历史发展1.2 仪器分析的基本原理1.2.1 仪器分析的基本概念1.2.2 仪器分析的分类和特点1.2.3 仪器分析的基本原理1.3 仪器分析的应用领域1.3.1 生物医药领域中的仪器分析1.3.2 环境监测中的仪器分析1.3.3 食品安全领域中的仪器分析1.3.4 能源领域中的仪器分析1.3.5 其他领域中的仪器分析第2章:常见仪器分析方法2.1 光谱分析法2.1.1 紫外可见光谱分析法2.1.2 红外光谱分析法2.1.3 质谱分析法2.1.4 核磁共振光谱分析法2.2 色谱分析法2.2.1 气相色谱分析法2.2.2 液相色谱分析法2.2.3 离子色谱分析法2.2.4 薄层色谱分析法2.3 电化学分析法2.3.1 电解法分析法2.3.2 电位法分析法2.3.3 极谱分析法2.3.4 电化学分析中的仪器设备2.4 质谱分析法2.4.1 质谱基本原理2.4.2 质谱原理及应用第3章:仪器分析的操作流程3.1 样品准备3.1.1 样品采集3.1.2 样品制备及处理3.2 仪器操作3.2.1 仪器的打开与关闭3.2.2 仪器的参数选择和调整 3.2.3 仪器的操作注意事项3.3 数据处理与分析3.3.1 数据采集与记录3.3.2 数据处理软件的使用 3.3.3 数据分析与解释第4章:仪器分析的常见问题与解决方法4.1 仪器故障与维护4.1.1 仪器常见故障原因4.1.2 仪器故障的排除方法4.1.3 仪器维护的注意事项4.2 数据异常及其处理4.2.1 数据异常的原因分析4.2.2 数据异常的处理方法4.3 实验误差及其控制4.3.1 实验误差的分类4.3.2 实验误差的产生原因4.3.3 实验误差的控制方法第5章:仪器分析的发展趋势5.1 仪器分析技术的创新5.1.1 新兴仪器分析技术的引入5.1.2 前沿仪器分析技术的研究进展5.2 仪器分析技术的应用推广5.2.1 实验室仪器的普及与应用5.2.2 仪器检测技术的应用领域扩展5.3 仪器分析技术的发展趋势5.3.1 仪器分析技术的自动化与智能化5.3.2 仪器分析技术在快速检测中的应用结语通过本课件的学习,你将了解到仪器分析的基本概念和原理,熟悉常见的仪器分析方法和操作流程,掌握解决仪器故障和数据异常的方法,了解仪器分析的发展趋势。
(完整版)仪器分析--电位分析法习题+答案

姓名:班级:学号:电位分析习题一.单项选择题( ) 1、在直接电位法中,指示电极的电位与被测离子活度的关系为______A.无关B.成正比C.与其对数成正比D.符合能斯特公式( )2、电位分析法中作为参比电极,应满足的要求之一是:A.其电位应与温度无关B.其电位应等于零C.测量过程中即使有微小电流通过,其电位仍保持恒定D.不存在液接电位( )3、采用pH 的实用定义主要是因为:A.单个离子的活度目前用电化学方法不能测量B.液体接界电位的变化和理论上难以计算C.K'不能准确的测定和计算,并经常发生变化D.不对称电位可能随时间而变化( )4、氟化镧单晶膜氟离子选择电极的膜电位的产生是由于_______A.氟离子在晶体膜表面氧化而传递电子B.氟离子进入晶体膜表面的晶格缺陷而形成双电层结构C.氟离子穿透晶体膜而使膜内外氟离子产生浓度差而形成双电层结构D.氟离子在晶体膜表面进行离子交换和扩散而形成双电层结构( )5、电位滴定是以测量电位的变化情况为基础,下列因素影响最大的是:A.外参比电极电位B.液接电位C.不对称电位D.被测离子活度( )6、电位滴定法比直接电位法更准确,这是因为:A.直接电位法在用能斯特方程计算时有误差B.电位滴定法选用了比直接电位法更灵敏的电极C.电位滴定法是以测量电位的相对变化为基础的D.电位滴定法比直接电位法的干扰因素少( )7、由电动势测量误差看,如用同一仪器测下列离子,最不宜用直接电位法测定的是:A.H +B.NO 3 -C.Ca 2+D.B 3+( )8、氟离子选择电极在使用前需用低浓度的氟溶液浸泡数小时,其目的A.清洗电极B.检查电极的好坏C.活化电极D.检查离子计能否使用( )9、用pH 玻璃电极测定pH 约为12 的碱性试液,测得pH 比实际值A.大B.小C.两者相等D.难以确定( )10、用氟离子选择性电极测定饮用水中F - 含量时,Al 3+ ,Fe 3+ 的干扰属于:A.直接与电极膜发生作用B.与共存离子在电极膜上反应生成一种新的不溶性化合物C.与被测离子形成配合物D.与被测离子发生氧化还原反应( )11、某离子选择电极对一价的A 和B 离子都有响应,但a B 100 倍于a A 时,B 离子提供的电位与A 离子提供的相等。
仪器分析绪论

蛋白质旳氮含量14-18% 平均为16%,折算系数 为6.25。
检测仪器: 气相色谱-质谱联用仪(GC-MS)、高效液相色谱 仪(HPLC)、液相色谱-质谱-质谱联用仪(HPLC-MS-MS) 等
分析化学及其任务
定义:研究物质化学构成、构成含量、表征物质化 学构造旳分析措施及有关理论旳科学。
清楚明了方法原理,弄懂记着基本概念。 知晓分清仪器装置,着重熟悉关键部件。 理解方法理论公式,熟练使用重点公式。
措施
发明了分配色谱法
发明了相差显微镜 首次发展了极谱法
发明了计算机控制扫描层析 诊疗法 (CT)
发展了高辨别率电子光谱法
发展了激光光谱学
对晶体显微镜旳发展
28项诺贝尔奖与分析仪器发展有关 2023年诺贝尔化学奖:
约翰·芬恩(美)与田中耕一(日): 库尔特·维特(瑞) 建立利用质谱分析生物大分子旳措施。 建立利用核磁共振测定生物大分子三维构造旳措施。
对电解理论旳贡献
对电导率旳理论研究及试验工作
制造了光学精密仪器及对天体所 做旳光谱研究
发觉结晶X射线衍射
共同采用X射线技术对晶体构造 旳分析
发觉了多种元素X射线发射旳不 同
发觉了质谱技术能够用来测定同 位素
编号 年份 获奖者 15 1939 Lawrence Ernest Orlando 16 1944 Rabi, Isidor Isaac
绪论应该讲旳内容? 为何学习仪器?
学术成就
生命质量
与仪器分析发明发展有关旳诺贝尔取得者
编号 年份 获奖者 1 1901 Rontgen Wilhelm Conrad 2 1901 Van't Hoff Jacbus Henricus
仪器分析《电位分析法》试题附答案

仪器分析《电位分析法》试题附答案A g/AgCl 电位分析法⼀、计算题1. 在 -0.96V(vs SCE)时,硝基苯在汞阴极上发⽣如下反应:C 6H 5NO 2 + 4H++ 4e-= C 6H 5NHOH + H 2O把 210mg 含有硝基苯的有机试样溶解在 100mL 甲醇中,电解 30min 后反应完成。
从电⼦库仑计上测得电量为 26.7C ,计算试样中硝基苯的质量分数为多少?2. 将氯离⼦选择性电极和饱和⽢汞电极接成如下电池:SCE||Cl -(X mol/L)│ ISE试推导标准加⼊法测定氯离⼦的计算公式。
3. 氟离⼦选择电极的内参⽐电极为Ag -AgCl ,E θ=0.2223V 。
内参⽐溶液为 0.10mol/LNaCl 和1.0×10-3mol/LNaF ,计算它在1.0×-5mol/LF -,pH =7的试液中,25oC 时测量的电位值。
4. 由Cl-浓度为 1mol/L 的⽢汞电极和氢电极组成⼀电对,浸⼊ 100mL HCl 试液中。
已知摩尔⽢汞电极作阴极,电极电位为 0.28V,Eq(H +/ H 2)= 0.00V ,氢⽓分压为 101325Pa 。
Ar(H) = 1.008,Ar(Cl) = 35.4该电池电动势为0.40V 。
(1) ⽤电池组成符号表⽰电池的组成形式(2)计算试液含有多少克 HCl5. Ca 2+选择电极为负极与另⼀参⽐电极组成电池,测得0.010mol/L 的Ca 2+溶液的电动势为0.250V ,同样情况下,测得未知钙离⼦溶液电动势为0.271V 。
两种溶液的离⼦强度相同,计算求未知Ca 2+溶液的浓度。
6.流动载体钾电极与饱和⽢汞电极组成测量电池,以醋酸锂为盐桥,在1.0×10-2mol/L 氯化钠溶液中测得电池电动势为60.0mV (钾电极为负极),在1.0×10-2mol/L 氯化钾溶液中测得电池电动势为90.8mV (钾电极为正极),钾电极的响应斜率为 55.0mV/pK 。
仪器分析 电位分析法(新)
玻璃膜内、外表面的性质基本相同
,则
k1=k2
,a
'
H
+
,
试
=
a
'
H
+
,
内
DEM
=
RT F
㏑a H + , 试
a H
+,
内
图4-4
E外
++++-
← H+ ← H+ ← H+ ← H+
由于内参比溶液中的H+活度 a H + , 内 是固定的,则:
DEM
=
K+
2.303RT
F
lg aH +
=
K 2.303RT F
≡SiO-Na+(表面)+ H+(溶液)=≡SiO- H+(表面)+ Na+(溶液)
△EM
外水化层与膜外溶液相界电位
E外 = k 1 +
RT㏑ F
aH+, 试
a
'
H
+
,
试
内水化层与膜内溶液相界电位
E内 = k 2 +
RT㏑ F
aH+, 内
a
'
H
+
,
内
E内
H+ -→+
H+ -→+
H+ -→+
H+ -→+
软质球状玻璃膜:含Na2O、CaO和SiO2, 厚度小于0.1mm 内部溶液:0.1 mol/L 的HCL内参比溶液 内参比电极:Ag-AgCL电极
玻璃电极
仪器分析--电位分析法习题 +答案 ()

姓名:班级:学号:电位分析习题一.单项选择题( ) 1、在直接电位法中,指示电极的电位与被测离子活度的关系为______A.无关B.成正比C.与其对数成正比D.符合能斯特公式( )2、电位分析法中作为参比电极,应满足的要求之一是:A.其电位应与温度无关B.其电位应等于零C.测量过程中即使有微小电流通过,其电位仍保持恒定D.不存在液接电位( )3、采用pH 的实用定义主要是因为:A.单个离子的活度目前用电化学方法不能测量B.液体接界电位的变化和理论上难以计算C.K'不能准确的测定和计算,并经常发生变化D.不对称电位可能随时间而变化( )4、氟化镧单晶膜氟离子选择电极的膜电位的产生是由于_______A.氟离子在晶体膜表面氧化而传递电子B.氟离子进入晶体膜表面的晶格缺陷而形成双电层结构C.氟离子穿透晶体膜而使膜内外氟离子产生浓度差而形成双电层结构D.氟离子在晶体膜表面进行离子交换和扩散而形成双电层结构( )5、电位滴定是以测量电位的变化情况为基础,下列因素影响最大的是:A.外参比电极电位B.液接电位C.不对称电位D.被测离子活度( )6、电位滴定法比直接电位法更准确,这是因为:A.直接电位法在用能斯特方程计算时有误差B.电位滴定法选用了比直接电位法更灵敏的电极C.电位滴定法是以测量电位的相对变化为基础的D.电位滴定法比直接电位法的干扰因素少( )7、由电动势测量误差看,如用同一仪器测下列离子,最不宜用直接电位法测定的是:A.H +B.NO 3 -C.Ca 2+D.B 3+( )8、氟离子选择电极在使用前需用低浓度的氟溶液浸泡数小时,其目的A.清洗电极B.检查电极的好坏C.活化电极D.检查离子计能否使用( )9、用pH 玻璃电极测定pH 约为12 的碱性试液,测得pH 比实际值A.大B.小C.两者相等D.难以确定( )10、用氟离子选择性电极测定饮用水中F - 含量时,Al 3+ ,Fe 3+ 的干扰属于:A.直接与电极膜发生作用B.与共存离子在电极膜上反应生成一种新的不溶性化合物C.与被测离子形成配合物D.与被测离子发生氧化还原反应( )11、某离子选择电极对一价的A 和B 离子都有响应,但a B 100 倍于a A 时,B 离子提供的电位与A 离子提供的相等。
3仪器分析电位分析法

pot A,B
越小,A离子选择电极抗B离子干
扰的能力越大,选择性越好。
由干扰离子所引起的误差:
e%
K pot A,B
aZA /ZB B
100
aA
误差与干扰离子浓度呈比例。
如:pNa电极,KNa+,H+ pot = 30, aNa+ = 10-3 mol/L, pH = 4, 5, 6时,e% = 300,30,3
平衡体系,测得的是物质游离离子的量。
电位滴定法-是向试液中滴加能与被测物质发生化 学反应的已知浓度的试剂,观察滴定过程中指示电 极电位的变化,以确定滴定的终点,根据所需滴定 剂的量计算出被测物的含量。
非平衡体系,测得的是物质的总量。
离子选择电极
离子选择电极是一种电化学传感器。它具有将溶 液中某种离子的活度变换成一定电位的能力。
流动载体电极又称为液膜电极,这种电极由电 活性物质(载体),溶剂(增塑剂),基体(微孔 支持体)以及内参比电极和内参比溶液等部分构成。 常见的电极形式有聚氯乙稀(PVC)膜电极和液膜 电极两种。
PVC膜电极的结构如图所示。将 电活性物质和PVC粉末一起溶在 四氢呋喃等有机溶剂(增塑剂) 中,倒在平板玻璃上,溶剂挥发 后得到透明的PVC膜为支持体的 薄膜。将薄膜切成圆片粘结在电 极杆上,管内装入内参比电极和 内参比溶液。此种电极与晶体膜 电极结构相似,以PVC膜代替晶 体膜。
1=k S lg aA
在校准曲线的水平线部分,即aB>aA, 电位值完全由干扰离子决定,则
2=k
'
S
'
lg
K
a pot
A,B B
假定k k ', S S ',在两直线交点的 M处,1=2,所以由以上两式得:
仪器分析-电位分析法

E电池 = E甘 – E玻
E电 池
E甘
K玻
2.303RT F
pH试
K'
2.303RT F
pH试
取标准pH缓冲液和被测溶液分别测得的电 池电动势为 Es 和 Ex 时:
pH x
pHs
Ex Es 2.303RT /
F
§4-4 离子选择性电极法
一、离子选择性电极的响应原理 离子选择电极(ion selective electrode,
Cx = -
cSVS V0
方法特点:能校正单次加标样造成的偶然误差,
定量精度较高。但必须作图,数据处理慢。
பைடு நூலகம் 下图
4、离子选择电极电位法的应用
离子选择性电极是一种以电位法测量溶液 中某些特定离子活度的指示电极。由于所需仪 器设备简单,轻便,适于现场测量,易于推广, 对于某些离子的测定灵 敏度可达ppm级(个别 可达ppb数量级),特效性较好,因此发展极 为迅速。
(standard curve, working curve)
特点:简单、快速、
logai
需要配置浓度稳定的一系
列标准溶液、便于批量分 E
析。但不能完全消除样品
中基底组分的干扰,需要
加大量“总离子强度缓冲
剂”。
logci
2、标准加入法 Standard addition method
设某未知试样的体积为V0 , 被测离子浓度为Cx , 则测得的电动势 Ex为:
极电位(E ’ )与反应型体活度的关系由能斯特
方程(Nernst equation )表示:
若某一电极上半反应的方程式为: Ox + ne Red
a 则其电极电位为 E E RT ln Ox a nF
第3章 电位分析法(仪器分析) (1)

§3-1 §3-2 §3-3 §3-4 §3-5 试题 概 述 金属基电极 离子选择性电极 直接电位法 电位滴定法
1
§3-1 概述
一、电位分析法(Potentiometry)
1.直接电位法(Direct Potentiometry) 通过测量电池电动势来确定待测离 子活度的方法。 特点:简单快捷 应用范围广 不破坏试液 试液用量少 利于实现连续和自动分析
(Silver Chloride Electrode )
4
217型甘汞电极
232型甘汞电极
1-导线;2-绝缘帽;3-加液口;4-内部电极;5-饱和KCl溶液;6-多孔陶瓷 芯;7-可卸盐桥磨口套管;8-可卸盐桥溶液;9-橡胶帽
5
甘汞电极的半电池可以写成:
Hg, Hg2Cl2 (s) |KCl
电极反应为:Hg2Cl2 + 2e实质是:Hg22+ + 2e Hg Cl /Hg
15
Ag
[
c
K SP (1)
2 2 o4
]
1 2
c
Ag
2 o4 2
K SP (1)
Ca
Ca
2
k SP ( 2 )
2
[
K SP ( 2 )
]
1 2
0.059 K SP (1) 0.059 Ag , Ag lg lg Ca 2 2 K SP ( 2) 2 0.059 lg Ca 2 2
(a)
图3-7 硫化银膜电极
(b)
(b)全固态型
32
(a)离子接触型
四、敏化电极
酶Pt/H2O2生物膜电极的基本原理图 1、工作电极(铂柱);2、Ag-AgCl参比电极; 3、电解液;4,5、透析膜;6、葡萄糖氧化酶 (GOD);7、固定圈;8、辅助电极 33
