第七章电位分析法
分析化学第7章课后知识题目解析

第七章氧化还原滴定1.条件电位和标准电位有什么不同?影响电位的外界因素有哪些?答:标准电极电位E′是指在一定温度条件下(通常为25℃)半反应中各物质都处于标准状态,即离子、分子的浓度(严格讲应该是活度)都是1mol/l(或其比值为1)(如反应中有气体物质,则其分压等于1.013×105Pa,固体物质的活度为1)时相对于标准氢电极的电极电位。
电对的条件电极电位(E0f)是当半反应中氧化型和还原型的浓度都为1或浓度比为,并且溶液中其它组分的浓度都已确知时,该电对相对于标准氢电极电位(且校正了各种外界因素影响后的实际电极电位,它在条件不变时为一常数)。
由上可知,显然条件电位是考虑了外界的各种影响,进行了校正。
而标准电极电位则没有校正外界的各种外界的各种因素。
影响条件电位的外界因素有以下3个方面;(1)配位效应;(2)沉淀效应;(3)酸浓度。
2.是否平衡常数大的氧化还原反应就能应用于氧化还原中?为什么?答:一般讲,两电对的标准电位大于0.4V(K>106),这样的氧化还原反应,可以用于滴定分析。
实际上,当外界条件(例如介质浓度变化、酸度等)改变时,电对的标准电位是要改变的,因此,只要能创造一个适当的外界条件,使两电对的电极电位超过0.4V ,那么这样的氧化还原反应也能应用于滴定分析。
但是并不是平衡常数大的氧化还原反应都能应用于氧化还原滴定中。
因为有的反应K虽然很大,但反应速度太慢,亦不符合滴定分析的要求。
3.影响氧化还原反应速率的主要因素有哪些?答:影响氧化还原反应速度的主要因素有以下几个方面:1)反应物的浓度;2)温度;3)催化反应和诱导反应。
4.常用氧化还原滴定法有哪几类?这些方法的基本反应是什么?答:1)高锰酸钾法.2MnO4+5H2O2+6H+==2Mn2++5O2↑+8H2O.MnO2+H2C2O4+2H+==Mn2++2CO2+2H2O2) 重铬酸甲法. Cr2O72-+14H++Fe2+===2Cr3++Fe3++7H2OCH3OH+Cr2O72-+8H+===CO2↑+2Cr3++6H2O3)碘量法3I2+6HO-===IO3-+3H2O,2S2O32-+I2===2I-+2H2OCr2O72-+6I-+14H+===3I2+3Cr3++7H2O5.应用于氧化还原滴定法的反应具备什么条件?答:应用于氧化还原滴定法的反应,必须具备以下几个主要条件:(1)反应平衡常数必须大于106,即△E>0.4V。
最新药物分析教案——第七章 巴比妥类药物的分析
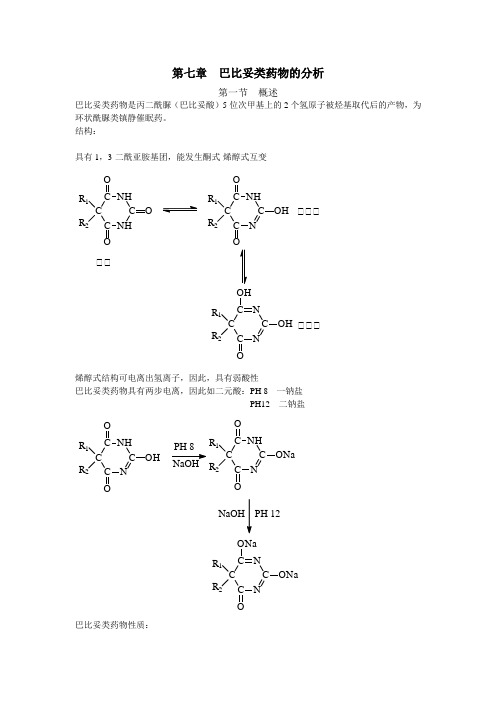
第七章 巴比妥类药物的分析第一节 概述巴比妥类药物是丙二酰脲(巴比妥酸)5位次甲基上的2个氢原子被烃基取代后的产物,为环状酰脲类镇静催眠药。
结构:具有1,3-二酰亚胺基团,能发生酮式-烯醇式互变C C NH C NH C OO R 1R 2O C C NC NHC OOR 1R 2OH C C N C N C OH OR 1R 2OH 酮酮酮酮酮酮酮酮烯醇式结构可电离出氢离子,因此,具有弱酸性巴比妥类药物具有两步电离,因此如二元酸:PH 8 一钠盐 PH12 二钠盐C C N C NH C OOR 1R 2OHC C N C N C ONa OR 1R 2ONaC C NC NH C OR 1R 2ONa PH 12NaOH巴比妥类药物性质:(1)、酸性溶液中不溶,易溶于乙醚、氯仿等有机溶剂中 (2)、钠盐易溶于水,不溶于有机溶剂中 (3)、钠盐加酸,析出巴比妥类药物 (4)、巴比妥类药物本身没有紫外吸收,但一钠盐或二钠盐有紫外吸收 PH 10 240nm 一钠盐 PH 13 255nm 二钠盐(5)具有酰亚胺结构,与碱溶液共沸即水解发生氨气 可使红色石蕊试纸变蓝C C NH C NH C OR 1R 2O NaOHCHCOONa R 1R 2+2+2NH Na2CO 3第二节 鉴别和检查一、鉴别 (一)、丙二酰脲类的鉴别反应 1、与硝酸银作用生成白色沉淀C C NH C NH C OR 1R 2O C C N C N C OAg R 1R OAgC C NC NH C OO R 1R 2ONa Na 2CO 3AgNO 3AgNO 3C C N C NH COR 1R OAg 酮酮酮酮酮酮酮酮酮酮酮酮酮酮酮酮加入硝酸银出现白色沉淀振摇溶解 加入硝酸银出现沉淀振摇不溶解 2、与铜吡啶试液作用显紫色或产生紫色沉淀C C NH C NH C OOR 1R 2O C C NC NHC OR 1R 2OH CuSO 4N2NN+2+SO 42-[]NC C N C NHC OR 1R 2O C C N C NH C OR 1R 2O CuNN紫色络合物举例:取巴比妥0.05g → 加吡啶溶液5ml ,溶解 → 加硫酸铜试液0.3ml → 紫色沉淀 → 加氯仿5ml → 氯仿层显紫色5位取代基亲脂性越强,生成的沉淀越易溶于氯仿3、与钴盐反应,生成紫堇色配位化合物C C NHC NH C OR 1R O 2C C N C NHC OR 1R OCC NH CN C O R 1R 2O +Co 2++4(CH 3)2CHNH 2NH 2CH(CH 3)2NH 2CH(CH 3)2反应条件:在无水条件下反应比较灵敏,因此所用试剂均不应含水分 常用溶剂:无水乙醇、甲醇 试剂:醋酸钴、硝酸钴或氧化钴 碱:异丙胺4、与汞盐反应生成白色沉淀 Hg (NO 3)2、HgCl 2生成的沉淀能溶与氨试液中C C NH C NH C OOR 1R 2O C C NC NHC OR 1R O3Hg(NO )C C N C N C OR 1R 2OH3酮酮酮酮NH 3C C N C N C O R 1R O -NH 4+沉淀溶解5、与香草醛反应C C N C NH C OR 1R O +CC NH C NC O R 1R 2O C C NH C NH C OO R 1R 2O CHOOHOCH 3H SO CHOHOCH 3酮酮酮酮酮酮CHOCH 3CC NC NC O O R 1R 2OH CC N C N C O OR 1R 2OH 96%酮酮举例:戊巴比妥10mg 和香草醛10mg → 瓷盘上 → 加浓硫酸0.15ml → 水浴上加热30秒 → 产生棕红色 → 放冷后加96%乙醇0.5ml → 颜色转为暗绿色(二)钠盐鉴别如为钠盐,加酸析出巴比妥类药物,依法进行鉴别C C N C NH C OR 1R ONa C C NH C NHC OOR 1R 2O H+(三)、取代基鉴别反应1、不饱和烃取代基,如司可巴比妥 (1)、使碘试液或溴试液褪色C C NHC NHC OCH 2CH 3(CH 2)2CH O CH 3CH 2+Br 2C C NHC NH C OOCH 2CH 3(CH 2)2CH OCH CH 3CH 2Br Br(2)使高锰酸钾溶液褪色C C NHC NH C OCH 2CH 3(CH 2)2CH OCH 3CH 2C C NHC NH C OCH 2CH 3(CH 2)2CH OCH 3CH 2OH OH KMnO 42、芳环取代基反应 苯巴比妥 (1)硝化反应与硝酸钾、硫酸加热 → 生成黄色硝基化合物C C NHC NH C OC 2H 5O C C NHC NHC OOC 2H 5O NO 2NO 22KNO 3H 2SO 4++黄色化合物(2)亚硝化反应与亚硝酸钠、硫酸反应生成桔黄色产物C C NHC NH C OC 2H 5O C C NHC NHC OC 2H 5O NONOH 2SO 4++2NaNO 2桔黄色产物(3)与甲醛-硫酸反应 → 生成玫瑰红色产物举例:中国药典苯巴比妥50mg → 放置试管中 →加甲醛试液1ml →加热煮沸 →冷却 →沿管壁缓缓加硫酸0.5ml →两层 →水浴加热 →界面显玫瑰红色二、检查中国药典规定检查苯巴比妥中检查苯基丙二酰脲及酸性杂质 苯巴比妥钠中检查流离苯巴比妥 检查方法:(1)吸收系数法 测定吸收度 →吸收系数 (2)薄层层析法将供试品配成1.0%、0.005%两种浓度的溶液,薄层展开0.005%溶液中的杂质斑点不得比1.0%溶液中的主斑点颜色深第三节 含量测定一、银量法CC N C NC OAg OR 1R 2OAg C C N C NH C OR 1R ONa AgNO 3AgNO 3C C N C NHCOR 1R OAg操作:取本品约0.2g ,精密称定 →加甲醇40ml 溶解 →加新鲜配制的3%无水碳酸钠溶液15ml (时间长,有二氧化碳吸收,碱度降低 NaHCO 3)→用AgNO 3滴定液(0.1mol/l )滴定 →出现白色浑浊 →终点实际上终点较难观察:滴加AgNO 3出现白色沉淀 →振摇 →溶解 →生成一银盐 →此时滴加硝酸银,在一银盐生成速度减慢,同时二银盐也生成,终点观察不易。
电位分析法的基本原理

电位分析法的基本原理首先,我们需要了解电位的概念。
电位是指电极表面的电荷状态与标准电极之间的差异,通常用电压来表示。
在电化学分析中,我们常用的是标准氢电极作为参比电极,其电位被定义为0V。
其他电极的电位则相对于标准氢电极而言,可以是正值,也可以是负值。
其次,电位分析法的基本原理与电极反应有关。
在电化学分析中,电极上发生的反应可以分为氧化和还原两种类型。
氧化反应是指电极上的物质失去电子,而还原反应则是指电极上的物质获得电子。
这些电极反应会导致电极的电位发生变化,而电位的变化可以反映出物质的性质和浓度。
基于以上原理,电位分析法可以分为两种基本类型,一种是直接测量电极的电位变化来分析物质的浓度,比如PH计和离子选择电极;另一种是通过控制电位来促使特定的电极反应发生,然后测量电流来分析物质的性质,比如极谱法和循环伏安法。
在实际应用中,电位分析法具有许多优点。
首先,它具有高灵敏度和高选择性,可以对微量物质进行准确测定。
其次,电位分析法的操作简便,不需要复杂的仪器和昂贵的试剂,因此成本较低。
此外,电位分析法还可以应用于各种不同的物质,包括有机物、无机物和生物分子等。
然而,电位分析法也存在一些局限性。
首先,它对环境条件比较敏感,如温度、PH值等,需要严格控制。
其次,一些物质可能会与电极发生非特异性的反应,导致测定结果的误差。
因此,在实际应用中需要进行严格的实验设计和数据处理,以确保测定结果的准确性和可靠性。
总的来说,电位分析法是一种重要的电化学分析方法,它基于电极的电位变化来分析物质的性质和浓度。
通过理解其基本原理和特点,我们可以更好地应用电位分析法进行实验研究和数据分析,为科学研究和工程实践提供有力的支持。
2020年智慧树知道网课《无机及分析化学2(山东联盟)》课后章节测试满分答案

第一章测试1【判断题】(2分)为测定某盐酸溶液的浓度,利用已知准确浓度的氢氧化钠溶液进行滴定操作,然后根据二者化学计量关系及消耗的氢氧化钠体积求算出盐酸溶液的浓度,这一测定方法是化学分析法。
A.对B.错2【判断题】(2分)按照分析对象分类,分析方法可分为无机分析法和有机分析法。
A.对B.错3【判断题】(2分)在分析化学中,超微量分析就是痕量成分分析。
A.错B.对4【单选题】(2分)分析化学的任务包括定性分析、定量分析和结构分析,当我们要测定物质的化学结构、晶体结构或者空间分布信息,这属于A.结构分析B.其他C.定性分析D.定量分析5【多选题】(2分)测定一铁矿石中的铁含量,称取铁矿石100克,分解后测得其中含铁量为0.05%,该分析过程为A.微量成分分析B.常量分析C.超微量分析D.常量成分分析第二章测试1【判断题】(2分)有效数字是指分析工作中实际能测量到的数字,每一位都是准确的。
A.对B.错2【判断题】(2分)从精密度好就可断定分析结果可靠的前提是系统误差小。
A.对B.错3【判断题】(2分)系统误差是由一些不确定的偶然因素造成的。
A.错B.对4【判断题】(2分)系统误差具有重复性、单向性和可测性。
A.错B.对5【单选题】(2分)下列数据中有效数字位数的是A.5.0000(1位)B.0.3006(4位)C.5.0008(5位)D.3.08×(3位)6【单选题】(2分)pH=12.00有效数字位数是A.0位B.4位C.2位D.1位7【单选题】(2分)分析某样品得到四个分析数据,为了衡量其精密度的优劣,可用()表示A.平均偏差B.绝对误差C.相对误差D.相对相差8【单选题】(2分)下列有关随机误差的论述中不正确的是A.随机误差具有单向性;B.随机误差是由一些不确定的偶然因素造成的。
C.随机误差在分析中是不可避免的;D.随机误差出现正误差和负误差的机会均等;9【单选题】(2分)可用以减少测定过程中的随机误差的方法是A.增加平行试验的次数B.进行仪器校准C.进行空白试验D.进行对照试验10【单选题】(2分)滴定分析法要求相对误差为±0.1%,若称取试样的绝对误差为0.0002g,则一般至少称取试样A.0.2gB.0.3gC.0.4gD.0.1g11【单选题】(2分)关于可用于减少系统误差的方法的是A.进行对照试验B.进行空白实验C.增加平行试验的次数D.进行仪器校准12【单选题】(2分)空白试验所得的空白值是指A.用分析试样时同样的方法,分析组成与待测试样相近的标准试样,所得的测定值;B.在已知分析试样中加入一定量标准样进行分析,所得的增加值;C.不加试样,按照分析试样时同样的手续进行分析,所得的测定值;D.用标准方法对已知组分的标准样品进行分析时所得值与真实值之差;13【单选题】(2分)下列测定过程造成的误差不属于系统误差的是A.重量分析中杂质产生共沉淀B.电位分析法测定自来水中的氯离子,配制溶液所用的蒸馏水中含有少量的氯离子;C.配制溶液过程中,称量样品时,少量样品洒落到天平内;D.以失去少量结晶水的基准为基准物质标定NaOH溶液的浓度14【单选题】(2分)下列有关精密度和偏差的论述中正确的是A.精密度能够反映系统误差的大小B.标准偏差比平均偏差表示分析结果更可靠C.精密度对测定的结果的准确度没有影响D.精密度可以通过误差的大小来评价第三章测试【判断题】(2分)化学计量点和滴定终点之间的差值称为终点误差。
第七章 电位分析法

离子敏感场效应晶体管(ISFET)
16-4 离子选择性电极性能参数
一、检测限与响应斜率 离子选择性电极能够检测到被测离子的最低浓 度。如图16-10中的CD与FG两延长线交叉点A 所对应的离子活度。 依能斯特方程直线的理论斜率为:
2.303 RT 理论斜率 zF
实际测定时斜率与理论值不一定相同。
(二)氟电极
氟电极的敏感膜由LaF3单晶片制成,为提高导电性, 在其中参杂少量Eu2+,Ca2+ ,二价离子的引入,使晶 格点阵中La3+被Eu2+,Ca2+取代,形成较多空的F-点 阵,增强了晶体的导电性,导电由F-完成。 氟离子选择性电极是目前最成功的单晶膜电极。
RT EF k ln a F F
能斯特方 程比较
EM
RT k ln a Ag F
二、电位选择性系数
电极选择性是指:电极对被测离子 和干扰离子响应的差异。 这种差异可用电极选择性系数Ki,j表 示。
RT z/m EM k ln( ai K iPot a ) ,j j zF
Ki,j表征了干扰离子对被测离子干扰的程度
玻璃电极的电位与溶液PH关系
玻璃电极的电位与溶液的PH有如下关系 RT E玻 k玻 ln aH F 2.303 RT E玻 k玻 pH 试 F
E玻 k玻 0.0592pH试
(三)阳离子玻璃电极
二、晶体电极
(一)电极结构 晶体电极的基本结构图16-5,其敏感膜 材料系难溶盐加压或拉制成的。能满足 室温下导电的难溶盐晶体只有少数几种, 氟化镧、硫化银、卤化银等。这类晶体 晶格能比较小,离子半径最小电荷最少 的离子F ,Ag+等参与导电。
物理化学模拟试题及答案(3)

第七章电化学选择题1.离子独立运动定律适用于(A) 强电解质溶液 (B) 弱电解质溶液(C) 无限稀电解质溶液 (D) 理想稀溶液答案C2. 电解质水溶液属离子导体。
其离子来源于(A) 电流通过溶液, 引起电解质电离(B) 偶极水分子的作用, 引起电解质离解(C) 溶液中粒子的热运动, 引起电解质分子的分裂(D) 电解质分子之间的静电作用引起分子电离答案:B3. 在电导测量实验中, 应该采用的电源是(A) 直流电源(B) 交流电源(C) 直流电源或交流电源(D) 测固体电导用直流电源, 测溶液电导用交流电源答案:D4. 德拜-休克尔为了推导出"极限定律",作了一些基本假定。
下列假定不在他们的假定之列的是(A) 溶液中导电的是离子而不是分子(B) 任何浓度的强电解质都是完全电离的(C) 离子之间以静电力相互作用, 其间的吸引能大于它们的热运动能(D) 在稀溶液中离子是刚性的圆球形点电荷, 不极化答案:A5. 电解质水溶液的离子平均活度系数受多种因素的影响, 当温度一定时, 其主要的影响因素是(A) 离子的本性 (B) 电解质的强弱(C) 共存的它种离子的性质 (D) 离子浓度及离子电荷数答案:D6. 采用电导法测定HAc的电离平衡常数时, 应用了惠斯登电桥。
作为电桥平衡点的示零仪器,不能选用(A)通用示波器 (B)耳机 (C)交流毫伏表 (D)直流检流计答案:D7. 电位滴定法是广泛使用的一种电分析方法。
在下列方法中能够用来确定电位滴定终点的是(A) 测量溶液电阻的变化 (B) 测量电极电位的突跃变化(C) 选用合适的指示电极 (D) 测定溶液pH值的突跃变化答案:B8. 离子的迁移数是指正负两种离子在作电迁移运动时各自的导电份额或导电的百分数, 因此, 离子的运动速度直接影响离子的迁移数。
它们的关系是(A) 无论什么离子,它们的运动速度愈大,• 迁移的电量就愈多,迁移数也愈大(B) 同一种离子的运动速度是一定的, 故它在不同的电解质溶液中, 迁移数相同(C) 在只含某种电解质的溶液中, 离子运动的速度愈大, 迁移数就愈大(D) 在任何电解质溶液中, 离子运动的速度愈大, 迁移数就愈大答案:C9. 采用对消法(或称补偿法)测定电池电动势时, 需要选用一个标准电池。
分析化学第三版下册答案

2 第一章绪论5 第二章光学分析法导论7 第三章紫外-可见吸收光谱法9 第四章红外吸收光谱法11 第五章分子发光分析法13 第六章原子发射光谱法21 第七章原子吸收与原子荧光光谱法27 第八章电化学分析导论30 第九章电位分析法34 第十章极谱分析法37 第十一章电解及库仑分析法41 第十二章色谱分析法第一章绪论1.解释下列名词:(1)仪器分析和化学分析;(2)标准曲线与线性范围;(3)灵敏度、精密度、准确度和检出限。
答:(1)仪器分析和化学分析:以物质的物理性质和物理化学性质(光、电、热、磁等)为基础的分析方法,这类方法一般需要特殊的仪器,又称为仪器分析法;化学分析是以物质化学反应为基础的分析方法。
(2)标准曲线与线性范围:标准曲线是被测物质的浓度或含量与仪器响应信号的关系曲线;标准曲线的直线部分所对应的被测物质浓度(或含量)的范围称为该方法的线性范围。
(3)灵敏度、精密度、准确度和检出限:物质单位浓度或单位质量的变化引起响应信号值变化的程度,称为方法的灵敏度;精密度是指使用同一方法,对同一试样进行多次测定所得测定结果的一致程度;试样含量的测定值与试样含量的真实值(或标准值)相符合的程度称为准确度;某一方法在给定的置信水平上可以检出被测物质的最小浓度或最小质量,称为这种方法对该物质的检出限。
2. 对试样中某一成分进行5次测定,所得测定结果(单位μg ⋅mL -1)分别为 0.36,0.38,0.35,0.37,0.39。
(1) 计算测定结果的相对标准偏差;(2) 如果试样中该成分的真实含量是0.38 μg ⋅mL -1,试计算测定结果的相对误差。
解:(1)测定结果的平均值37.0539.037.035.038.036.0=++++=x μg ⋅mL -1 标准偏差122222120158.015)37.039.0()37.037.0()37.035.0()37.038.0()37.036.0(1)(-=⋅=--+-+-+-+-=--=∑m Lg n x x s n i iμ相对标准偏差 %27.4%10037.00158.0%100=⨯=⨯=x s s r (2)相对误差 %63.2%10038.038.037.0%100-=⨯-=⨯-=μμx E r 。
2014-第七章-电位分析法--作业标准答案

第七章 电位分析法 作业答案一、选择题(每题只有1个正确答案) (2分⨯10=20分)1. pH 玻璃电极水化胶层传导电流的离子是( )。
[ D ]A. 只有Na +B. 只有H +C. 只有OH -D. Na +和H +2. 测定溶液中CO 2气体的气敏电极,其中介溶液中的平衡离子是( )。
[ D ]A. Cl -B. SO 42-C. NO 3-D. HCO 3-3. 氟电极的主要干扰离子是( )。
[ B ]A. Cl -B. OH -C. NO 3-D. SO 42-4. 氟电极的最佳pH 测量范围为5~5.5,当测量pH 较大时,其测量结果将比实际值( )。
[ A ]A. 偏高B. 偏低C. 不影响D. 不能判断5. 一种氟电极对OH -的选择系数为0.10,如允许误差为5%,那么在1.0⨯⨯10-2mol.L -1的F -溶液中,能允许的OH -应小于( )mol.L -1。
[ B ]A. 5×10-2B. 5×10-3C. 5×10-4D. 5×10-56. 某钠电极,其选择性系数30H ,Na =++K ,欲用此电极测定pNa=3的Na +溶液,并要求测量误差小于3.0%,则试液pH 必须大于( )。
[ B ]A. 3.0B. 6.0C. 9.0D.107. 以pH 玻璃电极做指示电极,用0.200 mol.L -1 KOH 溶液滴定0.0200 mol.L -1苯甲酸溶液;从滴定曲线上求得终点时溶液的pH 为8.22,二分之一终点时溶液的pH 为4.18,则苯甲酸的解离常数为( )。
[ B ]A. 6.2⨯10-5B. 6.6⨯10-5C. 7.2⨯10-5D. 8.2⨯10-58. 常温、常压下,当试液中二价响应离子的活度增加一倍时,该离子电极电位变化的理论值是( )mV 。
[ C ]A. 2.8B.5.9C. 8.9D. 10.29. 某玻璃电极的内阻为100MΏ,响应斜率为50mV/pH ,测量时通过电池回路的电流为1.0⨯10-12A ,由此产生的电压降引起的测量误差相当于( ) pH 单位。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
讨论
◈ 不对称电位
膜
外
内
RT ZF
lnH (外) H (内)
如果 H (外) H (内) , 则 膜 0
但实际上 膜 0 ,即存在不对称电位。
☀ 使用前,需长时间浸泡,使不对称电位趋于稳定。
◈ 酸差和碱差
考宁015玻璃电极:pH 1~10
pH<1
a 'M (内)
膜本体
敏感膜
道,外
k1
RT ZF
ln aM (外) a 'M (外)
a 'M (外)
k1 k2,a 'M (内) a 'M (外) ,
待测溶液 aM (外)
且扩,外 扩,内
膜
道,外
扩,外
扩,内-道,内
RT ZF
ln M (外) M (内)
膜
常数
RT ZF
ln M (外)
对RZ-产生响应时,
膜
RT ZF
ln
aR(内) aR(外)
膜
常数
RT ZF
ln aR(外)
常数项为膜内界面上的相间电位及膜的内外 两个表面不完全相同而引起的不对称电位。
三 玻璃电极
1、pH玻璃电极的构造
构造
内参比溶液 0.1mol/LHCl
W
PNH3 H
H
NH
4
KW
PNH3 K s
k' PNH 3
玻璃电极
k
RT F
l
n
H
常
数
RT F
l n PNH3
CO2气敏电极
中介溶液:0.01 mol·L-1NaHCO3
玻璃电极
k
RT F
ln H
常
数
RT F
l nPCO2
5、 生物电极
1) 酶电极
L-谷酰胺 鸟嘌呤 尿酸 儿茶酚胺
黄瓜 大豆 香蕉肉 土豆
谷氨酸 尿素 多巴胺 儿茶酚胺
第三节 离子选择电极性能参数
一 线性范围和检测下限
E Байду номын сангаасK 2.303RT lg
ZF
检测下限
线性范围
符合能斯特公式的响应范围
二 电位选择性系数
K Pot i, j
响应离子:iZ+;共存离子:jm+
膜
KCl
KCl
1
2
离子扩散具 有强制性和
选择性
D
1
2
RT nF
ln
a(2) a(1)
D
1
2
RT nF
ln
a(2) a(1)
膜电位
对RZ+产生响应时,
道,内 扩,内
扩,外 道,外
内参比电极
内参比溶液 aM (内)
道,内
k2
RT ZF
ln
aM (内) a 'M (内)
2Ag+ + S2-
2 Ag
S2
Ksp(Ag2S)
1
Ag
K
sp(
Ag2S
)
2
S2
ISE
k'
RT 2F
ln S2
S2-浓度测定范围:0~10-7mol/L
3)、其它晶体膜电极
电极组成
AgCl-Ag2S AgBr-Ag2S AgI-Ag2S AgI-Ag2S AgSCN-Ag2S CdS-Ag2S CuS-Ag2S PbS-Ag2S 任何卤化银或Ag2S
内参比电极 内参比溶液
酶层
C O(NH 2
)2
H3O
H2O
尿素酶
2NH
4
HC O3
CO(NH 2 )2 H2O 尿素酶 2NH 3 CO2
葡 萄 糖 O2 H2O 葡萄糖氧化酶葡 萄 糖 酸 H2O2
H2O2
3I
2H
过氧化物酶
测定值偏高(酸差)
☞产生原因:在强酸性溶液溶液中,H+的浓度
很高,相对而言,H2O的活度降低,H+靠H3O+ 传递,达到电极表面的H+减少,pH值增大。
测定值偏低 (碱差或钠差)
pH>10
☞产生原因:在强碱性溶液溶液中,H+的活度低,
Na+活度高,Na+重新进入玻璃膜的硅氧网格,并占据 少数交换点位,导致测量到的H+活度偏大,pH值偏低。
lg(NO3
K
Pot NO3
,HPO
2 4
1/ 2 HPO
2 4
)
误
差
%
K =
pot NO3
,
HPO
2 4
1/ 2 HPO
2 4
100%
2%
NO3
NO3
1.4104 (2)1/ 2 2%
100% 0.01mol
L1
三 响应时间
响应时间
电位测定法 的理论依据
去极化电极
电极的电位在电化学测量过程中始终保持 不变的电极,如参比电极
极化电极
电极电位随着外加电压的改变而改变的电 极;具有这种性质的指示电极,又称为工 作电极
电位分析法
指示电极 参比电极均为去极化电极
原因: 测量电极的电位是在零电流状态下进
行的
第七章 电位分析法
第二节 离子选择性电极和膜电位
从两电极刚接触溶液时起,到电池电动 势达到稳定数值(E变化在±1 mV之内)
所需时间。
搅拌 四 稳定性
是缩短响应时间的 有效方法
五 电阻
第五节
重要的实验条件
一 离子强度的影响
E
ISE
K
2.303RT ZF
lg
K 2.303RT lg c
lgc
ZF
K 2.303RT lg 2.303RT lgc
锂玻璃电极,pH > 13时,才发生碱差。
3、复合PH玻璃电极
4 其他阳离子玻璃电极
主要响 应离子
Na+
玻璃膜组成(摩尔分数, %) 电位选择性系数
Na2O Al2O3 SiO2 11 18 71
KNa+,K+: 3.6×10-4
K+
27 5 68
KK+,Na+: 0.05
Ag+ 11 18 71
原理
其原理可用晶体中离子传导原理及膜表 面离子间扩散解释。
LaF3 空穴 LaF2+ F 离子的移动传导电流
缺陷空穴的大小、形状和电荷分布,只能容 纳特定的可移动的晶格离子,其它离子不能进入 空穴,故亦不能参与导电过程。
故晶体敏感膜具有选择性。
1)、氟电极(固态晶体电极)
◈ 膜电位的产生
二癸基磷酸根可以在液膜-试液两相界面间传递钙离子, 直至达到平衡。由于Ca2+在水相(试液和内参比溶液)中的 活度与有机相中的活度差异,在两相之间产生相界电位。 液膜两面发生的离子交换反应:
[(RO)2PO]2 - Ca2+ (有机相) = 2 [(RO)2PO]2 -(有机相) + Ca2+ (水相)
第七章 电位分析法
第七章 电位分析法
一、电位分析法概述
电位分析
是利用电极电位与化学电池电解质溶液中某 组分浓度的对应关系,实现定量测定的方法
实质
零电流 测定原电池电动势
电极与测量仪器
(参比电极、指示电极、电位计);
直接电位法
电位滴定法
电位分析分类
☛ 直接电位法
☛ 电位滴定法
第七章 电位分析法
超微电极用于单细胞活体分析
2 仪器
直接电位法
3 定量测量方法 1 标准曲线法
A电极|AZ+(α)¦¦KCl(≥3.5mol·L-1)|Hg2Cl2, Hg
E K ' 2.303RT lg c ZF
调节相同PH值 加入TISAB
测F-过程所使用的TISAB典型组成:1mol/L的NaCl,使溶液保持较 大稳定的离子强度;0.25mol/L的HAc和0.75mol/L的NaAc, 使溶液pH在5左右 ;0.001mol/L的柠檬酸钠, 掩蔽Fe3+、Al3+等干扰离子。
钙电极适宜的pH范围是5~11,可测出10-5 mol/L的Ca2+ 。
4、 气敏电极
Ag-AgCl电极 透气膜
0.1 mol·L-1 NH4Cl溶液
玻璃电极 内参比溶液
玻璃膜 氨气敏电极
NH3 + H2O Ks NH4+ + OH-
Ks
NH
4
OH
PNH 3
K NH
4
ZF
ZF
调节和控制离 子强度的方法
加入足够量的 惰性电解质
第六节 定量分析方法
一 直接电位法(离子选择性电极法)
1 原理与特点
(1)原理 E K 2.303RT lg
(2)特点与应用
ZF
阴离子 阳离子 有机离子 生物物质 气体分析 碱金属离子分析 分析范围宽,可达几个数量级 工业流程 环境监测中用作传感器
KNa+, K+ 3.6×10-4 (pH=11)
3.3×10-3 (pH=7)
Na+ 10.4 22.6 67
