全市药品生产企业GMP认证情况表
河北省兽药GMP认证企业基本情况表

20 0 6年 9月 3 0日 农 历 八 月初 九
姐 放 业 青 低
贮 成
玉 本
信 息 有限公 司 粉针、 水针 、 粉散 荆 、 消毒剂 近 日. 龙 汀 省 青 贮 玉 米 收 获 现 黑 为 推 广 机 械 化 收 .近 年 来 , 河 北远 征 黑 粉针 、 水打针 太针( 非静 ) 灌注剂 ( 乳房给 药) 预剂 、 非 、 口服液 场 会 在 安 达 市 召 开 , 几 处 大 型 青 贮 龙 汀 省 针 对 进 口青 收 获 机 价 格 普 河 北奥 菲动物 药业有限 公司 在 水针 、 口般 液 K水种 植 内 . 种 型 号 的青 贮 收 获 遍 偏 高 的 问 题 . 大 力 度 研 制 、 发 河 北奥 菲动物药 业有限 公司 各 加 开 粉 , 、 毒荆 散 消 河 动 态: 粉散剂 、 颗粒 押 、 J 水针 , = 机 神 通 . 些 机 械 与以 往 人 T 收 自主 知 识 产 权 的 青 时 收 获 机 并 获 得 北华捅 药业有 限公 司 这 深 州保 吉安康兽 药翩 品有限 公司 动态: 粉散荆 、 口服 液 割 、 输 、 车 、 机 再 粉 碎 的 繁 琐 不 成 功 。这 些 自主 生 产 的 机 械 虽 然 质 量 运 卸 填 傈 定市 冀申药 业有限公 司 动态: 粉散剂 、 消毒 剂 、 水针 、 口服 液 、 片荆 、 颗粒剂 它 们 在 收 割 的 同 时轻 松 实 现 了对 还 不 能 完 全 达 到 进 口产 品 的水 平 . 华北制 药集团 动物保健 品有 限公司 动态: 但 粉针 、 水针 、 粉剂 t 料 的 直 接 粉 碎 , 大 提 高 了 劳 动 生 价格 却 只 有进 口机 械 的 =丹 之 一 。 华药集 闭动保 公司 日 大 三 同 散荆, 预棍剂 动态: 散剂 、 粉 消毒 剂 产 牢 . 决 r以往 种 养殖 户 最 为 头 痛 时 . 了 解 决 农 民 购 买 机 械 资 金 不 足 石 家庄 江山动 物药业有 限公 司 解 为 粉散 预剂 的 收 难 题 、 的 问 题 年 起 财 政 还 对 农 民 、 石 家座 市格瑞特 动物药 业公 司 今 省 农 区采昌兽药 有限 公司 动态 : 荆、 针 、 粉散 水 口服i 颗粒 j 瞳、 f 吐 这是黑 龙江省推广机械化收贮 , 场 、 青 公 司购 买 青 贮 机 械 每 台 给 予 生物技术有 限公 司 动态 : 散剂, 耪剂 人 力研 制 、 发 自 主知 识 产 权 的 青 贮 3 %的 补 贴 . 开 O 一些 青 旷 种 植 大 县 还 在 动物药业 有限公 司 粉散 荆 收 擅机 获 得 的 成 功 。 此 基 础 上再 自拿 2 % 进 行 补 贴 , 样 O 这 动物药业 有限公 司 徽剂 粉荆 物药业有 跟公 司 动态 : 糟散剂 口般液 青 玉米 饲 料 适 口性 好 、 养 丰 算 下 来 . 民 购 买 青 收 获 机 械 只 要 河北 普德 动 营 农 河北 源药韭 有限公 司 动态 :} 刺 罄散 寓 , i , 年 来 , 种 优 质 饲 料 在 黑 拿 一 半 的 钱 就 可 以 r f是 近 【 这 河北 盘丰动 物药业有 限公 司 动态 : 剂 粉散 龙江 省 的 推 广 过 程 并 不 顺 利 。以往 青 在各种扶持政策 的作 用下, 黑龙 石家 庄市地邦 兽药有 限公 司 动 态 : 剂 、 毒荆 、 粉散 消 水针 、 口服液 J 五米 饲 料 收 割 、 输 、 车 、 机 、 汀 省 各 地 购 买 青 贮 机 械 的 积 极 性 大 石家 庄市科 星动物保健 品公 司 。 运 卸 填 动态 : 荆 、 毒剂f 粉散 消 液体1 水针 、 、 口服液 、 I 大输液 片) 畸、 粉碎 实 、 严 等 诸 多 环 节 都 需 要 幅 提 高 今 年 到 目前 为 止 , 省 经 省 河北 瑞高药 业有限公 哥 封 全 动态 : 粉散剂 针 水 _ 庄瓤宇 动物药业 有限公 司 石家 动态 : 粉散 剂 人 l操 作 . 序 复 杂 . 青 贮 玉 米 的 财 政 补 贴 购 置 的 青 时= 械就 达 到 64 : 程 而 , 机 9 石隶 庄华被 集团兽药 公司 动态 : 粉散剂 逝宜收 获期只有不足 2 O天 , 间 短 、 什 ,仅 这 些 机 械 的 收 贮 能 力 就 达 到 时 河北 华强动 物药业有 限公 司 动态 : 荆 粉散 i 量 大 .} 很 多 人 对 青 贮 玉 米 2 2 吨 。而 记 者 从 省 畜 牧 兽 医 局 了 河北 华强动 物药业有 限公 司 作 f此 ] 3万 水针 口服液 饲料 产 生 畏 难 情 绪 。 采 用 机 械 化 收 解 到 . 下 黑 龙 江 省 青 玉 米 收 获 期 河北 华天动 街保健 品有 限公 司 眼 动态 : 粉散剂 获后 . 多个 步 骤 可 以 ・ 性 完 成 . 次 机 刚 刚 开 始 . 地 购 买 青 收 获 机 的 热 藁城 市四梅药 业有 限公 司 各 动春: 粉钟 、 水针 河北 省藁城 四海药业 有限公 司 太针 、 散, 糟, 预剂 械 收 割 机 比 人 丁 铡 切 质 量 好 , 仅 提 情 还 在 进 一 步 提 高 黑 龙 江 日 报 不 华 水针 、 口服 液 、 片荆 、 颗粒 蠢 0 f7 4 1 石家 庄市光 畜牧业 有限公 司 0 D7 O 岛 r青 贮 生 产 中 的 劳 动 生 产 牢 和 质 - 华畜牧业 有限公 司 粉, , 散 预混荆 、 消毒 剂( 液体 ) 还 减 少 了劳 动 强 度 和 生 产 成 本 星药业( 集团) 司 公 动态: 粉散 荆 、 混剂 、 预 消毒 剂(葭体 ) { 槛 兽药有 限公 司 动态 : 粉散荆 、 混剂 预 河北 新华科 援兽药有 限公 司 承针 、 针、 粉 口般液 、 村( 清毒 液) 深州 同德兽 药有限公 司 动志 : 耕 、 菌肽锌 原料 预混 杆 悍寓 市越农 动物药业 有限 公司 动态 : 剂 预混剂 粉散 河北 诚康药 业有限公 司 动态 : 荆 粉散 河北 一兽药业有 限公 司 动态 : i 、 粉散 f 预混剂 l I 玉 米 收 F了 . 秆 怎 幺 办' 往 吨 货 隆镇 当地 的 玉米 秸 秆 已不 能 秸 . 河北 新世纪 动物药业 有限公 司 动态 : 粉散剂 、 Ⅱ服液 、 粳粒 剂 消毒剂 ( 液体 ) 针 、 永 粉针 、 片剂 年 这 时 节 . 是 不 少 庄稼 人 犯 难 的 满足 需求 . 司 目 前 的 秸 秆 原 料 都 正 公 河北新 世纪 动物药业 有限公 司 预混 剂 、 杀虫剐 ( ) 液 时候. 而今 年 海 门 市 货 隆镇 厦 周 边 由 农 民 经 纪 人 从 周 边 其 他 乡 镇 收 河北康 利兽 药有限公 司 动态 : 、 水针 口骧液 ’ 粉散荆 、 漉剂 预 石家 庄九通 兽药厂 动态 : 液 、 散荆 、 口服 粉 预混剂 方 圆 百 里 的农 民 却 喜 上 眉梢 : 机 来 的 。 农 石家 庄华曙 制药企 宁药业公 司 静春: 土霉素 盐酸土莓素、 硫酸新霉素、 盐酸多西环素、 阿雏菌幕五个口疆缀兽用原料药 部 门推 广 的 秸 秆 青 贮技 术 . 货 隆 在 记 者在 秸 秆加 工 现 场 看 到 . 一 石家庄 彤盛 药业有 限公司 动态 : 消毒剂( 液体) 糟散 剂 预混荆 、 镇催 生 了 一 家 草 业 公 司 . 秆 卖 到 棵 棵 玉 米 秸 秆被 送进 破 碎 机 切 段 、 秸 河北技 工商 动物饲料 兽药公 司 粉针 、 针 水 加 再 这 里被 加 工成 “ 牛罐 头 ” 农 民每 揉 丝 . 入 生 物 添 加 剂 . 通 过 圆 奶 . 何 l 龀牧 工商 动物饲料 兽药公 司 粉, 预剂 散, 拇 北正 大鸿 橱药业有 限公 司 动态 : 粉散剂 、 混剂 、 预 水针 卖 一 亩 玉 米 秸秆 可 获利 近 2 0元 捆 机 捆 扎 成 型 .然 后 经 包 膜 机 包 0 邯郸 久鹏精 细化工有 限公 司 盐酸 多西环 素原料药 车间 在 地 处 货 隆 镇 的 南 通 市 兴 荣 膜 . 誉 为 “ 牛罐 头 ” 成 品 就 生 被 奶 的 沧州 市方正 畜禽药 品有限公 司 动态 : 荆 、 混荆 粉散 预 产 出 来 了。 慧 锋 介 绍 说 . 种 “ 姜 这 奶 草 业 有 限公 司 . 当地 农 民给 记 者 算 石家 庄丰强 动物药业公 司 动态 : 剂 、 针 、 粉散 水 消毒剂 ( ) 液 一 了 一笔 账 : 亩 地 . 间 套 种 玉 米 . 牛 罐 头 ” 质 期 可 达 两 年 . 颇 受 一 如 保 是 河北 威趣动物 药业有 限公 司 粉散 预刺 水针 、 原料 依维 密度 在 40 50棵 左 右 .秸 秆 重 量 两 奶 牛 场 青 睐 的 上 等 饲 料 今 年 公 司 河北 威远动 物药业有 限公 司 水针 大针 、 消毒剂 、 杀虫剂 、 浇泼刺 、 乙酰 氨摹阿 维菌煮 预混刺 河北 安然药业 有限公 司 粉散 瑗 帮 口服淮 吨 多 , 公 司每 吨 1 0 1 0元 的收 已与 上 海 、 州 、 锡 、 波 等 地 的 按 0 ̄ 2 苏 无 宁 河北 安霖 药业有限公 司 粉, 预剂 、 原料 磺胺氯 毗礤钠 购价算, 就是 20 多元 而 在 以 往 , 奶 牛 养 殖 场 签 下 5 0 0 0 0吨 的 订 单 , 河北 安霖制 药有限 公司 磺胺 缕达嗪 铺、 环丙胺 嚷 敌百虫 这 些 玉 米 秸 秆要 么 焚 烧 , 幺 堆 放 目前 市 场仍 在 进 一 步 拓 展 中 要 河北 紫金药 业有限 公司 粉, 预混剂 、 散剂 田 间 地 头 . 不仅 卖 不 出 一 分 钱 . 还 据 了解, 目前 �
药品企业gmp认证自查报告

药品企业gmp认证自查报告1. 引言Good Manufacturing Practices(GMP)是指制药、医疗器械及相关产品制造过程中,质量管理系统的一系列要求和规定。
作为一家药品企业,我司一直以来都高度重视GMP认证,并致力于提高产品质量和生产工艺的标准化。
本文将针对我司的GMP认证情况进行自查,并提供相应的改进建议。
2. 自查内容2.1 设备和设施1. 工厂内设备是否齐全,是否能够满足生产工艺要求?2. 设备是否处于良好的维护状态,是否定期进行保养和校准?3. 生产区域是否能够有效地控制温度、湿度和洁净度?4. 设备清洁程序是否规范,并有相应的记录?2.2 人员和培训1. 是否有合格的员工,包括生产操作员、质量控制人员等?2. 员工是否接受了相关岗位培训,并定期进行培训和考核?3. 是否有良好的卫生习惯和个人防护要求,并有相应的记录?2.3 质量管理系统1. 是否建立了符合GMP要求的质量管理体系?2. 是否有规范的记录管理制度,并对记录进行定期审核和归档?3. 是否定期进行质量风险评估和控制?2.4 原辅材料管理1. 是否有明确的原辅材料采购要求,并与供应商签订合同?2. 是否对进货的原辅材料进行验收和取样,并建立相应的记录?3. 是否有对原辅材料进行完整的追溯体系?2.5 生产记录1. 是否建立了规范的生产记录表,并定期进行复查?2. 是否对不合格品进行正确处理,如停产、追溯等?3. 生产记录是否能够准确反映生产过程并进行记录?3. 自查结果3.1 设备和设施1. 工厂内设备齐全,能够满足生产工艺要求。
2. 设备维护状况良好,定期保养和校准工作得到落实。
3. 生产区域能够有效地控制温度、湿度和洁净度。
4. 设备清洁程序规范并有相应的记录。
3.2 人员和培训1. 有合格的员工,但需要进一步提高员工素质和技术培训。
2. 员工接受了相关岗位培训,但培训和考核工作可以更加完善。
3. 有良好的卫生习惯和个人防护要求,但需要加强监督和记录的管理。
GMP认证申报资料及现场检查中发现的问题

GMP认证申报资料及现场检查中发现的问题云南省食品药品监督管理局药品认证审评中心内容提要一、认证情况简介二、认证现场检查中发现的问题三、申报资料中存在的问题认证情况简介¡全省通过GMP认证药品生产企业共158家,其中无菌制剂(含生物制品)生产企业26家,原料药及非无菌制剂生产企业108家,医用氧生产企业17家,中药饮片生产企业7家。
¡06年认证35家,飞行检查25家,跟踪检查10家,有因飞行检查2家,飞行检查及跟踪检查现场检查报告中严重缺陷8项,通常缺陷项447项。
¡07年认证38家,飞行检查52家(次),有因飞行检查3家4次,52份飞行检查现场检查报告中严重缺陷有11 项,通常缺陷316项。
现场检查中发现的问题¡ 1.缺陷项目统计¡ a.125份现场检查报告样本统计¡ b.07年认证缺陷项目统计¡ c.07年飞行检查缺陷项目统计¡ 2.缺陷项目要紧涉及内容机构与人员¡发现较多的缺陷条款:0601、0603、0701¡涉及内容:¡ a.足够资历与经验的人员缺乏¡——人员不稳固,人员的实践经验与知识无法应付可能出现的问题,导致产生质量问题的风险;¡ b.上岗与继续培训针对性、专业性、持续性差¡——培训缺乏目的性,流于形式,培训效果在实际操作中难以表达;¡ c.未严格按书面规定操作¡——文件未进行培训,不能清晰懂得要干什么,职责是什么,如何按规操作并准确记录;¡ d.未雇用特殊专业人员¡——如空调、机械工程师或者技工;¡ e.无足够的员工完成工作任务¡——存在岗位临时顶替现象,不重视培养合格、有经验的后备人员;¡ f.人员、理念、执行与GMP要求有差距厂房与设施、设备¡发现较多的缺陷条款:0801、1001、1101、1201、1204、1205、1502、1504、1602、2401、2601、2802 、3501、3601、3602、3701¡涉及内容:¡ a.生产环境¡——对厂区周围地势、气候、噪声、产尘、邻居等因素不进行熟悉;¡——厂区的卫生状况不佳;¡——污染/废水未经处理或者收集就排放;¡ b.厂房¡——防止昆虫与其他动物进入措施不力;¡——不易清洁、保护保养不当;¡——生产区或者储存区的面积空间与规模不相习惯,储存区的物料等防止差错与交叉污染的措施不当;¡ c.洁净区¡——洁净厂房未分析定期监测结果;¡——指示压差装置未按需安装;¡ d.空调系统、水系统¡——水系统定期清洗消毒的设定不合理;¡——水系统定期监测警戒限与行动限未设定;¡——取水点防止污染措施不力;¡——空调系统未按规定保护、保养;¡——高效过滤器未监测或者措施不完善;¡ e.设施、设备¡——未按需安装捕尘设备;¡——未按规定保护、保养;¡——微生物检查室洁净级别不符合药典要求;¡——部份生产与检验用仪器、仪表未定期校验;¡——部分设备无状态标识或者不规范;¡——呼吸器、压缩空气过滤器管理不清晰;物料¡发现较多的缺陷条款:3801、3902、4002、4302、4702¡涉及内容:¡ a.物料管理¡——供应商审计与评估仅进行合法性审查;¡——标签说明书领用等规程的可操作性差;¡——中药材、中药饮片状态标识内容不完整;¡——不合格物料未及时处理;¡ b.物料检验¡——原、辅料未按批取样检验;¡——复验周期未设定或者设定不合理,到期未进行复验;¡ c.物料储存¡——标签、说明书帐物不符;¡——未按规定储存物料;卫生¡发现较多的缺陷条款:4301、4902、4903、5401¡涉及内容:¡ a.卫生管理¡——对进出洁净区人员操纵不力;¡——清洁记录形式化;¡ b.人员卫生¡——工衣穿戴不符合要求。
药品生产企业质量信用等级AA、AAA级

湖南省药品生产企业质量信用等级AA、AAA级
评估细则(讨论稿)
一、参评基本条件
1、企业必须达到《湖南省药品医疗器械生产经营企业质量信用等级评估实施办法(试行)》第四章规定的“评估条件”;
2、企业必须经所在地州市局评估,达到A级质量信用等级;
3、企业连续三年销售回款额平均在5000万元以上;
4、企业连续三年均为一次性通过药品GMP认证检查、跟踪检查。
二、等级评估方式
1、企业主动申请,所在地市州局进行推荐;
2、评估工作由省局组织,以行业协会名义进行,省局诚信办负责具体实施;
3、按合理比例分别抽取药品生产企业专家、药品GMP检查员、药品安监人员、社会代表组成评估小组,负责具体评估评分;
1
4、评分采取扣分制,坚持资料审查与现场检查相结合原则。
三、评估考核内容
1、评估细则分6个大项20个小项,每项分值为1-10分不等,总分为100分(附药品生产企业质量信用AA、AAA等级评估评分表);
2、对存在否决情形的本项分全扣,存在部分缺陷的按缺陷细数扣分,直到扣完本项为止。
四、等级评估标准
1、AA、AAA级实行同一评估标准,以评估分值定级;
2、综合评估达90分以上的评为AAA级企业,80分以上的评为AA级企业;
3、对企业A、B、C、D级质量信用等级评估工作,由各市州局开展。
2
3
4
5
6。
零售药店GSP认证各项记录表格大全
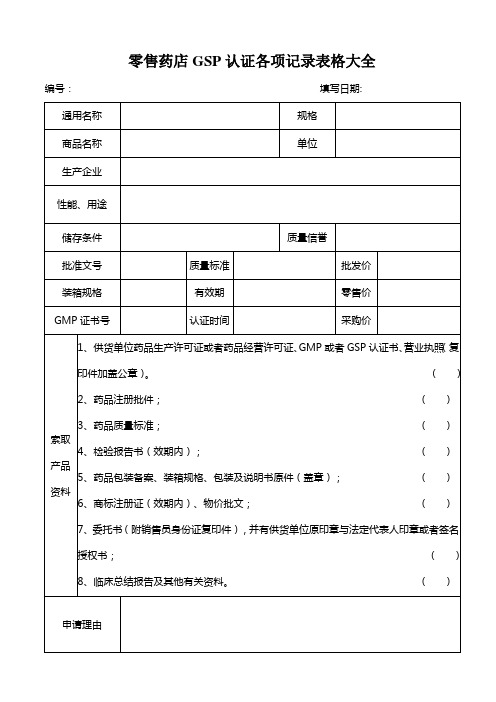
零售药店GSP认证各项记录表格大全编号:填写日期:首营企业审批表编号:填表日期:合格供货方档案表编号:建档日期:质量信息处理记录编号:药品质量管理档案编号:XXXXXXX拆零药品记录表类别:处方药OTC注:OTC类药品病人信息与病情主述项可不填。
XXXXXXX人员花名册XXXXXXX中药饮片购进验收记录供货单位:购货日期:不合格药品确认报告表编号:不合格药品报损审批表编号:XXXXXXX不合格药品销毁记录销毁日期:销毁方式:销毁地点:批准人:经手人:见证人:XXXXXXX药店重点养护品种确定表日期:审批人:养护员:XXXXXXX近效期药品催销表日期:养护员:XXXXXXX设施设备一览表XXXXXXX设施设备检修保护记录XXXXXXX企业培训计划XXXXXXX企业培训考核记录表XXXXXXX员工个人教育培训档案XXXXXXX人员健康档案记录建档时间:年月日XXXXXXX服务质量满意度征询表征询日期:XXXXXXX经营场所温湿度记录表XXXXXXX营业场所日常检查表药品召回登记表药品陈列养护检查记录表年月日养护区域:药品信息数据备份登记表备注:药品信息数据每天都需备份。
含麻黄碱类复方制剂销售明细表冷藏、冷冻药品收货记录根据:第七十四条冷藏、冷冻药品到货时,应当对其运输方式及运输过程的温度记录、运输时间等质量操纵状况进行重点检查并记录。
不符合温度要求的应当拒收。
XXXXXXX处方调配销售记录年月药品不良反应/事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□通常□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□零售质量管理制度执行情况自查表。
国家食品药品监督管理局药品GMP认证公告(第163号)--阳泉医用氧气厂等75家药品生产企业认证

国家食品药品监督管理局药品GMP认证公告(第163号)--阳泉医用氧气厂等75家药品生产企业认证
文章属性
•【制定机关】国家食品药品监督管理局(已撤销)
•【公布日期】2008.11.11
•【文号】国食药监安[2008]643号
•【施行日期】2008.11.11
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】标准化,药政管理
正文
国家食品药品监督管理局药品GMP认证公告(第163号)
(国食药监安[2008]643号)按照国家食品药品监督管理局《药品生产质量管理规范认证管理办法》的规定,经现场检查和审核批准,阳泉医用氧气厂等75家药品生产企业符合药品GMP
要求,发给《药品GMP证书》。
特此公告。
国家食品药品监督管理局
二○○八年十一月十一日
药品GMP认证公告(第163号)。
药品生产企业GMP认证全过程汇报材料

汇报人:
01 02 03 04 05
06
Part One
Part Two
GMP认证的概念:GMP是药品生产质量管理规范,旨在确保药品生产过程符合安全、 有效、质量可控的要求。
GMP认证的意义:通过GMP认证,可以确保药品生产企业的生产过程符合法规要求, 提高药品质量,保障公众用药安全。
GMP认证的目的:通过规范药品生产过程,降低药品生产过程中的风险,提高药品生 产的效率和质量。
Part Four
生产车间:洁净度、 温度、湿度等符合 规定
设备:清洗、消毒、 干燥等设备齐全
仓储设施:分类存 放、标识清晰、防 潮防虫
实验室:符合国家 规定,配备必要的 仪器和试剂
文件管理:建立完善的文件管 理制度,确保文件内容完整、 准确、易于理解
记录管理:对GMP认证过程中 的所有记录进行分类、归档、 保存,确保可追溯性
添加标题
添加标题
经验分享:分享GMP认证过程中的 经验和教训
持续学习:不断学习新知识,提高 自身素质和能力
Part Six
设备设施不达标 生产流程不规范 人员素质参差不齐 文件记录不完善
制定详细 的计划和 时间表
建立完善 的组织机 构和人员 配备
加强培训 监管和 检查制度, 确保合规 性
加强市场营销,扩大品牌知 名度和市场份额
加大研发投入,提高产品质 量和技术水平
推进国际化战略,拓展海外 市场和资源
注重人才培养和引进,提升 企业核心竞争力
建立完善的GMP认证法规体系 加强GMP认证监管力度 完善GMP认证标准和技术规范 加强GMP认证与国际接轨
汇报人:
质量保证部门负 责人:具有药师 (含药师和中药 师)以上的技术 职称,并有药品 质量管理工作经 历
药品GMP认证申请材料要求

1.2 企业的药品生产情况
简述企业获得(食品)药品监督管理部门批准的生产活动,包括进口分包装、出口以及获得国外许可的药品信息; 药品监督管理部门批准的生产活动包括:《药品生产许可证》,有效期限及生产许可范围;历次认证情况:通过认证的生产范围、时间;如有涉及进口分包装、出口的,简述获得国外许可的药品信息。
5.文件
描述企业的文件系统; 简要描述文件的起草、修订、批准、发放、控制和存档系统。 文件系统结构层次描述 文件分类情况描述,文件结构图 文件管理状况描述
6.生产
6.1 生产的产品情况 所生产的产品情况综述(简述); 产品与生产车间(线)对应情况、产品历史情况、产品控制情况(关键质量属性、生产控制方式)等 本次申请认证剂型及品种的工艺流程图,并注明主要质量控制点与项目。 工艺流程图 质量控制项目表(工序、控制项目、指标、频次)
2. 企业的质量管理体系
2.企业的质量管理体系
2.2 成品放行程序 放行程序的总体描述以及负责放行人员的基本情况(资历等)。 放行流程描述(流程图)-批生产记录审核、批检验记录审核、汇总审核、批准、证书发放。 负责产品放行的具体人员,有无转授权。 受权人、转受权人的资历(姓名、年龄、毕业院校、专业、毕业时间、相关工作经历及年限),及是否经过培训取得质量受权人的资格,是否在市局备案等情况。
4.厂房、设施和设备
4.2.1 列出生产和检验用主要仪器、设备。 主要生产设备一览表:注明序号、名称、制造厂家、规格型号、数量、所属车间(生产线)、生产能力、安装位置、确认与验证时间、验证周期。 主要检验仪器一览表:注明序号、名称、制造厂家、规格型号、精度、所属实验室(如有多个实验室)、设置位置、校准时间、校准周期(内、外部校准情况说明)
1 企业的总体情况
药品生产企业GMP认证全过程汇报材料

*
药品GMP检查汇报
单击此处添加副标题
演讲人姓名
单击此处添加正文,文字是您思想的提炼,为了演示发布的良好效果,请言简意赅地阐述您的观点。
*
*
我公司由原XXXXX药业有限公司于2004年3月,经XXXXXX省药品监督管理局批准更名而来。部分剂型于2000年顺利通过XXXXX省药品监督管理局换证验收,但因原厂址不具备GMP改造条件,故经批准后进行异地GMP改造。 公司GMP改造项目由XXXXXX省医药设计院设计,于2004年4月全部完工。厂区占地面积40 020m2,建筑面积12 400m2,绿化面积24 000m2,占厂区总面积的60%。公司总体布局合理,与生产规模相适应.已完成GMP认证的车间有口服固体制剂车间和合成车间;已完成GMP改造工程的车间有小容量注射剂车间。 c ]&|.~2& 公司现有车间可以生产小容量注射剂、片剂、颗粒剂、胶囊剂和化学原料药5个剂型,101个生产品种,本次拟通过GMP认证的是小容量注射剂车间。
*
*
十二、自检
公司成立了自检小组,由自检小组负责定期组织GMP自检,按预定程序对公司人员、厂房、设备、文件、生产、质量控制、用户投诉和产品收回处理等项目进行全面检查。
*
*
各位领导、各位专家,关于新疆华康药业股份有限公司认证准备情况,就汇报到这里。虽然我们经过历时一年多的准备工作,投入了大量的人力和财力,但由于我们对GMP认识还比较浮浅,在整个准备工作中还缺乏经验,所有难免有不少不足之处,敬请各位领导和专家毫不保留的提出宝贵的批评和建议。
*
*
十、产品销售与收回
产品的退货和收回制定有管理规程,公司严格按照《产品收回管理规程》和《成品退货管理规程》执行。 _x001D_
2023年药品GMP认证

2023年药品GMP认证药品GMP认证篇一关于gmp认证“gmp”是英文good manufacturing practice 的缩写,中文的意思是「良好作业规范」,或是「优良制造标准」,是一种特别注重制造过程中产品质量与卫生安全的自主性管理制度。
它是一套适用于制药、食品等行业的强制性标准,要求企业从原料、人员、设施设备、生产过程、包装运输、质量控制等方面按国家有关法规达到卫生质量要求,形成一套可操作的作业规范帮助企业改善企业卫生环境,及时发现生产过程中存在的问题,加以改善。
食品gmp认证由美国在60年代发起,当前除美国已立法强制实施食品gmp外,其他如日本、加拿大、新加坡、德国、澳洲、中国等国家均尚采取劝导方式辅导业者自动自发实施。
我国gmp对验证的要求1、药品生产验证包括厂房、设施及设备安装确认、运行确认、性能确认和产品验证。
2、产品的生产工艺及关键设施、设备应按验证方案进行验证。
当影响产品质量的主要因素,如工艺、质量控制方法、主要原辅料、主要生产设备等发生改变时,以及生产一定周期后,应进行验证。
3、应根据验证对象提出验证项目、制定验证方案,并组织实施。
验证工作完成后应写出验证报告,由验证工作负责人审核批准。
4、验证过程中的数据据和分析内容应以文件形式归档保存。
验证文件应包括验证方案、验证报告、评价和建议、批准人等。
5、药品生产过程的验证内容必须包括:a)空气净化系统b)工艺用水及其变更c)设备清洗d)主要原辅材料变更e)灭菌设备和药液滤过及灌封(分装)系统。
(适用于无菌药品生产过程的验证)涉及gmp验证的各要素一、产品设计的确认;二、机构与人员素质的确认;三、厂房、设施和设备的属性认定;四、符合质量标准的物料的确认;五、软件的确认。
药品gmp认证工作程序一、申请药品gmp认证企业应向省药品监管局领取《药品gmp认证申请书》,并按《药品gmp认证管理办法》的规定报送如下资料:1.《药品生产许可证》和《营业执照》(复印件);2.药品生产管理和质量管理自查情况(包括企业概况、gmp实施情况及培训情况);3.药品生产企业(车间)的负责人、检验人员文化程度登记表;高、中、初级技术人员的比例情况表;4.药品生产企业(车间)生产的组织机构图(包括各组织部门的功能及相互关系,部门负责人);5.药品生产企业(车间)生产的所有剂型和注册品种表;6.药品生产企业(车间)的环境条件、仓储及总平面布置图;7.药品生产车间概况及工艺布局平面图(包括更衣室、盥洗间、人流和物料通道、气闸等,并标明空气洁净度等级,同时附洁净度级别测试报告、安全、环保、消防、卫生防疫、计量、医药专业设计等部门的验收意见);8.所生产剂型或品种工艺流程图,并注明主要过程控制点;9.药品生产企业(车间)的关键工序、主要设备验证情况和检验仪器、仪表校验情况;10.药材品生产企业(车间)生产管理、质量管理文件目录;11.新开办的药品生产企业(车间)申请gmp认证,除报送上述2-10项规定的资料外,还须报送开办的药品生产企业(车间)批准立项文件和拟生产的品种或剂型3批试生产记录;12.上述文件以word文档的格式保存的软磁盘(1张)二、省药品监管局收到完整的申请资料之日起5个工作日内,对申请资料进行初审,并决定是否进行现场审查(新建、改建、扩建的企业原则上都应现场审查)。
药品GMP认证评定标准检查表

1、操作间的面积小,操作不便;
工程部
1、现场检查人流、物料通道防止昆虫和其它动物进入的设施;
2、现场检查窗户、排风扇等与外界相通的设施防止昆虫和其它动物进入的设施。
1、人流、物料通道缺风幕或门帘;
2、人流、物料通道的门帘在未进出时开启,或进出时未开启风幕;
3、人流、物料通道的灭蝇灯位置不当(安装在门外、太高、离门距离太大),起不到实际成效;
0604
从事原料药生产的人员应同意原料药生产特定操作的有关知识培训。
人力资源部
生产部
1、抽查生产操作人员的人员培训档案
2、现场提问原料药生产操作人员有关原料药生产的知识
1、个人培训档案中无原料药生产特定操作方面的培训内容;
2、公司培训档案中无原料药生产特定操作培训的培训教案;
3、原料药生产特定操作方面的培训内容不全(如缺安全方面的知识培训);
2、现场提问生产操作人员有关专业知识。
1、培训档案中无专业技术方面的培训内容;
2、培训档案中专业技术培训的知识不全面;
3、各岗位人员的专业培训知识针对性不强;
4、公司培训档案中无专业技术培训的培训教案;
5、个人培训档案中有专业技术方面的培训内容,但培训无考核,或考核不合格就上岗;
6、培训考核合格未下发上岗证或其它上岗证明;
人力资源部
抽查检验人员的上岗证
部分检验人员未经省、市级药品监督部门或药品检验部门培训;或已参加培训,但因某种缘故未取得上岗证。
0609
进入洁净区的工作人员(包括修理、辅助人员)应定期进行卫生和微生物学基础知识、洁净作业等方面的培训及考核。
2024年认证工作总结_药厂gmp认证工作总结

2024年认证工作总结_药厂gmp认证工作总结一、背景介绍随着我国医药行业的发展,药品生产企业面临着越来越严格的监管标准和质量要求。
GMP(Good Manufacturing Practice)是药品生产质量管理的国际通用标准,是确保药品质量和安全的重要保障。
在2024年,我公司在GMP认证工作方面取得了一定的成绩,现就2024年GMP认证工作的总结进行如下报告。
二、工作回顾1. 完善GMP管理制度在2024年,我公司在GMP管理制度上进行了全面的完善和更新。
我们结合国家GMP最新标准和我公司实际情况,对原有的管理制度进行了修订和完善,确保了各项管理制度和操作程序符合标准要求。
2. 强化人员培训在2024年,我们加大了GMP相关人员的培训力度,通过开展各种形式的培训活动,提高了员工对GMP管理的认识和要求,加强了GMP管理的执行力度,提高了员工的GMP意识和素质。
3. 质量控制体系建设在2024年,我公司进一步完善了质量控制体系,加强了原材料、中间品、成品的质量控制,确保了产品的质量和安全,提高了产品符合率和合格率。
4. 强化现场管理在2024年,我们加强了现场管理工作,建立了定期巡查和检查制度,确保了各个生产环节的符合GMP要求,严格执行清洁消毒和个人卫生制度,提高了生产车间的整洁度和卫生标准。
5. 严格执行标准操作程序在2024年,我公司加强了对标准操作程序的执行,加大对操作人员的监督和检查力度,确保了生产操作的规范和标准化,避免了操作不当而导致的产品质量问题。
三、工作成果1. 成功通过GMP认证在2024年,经过我们的努力,公司成功通过了GMP认证,为公司产品质量和市场竞争力提供了有力的保障。
通过GMP认证,公司在市场上的知名度和信誉度得到了提高,为公司的发展奠定了坚实的基础。
2. 提高了产品质量和安全性通过GMP认证工作的开展,我公司进一步提高了产品的质量和安全性,确保了产品的合格率和符合率,为广大消费者提供了优质可靠的药品产品。
药品生产企业跟踪检查报告(制剂企业GMP)

现场检查时发现严重缺陷0项、主要缺陷0项,发现一般缺陷2项。
Байду номын сангаас检查中发现的缺陷问题
严重缺陷:0
主要缺陷:0
一般缺陷:
1、微生物检查室未配备生物安全柜;
2、盐酸阿莫罗芬乳膏粒度检查物镜测微尺未校准。
需要说明的问题:
本次检查现场发现的缺陷不代表公司存在的所有问题,公司应举一反三、持续改进、迅速整改。整改结果或整改计划应于**年8月底前报**县市场监督管理局。
委托方质量负责人签字:受托方质量负责人签字:
被检查负责人签名:
年月日
检查员签名:
年月日
附件2
**省药品委托检验专项检查现场检查表
委托方名称:****药业有限公司联系电话:受托方名称:无联系电话:无
项目
检查内容
检查结果
企业总体情况
1.1有无委托检验行为?
无
1.2是否备案(如备案填写备案号及备案内容,未备案填写委托内容及未备案原因)?
无
1.3委托检验内容是否在备案范围和期限内?近三年委托检验频次?
无
委托方
2.1是否建立委托检验管理规程和SOP等文件?
无
2.2委托检验由哪个部门负责管理,是否有专门的人员负责委托检验的评估、实施和审计?
无
2.3委托检验报告由谁放行?
无
2.4委托检验送样有无文件规定?如为邮寄或物流送样,有无相应的风险评估?
无
2.5委托检验数据可靠性如何保证?
无
2.6与受托方是否制定偏差以及OOS沟通机制,有无文件规定?
无
3.2是否有收样、分样和样品储存的管理规定并记录?
无
3.3检验过程是否符合国家药品标准要求,是否有记录并归档?
制药企业GMP实施与认证指南与表格

制药企业GMP实施与认证指南目录上篇GMP对硬件系统的要求第一章总则 (3)第一节厂址及总图 (3)第二节药品生产区域的环境参数 (3)第三节工艺布局及厂房 (5)第四节设备选取型及安装 (6)第五节空气净化系统 (8)第六节工艺用水系统 (10)第七节生产辅助设施 (12)第二章分则(含工艺流程及区域划分) (15)第一节生物制剂认证要点 (15)第二节粉针剂认证要求 (17)第三节大输液认证要点 (18)第四节小容量注射剂认证要点 (19)第五节滴眼剂认证要点 (21)第六节口服固体制剂认证要点 (22)第七节口吸取液体制剂认证要点 (26)第八节原料药认证要点 (28)第九节中成药认证要点 (29)第十节外用药认证要点 (32)下篇GMP对文件(软件)系统的要求第一章怎样建立一套完备的文件系统 (34)第一节制剂企业为什么要建立文件系统 (34)第二节制药企业文件的类型 (34)第三节怎样制订有关文件 (34)第四节如何管理和使用文件 (36)第五节制药企业基本文件 (37)第二章制药企业标准类文件 (39)第一节物料管理标准文件 (39)第二节生产技术管理标准文件 (45)第三节质量管理标准文件 (52)第四节设备管理标准文件 (66)第五节销售管理标准文件 (69)第六节人员管理标准文件 (70)第三章制药企业记录(凭证)文件 (77)第一节物料管理记录(凭证)文件 (77)第二节生产技术管理记录(凭证)文件 (81)第三节质量管理记录(凭证)文件 (120)第四节设备管理记录(凭证)文件 (137)第五节销售管理记录(凭证)文件 (142)第六节人员管理记录文件 (142)第七节施工检查记录(凭证)文件 (145)第四章人员及文件(软件)系统认证要点 (150)附录一、药品生产质量管理规范(1998年修订) (152)(附录)……………………………………二、药品生产质量管理规范(1998年修订)157三、药品生企业GMP认证管理办法 (163)四、药品生产企业GMP认证工作程序 (165)五、药品生产企业GMP认证资料 (168)六、制药企业如何准备GMP认证 (183)七、医药工业洁净室(区)洁净度测试方法……………………………………………………186八、其他参考资料…………………………………………………………………………………194九、名词解释………………………………………………………………………………………198十、常见英文缩写…………………………………………………………………………………200十一、获国家药品监督管理局《药品GMP证书》的企业名单 (201)十二、获原中国药品认证委员会“药品GMP认证证书”企业名单 (210)十三、原国家医药管理局GMP达标企业名单 (213)十四、关于公布原药品GMP认证和达标企业复核结果的通知 (219)第一章总则第一节厂址和总图一、药品生产工厂的厂址选择,应根据下列原则,并经技术经济方案比较后确定1.应在大气含尘、含菌浓度低,无有害气体,自然环境好,对药品质量无有害因素,卫生条件较好的区域。
药品生产企业质量信用等级信息表

XX省药品生产企业质量信用等级信息表
备注:.此表电子版与加盖公章的纸质材料同时上报。
2.各类检查报告复印件作为附件报送。
填表说明:
1.行政处罚记录按类别及数量分别填写。
2.收回GMP证书记录填写证书被收回的时间和证书编号。
3.药品抽检不合格情况以被公布时间为序,依次填写发布时间、发布机构、不合格产品的品名、批号、不合格项目及抽检方式;
4.药品不良反应报告记录按品种分别填写不良反应的数量、严重程度及处理情况;
5.药品召回记录以召回信息发布时间为序,依次填写召回时间、产品名称、召回原因(主动召回或责令召回、具体质量原因)、召回结果;
6.监督检查记录以检查的时间为序,依次填写检查机构、检查发现严重缺陷、主要缺陷及一般缺陷数量、检查缺陷整改完成情况,未完成的简要说明原因。
浙江省GMP药品认证现场情况分析

自从2003年5月份省级GMP认证开展至2005年5月30日,省药品认证中心共组织了122个检查组对218家企业共计422条制剂生产线、334个原料药品种进行了GMP认证现场检查。
其中杭州43家,温州7家,宁波26家,台州40家,衢州9家,丽水8家,金华31家,绍兴32家,嘉兴8家,湖州11家,舟山3家。
认证企业涉及已有剂型通过认证的企业、首次申请认证的企业和期满后复认证企业;大部分企业是多剂型、多品种认证,小部分企业是单剂型或单品种认证;还有一部分企业是在原已认证的生产车间内增加新剂型或新品种。
现将认证中发现的主要问题分析如下:一、现场检查缺陷项目统计情况统计218次现场检查的企业情况,其中一次性通过企业210家,一次通过率96%;限期整改企业7家;现场重新核实企业1家。
合计发现缺陷项目2716项,平均每家12.5条缺陷项目。
统计缺陷项目出现频率25次以上的项目如下:表一、缺陷项目出现的频次统计表(共218个企业)检查条款条款内容出现频次占检查企业的比率(%)6001 验证文件内容是否完整177 81.26501 文件制定是否符合规定173 79.47503 质管部对实验室的管理职责158 72.50701 生产人员的规范培训和考核146 676801 批生产记录的填写及复核91 41.77601 供应商的审查及评估82 37.62601 仓储条件及取样是否符合要求66 30.38401 自检记录是否符合规定60 27.53801 物料的管理制度60 27.53701 生产和检验设备记录与管理56 25.73501 生产和检验设备校验的相关问题55 25.21602 压差装置的安装及读数是否符合规定54 24.87502 质管部的取样和留样职责53 24.37510 稳定性考察45 20.61504 空气净化系统的维护保养及记录42 19.37009 操作间及容器是否有状态标志38 17.46701 物料平衡是否符合要求37 175203 洁净工作服的清洗37 174902 设备清洗37 174903 容器清洗36 16.51001 厂房是否有防虫及其他动物措施36 16.53601 生产设备是否有明显的状态标志33 15.13401 纯化水是否有防污染措施33 15.18301 企业是否按书面规程定期自检30 13.87301 生产完成后是否清场并完整记录30 13.80801 生产环境是否整洁无污染及布局合理30 13.87403 是否适应要求的检验场所、仪器和设备26 11.91103 洁净区内清洁工具使用及存放是否合理26 11.90604 药品检验人员是否经相应培训26 11.92701 称量室或备料室是否符合要求25 11.51801 洁净室内水池及地漏的设置是否合理25 11.5二、列为整改企业进行现场复查的严重缺陷出现情况1、激素类药品与其它药品共用空气净化系统未进行有效验证。
国家食品药品监督管理局药品GMP认证公告(第152号)--森隆药业有限公司等70家药品生产企业认证

国家食品药品监督管理局药品GMP认证公告(第152号)--森隆药业有限公司等70家药品生产企业认证
文章属性
•【制定机关】国家食品药品监督管理局(已撤销)
•【公布日期】2008.05.27
•【文号】国食药监安[2008]258号
•【施行日期】2008.05.27
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】标准化
正文
国家食品药品监督管理局药品GMP认证公告
(第152号)
(国食药监安[2008]258号)按照国家食品药品监督管理局《药品生产质量管理规范认证管理办法》的规定,经现场检查和审核批准,森隆药业有限公司等70家药品生产企业符合药品GMP要求,现发给《药品GMP证书》。
特此公告。
国家食品药品监督管理局
二○○八年五月二十七日
药品GMP认证公告。
福建省药品生产企业实施 GMP 调查情况

福建省药品生产企业实施 GMP 调查情况
谢星云;叶炳杰;唐文娟;林燧
【期刊名称】《海峡预防医学杂志》
【年(卷),期】1999(5)3
【摘要】《药品生产质量管理规范》[1](GMP)是药品生产企业管理生产和质量的基本准则,要求药品生产企业的新建或改建工程必须按GMP进行。
为了解我省药品生产企业实施GMP的现状,1994年以来,我们对33家药品生产企业洁净室(区)的空气悬浮粒子数、微生物数和...
【总页数】2页(P41-42)
【关键词】医药企业;福建;药品生产;质量管理
【作者】谢星云;叶炳杰;唐文娟;林燧
【作者单位】福建省劳动卫生职业病研究所
【正文语种】中文
【中图分类】F407.763
【相关文献】
1.2009年福建省药品生产企业GMP认证及跟踪检查情况分析 [J], 陈鹭颖
2.跟踪检查广西壮族自治区31家药品生产企业实施新版GMP后的缺陷情况分析[J], 陆仕华;韦莹莹;韦广辉
3.2009~2011年新疆药品生产企业GMP实施情况 [J], 马小华;焦保辉;马晓峰
4.SFDA发布关于开展药品生产企业实施新修订药品GMP情况摸底调查做好分类指导工作的通知(急件) [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
20060330
原料药(福辛普利钠)
浙H0344
20060705
原料药(厄贝沙坦、氯沙坦钾)
浙H0376
20061106
序号
企业名称
已通过GMP认证剂型或产品(原料药)
证书编号
发证日期
备注
4
浙江新东港药业股份有限公司
片剂、胶囊剂、颗粒剂;
D1941
20021209
原料药(氟哌酸)
浙E0001
浙F0078
20040602
原料药(卡马西平、诺氟沙星、酮洛芬、柳氮磺吡啶)
浙G0262
20051121
18
台州市星明药业有限公司
原料药(氯氮平)
浙H0308
20060303
19
台州市黄岩联化药业有限公司
原料药(齐多夫定)
已复查
20
浙江精进药业有限公司
原料药(吉非罗齐)
浙H0296
20060125
21
无菌原料药(头孢地嗪钠、头孢他啶、头孢孟多酯钠、盐酸头孢吡肟)、原料药(更昔洛韦、坎地沙坦酯)
浙G0199
20050429
原料药(头孢呋辛钠、头孢哌酮钠粉针剂(头孢菌素类)
G3605
20051121
原料药(头孢尼西钠、硫酸头孢匹罗、西洛他唑)
浙H0321
20060425
原料药(氟马西尼)
浙H0357
20060907
原料药(二丙酸倍他米松、戊酸倍他米松)、片剂(外用)
已查
3
浙江华海药业股份有限公司
原料药(卡托普利)
D1692
20020718
原料药(赖诺普利、马来酸依那普利)
E2243
20030213
原料药(去羟肌苷、尼莫地平)、片剂、胶囊剂
浙E0022
20060508
无菌原料药(头孢呋辛钠、头孢曲松钠、头孢噻肟钠、硫酸头孢匹罗、舒巴坦钠)、原料药(胸腺五肽)
已查
6
浙江新华制药有限公司
胶囊剂、口服溶液剂
浙F0154
20041202
原料药(他唑巴坦、舒巴坦钠)
浙H0287
20060109
原料药(螺内酯)
浙H0299
20060109
原料药(盐酸环丙沙星,拖西酸舒他西林, 替卡西林钠,氯唑西林钠)
E2508
20030409
大容量注射剂(玻璃输液瓶和塑料输液瓶)
F3247
20041231
大容量注射剂(多层共挤输夜袋二车间)
G3422
20050708
10
浙江百佳药业有限公司
硬胶囊剂
浙F0134
20041011
片剂、滴丸剂
浙G0233
20050804
11
浙江南洋药业有限公司
中药前处理、口服液、口服溶液剂、颗粒剂、露剂、酊剂(含外用)、合剂、硬胶囊剂(含外用、含头孢菌素类)、片剂(含外用)
浙F0070
20040409
25
浙江天新药业有限公司
原料药(萘普生、萘普生钠、维生素B6)
浙G0210
20050603
26
浙江天台药业有限公司
原料药(盐酸克林霉素)
D1534
20020401
原料药(克林霉素磷酸酯)
浙G0200
20050428
原料药(盐酸克林霉素)
浙H0337
20060619
序号
企业名称
14
浙江天皇药业有限公司
胶囊剂、颗粒剂
浙H0304
20060217
15
浙江施比灵药业有限公司
酊剂、洗剂(均含中药提取)
浙F0107
20050112
序号
企业名称
已通过GMP认证剂型或产品(原料药)
证书编号
发证日期
备注
16
浙江海翔药业股份有限公司
原料药(吗氯贝胺)
浙E0003
20030609
原料药(盐酸克林霉素)
D1888
20021128
粉针剂、无菌原料药(美罗培南)、原料药(盐酸表柔比星、辛伐他汀)
E2438
20030319
胶囊剂(青霉素类、头孢菌素类)、片剂(头孢菌素类)、干混悬剂、粉雾剂、原料药(克念菌素、妥布霉素、依替膦酸二钠、泛昔洛韦、亚叶酸钙、氯硝西泮、丁二酸洛沙平、依维菌素、厄贝沙坦、盐酸普罗帕酮、硝苯地平、酒石酸托特罗定、不嘌醇、单硝酸异山梨酯、盐酸格拉司琼、氯雷他定、头孢克肟、头孢氨苄)
浙H0375
20061106
序号
企业名称
已通过GMP认证剂型或产品(原料药)
证书编号
发证日期
备注
7
浙江万邦药业有限公司
片剂、滴丸剂
浙F0095
20040630
胶囊剂
浙G0192
20050313
原料药(甲硝唑、石杉碱甲、盐酸奈福泮、盐酸溴己新、盐酸去氯羟嗪、盐酸氯丙那林、诺氟沙星、氯氮平、硝苯地平、联苯双酯、丁溴东莨菪碱、西咪替丁、舒必利、盐酸氯丙嗪、枸橼酸钙)
浙F0015
20040226
片剂、硬胶囊剂
浙H0291
20060123
12
台州南峰药业有限公司
片剂、胶囊剂、颗粒剂
E2199
20030130
丸剂、糖浆剂、酒剂、合剂、散剂、酊剂、煎膏剂(均含中药提取)
浙F0064
20040317
13
浙江丰安生物制药有限公司
冻干粉针剂、冻干粉剂
H3738
20060123
20031103
原料药(富马酸酮替芬、硫酸茚地那韦、盐酸帕罗西汀、奈韦拉平)
浙F0074
20040524
原料药(盐酸多巴酚丁胺)
浙F0146
20041111
原料药(氯沙坦钾)
浙G0212
20050614
原料药(阿塞佐米)
浙G0256
20051102
原料药(利培酮)
浙H0285
20060109
原料药(重酒石酸间羟胺、奈韦拉平、硫酸茚地那韦)
20030609
原料药(甲磺酸多沙唑嗪)
浙G0203
20050428
原料药(盐酸溴己新、盐酸舍曲林)
浙G0282
20051221
原料药(奈韦拉平)
浙H0336
20060619
5
浙江永宁制药厂
小容量注射剂、原料药(阿米卡星、硫酸阿米卡星)
E2130
20030128
片剂(头孢菌素类)
E2490
20030404
浙江海正天然药业有限公司
原料药(诺氟沙星)
浙F0169
20041217
22
浙江台州晶丰药业有限公司
软胶囊剂、口服溶液剂、乳剂、滴剂
浙F0149
20041111
厂房已卖
23
浙江台州海神制药有限公司
原料药(碘海醇)
浙G0220
20050708
24
浙江尖峰海洲制药有限公司
原料药(愈创木酚磺酸钾、牛磺酸、愈创木酚甘油醚、吡嗪酰胺)
浙G0193
20050317
原料药(普伐他汀钠、盐酸平阳霉素、磷酸氟达拉滨、去氧氟尿苷、盐酸阿糖胞苷、盐酸西布曲明、头孢泊肟酯)
浙G0237
20050815
粉针剂(头孢菌素类)、冻干粉针剂(抗肿瘤药)
G3634
20051201
原料药(盐酸柔红霉素、盐酸博来霉素、紫杉醇、甲氨碟呤、硫酸长春新碱、克拉屈滨、卡铂、氨曲南、舒巴坦钠、氟氯西林钠、哌拉西林、头孢他啶、硫酸头孢匹罗、氢溴酸西酞普兰、盐酸舍曲林、佐米曲普坦、硫酸卷曲霉素、齐多夫定)
20050808
28
浙江圣达药业有限公司
原料药(硝酸咪康唑)
浙F0132
20041011
29
浙江仙居仙明制药有限公司
原料药(黄体酮)
浙G0280
20051221
30
浙江司太立制药有限公司
原料药(碘海醇)
浙G0184
20050201
原料药(盐酸左氧氟沙星)
浙G0221
20050708
31
浙江银河药业有限公司
浙F0089
20040623
原料药(诺氟沙星、依诺沙星、司帕沙星、甲苯磺酸托氟沙星、盐酸环丙沙星、叶酸、盐酸塞利洛尔、维生素B4、樟脑、盐酸洛美沙星、放线菌素D、原料药(头孢唑林钠)
浙F0165
20041215
小容量注射剂
G3317
20050321
小容量注射剂(抗肿瘤药)
G3318
20050315
原料药(头孢曲松钠、头孢哌酮钠、头孢噻肟钠、头孢羟氨苄、阿莫西林、吡柔比星、盐酸伊达比星、硫酸异帕米星、硫酸氨基葡萄糖氯化钠复盐、氟伐他汀钠、吗替麦考酚酯)
原料药(甲磺酸罗哌卡因)
浙G0244
20050912
乳膏剂(激素类)、原料药(糠酸莫米松、醋酸炔诺酮)
浙G0238
20050815
冻干粉针剂
G3587
20051101
原料药(倍他米松磷酸钠、醋酸环丙孕酮、甲硫酸新斯的明、醋酸地塞米松、地塞米松磷酸钠)
浙G0279
20051216
原料药(维生素D3)
浙H0323
浙G0222
20050708
8
浙江奥瑞特制药有限公司
软膏剂、乳膏剂、溶液剂(均含激素类)、酊剂(激素类)、凝胶剂
D1659
20020702
胶囊剂
浙F0001
20040226
原料药(聚维酮碘)
浙G0209
20050530
片剂
浙H0329
20060523
