选修三第一章第一节___原子结构
人教版高中化学选修三第一章 第一节 原子结构(第3课时)

可以准确地测出它们在某一时刻所处的位置 及运行的速度; 可以描画它们的运动轨迹。
核外电子运动的特征
⑴ 核外电子质量小(只有9.11×10-31 kg),运动空间 小(相对于宏观物体而言),运动速率大(近光速)。
⑵无确定的轨道,无法描述其运动轨迹。 ⑶无法计算电子在某一刻所在的位置,只能指出 其在核外空间某处出现的机会的多少(概率)。
用光谱仪测定氢气放电管发射的氢的发射光谱
特征:暗背景,
亮线, 线状不连续
锂、氦、汞的发射光谱 特征汞的吸收光谱
原子光谱 不同元素的原子发生跃迁时会吸收或释放不同的光, 可以用光谱仪摄取各种元素的电子的吸收光谱或发射光 谱,总称原子光谱。
锂、氦、汞的发射光谱
锂、氦、汞的吸收光谱
①③⑤ 下图是锂、氦、汞的吸收光谱和发射光谱。其中图_______是 ②④⑥ 原子由基态转化为激发态时的吸收光谱,图_______是原子由 激发态转化为基态时的发射光谱。不同元素的原子光谱上的特 征谱线不同,请在下图中用线段将同种元素的吸收光谱和发射 光谱连接。
五、电子云与原子轨道 思考: 宏观物体的运动特征:
课堂练习
1、当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下说法正确的是 ( A ) A.镁原子由基态转化成激发态,这一过程中吸收能量 B.镁原子由激发态转化成基态,这一过程中释放能量 C.镁原子由基态转化成激发态,这一过程中释放能量 D.镁原子由激发态转化成基态,这一过程中吸收能量
2、判断下列表达是正确还是错误? (1) 1s22s2 2p63s2 3p63d54s2 属于激发态
(2) 1s22s2 2p63d1 属于激发态
构造原理: 1s;2s ; 2p 3s ; 3p 4s ; 3d 4p 5s; 4d 5p 6s ;4f 5d 6p 7s
高中化学选修三-物质结构与性质-全套课件

b.电子云扩展程度
同类电子云能层序数n越大,电子能量越 大,活动范围越大电子云越向外扩张
2、原子轨道
①定义
电子在原子核外的一个空间运动状态
②原子轨道与能级
ns能级 ns轨道
npx轨道 简
np能级 npy轨道 npz轨道
并 轨 道
nd能级
ndz2轨道
ndx2—y2轨道
从K至Q ,能层离核越远,能层能量越大 每层最多容纳电子的数量:2n2
2、能级
同一个能层中电子的能量相同的电子亚层
能级名称:s、p、d、f、g、h…… 能级符号:ns、np、nd、nf…… n代表能层 最多容纳电子的数量 s:2 p:6 d:10 f:14
能层: 一 二
三
KL
M
四…… N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
全满规则 半满规则
四、电子云与原子轨道
1、电子云 以量子力学为基础
①电子云 处于一定空间运动状态的电子在原子核外空间 的概率密度分布的形象化描述
小黑点:概率密度 单位体积内出现的概率 小黑点越密概率密度越大
小黑点不是电子!
②电子云轮廓图 电子出现的概率约为90%的空间 即精简版电子云
③电子云轮廓图特点 a.形状 ns能级的电子云轮廓图:球形 np能级的电子云轮廓图:双纺锤形
2s
2p
F ↑↓ ↑ ↓ ↑ ↓ ↑
原子结构的表示方法 原子结构示意图
电子排布式 O原子:1s2 2s2 2p4
电子排布图
1s2 2s2
2p4
O原子
六、能量最低原理、基态与激发态、光谱
1、能量最低原理
人教版高二化学选修三1.1原子结构课件

思考与交流
1、铁易生锈,真金不怕火炼等事例说明了什么问 题?为什么?
2、O2和O3是同素异形体,空气中的O2是须臾不能 离开的,而空气中的O3多于1.2mg/L则有害;CO易燃, CO2却能灭火。这由说明了什么问题?为什么?
3、分子式为C2H6O的物质可能有图示两种结构, 前者与水互溶而后者不能。这也说明了什么问题?
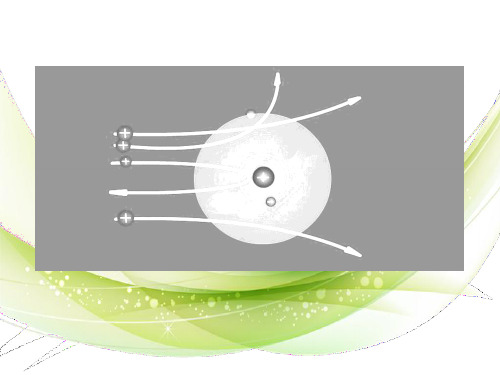
4.卢瑟福原子模型(1911年)
原子中心有一个带正电荷的核,它的质量几乎 等于原子的全部质量,电子在它的周围沿着不同的 轨道运转,就象行星环绕太阳运转一样。
(“行星系式”原子模型) (核式模型)
5.玻尔原子模型(1913年)
电子在原子核外空间的一定轨道上绕核 做高速的圆周运动。
(电子分层排布模型)
思考与交流
• 电子排布式可以简化,如可以把钠 的电子排布式写成【Ne】3s1。试 问:上式方括号中的符号的意义是 什么?你能仿照钠原子的简化电子 排布式写出O、Si、Fe的简化电子 排布式吗?
s 1×2=2 p 3×2=6
d 5×2=10 f 7×2=14 g 9×2=18
课堂练习
1、以下能级符号正确的是( AD) A、6s B、2d C、3f D、7p
2、若n=3,以下能级符号错误的是( B ) A.n p B.n f C.n d D.n s
3、下列各电子能层中,不包含 d 能级的是 (CD )
3) 不同层不同能级可由下面的公式得出: ns < (n-2)f < (n-1)d < np (n为能层序数)
不同能层的能级上,能量有交错现象,如E(3d)>E(4s)、 E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、 E(4f)>E(6s)等。
高中化学鲁科版选修三课件:第1章 第1节 原子结构模型(25张PPT)

3.玻尔原子结构模型的基本观点
运动 原子中的电子在具有确定半径的圆周轨道上绕原__子__核__运 轨迹 动,并且不辐射能量 能量 在不同轨道上运动的电子具有_不__同__的能量,而且能量 分布 是_量__子__化_的。轨道能量依n(电子层数)值(1,2,3,…)的
增大而_升__高_ 对氢原子而言,电子处于n=1的轨道时能量最低,称为 电子 _基__态_;能量高于基态的状态称为_激__发__态__。电子在能量 跃迁 不同的轨道之间跃迁时,辐射或吸收的能量以光的形式 表现出来并被记录下来,就形成了_光__谱_
•8、教育技巧的全部诀窍就在于抓住儿童的这种上进心,这种道德上的自勉。要是儿童自己不求上进,不知自勉,任何教育者就都不 能在他的身上培养出好的品质。可是只有在集体和教师首先看到儿童优点的那些地方,儿童才会产生上进心。 2022/4/132022/4/132022/4/132022/4/13
1.判断正误(正确的打“√”,错误的打“×”)。
立核外电子分层排布模型→20 世纪 20 年代产生了量子力学模型。
量子力学对原子核外电子运动状态的描述
1.原子轨道
(1)电子层(n) 分层标准
电子离核的远近
n 的取值 1 2 3 4 5 6 7
符号 能量
K LM N O P Q 由低 到 高 ―――→
离核
由 近到远 ―――→
(2)能级 在同一电子层中,电子所具有的能量可能 不同 ,所以同一
5.填空。 (1)用符号填写电子层所含能级种类: K 层:_1_s;L 层:_2_s、__2_p_;M 层:3_s_、__3_p_、__3_d_;N 层:_4_s_、__4_p_、__4_d_、__4_f。 (2)用数字填写能级所含原子轨道数目: s:__1__;p:__3__;d:__5__;f:__7__。 (3)比较下列原子轨道的能量高低(填“<”“=”或“>”)。 ①4s_>___3s_>___2s__>__1s; ②3px__=__3py__=__3pz; ③4f__>__4d__>__4p__>__4s; ④1s_<___2p_<___3d__<__4f。
高中化学选修3教案:第一章第一节原子结构

第一章第一节原子结构一、设计思想新课程标准要求中学化学立足于学生,适应现代生活和未来发展的需要,培养学生解决实际问题的能力,教学应确立以促进学生发展为主的教育目标,着眼于学生的发展,因此教学的设计应注重学生的主体地位,发挥教师组织和引导的主导作用,调动学生的主动性和积极性,激发学生学习化学的兴趣。
二、教材分析《原子结构》选自化学选修3第一章第一节,,属于物质结构理论基础知识,是中学化学最重要的基本理论之一,而原子结构又是学习物质结构理论和元素周期律的基础,因此原子结构是本单元也是高中化学的教学重点。
本节知识充分考虑了初中化学和化学2中的原子结构知识的基础上,教科书不再重复建立原子结构的概念,而是直接建立核外电子的能层(即“电子层”)和能级(即“电子亚层”)的概念,给出每一个能层有几个能级,每个能级最多可以容纳几个电子,有了能层和能级的概念,直接给出构造原理,并根据构造原理进行核外电子排布;学生对原子结构知识的认识是一个逐步深入的过程,同时,课本直接把构造原理看做一个经验规律,直接给出了原子核外电子排布顺序,体现了很大的工具作用,使学生直接会用。
三、教学方法复习法、延伸归纳法、讨论法、引导分析法四、学情分析课后反思1410621062622能级最多电子数74f54d 34p 53d 1813s M 812s L 322能层最多电子数1331原子轨道数4s 3p 2p 1s 能级符号NK 能层各能层、能级中最多电子数:最多电子数=原子轨道数×21s<2s<3s<4s<5s …能量:ns<np<nd<nf …能量:2p<3p<4p<5p<6p …各能层最多电子数=2(能层序数)2[思考]钾原子的电子排布为什么是2、8、8、1而非2、8、9?[板书]三、构造原理[投影]图1-2构造原理:[讲]在多电子原子中,电子在能级上的排布顺序:电子最先排布在能量低的能级上,然后依次排布在能量较高的能级上。
鲁科版高中化学选修三课件:1.1.1 原子结构模型 (共21张PPT)

[质疑] 根据卢瑟福的原子结构模型和经典的 电磁学观点,围绕原子核高速运动的电子 一定会自动且连续地辐射能量,其光谱应 是连续光谱而不应是线状光谱。那么,氢 原子的光谱为什么是线性光谱而不是连续
光谱呢?
2、在卢瑟福的原子结构模型的基础上提 出玻尔(Bohr)的原子结构模型 (玻尔理 论的三个假设)。 (1) 原子中的电 子在具有确定半径 的圆周轨道上绕原
卢瑟福原子模型
根据Α粒子散射实验原子的“核式模型”
波尔原子模型
原子结构的量子力学模型 (电子云模型)
一、氢原子光谱和波尔的原子结构模型 [联想· 质疑]
对于“光”这种物质,如阳光、火光、 灯光等,你们是熟悉的。但是,你知道有 些光是由原子在一定的条件下产生的吗? 原子发光的基本特点是什么?怎样用原子
结构知识来解释原子的发光现象?
1、氢原子光谱
狭义的光:波长400~700nm之间的电磁波; 广义的光:即电磁波,包括可见光、红外光、 紫外光、X射线等。
[知识支持] 连续光谱(continuous spectrum):
若由光谱仪获得的光谱是由各种波长的光 所组成,且相近的波长差别极小而不能分辨, 则所得光谱为连续光谱。如阳光等。
子核运动,并且不
辐射能量;
(2)不同轨道上运动的电子具有不同能 量,而且能量是量子化的,轨道能量依n 值(1、2、3、· · · · · )的增大而升高,n称 为量子数。对氢原子而言,电子处在n=1 的轨道是能量最低,称为基态,能量高于 基态的状态,称为激发态;
(3)只有当电子从一个轨道(能量为Ei) 跃迁到另一个轨道(能量为Ej)时,才会 辐射或吸收能量。如果辐射或吸收的能量 以光的形式表现并被记录下来,就形成了 光谱。
玻尔理论的局限:
人教版化学选修三 1.1《原子结构(第一课时)》课程教学设计

选修3第一章《物质结构与性质》第一节原子结构:(第一课时)教学设计一、教学目标1、知识与技能:(1)进一步认识原子核外电子的分层排布(2)知道原子核外电子的能层分布及其能量关系、能级分布及其能量关系(3)了解原子结构的构造原理,能用构造原理认识原子的核外电子排布(4)能用电子排布式表示常见元素(1~36号)原子核外电子的排布2、方法和过程:复习回顾与知识沿伸、类比和归纳如能层类比楼层,能级类比楼梯。
3、情感和价值观:充分认识原子结构理论发展的过程是一个逐步深入完美的过程。
二、教学重点难点根据构造原理写出1~36号元素原子的电子排布式三、教学准备课件准备四、学习方法:预习法、阅读法、归纳法、讨论法五、教学方法:讲解、讨论、归纳、探究法七、教学过程(一)情景引入简介原子结构理论衍变道尔顿原子模型:一切物质都是由最小的不能再分的粒子——原子构成。
原子模型:原子是坚实的、不可再分的实心球汤姆生原子模型:电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。
卢瑟福原子模型:原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。
原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。
玻尔原子模型:当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
不同的电子运转轨道是具有一定级差的稳定轨道。
电子云模型:现代科学家们在实验中发现,电子在原子核周围有的区域出现的次数多,有的区域出现的次数少。
电子在核外空间的概率分布图就像“云雾”笼罩在原子核周围。
因而提出了“电子云模型”。
【板书】第一节原子结构(二)讲授新课一、开天辟地——原子的诞生学生阅读P4页相关内容,总结出宇宙大爆炸——2小时后,诞生物质中最多为氢(88.6%),少量为氦(1/8),极少量为锂——融合形成其他元素。
第一章_第1节_原子结构模型知识点及练习[选修3]鲁科版
![第一章_第1节_原子结构模型知识点及练习[选修3]鲁科版](https://img.taocdn.com/s3/m/9eab8ef40242a8956bece491.png)
第1节原子结构模型一、原子结构模型的提出1、道尔顿原子模型(1803年):原子是组成物质的基本的粒子,它们是坚实的、不可再分的实心球。
2、汤姆生原子模型(1904年):原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。
(“葡萄干布丁模型”)3、卢瑟福原子模型(1911年):在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
(“卢瑟福核式模型”)4、玻尔原子模型(1913年):电子在原子核外空间的一定轨道上绕核做高速的圆周运动。
(“玻尔电子分层排布模型”)5、电子云模型(1927年~1935年):现代物质结构学说。
(“量子力学模型”)【例1】下列对不同时期原子结构模型的提出时间排列正确的是()①电子分层排布模型②“葡萄干布丁”模型③量子力学模型④道尔顿原子学说⑤核式模型A、①③②⑤④B、④②③①⑤C、④②⑤①③D、④⑤②①③二、原子光谱和波尔的原子结构模型1、原子光谱:光(辐射)是电子释放能量的重要形式之一,不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素电子的吸收光谱或发射光谱,总称原子光谱。
(1)通常所说的光是指人的视觉所能感觉到的在真空中波长介于400~700nm之间的电磁波。
不同波长的光在人的视觉中表现出不同的颜色,按波长由长到短依次为红橙黄绿青蓝紫。
实际上,广义的光即电磁波,除了可见光外,还包括红外光、紫外光、X射线等。
(2)人们在真空放电管内充入低压氢气,并在放电管两端的电极间加上高压电时,氢气会放电发光,利用三棱镜可观察到不连续的线状光谱。
(3)光谱分为连续光谱和线状光谱,氢原子光谱为线状光谱。
线状光谱:具有特定波长、彼此分离的谱线所组成的光谱(图1-1)锂、氦、汞的发射光谱锂、氦、汞的吸收光谱图1-1连续光谱:由各种波长的光所组成,且相近的波长差别极小而不能分辨所得的光谱,如阳光形成的光谱。
最新人教版高二化学选修3教学案:第一章第一节原子结构含答案

了解原子核外电子的运动状态O 能应用电子排布式表示常见元素 〔1〜36号〕原子核外电子的排布.理解原子结构的构造原理,知道原子核外电子的能级分布.了解多电子原子核外电子的运动情况,知道电子云和原子轨道.了解泡利原理和洪细读教材记主干1 .原子由原子核和核外电子构成,原子核一般由质子和中子构成.2 .原子的核外电子是分层排布的,电子的能量越低离核越近,能量越高离核越远.3 . 一至七能层的符号分别为: K 、L 、M N 、O P 、Q,各能层容纳的最多电子数为4 .原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原 理,处于最低能量的原子叫做基态原子.5 .在一个原子轨道里,最多只能容纳 2个电子,而且它们的自旋状态相反,这个原理称为泡利原理.6 .洪特规那么的内容是当电子排布在同一能级的不同轨道时,基态原子中的电子总是优 先单独占据一个轨道,而且自旋状态相同.原子的诞生、能层与能级原子结构与性质第一节原子结构特规那么.2.3. 4. 了解能量最低原理, 了解原子核外电子在一定条件下会发生跃迁, 了解其简单应用.5.2n 2.1 .原子的诞生 (1)原子的诞生T ,约占原子总数的匿叱宇宙一氮,约为氢原子数的;一 8 /f 其他超.多种天蚣元素原子总数缺乏IX(3)地球上元素的分类L 金属元素;占绝大多数元素一 ------交非金属元素园2种元素(包括稀有气体)2.能层与能级 ⑴能层根据多电子理子■的展外电子的能h 状进,监核外电子 分成不囿的能层符号一督序效1、23心67分利用KJ.M 、NCPq(2)能级根据一电F 原子中同一酷层电『能皿不同’将它们分 一成不同的期缎I_在每一幢鬼中.优僦符号分别为一心3・门,—,其 中n 代表能乐1能层序数过 谟能层所包含的筋级触(3)能层、能级中所容纳的电子数 能 层 (n ) 一 一 三 四 五 六七 … …符K LM N O P Q …@©[新知探究](2)宇宙的组成及各元素的含量氤义[名师点拨]能层与能级的组成与能量关系1 .不同能层的能级组成任一能层的能级总是从s能级开始,而且能级数等于该能层序数,即第一能层只有1个能级(1s),第二能层有2个能级(2s和2p),第三能层有3个能级(3s、3P和3d),依次类推.2 .不同能层中各能级之间的能量大小关系(1)不同能层中同一能级,能层序数越大能量越高.例如, 1s<2s<3s<……或2pv 3P <4p< .(2)同一能层中,各能级之间的能量大小关系是svpvdvfv…….例如,第四能层中4sv 4pv 4dv 4f.[对点?M练]1. (2021衡水高二检测)以下表达正确的选项是()A.能级就是电子层B.每个能层最多可容纳的电子数是2n2C.同一能层中不同能级的能量上下相同D.不同能层中的s能级的能量上下相同解析:选B能层是电子层,能级是同一能层中不同能量的电子所占据的分层.同一能层中不同能级的能量上下的顺序是:E( ns)< E( np)< E( nd)< E( nf) ,不同能层能级符号相同时,n越大,能量越高.构造原理与电子排布式[新知探究]电子在能级上的排列顺序是电子选排在能量较低的能级上, 然后依次排在能量较高的能级上.(2)构造原理示意图2.电子排布式 (1)含义将能级上所容纳的电子数标在该能级符号的右上角, 并根据能层从左到右的顺序排列的式子.(2)表示形式及各符号含义站序手能线上填充的鱼建(3)实例根据构造原理,可以写出元素原子的电子排布式,如①Mg 1s 22s 22p 63s 2,简写为[Ne ]3s 2. ② Cl : 1s 22s 22p 63s 23p 5,简写为[Ne ]3s 23p 5.[名师点拨]电子排布式的书写 1 .简单原子的电子排布式(1)根据构造原理将电子依次填充到能量逐渐升高的能级中.如微粒 电子排伸式 微粒 电子排伸式 C1s 22s 22p 2Ne1s 22s 22p 61 .构造原理(1)含义:在多电子原子中,Cl 1s 22s 22P 3s 23p 5 K 1s 22s 22P 3s 23p 4s(2)简化电子排布式:把内层电子到达稀有气体结构的局部,以相应稀有气体元素符号 Ne(1s 22s 22p 6)的结构相同,所以其电子排布式可简化为 1s 22s 22p 63s 23p 64s 〔或[Ar ]4s \2 .复杂原子的电子排布式对于较复杂的电子排布式,应先按能量从低到高排列,然后将同一层的电子移到一起. 如26Fe :先按能量从低到高排列为1s 22s 22p 63s 23p 64s 23d 6,然后将同一层的移到一起,即该原子的电子排布式为 1s 22s 22p 63s 23p 63d 64s ;简化为[Ar ]3d 64s 2o3 .特殊原子的核外电子排布式当p 、d 、f 能级处于全空、全充满或半充满状态时,能量相对较低,原子结构较稳定.⑴24Cr的电子排布式的书写2,以下原子的电子排布式正确的选项是 ( ) A. 9F :1s 22s 22p 6 B.15P :1s 22s 22p 63s 33p 2C. 21Sc : 1s 22s 22p 63s 23p 64s 23d 1D. 35Br : 1s 22s 22p 63s 23p 63d 104s 24p 5解析:选D 氟原子2P 能级应排5个电子;磷原子的3s 能级应排2个电子,3P 能级应 排3个电子;写电子排布式时,应将同能层的能级移到一起.[新知探究]1 .基态与激发态、光谱外加方括号来表示.如 Na 的核外电子排布式为 1s 22s 22p 63s1,其中第一、二电子层与 [Ne ]3s 1; K 的核外电子排布式为知识点3能量最低原理、电子云与原子轨道[对点?M 练](1)基态原子与激发态原子处于㈱低能M(2)光谱与光谱分析 ①光谱的成因与分类:②光谱分析:在现代化学中,利用原子光谱上的特征谱线来鉴定元素的分析方法. 2 .电子云与原子轨道 (1)电子运动的特点电子质量小,运动速度快,无规那么, 故无法确定某个时刻处于原子核外空间何处.只能确定它在原子核外空间各处出现的概率(2)电子云及形状①含义:处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述. ②形状(3)原子轨道①定义:电子在原子核外的一个空间运动状态称为一个原子轨道. ②各能级所含原子轨道数目3 .核外电子排布 (1)核外电子排布规那么①能量最低原理:原子的电子排布遵循构造原里能使整个原子的能量处于最低状态.4&②泡利原理:在一个原子轨道里,最多只能容纳 2个电子,而且它们的自旋状态相反,这个原理称为泡利原理.③洪特规那么:当电子排布在同一能级的不同轨道时, 基态原子中的电子总是优先单独占 据一个轨道,而且自旋状态相同.〔2〕电子排布图在电子排布图中,用一个方框表示一个原子轨道,用箭头表示电子.[名师点拨]4 .基态原子核外电子排布的规那么〔i 〕核外电子排布所遵循的规律①能量最低原理 ②泡利原理 ③洪特规那么〔2〕构造原理中的“能级交错〞现象从原子核外电子排布的轨道能量顺序看出从第三电子层就会出现能级交错现象,这是因为3d 能级的能量似乎低于 4s 能级,而实际上 E 〔3d 〕> E 〔4s 〕.按能量最低原理,电子在进入 核外电子层时,不是排完 3P 就排3d,而是先排4s,排完4s 才排3d .由于能级交错,在次 外层未达最大容量之前,已出现了最外层,而且最外层未达最大容量时,又进行次外层电子的填充,所以原子最外层和次外层电子数一般达不到最大容量.〔3〕洪特规那么特例有少数元素基态原子的电子排布对于排布原那么有1个电子的偏差.由于能量相同的原子轨道在全充满〔如p 6和d 10〕、半充满〔p 3和d 5〕和全空〔p 0和d 0〕状态时,体系能量较低,原子 较稳定.如 Cr : 1s 22s 22p 63s 23p 63d 44s 2〔错误〕 应为 1s 22s 22p 63s 23p 63d 54s 1Cu : 1s 22s 22p 63s 23p 63d 94s 2〔错误〕 应为 1s 22s 22p 63s 23p 63d 104s 1 5 .原子核外电子排布的表示方法C:Is 2s 卬 回w LnN:Is Zs匕w叵回rrin结构力、Jg、图意义将每个能层上的电子总数表示在原子核外的式子实例Al — . "S2N? 8 S电子排布式意义用数字在能级符号右上角标明该能级上排布的电子数实例K: 1s22s22p63s23p64s1简化电子排布式意义为了防止电子排布式书写过于繁琐,把内层电子到达稀有气体结构的局部以相应稀有气体的元素符号外加方括号表示实例1K: [Ar]4s价电子排布式意义主族兀素的价层电子指最外层电子,价层电子排布式即外围电子排布式实例Al : 3s23p1电子排布图意义每个方框代』个原子轨道,每个箭头代柠-个电子实例Is 2s 2pAl臼臼包〞All3s11 |〞K3P[对点?M练]6 .以下原子或离子的电子排布式正确的选项是 ,违反能量最低原理的是违反洪特规那么的是 ,违反泡利原理的是.① CaT: 1s22s22p63s23p6②F : 1s22s23p615 2s 2p 3pAl Al A. I Jk I A I L* I h I AI 〞I “ I T 〞* | J |T I 〞I③P:④ Cr: 1s22s 22p63s 23p63d44s2⑤ Fe: 1s22s22p63s23p63d64s2⑥ M& : 1s22s22p6解析:根据核外电子排布规律,②中错误在于电子排完3p轨道,正确的应为1s22s22p6.③中没有遵循洪特规那么2s轨道后应排2P轨道而不是电子在能量相同的轨道上排布3s 3pp I I A A *时,应尽可能分占不同的轨道并且自旋状态相同,正确的应为 ।——————I .④中忽略了能量相同的原子轨道在半充满状态时,体系的能量较低,原子较稳定,正确的应为1s 22s 22p 63s 23p 63d 54s 1.⑤和⑥正确.⑦违反泡利原理和洪特规那么,所以应为Is 2s 2P臼巴IN AI I答案:①⑤⑥②④③⑦⑦4. 〔2021郑州高二检测〕以下对核外电子运动状况的描述正确的选项是B.当碳原子的核外电子排布由C. 3p 2表示3p 能级有两个轨道D.在同一能级上运动的电子,其运动状态可能相同这一过程释放能量, 正确;C 项3p 2表示3p 能级有两个电子,错误;D 项在同一能级上运动的电子,其运动状态不可能相同,错误.、学业水平达标A.同一原子中,2P,3p,4P 能级的轨道依次增多转变为这一过程释放能量解析:选B A 项同一原子中,2p,3p,4p 能级的轨道数相同,错误;B 项当碳原子的核外电子排布由回□ IM"能量较低,由转变为I学业水平小削.让学 生跄热打率浦北所学. 就蚱速度工琉淮度水平练I强下水平堤小,至灌 提能,每那一档洌,步量较高1.以下说法中,不符合现代大爆炸宇宙学理论的是()A.我们所在的宇宙诞生于一次大爆炸B.恒星正在不断地合成自然界中没有的新元素C.氢、氨等轻核元素是自然界中天然元素之母D.宇宙的所有原子中最多的是氢元素的原子解析:选B宇宙诞生于一次大爆炸,爆炸后产生了大量的氢、氨及少量的锂,然后氢、氨等发生原子融合反响合成其他元素,该过程在宇宙中仍在进行,但合成的都是元素, 且氢元素仍是宇宙中最丰富的元素.2. (2021烟台高二检测)电子排布有能级顺序,假设以E(n l)表示某能级的能量,以下各式中正确的选项是()A. E(4s)> E(3d)> E(3p x)> R3P y)B. E(3d)> 曰4s)> E(3p)> R3s)C. E(5s)> E(4f)> E(3p x) = E(3p y)D. E(5s)> E(4s)> E(4f)> R3d)解析:选B A项应为日3d)> E(4s),那么为曰3d)> E(4s)>曰3p x) = E^3p y),错误;B项符合构造原理,正确;C项应为E(4f)> E(5s)> E(3p x) = E(3p y),错误;D项E(4f)> E(5s)> E(3d)> E(4s),错误.3. (2021银川高二检测)以下各组表述中,两种微粒一定不属于同种元素原子的是( )A. 3p能级有一个空轨道的基态原子和核外电子排布式为1s22s22p63s23p2的原子B. M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p63d64s2的原子C.最外层的电子数是核外电子总数的1的原子和价电子排布式为4s24p5的原子5D. 2p能级有一个未成对电子的基态原子和原子的价电子排布式为2s22p5的原子解析:选B A项中3P能级有一个空轨道,说明3p上填2个电子,因填1个电子有2个空轨道,填3个电子或3个以上电子无空轨道,那么3P上有2个电子,3s上肯定已填满,价电子排布式为3s23p2, A中两微粒相同.B项中M层全充满而N层为4s; M层上有d轨道, 即3s23p63d10,应该是锌元素,3d64s2是铁元素,B选项符合题意.C项中价电子排布式为4s24p5, 那么3d上已排满10个电子,核外电子排布式为1s22s22p63s23p63d104s24p5,最外层电子数是核.............. 1 ,, 一 ........ 一外电子总数工的原子,可按下述方法讨论:假设最外层电子数为1,核外电子总数为5不可5能,最外层电子数为2,核外电子总数为10不可能,同理,可讨论,只有最外层电子数为7, 核外电子总数为35时合理,其电子排布式也是1s22s22p63s23p63d104s24p5,二者是同种元素的原子.D项中2P能级有一个未成对电子,可以是2p\也可以是2p5,因此二者不一定属于同种元素的原子.4. 〔2021松原高二检测〕以下有关电子云的表达中,正确的选项是 〔〕A.电子云形象地表示了电子在核外某处单位的体积内出现的概率B.电子云直观地表示了核外电子的数目C. 1s 电子云界面图是一个球面,表示在这个球面以外,电子出现的概率为零D.电子云是电子绕核运动形成了一团带负电荷的云雾解析:选A 为了形象地表示电子在原子核外空间的分布状况,人们常用小黑点的疏密程度来表示电子在原子核外出现概率的大小; 点密集的地方,表示电子出现的概率大; 点稀疏的地方,表示电子出现的概率小,这就是电子云.1s 电子云界面以外,电子出现的概率 不为零,只是出现的概率很小.5.〔2021襄阳高二检测〕以下核外电子的表示方法中, 能表示该原子处于能量最低状态 的是〔C. Fe : [Ar]3d 54s 2D. Cu : 3d 104s 1解析:选D A 选项不符合1期侍规那么,2P 轨道上的3个电子应分占三个轨道时能量最低;B 选项为 L 的电子排布图,不是 F 原子的电子排布图;C 选项中Fe 是26号元素,而非25 号;D 选项符合洪特规那么,原子处于能量最低状态.6. A 、B 、C 口 E 代表5种元素.请填空:〔1〕A 元素基态原子的最外层有 3个未成对电子,次外层有 2个电子,该原子的电子排 布图为. 〔2〕B 元素的负一价离子与 C 元素的正一价离子的电子排布式都与僦原子相同,B 元素的符号为, C 的离子结构示意图为 .〔3〕D 元素的正三价离子的 3d 能级为半充满,D 的元素符号为 ,其基态原子的 电子排布式为. 〔4〕E 元素基态原子的 M 层全充满,N 层没有成对电子,只有一个未成对电子,E 的元素 符号为 , 其基态原子的 电子排布图为 解析:〔1〕根据A 元素基态原子的最外层有 3个未成对电子,次外层有 2个电子,可知该元素的基 态原子有 2个电子层,共有7个电子,是N 元素,其 电子排布 图为B.A.)、课下水平提升(一)、选择题1 .以下关于多电子原子核外电子的运动规律的表达正确的选项是A.所有的电子在同一区域里运动B.在离原子核较近的区域内运动的电子能量较高,在离原子核较远的区域内运动的电子能量较低C.处于最低能量的原子叫基态原子D.同一原子中,4s 、4p 、4d 、4f 所能容纳的电子数越来越多,各能级能量大小相等解析:选C 在含有多个电子的原子里,电子分别在能量不同的区域内运动, A 错误; 在多个电子的原子中, 电子的能量是不相同的, 在离原子核较近的区域内运动的电子能量较 低,在离原子核较远的区域内运动的电子能量较高, B 错误;处于最低能量的原子叫基态原子,当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子, C 正确;同一原子中,4s 、4p 、4d 、4f 所能容纳的电子数越来越多,是正确的,但第四能层中,能级2P电子排布式与僦原子相同,即都有 .(2)B 元素的负一价离子与 C 元素的正一价离子的18个电子,那么B 元素为Cl 元素,C 元素为K 元素,?的结构示意图为A \\2 8 8 .. 5 型为3d ,那么原子的价电子构型为元素的正三价离子的 3d 能级为半充满,即三价阳离子的构 3d 64s 2,即为26号Fe 元素,基态原子的电子排布式为 1s 22s 22p 63s 23p 63d 64s 2o (4)由E 元素基态原子的 M 层全充满,N 层没有成对电子,只有2P答案: EH EH □ (2)Cl (3)Fe1s 22s 22p 63s 23p 63d 64s 2(或[Ar]3d 64s 2) 3d⑷Cu [Ar] 基态原子的电子排布图为的能量大小不同:日4s〕< E〔4p〕< E〔4d〕<曰4f〕,所以D错误.2 . 〔2021 ・日照高二检测〕以下电子层中,包含有f能级的是〔〕A. K电子层B. L电子层1. M电子层D. N电子层2. :选D K电子层是第一能层,只有1s能级;L电子层是第二能层,有两个能级,即2s和2p; M电子层是第三能层,有三个能级,即3s、3p、3d; N电子层是第四层,有四个能级,即4s、4p、4d、4f o而根据能级数等于能层序数的关系规律,只有能层序数>4 的电子层中才有f能级.3. 以下多电子原子不同能级能量上下的比拟错误的选项是〔〕A. 1s<2s<3s B . 2P<3p<4pC. 3s<3p<3d D . 4s>3d>3p解析:选D在多电子原子中,由构造原理知日nd〕>E[〔 n+ 1〕s],即4s能级能量小于3d.所以D错误.4. 〔2021汕头高二检测〕以下说法正确的选项是〔〕A.基态原子的能量一定比激发态原子的能量低B. 1s22shp1表示的是基态原子的电子排布C.日常生活中我们看到的许多可见光,如霓虹灯光、节日焰火,都与原子核外电子发生跃迁释放能量有关D.电子仅在激发态跃迁到基态时才会产生原子光谱解析:选C同类原子基态比激发态的能量低, A选项错误;1s22sZp1不符合构造原理,处于激发态,B选项错误;原子光谱有发射光谱和吸收光谱两种,电子从激发态跃迁到基态时产生发射光谱,从基态到激发态跃迁时产生吸收光谱, D选项错误.5. 〔2021宜昌高二检测〕以下关于价电子构型为3s23p4的粒子描述正确的选项是〔〕A.它的元素符号为OB.它的核外电子排布式为1s22s22p63s23p4C.可以与Hk化合生成液态化合物D.其电子排布图为:'解析:选B价电子构型为3s23p4的元素是16号元素S, O元素的价电子构型为2s22p4, A错误;S元素的核外电子排布式为1s22s22p63s23p4, B正确;硫和氢气化合生成的硫化氢是气体而不是液体,C错误;当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同,所以3P能级上电子排布图违反洪特规那么, D错误.6. 〔2021潍坊高二检测〕以下原子轨道表示式中,表示氧原子的基态电子轨道排布式正确的是〔〕解析:选B轨道〔能级相同的轨道〕中电子优先单独占据1个轨道,且自旋方向相同,回回।J廿|十|原子的能量最低,O原子能量最低排布是15’P , B项正确.7. 〔2021泰安高二检测〕当镁原子由1s22s22p63s2变为1s22s22p63p2时,以下熟悉正确的是〔〕A.镁原子由基态转化成激发态,这一过程中吸收能量8. 镁原子由激发态转化成基态,这一过程中释放能量C.转化后位于p能级上的两个电子处于同一轨道,且自旋状态相同D.转化后镁原子与硅原子电子层结构相同,化学性质相似解析:选A镁原子要从外界吸收能量才能由1s22s22p63s2〔基态〕变为1s22s22p63p2〔激: 态〕,A正确;B错误;转化后位于p能级上的两个电子处于不同轨道,且自旋状态相同,错误;硅原子有14个电子,处于激发态的镁原子的电子数为12个,D错误.8.以下是一些原子的2P能级和3d能级中电子排布的情况.其中违反了洪特规那么的是〔〕①।“ “一।②卜m③上旦引④「A * *⑤y I +1 +「HA.①B.①③C.②④⑤D.③④⑤解析:选C洪特规那么是在原子的同一电子亚层排布的电子, 总是尽先占据不同的轨道,而且自旋方向相同, 这样可以使原子的能量最低, 原子处于稳定状态. ①同一轨道电子的自旋方向相反,违背泡利不相容原理, 错误;②不同轨道的单电子自旋方向相反,违背洪特规那么,正确;③符合洪特规那么,错误;④电子应该尽先占据不同的轨道,每一个轨道有一个电子,自旋方向相同,违反洪特规那么,正确;⑤不同轨道的单电子自旋方向相反,违背洪特规那么,正确;⑥符合洪特规那么,错误.因此违反了洪特规那么的是②④⑤,选项是Co9. 〔2021漳州高二检测〕以下各组中的X和Y两种原子,在周期表中一定位于同一族的是〔〕A. X原子和Y原子最外层都只是一个电子B. X原子的核外电子排布式为Is?, Y原子的核外电子排布式为1s22s之C. X原子的2P能级上有三个电子, Y原子的3P能级上有三个电子D. X原子核外M层上仅有两个电子, Y原子核外N层上也仅有两个电子解析:选C最外层只有一个电子的不一定在同一族,如金属钠和金属铜的最外层都是一个电子,但是钠属于第I A族,而铜属于第I B族,A错误;X原子是He,属于0族元素, Y原子是Be,属于第n A族,B错误;X原子核外M层上仅有两个电子,X是镁原子,属于第HA族,N层上也仅有两个电子的原子除了钙原子,还有锌、铁等原子, D错误.10. 〔2021天水高二检测〕假设某原子在处于能量最低状态时,外围电子排布为4d15s2,那么以下说法正确的选项是〔〕A.该元素原子处于能量最低状态时,原子中共有3个未成对电子B.该元素核外共有5个电子层C.该元素原子的M能层共有8个电子D.该元素原子最外层共有3个电子解析:选B该元素原子处于能量最低^态时,原子中共有1个未成对电子,A错误;该元素原子核外共有5个电子层,B正确;该元素原子的M能层共有18个电子,C错误;该元素原子最外层共有2个电子,D错误.二、非选择题11. 〔2021玉溪高二检测〕如图是s能级和p能级的电子云轮廓图,试答复以下问题.〔1〕s电子云轮廓图呈形,每个s能级有个原子轨道;p电子云轮廓图呈形,每个p能级有个原子轨道,其能量关系为.〔2〕元素X的原子最外层电子排布式为n s n n p n+1,原子中能量最高的是电子, 其电子云在空间有方向;元素X的名称是 ,它的氢化物的电子式是.假设元素Y的原子最外层电子排布式为n s n—np"1,那么Y的元素符号应为原子的电子排布图为 .解析:〔1〕 n s 能级各有1个轨道,n p 能级各有3个轨道,s 电子的原子轨道都是球形的,p 电子的原子轨道都是哑铃形的,每个 p 能级有3个原子轨道,它们相互垂直,分别以 p 、 p y 、p z 表示,能量p x=p y=p z .〔2〕由于元素X 的原子最外层电子排布式为 n s n n p n \ n p 轨道 已排上电子,说明n s 轨道已排满电子,即n= 2,那么元素X 的原子核外电子排布式为 1s 22s 22p 3, 是氮元素;当元素 Y 的原子最外层电子排布式为 n s n —n p-1时,有n —1=2,那么n = 3,那么 Y 元素的原子核外电子排布式为 1s22s 22P 63s 23p 4,是硫元素.HH : N ;答案:〔1〕球 1 哑铃 3 相等 〔2〕2p 三个互相垂直的伸展12. 〔2021襄阳高二检测〕〔1〕写出碑的元素符号 ,原子中所有电子占有 个轨道,核外共有 个不同运动状态的电子. 〔2〕写出Ni 的元素名称 ,该元素在周期表的位置为第 周期,第 族.13. 第四周期基态原子中未成对电子数最多的元素是 ,该元素基态原子的价电 子轨道表示为 .14. 第三电子层上有 个能级,作为内层最多可容纳 个电子,作为最外 层时,最多可含有 个未成对电子.解析:〔1〕神的元素符号为 As,是第33号元素,核外有33个不同运动状态的电子,其 核外电子排布为:1s 22s 22p 63s 23p 63d 104s 24p 3,即有18个轨道.〔2〕馍的元素符号为Ni ,在周 期表中的第四周期,第皿族. 〔3〕第四周期元素中,外围电子排布为 n d x n s y,且能级处于半 满稳定状态时,含有的未成对电子数最多,即外围电子排布为 3d 54s 1,此元素为铭,其基态4s H常由〃.. 1 --- 1. 〔4〕第三电子层上有 s 、p 、d 三2个不同的能级,由于每个电子层最多谷纳 2n 个电子,故当第三层作为内层时,最多可谷纳18个电子,作为最外层时,当3P 轨道仅填充3电子时未成对电子最多,有3个未成对电子. 答案:〔1〕As 18 33 〔2〕馍 四 W 〔3〕铭〔或 Cr 〕(4)318 30 00 Is 汰 2P 3s3p 3d13.根据以下元素基态(能量最低)原子的电子排布特征判断元素,并答复以下问题.(1)写出由 C、D中的三种元素组成的化合物的化学式(至少写出5种):(2)写出用上述元素组成的物质制得A的单质的化学方程式(至少写出2个):_________ ;(3)检验某溶液中是否有D+,可通过反响来实现;检验某溶液中是否含有 B ,通常所用的试剂是和.(4)写出E的元素符号: ,要证实太阳上是否含有E元素,可采用的方法是解析:由A只有1个能层且只含1个电子,判断A为氢元素;B原子3p轨道得1个电子饱和,那么原有5个电子,即B的电子排布式为1s22s22p63s23p5,为氯元素;C原子电子排1s 2s 2p5lul * t上一主“主 q一主布图为I——I I——J l——————1,为氧兀素;D为钾兀素;E为僦兀素.答案:(1)KOH、KClO、KClQHCl.HClQ等(合理即可)电解人人(2)2H 2O====2H4 + QT2K+ 2H2O===2KOH H2 T (合理即可)(3)焰色AgNO稀硝酸(4)Ar 对太阳光进行光谱分析[水平提升]14. (2021唐山高二检测)X、Y和Z三种元素的原子序数之和等于42.X元素原子的4P轨道上有3个未成对电子,丫元素原子的最外层2P轨道上有2个未成对电子.X跟Y 可形成化合物X2Y3, Z元素可以形成负一价离子.请答复以下问题:(1)X元素原子基态时的电子排布式为 ,该元素的元素符号是.(2)Y元素原子的价层电子的电子排布图为 ,该元素的名称是.⑶化合物X2Y3在稀硫酸溶液中可被金属锌复原为XZ3,产物还有ZnSO和H2Q该反响的化学方程式是.解析:(1)X元素原子的4P轨道上有3个未成对电子,那么X是第四周期第V A族元素, 即X为As,其电子排布式为1s22s22p63s23p63d104s24p3.(2)Y元素原子的最外层2P轨道上有2个未成对电子,。
人教版化学选修三 1.1《原子结结构》经典教案设计

高中化学选修三第一章原子结构与性质第一节原子结构第1课时 原子结构一、教学目标 知识与技能1、了解原子结构的模型发展史2、理解现代原子结构模型中的能层、能级、原子轨道等重要概念 过程与方法利用教材、资料卡片、制作模型及借助多媒体等教学手段,初步学会运用类比、想象、归纳、概括等方法获取信息并进行加工。
与同伴合作共享资源、观点分享,逐步形成良好的学习习惯和学习方法。
情感态度与价值观1、通过了解人类在揭示原子结构秘密过程中,赞赏科学家为人类所做出的突出贡献。
欣赏他们建立了各种模型,养成批判的思维习惯,热爱科学。
2、认同实验在科学发展中的重要价值。
二、教学重点、难点:重点:原子核外电子的能层、能级分布及其表示 难点:能级概念的建立 三、教学用具:橡皮泥、气球多媒体辅助:PPT 、视频及资料卡片(供学生使用) 四、教学方法:探究、小组合作2、揭秘原子结构(模型)的发展历程:资料卡片——分组讨论————收获启迪1、引课激趣:观看核弹爆炸的蘑菇云3、 对钠原子结构示意图的复习和质疑:在复习了能层的基础上,以上模型可否解释为什么这样排布?核外电子的运动状态到底怎样描述?六、教学过程设计程教重新认识电子的运动[过度] PPT播放原子大小示意图[讲述]科学离不开假设,如果你的同桌突然变成了电子,你做为观察者,会看到什么?[问题3]:能画出电子运动的方向、轨迹是怎样的?讲解:电子的特征:体积小、质量小、运动空间小、高速(接近光速)——无法确定在某一时刻的位置、运动方向等(实验法)。
不完全能照般宏观物体的运动规律。
[过度]怎样描述电子的运动状态?以氢原子为例。
科学家提出了不同与以往的假设:播放模拟动画[问题3] 这一假设是从怎样的角度描述电子的运动状态的?结论:从统计学的角度,描绘成图像[问题4]大家齐动手——根据视频的画面,用橡皮泥做出氢原子的电子云模型思考观看听讲学生讨论、交流观看小组拿到材料:橡皮泥、,动手制作模型、并展示个电子排序,描述(而不是测量)电子的运动状态。
人教版高中化学选修三第一章第一节 原子结构 课件(共54张PPT)
二、10电子微粒和18电子微粒 1.10电子微粒
【典例3】 已知A、B、C、D四种物质分别是由短周 期元素组成的微粒,它们之间有如图所示的转化关系,且A 是一种含有18电子的微粒,C是一种含有10电子的微粒。请 完成下列各题:
(1)若A、D分别是两种气态单质分子,写出A与B反应的 化学方程式:________________;
是O2置换H2S中的S。问题(4)中H、O形成的原子个数为1:1 的化合物是H2O2,N、H形成的化合物分子中电子数也为18 的分子只能是N2H4。
[答案] (1) (2)X(或氧) 2H2S+O2===2H2O+2S↓ (3)NH4HSO4
点燃 (4)N2H4+2H2O2=====N2+4H2O
2.(2012·长沙模考)下列有关化学用语使用正确的是 ()
A.硫原子的结构示意图: B.11H2、12H2、31H2是氢的三种同位素 C.原子核内有10个中子的氧原子:188O D.金刚石和石墨、甲烷和乙烷都属于同素异形体
解析 硫原子的结构示意图应为
A项错误。同位
素的研究对象是原子,但B选项中三种粒子是氢的单质,故
(4)若D是一种含有22个电子的分子,则符合如图关系的 A的物质有________(写化学式,如果是有机物则写相应的结 构简式)。
[解析] 本题把指定电子数目的有关微粒作为命题素 材,着重考查考生的有序思维能力。寻找10电子、18电子、 22电子微粒,必须从元素周期表出发,遵循由原子到分子, 再到离子的思考途径,列出相应的微粒。关于18电子微粒的 推断,对有序思维的要求更高,技巧性更强,我们可以以推 断10电子微粒的思路来进行分析,对数字18作一拆分,把18 拆成9+9,找出F2后会使18电子微粒的推断打开一个大“空
化学选修三第一章第一节

5d
6d
6p
7p
通式:ns··(n-2)f、(n-1)d、np ·· ··
三、构造原理与电子排布式
2.构造原理中排布顺序的实质 -----各能级的能量高低顺序
(1)相同能层的不同能级的能量高低顺序 : ns<np<nd<nf (2)英文字母相同的不同能级的能量高低顺序: 1s<2s<3s<4s;2p<3p<4p; 3d<4d (3) 不同层不同能级可由下面的公式得出: ns < (n-2)f < (n-1)d < np (n为能层序数)
5. 各能级包含的原子轨道数:
三、构造原理与电子排布式
问题解释:
1s22s22p63s23p63d1 1s22s22p63s23p64s1 正确书写方法:
想一想
第3层 第4层 第2层 第1层
钙Ca
+20
K层
2
L层
8
8
2
钙Ca 1s22s22p63s23p64s2
M层 N层
三、构造原理与电子排布式
3、电子排布式:
用数字在能级符号右上角表明该能级上的 排布的电子数。 该能级上排布 能层序数 能级符号 的电子数
小黑点不表示电 子,只表示电子在 这里出现过一次。 小黑点的疏密表示 电子在核外空间内 出现的机会的多少。
电子云只是形象地表示 电子出现在各点的概率高低, 而实际上并不存在。
五、电子云与原子轨道
课堂练习 1.下列有关说法正确的是 ( C ) A、通常用小黑点来表示电子的多少 B、小黑点密表示在该核外空间的电子数多 C、小黑点密表示在该核外空间的单位体积内 电子出 现的概率大 D、通常用小黑点来表示绕核作高速圆周运动
选修3《物质结构与性质》
.
原子结构设计

《原子结构》教学设计发布时间:2009-05-12 10:30:33 来源:中国信息技术教育杂志作者:宋唯● 教材分析本节内容选自人民教育出版社新课标教材《物质结构与性质》(选修3)第一章《原子结构与性质》的第一节《原子结构》。
本节从介绍原子的诞生(宇宙大爆炸)入手,在原子水平上认识物质构成的规律,在介绍能层、能级的概念后,直接给出构造原理并根据构造原理展示原子的核外电子排布;在原子基态与激发态概念的基础上介绍电子跃迁和光谱分析;根据电子云与原子轨道等概念,进一步介绍核外电子的运动状态,并导出泡利原理和洪特规则,旨在帮助高中学生进一步丰富原子结构的知识,提高分析问题和解决问题的能力。
● 学生分析学生在初中化学所学仅仅局限于对原子构成的简单识记上。
高中阶段在新课标化学教材(必修2)的第一章第一节中,主要从原子核外电子的排布规律讲授了原子结构的知识。
而学生对原子核外电子排布的相关概念、原理(如泡利原理、洪特规则等)都很陌生。
另外,学生对于原子核外电子运动状态与原子基本性质(如电子运动与光谱的关系)之间的关系了解很少,这种强烈的求知欲望将会促使学生更好地学习这部分知识。
除此之外,高二学生已经具备了较强的抽象思维能力,对于理论的理解较深刻,并且能够将学到的理论快速应用于问题解决中。
● 教学目标1.知识与技能目标(1)了解宇宙大爆炸理论及元素在宇宙中的含量。
(2)了解原子结构理论的发展历史,能够区分主要的原子结构理论创始人及其理论内容。
(3)理解能层(电子层)和能级(电子亚层)的概念,熟练使用符号表示原子核外的能层和能级,掌握原子核外电子能层分布及其能量关系、能级分布及其能量关系,能够利用这两种关系判断电子能量的高低。
(4)了解原子结构的构造原理,并能利用构造原理排布原子的核外电子。
(5)理解电子排布式及简化电子排布式的含义,能用电子排布式和简化电子排布式表示常见元素(1~36号)的原子核外电子排布。
2.过程与方法目标在学习原子结构理论的发展历史,核外电子分层排布的特点、构造原理及其应用的过程中,掌握科学研究的一般方法:归纳法和类比法。
选修三第一章第一节原子结构第三课时

第一节原子结构:(第3课时)知识点一原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
处于最低能量的原子叫做基态原子。
当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。
电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将释放能量。
光(辐射)是电子释放能量的重要形式之一。
不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。
许多元素是通过原子光谱发现的。
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
巩固提高:1、同一原子的基态和激发态相比较()A、基态时的能量比激发态时高B、基态时比较稳定C、基态时的能量比激发态时低D、激发态时比较稳定2、生活中的下列现象与原子核外电子发生跃迁有关的是()A、钢铁长期使用后生锈B、节日里燃放的焰火C、金属导线可以导电D、夜空中的激光3、当碳原子的核外电子排布由转变为时,下列说法正确的是A.碳原子由基态变为激发态 B.碳原子由激发态变为基态C.碳原子要从外界环境中吸收能量 D.碳原子要向外界环境释放能量4、若某基态原子的外围电子排布为4d15s2,则下列说法正确的是A.该元素基态原子中共有3个电子 B.该元素原子核外有5个电子层C.该元素原子最外层共有3个电子 D.该元素原子M能层共有8个电子5、某元素的激发态原子的电子排布式为1s22s22p63s23p34s1,则该元素基态原子的电子排布式为;元素符合为。
能力提升:1、同一原子的基态和激发态相比较()A、基态时的能量比激发态时高B、基态时比较稳定C、基态时的能量比激发态时低D、激发态时比较稳定2、生活中的下列现象与原子核外电子发生跃迁有关的是()A、钢铁长期使用后生锈B、节日里燃放的焰火C、金属导线可以导电D、卫生丸久置后消失3、比较多电子原子中电子能量大小的依据是()A.元素原子的核电荷数 B.原子核外电子的多少C.电子离原子核的远近 D.原子核外电子的大小4、当氢原子中的电子从2p能级,向其他低能量能级跃迁时( )A. 产生的光谱为吸收光谱B. 产生的光谱为发射光谱C. 产生的光谱线的条数可能是2 条D. 电子的势能将升高.5.下列说法中正确的是()A.1s22s12p1表示的是激发态原子的电子排布B.3p2表示3p能级有两个轨道C.同一原子中,1s、2s、3s电子的能量逐渐减小D.同一原子中,2p、3p 4p能级的轨道数依次增多6.观察1s轨道电子云示意图,判断下列说法正确的是()A.一个小黑点表示1个自由运动的电子B.1s轨道的电子云形状为圆形的面C.电子在1s轨道上运动像地球围绕太阳旋转D.1s轨道电子云的点的疏密表示电子在某一位置出现机会的多少7.下列基态原子或离子的电子排布式错误的是A. K 1s22s22p63s23p64s1B. F 1s22s22p5C. Mg2+ 1s22s22p6D. Br 1s22s22p63s23p64s24p58.用“>”、“<”、“=”表示下列能级的能量高低关系:(1)1s____2s____3s____4s;2p____3p____4p____5p;3d____4d____5d;(2)2s____2p;3s____3p____3d;4s____4p____4d____4f;。
高中化学选修3知识点图示大全

高中化学选修3知识点图示大全第一章原子结构与性质一.原子结构1.能级与能层2.原子轨道3.原子核外电子排布规律(1)能量最低原理现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。
(2)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。
换言之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli)原理。
(3)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund)规则。
比如,p3的轨道式为或,而不是。
洪特规则特例:当p、d、f轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。
即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态。
前36号元素中全空状态的有4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。
4.基态原子核外电子排布的表示方法(1)电子排布式①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K:1s22s22p63s23p64s1。
②为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号表示,例如K:[Ar]4s1。
(2)电子排布图(轨道表示式)每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。
如基态硫原子的轨道表示式为二.原子结构与元素周期表1.原子的电子构型与周期的关系(1)每周期第一种元素的最外层电子的排布式为ns1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
➢小黑点的疏密表示电子在核外空间 单位体积内出现的概率的大小。
2020/3/26
1s电子在原子核外 出现的概率分布图
★量子力学中将 这种电子云轮廓
图称为
“原子轨道”
2020/3/26
注意:
①小黑点不表示电子,只表示 电子在这里出现过一次。
②小黑点的疏密表示电子在核外 空间单位体积内出现机会的多少。
复习巩固:
原子的构成?
原子序数=核电荷数=核内质子数=核外电子数
质量数=质子数+中子数
A
Z
N
同位素:Z同N不同的原子
周期序数= 电子层数=能层数 主族序数= 2020/3/26 最外层电子数
Company Logo
Company Logo
讨论: 19号K的核外电子排布究竟是哪种?
观点一: 1s22s22p63s23p63d1
6C :1s2 2s22p2
1s 2s
2p
① ↑↓ ↑↓ ↑↓
②
1s ↑↓
2s ↑↓
2p ↑↑
③
1s ↑↓
2s ↑↓
2020/3/26
2p ↑↓
谁 对 谁 错?
2.洪特规则(先占位后配对)
多个电子在同一能级的不同轨道上排布时,
将尽可能分占不同轨道且自旋方向相同。
构造原理 1s22s22p63s23p64s23d4
查阅结果 1s22s22p63s23p64s13d5
24Cr电子排布式为:
1s22s22p63s23p63d54s1
洪特规则 特例
绝大多数基态原子都遵循构造原理。但少数几个
有1个电子的偏差(铜、银、金、铬)。
2020/3/26
4.简化电子排布式 例如 Na:1s22s22p63s1
原子轨道的表示及排序
4s
能 量 3s
2s
2020/3/26
1s
3d
3p
2p
①每个轨道里排几个电子? ②多个电子在能量相同的 轨道里又是怎样排布的?
第一章 原子结构与性质 第一节 原子结构 (第3课时)
2020/3/26
六、核外电子排布规律
1.泡利不相容原理
同一个原子轨道中最多只能容纳2个电 子,且这2个电子的自旋方向必须相反。
价电子数是 6 。 2020/3/26
练习:
下列各原子或离子的电子排布 式错误的是( BC )
A. Ca2+ 1s22s22p63s23p6
B. O2- 1s22s23p4 C. Cl- 1s22s22p63s23p5
D. Ar 1s22s22p63s23p6 2020/3/26
Company Logo
构造原理中的排布顺序,其实质是各能级的能量高
低顺序,可由公式得出:ns<(n-2)f<(n-1)d<np。
构造原理是绝大多数基态原子核外电子排布 所遵循的顺序。
Company Logo
Company Logo
Company Logo
思考:查阅元素周期表中的24Cr的电子排布情 况,是否遵循构造原理?
③电子云只是形象地表示电子在 核外空间出现的概率高低,而实际 上并不存在。 2020/3/26
2、原子轨道 a.s电子的原子轨道(电子云)形 状 是以原子核为中心的球体,只有 一个伸展方向
2020/3/26
b.p电子云/原子轨道的形状是纺锤形 (或称为哑铃形),其伸展方向是互向 垂直的三个方向(Px、Py、Pz)。
观点二: 1s22s22p63s23p64s1
ns﹤np﹤nd﹤ nf
4
3 2 1 2020/3/26
4f
4d
能
4p 3d
级
4s 3p
交
3s
错
2p
2s
1s
三、构造原理与电子排布式 1、构造原理:
原子核外电子先占有能量低的轨道,然后依 次进入能量较高的轨道,这样能使整个原子的能 量处于最低状态。
具体表现为电子填充顺序: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
P电子原子轨道半径同样随着n增大而增大 2020/3/26
p能级的原子轨道
①形状:纺锤形(哑铃形、8字形)。 ②数目:p能级共有3个原子轨道,相互垂直, 能量相等。 如2px、2py、2pz ③半径:能层序数n越大,轨道半径越大。
d能级的原子轨道
①形状:花瓣形。 ②数目:d能级共有5个原子轨道,能量相等。 ③半径:能层序数n越大,轨道半径越大。
(2)电子云
①概念:看电起子来在像原一子片核云外雾出,现形概象率称的为统电计象化描述。
②含义:
电子云密度大的地方,表明电子在核外单位体积
内出现的机会多,反之,出现的机会少。
看起来像
如:H的电子云图
一片云雾
2020/3/26
图中 表示原子核,一个小黑点代表电 子2020在/3/26 这里出现过一次
[Ne]3s1
表示钠的内层电子排布与稀有气体元素 Ne的核外电子排布相同。
2020/3/26
练习:
写出O、Si、Fe的简化电子排布式。
O: [He]2s22p4 Si: [Ne]3s23p2 Fe: [Ar]3d64s2
上式方括号里的符号的意义是:
该元素的内层电子排布和上周期末稀有气体元素
的电子排布相同。
↑↓
2020/3/26
此时原子 的总能量 最低,体 系最稳定。
电子排布图=轨道表示式
1s
1H轨道表示式
↑
1s
2He轨道表示式 ↑↓
3Li轨道表示式
1s 2s ↑↓ ↑
4Be轨道表示式 B 轨道表示式 52020/3/26
1s 2s
↑↓ ↑↓
1s 2s
2p
↑↓ ↑↓ ↑
多个电子在同一能级的不同轨道上如何排布?
第一章 原子结构与性质 第一节 原子结构 (第1课时)
一.开天辟地—原子的诞生
1932年勒梅特首次提出了 现代宇宙大爆炸理论。
宇宙 大爆炸
2h后 诞生
大量的H 少量的He 极少量的Li
原子核的 熔合反应
合成
其 他 元 素
人类认识原子的过程
人类在认识自然的过程中,经历了无数的艰辛,正是因为有了无数的探索者,才使人类对事物的认 识一步步地走向深入,也越来越接近事物的本质。随着现代科学技术的发展,我们现在所学习的科学 理论,还会随着人类对客观事物的认识而不断地深入和发展。
2020/3/26
第一章 原子结构与性质 第一节 原子结构 (第2课时)
2020/3/26
Company Logo
练习:
某元素原子序数为24,试问: (1)该元素电子排布式:
1s2 2s22p6 3s23p63d5 4s1
(2)它有 4 个能层; 7 个能级;
(3)它的价电子排布式为 3d5 4s1 ,
