常见物质化合价
初三化学化合价详细讲解

初三化学化合价详细讲解一、常见元素及原子团的化合价:钾K 钠Na 氢H 银Ag +1价,氟F 氯Cl 溴Br 碘I -1价钙Ca 镁Mg 钡Ba 锌Zn +2价,+1、+2铜Cu,+2、+3铁Fe铝Al+3 硅Si+4 氧O-2常见带电离子团:硫酸根SO42+,硝酸根NO3-,氢氧根OH-,氯酸根ClO3-,碳酸根CO32-铵根NH4+,高锰酸根MnO4- 锰酸根MnO42-,磷酸根PO43-注意:标原子团的化合价时,应标在原子团的上方,如:书写离子符号时,应在原子团右上角标明带电荷数,如硫酸根离子:SO42-一个亚铁离子Fe2+,一个铁离子Fe3+。
二、初中化学物质的检验(一)、气体的检验1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.(二)、离子的检验.6、氢离子:滴加紫色石蕊试液/加入锌粒7、氢氧根离子:酚酞试液/硫酸铜溶液8、碳酸根离子:稀盐酸和澄清的石灰水9、氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子10、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡11、铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口12、铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子13、铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子(三)、相关例题14、如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质15、检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石16、检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCl。
常见元素及原子团的化合价表

常见元素及原子团的化合价表CuSO4+2NaOH=Cu(OH)2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成HCl+AgNO3= AgCl↓+HNO3生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3生成白色沉淀、不溶解于稀硝酸检验SO42—的原理FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成AgNO3+NaCl = AgCl↓+NaNO3白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子初中常见物质俗称1、氯化钠(NaCl):食盐2、碳酸钠(Na2CO3) :纯碱,苏打,口碱3、氢氧化钠(NaOH):火碱,烧碱,苛性钠4、氧化钙(CaO):生石灰5、氢氧化钙(Ca(OH)2):熟石灰,消石灰 6 、二氧化碳固体(CO2):干冰7、氢氯酸(HCl):盐酸8、碱式碳酸铜(Cu2(OH)2CO3):铜绿9、硫酸铜晶体(CuSO4 .5H2O):蓝矾,胆矾10、甲烷(CH4):沼气11、乙醇(C2H5OH):酒精12、乙酸(CH3COOH):醋酸13、过氧化氢(H2O2):双氧水14、汞(Hg):水银15、碳酸氢钠(NaHCO3):小苏打中化学常见物质的颜色(一)、固体的颜色1、黑色固体(5种):木炭,氧化铜,二氧化锰,四氧化三铁,铁粉2、红色固体:铜——紫红色,氧化铁Fe2O3——红(棕)色3、蓝色晶体:硫酸铜晶体CuSO4·5H2O4、蓝色沉淀:氢氧化铜5、红褐色沉淀:氢氧化铁6、白色沉淀(6种):碳酸钙,碳酸钡,碳酸银;氢氧化镁;硫酸钡,氯化银。
物质的化合价

物质的化合价
化合价是用来表示原子之间互相化合的数目。
常见的化合价有:
1. 氢元素的化合价:在化合物中,氢通常显正一价,但在一些特殊化合物中可能显正二价。
2. 钠元素的化合价:钠在化合物中通常显+1价。
3. 氧元素的化合价:在化合物中,氧元素通常显-2价。
4. 金属元素和非金属元素的化合价:金属元素通常显正价,而非金属元素通常显负价。
5. 非金属元素的常见化合价:氟、氯、溴、碘常显负价,氧显-2价,硫和氮等常显负二到正五价。
需要注意的是,在特定的化合物中,化合价可能会有所不同。
同时,同一元素在不同的化合物中的化合价也可能不同。
在化学学习中,我们需要根据具体的化学式和元素来了解物质的化合价。
初中常见化合价化学式及化学方程式
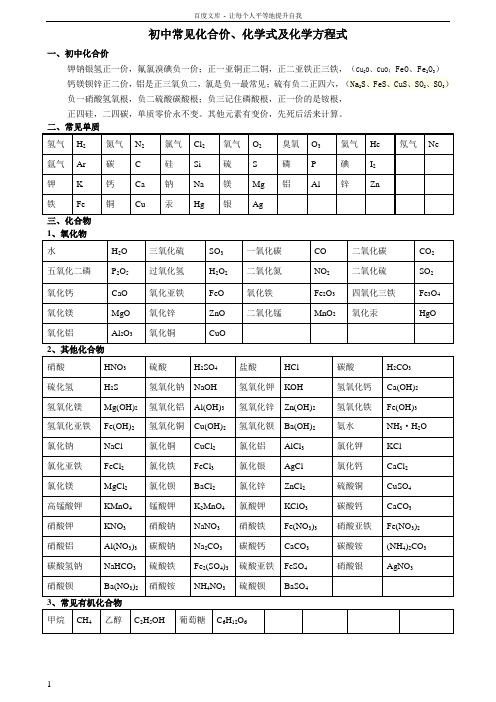
初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu2O、CuO;FeO、Fe2O3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na2S、FeS、CuS、SO2、SO3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根,正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
三、化合物初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O2点燃2MgO2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O43、铝在空气中燃烧:4Al+3O2点燃2Al2O34、氢气在空气中燃烧:2H2+O2点燃2H2O5、红磷在空气中燃烧:4P+5O2点燃2P2O56、硫粉在空气中燃烧:S+O2点燃SO27、碳在氧气中充分燃烧:C+O2点燃 CO28、碳在氧气中不充分燃烧:2C+O2点燃2CO9、二氧化碳通过灼热碳层:C+CO2高温2CO10、一氧化碳在氧气中燃烧:2CO+O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO312、生石灰溶于水:CaO+H2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl2点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑16、加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑18、碳酸化学性质不稳定而分解:H2CO3=H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+CO2↑20、加热氯酸钾分解:2KClO3=2KCl+3O2↑21、氧化汞加热分解:2HgO△2Hg+O2↑三、置换反应(单质+化合物→新的单质+新的合化物)22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl2+H2↑锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑23、镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑镁和稀硫酸反应:Mg+H2SO4=MgSO4+H2↑24、铁和稀盐酸反应:Fe+2HCl=FeCl2+H2↑铁和稀硫酸反应:Fe+H2SO4=FeSO4+H2↑25、铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑铝和稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑26、铁和硫酸铜溶液反应:Fe+CuSO4 =FeSO4+Cu铝和硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3+3Cu27、铜和硝酸银反应:Cu+2AgNO3=Cu(NO3)2+2Ag28、氢气还原氧化铜:H2+CuO△Cu+H2O29、木炭还原氧化铜:C+2CuO高温 2Cu+CO2↑30、焦炭还原氧化铁:3C+2Fe2O高温 4Fe+3CO2↑31、水蒸气通过灼热碳层:H2O+C高温 H2+CO四、复分解反应复分解反应是由两种互相交换成分,生成另外两种化合物的反应。
常见元素化合价归纳

化学基本知识归纳整理一、常见元素化合价口诀与原则一价氢氯钾钠银二价氧钙镁钡锌三铝四硅五价磷二三铁、二四碳一至五价都有氮铜汞二价最常见正一铜氢钾钠银正二铜镁钙钡锌三铝四硅四六硫二四五氮三五磷一五七氯二三铁二四六七锰为正碳有正四与正二再把负价牢记心;所有单质中元素化合价为零,化合物中各元素化合价代数和为零;二、常见原子团的化合价+1价:铵根离子NH4+;-1价: 氢氧根离子OH-硝酸根离子NO3-碳酸氢根离子HCO3-硫酸氢根离子HSO4-高猛酸根离子MnO4-氯酸根离子ClO3-次氯酸根离子ClO-醋酸根离子CH3COO-偏铝酸根离子AIO2--2价:碳酸根离子CO32-硫酸根离子SO42-亚硫酸根离子SO32-三、常见物质的化学式非金属单质:氢气碳氮气氧气磷硫氯气H2 C N2O2P S Cl2金属单质:钠镁铝钾钙铁锌铜钡钨汞Na Mg Al K Ga Fe Zn Cu Ba W Hg常见氧化物:水一氧化碳二氧化碳五氧化二磷氧化钠二氧化氮二氧化硅H2O CO CO2P2O5Na2O NO2SiO2二氧化硫三氧化硫一氧化氮氧化镁氧化铜氧化钡氧化亚铜SO2 SO3NO MgO CuO BaO Cu2O氧化亚铁三氧化二铁氧化铁或铁红四氧化三铁三氧化二铝三氧化钨FeO Fe2O3Fe3O4Al2O3WO3氧化银氧化铅二氧化锰Ag2O PbO MnO2氯化物/盐酸盐:氯化钾氯化钠食盐氯化镁氯化钙氯化铜氯化锌氯化钡氯化铝KCl NaCl MgCl2 CaCl2CuCl2ZnCl2BaCl2AlCl3氯化亚铁氯化铁氯化银FeCl2 FeCl3AgCl常见的酸:硫酸盐酸硝酸磷酸硫化氢溴化氢碳酸H2SO4HCl HNO3H3PO4H2S HBr H2CO3常见的盐:硫酸铜硫酸钡硫酸钙硫酸钾硫酸镁硫酸亚铁硫酸铁CuSO4 BaSO4CaSO4K2SO4MgSO4FeSO4Fe2SO43硫酸铝硫酸氢钠硫酸氢钾亚硫酸钠硝酸钠硝酸钾硝酸银Al2SO43NaHSO4KHSO4Na2SO3NaNO3KNO3AgNO3硝酸镁硝酸铜硝酸钙亚硝酸钠碳酸钠碳酸钙碳酸镁MgNO32 CuNO32CaNO32NaNO2Na2CO3CaCO3MgCO3常见的碱: 氢氧化钠氢氧化钙氢氧化钡氢氧化镁氢氧化铜氢氧化钾氢氧化铝NaOH CaOH2 BaOH2MgOH2CuOH2KOH AlOH3氢氧化铁氢氧化亚铁FeOH3 FeOH2常见有机物: 甲烷乙炔甲醇乙醇乙酸醋酸CH4 C2H2CH3OH C2H5OH CH3COOH常见结晶水合物:碱式碳酸铜石膏熟石膏明矾Cu2OH2CO3CaSO42H2O 2 CaSO4H2O KAlSO4212H2O绿矾蓝矾碳酸钠晶体常见化肥: FeSO47H2OCuSO45H2O Na2CO310H2O尿素硝酸铵硫酸铵碳酸氢铵磷酸二氢钾CONH22 NH4NO3NH42SO4NH4HCO3KH2PO4四、常见物质中重点元素的化合价H: HCl NaH CaH2; He: 惰性气体,单质零价;Li: LiCl ; Be: BeOH2B: H3BO3BF3 ;C: CH4CaC2CO CO2H2CO3CaCO3CaHCO32N: NH3、NH4Cl N2O笑气 NO N2O3HNO2NO2N2O4N2O5HNO3NH4NO3O: H2O Na2SO4Na2CO3含氧酸根里的氧都是-2 H2O2Na2O2F: KF HFF没有正价,只有-1和0;Ne: 惰性气体,单质零价Na: Na2CO3NaCl Mg: MgO MgSO4MgOH2Al: AlCl3 KAlSO42·12H2O 十二水合硫酸铝钾又称明矾Si: SiO2石英、玻璃的主要成分之一 SiF4Na2SiO3P: PH3 PCl3HPO2PCl5P2O5H3PO4S: H2S Na2S2O3SO2H2SO3Na2SO3SO3H2SO4BaSO4Cl: CaCl2 HClO HClO2HClO3HClO4高氯酸是最强的无机酸 Br和I类似ClAr: 惰性气体,单质零价; K: KNO3 Ca: CaCO3其他常见元素的化合价:Fe: FeCl2氯化亚铁 FeCl3氯化铁Fe2O3Fe3O4既有+2又有+3Cu: CuCl氯化亚铜 Cu2O氧化亚铜 CuO 氧化铜Mn: MnCl2 MnO2K2MnO4锰酸钾 KMnO4高锰酸钾Ag: AgCl Cr: CrCl3 K2Cr2O7重铬酸钾 KCrO4铬酸钾 Pb: PbO PbO2Sn: SnCl2 SnCl4Hg: HgCl 氯化亚汞 HgCl2氯化汞Zn: ZnO五、溶解性口诀钾钠铵盐硝酸盐全都溶入中间,碳酸氢盐醋酸盐全溶,盐酸盐中不溶AgCl HgCl 氯化亚汞,硫酸盐中钡不溶钙银微溶,碳酸盐中镁微溶,钡钙锰锌亚铁银均不溶;溶碱有五种:钾钠氨钙钡;不溶的酸仅有一种:H2SiO3硅酸四微溶:氢氧化钙CaOH2硫酸钙CaSO4硫酸银Ag2SO4碳酸镁MgCO3六、常见固体颜色1、黑色固体:铁粉、木炭、Fe3O4、CuO、MnO2、FeO2、绿色固体:Cu2OH2CO33、紫黑色固体:KMnO4、I24、红色固体:Cu、Fe2O3、HgO、Cu2O氧化亚铜,砖红色5、蓝色固体:CuOH2、CuSO4·5H2O胆矾,五水硫酸铜6、淡黄色固体:S硫磺Na2O2过氧化钠7、银白色固体:铁丝铁片…、Mg、Al、Ag、Zn…8、白色固体:MgO、CaCO3、P2O5、CuSO4无水硫酸铜、NaCl、……七、常见液体颜色1、蓝色溶液:CuSO4溶液、CuNO32溶液、CuCl2溶液2、浅绿色溶液:FeSO4溶液、FeCl2溶液3、黄色溶液:Fe2SO43溶液、FeCl3溶液4、无色溶液:大部分溶液5、I2遇淀粉→蓝色溶液。
常见物质的化学式

常见物质的化学式集团标准化小组:[VVOPPT-JOPP28-JPPTL98-LOPPNN]常见物质的化学式常见元素的化合价:+1价 K Na H NH4Ag+2价 Ca Mg Ba Hg Zn+3价 Al; Fe (+2,+3) Cu(+1,+2) 其中Fe、Cu显低价时读“亚铁、亚铜”负价:Cl (-1); O S(-2);原子团(根)的化合价:OH, NO3 (-1) ; SO4, CO3(-2)常见物质的名称及化学式:一、氯化物氯化钾 KCl 氯化钠 NaCl 氯化氢(溶于水为盐酸) HCl氯化铵 NH4Cl 氯化银 AgCl 氯化钙 CaCl2氯化镁MgCl2氯化钡 BaCl2氯化汞HgCl2氯化锌ZnCl2氯化铝AlCl3氯化亚铁FeCl2氯化铁FeCl3氯化亚铜CuCl氯化铜 CuCl2二、氧化物氧化钾K2O 氧化钠 Na2O 水 H2O 氧化银 Ag2O氧化钙CaO 氧化镁MgO 氧化钡 BaO 氧化汞HgO氧化锌ZnO 氧化铝Al2O3氧化亚铁FeO 氧化铁Fe2O3氧化亚铜Cu2O 氧化铜 CuO 三、硫化物硫化钾K2S 硫化钠 Na2S 硫化氢H2S 硫化银 Ag2S硫化钙 CaS 硫化镁MgS 硫化钡 BaS 硫化汞HgS硫化锌ZnS 硫化铝Al2S3硫化亚铁FeS 硫化铁Fe2S3硫化亚铜Cu2S 硫化铜 CuS 四、氢氧化物(碱)氢氧化钾KOH 氢氧化钠NaOH 氢氧化铵NH4OH (或NH3?H2O)氢氧化银 AgOH 氢氧化钙Ca(OH)2氢氧化镁Mg(OH)2氢氧化钡 Ba(OH)2 氢氧化汞Hg(OH)2氢氧化锌Zn(OH)2氢氧化铝Al(OH)3氢氧化亚铁Fe(OH)2氢氧化铁Fe(OH)3氢氧化亚铜CuOH氢氧化铜 Cu(OH)2五、带硝酸根的硝酸钾KNO3 硝酸钠NaNO3硝酸 HNO3硝酸铵NH4NO3硝酸银AgNO3 硝酸钙Ca(NO3)2硝酸镁Mg(NO3)2硝酸钡 Ba(NO3)2硝酸汞Hg(NO3)2硝酸锌Zn(NO3)2硝酸铝Al(NO3)3硝酸亚铁Fe(NO3)2硝酸铁Fe(NO3)3硝酸亚铜CuNO3硝酸铜 Cu(NO3)2六、带硫酸根的硫酸钾K2SO4硫酸钠Na2SO4硫酸 H2SO4硫酸铵(NH4)2SO4硫酸银Ag2SO4硫酸钙CaSO4硫酸镁MgSO4硫酸钡 BaSO4硫酸汞HgSO4硫酸锌ZnSO4硫酸铝Al2(SO4)3硫酸亚铁FeSO4硫酸铁Fe2(SO4)3硫酸亚铜Cu2SO4硫酸铜 CuSO4七、带碳酸根的碳酸钾K 2CO 3 碳酸钠Na 2CO 3 碳酸 H 2CO 3 碳酸铵(NH 4)2CO 3 碳酸银Ag 2CO 3 碳酸钙CaCO 3 碳酸镁MgCO 3 碳酸钡 BaCO 3碳酸汞HgCO 3 碳酸锌ZnCO 3 碳酸铝Al 2(CO 3)3 碳酸亚铁FeCO 3 碳酸铁Fe 2(CO 3)3 碳酸亚铜Cu 2CO 3 碳酸铜 CuCO 3初中化学常见化学方程式一、 A+ B+ …→ C1. 镁在空气(或氧气)中燃烧:2Mg + O 2 2MgO2. 铁在氧气中燃烧:3Fe + 2O 2Fe 3O 43.氢气在空气(或氧气)中燃烧:2H 2+O 22H 2O4.二氧化碳与水反应: H 2O+CO 2==H 2CO 35.生石灰与水反应生成熟石灰:CaO + H 20 = Ca(OH)2 二、分解反应 A →B+ C + … 1.电解水:2H 2O 2H 2↑+O 2↑2.氧气的实验室制法: 2H 2O 2 ====2H 2O+ O 2 ↑3.碳酸不稳定而分解:H 2CO 3 == H 2O + CO 2↑4.高温煅烧石灰石:CaCO 3 ==== CaO + CO 2↑三、置换反应 A+ BC →B+ AC 金属单质 + 酸 → 盐 + 氢气 1. 锌和 Zn + H 2SO 4 = ZnSO 4 + H 2↑ 2. 铁和 Fe + H 2SO 4 = FeSO 4 + H 2↑ 3. 镁和 Mg + H 2SO 4 = MgSO 4 + H 2↑ 4. 铁和稀盐酸 Fe + 2HCl == FeCl 2 + H 2↑ 5. 镁和稀盐酸 Mg+ 2HCl == MgCl 2 + H 2↑ 四、复分解反应 AB+ CD → AD+ CB (一)酸 + → 盐 + 水1. (除铁锈)(铁锈)和稀盐酸反应:Fe 2O 3 + 6HCl ==2FeCl 3 + 3H 2O2. (铁锈)和稀硫酸反应:Fe 2O 3 + 3H 2SO 4 == Fe 2(SO 4)3 + 3H 2O3. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl 2 + H 2O温高MnO 24. 氧化铜和稀硫酸反应:CuO + H2SO4== CuSO4+ H2O(二)酸 + 碱→盐 + 水()1.盐酸和起反应:HCl + NaOH == NaCl +H2O2. 盐酸和反应:2HCl + Ca(OH)2 == CaCl2+ 2H2O3. 药物治疗:3HCl + Al(OH)3 == AlCl3+ 3H2O4. 硫酸和反应:H2SO4+ 2NaOH == Na2SO4+ 2H2O5. 硫酸和反应(改良酸性土壤):H2SO4+ Ca(OH)2== CaSO4+ 2H2O(三)酸 + 盐→另一种酸 + 另一种盐1.二氧化碳的实验室制法:CaCO3 + 2HCl == CaCl2+ H2O + CO2↑2.与稀盐酸反应: Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑3. 硫酸和反应:H2SO4+ BaCl2== BaSO4↓+ 2HCl4.硝酸银溶液与稀盐酸反应:AgNO3+ HCl=== AgCl↓+ HNO3(四)碱 + 盐→另一种碱 + 另一种盐1.(烧碱的工业制法)与:Ca(OH)2 + Na2CO3== CaCO3↓+ 2NaOH2.硫酸铜与氢氧化钠: CuSO4+2NaOH==Na2SO4+Cu(OH)2↓3.氯化铜与氢氧化钠: CuCl2+ 2NaOH==2NaCl+Cu(OH)2↓五、其它碱 + →盐 + 水1.氢氧化钠暴露在空气中变质:2NaOH + CO2 == Na2CO3+ H2O2.氢氧化钠吸收气体:2NaOH + SO2 == Na2SO3+ H2O3.二氧化碳使石灰水变浑浊(鉴别二氧化碳):Ca(OH)2 + CO2== CaCO3↓+H2O4. 石灰水吸收:Ca(OH)2 + SO2== ↓+ H2O1,天然气(甲烷)在空气中燃烧:CH4 + 2O2CO2+ 2H2O2. 酒精在空气中燃烧:C2H5OH + 3O22CO2+ 3H2O。
初中常见化合价、化学式及化学方程式
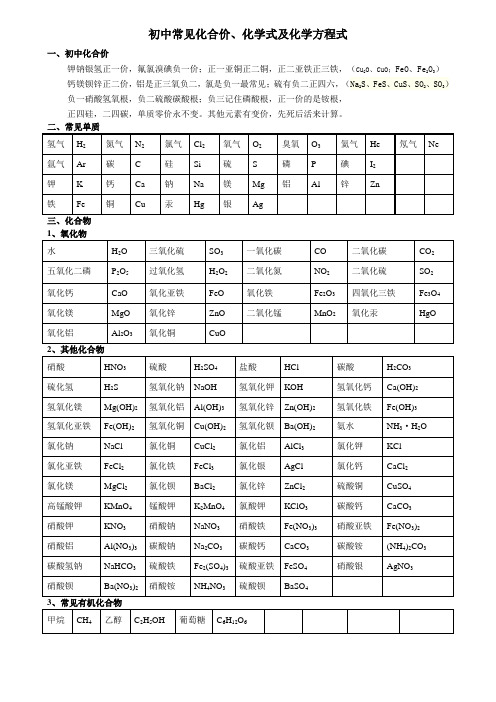
初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu2O、CuO;FeO、Fe2O3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na2S、FeS、CuS、SO2、SO3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根,正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
三、化合物初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O2点燃2MgO2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O43、铝在空气中燃烧:4Al+3O2点燃2Al2O34、氢气在空气中燃烧:2H2+O2点燃2H2O5、红磷在空气中燃烧:4P+5O2点燃2P2O56、硫粉在空气中燃烧:S+O2点燃SO27、碳在氧气中充分燃烧:C+O2点燃 CO28、碳在氧气中不充分燃烧:2C+O2点燃2CO9、二氧化碳通过灼热碳层:C+CO2高温2CO10、一氧化碳在氧气中燃烧:2CO+O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO312、生石灰溶于水:CaO+H2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl2点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑16、加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑18、碳酸化学性质不稳定而分解:H2CO3=H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+CO2↑20、加热氯酸钾分解:2KClO3=2KCl+3O2↑21、氧化汞加热分解:2HgO△2Hg+O2↑三、置换反应(单质+化合物→新的单质+新的合化物)22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl2+H2↑锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑23、镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑镁和稀硫酸反应:Mg+H2SO4=MgSO4+H2↑24、铁和稀盐酸反应:Fe+2HCl=FeCl2+H2↑铁和稀硫酸反应:Fe+H2SO4=FeSO4+H2↑25、铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑铝和稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑26、铁和硫酸铜溶液反应:Fe+CuSO4 =FeSO4+Cu铝和硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3+3Cu27、铜和硝酸银反应:Cu+2AgNO3=Cu(NO3)2+2Ag28、氢气还原氧化铜:H2+CuO△Cu+H2O29、木炭还原氧化铜:C+2CuO高温 2Cu+CO2↑30、焦炭还原氧化铁:3C+2Fe2O高温 4Fe+3CO2↑31、水蒸气通过灼热碳层:H2O+C高温 H2+CO四、复分解反应复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应。
初中化学常见元素及其化合价

初中化学常见元素及其化合价在化学中,元素是构成物质的最基本单位。
元素的化学性质主要由其原子的化合价决定。
化合价是指元素原子在形成化合物时,与其他元素原子结合时所表现出的原子的变化价电态。
常见元素及其化合价如下:1.氢(H):氢原子的化合价为+1,因为其原子只有一个电子,它能够失去电子与其他元素原子形成化合物。
例如,氢气(H2)中的两个氢原子共享一个电子形成氢分子。
2.氧(O):氧原子的化合价为-2,因为其原子有6个电子,它能够接受2个电子与其他元素原子形成化合物。
例如,水(H2O)中的氧原子接受两个氢原子失去的电子形成水分子。
3.氮(N):氮原子的化合价为-3或+5,它可以与其他元素原子形成各种化合物。
例如,氨(NH3)中的氮原子与三个氢原子形成了三键,化合价为-3、而在硝酸(HNO3)中,氮原子与三个氧原子形成了三键,化合价为+54.碳(C):碳原子的化合价为-4,它可以与其他元素原子形成各种化合物。
例如,甲烷(CH4)中的碳原子与四个氢原子形成了共价键,化合价为-45.铁(Fe):铁原子的化合价为+2或+3、例如,亚铁离子(Fe2+)的化合价为+2,而三价铁离子(Fe3+)的化合价为+36.铜(Cu):铜原子的化合价为+1或+2、例如,一价铜离子(Cu+)的化合价为+1,而二价铜离子(Cu2+)的化合价为+27.氯(Cl):氯原子的化合价为-1、例如,氯气(Cl2)中的氯原子共享一个电子形成氯分子。
8.氟(F):氟原子的化合价为-1、例如,氟化钠(NaF)中的氟原子接受了钠原子失去的电子形成氟化钠晶体。
这只是一部分常见元素及其化合价的例子。
化学中有许多元素及其多种化合价的存在,因此化学家将它们整理成了元素周期表。
元素周期表可以帮助我们更好地了解元素及其化合价的规律和特点。
值得注意的是,元素的化合价可以根据不同的反应条件和结构而变化。
所以,在具体的化学反应中,我们需要根据具体情况来确定元素的化合价。
1、化合价(常见元素的化合价):

55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ====K2SO4 + 2H2O
56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ====CuSO4 + 2H2O
57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O
Mn:+2,+4,+6,+7 N:—3,+2,+4,&#:有电子转移(或者化合价升降)的反应
本质:电子转移(包括电子的得失和偏移)
特征:化合价的升降
氧化剂(具有氧化性)——得电子——化合价下降——被还原——还原产物
还原剂(具有还原性)——失电子——化合价上升——被氧化——氧化产物
口诀:得——降——(被)还原——氧化剂
失——升——(被)氧化——还原剂
3、金属活动性顺序表
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
第二步:拆。易溶于水、易电离的物质拆成离子形式;难溶(如CaCO3、BaCO3、BaSO4、AgCl、AgBr、AgI、Mg(OH)2、Al(OH)3、Fe(OH)2、Fe(OH)3、Cu(OH)2等),难电离(H2CO3、H2S、CH3COOH、HClO、H2SO3、NH3?H2O、H2O等),气体(CO2、SO2、NH3、Cl2、O2、H2等),氧化物(Na2O、MgO、Al2O3等)不拆
58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O
常用化学元素的化合价

常用化学元素的化合价
以下是常见化学元素的化合价和相应的解释:
1.氢(H)的化合价通常为+1,因为它倾向于失去一个电子,形成带正电荷的单价阳离子H+。
2.氧(O)的化合价通常为-2,在大多数化合物中氧原子会接受两个电子,形成带负电荷的氧化物阴离子O2-,例如水分子(H2O)中氧的化合价为-2
3.氮(N)的化合价通常为-3,它往往会接受三个电子,形成带负电荷的氮化阴离子N3-。
4.碳(C)的化合价可以是+4或-4,取决于化合物的性质。
在有机化合物中,碳通常与其他元素共享电子,形成化合价为+4的带正电荷的阳离子。
5.铁(Fe)的化合价可以是+2或+3,这取决于它所处的化合物和溶液环境。
例如,Fe2+和Fe3+是两种常见的氧化态,如Fe2+在血红蛋白中的还原型。
6.铜(Cu)的化合价可以是+1或+2,在大多数情况下,它的化合价为+2,但在一些特定的化合物中,它的化合价为+1,例如CuO和Cu2O。
7.氯(Cl)的化合价通常为-1,因为它倾向于获得一个电子,形成带负电荷的氯化物阴离子Cl-。
8.锂(Li)的化合价通常为+1,因为它倾向于失去一个电子,形成带正电荷的单价阳离子Li+。
9.钠(Na)的化合价通常为+1,因为它也倾向于失去一个电子,形成带正电荷的单价阳离子Na+。
10.氟(F)的化合价通常为-1,因为它倾向于获得一个电子,形成带负电荷的氟化物阴离子F-。
这些只是常见化学元素的一些化合价,还有许多其他元素的化合价需要具体根据元素的性质、电子结构和化合物的类型来确定。
化合价是化学反应和物质变化的重要参数,它决定了元素能够与其他元素形成化学键,并决定了化合物的稳定性和性质。
化合价的规律、应用

CuSO4 Na2SO4 NH4NO3 (NH4)2SO4
+1 -2
氢元素通常显+1价。如:H2O
+1 -1
NaCl
(2)一般金属元素显正价,非金属元素显负价
2.一些元素在不同物质中可显不同的化合价
+2 +4
CO
-3
+5CO2
NH4NO3
同种元素在同一个化合物 中可表现出不同的化合价
回 忆
(一)、化合价的一般规律:
旧
知 3、 化合物中各元素正负化合
价的代数和为零。 (应用最广)
回 忆
(一)一些常见元素化合价口诀
旧
一价氢氯钾钠银
知
二价氧钙钡镁锌
三铝四硅五价磷
氮三五,二四碳
铜汞一二,二三铁
二 四六硫都齐全
变价根据规律算
单质为零永不变
回
忆 (二)一些常见原子团的化合价
旧
知
负一硝酸氢氧根
负二硫酸碳酸根
负三记住磷酸根
正一价的是铵根
回 忆
(三)、化合价的一般规律:
旧知(11)、化氧合元价素有通正常价显和-2负价价。。
PO
子个数
5.检查 -2x5+(+5)x2=0
练习:
1.已知下列元素在氧化物中的化合价,写 出它们与氧形成化合物的化学式
+2 +4 +2 +5 +2 +2 +3 +3 Ba S C N Mg Ca Fe Al
十字交叉法:
一排顺序二标价. 价数交叉写右
下.
1、排正价在约前简负价价数在作后角码P. O总价为零去检
化合价、化学方程式整理

初中化学整理一、常见元素化合价钾钠银氢+1价,钙镁钡锌+2价,一、二铜,二、三铁;氟氯溴碘-1价,氧硫通常-2价,单质化合价为零二、常见原子团化合价四、化学式的书写1、单质:(1)由原子直接构成(元素符号):a.金属:钾K、钙Ca、钠Na、镁Mg、铝Al、锌Zn、铁Fe、锡Sn、铅Pb、氢H、铜Cu、汞Hg、银Ag、铂Pt、金Au 钡Ba、钨Wb.稀有气体:氦He、氖Ne、氩Ar、氪Kr、氙Xe、氡Rnc.部分固态非金属:金刚石/石墨/碳C、硅Si、磷P、硫S(2)双原子分子:a.固体:碘I2;b.常见气体:氢气H2、氮气N2、氧气O2、氯气Cl2、氟气F2;c.液态:溴Br2(3)三原子分子:臭氧O32、化合物:按照化合价,利用化合价交叉法进行书写(1)氧化物:由两种元素组成,其中一种为氧元素的化合物a.非金属氧化物:水H2O、一氧化碳CO、二氧化碳CO2、二氧化硫SO2、三氧化硫SO3、二氧化硅SiO2、一氧化氮NO、二氧化氮NO2、五氧化二磷P2O5b.金属氧化物:氧化钾K2O、氧化钠Na2O、氧化银Ag2O、氧化亚铜Cu2O、氧化钙CaO、氧化镁MgO、氧化钡BaO、氧化锌ZnO、氧化铜CuO、氧化亚铁FeO、三氧化二铁(氧化铁)Fe2O3、四氧化三铁Fe3O4、三氧化二铝Al2O3、二氧化锰MnO2、三氧化钨WO3、氧化铅PbO(2)常见的酸(阳离子只有H+的化合物):硫酸H2SO4、盐酸HCl、硝酸HNO3、磷酸H3PO4、硫化氢H2S、碳酸H2CO3、醋酸CH3COOH(3)常见的碱(阴离子只有OH¯的化合物):氢氧化钾KOH、氢氧化钠NaOH、氢氧化钙Ca(OH)2、氢氧化镁Mg(OH)2、氢氧化钡Ba(OH)2、氢氧化锌Zn(OH) 2、氢氧化铜Cu(OH) 2、氢氧化亚铁Fe(OH) 2、氢氧化铁Fe(OH) 3、氢氧化铝Al(OH) 3(4)盐:由金属阳离子(或铵根离子)和酸根离子构成的化合物a.氯化物/盐酸盐:氯化钾KCl、氯化钠(食盐)NaCl、氯化银AgCl、氯化钙CaCl2、氯化镁MgCl2、氯化钡BaCl2、氯化锌ZnCl2、氯化铜CuCl2、氯化亚铁FeCl2、氯化铁FeCl3、氯化铝AlCl3b.硝酸盐:硝酸钾KNO3、硝酸钠NaNO3、硝酸银AgNO3、硝酸钙Ca(NO3)2、硝酸镁Mg(NO3)2、硝酸钡Ba(NO3)2、硝酸锌Zn(NO3)2、硝酸铜Cu(NO3)2、硝酸亚铁Fe(NO3)2、硝酸铁Fe(NO3)3、硝酸铝Al(NO3)3c.硫酸盐:硫酸钾K2SO4、硫酸钠Na2SO4、硫酸银Ag2SO4、硫酸钙CaSO4、硫酸镁MgSO4、硫酸钡BaSO4、硫酸锌ZnSO4、硫酸铜CuSO4、硫酸亚铁FeSO4、硫酸铁Fe2 (SO4) 3、硫酸铝Al2 (SO4) 3d.碳酸盐:碳酸钾K2CO3、碳酸钠Na2CO3、碳酸银Ag2CO3、碳酸钙CaCO3、碳酸镁MgCO3、碳酸钡BaCO3、碳酸锌ZnCO3、碳酸铜Cu CO3、碳酸亚铁Fe CO3、e.铵盐:氯化铵NH4Cl、硝酸铵NH4NO3、碳酸铵(NH4)2CO3、硫酸铵(NH4)2SO4、磷酸铵(NH4)3PO4、碳酸氢铵NH4HCO3f.其他:高锰酸钾KMnO4、锰酸钾K2MnO4、氯酸钾KClO3、氨气NH3、过氧化氢H2O2g.常见化肥:尿素CO(NH2)2(N%=46.7%)、硝酸铵NH4NO3(N%=35%)、硫酸铵(NH4)2SO4(N%=21.2%)、碳酸氢铵NH4HCO3(N%=17.7%)、硫酸钾K2SO4、氯化钾KCl(5)有机物(含碳化合物):甲烷CH4、乙炔C2H2、乙醇(酒精)C2H5OH、乙酸CH3COOH、葡萄糖C6H12O6(6)常见结晶水合物:五水硫酸铜CuSO4·H2O、明矾KAl(SO4) 2•12H2O、碳酸钠晶体Na2CO3•10H2O3、常见沉淀及其颜色:白色:CaCO3、CaSO4(微溶)、BaCO3、BaSO4、AgCO3、AgCl、AgOH、Fe(OH) 2、Mg(OH) 2红色:Cu、Fe(OH) 3(红褐色)、Fe2O3蓝色:Cu(OH)2(絮状)黑色:MnO2、CuO、Fe、C、Fe3O4、FeSO4五、溶解性表:OH¯:铵、钾、钠、钡、钙(微);NO3¯:全溶;Cl¯:AgCl(白色沉淀);SO42-:BaSO4(白色沉淀);CO32-:铵、钾、钠六、共存问题1、OH¯+H+→H2O2、OH¯+部分金属离子→碱↓3、Ba2++SO42—→BaSO44、Ag++Cl—→AgCl5、CO32—+部分金属离子→盐↓6、H++CO32—→H2O+CO2↑7、NH4++ OH¯→NH3↑+ H2O8、HCO3—+ H+→H2O+CO2↑9、无色:Fe2+(淡绿)、Fe3+(黄)、Cu2+(蓝)七、化合反应:两种或两种以上物质反应生成另一种物质。
化合价规律

5、O:
(1)常见-2:酸碱盐,氧化物,有机物中显-2
(2)还有-1:只在过氧化物中:H2O2、Na2O2
(3)少见的+2 :只有OF2
(4)更少见的是:- 只在超氧化物中:KO2
二.价态规律
1.最高价只有氧化性,如KMnO4、CuSO4、AgCl、HNO3、H2SO4、FeCl3、K2Cr2O7、H2O4它:过氧化物、超氧化物、HClO
二.常见还原剂
1.活泼的金属单质:Na、Mg、Al、Fe、Zn、Ca
2.某些非金属单质:H2、C、Si、S
3.某些非金属氧化物:CO、SO2、
4.含有低价态元素的化合物:HCl、HI、H2S、NH3、PH3、Fe2+
2、金属无负价,一般其化合价等于其最外层电子数:Na +1价、Mg +2价;常见的变价金属:Cu:+2,+1;Fe:+2,+3;Hg:+1,+2;Pb:+2,+4……
3、非金属化合价有正有负:
最低负价等于最外层电子数-8:F、S、C、N、O只有H:最外层电子—2;
最高正价等于,最外层电子数;(O、F特殊)
注意:氧化性、还原性指得电子的能力而不是多少!!
=======分====割====线=======
一.常见氧化剂
1活泼的非金属单质:F2、Cl2、Br2、I2、O2、O3
2含有高价态元素的化合物:KMnO4、CuSO4、AgCl、FeCl3、HNO3、H2SO4、K2Cr2O7、H2O
3能电离出H+的物质:酸、强酸的酸式盐
2.最低价只有还原性,如HCl、HI、H2S、NH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.化合价的应用
在离子化合物中,得、失电子的数目是相等的,在共价化合物中,共用电子对偏离和偏向的数目也是相等的,所以在任何化合物中正、负化合价的代数和都等于“0”。由此不难理解,不同元素相化合时,其原子个数不能是任意的,而要有一定的个数比,这是我们书写化学式和判断化学式是否正确的依据。例如,已知铝为+3价,硫酸根是-2价的原子团,铝跟硫酸根结合成的硫酸铝的化学式应为Al2(SO4)3, 这样才符合化合物中的各元素正、负化合价的代数和等于“0”的原则。如果写成AlSO4就错了,理由很简单,因为这个化学式中元素正、负化合价的代数和不等于“0”。
(高中)钾钙钠镁铝锰锌、铬铁镍、锡铅氢;铜汞银铂金。
盐的溶解性:
钾钠铵硝皆可溶、盐酸盐不溶银亚汞;
硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶。
常见元素化合价顺口溜(一):
钾钠氢银正一价,钙镁锌钡正二价;
氟氯溴碘负一价,通常氧是负二价;
铜正一正二铝正三,铁有正二和正三;
碳有正二和正四,硫有负二正四和正六。
二四碳铅二三铁, 二四六硫三五磷。
常见元素的主要化合价二:
氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
化合价口诀三:
一价氢氯钾钠银;二价氧钙钡镁锌,
三铝四硅五氮磷;二三铁二四碳,
二四六硫都齐;铜汞二价最常见。
常见根价口诀:
一价铵根硝酸根;氢卤酸根氢氧根。
高锰酸根氯酸根;高氯酸根醋酸根。
二价硫酸碳酸根;氢硫酸根锰酸根。
暂记铵根为正价;负三有个磷酸根。
金属活动性顺序表:
(初中)钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金。
4.化合价的特点
⑴有正负之分(得电子为负,失电子为正);
⑵化和价数值等于一个原子得失电子数目或共用电子对数;
⑶单质为零价
⑷通常情况下,金属元素只有正价;
⑸一种元素可以前世不同的化合价[变价];
化合价口决一:
一价氟氯溴碘氢, 还有金属钾钠银。
二价氧钡钙镁锌, 铝三硅四都固定。
氯氮变价要注意 ,一二铜汞一三金。
1.化合价的概念
元素的“化合价”是元素的一种重要性质,这种性质只有跟其他元素相化合时才表现出来。就是说,当元素以游离态存在时,即没有跟其他元素相互结合成化合物时,该元素是不表现其化合价的,因此单质中元素的化合价为“0”。例如Zn、C、H2等。
2.化合价的本质
元素的“化合价”就是该元素的1个原子跟其他元素的原子相化合时得失电子或共用电子的数目。化合价有正价和负价。在离子化合物中,元素正化合价的数值等于该元素1个原子给出电子的数目,元素负化合价的数值等于该元素的1个原子为了填满最外电子层所必须结合的电子数目。例如在氯化镁中,1个镁原子给出两个电子,1个氯原子获得1
常见元素化合价顺口溜(二):
一价氢锂钾钠银,二价氧镁钙钡锌,
铜汞一二铁二三,碳锡铅在二四寻,
硫为负二正四六,负三到五氮和磷,
卤素负一、一、三、五、七,
三价记住硼、铝、金。
精心搜集整理,只为你的需要
