注射用盐酸表柔比星说明书--法玛新
盐酸多柔比星脂质体注射液 质量标准

盐酸多柔比星脂质体注射液质量标准盐酸多柔比星脂质体注射液,是一种用于治疗癌症的药物。
其主要成分是盐酸多柔比星,以及一种称为脂质体的药物传递系统。
在本文中,我们将详细介绍盐酸多柔比星脂质体注射液的质量标准。
1.外观:盐酸多柔比星脂质体注射液应该是无颗粒、无悬浮物和无杂质的透明液体。
其中,脂质体应该是均匀分散在溶液中,并且具有均一的颗粒大小和形状。
2. pH值:盐酸多柔比星脂质体注射液的pH值应该在4.0-7.0之间。
pH值的范围对于药物的稳定性和生物利用度非常重要,过高或过低的pH值可能会影响药物的疗效。
3.盐酸多柔比星含量:盐酸多柔比星脂质体注射液的盐酸多柔比星含量应符合国家药典或企业自行制定的规定。
这是确保该药物在治疗癌症方面提供有效结果的重要指标。
4.脂质体粒径:盐酸多柔比星脂质体注射液中的脂质体应具有一定的粒径范围。
这是由于脂质体的大小会影响其在体内的分布和吸收情况。
通常来说,脂质体粒径应在100-200纳米之间。
5.无菌性:盐酸多柔比星脂质体注射液必须符合无菌性的要求。
这意味着在制造和包装过程中,要严格控制微生物的污染。
如果存在细菌、霉菌或其他致病微生物的污染,可能对患者的健康产生严重影响。
6.稳定性:盐酸多柔比星脂质体注射液在储存和运输过程中应该具有良好的稳定性。
药物的稳定性包括其在不同温度、光照和湿度条件下的物化特性和有效性。
针对盐酸多柔比星脂质体注射液,一般要求其在室温下储存,并且在有效期内保持其活性。
7.溶解度:盐酸多柔比星脂质体注射液的溶解性是十分重要的。
治疗的有效性与药物的溶解度密切相关。
因此,盐酸多柔比星脂质体注射液的溶解性应符合一定的标准,以确保在用药过程中能够得到良好的溶解。
综上所述,盐酸多柔比星脂质体注射液的质量标准涉及到外观、pH值、盐酸多柔比星含量、脂质体粒径、无菌性、稳定性以及溶解度等方面。
只有在这些方面都能达到标准,药物才能发挥其治疗癌症的作用。
不过需要注意的是,具体的质量标准可能因国家药典、公司标准或医疗监管要求而有所不同。
表柔比星注射液

盐酸表柔比星注射液目录编辑本段产品介绍【批准文号】国药准字H20041211【中文名称】盐酸表柔比星注射液【产品英文名称】Epirubicin Hydrochloride for Injection 【生产企业】浙江海正药业股份有限公司【功效主治】用于治疗白血症恶性淋巴瘤多发性骨髓瘤乳腺癌肺癌软组织肉瘤胃癌结肠直肠癌卵巢癌等【化学成分】盐酸表柔比星编辑本段药理作用4位置上的羟基由顺位变为反位为一细胞周期非特异性药物其主要作用部位是细胞核本品的作用机制与其能与DNA结合有关体外培养的细胞加入本品可迅速透入胞内进入细胞核与DNA结合从而抑制核酸的合成和有丝分裂已证实表柔比星具有广谱的抗实验性肿瘤的作用对拓扑异构酶也有抑制作用疗效与阿霉素相等或略高而毒性尤其是心脏毒性低于阿霉素【药物相互作用】1表柔比星可与其他抗肿瘤药物合用但表柔比星用量应减低联合用药时不得在同一注射器内使用2表柔比星不可与肝素混合注射因为二者化学性质不配伍在一定浓度时会发生沉淀反应编辑本段不良反应1与阿霉素相似但程度较低尤其是心脏毒性和骨髓换制毒性;2其他不良反应有:脱发60~90%的病例可发生一般可逆男性有胡须生长受抑;黏膜炎用药的第5~10天出现能常发生在舌侧及舌下粘膜;胃肠功能紊乱如恶心呕吐腹泻;曾有报道偶有发热寒颤荨麻疹色素沉着关节疼痛【禁忌症】1禁用于因用化疗或放疗而造成明显骨髓抑制的病人2已用过大剂量蒽环类药物(如阿霉素或柔红霉素)的病人3近期或既往有心脏受损病史的病人【产品规格】5ml:10mg【用法用量】表柔比星单独用药时成人剂量为按体表面积一次60~90mg/m2联合化疗时每次50~60mg/m2静脉注射根据病人血象可间隔21天重复使用【贮藏方法】遮光,密封保存。
编辑本段注意事项1关于心脏毒性(1)可导致心肌损伤,心力衰竭。
动物实验和短期人体实验表明,表柔比星的心脏霉性比异构体阿霉素小。
比较研究表明,表柔比星和阿霉素引起相同程度心功能减退的蓄积剂量之比为2:1。
表柔比星(法玛新)产品介绍

70
RT112细胞株的残余克
60
阿霉素
法玛新 643
隆繁殖活性 (1小时:PH=7.5) 在一次肿瘤细胞培养 抑制试验活动中,阿 霉 素 仍 遗 留 了 6 5 %的
克隆活性细胞%
50 40 30 20 10 0
克隆繁殖活性,而法
249 玛 新 仅 2 3 %, 显 示 其 抑制作用明显增加。
高效广谱
安全耐受 量效关系
为什么要选用“速溶型”,而取代“传 统型”
传统型制剂的问题:
– 蒽环类药物的溶解性差,在冬天
情况尤为严重 – 抽吸后有少许液滴附于瓶壁 – 增加了医务人员工作量。
法玛新 — 速溶剂型
溶解性好,用量精确 操作容易,减少污染
谢 谢!
法玛新作为单药治疗晚期乳腺癌
高剂量 (mg/m2) 剂量
120 100 90
有效率 (%)
65–85 35–85 16–50
常规剂量下,法玛新与阿霉素有效率相似
法玛新充分显示剂量-疗效关系
Plosker and Faulds, 1993
中华人民共和国卫生部批准, 法玛新单药剂量每次化疗可达
same conditions... moreover, the lower pKa of epirubicin ..is clearly reflected in the greater cytotoxicity of epirubicin at every PH studied.” (Launchbury and Habboubi,1993)
法玛新 :高剂量的用法
~ 120mg/m2 5 ~ 10分钟内静脉注射入体内,或30分钟内 静脉滴注用完 剂量可一次用完或分连续2 ~ 3天使用 视骨髓象情况21天重复用药。
盐酸表柔比星功能介绍
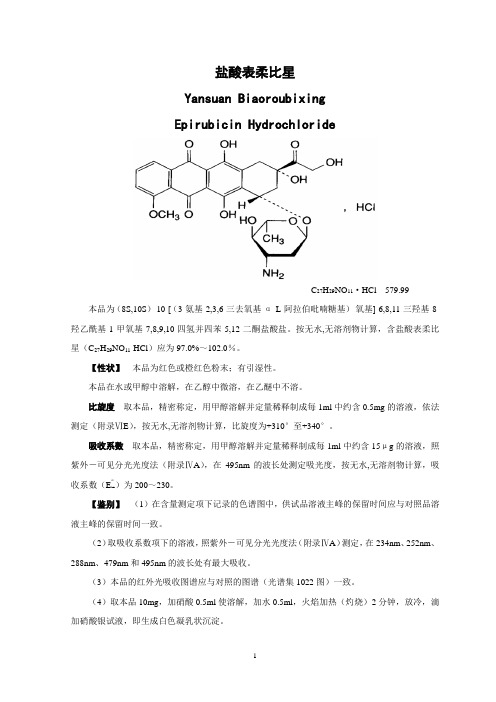
盐酸表柔比星Yansuan BiaoroubixingEpirubicin HydrochlorideC27H29NO11·HCl 579.99 本品为(8S,10S)-10-[(3-氨基-2,3,6-三去氧基-α-L-阿拉伯吡喃糖基)-氧基]-6,8,11-三羟基-8-羟乙酰基-1-甲氧基-7,8,9,10-四氢并四苯-5,12-二酮盐酸盐。
按无水,无溶剂物计算,含盐酸表柔比星(C27H29NO11·HCl)应为97.0%~102.0%。
【性状】本品为红色或橙红色粉末;有引湿性。
本品在水或甲醇中溶解,在乙醇中微溶,在乙醚中不溶。
比旋度取本品,精密称定,用甲醇溶解并定量稀释制成每1ml中约含0.5mg的溶液,依法测定(附录ⅥE),按无水,无溶剂物计算,比旋度为+310°至+340°。
吸收系数取本品,精密称定,用甲醇溶解并定量稀释制成每1ml中约含15μg的溶液,照紫外-可见分光光度法(附录ⅣA),在495nm的波长处测定吸光度,按无水,无溶剂物计算,吸收系数(E1%1cm)为200~230。
【鉴别】(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)取吸收系数项下的溶液,照紫外-可见分光光度法(附录ⅣA)测定,在234nm、252nm、288nm、479nm和495nm的波长处有最大吸收。
(3)本品的红外光吸收图谱应与对照的图谱(光谱集1022图)一致。
(4)取本品10mg,加硝酸0.5ml使溶解,加水0.5ml,火焰加热(灼烧)2分钟,放冷,滴加硝酸银试液,即生成白色凝乳状沉淀。
【检查】酸度取本品,加水制成每1ml中含5mg的溶液,依法测定(附录VI H),pH 值应为4.0~5.5。
溶液的澄清度取本品5份,各10mg,分别加水5ml溶解后,溶液应澄清;如显浑浊,与1号浊度标准液(附录ⅨB)比较,均不得更浓。
阿克拉霉素(注射用)

注射用盐酸阿柔比星说明书【药品名称】通用名:注射用盐酸阿柔比星商品名:英文名:Ac1arubicin Hydrochlorid for Injection汉语拼音:Zhusheyong Yansuan A roubixing本品主要成分为阿柔比星,化学名为(1R,2R,4S)-2-乙基-1,2,3,4,6,11-六氢-2,5,7-三羟基-6,11-二氢-4-[[2,3,6-三脱氧-4-O-[2,6-二脱氧-4- O-[(2R,6S)-四氢-6-甲基-5-氧-2H-吡喃-2-基]-α-L-来苏-已吡喃糖基]-3-(二甲氨基)-α- L-来苏-已吡喃糖基]氧]-1-并四苯羧酸甲酯。
其结构式:分子式:C42H58NO15 ·HCL分子量:848.34【性状】本品为黄色或淡橙黄色冷冻疏松块状物。
【药理毒理】阿柔比星是一种新蒽环类抗肿瘤抗生素,对各种移植性动物肿瘤如L310、P388、Ehlrich 腹水癌、Lewis 肺癌、S100肉瘤、B16黑色素瘤和CDF8及C3H乳癌等均有较强的抗瘤活性。
本品能抑制癌细胞的生物大分子合成,特别对RNA合成的抑制作用强。
本品对实验动物有一定的心脏毒性和骨髓抑制作用,但作用是可逆的。
本品有生殖毒性。
【药代动力学】本品静脉注射后,能很快分布到全身组织中,以肺浓度为最高,其次为脾、胸腺、小肠、心脏;在肝、肾中以配基类代谢物为主;瘤组织中也有一定分布。
虽然本品在注射后,血药浓度迅速降低,但能较久地维持在一定浓度。
原型药和糖苷类代谢物在胆汁中排泄较多,在尿粪中排泄较少;配基类代谢物主要由尿、粪排泄。
【适应症】急性白血病、恶性淋巳瘤,也可试用于其他实体恶性肿瘤。
【用法用量】临用前,加氯化钠注射液或5%葡萄糖注射液溶解,静脉注射或滴注。
白血病与淋巴瘤:15~20mg/日,连用7~10日,间隔2~3周后可重复。
实体瘤:30~40mg/次,一周2次,连时4~8周。
本品也可与其他抗癌药物联合应用。
表阿霉素(表柔比星)

表阿霉素(表柔比星)
【适用症】: 适应症与阿霉素相同,主要用于乳腺癌、恶性淋巴瘤、
卵巢癌、消化道癌、肺癌、白血病、头颈部癌、软组织肉瘤、膀胱癌、肾癌及恶性黑色素瘤等。
【注意事项】: 与阿霉素相同,骨髓抑制略轻,心脏毒性较低。
引起
心脏毒性的平均剂量为每平方米体表面积935mg,而阿霉素为每
平方米体表面积468mg。
70%的病人出现脱发。
【用法与用量】: 静注:成人单一用药每平方米体表面积75~90
mg,3周给药1次。
也可给予每平方米体表面积40~50mg,
连续2日,亦3周后重复。
对于既往作过放、化疗,骨髓贮备降低,
年老病人、肝功能异常及同时进行纵隔、心包放疗的病人需减量。
在
联合化疗中也应相应减量,一般可给每平方米体表面积50~75mg,3周1次。
表阿霉素口服无效,不能肌注或鞘内给药。
静注时最
好在输液后由侧管中冲入,避免药物外渗或漏至皮下引起严重的组织
损伤及坏死。
药物溶解后可在室温下保存24小时,但应避免阳光直
接照射。
在冰箱中(4~10℃)可保存48小时。
【包装】: 针剂表阿霉素:每支10mg、50mg。
【贮藏】: 室
温下避光保存。
药物说明书drins-表柔比星-辉瑞

儿童用药无特殊要求。
【老年用药】
老年患者伴心功能减退者宜慎用或减量。
【药物相互作用】
表柔比星可与其他抗肿瘤药物合用,但表柔比星用量应减低。联合用药时,不得在同一注射器内使用。 表柔比星不可与肝素混合注射,因为二者化学性质不配伍,在一定浓度时会发生沉淀反应。 表柔比星主要在肝脏代谢,伴随治疗中任何能引起肝功能改变的药物将会影响表柔比星的代谢、药动、疗效和/或毒性。 在表柔比星给药前使用紫杉醇类药物会引起表柔比星药物原形及代谢物血药浓度升高,其中代谢物既没有活性也没有毒性。当紫杉醇或多西紫杉醇类药物和表柔比星联合用药时,先给表柔比星则对其药代动力学没有影响。
【贮藏】
遮光、密封保存
【包装】
无色透明玻璃瓶,氯丁基橡胶塞,并用顶盖为聚丙烯塑料的嵌入式铝盖封口。包装规格:1瓶/盒
【有效期】
48个月
【执行标准】
YBH02502011
【批准文号】
10mg批准文号: 国药准字H20000496 50mg批准文号: 国药准字H20000497
【适应症】
治疗恶性淋巴瘤、乳腺癌、肺癌、软组织肉瘤、食道癌、胃癌、肝癌、胰腺癌、黑色素瘤、结肠直肠癌、卵巢癌、多发性骨髓瘤、白血病。 膀胱内给药有助于浅表性膀胱癌、原位癌的治疗和预防其经尿道切除术后的复发。
【规格】
10mg;50mg;(按C27 H29 NO11 ·HCl计)
【用法用量】
常规剂量:表柔比星单独用药时,成人剂量为按体表面积一次60~120mg/m2,当表柔比星用来辅助治疗腋下淋巴阳性的乳腺癌患者联合化疗时,推荐的起始剂量为100~120mg/m2静脉注射,每个疗程的总起始剂量可以一次单独给药或者连续2-3天分次给药。根据患者血象可间隔21天重复使用。优化剂量:高剂量可用于治疗肺癌和乳腺癌。单独用药时,成人推荐起始剂量为按体表面积一次最高可达135mg/m2,在每疗程的第1天一次给药或在每疗程的第1、2、3天分次给药,3-4周一次。联合化疗时,推荐起始剂量按体表面积最高可达120mg/m2,在每疗程的第1天给药,3-4周一次。静脉注射给药。根据患者血象可间隔21天重复使用。膀胱内给药:表柔比星应用导管灌注并应在膀胱内保持一小时左右。在灌注期间,患者应时常变换体位,以保证膀胱粘膜能最大面积地接触药物。为了避免药物被尿液不适当的稀释,应告知患者灌注前12小时不要饮用任何液体。医生应指导患者在治疗结束时排空尿液。浅表性膀胱癌,表柔比星50mg溶于25至50mL生理盐水中,每周一次,灌注8次。对于有局部毒性 (化学性膀胱炎) 的病例,可将每次剂量减少至30mg,患者也可接受50mg每周一次共4次、然后每月一次共11次的同剂量药物膀胱灌注。医生可根据患者病情调整给药次数。
注射用盐酸表柔比星说明书

注射用盐酸表柔比星说明书注射用盐酸表柔比星说明书一、商品名称注射用盐酸表柔比星二、药品分类处方药三、药品成分每1毫升含盐酸表柔比星2毫克四、适应症此药适用于治疗以下感染疾病:1. 呼吸道感染,如急性喉炎、急性支气管炎等。
2. 皮肤和软组织感染,如表浅性脓肿、痈、蜂窝织炎等。
3. 泌尿道感染,如肾盂肾炎、尿道炎等。
4. 消化道感染,如胃肠炎、胆囊炎等。
5. 骨骼系统感染,如骨髓炎,化脓性关节炎等。
五、用法用量该药应由医生按病情和患者体重等因素决定用药剂量和疗程,不宜自行调整。
1. 成人和12岁以上儿童:每次0.25毫克/千克,一日2次给药。
2. 特殊人群:(1)肝功能不全患者:应减小剂量或增加给药间隔时间。
(2)肾功能不全患者:根据肾功能状况,调整用药剂量和给药间隔时间,严重肾功能不全应禁用。
(3)老年患者:应注意肾功能变化,酌情调整剂量和给药间隔时间。
(4)儿童患者:剂量应按体重计算,给予成人剂量的半数。
六、注意事项1. 禁忌症:对本药过敏、严重肝功能不全和婴儿期患嗜血细胞减少症等禁用。
2. 孕妇和哺乳期妇女应慎用。
3. 本药物可能出现过敏、肝损伤、肾损伤、血液系统不良等不良反应,如出现不适应立即停药并就医。
4. 在药物使用期间应避免饮酒、吸烟等影响药效的行为。
5. 长期应用本药可能导致细菌耐药性增加,应尽可能遵医嘱使用。
七、药物相互作用1. 与苯扎氯铵合用可增加中枢神经系统毒性。
2. 与卡马西平合用可增强前者的抗高血压作用。
3. 与华法林、保泰松等药物合用可增加出血风险。
八、贮藏方法本药品需存放于干燥,阴凉和避光的环境内,离达到最佳效果的安瓿打开时间不超过24小时。
避免冷藏,不得使用色素变化、浑浊、有颗粒物的溶液。
九、过期时间该药品保质期为2年。
十、包装规格每瓶装2毫升,每盒12瓶。
注射用盐酸表柔比星

注射用盐酸表柔比星ZhusheyongYansuan BiaoroubixingEpirubicinHydrochloride forInjection本品为盐酸表柔比星加适宜赋形剂或/和抑菌剂制成的无菌冻干品。
盐酸表柔比星(CH29NO11·HCl)平均含量应为标示量的90.0%~110.0%。
27【性状】本品为红色或橙红色疏松块状物或粉末;有引湿性。
【鉴别】取本品适量,照盐酸表柔比星项下的鉴别(1)、(4)项试验,显相同的结果。
【检查】酸度取本品适量,加水制成每1ml中含盐酸表柔比星2mg的溶液,依法测定(附录VI H),pH值应为4.5~6.0。
溶液的澄清度取本品5瓶,分别加水制成每1ml中含盐酸表柔比星2mg的溶液,溶液应澄清;如显浑浊,与1号浊度标准液(附录ⅨB)比较,均不得更浓。
有关物质取本品,用含量测定项下的流动相制成每1ml中约含盐酸表柔比星0.5mg 的溶液;作为供试品溶液,精密量取适量,用流动相定量稀释制成每1ml中含盐酸表柔比星5μg的溶液,作为对照溶液,照盐酸表柔比星项下的方法测定。
供试品溶液色谱图中如有杂质峰[如本品含有抑菌剂对羟基苯甲酸甲酯(相对保留时间约0.2)应除外],多柔比星酮按校正后的峰面积计算(相对保留时间约0.3,校正因子0.7)不得大于对照溶液主峰面积(1.0%),多柔比星(相对保留时间约0.8)峰面积不得大于对照溶液主峰面积(1.0%),其他单个杂质峰面积不得大于对照溶液主峰面积的4/5(0.8%),各杂质峰面积(多柔比星酮按校正后的峰面积计算)的和不得大于对照溶液主峰面积的2.5倍(2.5%)。
对羟基苯甲酸甲酯取含量测定项下供试品溶液作为供试品溶液,取对羟基苯甲酸甲酯对照品适量,用含量测定项下的流动相定量溶解并稀释制成每1ml中约含20μg的溶液,作为对照品溶液;照含量测定项下的方法测定,按外标法以峰面积计算,含对羟基苯甲酸甲酯应为标示量的80.0%~120.0%(10mg规格每瓶含对羟基苯甲酸甲酯2mg;50mg规格每瓶含对羟基苯甲酸甲酯10mg)。
注射剂药物溶媒和配制浓度要求汇总(2023)

注射剂药物溶媒和配制浓度要求汇总(2023)一、说明书指定固定溶媒的药物(一)抗肿瘤药物(二)抗菌药物(三)其他药物(四)中药注射剂二、说明书中有溶媒用量及稀释浓度要求的药物(一)抗肿瘤药物(二)其他药物(三)中药注射剂药物溶解或稀释所用溶媒需注意相容性,原则上应参照药品说明书列出的溶媒种类及溶媒量进行配置。
O1溶媒的选择:静脉药物溶媒的选择需考虑溶媒PH值、电解质成分的因素。
溶媒PH 值偏低或偏高时,其氢离子、氢氧根离子可催化药物的水解,引起药物溶解度或降解速度的变化,影响质量稳定性。
强电解质溶媒或含有如Ca2÷.Na+等强电解质成分的,加入弱离子溶液或非电解质溶液中时,可降低药物的水溶性,诱导药物析出产生沉淀,或者对某些胶体溶液的稳定性产生破坏作用。
02溶媒量的选择:溶媒量过大,滴注浓度偏低,会降低药物疗效,并可能因滴注时间延长而增加药物毒副作用概率;溶媒量过小,药物溶解不充分,容易产生药物微粒,从而增加静脉炎或静脉血栓的发生率。
有时也会因药物浓度过高对血管产生刺激疼痛。
5%葡萄糖注射液:3.2~6.510%葡萄糖注射液:3.2〜6.5葡萄糖氯化钠注射液:3.5-5.5复方氯化钠注射液:4.5-7.50.9%氯化钠注射液:4.5-7.0一、说明书指定固定溶媒的药物(一)抗肿瘤药物01溶媒:5%GS注射用紫杉醇脂质体(力扑素)30mg注射用奥沙利粕(乐沙定)50mg卡粕注射液(波贝)IOOmgIOm1注射用盐酸叱柔比星(依比路)IOmg盐酸多柔比星脂质体注射液(多美素、立幸)IOm1NOnig 02溶媒:NS阿米福汀注射粉针(美罗)0∙4g注射用紫杉醇(白蛋白结合型)(克艾力)IOOmg贝伐珠单抗注射液(安维汀)4m1:0.Ig注射用培美曲塞二钠(力比泰)0.5g甲磺酸艾立布林注射液(海乐卫)2m1:Img注射用曲妥珠单抗(赫赛汀)440mg帕妥珠单抗注射液(帕捷特)420mg;14m1替雷利珠单抗注射液(百泽安)10m1:IOOmg信迪利单抗注射液(达伯舒)IOOmg:IOm1特瑞普利单抗注射液(拓益)240mg尼妥珠单抗注射液(泰欣生)50mg:IOm1西妥昔单抗注射液(爱必妥)IoOmg(20m1)达雷妥尤单抗注射液(兆珂)400mg:20m1注射用奈达箱(捷佰舒)IOmg注射用吉西他滨(健择)0.2g依托泊昔注射液(齐鲁)5m1:0.Ig(二)抗菌药物注射用醋酸卡泊芬净(科赛斯)50mg:70mg,溶媒NS两性霉素B注射粉针(华北)25mg,溶媒pH>4.2的5%GS (三)其他药物O1溶媒:10%GS葡萄糖酸钙注射液(华润双鹤)Igi1Om102溶媒:5%GS盐酸精氨酸注射液(上海信谊金朱)20m1:5g门冬氨酸钾镁注射液(潘南金)10m1脱氧核甘酸钠注射液(北京赛升)50mg地塞米松磷酸钠注射液(天津金耀)Ini1:5mg03溶媒:5%GS或10%GS间苯三酚注射液(南京恒生)4m1:40mg多烯磷脂酰胆碱注射液(成都天台山)5m1:232.5mg 04溶媒:NS艾司奥美拉哇钠注射粉针(艾速平)20mg注射用艾司奥美拉哇钠(耐信)40mg注射用兰索拉哇(山东罗欣)30mg肝素钠注射液(华北)2m1:12500iu丙戊酸钠注射粉针(德巴金)0.4g+4m1巴曲酶注射液(东菱迪芙)0.5m1:5BU蔗糖铁注射液(南京恒生)IOm1:20Omg矛头蝮蛇血凝酶注射粉针(巴曲亭)2iu罂粟碱注射粉针(阔舒)30mg注射用英夫利西单抗(类克)IoonIg注射用骨肽(I)(西若非)IOmg依达拉奉注射液(必存)IOm1硫辛酸注射液(亚宝)6m1∕20m1注射用脑蛋白水解物(In)(山西普德)60mg甘露聚糖肽注射液(徐州莱恩)5mg(四)中药注射剂O1溶媒:10%GS舒肝宁注射液(贵州瑞和)2m1灯盏花素注射液(石药银湖)5m1:20mg 02溶媒:5%GS丹参注射液(正大青春宝)10m1∕2m1静脉注射时使用50%GS稀释丹香冠心注射液(上海通用)IonI1静脉注射时使用50%GS稀释瓜萎皮注射液(上海第一生化)4m1静脉注射时使用25%GS稀释舒血宁注射液(北京双鹤)5m1生脉注射液(雅安三九)IOm1参麦注射液(河北神威)10m1蟾酥注射液(江苏浦金)2m1华蟾素注射液(华润金蟾)5m1大株红景天注射液(通化玉圣)10m103溶媒:5%GS或10%GS香丹注射液(正大青春宝)IOm1鱼腥草注射液(湖南正清)2m1路路通注射液(东北虎制药)10m1:250mg 04溶媒:NS血必净注射液(天津红日)IOm1灯盏细辛注射液(云南生物谷)10m1银杏二格内酯葡胺注射液(江苏康缘)5m1复方苦参注射液(山西振东)5m1鸦胆子油乳注射液(江苏九旭)10m1注射用红花黄色素(山西德元堂)150mg注射用丹参多酚酸(天津天力士)0.13g二、说明书中有溶媒用量及稀释浓度要求的药物盘点(一)抗肿瘤药物注射用卡瑞利珠单抗(艾瑞卡)200mg溶媒与用量(浓度要求):5%GS∕NS,IOOm1注射用雷替曲塞(正大天晴)2mg溶媒与用量(浓度要求):5%GS∕NS,50"250m1帕博利珠单抗注射液可瑞达IOO i ng:4m1溶媒与用量(浓度要求):5%GS∕NS,最终浓度为1~10πιg∕πι1 重酒石酸长春瑞滨注射液(诺维本)1m1:IOmg5%GS∕NS,20zv50m1注射用阿糖胞昔(赛德萨)100mg:500mg5%GS∕NS,最高浓度为IOOmgM卡隹1注射液(伯尔定)15m1:150mg5%GS∕NS,≥0.5mg∕m1注射用奥沙利柏(乐沙定)50mg5%GS,≥0.2mg∕m1多柔比星脂质体(多美素、立幸)20mg(IOm1)5%GS,剂量V90mg,使用250m15%GS稀释;剂量290mg,使用500m15%GS稀释盐酸伊立替康注射液(开普拓)40m g(2m1)5%GS∕NS,O.12"2.8mg∕m1多西他赛注射液(泰索帝)20mg0.5m15%GS∕NS,250m1,浓度不超过0・74mg∕m1多西他赛注射液(艾素)20mg0.5m15%GS∕NS,浓度不超过0.9mg∕m1利妥昔单抗注射液(美罗华)100mg∕10m15%GS∕NS,1mg/m1紫杉醇注射液(泰素)5m1:30mg5%GS∕NS,5%NGS等,0.3"1.2mg∕m1贝伐利珠单抗注射液(安维汀)IOOmg(4m1)NS,1.4^16.5mg∕m1信迪利单抗注射液(达伯舒)IOOnIg(IOm1)NS,1.5~5mg∕m1甲磺酸艾立布林注射液(海乐卫)2m1:ImgNS,IOOm1特瑞普利单抗注射液(拓益)240mgNS,IOOm1,浓度P3mg∕m1甲氨喋吟注射液IgNS,1mg/m1(鞘内注射)尼妥珠单抗注射液(泰欣生)50mgNS,250m1曲妥珠单抗注射粉针(赫赛汀)440mg(20m1)NS,250m1帕妥珠单抗注射液(帕捷特)420mg(14m1)NS,250m1注射用异环磷酰胺(匹服平)0.5gNS,500"1000m1注射用奈达粕(捷佰舒)IOmgNS,500m1注射用紫杉醇(白蛋白结合型)(克艾力)IOOmg NS,5mg∕m1注射用吉西他滨(健泽)200mgNS,浓度不超过40mg∕III1多西他赛注射液(艾素)60mg:1.5m15%GS∕NS,浓度不超过0.9mg∕m1依托泊昔注射液(齐鲁)5m1:0.IgNS,浓度不超过0.25mg∕m1注射用盐酸多柔比星(山西德普)IOmgNS,2mg∕m1注射用盐酸表柔比星(法玛新)IOmgNS/注射用水,浓度不超过2mg∕m1利巴韦林注射液(广东南国)1m1:0.Ig5%GS∕NS,ImgM注射用阿昔洛韦(湖北荷普)0.25g5%GS∕NS,浓度不超过7g∕1硫酸庆大霉素注射液(辰欣药业)1m1:4万单位40mg;2m1:8万单位80mg5%GS∕NS,药物浓度<0.1%注射用万古霉素(稳可信)0.5g5%GS∕NS,每O.5g至少需要IOOm1注射用阿奇霉素(希舒美)IOmg5%GS∕NS∕乳酸林格氏注射液/5%GNS等,250~500m1,终浓度为1.0~2.Omg/m1注射用两性霉素B(新欧泊)25mg(25万单位)5%GS(pH>4.2),滴注液药物浓度W1o1ng/10Om1注射用氨曲南(海南灵康)0.5g;1g;2g5%或10%GS∕NS∕林格氏注射液,浓度W2%注射用替加环素(泰阁)50mg5%GS∕NS∕乳酸林格氏注射液,最高浓度为1mg∕In1注射用更昔洛韦(赛美维)5OnIg5%GS∕NS∕林格氏液或乳酸林格氏液,滴注浓度<1Omg/m1注射用喷昔洛韦(恒奥普康)0.25gNS,IOOm1注射用醋酸卡泊芬净(科赛斯)50mg;70mg0.9%氯化钠注射液或者乳酸林格氏注射液,终浓度W0.5g∕m1注射用伏立康哇(丽福康、威凡)IOOnIg丽福康;20OnIg威凡5%GS∕NS等,0.5〜5mg∕m1注射用亚胺培南西司他丁钠(泰能、俊特)500mg:500mg5%GS∕NS等,每50OnIg亚胺培南(即Ig本品)需用IoOnI1溶媒稀释注射用头孜他脸(复达欣)Ig5%GS∕NS等,1〜40mg∕m1注射用头泡曲松钠(罗氏芬)Ig无钙静脉注射液,静脉滴注时2g溶于至少40m1无钙静脉注射液(二)其他药物伊班瞬酸注射液(邦罗力)2m1;6m15%GS∕等渗NS,500m1注射用帕米麟酸二钠(博宁)30mg5%GS∕NS,最大浓度W90mg∕500πι1尿多酸肽注射液(喜滴克)IOOm15%GS∕NS,1:1稀释注射用人凝血酶原复合物(康舒宁)300IU5%GS∕NS,50"IOOm1注射用右雷佐生(奥诺先)25OnIg5%GS∕NS,稀释成右雷佐生1.3~5.Omg/m1溶液氢化可的松注射液(醇型)氢化可的松2m1:IOmg 5%GS∕NS,必须用25倍体积的溶媒稀释注射用门冬氨酸鸟氨酸(瑞甘)2.5g5%GS∕10%GS∕NS,浓度不超过2%托烷司琼注射液(欣贝)1m1:5mg5%GS∕NS∕林格氏液,IoOnI1甲磺酸托烷司琼注射液(舒欧亭)2m1:4.48mg 5%GS∕NS∕林格氏液,IoOnI1甲磺酸多拉司琼注射液(立必复)1m1:12.5mg 5%GS∕NS,50m1复方曲肽注射液(吉林天成)2m15%GS∕NS,250~500m1脑昔肌肽注射液(吉林四环)2m15%GS∕NS,250m1注射用乌司他丁(天普洛安)10万单位5%GS∕NS,500m1法舒地尔注射粉针(朗来)35mgGS/NS,50"IOOm1注射用艾司奥美拉嗖钠(耐信)40mgNS,IOOm1兰索拉哇注射粉针(山东罗欣)30mgNS,IOOm1注射用雷贝拉哇(江苏奥赛康)20mgNS,IOOm1泮托拉哇注射粉针(潘妥洛克)40mg奥美拉嗖注射粉针(奥西康)20mg5%GS∕NS,20mg溶于50m1液体;40mg溶于IOonI1液体氯化钾注射液(湖北科伦)10m1:Ig5%GS∕NS等,钾浓度不超过3.4g∕1(45mmo1∕1)注射用福沙匹坦双葡甲胺(坦能)0.15gNS,150m1,终浓度为Img/m1蔗糖铁注射液(南京恒生)5m1NS,InI1最多稀释到20m1的NS中注射用脑蛋白水解物(In)(山西普德)以总氮计60mgNS,250m1注射用英夫利西单抗(类克)IOOmgNS,250m1,浓度0.4〜4mg∕m1左乙拉西坦注射用浓溶液(开浦兰)5m1:500mgNS∕5%GS∕乳酸钠林格液,Ioom1多种微量元素注射液(II)(安达美)IOm1复方氨基酸注射液或葡萄糖注射液,每IOm1至少用500m1溶媒稀释注射用丙氨酰谷氨酰胺(欣坤畅)10g;20g必须与含有氨基酸的输液混合,20g本品用100注射用水溶解,加入至少五体积的载体溶液,混合液最大浓度≤3.5%(三)中药注射剂注射用丹参多酚酸盐(多普赛、百通美)50mg.IOOmg 疏血通注射液(牡丹江友搏)2m15%GS∕NS,250~500m1银杏叶提取物注射液(金纳多)5m1:17.5mgGS/NS,混合比例1:10醒脑静注射液(无锡济煜山禾)10m15%"10%GS∕NS,250"500m1灯盏细辛注射液(云南生物谷)10m1NS,250~500m1复方苦参注射液(岩舒)5m1NS,200m1注射用红花黄色素(山西德元堂)150mgNS,250m1注:(1)以上参考厂家药品说明书;(2)GS:葡萄糖注射液(G1ucose);(3)NS:0.9%氯化钠注射液(Norma1sa1ine)o。
注射用盐酸吡柔比星说明书

注射用盐酸吡柔比星说明书【药品名称】通用名:注射用盐酸吡柔比星英文名:Pirarubicin Hydrochloride For Injection汉语拼音:Zhusheyong Yansuan Biroubixing【成份】本品主要成分及其化学名称为:(8S,10S)-[[3-氨基-2,3,6-三去氧-4-O-(2-四氢吡喃基)-α-L-阿拉伯吡喃糖基]氧]-7,8,9,10-四氢-6,8,11-三羟基-8-羟乙酰基-1-甲氧基-5,12-萘二酮盐酸盐其结构式为:分子式:C32H37NO12·HCl分子量:664.10CAS No.:72496-41-4【性状】本品为橙红色冻干疏松块状物或粉末。
【适应症】对恶性淋巴瘤和急性白血病有较好疗效,对乳腺癌、头颈部癌、胃癌、泌尿系统恶性肿瘤、及卵巢癌、子宫内膜癌、子宫颈癌等有效。
单用THP的有效率分别为20%~70%。
与多种化疗药物如Ara-C、CTX、6-MP、MTX、5-FU、DDP等联合应用抗癌作用增加。
【规格】(1) 10mg(2) 20mg【用法用量】将本品加入5%葡萄糖注射液或注射用水10ml溶解。
可静脉、动脉、膀胱内注射。
静注:一般按体表面积一次25~40mg/m2;动脉给药:如头颈部癌按体表面积一次7~20 mg/m2,一日1次,共用5~7日,亦可每次14~25 mg/m2,每周一次;膀胱内给药:按体表面积一次15~30 mg/m2,稀释为500~1000μg/ml浓度,注入膀胱腔内保留1~2h,每周3次为一疗程,可用2~3疗程。
【不良反应】1. 骨髓抑制为剂量限制性毒性,主要为粒细胞减少,平均最低值在14天,第21 天恢复,贫血及血小板减少少见;2. 心脏毒性低于ADM,急性心脏毒性主要为可逆性心电图变化,如心律失常或非特异性ST-T异常,慢性心脏毒性呈剂量累积性;3. 胃肠道反应:恶心、呕吐、食欲不振、口腔粘膜炎,有时出现腹泻;4. 其它:肝肾功能异常、脱发、皮肤色素沉着等,偶有皮疹。
盐酸多柔比星脂质体说明书

盐酸多柔比星脂质体说明书
【药品名称】盐酸多柔比星脂质体注射液
【成分】盐酸多柔比星。
【性状】本品为无色透明液体。
【适应症】用于治疗化学疗法失败的转移性乳腺癌。
【规格型号】200mg/10mL
【用法用量】成人按体表面积每次1.8mg/m2,每周一次静脉滴注,治疗周期为21天。
治疗前应评估患者心功能和血液学指标。
【注意事项】
1、使用前应先阅读说明书,按照规定用量和方法使用。
2、严格按照医嘱使用本品,不得随意更改用量和方法。
3、本品仅限医院使用。
4、静脉滴注速度应控制在1mg/min以内。
5、使用本品过程中,应密切监测患者的生命体征和心电图,如出现心电图异常或心功能不全等不适症状应立即停止使用。
6、本品不宜在孕妇和哺乳期妇女中使用。
7、儿童患者应慎重使用。
8、使用本品过程中,如出现过敏及其他严重不良反应,应立即停止使用。
【贮藏方法】遮光,密闭,储存于2℃~8℃,避免冻结。
【包装】200mg/10mL
【有效期】24个月
【执行标准】YB20180050
【生产企业】xxxxxxx公司。
注射用盐酸表柔比星说明书

注射用盐酸表柔比星说明书盐酸表柔比星用于治疗白血症恶性淋巴瘤等,具有很多功效,但是一定要在医生的建议下服用。
本文是店铺整理的表柔比星药物说明书,欢迎阅读。
盐酸表柔比星说明书注射用盐酸表柔比星说明书请仔细阅读说明书并在医师指导下使用。
[药品名称]通用名称: 注射用盐酸表柔比星(速溶)商品名称:法玛新®英文名称: Epirubicin Hydrochloride for Injection (Rapid Dissolution)汉语拼音: Zhusheyong Yansuan Biaoroubixing(Surong)[成份]化学名称:(7S:9S)-9-羟乙酰基-4-甲氧基-7,8,9,10-四氢-6,7,9,11-四羟基-7-O-(2,3,6-三去氧-3-氨基-α-L-阿拉伯吡喃糖基)-5,12-萘二酮盐酸盐分子式: C27H29NO11⋅ HCl分子量:579.98辅料名称:乳糖、对羟基苯甲酸甲酯[性状]本品为鲜红色或橙红色的疏松块状物,有引湿性。
[适应症]治疗恶性淋巴瘤、乳腺癌、肺癌、软组织肉瘤、食道癌、胃癌、肝癌、胰腺癌、黑色素瘤、结肠直肠癌、卵巢癌、多发性骨髓瘤、白血病。
膀胱内给药有助于浅表性膀胱癌、原位癌的治疗和预防其经尿道切除术后的复发。
[规格](1)10mg; (2)50mg;(按 C27H29NO11 HCl 计)[用法用量]常规剂量:表柔比星单独用药时,成人剂量为按体表面积一次60~120mg/m2,当表柔比星用来辅助治疗腋下淋巴阳性的乳腺癌患者联合化疗时,推荐的起始剂量为100~120mg/m2静脉注射,每个疗程的总起始剂量可以一次单独给药或者连续2-3天分次给药。
根据患者血象可间隔21天重复使用。
优化剂量:高剂量可用于治疗肺癌和乳腺癌。
单独用药时,成人推荐起始剂量为按体表面积一次最高可达135mg/m2,在每疗程的第1天一次给药或在每疗程的第1、2、3天分次给药,3-4周一次。
注射用盐酸表柔比星说明书20140213(法玛新)

15%)药量应减少 75%; (2)中度肾功能受损患者无需减少剂量,因为仅少量的药物经肾脏排出。表柔 比星和其它细胞毒药物一样,因肿瘤细胞的迅速崩解而引起高尿酸血症。应检 查血尿酸水平,通过药物控制此现象的发生;另外,在用药 1~2 天内可出现尿 液红染; 3. 关于骨髓抑制 可引起白细胞及血小板减少,应定期进行血液学监测。 4. 关于给药说明 (1)静脉给药,用注射用生理盐水或者注射用水稀释,使其终浓度不超过 2mg/ml; (2)建议先注入生理盐水检查输液管通畅性及注射针头确实在静脉之后,再经 此通畅的输液管给药。以此减少药物外溢的危险,并确保给药后静脉用盐水冲 洗; (3)表柔比星注射时溢出静脉会造成组织的严重损伤甚至坏死。小静脉注射或 反复注射同一血管会造成静脉硬化。建议以中心静脉输注较好; (4)不可肌肉注射和鞘内注射。 5. 继发性白血病 有报道使用蒽环类药物(包括表柔比星)的患者出现了继发性白血病 , 可伴或 不伴白血病前期症状。下列情况下出现继发性白血病更为常见:当与作用机制 为破坏 DNA 结构的抗癌药合用时;或患者既往多次使用细胞毒药物治疗;或蒽 环类治疗剂量有所提升时。此类白血病的潜伏期一般为 1~3 年。 6. 对生殖系统的影响 表柔比星能破坏精子染色体,正在接受表柔比星治疗的男性患者应采取有效的 避孕方法。表柔比星可能引起绝经前妇女闭经或绝经期提前。建议育龄妇女在 治疗期间应避免妊娠,并采取有效避孕方式。 7. 免疫抑制效应/增加对感染易感性 对于接受化疗药物包括表柔比星而导致免疫妥协的患者接种活疫苗或者减毒活 疫苗可能会产生严重甚至致命的感染。正在接受表柔比星的患者应该避免接种 活疫苗。可以接种死疫苗或者灭活疫苗,但是对这些疫苗的免疫应答可能会降 低。
注射用盐酸表柔比星制剂的制备方法及制剂[发明专利]
![注射用盐酸表柔比星制剂的制备方法及制剂[发明专利]](https://img.taocdn.com/s3/m/95f8933203020740be1e650e52ea551811a6c95f.png)
(10)申请公布号 CN 102614118 A(43)申请公布日 2012.08.01C N 102614118 A*CN102614118A*(21)申请号 201210069425.9(22)申请日 2012.03.15A61K 9/08(2006.01)A61K 31/704(2006.01)A61P 31/00(2006.01)A61P 35/00(2006.01)(71)申请人北京协和药厂地址102600 北京市大兴区黄村镇兴业北路北京协和药厂(72)发明人蔡丽芬 吕昭云 潘显道 何其林(74)专利代理机构北京天悦专利代理事务所(普通合伙) 11311代理人田明王瑛(54)发明名称注射用盐酸表柔比星制剂的制备方法及制剂(57)摘要本发明涉及注射用盐酸表柔比星制剂的制备方法,包括配制盐酸表柔比星水溶液、除菌过滤、灌装以及冻干步骤,在配制盐酸表柔比星水溶液时,采用酸性pH 调节剂调节盐酸表柔比星水溶液的pH 值为3.2~4.5,并在40℃~80℃下加热保温30分钟~120分钟。
本发明还提供了采用上述制备方法制成的注射用盐酸表柔比星制剂。
本发明提供的注射用盐酸表柔比星制剂的制备方法,其工艺简单,易于操作,且采用本发明方法制得的盐酸表柔比星产品中,二聚体杂质大体上小于0.2%,总杂质不超过1%,产品质量大大优于药典单个杂质不超过0.8%、总杂质不超过2.5%的规定,显著提高了产品质量及安全性。
(51)Int.Cl.权利要求书1页 说明书9页 附图3页(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书 1 页 说明书 9 页 附图 3 页1/1页1.注射用盐酸表柔比星制剂的制备方法,包括配制盐酸表柔比星水溶液、除菌过滤、灌装以及冻干步骤,其特征在于:在配制盐酸表柔比星水溶液时,采用酸性pH 调节剂调节盐酸表柔比星水溶液的pH 值为3.2~4.5,并在40℃~80℃下加热保温30分钟~120分钟。
盐酸多柔比星脂质体-详细说明书与重点

盐酸多柔比星脂质体英文名称:Doxorubicin Hydrochloride Liposome Injection【成份】活性成份为盐酸多柔比星,是从一种波塞链霉菌表灰变种培养液中提取得到的蒽环类细胞毒性抗生素。
【性状】●一种脂质体制剂,系将盐酸多柔比星包封于聚乙二醇化(PEG化)的,表面结合有甲氧基聚乙二醇(MPEG)的脂质体中,可以保护脂质体免受单核巨噬细胞系统(MPS)识别,从而延长其在血液循环中的时间。
●为无菌、半透明红色混悬液,每瓶10ml,含盐酸多柔比星2mg/ml,是用于单剂量静脉滴注的浓缩液。
【适应症】可用于低CD4(<200CD4淋巴细胞/mm3)及有广泛皮肤粘膜内脏疾病的与艾滋病相关的卡波氏肉瘤(AIDS-KS)病人。
可用作全身化疗药物,或者用作治疗病情有进展的AIDS-KS病人的二线化疗药物,也可用于不能耐受下列两种以上药物联合化疗的病人:长春新碱、博莱霉素和多柔比星(或其他蒽环类抗生素)。
脂质体多柔比星在国外还被批准用于乳腺癌、卵巢癌和多发性骨髓瘤等恶性肿瘤。
【用法用量】应为每2-3周静脉内给药20mg/m2,给药间隔不宜少于10天,因为不能排除药物蓄积和毒性增强的可能。
病人应持续治疗2-3个月以产生疗效。
为保持一定的疗效,在需要时继续给药。
用250毫升5%葡萄糖注射液稀释,静脉滴注30分钟以上。
禁止大剂量注射或给用未经稀释的药液。
建议滴注管与5%葡萄糖滴注管相连接以进一步稀释并限度地减少血栓形成和外渗危险。
禁用于肌肉和皮下注射。
肝功能不全病人:对少数肝功能不全病人(胆红素值达4mg/dl)给予20mg/m2,血浆清除率和清除半衰期未见变化。
然而在取得进一步的经验之前,根据以往盐酸多柔比星的使用经验,对于肝功能不全的病人的给药量要减少。
建议当胆红素高于以下数值时考虑减少用量:血清胆红素1.2-3.0mg/dl,用常用量的;大于3mg/dl时用常用量的。
肾功能不全病人:由于多柔比星由肝脏代谢和经胆汁排泄,故使用时剂量不需作调整。
法玛新

【药品名称】注射用盐酸表阿霉素【曾用名】注射用盐酸表柔吡星【英文名】Epirubicin Hydrochloride For Injection【商品名】法玛新【汉语拼音】Zhusheyong Yansuan Biao’ameisu【化学名】(7S:9S)-9-羟乙酰基-4-甲氧基-7,8,9,10-四氢-6,7,9,11-四羟基-7-O-(2,3,6-三去氧-3-氨基α-L-阿拉伯吡喃糖基)-5,12-萘二酮盐酸盐【分子式】C27H29NO11·HCl【分子量】579.98【性状】本品为微带橙红色的疏松块状物。
【药理、毒理】4'位置上的羟基由顺位变为反位。
为一细胞周期非特异性药物,其主要作用部位是细胞核。
本品的作用机制与其能与DNA结合有关。
体外培养的细胞加入本品可迅速透入胞内,进入细胞核与DNA结合,从而抑制核酸的合成和有丝分裂。
已证实表阿霉素具有广谱的抗实验性肿瘤的作用,对拓扑异构酶也有抑制作用。
疗效与阿霉素相等或略高,而毒性尤其是心脏毒性低于阿霉素。
【药代动力学】体内代谢和排泄较阿霉素快,平均血浆半衰期约40小时,主要在肝脏代谢,经胆汁排泄。
48小时内,9~10%的给药量由尿排出,4天内,40%的给药量由胆汁排出,该药不通过血脑屏障。
对有肝转移和肝功能受损的病人,该药在血浆中的浓度维持时间较长,故应适当减小剂量。
肾功能正常与否对本品的药代动力学特性影响不大。
【适应症】用于治疗白血病,恶性淋巴瘤,多发性骨髓瘤,乳腺癌、肺癌、软组织肉瘤、胃癌、肝癌、结肠直肠癌、卵巢癌等。
【用法与用量】表阿霉素单独用药时,成人剂量为按体表面积一次60~90mg/m2,联合化疗时,每次50~60mg/m2静脉注射。
根据病人血象可间隔21天重复使用。
【不良反应】1、与阿霉素相似,但程度较低,尤其是心脏毒性和骨髓抑制毒性;2、其它不良反应有:脱发,60~90%的病例可发生,一般可逆,男性有胡须生长受抑;粘膜炎,用药的第5~10天出现,通常发生在舌侧及舌下粘膜;胃肠功能紊乱,如恶心、呕吐、腹泻;曾有报道偶有发热、寒颤、寻麻疹、色素沉着、关节疼痛。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注射用盐酸表柔比星说明书【药品名称】通用名称: 注射用盐酸表柔比星(速溶)商品名称:法玛新®英文名称: Epirubicin Hydrochloride for Injection (Rapid Dissolution)汉语拼音: Zhusheyong Yansuan Biaoroubixing(Surong)【成份】化学名称:(7S:9S)-9-羟乙酰基-4-甲氧基-7,8,9,10-四氢-6,7,9,11-四羟基-7-O-(2,3,6-三去氧-3-氨基-α-L-阿拉伯吡喃糖基)-5,12-萘二酮盐酸盐化学结构式:分子式:C27H29NO11⋅ HCl分子量:579.98CAS No.:56390-09-1辅料名称:乳糖、对羟基苯甲酸甲酯【性状】本品为鲜红色或橙红色的疏松块状物,有引湿性。
【适应症】治疗恶性淋巴瘤、乳腺癌、肺癌、软组织肉瘤、食道癌、胃癌、肝癌、胰腺癌、黑色素瘤、结肠直肠癌、卵巢癌、多发性骨髓瘤、白血病。
膀胱内给药有助于浅表性膀胱癌、原位癌的治疗和预防其经尿道切除术后的复发。
【规格】10mg【用法用量】常规剂量:表柔比星单独用药时,成人剂量为按体表面积一次60~120mg/m2,当表柔比星用来辅助治疗腋下淋巴阳性的乳腺癌患者联合化疗时,推荐的起始剂量为100~120mg/m2静脉注射,每个疗程的总起始剂量可以一次单独给药或者连续2-3天分次给药。
根据患者血象可间隔21天重复使用。
优化剂量:高剂量可用于治疗肺癌和乳腺癌。
单独用药时,成人推荐起始剂量为按体表面积一次最高可达135mg/m2,在每疗程的第1天一次给药或在每疗程的第1、2、3天分次给药,3-4周一次。
联合化疗时,推荐起始剂量按体表面积最高可达120mg/m2,在每疗程的第1天给药,3-4周一次。
静脉注射给药。
根据患者血象可间隔21天重复使用。
膀胱内给药:表柔比星应用导管灌注并应在膀胱内保持一小时左右。
在灌注期间,患者应时常变换体位,以保证膀胱粘膜能最大面积地接触药物。
为了避免药物被尿液不适当的稀释,应告知患者灌注前12小时不要饮用任何液体。
医生应指导患者在治疗结束时排空尿液。
浅表性膀胱癌,表柔比星50mg溶于25至50mL生理盐水中,每周一次,灌注8次。
对于有局部毒性(化学性膀胱炎)的病例,可将每次剂量减少至30mg,患者也可接受50mg每周一次共4次、然后每月一次共11次的同剂量药物膀胱灌注。
医生可根据患者病情调整给药次数。
【不良反应】1. 与多柔比星相似,但程度较低,尤其是心脏毒性和骨髓抑制毒性;2.其它不良反应有:脱发,60~90%的病例可发生,一般可逆,男性有胡须生长受抑;粘膜炎,用药的第5~10 天出现,通常发生在舌侧及舌下粘膜;胃肠功能紊乱,如恶心、呕吐、腹泻;曾有报道偶有发热、寒颤、荨麻疹、色素沉着、关节疼痛。
【禁忌】1.禁用于因用化疗或放疗而造成明显骨髓抑制的患者;2.已用过大剂量蒽环类药物(如多柔比星或柔红霉素)的患者禁用;3.近期或既往有心脏受损病史的患者禁用。
4.禁用于血尿患者膀胱内灌注。
【注意事项】1. 关于心脏毒性(1)可导致心肌损伤,心力衰竭。
动物实验和短期人体试验表明,表柔比星的心脏毒性比它的同分异构体多柔比星小。
比较性研究表明,表柔比星和多柔比星引起相同程度心功能减退的蓄积剂量之比为2:1。
在表柔比星治疗期间仍应严密监测心功能,以减少发生心力衰竭的危险(这种心力衰竭甚至可以在终止治疗几周后发生,并可能对相应的药物治疗无效);(2)对目前或既往接受纵隔、心包区合并放疗的患者,表柔比星心脏毒性的潜在危险可能增加;(3)在确定表柔比星最大蓄积剂量时,与任何具有潜在心脏毒性药物联合用药时应慎重;(4)在每个疗程前后都应进行心电图检查。
蒽环类,尤其是多柔比星所引起的心肌病,在心电图上表现为QRS 波群持续性低电压、收缩间期的延长超过正常范围(PEP/LVET),以及射血分数减低。
对接受表柔比星治疗的患者,心电监护是非常重要的,可以通过无创伤性的技术如心电图、超声心动图来评估心脏功能。
如有必要,可通过放射性核素血管造影术测量射血分数。
(5)当表柔比星总累积剂量超过900mg/m2 时进展性充血性心力衰竭(CHF)的发生率明显增高,超过该累积剂量的使用需要非常小心。
当表柔比星总累积剂量超过900mg/m2 时有引起原发性心肌病的风险,超过该累积剂量的使用需要非常小心。
发生心脏毒性的风险因素包括活动的或者非活动性的心血管疾病、目前或既往接受过纵膈/心脏周围区域的放射治疗,之前用过其他蒽环类药物或者蒽二酮药物、同时使用其他抑制心肌收缩功能的药物或者具有心脏毒性的药物(例如曲妥珠单抗)。
除非患者的心功能得到严密的检测,否则蒽环类药物包括表柔比星不能与其他具有心脏毒性的药物同时使用。
患者在停止使用其他具有心脏毒性的药物(特别是具有长半衰期的药物例如曲妥珠单抗)之后接受蒽环类药物可能也会增加发生心脏毒性的风险。
曲妥珠单抗的半衰期约为28.5 天并且在血循环中可以持续至24 周。
因此,如果可能,医师应该在停用曲妥珠单抗之后的24 周内避免使用以蒽环类药物为基础的治疗。
如果在该时间之前需要使用蒽环类抗生素,须仔细监测心功能。
2. 关于肝肾功能影响(1)由于表柔比星经肝脏系统排泄,故肝功能不全者应减量,以免蓄积中毒。
中度肝功能受损者(胆红素1.4~3mg/100ml 或BSP 滞留量9~15%),药量应减少50%。
重度肝功能受损者(胆红素大于3mg/100ml 或BSP 滞留量大于15%)药量应减少75%;(2)中度肾功能受损患者无需减少剂量,因为仅少量的药物经肾脏排出。
表柔比星和其它细胞毒药物一样,因肿瘤细胞的迅速崩解而引起高尿酸血症。
应检查血尿酸水平,通过药物控制此现象的发生;另外,在用药1~2 天内可出现尿液红染;3. 关于骨髓抑制可引起白细胞及血小板减少,应定期进行血液学监测。
4. 关于给药说明(1)静脉给药,用注射用生理盐水或者注射用水稀释,使其终浓度不超过2mg/ml;(2)建议先注入生理盐水检查输液管通畅性及注射针头确实在静脉之后,再经此通畅的输液管给药。
以此减少药物外溢的危险,并确保给药后静脉用盐水冲洗;(3)表柔比星注射时溢出静脉会造成组织的严重损伤甚至坏死。
小静脉注射或反复注射同一血管会造成静脉硬化。
建议以中心静脉输注较好;(4)不可肌肉注射和鞘内注射。
5. 继发性白血病有报道使用蒽环类药物(包括表柔比星)的患者出现了继发性白血病,可伴或不伴白血病前期症状。
下列情况下出现继发性白血病更为常见:当与作用机制为破坏DNA 结构的抗癌药合用时;或患者既往多次使用细胞毒药物治疗;或蒽环类治疗剂量有所提升时。
此类白血病的潜伏期一般为1~3 年。
6. 对生殖系统的影响表柔比星能破坏精子染色体,正在接受表柔比星治疗的男性患者应采取有效的避孕方法。
表柔比星可能引起绝经前妇女闭经或绝经期提前。
7. 免疫抑制效应/增加对感染易感性对于接受化疗药物包括表柔比星而导致免疫妥协的患者接种活疫苗或者减毒活疫苗可能会产生严重甚至致命的感染。
正在接受表柔比星的患者应该避免接种活疫苗。
可以接种死疫苗或者灭活疫苗,但是对这些疫苗的免疫应答可能会降低。
【孕妇及哺乳期妇女用药】尚无定论性资料说明表柔比星对人的生育力是否有不利影响,以及对胎儿是否有致畸作用或其它有害影响。
但有实验资料提示表柔比星与大多数抗肿瘤药物和免疫抑制剂类似,在特定试验条件下,在动物身上表现出致突变性和致癌性。
可以降低胎儿的成活率。
因此在妊娠期间不主张使用本品,哺乳期妇女禁用。
【儿童用药】儿童用药无特殊要求。
【老年用药】老年患者伴心功能减退者宜慎用或减量。
【药物相互作用】1.表柔比星可与其他抗肿瘤药物合用,但表柔比星用量应减低。
联合用药时,不得在同一注射器内使用。
2.表柔比星不可与肝素混合注射,因为二者化学性质不配伍,在一定浓度时会发生沉淀反应。
3.表柔比星主要在肝脏代谢,伴随治疗中任何能引起肝功能改变的药物将会影响表柔比星的代谢、药动、疗效和/或毒性。
4.在表柔比星给药前使用紫杉醇类药物会引起表柔比星药物原形及代谢物血药浓度升高,其中代谢物既没有活性也没有毒性。
当紫杉醇或多西紫杉醇类药物和表柔比星联合用药时,先给表柔比星则对其药代动力学没有影响。
【药物过量】本品总限量为按体表面积550~800mg/m2。
9411 名使用表柔比星治疗的患者,其中大部分为实体瘤晚期患者,当累积剂量达到550mg/m2 时临床上出现明显充血性心力衰竭的患者约为0.9%;当累积剂量达到700mg/m2 时临床上出现充血性心力衰竭的患者约为1.6%;当累积剂量达到900mg/m2 时临床上出现明显充血性心力衰竭的患者约为3.3%。
使用表柔比星辅助治疗乳腺癌,临床试验中最大累积剂量为720 mg/m2。
【临床试验】早期乳腺癌患者的辅助治疗两项随机、开放、多中心临床研究评估了表柔比星100~120 mg/m2 联合环磷酰胺与氟脲嘧啶,辅助治疗腋下淋巴阳性不伴远处转移的乳腺癌患者( II 或III期)。
MA-5研究对表柔比星每个疗程120 mg/m2联合环磷酰胺与氟脲嘧啶(CEF-120)方案进行了评估,该研究将伴有1个或以上淋巴结转移的绝经前和围绝经期女性患者随机分为含有表柔比星的CEF-120组或CMF组。
GFEA-05研究则评估了表柔比星每个疗程100 mg/m2联合氟脲嘧啶与环磷酰胺(FEC-100方案),将绝经前和绝经后女性患者随机分为FEC-100组或较低剂量的FEC-50组。
GFEA-05研究入组患者要求伴有4个或以上淋巴结阳性,或,如果阳性淋巴结为1-3个,则要求患者雌激素和孕酮受体为阴性,而且肿瘤组织学为3级或2级。
这两项研究共入选1281名妇女,肿瘤组织学4级的患者均未入选。
表1列出各治疗方案,试验的主要终点指标为无复发生存时间(包括发生局部或区域复发、远处转移或疾病相关性死亡的时间)。
最后一次随访时记录是否发生对侧乳腺癌、患第二种原发性肿瘤或非乳腺癌导致的死亡。
表1. 早期乳腺癌患者III期临床研究治疗方案1 对于乳腺肿瘤切除术的患者,在化疗完成后继续给予放疗。
2 化疗期间曾用磺胺及喹诺酮预防性抗生素治疗。
3 化疗后全部患者均接受了乳腺放疗。
MA-5研究中,患者中位年龄45岁,肿瘤淋巴结转移1-3个占60%,4个或以上占40%。
GFEA-05研究中,中位年龄51岁,近半数为绝经后患者,肿瘤淋巴结转移1-3个占17%,4个或以上占80%。
每项研究两组的人口统计学及肿瘤特征均相近。
两项研究的疗效学指标为意向性治疗(ITT)患者的无复发生存时间(RFS)及总体生存期(OS),采用Kaplan-Meier方法分析。
