实验室常用技术参数资料1
物理化学实验室建设仪器技术参数

物理化学实验室建设仪器技术参数(1)标的(以下配置仅供参考,可进行优化,且可就部分标段进行投标):设备清单序号仪器设备名称数量参考功能和技术参数1 恒温槽 6 主要功能:适用于生物工程、医药、食品、化工、冶金、石油等领域,为用户提供高精度的、受控的、温度均匀的恒定场源,是研究所、高等院校、工厂实验室、质检部门理想的恒温槽。
参数要求:温度范围:5-150℃,温度波动态:±0.05℃,控温方式:微机温控、PID调节,显示分辨率:0.1℃,内胆容积:15,开口尺寸:215×170×200mm,泵循环方式:内循环,泵流量:10L,功率:1.5KW,外形尺寸:370×340×4802 控温仪 2 主要功能:通过对负载功率的精确控制,从而实现精密控温。
参数要求:电源:220V、50Hz,输出功率:≥1500W,空载功耗:≤5W,控温精度:±1℃,分辨率:±1℃,量程:室温—399℃,感温信号:K型,控温方式:可控硅控制输出3 贝克曼温度计 2主要功能:是精密测量温度差值的温度计参数要求:测量范围:-50—150℃,示值误差:0.001,外形尺寸:300×150mm4 奥氏粘度计 2 主要功能:测定低粘滞性液体的相对粘度参数要求:毛细管内经:≈0.55mm,水流过时间:75-100s,测定球体积:2.5mL,毛细管长:110mm,全长:230mm5 WLS-2数字恒流电源6主要功能:消除了负载导线电阻对电压显示的影响,电路的电压限幅,使得实验更加安全、可靠参数要求:输出电流:0—2A,输出电压:0—15V,电流分辨率:1mA,电压分辨率:0.01V6 SWC-II D数字温度温差仪6主要功能:实现“温度”、“温差”、“定时”三显示。
具有定时读数报警、基温自动选择和基准温差采零等功能。
参数要求:测量范围:-50—350℃,分辨率:0.1℃,稳定度:±0.1℃,线性误差:±0.2℃,传感器:Pt100微型,插入深度:50mm,响应时间:10s7 量热器 6 主要功能:可用来测定热量,比热、潜热(熔解热,汽化热、升华热等)、化学反应热,以及火炉及酒精灯火焰的温度等。
生物实验常用缓冲液和酶的配制

实验室常用技术参数资料一、核酸及蛋白质常用数据1.核苷三磷酸的物理常数2.常用核酸的长度与分子量3.常用核酸蛋白换算数据(1)重量换算1μg=10-6g1pg=10-12g1ng=10-9g 1fg=10-15g(2)分光光度换算:1A260双链DNA=50μg/ml1A260单链DNA=30μg/ml1A260单链RNA=40μg/ml(3)DNA摩尔换算:1μg 100bp DNA=1.52pmol=3.03pmol末端1μg pBR322 DNA=0.36pmol1pmol 1000bp DNA=0.66μg1pmol pBR322=2.8μg1kb双链DNA(钠盐)=6.6×105道尔顿1kb单链DNA(钠盐)=3.3×105道尔顿1kb单链RNA(钠盐)=3.4×105道尔顿(4)蛋白摩尔换算:100pmol分子量100,000蛋白质=10μg100pmol分子量50,000蛋白质=5μg100pmol分子量10,000蛋白质=1μg氨基酸的平均分子量=126.7道尔顿(5)蛋白质/DNA换算:1kb DNA=333 个氨基酸编码容量=3.7×104MW蛋白质10,000MW蛋白质=270bp DNA30,000MW蛋白质=810bp DNA50,000MW蛋白质=1.35kb100,000MW蛋白质=2.7kb DNA4.常用蛋白质分子量标准参照物5.常用DNA分子量标准参照物续上表二、常用缓冲液1.分子克隆常用缓冲液2.磷酸缓冲液(1)25℃下0.1mol/L磷酸钾缓冲液的配制※(2)25℃下0.1mol/L磷酸钠缓冲液的配制※※:用蒸馏水将混合的两种1mol/L贮存液稀释至1000ml,根据Henderson-Hasselbalch方程计算其pH 值:pH=pK’+1g([质子受体]/[质子供体])在此,pK’=6.86(25℃)。
3.电泳缓冲液测序凝胶加样缓冲液98%去离子甲酰胺10mol/L EDTA(pH8.0)0.025%二甲苯青FF0.025%溴酚蓝甲酰胺:许多批号的试剂级甲酰胺,其纯度符合使用要求,无须再进行处理。
实验室设备技术参数

NO.1XLB-300x300x4/0.25MN平板硫化机产品型号:XLB-DQ(柱)300×300×4公称合模力(MN):0.25主电机功率(kw):2.2热板间距(mm):125工作层数:2柱塞行程(mm):250热板单位面积压力(mpa):2.78外型尺寸(mm):1300×975×1500机器重量(kg):约850热板规格:300x300加热方式:电加热橡胶平板硫化机是各种橡胶模型制品及非模型制品的主要成型设备,具有结构简单、压力大、适应性广、效率高等特点,也适用于热固性塑料、泡沫、树脂、胶木、薄金属、建材等模型制品的压制成型。
该机为柱式结构,压制形式为下压(向上)式。
柱塞在工作液压力作用下上升,柱塞下降(即热板开启)靠热板、平台及柱塞自重,驱使工作液流回储油箱,达到下降(即开启)的目的。
NO.2 XK-160电加热开炼机产品型号:XK-160辊筒工作直径(mm):¢160辊筒工作长度(mm):320辊筒最大工作长度(mm):280前滚线速度(m/min):9.29后滚线速度(m/min):12.54前滚转速(r/min):18.51后滚转速(r/min):25辊筒速比:1:1.35辊筒调距范围(mm):0-5一次加料量(kg):1—2外型尺寸(mm): 1080X796X1415电机功率(kw):5.5加热方式:电加热设备重量(kg):约1000XK-160标准型开炼机全称X(S)K-160标准型开放式炼胶(塑)机.本机主要由台形机座.机架.辊筒.传动速比齿轮及齿轮减速电动机等部件组成。
辊筒采用冷硬铸铁制成。
工件表面经磨削加工,具有高硬度和耐磨性。
辊筒内为空心,可通过蒸汽或冷水用来调节辊筒温度。
机器系台式结构将齿轮减速机安装在机座内部,辊筒及机架安置在机上面,使之结构紧凑。
设备图片:注:此图为50T设备,仅供参考。
初中生物(综合)实验室技术规格参数

17
架
滴水棒,方便使用。(每台 2 个 32 孔)
套
4
8
厚,具有 防火、 抗强酸 强碱, 耐高温 等特点 。台面 板的理 化功 能
检测应达到如下要求:1、甲醛释放量必须达到国家环保 E1 级标
准;2、化学 特性试 剂检测 无明显 变化: 硝酸(65%) ,硫酸(98%) 、
磷酸(85%)、乙酸 (99% )等,(投 授 权书及 台面板 国家级 权威部 门出具 的检测 报告) 。● 台
3
6
特点。●结构 :下 部木制 对开门 ,内 设活隔 板;上部玻 璃推拉 门,
内部分多 层活动 隔板, 整体结 构科学 合理、 造型美 观。● 脚垫 :
优质橡胶材料,高度 20mm,有效防止桌身受潮。
●型号规格:1000×500×2000 mm●柜身:主体采用 18mm 厚进口
灰三聚氰胺贴面板,承重板均为 25mm 厚进口灰三聚氰胺贴面板,
JY/T0374-2004《教学实验室设备 电源系统》标准。交流电源。。
实验室教学设备详细的配置及技术参数

教学仪器设备采购清单及技术参数实验室教学设备详细的配置及技术参数(1) 普通化学实验室成套设备技术参数(48座/套、40座/套),以下为1套的配置,表格不规范导致实验桌无法安装,实验桌长度尺寸可经采购人同意后做出合理调整(结算价格不变)。
2、不带水的实验室由中标人采用铝合金压线槽对电线进行隐蔽处理,带水的实验室如果在底楼,则由学校根据中标人提供的图纸开挖地面,中标人进行管线铺设,回填及地面恢复由学校负责。
如果带水的实验室不在底楼,则由中标人采用木盒对管线进行隐蔽处理。
3、为了杜绝不合格产品进入校园,所有产品的质量必须符合技术参数、相关国家标准和行业标准及相关装备标准质量要求,所有电气设备都必须可靠接地,充分满足实验教学需要并确保无安全隐患!4、220V交流电源到桌,电源必须选用带开关的3孔、2孔防水安全插座。
3.物理、化学、生物、小学科学教学仪器采购清单(1)物理仪器2。
1供中小学物理教学实验用。
2.2实验器由(1)、平面镜,(2)、平面镜支架、(3)、三角尺,(4)、像物,(5)、白条(6)、有刻度的直尺组成。
(2)化学仪器所有玻璃仪器必须无气泡,裂痕,底、口水平,无毛刺;计量仪器必须达到国家计量仪器质量标准。
(3) 生物仪器(3)小学科学仪器:4 音乐、体育、美术器材(1)小学音乐器材:(2)中学音乐器材:(3)小学美术器材:(4)中学美术器材:(5)小学体育器材:(6)中学体育器材:(6)卫生器材:(7)功能室用计算机:教学仪器设备样品清单投标人应在开标前1天将以下样品送到招标采购人指定地点,样品在当天早上10点开始安装摆放,投标人应在当天晚上6点之前(过时不候)完成样品的组装及摆放(当天晚上6点之后,所有投标样品全部封存,第二天开标时由专家对样品进行评审),否则将被取消投标或说明:1、实物样品将作为评标、验收的重要依据之一,投标人自行将样品送至指定地点进行统一摆放。
2、样品作为投标文件的组成部分一起同投标文件提交,届时,招标人将派工作人员对其进行编号、登记.3、投标截止时间后,在开标会现场未提供样品或样品不齐、或不按要求提供样品的,将按照有关规定执行。
实验室通风系统--技术参数详解

实验室通风系统--技术参数详解一、实验室通风的基本概念1、通风和通风柜的概念:所谓通风,就是把室内的污浊空气直接或经净化后排至室外把新鲜空气补充进来,从而保持室内的空气条件,以保持卫生标准和满足生产工艺的要求,我们把前者称为排风,后者称为送风。
而通风柜可以简单理解成一个箱体和一个风机,产生于箱体中的气体被风机排出并被安全的排放到大气中。
2、通风的分类:按照动力不同,通风系统可以分为自然通风和机械通风,机械通风又可以分为全面通风和局部通风,全面通风是指在房间内整体的进行通风换气的一种方式,局部通风是指通风的范围控制在有害物质形成比较集中的地方,或是工作人员经常活动的局部地区的通风方式,例如通风柜、万向排烟罩、原子吸收罩等。
3、实验室通风:实验室通风是研究控制实验室有害物质对室内外空气环境的影响和破坏的技术。
二、实验室通风系统的基本组成1、通风末端设备:主要包括通风柜、万向排烟罩、原子吸收罩、吹吸式排风罩等。
2、通风管路系统:主要有风机、风管、风阀、消声器、废气处理塔等。
三、实验室通风设备简介1、通风柜主要尺寸宽度为 1200mm、1500mm、1800mm,深度为 800mm,高度为 2350mm。
通风柜的主要结构为:①柜体:通风柜的柜体可根据使用要求做成钢制、木制、塑料、不锈钢等材料;②台面及衬板:耐腐蚀、耐酸碱、耐高温的各种材质,进行高温或强酸碱操作的内层板要用不锈钢除渣除油静电喷涂环氧树脂粉末;③活动拉门:装在柜体表面上的透明玻璃,使用户远离有害的化学物质和气体,同时使有害气体通向通风柜的内部管道;④导流板:控制气流流经通风柜时的形状,减少空气流入通风柜时产生的由于方式不定造成的回流或涡流,提高使用效率(会对噪声及静压产生影响);⑤集流环:位于通风柜的顶部,将通风柜的气体导向风排放(对通风柜的效率和噪声有着重要的影响);⑥调风阀:通风柜的附属部件,来调节通风柜的排气量以及最佳表面风速;⑦水龙、考克、水杯等配件。
第三章实验室设备清单和主要技术参数第一包实验室电脑及网络设备

第三章实验室设备清单和主要技术参数第二包施工虚拟仿真教学课程软件(房屋构造虚拟仿真课程、建筑施工技术虚拟仿真课程、工程测量虚拟仿真课程、综合虚拟工法楼实训系统)一、房屋构造虚拟仿真课程(数量:1套)(一)实训功能及清单1、包含任务目标、建筑构造、构造剖面、构造解析、题库、图纸。
2、任务目标:了解学习的重点。
3、建筑构造:介绍构件的构造,可放大与缩小,可360°自由旋转。
4、构造剖面:剖面动画展示内部结构。
5、构造解析:配备专业的文字解析,介绍相关知识。
6、题库:系统配备知识点考核,平台自动评分。
7、图纸:学习、了解其平面结构,通过二维图与三维模型对比显示。
(二)模块清单1基础含砖基础、毛石基础、灰土基础、混凝土基础、钢筋混凝土基础、独立基础、条形基础、筏形基础、箱形基础、桩基础、钢筋混凝土锥形基础、钢筋混凝土台阶梯形基础等构造做法的讲解与实操交互练习。
2.墙体含墙体各部分名称、砌块、墙体外保温、空心砌块的形式、砖墙组砌方式、砌缝处理、砌块的竖缝、砌块的排列设计、散水构造、明沟构造、踢脚线、钢筋砖过梁、钢筋混凝土过梁、窗台、附加圈梁、构造柱、砌块墙墙芯柱、加气混凝土砌块隔墙、轻钢龙骨纸面石膏板隔墙、墙面抹灰、外墙贴面砖、防水处理等构造的讲解与实操交互练习。
3.楼板层与地面含楼板层的构成、梁板式楼板、无梁楼板、压型钢板组合楼板、预制实心平板、槽型板、空心板、板缝的处理、叠合楼板、密肋填充块楼板、水泥砂浆楼地面、现浇水磨石楼地面、石板楼地面、空铺式木楼地面、楼地面的防水构造、顶棚构造、阳台的结构布置形式、金属栏杆的形式和构造、阳台排水构造、雨棚构造等构造的讲解与实操交互练习。
4.楼梯含楼梯平面形式、楼梯的组成、踏步细部尺寸、楼梯段、楼梯段及平台净高、楼梯和暗步楼梯、平台板布置方式、踏步面层及防滑处理、无障碍楼梯和台阶形式、栏杆与踏步的连接、梯段转折处扶手处理、台阶尺度、台阶构造示例、坡道的构造做法等构造的讲解与实操交互练习。
实验室设备招标技术参数

实验室设备招标技术参数1.仪器规格和型号:列出所需的设备的具体规格和型号,以确保供应商明确了解招标的具体要求。
例如,如果招标是为了购买一台高性能液相色谱仪(HPLC),则应明确规定所需的HPLC型号、生产厂家等信息。
2.技术要求:明确希望设备能够具备的技术要求,包括设备的性能指标、测量范围、分辨率、精度、准确度等。
例如,对于激光共聚焦显微镜,可以规定要求设备具备最小分辨率为200纳米,最大采样速度为10帧/秒等。
3.功能和特点:描述设备所需的功能和特点。
例如,对于实验室离心机,可以要求设备能够具备不同转速和加速度的选择,具备多种离心模式(如常规离心、温度控制离心、悬浮离心等),并具备自动控制和数据记录功能。
4.安全要求:对于实验室设备,安全性是一个重要考虑因素。
在技术参数中,可以要求设备具备必要的安全措施,如设备应具备过电压、过电流、过温等多重保护功能,应具备安全锁定和警报装置,确保实验过程中的安全。
5.质量和可靠性要求:质量和可靠性是实验室设备的基本要求,可以要求设备能够通过相关的国际或行业标准认证,如ISO9001质量管理体系认证,CE认证等。
同时,可以要求设备具备较长的使用寿命,并提供相应的售后服务支持。
6.数据接口和软件要求:随着科学研究的进步,实验室设备往往需要与其他设备、计算机或网络进行数据交互。
在技术参数中,可以要求设备具备相应的数据接口,如USB、RS232、以太网等,并具备与其他设备或软件的兼容性。
7.能耗要求:能耗是一个重要的环保和成本考虑因素。
可以要求设备具备较低的能耗,如能耗等级达到A级或更高,并提供相应的能源管理功能,如自动关机、待机模式等。
8.售后服务要求:在技术参数中可以明确规定供应商对设备的售后服务要求,如保修期限、维修响应时间、维修服务地点等。
提供专业的技术支持和培训也是一个重要的考虑因素。
实验室设备招标技术参数

实验室设备招标技术参数一、不分光红外线一氧化碳气体分析仪(1台)(一)特点性能1、仪器符合GB/T18204.2-2014《公共场所卫生检验方法》和GB/T9801-88《空气质量一氧化碳的测定非分散红外法》的国家标准;符合JJG635—2011《一氧化碳、二氧化碳红外线气体分析器》的国家计量检定规程.2、仪器的主要技术指标符合国家二级仪表的技术要求,可以取得中国计量科学研究院的二级检定证书.3、仪器内置式调零过滤器、六通阀切换调零与测量,操作简便灵活。
4、仪器可以定制测量范围。
(二)主要技术指标1、测量原理:不分光红外分析法/非分散红外法(NDIR)2、采样方式:内置泵吸式3、测量范围:0.125mg/m3—62.5 mg/m34、分辨率:0。
1×10-65、重复性:≤1% F·S6、零点漂移:≤±2% 满量程/h7、跨度漂移:≤±2%满量程/3h8、线性偏差:≤±2% 满量程9、响应时间:t0~t90≤45S10、预热时间:≤30min11、流量范围:(0。
5—2.0)L/min12、标准配置:主机、采样器、背带、充电电池、充电器、小螺丝刀、技术文件、便携箱。
13、供电电源:交直流两用,220AVC(±10%)或机内充电电池。
二、二氧化碳分析仪(1台)(一)特点性能1、仪器符合GB/T18204.2—2014《公共场所卫生检验方法》和GB/T9801-88《空气质量一氧化碳的测定非分散红外法》的国家标准;符合JJG635—2011《一氧化碳、二氧化碳红外线气体分析器》的国家计量检定规程。
2、仪器的主要技术指标符合国家二级仪表的技术要求,可以取得中国计量科学研究院的二级检定证书。
3、仪器内置式调零过滤器、专用双向阀切换调零与测量、操作简便灵活。
(二)主要技术指标1、测量原理:不分光红外分析法/非分散红外法(NDIR)2、采样方式:内置泵吸式3、测量范围:0~0。
实验室门技术参数

实验室门技术参数1.引言1.1 概述概述实验室门技术参数是指用于描述实验室门的各项性能指标和规格要求的参数。
实验室门作为实验室安全和环境控制的一部分,对于实验室的正常运行和人员的安全起着至关重要的作用。
实验室门技术参数主要包括以下几个方面:防火性能、耐腐蚀性能、噪音阻隔性能、气密性能、防火门等级、密封性能、材料选择、开启方式、门扇构造等。
这些参数直接关系到实验室的安全、环境控制、气流调节等方面的要求,对于确保实验室内的工作环境和实验操作的安全性与有效性具有重要意义。
在编写本文的目的是为了对实验室门技术参数进行全面的了解和阐述,帮助读者更好地理解实验室门的各项性能指标和规格要求。
通过本文的阐述,读者将能够更好地了解实验室门技术参数的作用及其在实验室运行中的重要性,以便在实验室设计、建设和运营中更好地选择和使用实验室门,确保实验室的正常运行和人员的安全。
下面我们将按照大纲的结构,对实验室门技术参数进行全面的介绍和分析,以期能够更好地满足读者对于实验室门技术参数的需求,并为实验室设计、建设和运营提供一定的参考和指导。
文章结构部分的内容应该包括对整篇文章的组织架构进行介绍,让读者了解文章的主要结构和内容安排。
具体可以按照如下方式进行编写:1.2 文章结构本文总共分为引言、正文和结论三个部分组成。
引言部分是对实验室门技术参数的背景和意义进行概述,介绍了实验室门技术参数的重要性以及本文的目的和结构。
正文部分详细介绍了实验室门的技术参数和相关要点。
具体分为三个小节,分别是技术参数1、技术参数2和技术参数3。
在每个小节中,会依次介绍该技术参数的要点1和要点2,对这些要点进行详细的解释和分析。
结论部分对全文进行总结,并对未来的发展进行展望。
在总结部分,将对实验室门技术参数进行综合评述,概括出其主要特点和优势。
在展望部分,将对实验室门技术参数的发展前景和可能的研究方向进行展望。
通过以上结构的安排,本文能够全面而有条理地介绍实验室门的技术参数,使读者对该主题有一个清晰的了解。
实验室技术参数(1)

第一部分实验台及基础设施部分一、全钢实验台、中央台1).台面:采用威盛亚实芯理化板,标准12.7mm厚,抗酸碱和有机试剂,抗刻刮性能好,不易弯曲变形,使用寿命长。
颜色:黑色光面。
台面四周2×2mm 倒角处理,边框加厚至25.4mm,台面拼接处采用环氧树脂胶粘合处理。
2).全钢柜体:采用1.0mm净厚宝钢冷轧钢板,经过数控冲压、数控折弯、酸洗磷化、表层经环氧树脂静电粉末喷涂,喷塑采用环氧树脂(进口阿克粉末)厚度0.05-0.12mm。
要柔韧性好,承重力强,抗冲击力强,长期暴露于空气中也不易生锈,经久耐用, 且防火、防腐蚀性好。
3)柜门、抽屉面板:采用双层钢板折弯制作,中间加加强筋,以增加柜门抽屉抗撞击的能力。
接缝处无焊点,表面平整光滑,每个箱体后挡板均可拆卸,便于维修,并在箱体可调节地脚高度,在底板处设置4个可调口,并配有堵盖。
4).试剂架:试剂架立柱采用1.0mm厚宝钢冷轧钢板经折弯成100*40mm方钢经过化学防锈处理,表面经环氧树脂静电粉末喷涂;活动可拆卸式,可调节层板高度。
要求焊接后表面平整,柔韧性好,承重力强,抗冲击力强,长期暴露于空气中也不易生锈,经久耐用, 且防火、防腐蚀性好。
隔板材质用12mm厚钢化玻璃。
立柱电器部分采用西门子防尘防溅万用插座。
5)拉手:全钢暗式一体拉手6)附属配件a、铰链:采用DTC实验室专用铰链;铰链必须做环氧树脂粉末处理,达到防腐蚀、耐酸碱作用,无噪音,不回弹,强度好,与柜体面水平角度小于15度时,柜门可自动关闭。
b、抽屉滑轨: DTC优质三节承重、静音滑轨。
抽送轻滑无噪音,强度高,长期负重不变形,并有自动归位设计。
c、水嘴:采用台雄实验室专用铜制化验水嘴,表面环氧树脂粉末喷涂。
水阀为瓷质铜芯水阀。
防酸、防碱,耐腐蚀,耐热,防紫外线辐射。
给水管及管接头螺口为1/2″接头。
配设防堵水封防臭装置。
(提供检测报告)d、水槽:采用台雄高密度PP新料,台下托底式安装,壁厚5mm,平整,不变形。
参考技术参数

参考技术参数第一包:虚拟仿真实验教学系统第二包教学实验室家具一、虚拟仿真实验家具(军事预防与防护医学远程模拟训练平台)液晶升降电脑桌41规格:800*500*760板式结构,桌面采用25mm厚E1级三聚氢氨板,柜体及柜门采用16mm厚E1级三聚氢氨板,带明装暗拉手及锁,滑轨采用板式三节轨,截面一律用同色1.5mmPVC封边作防水处理,桌面喷迷彩色漆。
电脑椅41 可旋转,带升降,靠背,滑轮二、教学实验室家具(“两个中心”建设项目)台面 1 规格:7810*750采用12.7mm厚实芯理化板,边缘加厚至25mm边台 3 规格:3000*750*850钢木结构,台面采用12.7mm厚实芯理化板,边缘加厚至25mm,主钢架采用40×60冷轧方钢,柜体采用16mm厚E1级三聚氢氨板,柜门采用木门镶浮化玻璃,活动搁板采用16mm厚E1级三聚氢氨板。
采用PP暗装拉手。
金属可调地脚。
边台12 规格:1000*600*850钢木结构,台面采用12.7mm厚实芯理化板,边缘加厚至25mm,主钢架采用40×60冷轧方钢,柜体采用16mm厚E1级三聚氢氨板,抽屉面板采用16mm厚E1级三聚氢氨板,滑轨采用板式三节轨,截面一律用同色1.5mmPVC封边作防水处理。
采用PP暗装拉手。
金属可调地脚。
第三包:温湿度计等设备 设备名称数量 参考技术参数温湿度计 2温度:测量范围: - 20℃~+ 60℃,分 辨 率: 0.1℃,精度: ±0.8℃ 相对湿度:测量范围:10~95%RH ,分 辨 率:0.1%RH ,精度:±4%RH 采用进口高端温湿度计探头快速响应,测量结果稳定、准确具有读值锁定功能,可锁定测量值体积小、重量轻、便于操作双人会议桌 28 规格:1200*400*760板式结构,桌面采用25mm 厚E1三聚氢氨板,柜体及背板采用16mm 厚E1三聚氢氨板。
实验凳 12 可旋转,带升降,靠背,滑轮。
实验室设备配置清单及技术参数
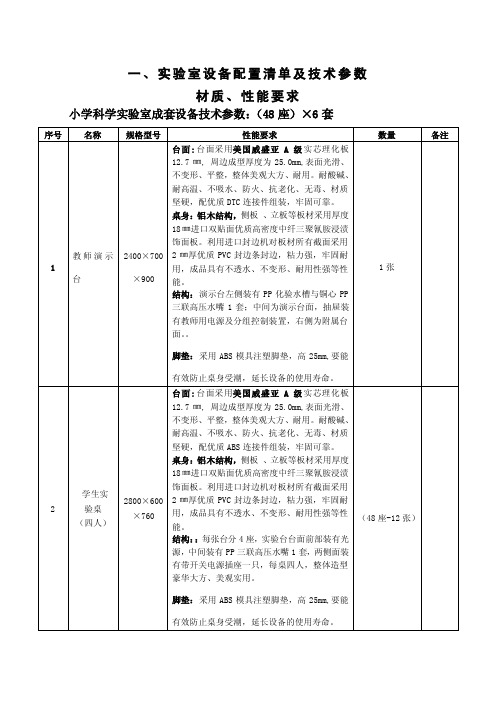
一、实验室设备配置清单及技术参数材质、性能要求小学科学实验室成套设备技术参数:(48座)×6套小学科学实验室学生实验桌(四人):规格:2800×600×760mm学生实验凳:仪器柜、实验准备桌配置清单及技术参数二、实验室设备技术质量标准(一)系统电源:市电220V ±22V 50HZ ; (二)环境温度:-30℃~40℃(室外)(三)相对湿度不低于20%-90%:;(四)工作时间:连续工作时间不低于8小时;(一)教师控制学生实验桌交流220V 的通断 (二)绝缘电阻,常温条件下大于20兆欧,温热条件下大于2兆欧;(三)配置清单中的所有材料及器材产品均达到国家或部级标准(一)电器部分(见技术参数部分内容)(二)桌体部分 (见技术参数部分内容)(三)、电气布线:1、配电箱至教师台预埋Φ32优质PVC(国标)管,内传电线并甩头药品柜1200×600×2200mm 仪器柜1200×600×2200mm2、教师台至学生实验桌预埋Φ25优质PVC(国标)管,内传电线并甩头3、给水布道预埋φ40、φ20㎜ PVC管4、排水布道预埋φ75、φ50㎜ PVC管(四)、验收标准:a)GB8898-1997 电网电源供电有关设备的要求b)Q/DBCA27-2000的验收要求c)JY0001-88《教学仪器产品一般质量要求》三、技术说明(1)、木质贴面和封边部件严密、平整,无脱胶、鼓泡、凹陷、压痕以及表面划伤、麻点、裂痕、崩角和刃口、外表和圆角、倒棱均匀一致(2)、各种配件安装严密、平整、端正、牢固,结全处均无崩茬或松动。
金属配件应做除锈和防腐处理。
结构处螺丝或连接件不允许外露。
(3)、所有台桌边缘须铣成半圆形,并经过后成型处理。
(4)、每一块板无论用在台柜的哪一个部分,该板的6个面(含板与板连接处隐蔽的一条边),必须用优质胶,高温高压封边条作防水封边处理。
一、电脑实验室设备技术参数
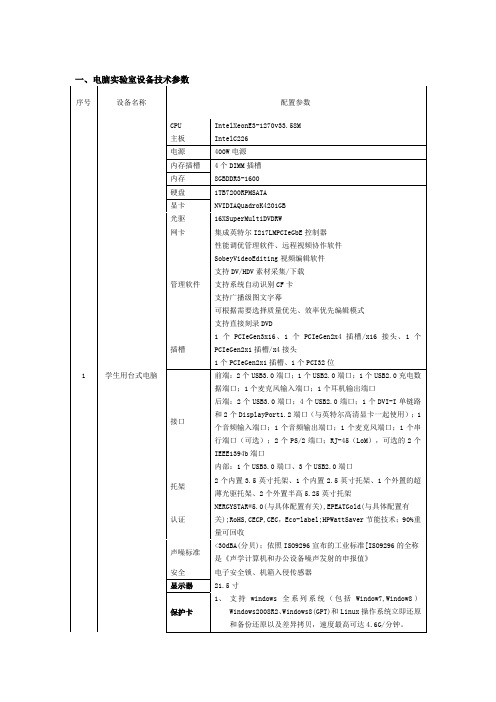
对焦方式类型:TTL辅助影像重合,相位检测自动对焦点:9(全部为十字型,中央为双十字型)测光范围:EV -0.5 - 18(23℃/73°F,ISO 100)对焦模式:单次自动对焦,人工智能伺服自动对焦,人工智能自动对焦,手动对焦(MF)自动对焦辅助光:由内置闪光灯发出的短促连续闪光对焦点数9点对焦范围450mm-无穷远近拍距离450mm-无穷远最大光圈F3.5-F5.6变焦类型变焦环显示屏类型旋转屏,高清屏纠错显示屏尺寸3英寸显示屏像素104万像素TFT液晶屏视野率:约100%角度调节亮度调节:手动(7级)电子水准仪:以1°单位显示水平水准菜单语言25种(含简体中文)实时取景支持长宽比设置:3:2, 4:3, 16:9, 1:1对焦:实时模式,面部优先实时模式(反差检测)快速模式(相差检测)手动对焦(约能放大5倍/10倍)测光模式:使用图像感应器进行评价测光测光范围:EV 0-20(23℃/73°F,使用EF 50mm f/1.4 USM镜头,ISO 100)静音拍摄(模式1和2)显示网格线:两种类型取景器类型光学取景器描述类型:眼平五棱镜视野率:垂直/水平方向约为96%(眼点约为22毫米)放大倍率:约0.95倍(-1m,使用50mm镜头对无限远处对焦)眼点:约22毫米(自目镜透镜中央起-1m)内置屈光度调节:约-3.0-+1.0m(dpt)对焦屏:可更换(另售两种类型),配备Ef-A电子水准仪:可在最大±9°的范围内以±1°单位显示水平水准(仅限于水平拍摄)反光镜:快回型景深预览:支持存储卡类型SD/SDHC/SDXC卡防抖性能不支持纠错短片拍摄短片压缩:MPEG-4 AVC/H.264 可变(平均)比特率音频记录格式:线性PCM记录格式:MOV二、玉雕制作实验室设备技术参数:三、艺术雕塑和白描工作室设备规格及参数:。
实验室通风系统--技术参数详解

实验室通风系统-—技术参数详解一、实验室通风的基本概念1、通风和通风柜的概念:所谓通风,就是把室内的污浊空气直接或经净化后排至室外把新鲜空气补充进来,从而保持室内的空气条件,以保持卫生标准和满足生产工艺的要求,我们把前者称为排风,后者称为送风。
而通风柜可以简单理解成一个箱体和一个风机,产生于箱体中的气体被风机排出并被安全的排放到大气中。
2、通风的分类:按照动力不同,通风系统可以分为自然通风和机械通风,机械通风又可以分为全面通风和局部通风,全面通风是指在房间内整体的进行通风换气的一种方式,局部通风是指通风的范围控制在有害物质形成比较集中的地方,或是工作人员经常活动的局部地区的通风方式,例如通风柜、万向排烟罩、原子吸收罩等.3、实验室通风:实验室通风是研究控制实验室有害物质对室内外空气环境的影响和破坏的技术。
二、实验室通风系统的基本组成1、通风末端设备:主要包括通风柜、万向排烟罩、原子吸收罩、吹吸式排风罩等。
2、通风管路系统:主要有风机、风管、风阀、消声器、废气处理塔等。
三、实验室通风设备简介1、通风柜主要尺寸宽度为 1200mm、1500mm、1800mm,深度为 800mm,高度为 2350mm。
通风柜的主要结构为:①柜体:通风柜的柜体可根据使用要求做成钢制、木制、塑料、不锈钢等材料;②台面及衬板:耐腐蚀、耐酸碱、耐高温的各种材质, 进行高温或强酸碱操作的内层板要用不锈钢除渣除油静电喷涂环氧树脂粉末;③活动拉门:装在柜体表面上的透明玻璃,使用户远离有害的化学物质和气体,同时使有害气体通向通风柜的内部管道;④导流板:控制气流流经通风柜时的形状,减少空气流入通风柜时产生的由于方式不定造成的回流或涡流,提高使用效率(会对噪声及静压产生影响);⑤集流环:位于通风柜的顶部,将通风柜的气体导向风排放(对通风柜的效率和噪声有着重要的影响);⑥调风阀:通风柜的附属部件,来调节通风柜的排气量以及最佳表面风速;⑦水龙、考克、水杯等配件。
一设备名称技术参数及功能要求

一、设备名称、技术参数及功能要求:设备一:多功能酶标仪1、仪器用途:应用于基础科研、临床检验等各个领域,特别是干细胞、血细胞、病毒、细菌等生物的检测,致病性机理和干细胞分化发育机理的研究,以及抗肿瘤药物的开发等领域的应用:1.1结合分析:免疫测定,受体分析1.2功能细胞受体配体结合分析,如GPCR受体分析细胞分析:细胞毒性,细胞存活率,细胞数量测定,细胞增殖,细胞粘附,自然杀伤细胞活性,氧化爆发,钙吸收,报告基因,噬菌作用1.3动力学分析:酶活性,Ca2+和其他离子通道的测量1.4激酶及信号转导通路检测1.5分子相互作用检测双比率检测,如FRET(荧光能量共转移),BRET(生物发光能量共转移),HTRF(均相时间分辨荧光)1.6药物筛选,药理分析,药毒分析,药代动力学分析;1.7分子生物学:杂交,DNA定量,基因表达,PCR产物定量,SNP分析定量:蛋白质,ssDNA,dsDNA,细胞,细菌,细胞毒素毒理学分析;2、技术指标和参数(带*者为必须具备指标):2.1检测模式:能够进行荧光强度(包括FRET等)、时间分辨荧光、吸光度和化学发光(包括BRET,闪光及慢发光等)、均相时间分辨荧光(HTRF等)等多种模式的检测,并通过电脑来控制各个模式的测定。
2.2孔板类型:支持6-1536孔等各种微孔板规格,用户自定义板;2.3具有Z-轴高度自动调整功能(顶读、底读),0.1mm步进;2.4读板方式:顶部和底部读板;支持终点法、动力学、顺序多激发、顺序多发射、比例(ratiometric)、光谱扫描、孔扫描(30x30数据点)等检测方式;2.5光源类型:高能氙闪灯(Xenon flash)2.6检测器:专业型的低噪音光电倍增器(PMT);线性CCD*2.7使用先进的LVF线性渐变光栅技术。
光谱扫描(激发&发射):320-850nm连续可调,0.1nm递增;带宽(激发&发射):8-100nm任意可调;2.8光谱范围2.8.1吸光度:220-1000nm;2.8.2荧光:320-850nm(使用LVF光栅),240-750nm或240-900nm(使用光学滤光片)2.8.3化学发光:320-750nm(使用LVF光栅);240-750nm(使用光学滤光片)*2.9滤光片整合光栅检测模式:光学滤光片可以和高端的光栅整合使用;激发光路使用其中一个,发射光路使用另一个;2.10全波长光谱扫描功能;包括吸光度扫描、顶读和底读的荧光扫描、顶读和底读的化学发光扫描;2.11微孔板混合器可控制时间、力度和方向以线性,圆形或双圆形的轨道运行。
试验室设备技术参数一览表试验室常用设备离心机4台参考

试验室设备技术参数一览表前言试验室是进行科学研究及产品开发的重要场所,其中设备的质量和使用效率对实验和研究结果的准确性有着至关重要的作用。
本文将提供试验室常用设备的技术参数一览表,旨在帮助读者对试验室设备有更深入的了解。
离心机离心机是试验室常用的一种设备,通常用于生物学、化学和医学等领域中的分离与纯化操作。
离心机的技术参数关系到其分离纯化效率,以下是四款常用型号的技术参数对比:型号最高转速(rpm)最大相对离心力(×g)最大容量(ml)控制方式A 15000 21379 50 面板控制B 20000 32658 20 数字控制C 25000 41477 100 面板控制D 30000 54095 15 数字控制从上表可以看出,不同型号离心机的最高转速,最大相对离心力和最大容量存在明显差异,使用时需要根据实际需求进行选择。
恒温水浴恒温水浴是一种可以控制水浴温度的设备,常用于化学、生物、制药和医药等领域。
它不仅可以控制温度,还可以控制搅拌和循环水浴。
以下是两款常见型号恒温水浴的技术参数:型号温度范围(℃)稳定度(℃)升温时间(min)电源A 室温 ~ 100 ±0.1 ≤20220V/50HzB 室温 ~ 99 ±0.2 ≤25220V/50Hz可以看出,两款恒温水浴型号之间在温度范围、稳定度和升温时间上存在一定的差异,使用时需要根据实际需求进行选择。
恒温恒湿箱恒温恒湿箱是可以同时控制温度和湿度的设备,常用于生物学研究、教学实验和医院检验等领域。
以下是两款常见型号恒温恒湿箱的技术参数对比:型号温度范围(℃)湿度范围(%RH)容积(L)工作电压(V)A 10 ~ 50 40 ~ 90 100 AC 220V/50HzB 5 ~ 50 20 ~ 98 250 AC 220V/50Hz可以看出,两款型号恒温恒湿箱在温度和湿度范围上也存在明显差异,使用时需要结合具体实验室实际需求进行选择。
仪器设备技术参数

仪器设备技术参数1.光谱仪
- 波长范围:200-1000nm
- 波长精度:±0.1nm
- 波长分辨率:0.5nm
- 波长重复性:±0.05nm
- 光谱分辨率:2nm
-光谱测量范围:0-3A
2.质谱仪
-质谱质量范围:1-1000m/z
-分辨率:5000
-扫描速度:10,000u/s
-离子源温度范围:50-500℃
-离子源功率:1000W
3.气相色谱仪
- 温度范围:Ambient-450℃
-温度控制精度:±0.1℃
-色谱柱长度:30-60m
-柱温传感器精度:±0.01℃
- 柱流量范围:0.1-10 mL/min
4.分子生物学实验室设备
-恒温培养箱温度范围:5-90℃
- 摇床速度范围:0-300 rpm
- 离心机最高转速:20,000 rpm
-显微镜放大倍率:40-1000x
-PCR机温度范围:4-99℃
5.电子显微镜
- 最高分辨率:0.1nm
-加速电压范围:10-300kV
-最大放大倍率:1,000,000x
-使用镜匣数量:2
-电子束探测器数量:4
这些仪器设备的技术参数对于研究人员和实验室来说非常重要,因为它们可以帮助确定仪器设备是否符合实验需求,并帮助研究人员选择合适的仪器设备进行实验。
这些参数也可以被用来比较不同供应商的仪器设备并进行选择。
此外,了解仪器设备的技术参数还有助于用户正确使用和维护仪器设备,以保证实验的准确性和可靠性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验室常用技术参数资料一、核酸及蛋白质常用数据1.核苷三磷酸的物理常数2.常用核酸的长度与分子量3.常用核酸蛋白换算数据(1)重量换算1μg=10-6g 1pg=10-12g1ng=10-9g 1fg=10-15g(2)分光光度换算:1A双链DNA=50μg/ml260单链DNA=30μg/ml1A260单链RNA=40μg/ml1A260(3)DNA摩尔换算:1μg 100bp DNA=1.52pmol=3.03pmol末端1μg pBR322 DNA=0.36pmol1pmol 1000bp DNA=0.66μg1pmol pBR322=2.8μg1kb双链DNA(钠盐)=6.6×105道尔顿1kb单链DNA(钠盐)=3.3×105道尔顿1kb单链RNA(钠盐)=3.4×105道尔顿(4)蛋白摩尔换算:100pmol分子量100,000蛋白质=10μg100pmol分子量50,000蛋白质=5μg100pmol分子量10,000蛋白质=1μg氨基酸的平均分子量=126.7道尔顿(5)蛋白质/DNA换算:1kb DNA=333 个氨基酸编码容量=3.7×104MW蛋白质10,000MW蛋白质=270bp DNA30,000MW蛋白质=810bp DNA50,000MW蛋白质=1.35kb100,000MW蛋白质=2.7kb DNA4.常用蛋白质分子量标准参照物5.常用DNA分子量标准参照物续上表二、常用缓冲液1.分子克隆常用缓冲液2.磷酸缓冲液(1)25℃下0.1mol/L磷酸钾缓冲液的配制※(2)25℃下0.1mol/L磷酸钠缓冲液的配制※※:用蒸馏水将混合的两种1mol/L贮存液稀释至1000ml,根据Henderson-Hasselbalch方程计算其pH值:pH=pK’+1g([质子受体]/[质子供体])在此,pK’=6.86(25℃)。
3.电泳缓冲液测序凝胶加样缓冲液98%去离子甲酰胺10mol/L EDTA(pH8.0)0.025%二甲苯青FF0.025%溴酚蓝甲酰胺:许多批号的试剂级甲酰胺,其纯度符合使用要求,无须再进行处混合理。
不过,一旦略呈黄色,则应用在磁力搅拌器上将甲酰胺与Dowex XG8床树脂共同搅拌1小时进行去离子处理,并用Whatman 1号滤纸过滤2次,去离子甲酰胺分装成小份,充氮存于-70℃。
常用的电泳缓冲液说明:①TBE溶液长时间存放后会形成沉淀物,为避免这一问题,可在室温下用玻璃瓶保存5×溶液,出现沉淀后则予以废弃。
以片都以1×TBE作为使用液(即1:5稀释浓贮液)进行琼脂糖凝胶电泳。
但0.5×的使用液已具备足够的缓冲容量。
目前几乎所有的琼脂糖胶电泳都以1:10稀释的贮存液作为使用液。
进行聚丙烯酰胺凝胶垂直槽的缓冲液槽较小,故通过缓冲液的电流量通常较大,需要使用1×TBE以提供足够的缓冲容量。
②碱性电泳缓冲液应现用现配。
③Tris-甘氨酸缓冲液用SDS聚丙烯酰胺凝胶电泳。
2×SDS凝胶加样缓冲液:100mmol/L Tris·HCl(6.8)200mmol/L二硫苏糖醇(DTT)4%SDS(电泳级)0.2%溴酚蓝20%甘油不含DTT的2×SDS凝胶加样缓冲液可保存于室温,应在临用前取1mol/L 贮存液现加于上述缓冲液中。
4.凝胶加样缓冲液使用以上凝胶加样缓冲液的目的有三:增大样品密度;以确保DNA均匀进入样品孔内;使样品呈现颜色,从而使加样操作更为便利,含有在电块中能以可预知速率向阳极泳动的染料。
溴酚蓝在琼脂糖中移动的速率约为二甲苯青FF 的2.2倍,而与琼脂糖浓度无关。
以0.5×TBF作电泳液时,溴酚蓝在琼脂糖中的泳动速率约与长300bp的双链线状DNA相同,而二甲苯青FF的泳动则与长4kb的双链线状DNA相同。
在琼脂糖浓度为0.5%~1.4%的范围内,这些对应关系受凝胶浓度变化的影响并不显著。
选用哪一种加样染料纯属个人喜恶。
但是,对于碱性凝胶应当使用溴甲酚绿作为示踪染料,因为在碱性pH条件下其显色较溴酚更蓝为鲜明。
5.各种pH值的Tris缓冲液的配制某一特定pH值的0.05mol/L Tris缓冲液的配制:将50ml 0.1mol/L Tris 碱溶液与上表所示相应体积(单位:ml)的0.1ml/L HCl混合,加水将体积调至100ml(2)温度对50mmol/L Tris·HCl液pH值的影响(6)常用缓冲液的pKa值a:三羟甲基氨基甲烷;b:N-2-羟乙基哌嗪-N’-2-乙磷酸;c:3-(N-吗啉代)丙磺酸;d:N,N’-双(2-乙磺酸)哌嗪;e:2-(N-吗啉代)乙磺酸。
7.温度对常用缓冲液pH的影响三、常用酶的配制1.溶菌酶用水配制成50mg/ml的溶菌酶溶液,分装成小份并保存于-20℃。
每一小份一经使用后便予丢弃。
2.蛋白水解酶类a:链霉蛋白酶是从链球菌(Streptomyces griseus)中分离到的一种丝氨酸酶和酸性蛋白酶的混合物。
b:自消化可消除DNA酶和RNA酶的污染,经自消化的链酶蛋白酶的配制方法如下:把该酶的粉末溶解于10mmol./l Tris·HCl(pH7.5)、10mmol/l NaCl 中,配成20mg/ml浓度,于37℃温育1h。
经消化的链霉蛋白酶分装成小份放在密封试管中,保存-20℃。
c:蛋白酶K是一种枯草蛋白酶类的高活性蛋白酶,从林伯氏白色念球菌(Tritirachium album Limber)中纯化得到。
该酶有两个Ca2+结合位点,它们离酶的活性中心有一定距离,与催化机理并无直接关系。
然而,如果从该酶中除去Ca2+,由于出现远程的结构变化,催化活性将丧失80%左右,但其剩余活性通常已足以降解在一般情况下污染酸制品的蛋白质。
所以,蛋白酶K消化过程中通常加入EDTA(以抑制依赖于Mg2+的核酸酶的作用)。
但是,如果要消化对蛋白酶K具有较强耐性的蛋白,如角蛋白一类,则可能需要使用含有1mmol/l Ca2+而不含EDTA的缓冲液。
在消化完毕后、纯化核酸前要加入EGT(pH8.0)至终浓度为2mmol/L,以鳌合Ca2+。
3.无DNA酶的RNA酶将胰RNA酶(RNA酶A)溶于10mmol/l Tris·HCl(pH7.5)、15mmol/l NaCl中,配成10mg/ml的浓度,于100℃加热15min,缓慢冷却至室温,分装成小份保存于-20℃。
四、常用抗生素溶液a:以水为溶剂的抗生素贮存液通过0.22μm滤器过滤除菌。
以乙醇为溶剂的抗生素溶液无须除菌处理。
所有抗生素溶液均应放于不透光的容器保存。
b:镁离子是四环素的拮抗剂,四环素抗性菌的筛选应使用不含镁盐的培养基(如LB培养基)。
五、常用贮存液的配制1.30%丙烯酰胺溶液【配制方法】将29g丙烯酰胺和1g N,N’-亚甲双丙烯酰胺溶于总体积为60ml的水中。
加热至37℃溶解之,补加水至终体积为100ml。
用Nalgene滤器(0.45μm 孔径)过滤除菌,查证该溶液的pH值应不大于7.0,置棕色瓶中保存于室温。
【注意】丙烯酰胺具有很强的神经毒性并可以通过皮肤吸收,其作用具累积性。
称量丙烯酰胺和亚甲双丙烯酰胺时应戴手套和面具。
可认为聚丙烯酰胺无毒,但也应谨慎操作,因为它还可能会含有少量未聚合材料。
一些价格较低的丙烯酰胺和双丙烯酰胺通常含有一些金属离子,在丙烯酰胺贮存液中加入大约0.2体积的单床混合树脂(MB-1Mallinckrodt),搅拌过夜,然后用Whatman 1号滤纸过滤以纯化之。
在贮存期间,丙烯酰胺和双丙烯酰胺会缓慢转化成丙烯酰和双丙烯酸。
2.40%丙烯酰胺【配制方法】把380g丙烯酰胺(DNA测序级)和20g N,N’-亚甲双丙烯酰胺溶于总体积为600ml的蒸馏水中。
继续按上述配制30%丙烯酰胺溶液的方法处理,但加热溶解后应以蒸馏水补足至终体积为1L。
【注意】见上述配制30%丙烯酰胺的说明,40%丙烯酰胺溶液用于DNA序列测定。
3.放线菌素D溶液【配制方法】把20mg放线菌素D溶解于4ml 100%乙醇中,1:10稀释贮存液,用100%乙醇作空白对照读取OD440值。
放线菌素D(分子量为1255)纯品在水溶液中的摩尔消化系数为21,900,故而1mg/ml的放线菌素D溶液在440nm处的吸光值为0.182,放线菌素D的贮存液应放在包有箔片的试管中,保存于-20℃。
【注意】放线菌素D是致畸剂和致癌剂,配制该溶液时必须戴手套并在通风橱内操作,而不能在开放在实验桌面上进行,谨防吸入药粉或让其接触到眼睛或皮肤。
药厂提供的作治疗用途的放线菌素D制品常含有糖或盐等添加剂。
只要通过测量贮存液在440nm波长处的光吸收确定放线菌素D的浓度,这类制品便可用于抑制自身引导作用。
4.0.1mol/L腺苷三磷酸(ATP)溶液【配制方法】在0.8ml水中溶解60mg ATP,用0.1mol/L NaOH调至pH值至7.0,用蒸馏水定容1ml,分装成小份保存于-70℃5.10mol/L乙酸酰溶液【配制方法】把770g乙酸酰溶解于800ml水中,加水定容至1L后过滤除菌。
6.10%过硫酸铵溶液【配制方法】把1g过硫酸铵溶解于终量为10ml的水溶液中,该溶液可在4℃保存数周。
7.BCIP溶液【配制方法】把0.5g的5-溴-4-氯-3-吲哚磷酸二钠盐(BCIP)溶解于10ml 100%的二甲基甲酰胺中,保存于4℃8.2×BES缓冲盐溶液【配制方法】用总体积90ml的蒸馏水溶解1.07g盐溶液BES[N,N-双(2-羟乙基)-2-氨基乙磺酸]、1.6g NaCl和0.027g Na2HPO4,室温下用HCl调节该溶液的pH值至6.96、然后加入蒸馏水定容至100ml,用0.22μm滤器过滤除菌,分装成小份,保存于-20℃。
9.1mol/L CaCl2溶液【配制方法】在200ml蒸馏水中溶解54g CaCl2·6H2O,用0.22μm滤器过滤除菌,分装成10ml小份贮存于-20℃。
【注意】制备感受态细胞时,取出一小份解冻并用蒸馏水稀释至100ml,用Nalgene 滤器(0.45μm孔径)过滤除菌,然后骤冷至0℃。
10.2.5mol/L CaCl2溶液【配制方法】在20ml蒸馏水中溶解13.5g CaCl2·6H2O,用0.22μm滤器过滤除菌,分装成1ml小份贮存于-20℃。
11.1mol/L二硫苏糖醇(DTT)溶液【配制方法】用20ml 0.01mol/L乙酸钠溶液(pH5.2)溶解3.09g DTT,过滤除菌后分装成1ml小份贮存于-20℃。
【注意】DTT或含有DTT的溶液不能进行高压处理。
