邻菲罗啉分光光度法测定水样中的铁实验指导
邻菲罗啉分光光度法测定铁

邻菲罗啉分光光度法测定铁邻菲罗啉分光光度法是一种常用的测定铁的方法。
邻菲罗啉,也称为邻二氮菲,是一种常用的螯合剂,可以与铁离子形成稳定的络合物。
下面将对这种方法进行详细的介绍。
一、实验原理邻菲罗啉分光光度法是一种基于络合反应的分光光度法,用于测定铁离子。
邻菲罗啉与铁离子形成稳定的络合物,该络合物的最大吸收波长位于530nm左右,因此可以通过测量该波长下的吸光度来测定铁离子的浓度。
二、实验步骤1.准备试剂和样品:邻菲罗啉溶液、铁标准溶液、缓冲溶液(PH=7)、去离子水、待测样品。
2.校准仪器:使用空白试剂校准仪器,确保仪器处于正常状态。
3.绘制标准曲线:分别取不同浓度的铁标准溶液于比色皿中,加入等体积的邻菲罗啉溶液和缓冲溶液,摇匀后静置片刻,记录各浓度下的吸光度。
以吸光度为纵坐标,铁离子浓度为横坐标绘制标准曲线。
4.测定样品:取适量待测样品于比色皿中,加入等体积的邻菲罗啉溶液和缓冲溶液,摇匀后静置片刻,测量吸光度。
5.计算结果:根据标准曲线计算待测样品中铁离子的浓度。
三、实验结果与分析1.结果记录:记录实验过程中各浓度下的吸光度和待测样品中铁离子的浓度。
2.结果分析:通过对比标准曲线和样品的吸光度值,可以得出待测样品中铁离子的浓度。
如果需要进一步分析,可以对实验数据进行处理和分析,例如计算相对误差、变异系数等指标,以评估实验结果的准确性和可靠性。
四、实验注意事项1.实验过程中要注意安全,避免直接接触皮肤或吸入粉尘。
2.试剂和样品应当存放在棕色瓶中,避免阳光直射和长时间暴露在空气中。
3.在绘制标准曲线时,要使用相同浓度的缓冲溶液和邻菲罗啉溶液,以确保实验条件的一致性。
4.在测定样品时,要保证样品的均匀性和稳定性,避免出现误差。
5.在计算结果时,要根据标准曲线进行线性回归分析,以得出准确的浓度值。
五、实验结论通过邻菲罗啉分光光度法测定铁离子的实验,可以得出待测样品中铁离子的浓度。
该方法具有操作简便、灵敏度高、准确度高等优点,适用于测定水中、土壤中或生物样品中的铁离子浓度。
邻菲罗啉分光光度法测定循环水中的铁含量

邻菲罗啉分光光度法测定循环水中的铁含量(0.02—20.0 mg/l)一、分析原理:用抗坏血酸将试样中的三价铁离子还原成二价铁离子,在PH 值2.5—9时,二价铁离子可与邻菲罗啉生成橘红络合物,在最大吸收波长510nm 处,用分光光度计测其吸光度。
二、试剂和材料:1.H2SO42.NH4Fe(SO4)·12H2O3.H2SO4,1+35溶液4.氨水,1+3溶液5.乙酸—乙酸钠缓冲溶液,PH=4.56.抗坏血酸,20.0g/L。
溶解10.0g抗坏血酸于200mL水中,加入0.2g EDTA及8.0mL甲酸,用水稀释至500mL,混匀,贮存于棕色瓶中(有效期一个月)。
7.邻菲罗啉,2.0g/L8.过硫酸钾,4.0g/L。
溶解4.0g过硫酸钾于水中并黧至100ml,室温下贮存于棕色瓶中,此溶液可稳定放置14天。
9.铁贮备溶液,1ml含有0.100mg铁。
10.铁标准溶液,1ml含有0.010mg铁。
取浓度为1ml含有0.100mg铁的铁贮备溶液稀释至10倍。
只限当日使用。
三、仪器和设备分光光度计,具有3cm比色皿。
四、测定步骤:1.工作曲线的绘制:分别取0.00、1.00 ml、2.00 ml、4.00 ml、6.00 ml、8.00 ml、10.00 ml含铁0.010mg/ml的铁标准溶液于七个100ml容量瓶中,加水至约40ml,加0.50ml 1+35 H2SO4溶液调PH值接近2,加3.0 ml 20.0g/L抗坏血酸溶液、10.0 ml PH值为4.5的乙酸—乙酸钠缓冲溶液、5.0ml 2.0g/L邻菲罗啉溶液。
用水稀释至刻度,摇匀。
室温下放置15分钟,用分光光度计于510nm处,以试剂空白调零测吸光度。
以测得的吸光度为纵坐标,相对应的二价铁离子含量(㎍)为横坐标,绘制工作曲线。
2.测定:1)总铁的测定:a)试样的分解:取5取5.0—50.0ml试验溶液于100ml锥形瓶中,(体积不足50.0ml的补水至50.0ml),加1.0ml (1+35)硫酸溶液,加5.0ml过硫酸钾溶液,置于电炉上,缓慢煮沸15分钟,保持体积不低于20ml,取下冷却至室温,用氨水或(1+35)硫酸调PH值接近2,备用。
水中铁的测定

水中铁的测定-12008-10-10 11:40邻菲罗啉分光光度法1.方法原理亚铁在PH3-9之间的溶液中与邻菲罗啉生成稳定的橙红色络合物〖(C12H8N2)3Fe〗,其反应式为:此络合物在避光时可稳定半年。
测量波长为510nm,其摩尔吸光系数为1.1x104.若用还原(如盐酸羟胺)将高铁离子还原,则本法可测定高铁离子及总铁含量.2.干扰及消除强氧化剂,氰化物,亚硝酸盐,焦磷酸盐,偏聚磷酸盐及某些重金属离子会干扰测定,经过加酸煮沸,可将氰化物及亚硝酸盐除去,并使焦磷酸,偏聚磷酸盐转化为正磷酸盐以减轻干扰,加入盐酸羟胺则可消除强氧化剂的影响.邻菲罗啉能与某些金属离子形成有色络合物而干扰测定.但在乙酸-乙酸胺的缓冲溶液中,不大于铁浓度10倍的铜,锌,钴,铬及小于2mg/L的镍,不干扰测定,当浓度再高时,可加入过量显色剂予以消除.汞,隔,银等能与邻沸罗啉形成沉淀,若浓度低时,可加过量邻沸罗啉来消除;浓度高时,可将沉淀过滤除去.水样有底色,可用不加邻菲罗啉的试液作参比,对水样的底色进行校正.3.方法适用范围此法适用于一般环境水和废水中铁的监测,最低检出浓度为0.03mg/L,测定上限为5.00mg/L的水样,可适当稀释后再按本方法进行测定.4.仪器分光光度计,10mm比色皿.5.试剂5.1铁标准储备液:准确称取0.7020g硫酸亚铁铵[(NH4)2Fe(SO4)2.6H2O],溶于1+1硫酸50mL中,转移至1000mL容量瓶中,加水至标线,摇匀.此溶液每毫升含铁100?g.5.2铁标准使用液:准确移取标准储备液25.00mL置100mL容量瓶中,加水至标线,摇匀.此溶液每毫升含铁25.0?g.5.31+3盐酸5.4 10%(m/v)盐酸羟胺溶液.5.5缓冲溶液:40g乙酸铵加50mL冰乙酸用水稀释至100mL.5.60.5%(m/v)邻菲罗啉(1,10-phennthroline)溶液,加数滴盐酸帮助溶解.6.步骤6.1标准曲线的绘制依次移取铁标准使用液0,2.00,4.00,6.00,8.00,10.0mL置150mL锥形瓶中,加入蒸馏水至50.0mL,再加1+3盐酸1mL,10%(m/v)盐酸羟胺1mL,玻璃珠1~2粒.然后,加热煮沸至溶液剩15mL左右,冷却至室温,定量转移至50mL具塞刻度管中.加一小片刚果红试纸,滴加饱和乙酸钠溶液至试纸刚刚变红,加入5mL缓冲溶液,0.5%(m/v)邻菲罗啉溶液2mL,加水至标线,摇匀.显色15min后,用10mm比色皿,以水为参比,在510nm处测量吸光度,由经过空白校正的吸光度对铁的微克数作图.6.2总铁的测定采样后立即将样品用盐酸酸化至PH为1,分析时取50.0mL混匀水样置150mL锥形瓶中,加1+3盐酸1mL,盐酸羟胺溶液1mL,加热煮沸至体积减少到15mL左右,以保证全部铁的溶解和还原.若仍有沉淀应过滤除去.以下按绘制标准曲线同样操作,测量吸光度并作空白校正.6.3亚铁的测定采样时将2mL盐酸放在一个100mL具塞的水样瓶内,直接将水样注满样品瓶,塞好塞,以防氧化,一直保存到进行显色和测量(最好现场测定或现场显色).分析时只需取适量水样,直接加入缓冲溶液与邻菲罗啉溶液,显色5~10分钟,在510nm处,以水为参比测量吸光度,并作空白校正.6.4可过滤铁的测定在采样现场,用0.45?m滤膜过滤水样,并立刻用盐酸酸化过滤水至PH为1,准确吸取样品50mL置150mL锥形瓶中,以下操作与步骤1相同.铁(Fe,mg/L)=m/v式中:m---由校准曲线查得的铁量(?g);v---水样体积(mL).8.精密度和准确度一个实验室测定铁离子的浓度为0.5,2.5,4.5mg/L的水样,相对标准偏差分别为1.1%,0.44%和0.33%.对于0.5,2.5mg/L浓度的铁溶液按1:1的比例加标进行回收试验,得回收率分别为102.6%和97.4%.9.注意事项9.1各批试剂的铁含量如不相同,每新配一次试液,都需重新绘制校准曲线.9.2含CN-或S2-离子的水样酸化时,必须小心进行,因为会产生有毒气体.9.3若水样含铁量较高,可适当稀释;浓度低时可换用30mm或50mm的比色皿。
实验五邻菲啰啉分光光度法测定水中铁

实验安排实验一、滴定分析基本操作实验内容: 水分析化学第三版P402~405实验二、水中溶解氧的测定实验内容: 水分析化学第三版P417~419实验三、水中化学需氧量的测定(重铬酸钾法-回流法)实验内容: 水分析化学第三版P421~423、补充讲义P2~4实验四水中铁的测定(邻菲啰啉分光光度法)实验内容: 水分析化学第三版P435~439及补充讲义P8~9实验五、水中氨氮的测定(絮凝沉淀法预处理—纳氏试剂光度法)实验内容:水分析化学第三版P445~449及补充讲义P4~8实验六、水中钙、镁含量测定(原子吸收光谱法)实验内容: 水分析化学第三版P458~460及补充讲义P9~12实验七、水中油的测定(红外分光光度法)实验内容:补充讲义P13~16水质分析化学实验补充讲义2015年11月实验三、水中化学需氧量的测定(重铬酸钾法)一、概述化学需氧量(COD),是指在一定条件下,用强氧化剂处理水样时所消耗氧化剂的量,以氧的毫克/升来表示。
化学需氧量反映了水中受还原性物质污染的程度。
水中还原性物质包括有机物、亚硝酸盐、亚铁盐、硫化物等。
水被有机物污染是很普遍的,因此化学需氧量也作为有机物相对含量的指标之一。
水样的化学需氧量,可受加入氧化剂的种类及浓度,反应溶液的酸度、反应温度和时间,以及催化剂的有无而获得不同的结果。
化学需氧量亦是一个条件性指标,必须严格按操作步骤进行。
对于工业废水,我国规定用重铬酸钾法,其测得的值为COD Cr。
1.方法原理在强酸性溶液中,一定量的重铬酸钾氧化水样中还原性物质,过量的重铬酸钾以试亚铁灵作指示剂、用硫酸亚铁铵溶液回滴。
根据消耗的重铬酸钾量算出水样中还原性物质消耗氧的量。
2.干扰及其消除酸性重铬酸钾氧化性很强,可氧化大部分有机物,加入硫酸银作催化剂时,直链脂肪族化合物可完全被氧化,而芳香族有机物却不易被氧化,吡啶不被氧化,挥发性直链脂肪族化合物、苯等有机物存在于蒸气相,不能与氧化剂液体接触,氧化不明显。
实验二十 水中微量铁的测定—邻菲啰啉分光光度法

实验二十水中微量铁的测定—邻菲啰啉分光光度法一、实验目的1.学习如何选择吸光光度分析的实验条件;2.掌握用吸光光度法测定铁的原理及方法;3.掌握分光光度计和吸量管的使用方法。
二、实验原理铁的吸光光度法所用的显色剂较多,有邻二氮菲(又称邻菲啰啉,菲绕林)及其衍生物、磺基水杨酸、硫氰酸盐、5-Br-PADAP等。
其中邻二氮菲分光光度法的灵敏度高,稳定性好,干扰容易消除,因而是目前普遍采用的一种方法。
在pH为2~9的溶液中,Fe2+与邻二氮菲(Phen)生成稳定的橘红色络合物Fe(Phen)32+:其中lgβ3=21.3,摩尔吸光系数ε508=1.1×104 L·mol-1·cm-1。
当铁为+3价时,可用盐酸羟胺还原:Cu2+、Co2+、Ni2+、Cd2+、Hg2+、Mn2+、Zn2+等离子也能与Phen 生成稳定络合物,在少量情况下,不影响Fe2+的测定,量大时可用EDTA隐蔽或预先分离。
吸光光度法的实验条件,如测量波长,溶液酸度、显色剂用量、显色时间、温度、溶剂以及共存离子干扰及其消除等,都是通过实验来确定的。
本实验在测定试样中铁含量之前,先做部分条件试验,以便初学者掌握确定实验条件的方法。
条件试验的简单方法是:变动某实验条件,固定其余条件,测得一系列吸光度值,绘制吸光度-某实验条件的曲线,根据曲线确定某实验条件的适宜值或适宜范围。
三、仪器与药品1.分光光度计,pH计,50mL容量瓶8个(或比色管8支)2.100 μg·mL-1铁标准溶液:准确称取0.8634 g 分析纯 NH4Fe(SO4)2·12H2O于200mL烧杯中,加入20mL 6mol·L-1 HCl溶液和少量水,溶解后转移至1L容量瓶中,稀释至刻度,摇匀。
3.邻二氮菲 1.5 g·L-1。
(新配制);4.盐酸羟胺100 g·L-1(用时配制)。
5.NaAc 1mol·L-1。
邻菲罗啉分光光度法测定铁

邻菲罗啉分光光度法测定铁一、实验目的1、掌握邻菲罗啉分光光度法测定铁的原理和方法;2、学习分光光度法实验条件的选择方法,应用确定的条件测出待测试样中铁的含量;3、熟悉分光光度计的结构原理和使用方法(参阅附录1、2)二、实验原理分光光度法测定铁的理论依据是朗伯-比耳定律:当一束平行单色光通过单一均匀的、非散射的吸光物质溶液时,溶液的吸光度与溶液浓度和液层厚度的乘积成正比。
如果固定比色皿厚度测定有色溶液的吸光度,则溶液的吸光度与浓度之间有简单的线性关系,可根据相对测量的原理,用标准曲线法进行定量分析。
分光光度法的显色反应条件(酸度、显色剂用量、显色时间、显色温度等)和测量条件(测定波长、参比液的选择等)都是通过实验确定的。
用分光光度法测定铁的显色剂,常用的有邻菲罗啉(邻二氮菲)、磺基水杨酸、硫氰酸盐等。
其中邻菲罗啉法灵敏度高,选择性好,络合物十分稳定,故应用甚为广泛。
在pH=3~9的溶液中,邻菲罗啉与Fe2+生成稳定的橙红色络合物:Fe2++3NN [(NN)3Fe]2+该络合物lgβ3=21.3(20˚C),在510nm附近有最大吸收,摩尔吸光系数ε510=1.1×104L · mol-1 · cm-1。
邻菲罗啉与Fe3+也生成3 : 1的淡蓝色络合物,lgβ3=14.1。
因此,在显色前需用盐酸羟胺将Fe3+还原为Fe2+:2Fe3+ + 2NH2OH = 2Fe2+ + N2↑+ 2H2O + 2H+测定时,控制溶液酸度在pH=3~9较适宜,酸度高时,反应速度慢;酸度太低,则Fe2+部分水解,影响测定。
通常在微酸性(pH=5)溶液中显色。
本法选择性很高,相当于含铁量40倍的Sn2+、Al3+、Ca2+、Mg2+、Zn2+、SiO32-,20倍的Cr3+、Mn2+、V(v)、PO43-,5倍的Co2+、Cu2+等均不干扰测定。
三、试剂与仪器1、铁标准溶液(100μg/mL):称取0.8634gNH4Fe(SO4)2· 12H2O(或0.7022g (NH4)2Fe(SO4)2· 6H2O)于洁净的烧杯中,加入100ml 2mol/L的盐酸,溶解后定量转移至1L容量瓶中,加水至刻线,摇匀;2、盐酸羟胺溶液:10%水溶液,两周内有效;3、邻菲罗啉溶液:0.1%水溶液。
邻菲罗啉分光光度法测定铁
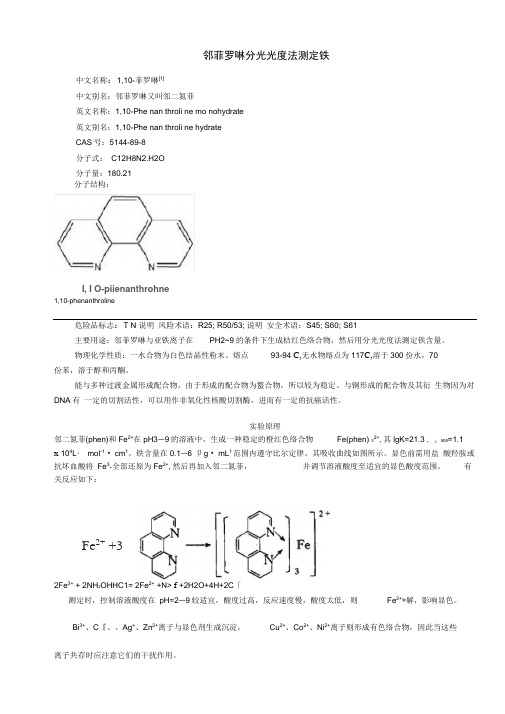
Fe 2+ +3邻菲罗啉分光光度法测定铁中文名称:1,10-菲罗啉[1]中文别名:邻菲罗啉又叫邻二氮菲英文名称:1,10-Phe nan throli ne mo nohydrate 英文别名:1,10-Phe nan throli ne hydrate CAS 号:5144-89-8 分子式: C12H8N2.H2O 分子量:180.21I, I O-piienanthrohne1,10-phenanthroline危险品标志:T N 说明 风险术语:R25; R50/53; 说明 安全术语:S45; S60; S61 主要用途:邻菲罗啉与亚铁离子在PH2~9的条件下生成桔红色络合物,然后用分光光度法测定铁含量。
物理化学性质:一水合物为白色结晶性粉末。
熔点 93-94 C,无水物熔点为117C,溶于300份水,70份苯,溶于醇和丙酮。
能与多种过渡金属形成配合物,由于形成的配合物为螯合物,所以较为稳定。
与铜形成的配合物及其衍 生物因为对DNA 有 一定的切割活性,可以用作非氧化性核酸切割酶,进而有一定的抗癌活性。
实验原理邻二氮菲(phen)和Fe 2+在pH3〜9的溶液中,生成一种稳定的橙红色络合物 Fe(phen) 32+,其lgK=21.3 , £ 508=1.1x 104L ・ mol -1 • cm 1,铁含量在0.1〜6卩g • mL 1范围内遵守比尔定律。
其吸收曲线如图所示。
显色前需用盐 酸羟胺或抗坏血酸将 Fe 3+全部还原为Fe 2+,然后再加入邻二氮菲, 并调节溶液酸度至适宜的显色酸度范围。
有关反应如下:2Fe 3+ + 2NH 2OHHC1= 2Fe 2+ +N> f +2H2O+4H+2C 「测定时,控制溶液酸度在 pH=2〜9较适宜,酸度过高,反应速度慢,酸度太低,则 Fe 2+*解,影响显色。
Bi 3+、C 『、、Ag +、Zn 2+离子与显色剂生成沉淀, Cu 2+、Co 2+、Ni 2+离子则形成有色络合物,因此当这些离子共存时应注意它们的干扰作用。
邻菲罗啉紫外可见分光光度法测定铁含量(详细)

邻菲罗啉紫外可见分光光度法测定铁含量一、仪器1.紫外可见分光光度计(UV-1800PC-DS);配1cm石英比色皿2个(比色皿可以自带);2.容量瓶:100mL1个;50mL11个;3.吸量管:5mL2支;10mL3支;二、试剂1.标准储备溶液:200μg·mL-1铁标准储备溶液。
2.未知液:未知浓度的铁标准溶液。
20μg·mL-13.其他:100g·L-1盐酸羟胺溶液、1g·L-1邻菲罗啉溶液、pH=4.5的醋酸-醋酸钠缓冲溶液。
三、实验操作1.吸收池配套性检查玻璃吸收池在600nm装蒸馏水,以一个吸收池为参比,调节τ为100%,测定其余吸收池的透射比,其偏差应小于0.5%,可配成一套使用,记录其余比色皿的吸光度值作为校正值。
2.标准使用溶液的制备用10mL吸量管移取200 ug/mL 铁的标准储备溶液10.00 mL 于100 mL 容量瓶中,配制成20 ug/mL浓度的标准使用溶液。
3.绘制吸收曲线选择测量波长⑴用10mL吸量管移取20 ug/mL 铁的标准溶液5.00 mL 于50 mL 容量瓶中,⑵用5mL吸量管依次加入然后加入5mL100g·L-1盐酸羟胺溶液,摇匀。
放置2min后,⑶用5mL吸量管加入5mL1g·L-1邻菲罗啉溶液,⑷用10mL吸量管加入10mLpH=4.5的醋酸-醋酸钠缓冲溶液,⑸用蒸馏水稀释至刻度线摇匀。
⑹用1cm吸收池,以试剂空白为参比,在400~600nm间扫描其吸收曲线,并根据吸收曲线的吸光度确定最大吸收波长。
4.标准工作曲线的绘制⑴取50 mL容量瓶6只,分别移取(务必准确移取)20 ug/mL铁标准溶液2.0 mL,4.0 mL,6. 0mL ,8.0 mL ,10.0 mL于5只容量瓶中,不加铁标准溶液醅空白液作参比,⑵各加5ml盐酸羟胺溶液,摇匀经二分钟后,再各加10ml NaAc溶液及5ml 邻菲罗啉溶液,用蒸馏水稀释至刻度线,充分摇匀,待测定。
仪器分析实验-自来水中铁含量测定(邻二氮菲分光光度法)

实验二 自来水中铁含量的测定(邻二氮菲分光光度法)一、目的要求1.掌握邻二氮菲分光光度法测定微量铁的方法原理;2.熟悉绘制吸收曲线的方法,正确选择测定波长;3.学习标准曲线的制作。
二、实验原理邻二氮菲(1,10—二氮杂菲),也称邻菲啰啉,是测定微量铁的高灵敏、高选择性显色剂。
在pH2~9范围内(一般控制在5~6间)Fe 2+与邻二氮菲试剂生成稳定的橙红色配合物Fe(Phen)32+ lgK =21.3,在510nm 下,其摩尔吸光系数为1.1×104 dm 3·cm -1·mol -1 。
Fe 3+也和邻二氮菲生成配合物(呈蓝色)。
因此,在显色之前需用盐酸羟胺或抗坏血酸将全部的Fe 3+还原为Fe 2+。
本方法的选择性很高,相当于含铁量40倍的Sn 、AI 、Ca 、Mg 、Zn 、Si ,20倍的Cr 、Mn 、V 、P 和5倍的Co 、Ni 、Cu 不干扰测定。
本实验采用标准曲线法(又称工作曲线法),即配制一系列浓度由小到大的标准溶液,在确定条件下依次测量各标准溶液的吸光度(A ),以标准溶液的浓度为横坐标,相应的吸光度为纵坐标,在坐标纸上绘制标准曲线。
将未知试样按照与绘制标准曲线相同的操作条件的操作,测定出其吸光度,再从标准曲线上查出该吸光度对应的浓度值就可计算出被测试样中被测物的含量。
三、仪器与试剂1.仪器 722型分光光度计、容量瓶(50mL 、100mL )、刻度吸管(5mL ,10mL )等。
2.试剂(1)铁标准储备溶液准确称取0.176克分析纯硫酸亚铁铵(FeSO 4 ·(NH 4)2 SO 4·6H 2O )于小烧杯中,加水溶解,加入6mol ∕L HCl 溶液5mL ,定量转移至250mL 容量瓶中稀释至刻度,摇匀。
所得溶液每毫升含铁0.100 mg (即100ug/mL )。
(2)0.1%邻二氮菲溶液;2Fe 3++2NH 2OH = 2Fe 2++N2O +2H +Fe 2+ + 3N N Fe2+3(3)10%盐酸羟胺(新配)(4)HAc-NaAc缓冲溶液(pH=4.6)(5)6 mol∕L HCl(6)测铁水样:约10mL 100ug/mL铁标准储备液稀释至250mL。
邻菲罗啉分光光度法测定水样中的铁实验指导图文稿

邻菲罗啉分光光度法测定水样中的铁实验指导集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)实验二邻菲罗啉分光光度法测定水样中的铁——标准曲线法一、实验目的:1.掌握邻菲罗啉分光光度法测定微量铁的原理和方法;2.学会标准曲线的绘制方法及其使用。
二、原理:1.定量分析依据:A=κbc2.有关反应:4Fe3++2NH2OH·HCl=4Fe2++N2O↑+4H++2H2O+2Cl-橙红色配合物3.显色条件pH值控制:pH≈5.0。
显色时间:15min显色温度:室温显色剂及用量:邻二氮菲2.00mL 4.测量条件λmax=510nm参比溶液:试剂空白吸光度范围:0.2-0.8三、仪器:可见分光光度计,1cm 比色皿、100mL 容量瓶 1个,20mL 移液管 1 支,50mL 容量瓶 10 个, 10mL 吸量管 1 支,1mL 吸量管(或移液管) 1 支,5mL 移液管 1 支,2mL 移液管1 支。
四 、试剂:①铁贮备液(100μg/mL ):准确称取0.7020克分析纯硫酸亚铁铵[(NH 4)2Fe (SO 4)2·6H 2O]于100毫升烧怀中(或0.8640g 分析纯的NH 4Fe(SO 4)2·12H 2O ,其摩尔质量为482.18g/mol ),加50毫升1+1 H 2SO 4,完全溶解后,移入1000ml 的容量瓶中,并用水稀释到刻度,摇匀,此溶液中Fe 的质量浓度为 100.0μg/mL 。
(实验室准备好) ② 铁标准溶液(20.00 μg ·mL -1) 移取 100.0μg ·mL -1铁标准溶液20.00mL 于100mL 容量瓶中,并用蒸馏水稀释至标线,摇匀。
(学生自行配制)③ 10%盐酸羟胺水溶液:(用时配制)。
④ 0.5%邻菲罗啉水溶液:配制时加数滴盐酸能助溶液或先用少许酒精溶解,再用水稀释至所需体积。
实验二十 水中微量铁的测定—邻菲啰啉分光光度法

实验二十水中微量铁的测定—邻菲啰啉分光光度法一、实验目的1.学习如何选择吸光光度分析的实验条件;2.掌握用吸光光度法测定铁的原理及方法;3.掌握分光光度计和吸量管的使用方法。
二、实验原理铁的吸光光度法所用的显色剂较多,有邻二氮菲(又称邻菲啰啉,菲绕林)及其衍生物、磺基水杨酸、硫氰酸盐、5-Br-PADAP等。
其中邻二氮菲分光光度法的灵敏度高,稳定性好,干扰容易消除,因而是目前普遍采用的一种方法。
在pH为2~9的溶液中,Fe2+与邻二氮菲(Phen)生成稳定的橘红色络合物Fe(Phen)32+:其中lgβ3=21.3,摩尔吸光系数ε508=1.1×104 L·mol-1·cm-1。
当铁为+3价时,可用盐酸羟胺还原:Cu2+、Co2+、Ni2+、Cd2+、Hg2+、Mn2+、Zn2+等离子也能与Phen 生成稳定络合物,在少量情况下,不影响Fe2+的测定,量大时可用EDTA隐蔽或预先分离。
吸光光度法的实验条件,如测量波长,溶液酸度、显色剂用量、显色时间、温度、溶剂以及共存离子干扰及其消除等,都是通过实验来确定的。
本实验在测定试样中铁含量之前,先做部分条件试验,以便初学者掌握确定实验条件的方法。
条件试验的简单方法是:变动某实验条件,固定其余条件,测得一系列吸光度值,绘制吸光度-某实验条件的曲线,根据曲线确定某实验条件的适宜值或适宜范围。
三、仪器与药品1.分光光度计,pH计,50mL容量瓶8个(或比色管8支)2.100 μg·mL-1铁标准溶液:准确称取0.8634 g 分析纯 NH4Fe(SO4)2·12H2O于200mL烧杯中,加入20mL 6mol·L-1 HCl溶液和少量水,溶解后转移至1L容量瓶中,稀释至刻度,摇匀。
3.邻二氮菲 1.5 g·L-1。
(新配制);4.盐酸羟胺100 g·L-1(用时配制)。
5.NaAc 1mol·L-1。
仪器分析实验邻菲罗啉分光光度法测定铁

Page 11
四、实验步骤:
6.标准曲线的测绘
以步骤1中试剂空白溶液(1号)为参比,用1cm吸收池, 在选定波长下测定2~6号各显色标准溶液的吸光度。 在坐标纸上,以铁的浓度为横坐标,相应的吸光度为 纵坐标,绘制标准曲线。 7.铁含量的测定 试样溶液取20mL按步骤1显色后,在相同条件下测量 吸光度,由标准曲线计算试样中微量铁的质量浓度。
朗伯-比尔定律
A lg 1 T
朗伯-比尔定律的物理意义:当一束平行单色光垂直照射到均 匀、非散射的吸光物质的溶液时,溶液的吸光度与吸光物质的 浓度及液层厚度成正比。
吸光度具有加和性
Page 5
三、仪器和试剂:
(1)0.1 g·L-1铁标准储备液 准确称取0.7020 g NH4Fe(SO4)2·6H2O置于烧杯中,加少量水和20 mL 1:1H2SO4 溶液,溶解后,定量转移到1L容量瓶中,用水稀释至刻度, 摇匀。 (2)10-3 mol·L-1铁标准溶液 可用铁储备液稀释配制。 (3)100 g·L-1盐酸羟胺水溶液 用时现配。 (4)1.5 g·L-1邻二氮菲水溶液 避光保存,溶液颜色变暗时即不 能使用。 (5)1.0 mol·L-1乙酸钠溶液。 (6)0.1 mol·L-1氢氧化钠溶液。
Page 9
四、实验步骤:
4.溶液适宜酸度范围的确定
在9只50 mL容量瓶中各加入2.0 mL10-3 mol·L-1铁标准溶液和 1.0 mL 100 mol·L-1盐酸羟胺溶液,摇匀后放置2 min。各加2 mL 1.5 g·L-1邻二氮菲溶液,然后从滴定管中分别加入0, 2.00,5.00,8.00,10.00,20.00,25.00,30.00,40.00 mL 0.1 mol·L-1NaOH溶液摇匀,以水稀释至刻度,摇匀。用精 密pH试纸测量各溶液的pH。
水中微量铁的测定—邻菲啰啉分光光度法

实验3-1 水中微量铁的测定—邻菲啰啉分光光度法学院/专业/班级:_____________________________________ 姓名:实验台号:_________ 合作者:____________________ 教师评定:____________【实验目的】1. 了解分光光度计的基本构造和使用方法;2. 学习分光光度法测定微量铁的原理及方法;3. 学习用origin等绘图软件绘制吸收曲线及标准工作曲线方法。
【实验原理】【实验仪器及试剂】仪器:分光光度计(厂家及型号:___________________________);1 cm比色皿2个;50 mL容量瓶8个;吸量管;移液管;量筒;废液杯等试剂:铁标准工作溶液:________mg ⋅L -1邻菲啰啉溶液:5 g ⋅L -1(15/85V /V O H CH CH O H 232=) 盐酸羟胺溶液:100 g ⋅L -1 HAc-NaAc 缓冲溶液:pH=4.6【实验步骤】(条件实验中酸度和显色剂用量的选择不做)1. Fe 2+标准系列溶液和待测试样的配制在8个50 mL 容量瓶(编好号码*)中,用吸量管依次加入铁标准工作溶液____、____、____、____、____、____mL 及____mL 待测水样(待测水样平行做2份),然后在所有容量瓶中分别加入1 mL 盐酸羟胺溶液,摇匀后放置1 min ,再分别加入1.5 mL 邻菲啰啉溶液和5 mL HAc-NaAc 缓冲溶液,用水定容摇匀后放置10分钟后测定。
2. Fe 2+-邻菲啰啉络合物吸收曲线的绘制及测定波长的选择以试剂空白(指加入标准工作溶液0.00 mL 的容量瓶,即1号瓶)为参比溶液,用已配好的系列标准溶液(2-6号瓶)中的某一个溶液(选择任意一瓶均可,但是习惯选择系列中次浓的溶液,即5号瓶)为待测液,采用____cm 比色皿,分别测定波长为480、490、500、505、510、515、520、530、550、580 nm 时的吸光度。
邻菲罗啉分光光度法测定水样中的铁实验指导

实验二邻菲罗啉分光光度法测定水样中的铁——标准曲线法一、实验目的:1.掌握邻菲罗啉分光光度法测定微量铁的原理和方法;2.学会标准曲线的绘制方法及其使用。
二、原理:1.定量分析依据:A=κbc2.有关反应:4Fe3++2NH2OH·HCl=4Fe2++N2O↑+4H++2H2O+2Cl-橙红色配合物3.显色条件pH值控制:pH≈5.0。
显色时间:15min显色温度:室温显色剂及用量:邻二氮菲2.00mL4.测量条件λmax=510nm参比溶液:试剂空白吸光度范围:0.2-0.8三、仪器:可见分光光度计,1cm比色皿、100mL 容量瓶1个,20mL 移液管 1 支,50mL 容量瓶10 个,10mL 吸量管 1 支,1mL 吸量管(或移液管)1 支,5mL 移液管 1 支,2mL 移液管1 支。
四、试剂:①铁贮备液(100µg/mL):准确称取0.7020克分析纯硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]于100毫升烧怀中(或0.8640g分析纯的NH4Fe(SO4)2·12H2O,其摩尔质量为482.18g/mol),加50毫升1+1 H2SO4,完全溶解后,移入1000ml的容量瓶中,并用水稀释到刻度,摇匀,此溶液中Fe的质量浓度为100.0µg/mL。
(实验室准备好)②铁标准溶液(20.00 μg·mL-1)移取100.0μg·mL-1铁标准溶液20.00mL于100mL 容量瓶中,并用蒸馏水稀释至标线,摇匀。
(学生自行配制)③10%盐酸羟胺水溶液:(用时配制)。
④0.5%邻菲罗啉水溶液:配制时加数滴盐酸能助溶液或先用少许酒精溶解,再用水稀释至所需体积。
(临用时配制)或(避光保存,两周内有效)。
⑤HAc-NaAc缓冲溶液(pH≈5.0):称取40克纯醋酸铵加到50毫升冰醋酸中,加水溶解后稀释至100毫升。
12五、测定步骤: 1、标准曲线的绘制:(1)分别吸取铁的标准溶液0.00、1.00、2.00、4.00、6.00、8.00、10.00ml 于7支50ml 容量瓶中,加水至刻度;(2)依次分别加入10%盐酸羟胺溶液1ml ,混匀,加入5ml pH ≈5.0缓冲溶液,摇匀,加入0.5%邻菲罗啉溶液2ml ,摇匀,(3)放置15分钟后,在510nm 波长处,用1cm 比色皿,以试剂空白作为参比,测定各溶液的吸光度。
水中铁离子测定实验报告(3篇)

第1篇一、实验目的1. 了解水中铁离子测定的原理和方法;2. 掌握使用邻菲罗啉分光光度法测定水中铁离子的操作步骤;3. 分析实验数据,得出水中铁离子的含量。
二、实验原理水中铁离子主要以Fe2+和Fe3+的形式存在,其中Fe2+为低价态,Fe3+为高价态。
邻菲罗啉分光光度法是一种测定微量铁离子的方法,其原理是亚铁离子(Fe2+)在pH3~9的条件下与邻菲罗啉生成稳定的橙红色络合物。
该络合物的吸光度与铁离子的浓度成正比,根据吸光度可以计算出水中铁离子的含量。
三、实验仪器与试剂1. 仪器:721型分光光度计、1cm比色皿、具塞比色管(50ml)、移液管、吸量管、容量瓶等;2. 试剂:铁贮备液(100g/mL)、铁标准使用液(20g/mL)、0.5%邻菲罗啉水溶液、盐酸、氢氧化钠、pH计等。
四、实验步骤1. 准备工作:将实验仪器和试剂准备好,调节分光光度计至波长510nm;2. 标准曲线绘制:准确移取一定量的铁标准使用液,加入适量盐酸和氢氧化钠,调节pH至3~9,再加入邻菲罗啉水溶液,混匀后静置5分钟,用分光光度计测定吸光度,以铁离子浓度为横坐标,吸光度为纵坐标绘制标准曲线;3. 水样测定:准确移取一定量的水样,加入适量盐酸和氢氧化钠,调节pH至3~9,再加入邻菲罗啉水溶液,混匀后静置5分钟,用分光光度计测定吸光度;4. 数据处理:根据标准曲线和测得的吸光度,计算水样中铁离子的含量。
五、实验结果与分析1. 标准曲线:绘制标准曲线,得到铁离子浓度与吸光度之间的关系;2. 水样测定:根据标准曲线和测得的吸光度,计算水样中铁离子的含量;3. 结果分析:分析实验数据,判断水中铁离子的含量是否符合国家标准。
六、实验结论通过本次实验,掌握了使用邻菲罗啉分光光度法测定水中铁离子的原理和操作步骤。
实验结果表明,该方法可以准确测定水中铁离子的含量,为水质监测提供了技术支持。
七、实验注意事项1. 操作过程中注意避免样品和试剂的污染;2. 严格控制实验条件,如pH值、温度等;3. 选用合适的仪器和试剂,保证实验结果的准确性;4. 实验数据应进行多次重复,以提高实验结果的可靠性。
实验二十四邻菲罗啉分光光度法测定铁

实验二十四邻菲罗啉分光光度法测定铁1 实验目的1.1 进一步了解朗伯-比尔定律的应用。
1.2 学会邻菲罗啉分光光度法测定铁的方法和正确绘制邻菲罗啉-铁的标准曲线。
1.3 了解分光光度计的构造及使用。
2 实验原理邻菲罗啉(又称邻二氮杂菲)是测定微量铁的一种较好试剂,其结构如下:在pH=1.5~9.5的条件下,Fe2+与邻菲罗啉生成很稳定的橙红色的络合物,反应式如下:此络合物的logK稳=21.3,ε=11000。
在显色前,首先用盐酸羟胺把Fe3+还原为Fe2+:4 Fe3++2NH2OH═4 Fe2++N2O+H2O+4H+测定时,控制溶液酸度在pH=2~9较适宜,酸度过高,反应速度慢,酸度太低,则Fe2+水解,影响显色。
Bi3+、Ca2+、Hg2+、Ag+、Zn2+离子与显色剂生成沉淀,Cu2+、Co2+、Ni2+离子则形成有色络合物,因此当这些离子共存时应注意它们的干扰作用。
3 仪器和试剂3.1 可见分光光度计。
3.2 铁盐标准溶液的配制:A液(母液→0.1g·L-1):准确称取0.7020g分析纯硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O] ,溶于(1+1)硫酸50mL,完全溶解后移入1000mL容量瓶中,加去离子水稀释至刻度,摇匀。
B液(0.01g·L-1):用25mL移液管,准确移取A液25.00mL,置于100mL的容量瓶中,加去离子水稀释至刻度,摇匀。
3.3 乙酸-乙酸钠(HAc-NaAc)缓冲溶液(pH=4.6):称取135g分析纯乙酸钠,加入120mL冰乙酸,加水溶解后,稀释至500mL。
3.4 ω=1%的盐酸羟胺水溶液,因不稳定,需临用时配制。
3.5 ω=0.1%的邻菲罗啉水溶液:先用少许乙醇溶解后,用水稀释,新近配制。
3.6 50mL容量瓶7个(先编好1、2、3、4、5、6、7号),10mL移液管(有刻度)1支,5mL移液管(有刻度)4支,5mL量筒1个,500mL烧杯1个,洗瓶1个,洗耳球1个,小滤纸,镜头纸。
水质 铁的测定 邻菲啰啉分光光度法

水质铁的测定邻菲啰啉分光光度法(量程:0.12~5mg/L)1 适用范围本标准适用于地表水、地下水及废水中铁的测定。
方法最低检出浓度为0.03mg/L,测定下限为0.12mg/L,测定上限为5.00mg/L。
对铁离子大于5.00mg/L 的水样,可适当稀释后再按本方法进行测定。
2 原理亚铁离子在pH3~9 之间的溶液中与邻菲啰啉生成稳定的橙红色络合物,其反应式为:此络合物在避光时可稳定保存半年。
测量波长为510nm,其摩尔吸光系数为1.1×10 4 L·mol -1·cm-1。
若用还原剂(如盐酸羟胺)将高铁离子还原,则本法可测高铁离子及总铁含量。
3 试剂本标准所用试剂除另有注明外,均为符合国家标准的分析纯化学试剂;实验用水为新制备的去离子水。
3.1 盐酸(HCl):ρ20=1.18g/mL,优级纯。
3.2 (1+3)盐酸。
3.3 10%(m/V)盐酸羟胺溶液。
3.4 缓冲溶液:40g 乙酸铵加50mL 冰乙酸用水稀释至100mL。
3.5 0.5%(m/V)邻菲啰啉(1,10-phenanthroline)水溶液,加数滴盐酸帮助溶解。
3.6 铁标准贮备液:准确称取0.7020g 硫酸亚铁铵((NH 4 ) 2 Fe(SO 4 ) 2 ·6H 2 O),溶于(1+1)硫酸50mL 中,转移至1000mL容量瓶(A 级)中,加水至标线,摇匀。
此溶液每毫升含100μg 铁。
3.7 铁标准使用液:准确移取铁标准贮备液(3.6)25.00mL 置100mL 容量瓶(A 级)中,加水至标线,摇匀。
此溶液每毫升含25.0μg 铁。
4 仪器分光光度计,10mm 比色皿。
25 干扰的消除强氧化剂、氰化物、亚硝酸盐、焦磷酸盐、偏聚磷酸盐及某些重金属离子会干扰测定。
经过加酸煮沸可将氰化物及亚硝酸盐除去,并使焦磷酸、偏聚磷酸盐转化为正磷酸盐以减轻干扰。
加入盐酸羟胺则可消除强氧化剂的影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
邻菲罗啉分光光度法测定水样中的铁实验指导
TTA standardization office【TTA 5AB- TTAK 08- TTA 2C】
实验二邻菲罗啉分光光度法测定水样中的铁——标准曲线法
一、实验目的:
1.掌握邻菲罗啉分光光度法测定微量铁的原理和方法;
2.学会标准曲线的绘制方法及其使用。
二、原理:
1.定量分析依据:A=κbc
2.有关反应:
4Fe3++2NH2OH·HCl=4Fe2++N2O↑+4H++2H2O+2Cl-
橙红色配合物
3.显色条件
❖pH值控制:pH≈。
❖显色时间:15min
❖显色温度:室温
❖显色剂及用量:邻二氮菲
4.测量条件
➢λmax=510nm
➢参比溶液:试剂空白
吸光度范围:三、仪器:
可见分光光度计,1cm比色皿、100mL 容量瓶 1个,20mL 移液管 1 支,50mL 容量瓶10 个, 10mL 吸量管 1 支,1mL 吸量管(或移液管) 1 支,5mL 移液管 1 支,2mL 移液管1 支。
四、试剂:
①铁贮备液(100μg/mL):准确称取0.7020克分析纯硫酸亚铁铵[(NH4)2Fe(SO4)
·6H2O]于100毫升烧怀中(或0.8640g分析纯的NH4Fe(SO4)2·12H2O,其摩尔质量为2
482.18g/mol),加50毫升1+1 H2SO4,完全溶解后,移入1000ml的容量瓶中,并用水稀释到刻度,摇匀,此溶液中Fe的质量浓度为μg/mL。
(实验室准备好)
②铁标准溶液(μg·mL-1)移取μg·mL-1铁标准溶液于100mL容量瓶中,并用蒸馏水稀释至标线,摇匀。
(学生自行配制)
③ 10%盐酸羟胺水溶液:(用时配制)。
④ %邻菲罗啉水溶液:配制时加数滴盐酸能助溶液或先用少许酒精溶解,再用水稀释至所需体积。
(临用时配制)或(避光保存,两周内有效)。
⑤ HAc-NaAc缓冲溶液(pH≈):称取40克纯醋酸铵加到50毫升冰醋酸中,加水溶解后稀释至100毫升。
五、测定步骤:
1、标准曲线的绘制:
(1)分别吸取铁的标准溶液、、、、、、于7支50ml容量瓶中,加水至刻度;(2)依次分别加入10%盐酸羟胺溶液1ml,混匀,加入5ml pH≈缓冲溶液,摇匀,加入%邻菲罗啉溶液2ml,摇匀,
(3)放置15分钟后,在510nm波长处,用1cm比色皿,以试剂空白作为参比,测定各溶液的吸光度。
附721型分光光度计操作过程:
❖ 1.检查仪器各调节钮的起始位置是否正确,选择波长,并将灵敏度档置第1档❖ 2.接通电源,打开开关
❖3盖上比色皿暗盒盖,用调“100%”调节器使电表指针处于透过率“100%”位,打开比色皿暗盒盖,用调“0”调节器使电表指针处于透过率“0”位;预热20min ❖ 4.放入参比溶液及试样溶液
❖ 5.校准:拉动吸收池拉杆,使参比溶液置于光路中,打开比色皿暗盒盖,用调“0”调节器使电表指针处于透过率“0”位;盖上比色皿暗盒盖,用调“100%”调节器使电表指针处于透过率“100%”位。
重复校正至稳定
❖ 6.若调“100%”调节器不能使电表指针处于透过率“100%”位,打开比色皿暗盒盖,则应放大灵敏度,重新调整直至稳定
❖7. 盖上样品盖,拉动吸收池拉杆,依次将待测溶液推入光路,读出吸光度值
A。
连续读数后,立即打开比色皿暗盒盖,取出吸收池,参比溶液不取出。
❖8.再放入其他浓度待测溶液,继续调“0”及”100%”,按前面的“校准”步骤重新调
整直至稳定,再测量其他浓度待测溶液的吸光度A。
❖9.测量完毕,取出吸收池,各旋钮置于原来位置,电源开关置于“关”,拔下电
源插头。
❖10.比色皿用纯水洗净后倒置于滤纸上晾干。
(4)以吸光度为纵坐标,铁含量(μg,50ml)为横坐标,用软件(excel或origin)
绘制出标准曲线。
取3只洁净的50mL容量瓶,分别加入适量(以吸光度落在工作曲线中部为宜)含铁未知试液,按步骤(前面步骤1标准曲线的绘制)显色,测量吸光度并记录,由线性回应方程式求出相应的铁含量。
(记录格式参考下表)。
六.注意事项
(1)显色过程中,每加入一种试剂均要摇匀。
(2)试样和工作曲线测定的实验条件应保持一致,所以最好两者同时显色同时测定。
七.思考题
(1)T与A两者关系如何分光光度测定时,一般读取A值,该值在标尺上什么范围好为什么如何控制被测溶液的A值在此范围内。
