立体定向放射外科
立体定向放射外科学名词解释

立体定向放射外科学名词解释
立体定向放射外科
立体定向放射外科(Stereotactic Radiosurgery, SRS)是一种使用立体定向技术结合放射疗法的非侵入性治疗方法。
它利用三维坐标系统精确定位和定向照射肿瘤,最大限度地减少对周围正常组织的损伤。
名词解释
立体定向技术
立体定向技术是通过利用图像引导和定位系统,将超声波、磁共振(MRI)或计算机断层扫描(CT)等影像进行三维重建,进而确定目标区域的准确位置。
放射疗法
放射疗法(Radiation Therapy)是一种利用高能辐射杀灭或抑制肿瘤细胞生长的治疗方式。
常用的放射疗法包括外部放射治疗和内部放射治疗。
非侵入性治疗方法
非侵入性治疗方法是指在进行治疗时不需要进行手术或穿刺等侵入性操作的一种治疗方式。
立体定向放射外科属于非侵入性治疗方法,可以减少患者的手术风险和恢复时间。
立体定向放射治疗名词解释

立体定向放射治疗名词解释立体定向放射治疗(Stereotactic Radiosurgery,SRS)是一种利用高精度放射束传递,以非入侵性方式治疗脑内疾病的方法。
它是通过引导系统将放射束聚焦到异常组织上,从而使正常组织受到最小的辐射损伤。
立体定向放射治疗可以用于治疗良性和恶性脑内病变,如肿瘤、动脉瘤和神经元疾病等。
它被广泛应用于神经外科、放射肿瘤学和神经放射学等领域。
立体定向放射治疗的核心原理是利用三维空间定位系统精确测量和定位要治疗的病灶。
基于这些定位数据,医生可以制定个性化的治疗计划,确保放射束准确地照射到病灶上,最大限度地保护正常脑组织。
具体治疗过程包括影像学评估、放射学计划和治疗传递。
影像学评估常常使用磁共振成像(MRI)和计算机断层扫描(CT)等技术,以获取准确的病灶位置和形状信息。
医生根据这些数据制定治疗计划,确定放射束的大小、形状和方向。
在治疗传递过程中,患者通常需要佩戴特殊的头架或面面罩,以固定头部位置,保证放射束准确照射到病灶上。
立体定向放射治疗具有诸多优点。
它是一种非侵入性的治疗方法,不需要进行手术切除,因此能够避免传统手术所带来的风险和并发症。
立体定向放射治疗具有较高的精确性和准确性,可以实现亚毫米级的病灶定位和准确照射。
它还可以一次性完成治疗,无需分次治疗,减少了盲区的风险。
立体定向放射治疗不会对正常组织产生显著的副作用,使患者在治疗期间可以正常生活。
然而,立体定向放射治疗也存在一些限制和挑战。
对于一些特殊的病灶和位置,立体定向放射治疗可能无法实现完全覆盖,需要采用其他治疗方式进行补充。
立体定向放射治疗的适应症和禁忌症需要进行严格的评估和选择,以确保治疗的安全性和有效性。
立体定向放射治疗的费用较高,并且在一些地区可能无法得到普及。
立体定向放射治疗作为一种高精度、非侵入性的脑内疾病治疗方法,具有广泛的应用前景和临床价值。
通过精确的定位和放射传递技术,它可以实现对病灶的精确治疗,最大限度地保护正常脑组织。
立体定向放射外科治疗的物理剂量学

立体定向放射外科治疗的物理剂量学第一节物理剂量学基础一,设计思想及相关技术的比较手术不用刀、无血无创杀灭肿瘤是医学界多年的愿望,曾做过各种探索。
居里发现放射性镭后有了契机,逐渐向此宿愿逼近。
1.近距离后装。
直接放入小放射源杀灭肿瘤,但需有腔道或有插植将源植入瘤内,病变边缘处剂量梯度小。
已有90余年的历史。
2.术中放疗(IORT)。
将病变暴露,直接从外面单次照射大剂量,剂量分布好,但绝对有创。
已有80多年的历史。
3.普通外照射。
在固定野射线路径内好坏细胞一起杀,仅利用正常组织放射敏感性差些,较易恢复,并使之受量小些,展开持久拉锯战。
4.多叶光栅、适形照射、交角照射等。
保护正常组织更多些,但在射线路径内的分散度仍不够。
5.SRS。
单次或分次立体定向放射外科采用空间立体会聚多弧非共面围歼病变,躲避重要器官,靶外剂量能最大限度地分散开,最好地实现了临床剂量学的原则,是变革性的大改进。
二,物理学特性(一)带电粒子的SRS。
利用回旋加速器产生的质子、氦核等离子在穿过的组织中产生的Bragg峰,用2~4个固定野交角照射,可获得理想的剂量分布。
可选择能量及旋转吸收体的厚度等,适用于不同深度和大小的肿瘤。
(二)γ刀的SRS。
(三)加速器的SRS(X刀)。
X刀在技术可分为:①Buenos Aires技术(阿根廷)。
始于1983年,当时用10MV加速器,坐椅式立体定向架,可沿导轨前后旋转,水平转轴通过固定头架的等中心,此等中心与加速器要架左右的旋转中心重合,多用床实现精确的多弧非共面等中心治疗。
准直筒直径为5~30mm或更大,病变中心与系统等中心重合。
②Heidelberg技术(德国)。
始于1984年,当时用4MV的加速器,属Couch Mount 型,对加速器机架和治疗床的等中心误差不做纠正,准直筒为4~40mm或更大,可做多弧非共面旋转治疗,TPS的典型设计是每个等中心11个弧。
③JCRT技术(美国)。
始于1985年,当时在6MV加速器上,用BRW头环固定头部。
立体定向放射外科学名词解释

立体定向放射外科学名词解释
立体定向放射外科学是研究利用放射线治疗疾病的科学领域。
在这个领域,人们通过设计特殊的装置和放射线源,将放射线准确地聚焦在需要治疗的部位上,以治疗疾病。
立体定向放射外科学涉及到许多名词,下面是其中一些常见的名词解释和相关资料的拓展:
1. 立体定向技术:该技术通过设计特殊的装置和放射线源,将放射线准确地聚焦在需要治疗的部位上。
它需要对放射线进行精确的测量和定向,以确保其能够聚焦在正确的位置上。
2. 放射线源:放射线源是立体定向放射外科学中的核心部件。
它通常是由放射线源核、放射线束栅、放射线发射器等组成,用于产生放射线。
放射线源的性能和设计对于治疗的准确性和安全性至关重要。
3. 立体定向装置:立体定向装置是用于控制放射线源的方向和位置的装置。
它通常包括放射线引导系统、放射线定位系统、放射线控制系统等设备,用于帮助患者实施治疗。
4. 治疗计划:治疗计划是用于制定和准备治疗的方案。
它通常包括治疗的目标、治疗方案、治疗参数等,以确保治疗的准确性和安全性。
5. 立体定向放射治疗:立体定向放射治疗是一种利用放射线治疗疾病的技术。
它通过设计特殊的装置和放射线源,将放射线准确地聚焦在需要治疗的部位上,以治疗疾病。
立体定向放射治疗已经在许多疾病领域得到了广泛应用,包括癌症、心脏病、神经系统疾病等。
除了以上名词解释外,还可以查阅相关资料,如《立体定向放射外科学》、《放
射治疗学》等书籍,了解该领域的更多知识。
某医院γ射线头部立体定向外科治疗放射卫生防护检测与评价

某医院γ射线头部立体定向外科治疗放射卫生防护检测与评价摘要:目的︰检测与评价某医院Y射线头部立体定向外科治疗( Y刀)的放射卫生防护情况,保证其剂量学参数和防护安全性能符合有关标准和要求。
方法﹐依据X、Y射线头部立体定向外科治疗放射卫生防护标准(GBZ168—2005)对Y刃进行检测与评价。
结果﹐Y刃剂量学参数:焦点剂量率为2.39 Gy hm ins焦点计划剂量与实测剂量的相对偏差为2.3% ,机械中心与照射野中心的距离为0.19~0.41 mm.照射野尺寸与标称值偏差为0.11~1.12 mm.照射野半影宽度为2.86~~4.12 mm;防护安全性能;治疗室周围辐射水平为0.06~0.20'Gyh安全连锁及通风装置工作正常。
结论Y7剂量学参数和防护安全性能符合有关标准要求。
关键词:Y射线头部立体定向外科治疗( Y刀)﹔放射卫生防护﹔检测;评价引言:放射治疗是治疗头部恶性肿瘤治疗的非常重要手段。
其原理在于利用射线重复多次照射肿瘤区域,以达到杀死肿瘤细胞的目的。
由于头颈部集中重要器官和组织,因此在放射治疗中如何提高头部固定的精度,使得靶区内接受放射剂量,而正常组织能有效避开对射线剂量的接受,变得非常重要;头部固定的关键点在于如何避免脖颈部位的旋转误差。
1对象和方法1.1对象某医院l台国产“月亮神”丫刃。
1.2方法1.2.1 检测项目详见表一检测项目栏。
1.2.2检测仪器1Fa m er NE 2570型剂量仪,PIW 0.015cc电离室(用经刻度的 NE 2571 0.6 cc电离室在Co远距治疗机下传递刻度因子);② Y刃剂量学检测专用球形模体;3)451P型加压电离室巡测仪。
检测仪器均经国家计量实验室检定,在有效期内使用。
1.2.3检测方法按照GBZ168一2005中附录AX刀和刃治疗设备的剂量学等性能检测方法”进行检测12结果2.1刃剂量学参数和防护安全性能检测结果从表二看出,检测结果均符合国家有关标准要求'。
立体定向放射外科(伽玛刀)与普通放疗的区别:
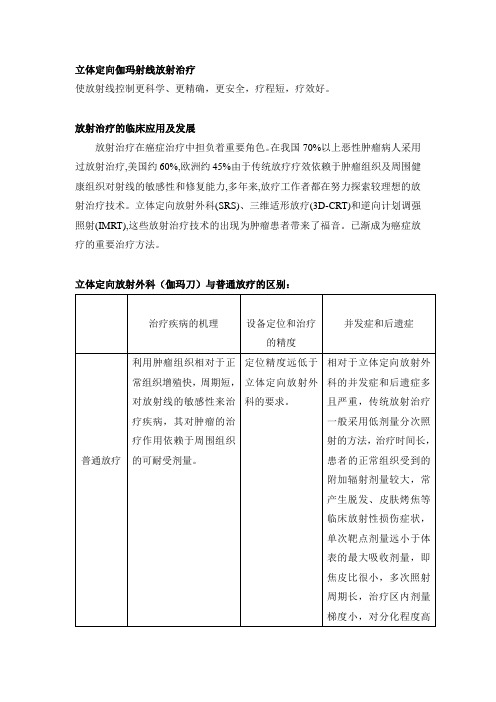
立体定向伽玛射线放射治疗使放射线控制更科学、更精确,更安全,疗程短,疗效好。
放射治疗的临床应用及发展放射治疗在癌症治疗中担负着重要角色。
在我国70%以上恶性肿瘤病人采用过放射治疗,美国约60%,欧洲约45%由于传统放疗疗效依赖于肿瘤组织及周围健康组织对射线的敏感性和修复能力,多年来,放疗工作者都在努力探索较理想的放射治疗技术。
立体定向放射外科(SRS)、三维适形放疗(3D-CRT)和逆向计划调强照射(IMRT),这些放射治疗技术的出现为肿瘤患者带来了福音。
已渐成为癌症放疗的重要治疗方法。
立体定向放射外科(伽玛刀)与普通放疗的区别:立体定向放射外科:方法简便而安全,在门诊即可完成,易为病人接受。
手术:创伤性大,病人的痛苦大,死亡率及并发症发生率较高,还有感染及出血的危险,有些深部病变根本无法手术切除。
立体定向放射治疗(SRT)与立体定向放射外科(SRS)的概念与区别:共同点:都是利用立体定向技术进行病灶定位,照射靶区的放射治疗技术。
不同点:常规分割放疗与伽玛刀治疗的关系单次大剂量对控制属于早反应组织的肿瘤有利, 伽玛刀大剂量的照射注定只能治疗较小病变,常规分割放疗时,医生可以大胆地做减量全脑照射,残灶留给后续的补充性伽玛刀消灭之。
两者可相辅相成。
头部伽玛刀的组成部分及种类:头部伽玛刀的组成:放射源、准直器、立体定向仪、计算机剂量计划系统及治疗床。
目前全世界仅有两2种头部伽玛刀产品:瑞典医科达(Elekta)公司生产的静态伽玛刀:组成:201个60Co作为放射源。
深圳奥沃国际公司(OUR。
Co.)设计生产的旋转式伽玛刀:组成:30个60Co作为放射源,采用旋转聚焦方式。
旋转式伽玛刀相对静态式伽玛刀治疗后脑水肿相对较轻。
头部伽玛刀治疗:一般不需要住院1、动静脉畸形(包括隐性者)2、转移瘤3、各种良性肿瘤:如听神经瘤、脑膜瘤、颅咽管瘤、三叉神经瘤、松果体瘤、脊索瘤、垂体瘤等。
4、胶质瘤等恶性肿瘤,5、颅内肿瘤总体的适应症,1)肿瘤最大直径<3.0cm,中线结构无移位及颅高压症状尚不明显者;2)鞍区肿瘤没有视神经受压现象者;3)脑干肿瘤在脑干中体积不超过1/4者;4)转移瘤瘤体数不超过3个月,且无严重颅高压症状者;5)颅内肿瘤术后复发,或首发肿瘤因病人高龄、体质虚弱,难以承受手术风险者。
立体定向放射外科

立体定向放射外科立体定向放射外科(stereotaxic radio surgery,SRS)作为一种特殊的治疗手段,在临床中应用越来越广泛,其安全性及有效性得到了医学界的广泛认可,但SRS有其严格的应用指征,只有严格掌握适应证,才能在尽可能降低并发症的前提下发挥最大功效。
SRS是立体定向神经外科技术与放射治疗学相结合而形成的一门新兴学科,属于立体定向外科学范畴。
SRS的概念最早于1951年由瑞典神经外科专家Leksll提出,是指利用立体定向技术对颅内靶点进行精确定位,再用单次大剂量放射线集中照射靶组织,使之产生特殊的放射生物学效应而发生局灶性坏死,从而达到类似外科手术的效果。
SRS自20世纪50年代开始临床应用以来,经历了50多年的发展,近10年来随着医学影像学和计算机技术的迅速发展,SRS技术被广泛用于治疗神经外科疾病,并发展为神经外科的重要组成部分,为神经外科医生提供了一种成熟、可靠的治疗手段。
与传统的神经外科开颅手术相比,SRS治疗具有无创伤、不出血、不需全麻、治疗时间短、定位精确、对颅内重要功能区损伤小、术后并发症少等特点。
经国内外大量临床实践证明,SRS对某些颅脑疾病疗效肯定,甚至可以达到超过显微外科手术的治疗效果,但采用SRS技术治疗颅内疾病也存在很多不足和需要探讨之处,如不易明确病变性质、治疗后显效缓慢、不能尽快解除占位效应、脑动静脉畸形闭塞缓慢、某些疾病治疗后有发生脑水肿可能等,这些都是我们今后需进一步深入研究解决的问题。
(一)立体定向放射外科的放射物理学及放射生物学基础SRS的放射物理学及放射生物学知识是相当复杂的,有关这方面的介绍比较少,这里只对临床上经常涉及到的问题简单做一阐述。
1.放射物理学基础要提高肿瘤放射治疗的效果,必须提高其治疗的增益比,即最大限度地将射线集中到病变内,杀死肿瘤细胞,而使周围正常组织和器官少受或免受不必要的照射,这正是肿瘤放射治疗的目标。
近年来,随着影像诊断与放疗技术的进步,开展了三维适形放射治疗,这在肿瘤放射治疗方面可以说是一大进步,是放射肿瘤治疗学上的一项重要变革。
【文献快递】大分割立体定向放射外科治疗脑动静脉畸形的长期疗效和并发症

【⽂献快递】⼤分割⽴体定向放射外科治疗脑动静脉畸形的长期疗效和并发症《Journal ofClinical Neuroscience》2020年11⽉24⽇在线发表⾹港中⽂⼤学The ChineseUniversity of Hong Kong的Aurora K YTam, David Y C Chan, Kevin Lim, 等撰写的《⼤分割⽴体定向放射外科治疗脑动静脉畸形的长期疗效和并发症。
Long termtreatment efficacy & complications of hypofractionated stereotactic radiosurgeryin brain arteriovenous malformations 》(doi: 10.1016/j.jocn.2020.10.057.)。
⽬的:评价⼤分割⽴体定向放射外科(hfSRS)的长期治疗效果和并发症,并确定预测结果的因素。
⽅法:回顾性分析2008年⾄2017年连续接受⼤分割⽴体定向放射外科(hfSRS)治疗的34例患者。
从临床数据分析和报告系统和我们单位的iPlan (BrainLAB, Munich)系统中提取⼈⼝统计学、临床、⾎管结构特征和放射外科数据。
对数据采⽤SPSS进⾏分析。
结果:5年闭塞率为39.1%。
⼤多数患者(29例,85.3%)恢复良好,GOS为4-5。
26.9%(9例)患者放射外科治疗后⾄少有⼀种并发症,包括出⾎、神经功能障碍、放射性坏死。
神经系统并发症致死致残率为17.6% (n = 6例)。
改良放射外科动静脉畸形评分(mRBAS)越⾼,5年闭塞率越低(Rho = -0.486, p = 0.025)。
当改良放射外科动静脉畸形评分(mRBAS)超过5.35时,所有的脑动静脉畸形(bAVM)未消失。
正如预期的那样,病灶外20Gy的体积越⼤,并发症越多,GOS越差。
有意思的是,照射引流静脉容积同AVM容积(iiDVV)的相关性与hfsrs术后出⾎风险的增加(Rho = 0.472, p = 0.031)和⽆事件⽣存率的降低(Rho = -0.472, p = 0.031)相关。
【综述】立体定向放射外科

【综述】立体定向放射外科《StatPearls [Internet]》2019 年9月28日在线发表英国National Hospital for Neurology and Neurosurgery的Harris L, M Das J撰写的综述《立体定向放射外科Stereotactic Radiosurgery.》。
【引言】放射治疗的目的是破坏异常组织,特别是肿瘤细胞,使周围的正常组织受到最小的损害。
Lars Leksell于1951年引进立体定向放射外科治疗(SRS),作为常规全脑放疗(WBRT)的替代治疗选项。
立体定向放射外科(SRS)使用高能x射线、伽马射线或质子的多束收敛会聚的射线束(multiple, convergent beams),投射到一个离散的、放射影像学定义的治疗体积(iscrete, radiographically-defined, treatment volume.)。
辐射的传递是高度适形性的。
通过使用多个交叉的辐射束,治疗体积接受高剂量的治疗处方剂量,而周围的正常脑组织接受相对较低的剂量。
这种治疗方法可以精确地量身定制,根据治疗体积的边界允许超出边界的能量快速耗散(dissipation of energy beyond the margins),保存正常组织。
对周围组织的急剧的辐射衰减限制了毒性和副作用,并保持了安全性。
立体定向放射外科的工作原理是由离子和自由基对DNA的辐射诱发的损伤。
通过内皮细胞凋亡、微血管功能障碍和T细胞反应,血管内皮细胞成为主要作用的靶体。
组织学上,在对SRS治疗反应良好的病变中会出现强烈的炎症反应和严重的血管性病变(a brisk inflammatory response and severe vasculopathy)。
【适应证】立体定向放射外科治疗适用于脑转移瘤以及包括脑膜瘤、前庭神经鞘瘤、垂体瘤和那些对常规全脑放疗(WBRT)有抵抗性的原发性肿瘤患者。
立体定向放射外科

.
5
5
立体定向放射外科(SRS) 立体定向放射治疗(SRT)目的
(1)提高靶区的精确性,提高靶区 剂量,确保靶区内剂量的均匀 分布,从而提高肿瘤局控率。
(2)降低靶区周围正常组织的受照 射剂量,从而降低放疗并发症 的发生率。
.
6
6
立体定向放射治疗(SRT)简介
SRT与常规放疗比较
❖ 肿瘤的大小是影响控制率的主要因素,对 于较大的肿瘤或放疗不敏感肿瘤实施伽玛 刀剂量分割对提高肿瘤控制率是有益的。
.
43
43
立体定向放射外科(SRS)的剂量学特性
一次性大剂量照射
靶区内剂量高
靶区外剂量低
靶周围剂量梯度差大
靶区剂量分布不均匀
.
44
体部伽玛刀治疗 肿瘤区与周边正 常组织区受照射 剂量比较
.
30
听神经瘤
❖ 多起源于前庭神经的许旺氏细胞的良性 肿瘤,多为单侧,少数为双侧。
❖ 多30岁后发病,占颅内肿瘤8-10%.
❖ 主要表现为耳鸣、听力下降或丧失,脑 干及周围神经受压,脑积水等
❖ 手术治疗:疗效较好,局部切除率高,
但术后听力丧失机率达达90%,有70%
术后合并面瘫。 .
31
听神经瘤治疗适应症
目标定位精准且更小 (误差<0.3mm)
单次或大分割
剂量梯度变化大
多重射束在中心交汇
❖其他
不能预防远处新发病灶的出现
放射坏死发生率. 5-10%
7
7
.
8
8
立体定向放射外科(SRS)的剂量学
❖有效的固定—基本保证 ❖立体定位技术--高精度的基础 ❖CT或MRI、TPS—精度实施的保证 ❖放射线几何聚焦--高剂量的保障
伽玛刀

伽玛刀伽玛刀伽玛刀又称立体定向伽玛射线放射治疗系统,是一种融合现代计算机技术、立体定向技术和外科技术于一体的治疗性设备,它将钴-60发出的伽玛射线几何聚焦,集中射于病灶,一次性、致死性的摧毁靶点内的组织,而射线经过人体正常组织几乎无伤害,并且剂量锐减,因此其治疗照射范围与正常组织界限非常明显,边缘如刀割一样,人们形象的称之为“伽玛刀”。
“伽玛刀”名为“刀”,但实际上并不是真正的手术刀,它是一个布满直准器的半球形头盔,头盔内能射出201条钴60高剂量的离子射线---伽玛射线。
它经过CT和磁共振等现代影像技术精确地定位于某一部位,我们称之为“靶点”。
它的定位极准确,误差常小于0.5毫米;每条伽玛射线剂量梯度极大,对组织几乎没有损伤。
但201条射线从不同位置聚集在一起可致死*地摧毁靶点组织。
它因功能尤如一把手术刀而得名,有无创伤、不需要全麻、不开刀、不出血和无感染等优点。
伽玛刀分为头部伽玛刀和体部伽玛刀。
头部伽玛刀是将多个钴源安装在一个球型头盔内,使之聚焦于颅内的某一点,形成一窄束边缘锐利的伽马射线。
在治疗时将窄束射线汇聚于病灶形成局限的高剂量区来摧毁病灶,主要用于颅内小肿瘤和功能性疾病的治疗。
体部伽玛刀主要用于治疗全身各种肿瘤。
原理伽玛射线立体定向放射治疗系统,是一种融立体定向技术和放射外科技术于一体,以治疗颅脑疾病为主的立体定向放射外科治疗设备。
它采用伽玛射线几何聚焦方式,通过精确的立体定向,将经过规划的一定剂量的伽玛射线集中射于体内的预选靶点,一次性、致死性地摧毁点内的组织,以达到外科手术切除或损毁的效果。
病灶周围正常组织在焦点以外,仅受单束伽玛射线照射,能量很低,而免伽玛刀于损伤。
犹如用放大镜聚焦阳光,聚焦的焦点热量可点燃物品,而焦点外的阳光则安全。
用伽玛射线代替手术刀,其治疗照射范围与正常组织分界非常明显,边缘如刀割一样,人们形象地称之为“伽玛刀”。
适用伽玛刀分为头部伽玛刀和体部伽玛刀。
头部伽玛刀有静态式伽玛刀和旋转式伽玛刀,静态式伽玛刀是将多个钴源安装在一个球型头盔内,使之聚焦于颅内的某一点,旋转式伽玛刀是在静态式的基础上改进而来,具备许多优点,是中国的专利。
立体定向放射外科治疗(伽玛刀)简介

伽玛刀与放疗相结合方案
腺癌: 单纯伽玛刀治疗,不加放疗,复查发现新的病 灶可再次伽玛刀治疗; 鳞癌: 先行伽玛刀治疗,若为单发病灶,不加放疗, 定期复查,若为多发病灶,再增加全脑放疗40Gy; 小细胞癌: 先行全脑放疗30-40Gy,复查MRI,若有残留, 再加伽玛刀治疗。
男,55岁,非小细胞肺癌 右顶叶转移瘤 两个月复查
女,59岁,脑干占位
治疗六个月后复查
男,62岁,左颞顶叶占位 伽玛刀治疗半年后复查
女,48岁, 右侧丘脑占位
治疗6周后 复查
女,46岁,左侧脑室占位 治疗3个月后复查
男,45岁,三脑室占位
治疗后12个月复查
女,62岁,脑室内占位 治疗4个月后复查
59/F 脊索 瘤术 后 复发 治疗 前
不良反应
晚期放射反应(并发症) 主要是由于局部脑组织的放射性损伤 所致,多数为病理性改变,临床表现为 偏瘫、失语、失听、视力障碍等局灶性 神经功能缺失症状或垂体功能减退等, 往往不可逆转,关键在于前期预防,治 疗主要为护理康复。
肿瘤容积与肿瘤控制率的统计分析
结论:
不同的处方剂量均能获得较好的肿瘤控制率。 肿瘤控制率主要与组织类型有关,良性脑膜瘤 和不典型型脑膜瘤能够获得满意的疗效,恶性 脑膜瘤疗效尚不理想,总的趋向是在原位或异 位复发。 肿瘤的容积越大,治疗后越容易侵犯周围敏感 组织,疗效越差。
女,44岁,窦旁脑膜瘤术后复发
伽玛刀术前
术后一年半
女,59岁,嗅沟脑膜瘤 治疗前 14个月 25个月
男,68岁,蝶骨嵴脑膜瘤术后复发; 伽玛刀治疗后五年复查
治疗时
男,57岁,鞍旁脑膜瘤 治疗后7个月
治疗后14个月
治疗前
动静脉畸形立体定向放射外科治疗

动静脉畸形立体定向放射外科治疗
王俊杰;庄永志;申文江
【期刊名称】《国际医学放射学杂志》
【年(卷),期】2001(024)001
【摘要】立体定向放射外科是近年来伴随计算机、现代影像学和现代放疗学发展起来的一门新技术,临床应用治疗肿瘤和一些良性疾病具有靶区剂量高和周围正常组织损伤小的特点.本文就立体定向放射外科治疗动静脉畸形进行综述.
【总页数】3页(P54-56)
【作者】王俊杰;庄永志;申文江
【作者单位】北京大学第三医院;北京大学第三医院;北京大学第一医院
【正文语种】中文
【中图分类】R73
【相关文献】
1.立体定向放射外科治疗脑动静脉畸形的效果观察 [J], 山常国;蔡林波;洪伟平;周青;王立超
2.脑动静脉畸形立体定向放射外科治疗的新思维 [J], 王来兴;刘建民;周晓平
3.立体定向放射外科治疗脑动静脉畸形新进展 [J], 周喆;周晓平
4.血管内栓塞结合二期立体定向放射外科治疗颅内动静脉畸形的效果 [J], 诸德源;赵文元;刘建民;方亦斌;黄清海;刘炜;李仁利;祝国荣;李强;许奕;洪波
5.脑动静脉畸形的立体定向放射外科治疗 [J], 姜炜;靳松;吕仲虹
因版权原因,仅展示原文概要,查看原文内容请购买。
立体定向放射外科治疗简介

立体定向放射外科治疗简介立体定向放射外科, 或放射外科, 这一概念是1951年由瑞典神经外科医生Leksell提出并最早使之得以实施,是指应用立体定向原理和技术, 对人体内肿瘤(称为靶点)施行精确定位,将窄束放射线聚集于靶点, 一次性给与致死性大剂量放射, 使靶点区域产生局灶性破坏而达到治疗目的学科。
这有一点类似于用透镜聚焦阳光,在一张纸上烤穿一点而又不损坏纸张的其余部份。
由于这种照射区边缘锐利如刀割, 故被称为“刀”。
这一技术的诞生,彻底避免了传统外科手术给病人带来的种种风险和痛苦,是人类医学史上深受医生和病人欢迎的又一最新发明。
它使医生和病人都梦寐以求的“开刀不出血、无创伤、不感染,突破手术禁区”,从神话变成了现实。
立体定向放射外科治疗和传统的放射治疗有着根本的区别,传统的放射治疗是利用正常组织和肿瘤组织对放射线的敏感性差异来治疗疾病,而立体定向放射神经外科则采用给予致死性大剂量放射使靶点产生局灶性坏死达到治疗目。
由于采用的射线源不同,从放射物理学角度又分有γ-刀(伽玛刀)、X-刀及离子射线放射外科技术, 以γ-射线为能源的放射外科的称为γ-刀,而以产生X-射线为放射源的被称为X-刀, 此外尚有中子射线刀和离子射线刀等。
起初, 放射外科的伽玛刀和X-刀只能用于治疗脑部疾病, 如脑肿瘤和脑血管畸形, 随着立体定向技术和设备的不断改进和完善,立体定向放射外科的工作范围不断拓宽,现在的X-刀亦可以对颌面、颈部、脊髓和胸、腹腔实质性脏器的一些疾病(肿瘤和血管畸形)实施放射外科治疗。
由于伽玛刀本身的缺点, 如设备成本高, 治疗费用高, 60钴源需要定期更换以保证剂量率不至太低,更换一次60钴源的费用即高达50万美元, 60钴源的放射物理特性方面的局限性,存在放射污染等, 只能治疗头部小肿瘤,目前已有人提出淘汰伽玛刀。
X-刀到目前已得到很大发展, 同时X-刀可以治疗全身各个部位的肿瘤, 已有取代伽玛刀的趋势。
SRS、SRT、3D-CRT、IMRT

SRS、SRT、3D—CRT、IMRT一、立体定向放射手术(stereotactic radiosurgery ,SRS):该概念由瑞典神经外科学家Lars Leksell于1951年最早提出,主要用于治疗颅内良、恶性病变.其特征是多个小野三维集束单次大剂量照射。
所谓立体定向放射手术,即用多个小野三维集束单次大剂量照射颅内不能手术的,诸如脑动静脉畸形(AVM)病等良性病变。
由于多个小野集束定向照射,周围正常组织受量很小,射线对病变起到类似于手术的作用,故名X (γ)刀。
γ—刀(γ-knife):最早由瑞典Elekta公司研制,使用201个钴-60源集束照射.X -刀(X -knife):由美国同道提出,几乎在Elekta γ刀装置临床安装使用的同时及稍后,用直线加速器的6—15MV X线非共面多弧度等中心旋转实现多个小野三维集束照射病变,起到与γ刀一样的作用,故称为X-刀(X—Knife)。
γ-刀、X-刀分别为瑞典Elekta公司钴-60γ刀装置和美国Radionics公司X刀装置的商品注册名。
它们的学名称为X(γ)线立体定向放射手术(stereotactic radiosurgery),简称为SRS。
X(γ)线SRT(SRS)治疗过程:X(γ)线SRT(SRS)治疗一般要经过病变定位、计划设计和治疗三个过程.1、定位:利用立体定向装置(stereotaxy)、CT、磁共振和X线数字减影等先进影像设备及三维重建技术,确定病变和邻近重要器官的空间准确位置和范围,这个过程叫作三维空间定位,也叫立体定向。
2、计划设计:定位后利用三维治疗计划系统,确定X(γ)SRT(SRS)的线束方向,精确地计算出一个优化分割病变和邻近重要器官间的剂量分布计划,使射线对病变实施“手术”式照射。
3、治疗:X(γ)线SRT(SRS)治疗既可严格保护临近重要器官,又可使病变得到大剂量的破坏性照射,起到不开颅也能准确、安全去病的目的,很受患者和神经外科医师们的欢迎。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
72Y 男 右肺腺癌
治疗前
治疗后3个月
51
55Y 女 右下肺癌术后化疗后复发 中分化鳞癌 T3N2M0
治疗前
治疗后3个月
52
67Y 男 左肺中分化鳞癌
治疗后2个月
治疗前
53
纵膈肿瘤气管气管受压狭窄支架置入后 伽玛刀治疗后56周
右肺鳞癌治疗前后10周对照
治疗前
治疗后10周
肝癌
腹膜后肿瘤
AVM的血供
AVM伽玛刀治疗后随访
治疗后常见反应为局部再出血及放射性
损伤 闭塞时间多在治疗后1年-3年开始闭塞, 早期主要表现为流空效应的减少,一般 每年复查一次MRI,2-3年以后复查 DSA 一般1年闭塞率70%,2年85%, 3年90%左右
动静脉畸形(AVM)
治疗前
治疗后12个月
17
18
ቤተ መጻሕፍቲ ባይዱ
50Y 右肺中分化腺癌术后化疗后 12 脑内多发转移
治疗前
治疗前
治疗后3个月
19
20
垂体瘤
垂体瘤为垂体前叶的肿瘤,99%以
上为良性。 为放射敏感性肿瘤,为伽玛刀治疗 的较好适应症。 生长较慢,正常垂体射线耐受量大。
垂体瘤的伽玛刀治疗
目的 消灭肿瘤,防止复发 减轻周围结构的受压 控制内分泌症状 最大程度的保护正常垂体结构及
头部伽玛刀治疗流程
立体定向框架安装
MRI定位扫描
TPS治疗计划制定
治疗的实施
疗效
疾病
垂体瘤 脑膜瘤 听神经、三叉神经鞘瘤 脑转移瘤 血管畸形 脑胶质瘤 功能性疾病
肿瘤局部控制率(%)
90-100 85 80-95 >95 78-92 74-87 60-80
脑转移瘤
伽玛刀治疗的优势 1、多数脑转移瘤对放疗敏感,即使对放疗 抵抗(黑色素瘤、肾癌、肉瘤)的转移瘤, 由于伽玛刀的局部高剂量性,对肿瘤也是 致死性的 2.伽玛刀一次可以完成多个病灶的治疗。 3、受照射正常脑组织少,最大程度提高神 经功能的保护。 4、可反复治疗、治疗风险极小。
颅脑伽玛刀的适应症
1、颅内肿瘤: (1)良性肿瘤:如垂体瘤、脑膜瘤、颅咽管瘤、 听神经瘤等,约占颅脑SRS病人的36%。 (2)恶性肿瘤:包括转移瘤和位于重要部位不能 手术、拒绝手术或不能耐受手术的原发肿瘤, 约占29%。 2、AVM等脑血管畸形:约占33%。 3、功能性疾病:癫痫、三叉神经痛等,约占2%。 4、其它如鼻咽癌复发、外照射后的补充加量
43
立体定向放射外科(SRS)的剂量学特性
一次性大剂量照射 靶区内剂量高 靶区外剂量低 靶周围剂量梯度差大 靶区剂量分布不均匀
体部伽玛刀治疗 肿瘤区与周边正 常组织区受照射 剂量比较
1cm 3cm 5cm
体部伽玛刀治疗适应症
1、根治性单纯γ刀治疗: 主要用于中早期肺癌、肝癌、 食道癌、胆管癌、 胰腺癌、前列腺癌、膀胱癌、肾上腺癌、腹膜后 肿瘤、纵隔肿瘤和直肠癌等。 2、姑息性单纯γ刀治疗:(1)不能耐受或拒绝手术 者(2)手术不能切除者(3) 转移瘤的治疗 (4)不愿接 受普放和化疗者。 3、体刀结合外照射:(1)外照射在先:最常用的结 合方式(2)体刀在先:用于急症情况需缓解者。 4、放疗后肿瘤复发的γ 刀治疗:
水肿。 局部控制率>85%
矢状窦旁脑膜瘤
蝶骨嵴内侧脑膜瘤
治疗前
治疗后2年复查
海绵窦旁脑膜瘤
治疗前
治疗后18个月
听神经瘤
多起源于前庭神经的许旺氏细胞的良性
肿瘤,多为单侧,少数为双侧。 多30岁后发病,占颅内肿瘤8-10%. 主要表现为耳鸣、听力下降或丧失,脑 干及周围神经受压,脑积水等 手术治疗:疗效较好,局部切除率高, 但术后听力丧失机率达达90%,有70% 术后合并面瘫。
体部伽玛刀治疗过程
1、体膜固定 2、CT定位 3、制定治疗计划 4、治疗摆位 5、治疗实时监控
体部γ刀靶区确定原则
2、肿瘤的性质和大小 3、肿瘤的分化程度
4、肿瘤的边缘情况
5、肿瘤周围的敏感组织情况
影响体刀伽玛刀剂量学的因素
l、原发肿瘤单纯伽玛刀根治性放疗 2、原发肿瘤单纯伽玛刀姑息放疗 3、转移癌或复发癌伽玛刀的治疗 4、外照射结合伽玛刀补充加量 5、病人的一般情况 6、靶区的大小 7、肿瘤性质、组织学类型及分化程度 8、病灶部位及周围敏感组织情况 9、病灶在治疗状态的活动度
立体放射外科治疗进展
朱敬伟 上海解放军455医院肿瘤放疗伽玛刀中心
1
近年来,随着计算机技术、影像技
术、精确定位技术和聚焦式放疗技 术的发展,立体定向放射治疗技术 应用于肿瘤的治疗日益得到临床医 师的重视
2
立体定向放射外科(SRS)
SRS是指利用立体定向原理,对 特定靶点,使用一次大剂量照射, 产生特定的放射生物学效应,达到 治病的目的。
(误差<0.3mm)
5-10%
7
8
立体定向放射外科(SRS)的剂量学
有效的固定—基本保证
立体定位技术--高精度的基础
CT或MRI、TPS—精度实施的保证
放射线几何聚焦--高剂量的保障
立体定向放射外科(SRS)放射生物学基 础
G60射线直接及氧自由基使DNA双链
损失,引起细胞的增殖性死亡或凋 亡。 迟发性血管损伤。
颅内淋巴瘤
治疗前
治疗后3周
松果体肿瘤
治疗前
治疗后3个月
脑干胶质瘤伽玛刀治疗
治疗前
治疗后3个月
肿瘤体积大于(>3cm) 能否接受伽玛刀治疗
对病灶体积较大的肿瘤,可以采用剂量分
割治疗或者肿瘤体积分割治疗方法。 肿瘤的大小是影响控制率的主要因素,对 于较大的肿瘤或放疗不敏感肿瘤实施伽玛 刀剂量分割对提高肿瘤控制率是有益的。
体部伽玛刀放射性损伤及防治
伽玛刀治疗相对普放副作用较少、较轻.全身反 应轻微。主要为局部反应: 早期反应:皮肤粘膜反应如食管炎、皮炎、肠炎, 多轻微,一般应用粘膜保护剂、激素治疗。治疗 后3-5天出现,多持续2-4周。 后期反应:一般在2-3月以后发生,如放射性肺 炎、肺纤维化,肠道疤痕性狭窄、穿孔,脊髓炎 等。防治主要为靶区的设计、必要时剂量分割治 疗。
立体定向放射治疗(SRT或FSRT)
SRT是引入了放疗的概念,利用立
体定向放射外科(SRS)的技术和优势 根据肿瘤的放射生物学原则给予靶 区常规或相对高的剂量分次照射。 立体定向放射治疗主要用于恶性肿 瘤和体积较大的良性肿瘤的放疗。
放射治疗新技术的应用: 三维适形放射治疗(3D CRT) 调强适形放射治疗 (IMRT) 影像引导放射治疗 (IGRT) 立体定向放射治疗 (SRT) ———— 精确放射治疗
脑膜瘤伽玛刀治疗
适应症 颅底、脑深部及重要结构区的脑膜瘤
直径较小的脑膜瘤
多发性脑膜瘤 高龄无法耐受手术,且影像学观察进行性
增长 术后复发、术后残留
治疗后随访及并发症
一般瘤体缩小较慢需12—24月时间。 随访时间多为每年一次,以MRI为主。
常见并发症为局部脑神经损伤、放射性
10
11
伽玛刀治疗程序
确定诊断 选择适应证 定位 治疗计划规划 照射治疗
重复定位 初始定位 组织学诊断
定期随访
靶区的设计
原则
个体化
据病理类型、分期、临床分型、既往治疗情
况、一般情况 尽量减少靶点数,尽量用小准直器 尽量使靶区高剂量,周围低剂量,减少周围 正常组织或器官的所受量 剂量分布与病灶适形性好 有效的治疗剂量:亚临床病灶及中心部位具 有等同放射生物学效应
伽玛刀治疗团队需要多学科配合
神经外科医师 影像科医师 肿瘤科医师 物理师 技师 护理人员 其他相关科室医师
58
5
立体定向放射外科(SRS) 立体定向放射治疗(SRT)目的 (1)提高靶区的精确性,提高靶区 剂量,确保靶区内剂量的均匀 分布,从而提高肿瘤局控率。 (2)降低靶区周围正常组织的受照 射剂量,从而降低放疗并发症 的发生率。
6
立体定向放射治疗(SRT)简介
SRT与常规放疗比较
目标定位精准且更小 单次或大分割 剂量梯度变化大 多重射束在中心交汇 其他 不能预防远处新发病灶的出现 放射坏死发生率
听神经瘤治疗适应症
无明显脑积水表现 双侧听神经瘤 位于内听道内较小肿瘤,听力较好 术后残留 不能耐受手术者 要求保留面、听神经功能者
听神经瘤
治疗前
治疗后20个月
右侧听神经瘤
右侧听神经瘤
脑动静脉畸形(AVM)
脑血管发育畸形,年轻人多见,多以脑内出
血为主要表现,部分为癫痫症状。 其后果主要为致命性脑内出血,年发生率为 2% 诊断方法为影像学为主,DSA血管造影确诊 治疗方法:有手术切除、血管内介入栓塞、 伽玛刀治疗为主
功能,减少并发症
垂体瘤的伽玛刀治疗
适应症 小腺瘤首选 不能耐受手术 术后残留 术后复发
侵袭性垂体瘤 F 48Ys
治疗前
治疗后12个月复查
脑膜瘤
占颅内原发性肿瘤的第二位。 90%为良性,5-10%为恶性。
分型:典型脑膜瘤、非典型脑膜瘤、
恶性脑膜瘤。 多生长缓慢,伽玛刀治疗产生生物 学效应:瘤体细胞的杀死;延迟性 血管闭塞,6个月后。
