临床试验项目管理医学PPT课件
合集下载
药物临床试验管理制度和流程ppt课件

➢取得伦理批件后,申办者/CRO、机构办公室与研究 者起草合同
➢最后由申办者/CRO与机构主任签字生效。
在整堂课的教学中,刘教师总是让学 生带着 问题来 学习, 而问题 的设置 具有一 定的梯 度,由 浅入深 ,所提 出的问 题也很 明确
步骤七:接爱临床试验材料及药物
申办者/CRO将临床试验材料交机构办公室,经办公 室备份后分发项目研究小组
在整堂课的教学中,刘教师总是让学 生带着 问题来 学习, 而问题 的设置 具有一 定的梯 度,由 浅入深 ,所提 出的问 题也很 明确
临床药物试验运行管理制度
申办者提供药物与临床试验药物相关的资料 专业科室的软硬件设施要达到要求,研究人员要
有资格并经过培训 研究者须对受试者在医疗上应认真负责 必须严格按照试验方案开展试验 研究者须保留试验过程中的源文件和源数据;将
在整堂课的教学中,刘教师总是让学 生带着 问题来 学习, 而问题 的设置 具有一 定的梯 度,由 浅入深 ,所提 出的问 题也很 明确
临床药物试验运行管理制度
国家食品药品监督管理局认定的专业才能开展 要有充分的科学依据,并《赫尔辛基宣言》和《人
体生物医学研究国际道德指南》规定的原则 申办者必须出具国家食品药品监督管理局的批件及 药检部门的检测报告 药物临床试验必须经过伦理委员会批准后方可进行 受试者必须自愿,并签署知情同意书
为参加单位,PI组织研究人员进行项目总结。 申办者/CRO将总结报告交至机构办公室,待“临
床试验项目结题签认表”签字确定后,由机构主 任会议审议、签字、盖章
在整堂课的教学中,刘教师总是让学 生带着 问题来 学习, 而问题 的设置 具有一 定的梯 度,由 浅入深 ,所提 出的问 题也很 明确
临床药物试验运行管理制度
➢最后由申办者/CRO与机构主任签字生效。
在整堂课的教学中,刘教师总是让学 生带着 问题来 学习, 而问题 的设置 具有一 定的梯 度,由 浅入深 ,所提 出的问 题也很 明确
步骤七:接爱临床试验材料及药物
申办者/CRO将临床试验材料交机构办公室,经办公 室备份后分发项目研究小组
在整堂课的教学中,刘教师总是让学 生带着 问题来 学习, 而问题 的设置 具有一 定的梯 度,由 浅入深 ,所提 出的问 题也很 明确
临床药物试验运行管理制度
申办者提供药物与临床试验药物相关的资料 专业科室的软硬件设施要达到要求,研究人员要
有资格并经过培训 研究者须对受试者在医疗上应认真负责 必须严格按照试验方案开展试验 研究者须保留试验过程中的源文件和源数据;将
在整堂课的教学中,刘教师总是让学 生带着 问题来 学习, 而问题 的设置 具有一 定的梯 度,由 浅入深 ,所提 出的问 题也很 明确
临床药物试验运行管理制度
国家食品药品监督管理局认定的专业才能开展 要有充分的科学依据,并《赫尔辛基宣言》和《人
体生物医学研究国际道德指南》规定的原则 申办者必须出具国家食品药品监督管理局的批件及 药检部门的检测报告 药物临床试验必须经过伦理委员会批准后方可进行 受试者必须自愿,并签署知情同意书
为参加单位,PI组织研究人员进行项目总结。 申办者/CRO将总结报告交至机构办公室,待“临
床试验项目结题签认表”签字确定后,由机构主 任会议审议、签字、盖章
在整堂课的教学中,刘教师总是让学 生带着 问题来 学习, 而问题 的设置 具有一 定的梯 度,由 浅入深 ,所提 出的问 题也很 明确
临床药物试验运行管理制度
药品临床试验管理规范ppt课件

8.
9.
研究中的药品应按GMP要求生产、处理与保存, 并应按照批准了的试验方案中的规定使用。
能确保临床试验各方面质量的具有操作规程的 工作系统应加以实施。
ICH指导原则(ICH-GCP)
• • • • • • • • • 内容目录 前言 1. 专业术语名词解释 2. ICH-GCP基本原则 3. 机构审查委员会/独立的伦理委员会 3.1 职责 3.2 组成,功能与操作 3.3 工作程序 3.4 记录
ichichgcp31职责32组成功能与操作33工作程序34记录ichgcp续141研究者的资格与认同42适当的研究条件43对受试者的医疗责任44与irbiec对话45对试验方案的依从性46试验药品47随机化步骤或试验中失盲48受试者知情同意书49记录与报告410进展报告411安全性报告412提前终止试验与试验暂停413试验研究者的总结报告ichgcp51确保质量与质量控制52合同研究组织cro53医学专长54试验设计55试验管理数据处理与记录保管56试验研究者选择57现有与试验有关的责任与功能的分配58对受试者与研究者的补偿59试验费用510向管理当局的报告提交书511irbiec审批件512有关研究中药品的信息资料513研究中药品的制造包装标签与编码ichgcp514研究中药品的供应与管理515记录通路516安全性情报517药物不良反应报告518监视monitoring5181目的5182监视员的选择与资格5183监视范围与性质5184监视员职责5185监视程序5186监视报告ichgcp519监察audit5191目的5192监察人员的选择与资格5193监察程序520缺乏依从性521提前终止或试验暂停522临床试验研究报告523多中心临床试验ichgcp续561一般资料信息62背景资料信息63试验目的与本项试验目的64试验设计65受试者的选择与剔除66受试者的治疗67疗效评价68安全性评价69统计分析ichgcp610原始资料文件的直接通路611质量控制与确保质量的程序612伦理考虑613数据处理与记录保管614经费与保险615发表政策616增补ichgcp续771简介721标题页
9.
研究中的药品应按GMP要求生产、处理与保存, 并应按照批准了的试验方案中的规定使用。
能确保临床试验各方面质量的具有操作规程的 工作系统应加以实施。
ICH指导原则(ICH-GCP)
• • • • • • • • • 内容目录 前言 1. 专业术语名词解释 2. ICH-GCP基本原则 3. 机构审查委员会/独立的伦理委员会 3.1 职责 3.2 组成,功能与操作 3.3 工作程序 3.4 记录
ichichgcp31职责32组成功能与操作33工作程序34记录ichgcp续141研究者的资格与认同42适当的研究条件43对受试者的医疗责任44与irbiec对话45对试验方案的依从性46试验药品47随机化步骤或试验中失盲48受试者知情同意书49记录与报告410进展报告411安全性报告412提前终止试验与试验暂停413试验研究者的总结报告ichgcp51确保质量与质量控制52合同研究组织cro53医学专长54试验设计55试验管理数据处理与记录保管56试验研究者选择57现有与试验有关的责任与功能的分配58对受试者与研究者的补偿59试验费用510向管理当局的报告提交书511irbiec审批件512有关研究中药品的信息资料513研究中药品的制造包装标签与编码ichgcp514研究中药品的供应与管理515记录通路516安全性情报517药物不良反应报告518监视monitoring5181目的5182监视员的选择与资格5183监视范围与性质5184监视员职责5185监视程序5186监视报告ichgcp519监察audit5191目的5192监察人员的选择与资格5193监察程序520缺乏依从性521提前终止或试验暂停522临床试验研究报告523多中心临床试验ichgcp续561一般资料信息62背景资料信息63试验目的与本项试验目的64试验设计65受试者的选择与剔除66受试者的治疗67疗效评价68安全性评价69统计分析ichgcp610原始资料文件的直接通路611质量控制与确保质量的程序612伦理考虑613数据处理与记录保管614经费与保险615发表政策616增补ichgcp续771简介721标题页
临床试验项目管理

在项目启动阶段,需要清晰地定义 研究目的,包括要解决的科学问题、
预期成果以及可能的应用。
制定项目计划
根据研究目的,制定详细的项 目计划,包括研究设计、时间 表、预算、人员分工等。
建立项目管理团队
组建一个高效的项目管理团队, 包括项目经理、研究人员、协调 员等,确保项目顺利进行。
确定研究资源
根据项目需求,确定并获取必 要的资源,如研究场地、设备
THANKS
感谢观看
总结词
精心策划、严格实施、高效管理
详细描述
该案例中,项目团队制定了详细的研究计划 和时间表,明确了研究目的、方法、样本量 等关键要素。通过有效的协调和沟通,确保 了试验的顺利进行。同时,团队密切关注数 据质量,及时处理异常情况,最终获得了高 质量的研究结果。
案例二:失败的临床试验项目
总结词
目标不明确、实施不力、管理混乱
促进成果转化
提升企业竞争力
科学的项目管理有助于协调各方资源,推 动研究成果的转化和应用,为患者提供更 好的治疗方案。
优秀的临床试验项目管理能力是企业核心 竞争力的重要组成部分,有助于提高企业 在国内外市场的地位和影响力。
临床试验项目管理的历史与发展
历史回顾
自20世纪中期以来,随着药物研发和医学技术的不断发展,临床试验项目管理的理念和实践逐渐形成和发展。
案例五:研究参与者的招募与管理
总结词
广泛宣传、严格筛选、有效沟通
详细描述
项目团队通过多种渠道进行宣传,吸引潜在参与者。 在招募过程中,团队对参与者进行严格的筛选和评估 ,确保其符合研究要求。同时,与参与者保持有效沟 通,及时解答疑问和处理问题。通过合理的招募和管 理工作,确保了参与者的数量和质量。
预期成果以及可能的应用。
制定项目计划
根据研究目的,制定详细的项 目计划,包括研究设计、时间 表、预算、人员分工等。
建立项目管理团队
组建一个高效的项目管理团队, 包括项目经理、研究人员、协调 员等,确保项目顺利进行。
确定研究资源
根据项目需求,确定并获取必 要的资源,如研究场地、设备
THANKS
感谢观看
总结词
精心策划、严格实施、高效管理
详细描述
该案例中,项目团队制定了详细的研究计划 和时间表,明确了研究目的、方法、样本量 等关键要素。通过有效的协调和沟通,确保 了试验的顺利进行。同时,团队密切关注数 据质量,及时处理异常情况,最终获得了高 质量的研究结果。
案例二:失败的临床试验项目
总结词
目标不明确、实施不力、管理混乱
促进成果转化
提升企业竞争力
科学的项目管理有助于协调各方资源,推 动研究成果的转化和应用,为患者提供更 好的治疗方案。
优秀的临床试验项目管理能力是企业核心 竞争力的重要组成部分,有助于提高企业 在国内外市场的地位和影响力。
临床试验项目管理的历史与发展
历史回顾
自20世纪中期以来,随着药物研发和医学技术的不断发展,临床试验项目管理的理念和实践逐渐形成和发展。
案例五:研究参与者的招募与管理
总结词
广泛宣传、严格筛选、有效沟通
详细描述
项目团队通过多种渠道进行宣传,吸引潜在参与者。 在招募过程中,团队对参与者进行严格的筛选和评估 ,确保其符合研究要求。同时,与参与者保持有效沟 通,及时解答疑问和处理问题。通过合理的招募和管 理工作,确保了参与者的数量和质量。
临床试验项目管理培训课件
1/10/2021
临床试验1项3 目管理
文件管理(3)
试验结束阶段
试验用药的回收和销毁 CRF的回收及数据的质疑 试验文件完整性的确认 伦理委员会的通报 临床试验的报告
1/10/2021
临床试验1项4 目管理
临床试验项目管理要素
文件管理
进度管理
质量管理 风险管理 1/10/2021
临床试验1项5 目管理
Have blood pressure and heart/pulse rate been taken at this visit?
No
Yes
Please record the results in the Vital Signs Log at the
end
of the CRF.
Is there any clinically significant abnormality?
病史(患病时间等) 目前身体状况、伴随疾病和用药 近期停止用药时间(满足方案要求) 受试者参加临床试验号/签署知情同意书 访视日期 实验室/X-线等结果 试验用药数量及伴随治疗记录
1/10/2021
临床试验9项目管理
1/10/2021
临床试验1项0 目管理
Protocol 265805/249
批文(CFDA批文、伦理委员会批件及其成员) 签字合同(研究者合同、财务规定) 试验器械药品器械接收单和检测报告 实验室文件(正常值范围、质控证明) 研究者简历、研究者授权表及相关文件
1/10/2021
临床试验5项目管理
临床试验方案:
方案的形成过程中需申办者 与研究者讨论,并严格遵守 中国注册法规要求。
计划阶段 撰写方案摘要 选择研究者
《临床试验项目管理》课件

3
制定计划
根据实际情况,制定多部门间的相关计划和协调方案,实现多部门间的协同合作 和管理。
临床试验项目管理的未来发展趋势
技术区块链技术将应 用到临床研究中
利用区块链技术建立查处临床 研究中的数据造假问题,促进 临床研究的透明与诚信。
经费
经费预算和使用方面,更加注 重效率和利用率,采用数字记 账和纪录等技术提升经费的评 估和审批效率。
时间分配
合理安排试验时间表,建立时间点监控机制,及时调整计划,保持试验进度和效果的协调性。
执行监督
细化制定实施规范、流程、操作手册,加强现场监督,并及时反馈和汇报试验计划、时间表 和执行情况。
预算和资源管理
预算管理
合理制定预算,降低费用,控 制风险,最终保证试验的顺利 进行和预算的有效利用。
人力资源
风险许可
采用风险、不确定和时间的综 合考虑方法,及时评估和批准 新样本,为临床试验研究提供 更高效和科学的统筹管理。
管理人员的职业道路和发展方向
1 进修学习
通过科目考试、技能考核等方式提升自己的专业背景和管理技能,培养和提升自己的管 理层次。
2 现场培训
通过参加项目、实验安排等现场实训,在实践中不断进取、提高实际操作能力和经验。
试验材料和设备的采购和管理
试验材料 药品 仪器设备 实验材料
采购和管理需求
统一保管、分类存储,符合GMP/GCP的标准, 保证药品的质量可控。
检查、维护及运输设备,保证仪器设备的整体性、 精准性和可用性。
标明采集时间、采集者等数据,建立实验材料样 本库,确保数据的可追溯性和与后续数据的高度 可比性
3 内部审核
机构内部根据规定要求进行内部审核,确保临床试验项目管理流程及时产生审查、申报 和内部审核文件。
临床试验项目培训---药物临床试验质量管理规范(GCP)ppt课件

在一名集中营囚犯身上诱导低温
减压实验,杀死了一名囚犯
9
Hale Waihona Puke 相关国际法规的发展历程-6
1947 年的纽伦堡审判
骇人听闻的纳粹实验暴露给公众 23 名纳粹医生 受到了战争罪行的审判
一名波兰证人在法庭展示了气性坏 疽实验给腿部留下的伤疤
纳粹医生 Karl Brandt 被 判处死刑
10
相关国际法规的发展历程-7
的概念
1978 年 , Belmont 报告(美国国家委员会为保护参加生物医学和 行为学研究的人体实验对象而制定的道德原则和准则)
1974 年,美国国会任命了一个国家委员会,以保护参加临 床研究的受试者
审核临床研究的伦理原则 :
自主性 受益性 公正性
16
相关国际法规的发展历程-13
念; FDA 提出了临床试验质量管理规范的概念; ICH 提供了临床研究中的全球性指导原则。
21
我国新药管理与GCP发展概况
22
我国新药管理与GCP发展概况-1
1963年卫生部、化工部、商业部《关于药政管理的若干规定》 是我国最早关于药品临床试验的规定; 1965年卫生部、化工部《药品新产品管理暂行规定》; 1978年国务院《药政管理条例》; 1979年卫生部《新药管理办法》; 1985年《中华人民共和国药品管理法》; 1985年卫生部《新药审批办法》标志我国的新药管理进入法制 化时期; 1988年卫生部《关于新药审批管理若干补充规定》,同时颁发 了15类药物的临床试验指导原则; 1992年卫生部《关于药品审批管理若干问题的通知》。
公众到美国国会群起抗议示威; 1906 年,通过 “完全食品与药物法 ”,食品与
药品管理局 (FDA) 诞生; 要求每种药物的标签必须准确; 未要求检测安全性。
药物临床试验质量管理规范培训PPT课件

案,由FDA强制实施。其中规定药品上市前必 须进行安全性临床试验,并通过新药审批程序 提交安全性临床试验的结果证明。
12
1961年国际著名药灾反应停事件
1957年首先在德国作为镇静安眠剂应用于妇女妊娠 呕吐的治疗,先后在加拿大、日本、欧洲、澳洲、 南美洲及非洲等17个国家上市使用。
1961年,澳大利亚医生最先提出一些胎儿出生畸形, 怀疑可能与妇女妊娠期间服用沙利度胺有关。
肿 心呼消 内 泌感精
瘤 血吸化 分 尿染神
管
泌
31
新专业检查要点
专业负责人 的情况; 人员培训 情况(研究人员、护士)--证书; GCP知识考核 提问; 专业的门诊量,床位数,病种量; 专业的必要设备 ; 重症监护病房、急救药物 ; 试验用药品及专用储藏设施; 资料保管柜 ; 临床试验管理制度和标准操作规程 。
8
一、《中华人民共和国药品管理法》 第30条:药物的非临床安全性评价机构和临床试验 机构必须分别执行药物非临床研究质量管理规范、 药物临床试验质量管理规范。
二、《中华人民共和国药品管理法实施条例》 第28条:药物临床试验机构必须执行《药物临床试 验质量管理规范》。
三、《药品注册管理办法》(试行) 第24条:药物临床研究必须经国家药品监督管理局 批准后实施,必须执行《药物临床试验质量管理规 范》。
药物临床试验质量 管理规范(GCP)
1
内容
一. GCP的概念 二. 实施GCP的依据 三. GCP产生的背景与现状 四. GCP的主要内容
2
GCP的概念
定义: 药物临床试验全过程的标准规定,
包括方案设计、组织、实施、稽查、检 查、记录、分析总结和报告。
GCP是新药研发过程中所推行的标 准化规范之一。
12
1961年国际著名药灾反应停事件
1957年首先在德国作为镇静安眠剂应用于妇女妊娠 呕吐的治疗,先后在加拿大、日本、欧洲、澳洲、 南美洲及非洲等17个国家上市使用。
1961年,澳大利亚医生最先提出一些胎儿出生畸形, 怀疑可能与妇女妊娠期间服用沙利度胺有关。
肿 心呼消 内 泌感精
瘤 血吸化 分 尿染神
管
泌
31
新专业检查要点
专业负责人 的情况; 人员培训 情况(研究人员、护士)--证书; GCP知识考核 提问; 专业的门诊量,床位数,病种量; 专业的必要设备 ; 重症监护病房、急救药物 ; 试验用药品及专用储藏设施; 资料保管柜 ; 临床试验管理制度和标准操作规程 。
8
一、《中华人民共和国药品管理法》 第30条:药物的非临床安全性评价机构和临床试验 机构必须分别执行药物非临床研究质量管理规范、 药物临床试验质量管理规范。
二、《中华人民共和国药品管理法实施条例》 第28条:药物临床试验机构必须执行《药物临床试 验质量管理规范》。
三、《药品注册管理办法》(试行) 第24条:药物临床研究必须经国家药品监督管理局 批准后实施,必须执行《药物临床试验质量管理规 范》。
药物临床试验质量 管理规范(GCP)
1
内容
一. GCP的概念 二. 实施GCP的依据 三. GCP产生的背景与现状 四. GCP的主要内容
2
GCP的概念
定义: 药物临床试验全过程的标准规定,
包括方案设计、组织、实施、稽查、检 查、记录、分析总结和报告。
GCP是新药研发过程中所推行的标 准化规范之一。
临床试验医学PPT课件

24
我国GCP临床试验方案内容(4)
(16) 评价试验结果采用的方法(如统计学方法)和从总 结报告中剔除病例的依据。 (17) 数据处理与记录保存的规定。 (18) 临床试验的质量控制与质量保证。 (19) 临床试验预期的进度和完成日期。 (20) 试验结束后的医疗措施。 (21) 如该试验方案同时作为合同使用时,应写明各方承 担的职责和论文发表等规定。 (22) 参考文献
23
我国GCP规定临床试验方案内容(3)
(10) 临床观察、实验检查的项目和测定次数、随访步骤, 保证受试者依从性的措施。 (11) 中止和停止临床试验的标准,结束临床试验的规定。 (12) 疗效评定标准、规定疗效评定参数的方法、观察时 间、记录与分析。 (13) 受试者的编码、治疗报告表、随机数字表及病例报 告表的保存手续。 (14) 不良反应的评定记录和严重不良事件的报告方法, 处理并发症的措施以及事后随访的方式和时间。 (15) 试验密码的建立、保存、紧急情况下何人破盲和破 盲方法的规定。
3
名词释义
• 临床试验(Clinical trial): 指任何在人体(病人或健 康志愿者)进行药品的系统性研究,以证实或揭示试 验用药品的作用、不良反应及/或试验用药品的吸收、 分布、代谢和排泄,目的是确定试验用药品的疗效与 安全性。 • 试验方案( Protocol):叙述试验的背景、理论基础 和目的,以及试验设计、方法和组织,包括统计学考 虑、试验执行和完成的条件。方案必须由参加试验的 主要研究者、研究机构和申办者签章并注明日期。
21
我国GCP规定临床试验方案内容(1)
• 我国GCP规定,临床试验前应制定试验方案。该方案由 研究者与申办者共同商定并签字, 报伦理委员会审批 后实施。临床试验方案应包括以下内容: (1) 临床试验的题目和立题理由。 (2) 试验的目的、目标;试验的背景,包括试验用药 品的名称、非临床研究中有临床意义的发现和与试 验有关的临床试验发现,已知对人体的可能危险与 受益。 (3) 进行临床试验的场所,申办者的姓名、地址;试 验研究者的姓名、资格和地址。 (4) 试验设计包括对照或开放、平行或交叉、双盲或 单盲、随机化方法和步骤、单中心或多中心等
我国GCP临床试验方案内容(4)
(16) 评价试验结果采用的方法(如统计学方法)和从总 结报告中剔除病例的依据。 (17) 数据处理与记录保存的规定。 (18) 临床试验的质量控制与质量保证。 (19) 临床试验预期的进度和完成日期。 (20) 试验结束后的医疗措施。 (21) 如该试验方案同时作为合同使用时,应写明各方承 担的职责和论文发表等规定。 (22) 参考文献
23
我国GCP规定临床试验方案内容(3)
(10) 临床观察、实验检查的项目和测定次数、随访步骤, 保证受试者依从性的措施。 (11) 中止和停止临床试验的标准,结束临床试验的规定。 (12) 疗效评定标准、规定疗效评定参数的方法、观察时 间、记录与分析。 (13) 受试者的编码、治疗报告表、随机数字表及病例报 告表的保存手续。 (14) 不良反应的评定记录和严重不良事件的报告方法, 处理并发症的措施以及事后随访的方式和时间。 (15) 试验密码的建立、保存、紧急情况下何人破盲和破 盲方法的规定。
3
名词释义
• 临床试验(Clinical trial): 指任何在人体(病人或健 康志愿者)进行药品的系统性研究,以证实或揭示试 验用药品的作用、不良反应及/或试验用药品的吸收、 分布、代谢和排泄,目的是确定试验用药品的疗效与 安全性。 • 试验方案( Protocol):叙述试验的背景、理论基础 和目的,以及试验设计、方法和组织,包括统计学考 虑、试验执行和完成的条件。方案必须由参加试验的 主要研究者、研究机构和申办者签章并注明日期。
21
我国GCP规定临床试验方案内容(1)
• 我国GCP规定,临床试验前应制定试验方案。该方案由 研究者与申办者共同商定并签字, 报伦理委员会审批 后实施。临床试验方案应包括以下内容: (1) 临床试验的题目和立题理由。 (2) 试验的目的、目标;试验的背景,包括试验用药 品的名称、非临床研究中有临床意义的发现和与试 验有关的临床试验发现,已知对人体的可能危险与 受益。 (3) 进行临床试验的场所,申办者的姓名、地址;试 验研究者的姓名、资格和地址。 (4) 试验设计包括对照或开放、平行或交叉、双盲或 单盲、随机化方法和步骤、单中心或多中心等
临床试验PPT课件(2024版)

什么是盲底?
❖ 盲底是在临床试验中采用随机化方法确定的 每个受试者接受何种处理(试验组或对照组) 的随机安排。也可以通俗地说是受试者的详 细分组情况。
❖ 双盲试验中每个盲底中有三个信封:①药物 编号盲底,供药物编码用;②第一次揭盲盲 底;③第二次揭盲盲底。
应急信件何时拆阅及处理?
❖ 随试验用药物下发到主要研究者手中的应急 信件只有在该受试者发生严重不良事件时, 需立即查明所服药物的种类,此时,研究单 位的负责研究者应拆阅应急信件,即紧急揭 盲。
❖ II期临床试验:治疗作用初步评价阶段。其目 的是初步评价药物对目标适应症患者的治疗 作用和安全性,也包括为III期临床试验研究 设计和给药剂量方案的确定提供依据。
❖ III期临床试验:治疗作用确证阶段。其目的是进一 步验证药物对目标适应症患者的治疗作用和安全性, 评价利益与风险关系,最终为药物注册申请获得批 准提供充分的依据。
❖ 药物临床试验方案由研究者和申办者共同商 定并签字和注明日期,报伦理委员会审批后 实施 。
临床试验设计的基本原则是什么 ?
❖ 临床试验设计的基本原则是必须遵循对照、 随机和重复的原则,这些原则是减少临床试 验中出现偏倚的基本保障 。
受试者入选年龄界限 ?
❖ Ⅱ期、Ⅲ期、Ⅳ期临床试验受试者年龄在 18~65岁之间。
我国对临床试验的资料保存时间有何 规定 ?
❖ 研究者— 临床试验结束后5年 ❖ 申办者— 试验药物获准上市后5年
监查、稽查和视察有何不同 ?
❖ 监查(monitoring):指临床试验申办单位委派人 员对临床试验情况进行检查,以保证临床试验数据 的质量并保护受试者的安全和合法权益。
❖ 稽查(Audit):指由不直接涉及试验的人员所进行 的一种系统性检查,以评价试验的实施、数据的记 录和分析是否与试验方案、标准操作规程以及药物 临床试验相关法规要求相符。
临床试验的PPT课件

三、受试者工作特性曲线(ROC曲线)
用真阳性率和假阳性率作图所得出的曲线, 表示灵敏度和特异度之间的相互关系。 ROC曲线常被用来决定最佳临界点。
ROC曲线也可用来比较两种和两种以上诊 断试验的诊断价值,从而帮助临床医师对 诊断试验作出最佳选择。
ROC曲线是一种全面、准确评价诊断试验
非常有效的方法,并可以比较两种或多种 诊断试验的诊断价值,可通过计算ROC曲 线下的面积(AUCROC)来比较几种诊断试 验的诊断效率。 AUCROC越大,越接近1.0, 诊断的真实度越高, AUCROC越接近0.5,则 诊断的真实度越差。
的筛检试验。
二、用于筛检的诊断试验
诊断筛查试验的特点: 1、灵敏度和特异度较高 2、试验方法必须简便、快速和价廉 3、试验方法很安全 4、采用的筛检试验必须为患者所接受,
依从率高
三、筛查和早期诊断试验有效性的评判标准
1、是否有临床RCT证据证明早期诊断的确改善了生 存期或生命质量
2、病人如果被早期诊断,是否愿意依从治疗 3、应当有在不同人群和不同的筛查措施间进行比较 4、是否有能力和足够的资源进行这项筛查
1、住院、急诊病人或外地门诊病人复诊有 困难时,急需迅速作出诊断。
2、需要一种很灵敏的试验,但手中只有两 项或两项以上不太灵敏的试验,组合成平 行试验特别有用。
3、较单项试验提高了灵敏度和阴性预测值 使疾病漏诊减少,但降低特异度和阳性预 测值,故可能作出假阳性诊断。
系列试验适用情况:
1、不需迅速作出诊断,但需增加诊断的正确性。 2、当某些试验昂贵且有危险时,较简单安全的试验可先
联合灵敏度和特异度的计算方法:
(1)系列试验
(2)平行试验
第五节 疾病早期诊断
一、疾病早期诊断的意义 早期诊断是指临床出现症状之前的诊断,为临床前期诊 断,列入二级预防的范畴。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
临床试验项目管理初探
1
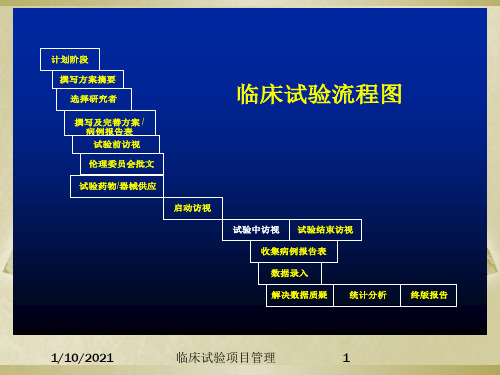
计划阶段 撰写方案摘要 选择研究者 撰写及完善方案 / 病例报告表 试验前访视 伦理委员会批文 试验药物/器械供应 启动访视 试验中访视 试验结束访视
临床试验流程图
收集病例报告表 数据录入 解决数据质疑 统计分析 终版报告
2
临床试验项目的基本要素
产品
(临床试验报告)
时间表
资源
• 方案+CRF • 参与人员 • 机构口碑
21
质量管理(2)-质量就是生命
试验进行阶段质量管理:
• 监察 • 稽查 • CRC
22
• 确认受试者符合入组标准; • 确认试验按试验方案进行所有访视;
• 随时纠正违背方案的事件。
23
质量管理(3)-质量就是生命
试验结束阶段质量管理:
• 数据和统计
VITAL SIGNS Weight (without shoes) (kg) Sitting Blood Pressure and Heart/Pulse Rate Prior to any blood pressure measurements being taken, subjects should have rested in the clinic for at least 5 minutes. Blood pressure must be measured in the same arm at each visit. Have blood pressure and heart/pulse rate been taken at this visit? No end of the CRF. Is there any clinically significant abnormality? No Yes Arm : please record details in Significant Medical/Surgical History page. Left Right Yes Please record the results in the Vital Signs Log at the Height (m)
• 注意:逻辑性 (不良事件&合并用药) 多选挑一(是&否) 不可空格(DM问题来源)
265805/249
Visit Date DD MM YY
DEMOGRAPHY Male Female
Date of Birth DD Race: White MM YY Black
Sex Chinese
Other: specify:
临床试验项目的生命周期
立项 计划(试验前)
实施(试验中)
结束(试验后)
4
临床试验项目管理要素
文件管理
进度管理
质量管理
风险管理
5
文件管理(1)
试验前文件内容:
• 试验文件(研究者手册、签字方案、病例报告表、知 情同意书) • 批文(CFDA批文、伦理委员会批件及其成员) • 签字合同(研究者合同、财务规定) • 试验器械药品器械接收单和检测报告 • 实验室文件(正常值范围、质控证明) • 研究者简历、研究者授权表及相关文件
12
• 更改有原始数据支持 • 在错误上划横杠、旁加正确内容 • 研究者签署姓名和日期
082 086
SXC 25/2/04
• 监查员确保CRF与原始资料相一致
13
文件管理(2)
• 临床试验进行阶段:
• 更新文件 • 填写后的知情同意书、CRF
• 严重不良事件报告及原始文件
• 受试者筛选表登记表 • 试验药品管理记录表
24
临床试验项目管理要素
文件管理
进度管理
质量管理
风险管理
25
风险管理
风险来自哪里??
26
经费管理!
27
谢谢!
28
10
• 不良事件原始记录应涵盖如下内容:
• 不良事件的描述 • 发生时间 • 终止时间 • 疾病程度 • 发作特点(频度) • 是否需要治疗 • 研究者判断是否与研究药物有关
11
• 依据原始文件 • 及时、完整、准确 • 清晰、易认、采用黑色圆珠笔
Protocol Centre Number Subject Number Subject Initials Screening
6
临床试验方案:
• 方案的形成过程中需申办者与研究者讨论,并严格 遵守中国注册法规要求。 • 方案必须经过伦理委员会书面批准。 • 方案终稿需有研究者签名,并声明遵循方案实施该 试验。
7
• 知情同意书是临床试验的重要文件,怎样强调也不过分!
• 知情同意书过程也重要。
• 受试者参加临床试验前应签署知情同意书,所以受试者签署 姓名和时间是非常重要的文字证明。
17
进度管理(2)
试验进行阶段进度管理:
• 定期随访 • 定期填表 • 感情沟通
18
进度管理(3)
试验结束阶段进度管理:
• CRF收集 • 数据录入 • 统计分析 • 临床报告 • 机构盖章
19
临床试验项目管理要素
文件管理
进度管理
质量管理
风险管理
20
质量管理(1)-质量就是生命
试验开始阶段质量管理:
14
文件管理(3)
试验结束阶段
• 试验用药的回收和销毁 • CRF的回收及数据的质疑
• 试验文件完整性的确认
• 伦理委员会的通报 • 临床试验的报告
15
临床试验项目管理要素
文件管理
进度管理
质量管理
风险管理
16
进度管理(1)
试验前进度管理:
• 文件准备(方案+CRF+基本文件) • 人员准备(医院筛选+统计) • 物资准备(试验器械+对照器械)
• 知情同意书时间至少与访视1同日。
8
• 原始文件是指原始的资料、数据和记录。
• 病历 • 实验室报告
• 受试者日记
• 药品发放记录等 • 原始文件用于证明临床试验数据的真实性、准确、可靠的证据。
• 满足方案要求
• 提供所有CRF要求的数据 • 原则上,是不容改动的
9
• 病例至少应包括的内容:
• 病史(患病时间等) • 目前身体状况、伴随疾病和用药 • 近期停止用药时间(满足方案要求) • 受试者参加临床试验号/签署知情同意书 • 访视日期 • 实验室/X-线等结果 • 试验用药数量及伴随治疗记录
1
计划阶段 撰写方案摘要 选择研究者 撰写及完善方案 / 病例报告表 试验前访视 伦理委员会批文 试验药物/器械供应 启动访视 试验中访视 试验结束访视
临床试验流程图
收集病例报告表 数据录入 解决数据质疑 统计分析 终版报告
2
临床试验项目的基本要素
产品
(临床试验报告)
时间表
资源
• 方案+CRF • 参与人员 • 机构口碑
21
质量管理(2)-质量就是生命
试验进行阶段质量管理:
• 监察 • 稽查 • CRC
22
• 确认受试者符合入组标准; • 确认试验按试验方案进行所有访视;
• 随时纠正违背方案的事件。
23
质量管理(3)-质量就是生命
试验结束阶段质量管理:
• 数据和统计
VITAL SIGNS Weight (without shoes) (kg) Sitting Blood Pressure and Heart/Pulse Rate Prior to any blood pressure measurements being taken, subjects should have rested in the clinic for at least 5 minutes. Blood pressure must be measured in the same arm at each visit. Have blood pressure and heart/pulse rate been taken at this visit? No end of the CRF. Is there any clinically significant abnormality? No Yes Arm : please record details in Significant Medical/Surgical History page. Left Right Yes Please record the results in the Vital Signs Log at the Height (m)
• 注意:逻辑性 (不良事件&合并用药) 多选挑一(是&否) 不可空格(DM问题来源)
265805/249
Visit Date DD MM YY
DEMOGRAPHY Male Female
Date of Birth DD Race: White MM YY Black
Sex Chinese
Other: specify:
临床试验项目的生命周期
立项 计划(试验前)
实施(试验中)
结束(试验后)
4
临床试验项目管理要素
文件管理
进度管理
质量管理
风险管理
5
文件管理(1)
试验前文件内容:
• 试验文件(研究者手册、签字方案、病例报告表、知 情同意书) • 批文(CFDA批文、伦理委员会批件及其成员) • 签字合同(研究者合同、财务规定) • 试验器械药品器械接收单和检测报告 • 实验室文件(正常值范围、质控证明) • 研究者简历、研究者授权表及相关文件
12
• 更改有原始数据支持 • 在错误上划横杠、旁加正确内容 • 研究者签署姓名和日期
082 086
SXC 25/2/04
• 监查员确保CRF与原始资料相一致
13
文件管理(2)
• 临床试验进行阶段:
• 更新文件 • 填写后的知情同意书、CRF
• 严重不良事件报告及原始文件
• 受试者筛选表登记表 • 试验药品管理记录表
24
临床试验项目管理要素
文件管理
进度管理
质量管理
风险管理
25
风险管理
风险来自哪里??
26
经费管理!
27
谢谢!
28
10
• 不良事件原始记录应涵盖如下内容:
• 不良事件的描述 • 发生时间 • 终止时间 • 疾病程度 • 发作特点(频度) • 是否需要治疗 • 研究者判断是否与研究药物有关
11
• 依据原始文件 • 及时、完整、准确 • 清晰、易认、采用黑色圆珠笔
Protocol Centre Number Subject Number Subject Initials Screening
6
临床试验方案:
• 方案的形成过程中需申办者与研究者讨论,并严格 遵守中国注册法规要求。 • 方案必须经过伦理委员会书面批准。 • 方案终稿需有研究者签名,并声明遵循方案实施该 试验。
7
• 知情同意书是临床试验的重要文件,怎样强调也不过分!
• 知情同意书过程也重要。
• 受试者参加临床试验前应签署知情同意书,所以受试者签署 姓名和时间是非常重要的文字证明。
17
进度管理(2)
试验进行阶段进度管理:
• 定期随访 • 定期填表 • 感情沟通
18
进度管理(3)
试验结束阶段进度管理:
• CRF收集 • 数据录入 • 统计分析 • 临床报告 • 机构盖章
19
临床试验项目管理要素
文件管理
进度管理
质量管理
风险管理
20
质量管理(1)-质量就是生命
试验开始阶段质量管理:
14
文件管理(3)
试验结束阶段
• 试验用药的回收和销毁 • CRF的回收及数据的质疑
• 试验文件完整性的确认
• 伦理委员会的通报 • 临床试验的报告
15
临床试验项目管理要素
文件管理
进度管理
质量管理
风险管理
16
进度管理(1)
试验前进度管理:
• 文件准备(方案+CRF+基本文件) • 人员准备(医院筛选+统计) • 物资准备(试验器械+对照器械)
• 知情同意书时间至少与访视1同日。
8
• 原始文件是指原始的资料、数据和记录。
• 病历 • 实验室报告
• 受试者日记
• 药品发放记录等 • 原始文件用于证明临床试验数据的真实性、准确、可靠的证据。
• 满足方案要求
• 提供所有CRF要求的数据 • 原则上,是不容改动的
9
• 病例至少应包括的内容:
• 病史(患病时间等) • 目前身体状况、伴随疾病和用药 • 近期停止用药时间(满足方案要求) • 受试者参加临床试验号/签署知情同意书 • 访视日期 • 实验室/X-线等结果 • 试验用药数量及伴随治疗记录
