超氧阴离子清除实验
超氧阴离子清除能力邻苯三酚法

超氧阴离子清除能力邻苯三酚法1 超氧阴离子的来源超氧阴离子(O2•-)是一种高活性自由基,是氧气分子失去一个电子后产生的。
在生物体内,超氧阴离子通常由线粒体电子传递链产生,同时也可以由细胞质中的NADPH氧化酶生成。
2 超氧阴离子的损害超氧阴离子是一种极其活泼的氧化剂,可以与细胞内的脂质、蛋白质和核酸等大分子发生氧化反应,并引起细胞的损害。
长期以来,科学家们一直在研究如何有效地清除超氧阴离子,以保护细胞免受其损害。
3 邻苯三酚法的原理邻苯三酚法是一种用于清除超氧阴离子的方法,该方法利用邻苯三酚的还原能力,将超氧阴离子还原成氧气分子,以达到清除超氧阴离子的目的。
邻苯三酚法的原理如下:① 邻苯三酚在氧气存在下被氧化成半醌,1C6H5-1C(OH)2-2C6H4 +O2 →C6H5-1C(O)2-2C6H4+H2O2② 半醌进一步被氧化成互相联结的二聚体,1C6H5-1C(O)2-2C6H4+C6H5-1C(O)2-2C6H4→(C6H5-1C(O)2-2C6H4)22③ 该反应同时产生超氧阴离子,1O2 +e-→O2•-2导致增加超氧阴离子的浓度。
④ 当邻苯三酚浓度超过一定程度时,它具有还原能力,可以将超氧阴离子还原为氧气分子,1O2•- + 2C6H5-1C(O)2-2C6H4→2C6H5-1C(OH)2-2C6H4 +O24 邻苯三酚法的应用邻苯三酚法已被广泛用于生物学、医学和环境科学等领域。
在生物学中,这种方法被用于研究超氧阴离子在细胞中的作用。
在医学中,邻苯三酚法被应用于治疗一些慢性气道疾病,如支气管哮喘。
在环境科学中,邻苯三酚法也被用于去除环境中的有害物质,如重金属离子。
5 邻苯三酚法的不足虽然邻苯三酚法是一种有效清除超氧阴离子的方法,但它也存在一些不足之处。
一方面,邻苯三酚的使用受到其毒性和生物可降解性的限制;另一方面,邻苯三酚的还原能力相对较弱,反应速度较慢,因此需要较长时间来消除超氧阴离子。
超氧阴离子清除实验

·O2ˉ自由基清除实验(1) 实验原理黄嘌呤氧化酶黄嘌呤+H2O+O2尿酸+H2O2+·O2¯即黄嘌呤氧化酶在有氧条件下催化黄嘌呤转化为尿酸,同时产生超氧阴离子自由基(·O2¯)。
·O2¯与NBT结合后呈蓝色,样品清除能力越大,与NBT结合的·O2¯越少,溶液的颜色越浅。
(2)试剂Xanthine(黄嘌呤): (C5H4N4O2 ), MW=152.1, 6.084mg/100mL(0.4mmol/l)实际配制:1.216mg/10mL,与NBT等体积混合使用Xanthine oxidase(黄嘌呤氧化酶)贮液: 1 unit/mL , (溶解酶的溶液要高压灭菌!防止蛋白酶对酶的降解!)0.05 unit/mL,每次取200uL稀释到4mL(PBS溶解)NBT: (Nitro blue tetrazolium chloride氯化硝基四氮唑蓝), MW=817.65,黄色19.6236mg/100mL(0.24mmol/l)实际配制3.925mg/10mL,与Xanthine等体积混合使用PBS(0.01mol/L,pH=8.0): NaCl 8g, KCl 0.2g, Na2HPO4(无水) 1.44g, KH2PO4 0.24g,800mL水,用NaOH(1M)调pH到8.0,定容到1000mL。
实际配制500mL。
高压灭菌,室温保存。
PBS(0.01mol/L,pH=7.4): 配制同上Ascorbic acid: MW=176.12 母液为1mg/mL 先两倍逐级稀释5个浓度实际配制见记录本!HCl(1M): MW=36.5 310ul/10ml.(36% HCl密度1.18g/ml)实际配制:800uL浓盐酸+9mL水,于塑料管中4℃保存。
NaOH(1M): MW=40 0.4g/10mL, 存于冰箱(3) 测定方法超氧阴离子自由基清除能力的测定参照Bae等人的方法略加改进。
清除超氧阴离子自由基

清除超氧阴离子自由基
取0.05mol/L Tris-HCl 缓冲液(PH8.2)5ml ,置于25℃水浴中预热20min ,分别加入4ml 不同浓度的提取液,25℃水浴中预热20min ,再加入3mmol/L25℃水浴中预热20min 的邻苯三酚溶液1ml ,混匀后于25℃水浴中准确反应5min ,加入10mol/LHCl 1ml 终止反应,于320nm 处测定吸光度,空白对照组以相同体积的蒸馏水代替样品。
每个试样作三个平行样,取其平均值。
实验结果以清除率E 表示: E=空白
样品空白A A A -×100% A 样品用相同样品浓度的空白调零,消除样品颜色的影响。
注:A 空白是不加样液测一值(A 0),A 样品空白(A x0)是只加样液,其他用水代替。
2.5.2.3清除羟自由基
于试管中分别加入不同浓度的提取液2ml ,9mmol/L 水杨酸-乙醇2ml ,9mmol/L FeSO 4 2ml ,最后加入2ml 8.8mmol/L H 2O 2 启动反应,37℃反应15min ,以蒸馏水为空白对照,在510nm 下测量各待测液的吸光度。
考虑到本身的吸光值,以9mmol/L 水杨酸-乙醇2ml ,9mmol/L FeSO 4 2ml ,蒸馏水2ml ,不同浓度的样品溶液2ml 为提取液的本底吸收。
清除率的计算公式为:
·OH 清除率=0
)0x x (0A A A A --×100% 式中:A0为空白对照液的吸光度,Ax 为加入样品液后的吸光度,Ax0为提取液本底的吸光度。
中药对超氧阴离子自由基清除率的测定

第1 期
林祥 潮等 :中药对 超氧 阴 离子 自由基 清 除率 的测 定
3 3
在表 l 示 的光度 法 中,羟 胺氧 化法 由于 甲萘 胺溶 液不 稳定 ,因而 线性相 关性较 差 ;氯 所 化硝 基 四氮 唑蓝还 原法 和 四 甲基 偶氮 唑盐还 原法 都 需要 昂贵 的氮 唑类 化合 物 ; 照核黄 素法 光 中硫 代碳 酰腙 类化 合物 需要 合成 ;酶催 化法 需要 昂贵 的酶试 剂且 测定 条件 苛刻 ;而本 方法 只 需 用天 青 I 为指 示物 质 ,指示 反应简 单直 接 ,且指 示物质 易得 价廉 ,体 系稳 定性好 ,能快 作
液后 , 向其 中一 支加 入 08 0mmo L的邻 苯三 酚溶 液 ,另一支 不加 。分 别用水 稀释 至 .0 3 mL l /
刻度 ,在 室温 下反应 1 n 5 mi,以水 为参 比,用 1 m 比色皿在 6 2 l 波长 处测 定体 系 的吸光 c 0 Y nl
度 。设不加 邻苯 三酚 时体 系 的吸光度 为 o ,加 入邻 苯三 酚后 体系 的吸光 度 为 1 ,则超氧 自
超氧 阴离 子 自由基 ( 2・ 0 。)作 为生物 体所产 生 的一种 自由基 ,大 量研 究证 明 , 自由基 的
作用 与 生物 衰老 、某些 疾病 的发病 机制 密切相 关 。关 于它 的清 除方法 ,光度 测 定 已有 一些报 道 【 ] 以天青 I为指示 物质 ,褪 色光 度法 测定 中药 清 除超氧 阴 离子 自由基 未见 报 道 。本 1 ,但 文研 究发现 ,在一 定条 件下 ,天 青 I 能被超 氧 阴离子 自由基氧 化而褪 色 ,中药提 取物 可 以清
度值 记为 2 。 超氧 自由基清 除率 R % : 二 × 0 / 10 4
超氧阴离子清除能力检测试剂盒说明书 可见分光光度法

第1页,共2页超氧阴离子清除能力检测试剂盒说明书可见分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC1410规格:50T/48S 产品内容:提取液:液体50mL×1瓶,4℃保存。
试剂一:液体2mL×1瓶,4℃避光保存。
试剂二:粉剂×1瓶,4℃避光保存。
临用前加8mL蒸馏水充分溶解。
试剂三:液体10mL×1瓶,4℃保存。
试剂四:液体10mL×1瓶,4℃避光保存。
试剂五:液体10mL×1瓶,4℃避光保存。
产品说明:超氧阴离子自由基作为生物体代谢过程中产生的一种自由基,可攻击生物大分子,如脂质、蛋白质、核酸和聚不饱和脂肪酸等,使其交链或者断裂,引起细胞结构和功能的破坏,与机体衰老和病变有很密切的关系,清除超氧阴离子自由基的研究已经得到了广泛的关注。
AP-TEMED系统产生超氧阴离子,与盐酸羟胺反应生成NO 2-,NO 2-与对氨基苯磺酸和α-萘胺的作用生成红色的偶氮化合物,在530nm处有特征吸收峰,样品对超氧阴离子的清除能力与530nm的吸光值呈负相关。
自备实验用品及仪器:天平、研钵、低温离心机、可见分光光度计/酶标仪、1ml玻璃比色皿、恒温水浴锅。
操作步骤:一、样品处理1.组织:按照质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g,加入1mL提取液)加入提取液,冰浴匀浆后于4℃,10000g离心10min,取上清置于冰上待测。
2.细胞:按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细胞加入1mL提取液),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后4℃,10000g离心10min,取上清置于冰上待测。
3.培养液或其它液体:直接检测。
4.粉剂药物可配制成相同浓度,比如1mg/mL。
二、测定操作空白管对照管测定管试剂一(μL)404040试剂二(μL)160160H2O(μL)260100充分混匀,25℃反应1min样品(μL)100试剂三(μL)200200200充分混匀,37℃反应30min试剂四(μL)200200200试剂五(μL)200200200充分混匀,37℃显色20min,于1ml玻璃比色皿,以空白管调零,在530nm处测定对照管和测定管的吸光值,分别记为A对照管和A测定管。
牛磺酸清除超氧阴离子和羟自由基的实验研究

2 . D e p a t r m e n t fP o h a r m a c y ,S h e n z h e n F o u r t h P e pl o e &H o s p i t a l ,S h e n z h e n 5 1 8 0 3 3 ,C h i n a)
Z H E N G J i a —j i a ,UN Y i n g ,Z E N G F a n—t a o
( 1 . D e p a r t m e n t o fP h a r ma c y ,T h e S e c o n d P e o p l e s ' H o s p i t a l o fL o n g g a n g D i s t r i c t ,S h e n z h e n 5 1 8 1 1 2 ,C h i n a ;
i d e a n i o n a n d o f t a u r i n e’ s f u n c t i o n o n t h e s c a v e n g i n g o f h y d r o x y l r a d i c a l s t o s t u d y he t a n t i o x i d a n t a c t i v i t y o f
Ex p e r i me n t a l S t u d y o n Ta u r i n e Cl e a r i n g S u p e r o x i d e An i o n Ra d i c a l a n d Hy d r o x y l F r e e Ra ic d a l
t a u r i n e . Re s u l t s :E f e c t o f t a u i r n e o n s u p e r o x i d e a n i o n r a d i c l a a n d h y d mx y l r a d i c a l s c a v e n g i n g i s s t r o n g, a n d i t wi l l i n c r e a s e wi t h t h e a d d e d a mo u n t o f t a u i r n e i n a c e r t a i n r a n g e . Co n c l u s i o n s :T h e bi a l i t y o f t a u r i n e’ S a n t i o x i d a n t i s
芦荟中芦荟苷清除超氧阴离子自由基的ESR研究_陈丹

组别
动物数 (只 )
剂量 ( g /kg)
SOD 活力 ( U / L)
CAT 活力 ( @ 10- 4 )
G SH-PX 活力 ( U /L)
空白对照组
10
2032 ? 6912)
2. 962 ? 0. 4012)
13. 1 ? 3. 52)
模型组
10
962 ? 493
1. 713 ? 0. 401
7 9. 1 ? 2. 6
香菇多糖组
10
莲子多糖组
10
莲子多糖组
10
0. 1
1434 ? 5272)
3. 040 ? 0. 5572)
12. 5 ? 2. 91)Fra bibliotek0. 2
1822 ? 7682)
3. 476 ? 0. 7642)
13. 7 ? 3. 52)
0. 4
1685 ? 7442)
2. 885 ? 0. 5532)
剂量 ( g /kg)
血浆 LPO 水平
脑匀浆 LPO 水平
肝匀浆 LPO 水平
空白对照组
10
0. 151 ? 0. 0432)
0. 199 ? 0. 0332)
0. 158 ? 0. 0281)
模型组
10
0. 276 ? 0. 062
0. 412 ? 0. 085
0. 199 ? 0. 048
香菇多糖组
13. 9 ? 2. 02)
注: 与模型组相比 1) P < 0. 05, 2) P < 0. 01
N ote: 1) P < 0. 05, 2) P < 0. 01vs the m odel group 3. 2 芦 笋 多糖 对 衰 老模 型 小鼠 血 浆、肝 匀 浆和 脑 匀浆 中 模型成功。与模 型组比, 大、小 剂量莲 子多 糖组均 可显 著降 LPO 水平的影响模型组血浆、脑匀浆及肝匀浆 LPO 水平均明 低血浆及脑匀浆 LPO 水平 (P < 0. 01) , 小 剂量组明显 降低肝 显或显著高于空白对 照组 (P < 0. 05, P < 0. 01), 说明 造衰老 匀浆 LPO 水 平 (P < 0. 05)。见表 2 表 2 莲子多糖对衰老模型小鼠血浆、脑匀浆、肝匀浆中 LPO 水平的影响 ( x¸? s)
超氧阴离子自由基清除
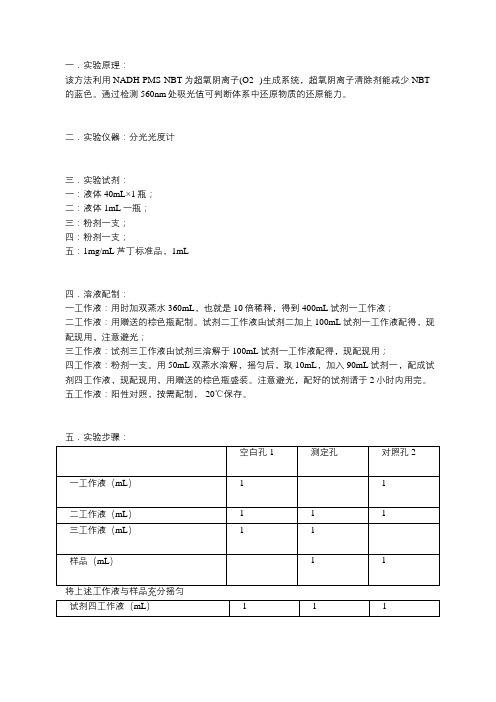
一.实验原理:该方法利用NADH-PMS-NBT为超氧阴离子(O2·-)生成系统,超氧阴离子清除剂能减少NBT 的蓝色。
通过检测560nm处吸光值可判断体系中还原物质的还原能力。
二.实验仪器:分光光度计三.实验试剂:一:液体40mL×1瓶;二:液体1mL一瓶;三:粉剂一支;四:粉剂一支;五:1mg/mL芦丁标准品,1mL四.溶液配制:一工作液:用时加双蒸水360mL,也就是10倍稀释,得到400mL试剂一工作液;二工作液:用赠送的棕色瓶配制。
试剂二工作液由试剂二加上100mL试剂一工作液配得,现配现用,注意避光;三工作液:试剂三工作液由试剂三溶解于100mL试剂一工作液配得,现配现用;四工作液:粉剂一支。
用50mL双蒸水溶解,摇匀后,取10mL,加入90mL试剂一,配成试剂四工作液,现配现用,用赠送的棕色瓶盛装。
注意避光,配好的试剂请于2小时内用完。
五工作液:阳性对照,按需配制,-20℃保存。
五.实验步骤:充分混匀,室温避光静置5min使之充分反应。
560nm处,1cm光径比色杯,采用分光光度计测定吸光值。
六.清除能力计算:超氧阴离子自由基清除(%)=[空白孔吸光值-(测定孔吸光值-对照孔吸光值)]/空白孔吸光值*100注: 1 如未做对照孔,可以将其视作为0;2 阳性对照求值时将其视作测定孔进行计算即可。
七.注意事项:1. 如样品中色素物质不是分析对象,建议先通过SEP C18柱进行脱色处理,处理后样品可不做对照孔;2. 如不确定样品的超氧阴离子自由基清除能力,可先做不同浓度的稀释液进行摸索,并选择适宜浓度进行测定,高浓度下,浓度与清除率间并不线性相关。
3. 试剂三建议全程冰上操作。
试剂四切记避光保存,特别是配制后,且应尽快用完。
建议在做好一切其它准备工作后再配制试剂四应用液。
试剂四正常颜色为黄色,强光照射下,5-10分钟内会变为绿色,随后变为蓝色,变色后试剂不可再用!4. 试剂二、三应用液和样品混匀后再加入试剂四,次序颠倒会导致不显色。
连苯三酚-邻苯三酚SOD 超氧自由基清除-过氧自由基清除-过氧阴离子自由基清除-超氧阴离子自由基清除

改进的连苯三酚法:一种适用于所有抗氧化剂超氧自由基(•O2-)清除试验(适用于SOD)【名词辨析】•O2-:该微粒既含有一个成单的电子,所以,可以属于自由基,又带一个单位负电荷,也属于阴离子。
所以,可以称为“超氧自由基”、“过氧自由基”、“过氧阴离子自由基”、“过氧阴离子”、“超氧阴离子自由基”、“超氧阴离子”。
SOD:过氧化物歧化酶,使过氧自由基发生岐化反应,而清除之。
连苯三酚:有些文献也称为“邻苯三酚”。
但邻苯三酚是不准确的名称。
因为分子含有三个取代基,应当称为“连”。
【操作示意图】操作示意图[1]操作示意图的说明:最初的连苯三酚(1,2,3-三羟基苯)法是专门为超氧化物歧化酶开发的,现在广泛用于测量其他抗氧化剂的超氧化物清除。
然而,强烈的pH影响被忽略了。
在本研究中,首次系统地研究了影响因素,大量实验证明pH值至关重要。
由于主要抗氧化剂含有羧酸、酯或内酯基团,pH 8.2应改为生理pH 7.4。
改进的程序如下。
将连苯三酚溶液(在1 M HCl中)与pH 7.4的Tris-HCl溶液充分混合;在37°C下每隔30秒测量一次A325nm值,持续5分钟。
由于ΔA325nm,控制值反映基质•O2-的初始浓度−, 应妥善控制,以保证方法的准确性。
改进的连苯三酚法是一种可靠且廉价的超氧自由基清除试验,适用于所有类型的抗氧化剂。
用石英比色皿,不能用玻璃比色皿,因为玻璃比色皿在325nm处有吸收。
【详细介绍】[1]有几种方法可以测定食品的超氧阴离子交换活性,包括细胞色素还原、硝基四氮唑蓝(NBT)、电子自旋共振(ESR)、化学发光、荧光和高效液相色谱。
所有这些方法都需要特殊且昂贵的仪器或生物试剂。
连苯三酚(1,2,3-三羟基苯)自氧化法相对便宜。
它最初由Marklund 专门为超氧化物歧化酶(SOD)而设计,而不是为其他抗氧化剂而设计。
近几十年来,由于其方便性,它还被用于测定其他抗氧化剂,如多酚、酚酸、单宁、黄酮、花青素、蒽醌、多糖,甚至各种营养添加剂和提取物。
抗氧化实验方法

附录抗衰老实验实验一:对超氧阴离子清除作用的测定(邻苯三酚自氧化法)一实验原理:超氧阴离子自由基产生体系模型:邻苯三酚在弱碱性(Tris-HCl缓冲液,pH8.2)溶液中自身氧化分解产生超氧阴离子的反应为:在一定条件下,随着反应的进行,生成的超氧阴离子在体系中会不断积累,导致反应液的吸光度(299nm波长)在反应开始后5min之内随时间变化而线性增大。
因此在该时间内,于299nm处测定含被测物反应液的吸光度随时间的变化率, 并与空白液比较便可得出被测物抑制超氧阴离子积累的作用能力。
抑制率可根据下式计算:式中F O和F X分别表示空白液和被测液的吸光度随时间的变化率二实验仪器和试剂:1 主要仪器:紫外可见分光光度计,恒温水浴锅,10mL试管,分析天平。
2 主要试剂:待测液,弱碱性(Tris-HCl)缓冲液,邻苯三酚溶液,HCL溶液。
三试剂配制:1、Tris碱溶液:6.05g定容于500mL水中,形成0.1mol/L的Tris碱溶液。
2、0.1mol/L HCL溶液:1.0mL浓盐酸(36%,11.6mol/L)加入91.4mL水中。
3、Tris-HCL缓冲液(0.05mlo/L,pH8.2):50mL的0.1mol/L的Tris碱溶液与22.9mL的0.1mol/L HCL溶液混合,定容至100mL。
4、25mmol/L 邻苯三酚溶液(焦性没食子酸):将0.0315g邻苯三酚定容于10mL水中。
现配现用,4h内有效。
四实验方法:1、取0.05mol/L pH8.2的Tris-HCl缓冲液4.5ml于试管中,置于25℃水浴中预热20min;2、分别加入1ml不同浓度的试样和0.4mL,25mmol/L的邻苯三酚溶液(2.5 mmol/L邻苯三酚(由10 mmol/L HCl配制)0.4 ml),混匀后于25℃水浴中反应5min;3、加入8mol/L 盐酸1.0ml终止反应,以Tris-HCl缓冲液作参比,空白组以0.1 ml蒸馏水代替样品试液,在299nm处测定吸光度,计算清除率。
清除超氧阴离子能

2.3试验方法
吸取不同质量浓度样品液1mL 于试管中,依次加 入1mL 0.078mol/LNBT,1mL 0.468mol/L NADH, 最后加入0.4mL 的0.06mol/L PMS 溶液,室温摇 匀,后静置5min,于560nm波长处测定吸光度, 调零组用不同质量浓度样品液1mL,0.4mL 蒸馏 水代替PMS 溶液调零,用蒸馏水作阴性对照,VC 作阳性对照,清除率计算
1.2试剂
Tris-HCl 缓冲溶液(三羟甲基氨基甲烷) 邻苯三酚 HCl 溶液
1.3仪器
紫外-可见分光光度计 真空干燥箱 电热恒温水浴锅 旋转蒸发仪
1.4试验方法:
【1】取4.5 mL 50mmol/L Tris-HCl 缓冲溶液(pH 8.2), 4.2 mL 蒸馏水,混匀后在25 ℃水浴中保温20 min,取出, 立即加入在25 ℃预热的3 mmol/L 邻苯三酚0.3 mL,迅速 摇匀后倒入比色杯, 于325 nm 处每隔30 s 测定吸光度, 计算线性范围内每分钟内吸光度的增加值, 以10mmol/L HCl 溶液配制空白为对照。 加入晒青毛茶不同溶剂提取物后, 邻苯三酚自氧化速率 的测定方法:按照上述步骤,在加入邻苯三酚前先分别加 入0.1 mL 不同浓度的样品液,蒸馏水减少。同样以10 mmol/L HCl 溶液配制空白管并作为对照。计算清除超氧 阴离子清除率。清除率:
【2】邻苯三酚自氧化法测定按参照文献[11]的方 法并略有改动,按照表3进行加样,在325 nm波长 下,每隔0.5 min记录一次值,连续记录3 min。样 品在同样条件下测定吸光值,每个处理试样均做3 个平行试验,取平均值。多糖对超氧阴离子的清除 作用按下列公式计算:
超氧阴离子自由基清除实验

超氧阴离子自由基清除实验
超氧阴离子自由基清除实验是一种用于测量超氧阴离子自由基(O2-)在发射光谱中的吸收程度的实验方法。
该实验需要设备有发射光谱仪、恒
定光源和荧光检测器。
实验步骤如下:1、将要测量的样品置于发射光谱
仪中,并调节恒定光源;2、将荧光检测器置于样品前,并开启荧光检测器;3、使用发射光谱仪测量样品发射光谱;4、计算发射光谱的吸收程度;
5、根据发射光谱的吸收程度和超氧阴离子自由基(O2-)的濃度,得出超
氧阴离子自由基(O2-)的清除量。
以上就是超氧阴离子自由基清除实验的实验过程,通过这个实验,可
以测量超氧阴离子自由基(O2-)的清除量,这对于环境中污染物的控制
有着非常重要的意义。
细胞内超氧阴离子产生及清除机制的研究

细胞内超氧阴离子产生及清除机制的研究细胞内超氧阴离子的产生及清除机制一直是细胞生物学领域的一个热门研究方向。
超氧阴离子是氧分子还原后的一种活性氧自由基,它在人体内的大量积累会引起多种疾病和衰老过程。
在这篇文章中,我们将探讨细胞内超氧阴离子产生及清除的相关机制。
细胞内产生超氧阴离子的途径细胞内产生超氧阴离子的途径有多种,包括线粒体呼吸链、NADPH氧化酶、xanthine氧化酶等。
其中,线粒体呼吸链是超氧阴离子产生的主要来源之一。
当线粒体内电子转运链出现故障或者过载时,就会导致线粒体内链中的电子被还原成超氧阴离子。
此外,线粒体外膜和内膜之间的通道贡献了细胞内大约30%的超氧阴离子产生量。
另一种超氧阴离子产生的途径是NADPH氧化酶,在炎症反应和细胞功能活性中发挥着关键作用。
NADPH氧化酶是细胞膜上的一种酶类,能够将细胞内的氧分子和NADPH还原成超氧阴离子和NADP+。
此外,xanthine氧化酶也是产生超氧阴离子的一种途径。
当细胞内的某些物质被分解成xanthine时,xanthine氧化酶就会将其还原成尿酸和超氧阴离子。
细胞内清除超氧阴离子的途径由于超氧阴离子具有强氧化性,会对细胞内分子结构、DNA、蛋白质等造成损伤。
因此,细胞内必须有一套完备的清除机制来调节超氧阴离子的产生和积累。
这些机制包含了多种酶类、分子和细胞器。
其中,超氧化物歧化酶是细胞内最主要的超氧阴离子清除酶。
它可以将两个超氧阴离子逐步转化成氧分子和氢氧离子,并在此过程中释放能量。
此外,过氧化氢酶和谷胱甘肽过氧化物酶也可以参与清除超氧阴离子。
细胞内一些小分子物质也能够清除超氧阴离子。
其中,维生素C和维生素E被广泛应用于细胞的氧化应激修复,它们可以直接参与清除细胞内的超氧阴离子,从而起到抗氧化的作用。
此外,一些微小RNA(miRNA)还被发现可以介导超氧阴离子的清除。
例如,miR-143被证明可以降低细胞内的超氧阴离子含量,从而保护细胞功能和健康。
抗氧化实验

抗氧化实验:,1,熊果酸对超氧阴离子自由基(O-2·)的清除实验本实验采用邻苯三酚自氧化法,即采用邻苯三酚自氧化法产生超氧阴离子,生成有色中间产物,吸光度随之增加,使吸光度值与反应时间呈良好的线性关系。
但是加入抗氧化性物质后会对其产生清除作用,从而对其进行抗氧化性能的评价。
取试管,加入不同浓度的熊果酸溶液(5mg/10mL)各50、100、200uL以及200uL Vc 进行阳性对照,同时分别取相同体积的甲醇做对照。
在试管中分别加入50mmol/L,pH8.3K2HPO4-KH2PO4缓冲液4.5mL.在25℃水浴锅保温10min,加入预热至25℃的50mmol/L邻苯三酚的盐酸溶液10uL迅速摇匀,倾入1cm的比色杯中,以缓冲液调零,在325nm处,每隔30s测吸光度1次,连续测定15min。
2熊果酸对羟自由基(·OH)的清除实验(1) 本实验采用Feton体系法产生羟自由基,即:H2O2+Fe2+ OH +H2O+Fe3+。
然后在体系中加入水杨酸捕捉羟自由基并产生有色物质,该物质在510nm处有最大吸收,可以利用该吸光度值来表示羟自由基的含量。
取不同的试管分别加入0.5mg/mL熊果酸标准品各50、100、200uL以及200uL甘露醇作为阳性对照。
再分别加入1mL9mmol/L水杨酸-乙醇溶液,1mL9mmol/L FeSO4,1mL8.8mmol/L H2O2, 用双蒸水补齐至5mL,充分摇匀,迅速倒入1cm的比色杯中,于510nm处测定其吸光度值,以甲醇调零。
可以根据吸光度值判断样品对羟自由基的清除作用。
(2)羟基自由基清除能力的测定。
量取0.2ml、0.4ml、0.6ml、0.8ml和1.0ml样品溶液于试管中,用蒸馏水补齐至1ml,依次加入0.15mol/L FeSO41ml、2mmol/L水杨酸1ml,最后加6mmol/L H2O2 1ml启动反应,37℃反应1h,测510nm的吸光度。
抗氧化测定方法(三种)

实验一超氧阴离子自由基清除能力的测定——抗氧化实验之一一、目的要求通过本实验掌握利用利用植物(或微生物发酵生产的原料)提取物进行超氧阴离子自由基清除能力测定的方法。
二、实验原理超氧阴离子自由基是生命活动代谢过程中产生的一种重要的自由基,超氧阴离子自由基具有很强的氧化能力,因此在抗氧化物性能的测定时,经常把清除超氧阴离子自由基作为其中一个重要的指标,产生超氧阴离子自由基的体系有多种,邻苯三酚自氧化法由于操作简单、反应灵敏等特点而被广泛采用。
邻苯三酚在碱性条件下迅速自氧化,在自氧化过程中会产生02﹣∙,02﹣∙能加速邻苯三酚自氧化速率,同时生成有色中间产物,中间产物的积累在滞后30s~45s 与时间呈良好的线性关系,一般维持4min左右,随后减慢.,有色产物在325nm 有强烈的光吸收,由于自氧化速率依赖于02﹣∙的浓度,清除02﹣∙就可以抑制自氧化反应,阻止中间产物的积累,从而达到清除超氧阴离子的目的。
三、器材及试剂(一)器材恒温水浴锅、控温电动搅拌器、电子天平、超滤器、电加热套、紫外分光光度计、旋转蒸发仪、超声波清洗仪等。
10ml比色管、秒表、比色皿、100ml容量瓶、温度计、微量取样器、移液管等。
(二)试剂邻苯三酚、三羟甲基氨基甲烷(Tris)、HCl、磷酸氢二钠、磷酸二氢钠、抗坏血酸、BHT等。
(1)pH8.2的Tris-HCl缓冲液(0.05mol/L,25℃):50ml 0.1mol/L三羟甲基氨基甲烷(Tris)溶液与22.9ml 0.1mol/L盐酸混匀后,加水稀释至100ml。
(2)0.2mmol/L邻苯三酚溶液(邻苯三酚用0.05mol/L的盐酸配制)四、操作步骤(一)样品的测定(1)先将提取物用双蒸水配制成不同浓度梯度,在10mL的比色管中分别加入4mL(0.05mol/L)pH8.2的Tris-HCl缓冲液,置于25℃水浴中预热20min,然后加入25℃水浴中预热20min不同浓度样品液1mL,再加入在25℃水浴中预热20min的0.2mmol/L邻苯三酚溶液1mL(邻苯三酚用0.05mol/L的盐酸配制),混匀后在25℃水浴中反应4min,立即用浓HCl两滴终止反应,并在325nm处测定吸光度(A样)。
超氧阴离子自由基清除能力 缩写

超氧阴离子自由基清除能力缩写超氧阴离子自由基(Superoxide anion radical, O2-)是一种重要的活性氧自由基,它在生物体内具有一定的清除能力。
本文将从超氧阴离子自由基的生成、作用机制以及清除能力等方面进行探讨。
一、超氧阴离子自由基的生成超氧阴离子自由基的生成主要通过氧化还原反应产生。
在生物体内,常见的生成方式有:1.线粒体呼吸链反应:在线粒体内,由于电子传递链的不完全还原,氧气(O2)可以被还原成超氧阴离子自由基。
2.酶催化反应:多种酶如超氧化物歧化酶、NADPH氧化酶等,能够催化超氧阴离子自由基的生成。
3.脂质过氧化反应:脂质与氧气反应,也能够产生超氧阴离子自由基。
二、超氧阴离子自由基的作用机制超氧阴离子自由基在生物体内具有复杂的作用机制,主要表现为:1.氧化反应:超氧阴离子自由基能够与其他分子发生氧化反应,导致氧化损伤。
例如,它可以氧化DNA、蛋白质和脂质,引发细胞损伤和衰老。
2.信号转导:适量的超氧阴离子自由基可以参与细胞信号转导,调节细胞生理功能。
例如,在免疫应答中,超氧阴离子自由基可以被巨噬细胞产生,用于杀伤入侵的病原体。
3.参与细胞凋亡:超氧阴离子自由基可以通过与细胞内的一些蛋白质相互作用,引发细胞凋亡。
三、超氧阴离子自由基的清除能力尽管超氧阴离子自由基在生物体内具有一定的作用机制,但过多的超氧阴离子自由基会导致氧化应激反应和细胞损伤。
因此,生物体内存在一系列的清除机制来减少超氧阴离子自由基的数量,维持生物体的稳态。
1.超氧化物歧化酶(SOD):SOD是一种酶类,在生物体内能够催化超氧阴离子自由基的还原,将其转化为较稳定的氧气和过氧化氢(H2O2)。
2.谷胱甘肽过氧化物酶(GPx):GPx是另一种酶类,它能够将过氧化氢(H2O2)转化为水(H2O),从而减少超氧阴离子自由基的生成。
3.抗氧化剂:包括维生素C、维生素E和谷胱甘肽等,能够直接与超氧阴离子自由基发生反应,起到清除作用。
清除超氧阴离子自出基能力的测定

清除超氧阴离子自出基能力的测定清除超氧阴离子自出基能力的测定?听起来好像高深莫测,但其实它就像是一次科学“侦探”游戏,目标是找到并消除体内的坏小子——超氧阴离子。
我们平时说的自由基,大家都知道吧?它们就像街头上的“坏蛋”,能引发一连串的麻烦,比如加速衰老、引发疾病等等。
超氧阴离子就是这种坏蛋的亲戚之一,它活跃得很,又特别“调皮”,一不小心就能对我们的细胞造成伤害。
所以,清除它的能力如何测定,关系着我们如何守护自己的健康,简直是生活中不可忽视的小细节!究竟该怎么测定这种能力呢?其实嘛,不是像侦探小说里的那种大案子,直接一上来就有个明确的线索。
而是得通过一系列的实验,逐步寻找蛛丝马迹。
最常见的一个方法,就是通过特定的化学试剂来“捉拿”这些超氧阴离子。
它们就像犯罪现场的指纹一样,只要你用对了方法,就能准确找到它们藏身的地方。
实验中,我们通常会使用一种叫做NBT的化学物质,超氧阴离子一旦和它接触,就会发生颜色变化。
这就好比是超氧阴离子自己暴露了行踪,白白地站在那儿,成了显眼的“嫌疑犯”。
这样一来,实验人员只需要观察颜色变化的程度,就能判断体内清除超氧阴离子自出基的能力强不强。
这时候你可能会想,为什么要通过NBT来测量呢?其实是因为NBT反应得很灵敏,它能迅速与超氧阴离子反应,形成一种沉淀物,产生蓝色的变化。
想象一下就像我们在画画时,画布突然冒出了几滴颜料,整个画面一下子就不一样了。
颜色越深,就说明超氧阴离子的清除能力越弱,反之,如果颜色很淡或者没有什么变化,那就说明清除能力比较强,毕竟超氧阴离子在实验中被清除得差不多了。
不过,话说回来,实验的结果就像打麻将,得靠点运气。
因为很多时候,清除超氧阴离子自出基能力不仅受化学反应影响,还和实验条件密切相关。
比如温度、时间、试剂浓度等等,都可能让实验结果出现偏差。
每个小细节都很重要,有时候稍不注意,实验结果就像那种“莫名其妙”的失败,怎么做都不对劲。
所以,这个测定的过程既考验技巧,也考验耐心,真的是需要一点点时间去琢磨。
tiron清除超氧阴离子的原理

Tiron清除超氧阴离子的原理超氧阴离子是一种高度反应性的自由基物质,在生物体内可以产生氧化应激,损害细胞结构和功能,导致多种疾病。
Tiron是一种有效的超氧阴离子清除剂,具有保护细胞免受氧化损伤的作用。
本文将从Tiron 清除超氧阴离子的原理入手,深入探讨其在生物体内的作用机制。
1. Tiron的结构和性质Tiron,化学名为4,5-二羟基苯磺酸,是一种含有羟基和磺酸基团的有机化合物。
这种结构使得Tiron具有较高的亲电性,能够与超氧阴离子快速结合而形成稳定的产物,从而减少其对细胞的损害。
2. Tiron清除超氧阴离子的原理Tiron清除超氧阴离子的原理主要有两个方面:化学反应和生物作用。
Tiron与超氧阴离子发生化学反应。
超氧阴离子是一种强氧化剂,具有较强的氧化能力,能够与生物分子相互作用,造成氧化损伤。
Tiron的羟基和磺酸基团能够与超氧阴离子发生加成反应,形成稳定的产物,从而中和了超氧阴离子的氧化能力,减轻了其对细胞的损害。
Tiron能够作为抗氧化剂进入细胞内,清除细胞内的自由基,并参与细胞内的抗氧化反应。
在有氧呼吸的过程中,细胞内会产生一定量的超氧阴离子,如果不能及时清除,会导致氧化应激,造成细胞损伤。
Tiron能够进入细胞内,清除细胞内的超氧阴离子,调节氧化还原平衡,保护细胞免受氧化损害。
3. Tiron在生物体内的作用Tiron作为超氧阴离子清除剂,在生物体内发挥着重要的保护作用。
在许多疾病模型中,Tiron都能够减轻疾病的严重程度,延缓疾病的进展。
Tiron可以保护心血管系统免受氧化应激的损害,降低心脏病和动脉粥样硬化的风险;Tiron还可以减轻神经退行性疾病的病理进展,延缓细胞的氧化损伤和逝去。
这些研究表明,Tiron在生物体内具有广泛的应用前景,可以作为一种新型的抗氧化治疗剂。
4. 个人观点和总结作为一种有效的超氧阴离子清除剂,Tiron在生物体内的作用机制值得我们深入探讨。
超氧阴离子清除实验

·O2ˉ自由基清除实验(1) 实验原理黄嘌呤氧化酶黄嘌呤+H2O+O2尿酸+H2O2+·O2¯即黄嘌呤氧化酶在有氧条件下催化黄嘌呤转化为尿酸,同时产生超氧阴离子自由基(·O2¯)。
·O2¯与NBT结合后呈蓝色,样品清除能力越大,与NBT结合的·O2¯越少,溶液的颜色越浅。
(2)试剂Xanthine(黄嘌呤): (C5H4N4O2 ), MW=152.1, 6.084mg/100mL(0.4mmol/l)实际配制:1.216mg/10mL,与NBT等体积混合使用Xanthine oxidase(黄嘌呤氧化酶)贮液: 1 unit/mL , (溶解酶的溶液要高压灭菌!防止蛋白酶对酶的降解!)0.05 unit/mL,每次取200uL稀释到4mL(PBS溶解)NBT: (Nitro blue tetrazolium chloride氯化硝基四氮唑蓝), MW=817.65,黄色19.6236mg/100mL(0.24mmol/l)实际配制3.925mg/10mL,与Xanthine等体积混合使用PBS(0.01mol/L,pH=8.0): NaCl 8g, KCl 0.2g, Na2HPO4(无水) 1.44g, KH2PO4 0.24g,800mL水,用NaOH(1M)调pH到8.0,定容到1000mL。
实际配制500mL。
高压灭菌,室温保存。
PBS(0.01mol/L,pH=7.4): 配制同上Ascorbic acid: MW=176.12 母液为1mg/mL 先两倍逐级稀释5个浓度实际配制见记录本!HCl(1M): MW=36.5 310ul/10ml.(36% HCl密度1.18g/ml)实际配制:800uL浓盐酸+9mL水,于塑料管中4℃保存。
NaOH(1M): MW=40 0.4g/10mL, 存于冰箱(3) 测定方法超氧阴离子自由基清除能力的测定参照Bae等人的方法略加改进。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
·O2ˉ自由基清除实验
(1) 实验原理
黄嘌呤氧化酶
黄嘌呤+H2O+O2尿酸+H2O2+·O2¯
即黄嘌呤氧化酶在有氧条件下催化黄嘌呤转化为尿酸,同时产生超氧阴离子自由基(·O2¯)。
·O2¯与NBT结合后呈蓝色,样品清除能力越大,与NBT结合的·O2¯越少,溶液的颜色越浅。
(2)试剂
Xanthine(黄嘌呤): (C5H4N4O2 ), MW=152.1, 6.084mg/100mL(0.4mmol/l)
实际配制:1.216mg/10mL,与NBT等体积混合使用
Xanthine oxidase(黄嘌呤氧化酶)贮液: 1 unit/mL , (溶解酶的溶液要高压灭菌!防止蛋白酶对酶的降解!)
0.05 unit/mL,每次取200uL稀释到4mL(PBS溶解)
NBT: (Nitro blue tetrazolium chloride氯化硝基四氮唑蓝), MW=817.65,
黄色19.6236mg/100mL(0.24mmol/l)
实际配制3.925mg/10mL,与Xanthine等体积混合使用
PBS(0.01mol/L,pH=8.0): NaCl 8g, KCl 0.2g, Na2HPO4(无水) 1.44g, KH2PO4 0.24g,
800mL水,用NaOH(1M)调pH到8.0,定容到1000mL。
实际配制500mL。
高压灭菌,室温保存。
PBS(0.01mol/L,pH=7.4): 配制同上
Ascorbic acid: MW=176.12 母液为1mg/mL 先两倍逐级稀释5个浓度
实际配制见记录本!
HCl(1M): MW=36.5 310ul/10ml.(36% HCl密度1.18g/ml)
实际配制:800uL浓盐酸+9mL水,于塑料管中4℃保存。
NaOH(1M): MW=40 0.4g/10mL, 存于冰箱
(3) 测定方法
超氧阴离子自由基清除能力的测定参照Bae等人的方法略加改进。
样品溶液1-5mg/ml 起始浓度,用于水或50%乙醇溶液。
Bae, S.W., Suh, H.J., 2007. Antioxidant activities of ve different mulberry cultivars in Korea.
LWT, 40:955-962.
A)在96孔板孔中依次加入100μL 黄嘌呤(0.4mmol/l)和NBT(0.24mmol/l)的混合液(每种各50μL,溶于0.01mol/l的PBS,pH=8.0),100μL黄嘌呤氧化酶(0.049units/ml), 50μL 样品溶液
B)混匀后37℃孵育30min, 酶标仪测OD560值(扣除OD800值)。
不加样品溶液作为空白对照,Vc(维生素C)为阳性对照,每个浓度的样品平行测定三次,分别计算清除率及样品的IC50。
IC50的计算,运用NDST 软件包进行。
(4) 样品清除率=(OD空白-OD样品)/OD空白×100%.
PS:某些样品在水中溶解度不好的可在聚四氟乙烯管内水浴孵育,再取反应液到96孔板中测试。
所加反应试剂按比例增加。
所有。
