第三章 化学动力学基础
化学动力学基础知识点总结

化学动力学基础知识点总结
化学动力学是化学的一个分支,主要研究化学反应的速率和机理。
以下是一些化学动力学的基础知识点总结:
1. 反应速率:化学反应速率是指单位时间内反应物或生成物浓度
的变化量,可以用单位时间内反应物或生成物的摩尔数来表示。
2. 反应级数:反应级数是指化学反应速率与反应物浓度的幂次方
之间的关系。
一级反应的速率与反应物浓度的一次方成正比,二级反
应的速率与反应物浓度的二次方成正比,以此类推。
3. 活化能:活化能是指反应物分子从常态转变为能够发生化学反
应的活化态所需的能量。
活化能越高,反应速率越慢。
4. 催化剂:催化剂是一种能够加速化学反应速率而自身在反应过
程中不被消耗的物质。
催化剂通过降低反应的活化能来加速反应速率。
5. 反应机理:反应机理是指化学反应的具体步骤和过程,包括反
应物分子如何相互作用形成过渡态以及过渡态如何转化为生成物。
6. 碰撞理论:碰撞理论认为化学反应是反应物分子之间的碰撞导致的。
只有那些具有足够能量的分子在适当的取向下发生碰撞时,才能发生化学反应。
7. 阿伦尼乌斯方程:阿伦尼乌斯方程是描述反应速率与温度之间关系的经验公式。
它表明反应速率常数与温度成指数关系,活化能越高,温度对反应速率的影响越大。
8. 稳态近似:稳态近似是一种处理快速平衡反应的方法,假设反应中间物的浓度在反应过程中保持恒定。
这些是化学动力学的一些基础知识点,化学动力学在化学研究和实际应用中都有广泛的应用,例如在化学工程、药物研发、环境保护等领域。
化学反应速率(习题及答案)

c
0.109
9
General Chemistry
Chapter 6 Homework
6. 人体中的某种酶的催化反应的活化能为50 kJ·mol-1,正常 人的体温为310K(37℃),问发烧到313K(40℃)的病人体 内,该反应的反应速率增加了多少倍?
解:
ln k2 Ea (T2 T1 ) k1 R T1T2
7
General Chemistry
Chapter 6 Homework
4. 已知某反应的活化能Ea=80 kJ·mol-1 。求(1)由20℃升到 30℃;(2)由100℃升至110℃时,其速率常数分别增大了多少倍?
解:
ln k2 Ea (T2 T1 ) k1 R T1T2
(1)
ln k2
80 103 303 293
- Ea
k Ae RT
3
General Chemistry
三、计算题:
Chapter 6 Homework
1.已知反应 2H2 + 2NO = 2H2O + N2的反应物浓度和反应 速率的数据见下表(1073K)。
实验序号
1 2 3 4
起始浓度
c(NO)/ mol·dm-3 c(H2)/ mol·dm-3
将3、4数据代入上式: 0.48103 k(6.00103)m (1.00103)n
1.92103 k(6.00103)m (2.00103)n
解得:n=2
所以:速率方程为v=kc (H2)c2(NO),反应级数为3。
k
v c(H2 )c2 (NO)
3.18 103 1.00 103 (6.00 103 )2
加了 活化分子数 ,使反应速率加快。
天津理工大学2024年硕士研究生招生考试复试大纲 材料:《材料综合》复试大纲

材料综合复试大纲(复试分为三部分内容,考生可以选择其中任一部分作答。
)第一部分无机化学参考书目:《无机化学》,大连理工大学无机化学教研室编,高等教育出版社。
第三章化学动力学基础掌握活化分子和活化能的概念,并能用其说明浓度、温度、催化剂对化学反应速率的影响;掌握化学反应速率、反应速率方程、反应级数等概念;熟悉Arrhenius 方程。
第五章酸碱平衡掌握酸碱质子理论基本要点;掌握同离子效应和缓冲溶液的概念、一元强弱酸、Lewis酸碱的相关内容;掌握配位化合物的基本概念。
第六章沉淀溶解平衡掌握相关理论并解释沉淀析出的实验现象。
第七章氧化还原反应电化学基础掌握电极电势的基本概念及应用;熟悉氧化还原反应的基本概念。
第八章原子结构掌握核外电子排布的基本原理;掌握周期表中元素的分区、结构特征;熟悉原子半径、电离能、电子亲和能和电负性的变化规律。
第十章固体结构熟悉晶体的类型、特征和组成晶体的微粒间的作用力;能用相关知识点解释结构对物性的影响。
元素部分(s、p、d区元素),掌握性质递变规律。
第二部分物理学参考书目:《物理学》上、下册,东南大学等七所工科院校编,马文尉改编,高等教育出版社。
第五章静电场理解电场强度,掌握场强叠加原理,了解电荷连续分布的带电体的场强,理解电场线、电通量,掌握高斯定理,理解环路定理,了解电势,电势差及电势叠加原理。
第六章静电场中的导体与电介质了解静电场中加入导体和电解质后电场发生的变化,了解电容器的概念。
第七章恒定磁场理解磁感应强度,掌握毕奥-萨伐尔定律,理解磁感线、磁通量,掌握磁场中的高斯定理和安培环路定理;理解洛沦兹力,了解霍尔效应。
第八章电磁感应电磁场理解电动势的概念,掌握法拉第电磁感应定律,理解动生电动势、感生电动势的本质。
第十一章光学理解光的相干条件及获得相干光的基本原理和一般方法;了解光程概念以及光程差与相位差的关系,了解反射时产生半波损失的条件;了解杨氏双缝干涉的基本装置和实验规律;了解干涉条纹的分布特点及其应用;了解薄膜干涉原理在实际中的应用。
普通化学——化学动力学基础PPT课件

(产物取正,生成物取负)
显然,两种方法定义的数值不一样,它们之间的关系为: r ri 1 dci vi vi dt
式中,vi为反应系数,符号一律取正)
||
||
5
3.1.2 反应动力学方程
1 积分形式的动力学方程
描述反应体系中某组分浓度与时间的关系的函数称为积分形式的动 力学方程:
ci = g(t)
||
||
10
3.2 简单级数的反应的动力学方程
常见的简单级数的反应有零级反应、一级反应和二级反 应,三级反应的例子不多。 零级反应(准)——气、固相催化反应,酶催化反应 一级反应——同位素衰变反应,部分取代反应 二级反应——水解反应,部分取代反应
||
||
11
3.2.1 一级反应
一级反应:A → P dc kc dt
t
图3.2 一级反应
||
||
13
一级反应计算示例
例3.1 从考古发现的某古书卷中取出的小块纸片,测得 其中 14C/12C 的比值为现在活的植物体内 14C/12C 的比值 的0.795 倍。试估算该古书卷的年代。
解: 已知 1 4 7 1 4 7 - 0 1 e - , t 12 5730a
可用式(2.34)求得此一级反应速率常数k
第三章 化学动力学基础
第三章 化学动力学基础
化学热力学为我们提供了判断反应能否自发进行的依据。 但是一个热力学自发的反应不一定能够进行,例如:
H2(g)+O2(g) = H2O(g) 298.15K时标准摩尔反应吉布斯函数变为–457kJ·mol-1,但 在此温度下,不点燃或无撞击的情况下几天甚至几月都 观察不到水分子的产生。
2 微分形式的动力学方程
北理无机化学第3章-化学动力学基础

基元反应
§3.2 浓度对反应速率的影响
NO2(g)+CO(g) NO(g)+CO2(g)
v=kc(NO2)c(CO)
反应级数 n = 2
基元反应 2NO(g)+O2(g)2NO2(g)
v=kc(NO)2c(O2)
反应级数 n = 3
第三章 化学动力学基础
3.注意
§3.2 浓度对反应速率的影响
或
lg{k}
Ea 2.303RT
lg{k0}
k: 反应速率常数,由反应的性质和温度决定;
Ea:实验活化能,单位为kJ·mol-1,是表示反应特性 的常数;
k0:指数前因子,频率因子,对指定反应为一常数。
第三章 化学动力学基础
§3.3 温度对反应速率的影响
3.3.2 Arrhenius 方程式的应用
vB ΔcB Δt
vC
ΔcC
t
vD ΔcD Δt
浓度的单位:mol·L-1 时间的单位:s(h、min)
第三章 化学动力学基础
例:
起始浓度/(mol·L-1)
§3.1 反应速率的意义
N2 + 3H2 → 2NH3
13
0
2秒后浓度/(mol·L-1)
0.8 2.4 0.4
同一反应,可用不同物质的浓度的变化表示反应速率,其 值可能不同。
vN2
-
(0.8-1) 2
0.1mol
L-1
S-1
vH2
-
(2.4- 3) 2
0.3 mol
L-1
S-1
vNH3
(0.42
0)
0.2 mol
L-1
S-1
第三章 化学动力学基础
第三章 化学反应动力学的计算
第三章 化学反应动力学的计算化学反应的速度各不相同,有的反应速度极快,只要几个毫微秒就达到平衡(接近扩散速度,如无机酸碱中和),有的反应速度极慢,几乎看不到变化(如自然界的某些变化)。
大部分有机化学反应可用常规方法测量,对某些快速反应则可用停留法、驰豫法等测量。
不论反应速度的快慢,动力学方程都是类似的。
一、化学反应动力学方程反应物浓度随时间的变化绝大部分不是线性关系,而是一条曲线,见图3-1。
反应速度公式可用微分方程来表示。
具有简单级数的化学反应的反应速度公式可用积分式表示:一级 如:0AA1Adc A C =a, -=k c dt 生成物:,㏑C A =㏑a –K 1t 二级 A+A →产物 C A 0=a 2A 2A 2A d c 11-k C , =+k t d t c a对于反应 1-1k k A B 这一可逆反应初始条件 t=0 a 0 时间t 时 t=t a-x x达到平衡时,B 的浓度为X e ,则可逆反应的速度积分式为: 级数:1-1 1-10k A A e e 1A -1B k 0e 0C =a dc x xA B=-k C +k C : =kt dt a x -xC =0ln 1-21-10Ak0A e e e B 1A -1B C k e e 0CC =a dc x ax +x(a-x )A B+C C =0=-k C +k C C : =kt dt 2a-x a(x -x)C =0ln 二、常微分方程的解化学反应动力学方程是用微分方程表示的,对于简单的反应,可直接求得微分方程的解。
微分方程:()(1)(,,,......)......(1)n n y f x y y y -'=在区间a<x<b 的解,是指()y x ϕ=,这样一个函数,在所述区间内存在导数()(),(),......()n x x x ϕϕϕ'''。
且对于区间a<x<b 内的每一个x ,等式(1)都成立。
大学无机化学第五版第三章化学动力学基础

aA(aq) + bB(aq)
yY(aq) + zZ(aq)
r dcA dcB dcY dcZ adt bdt ydt zdt
对于定容的气相反应:
r 1 dpB
B dt
§3.2 浓度对反应速率的影响 —速率方程
3.2.1 化学反应速率方程
3.2.2 由实验确定反应速率方程的 简单方法——初始速率法
反应速率—— mol·L-1·s-1等 分类:平均速率( r )、瞬时速率( r )
若以C1、C2代表时间t1、t2时,某反应物或生成物的 浓度则:
平均速率:化学反应在某一有限时段内浓度的变化量。
_
r= ±
C2 - C1 t2 - t1
△C =±
△t
为使反应速率为正值:若用反应物浓度表示 C2﹤C1,△C为负,则前面加负号;若用生成物浓度表 示 C2﹥C1,△C为正,则前面取正号。
答:各物质的系数不同;各数值除以系数后相等。
对于一般的化学反应: 0 BB
B
定容条件下,定义:r d
Vdt
r——定容条件下的反应速率(mol·L-1·s-1)
d dnB dt Bdt r d dnB 1 dcB Vdt V Bdt Bdt
溶液中的化学反应:
反应 级数
2
1+1
2NOg O2 g 2NO2 g r k[c(NO)]2c(O2) 2+1
2+1 2NOg 2H2 g N2 g H2Og r k[c(NO)]2 c(H2 )
S2O82 aq 3I aq 2SO24 aq I3 aq
t/ s
VSTP O2 /mL cN2O5 / mol L1
化学动力学基础_PPT课件
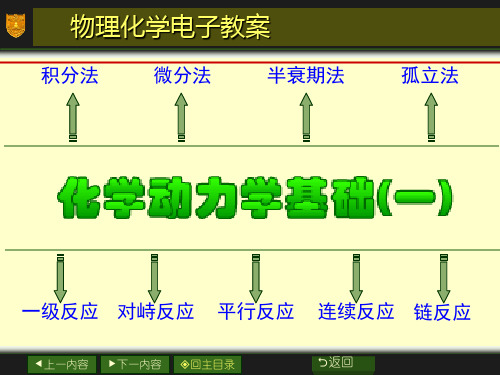
---differential rate equation of first order reaction)
反应:
A P
t0 cA ,0a 0
t t c A a xx
r
dcA dt
k1cA
或
r
dx dt
k1(ax)
上一内容 下一内容 回主目录
返回
一级反应的积分速率方程
--integral rate equation of first order reaction 不定积分式
上一内容 下一内容 回主目录
返回
质量作用定律(law of mass action)
对于基元反应,反应速率与反应物浓度的幂
乘积成正比。幂指数就是基元反应方程中各反应
物的系数。这就是质量作用定律,它只适用于基
元反应。
例如: 基元反应
反应速率r
(1)C2lM2ClM k1[C2l][M]
(2)ClH2 HClH (3)HC2lHClCl (4)2ClMC2lM
t 2. 半衰期(half-life time) 1 / 2是一个与反应物起始
浓度无关的常数 ,t1/2 ln2/k1 。
3. ln cA 与 t 呈线性关系。
引 (1)
伸 的
(2)
特 (3)
点
所有分数衰期都是与起始物浓度无关的常数。
t1/2:t3/4:t7/81:2:3
c/c0exp k1t)(
反应间隔 t 相同, c / c0有定值。
例如,下列反
应为总包反应: H 2 Cl 2 2HCl
H 2 I2 2HI
H 2 Br2 2HBr
上一内容 下一内容 回主目录
返回
化学反应动力学基础N

c-t图
r-c图
40℃,CCl4中N2O5分解反应的r:c( N2O5 )
t /s
0 300 600 900 1200
r : c N 2 O5 / s1
t /s
1800 2400 3000 4200 5400
r : c N 2 O5 / s
1
3.6510
4
4
3.64104 3.6210 3.6910
反应 反 应 速 级数 率 方 程 积 分 速 率 方 程 式 对 t 的 图 直线 是 直 线 斜率
t
1/2
0
r k At kt A0
1 1 kt At A0
At
ln At
1 At
-k -k
A0 2k
1 r kA ln At kt ln A0 2
0.693 k
r kA
取一般通式:
r (1 /n B )dcB / dt
例:2N2O5(CCl4) 2N2O4(CCl4)+ O2(g)
例如2700s时的瞬时速率:
0.144 0 2.58105 A点的斜率= 2 (55.8 0) 10
r 2.5810 mol L s
ln 2 0.693 Qt1/ 2 k k 0.693 \k t1/ 2 t1/ 2 1 A0 1.297 9 1.7 10 (年) t ln ln k A 0.693 1.000
美国科学家利比因发明利用测定放射性14C 确定地质年代的方法获1960年诺贝尔奖。
第三节
反应级数不同,k的单位不同。 k的单位:零级反应 mol· -1 ·-1;一级反应 s-1; L s 二级反应 (mol· -1)-1 ·-1。 L s
化学反应速率的概念

3.1 化学反应速率的概念
2
3.5 催化剂与催化作用
第三章 化学动 力学基础
3
3.4 反应速率理论和反应机理简介
3.3 温度对反应速率的影响
4
—Arrhenius方程
3.2 浓度对反应速率的影响
5
—速率方程
3.1 化学反应 速率的概念
平均速率和瞬时速率 定容反应速率
例: N2O5(CCl 4)
40℃,CCl4中N2O5分解反应的
r:c(t /Ns 2Or 5:c ) N 2O 5/s 1 t /s
r:cN 2O 5/s1
0
3.6 51 0 4
1800
3.6 41 04
300 3.59104 2400
3.6 21 04
600 3.60104 3000
3.6 91 04
900 3.62104 4200
l nk2 Ea T2 T1 k1 R T1T2
3. 根据
对同一反应,升
高一定温度,在高温区值增加较少, 因此对于
原本反应温度不高的反应 ,可采用升温的方法提
高反应速率;
4. 对不同反应,升高相同温度, Ea大的反应 k 增 大的倍数多,因此升高温度对反应慢的反应有明显 的加速作用。
01 3.4.1 碰撞理论 02 3.4 反应速率理论和反应机理简介 03 3.4.4 反应机理与元反应 04 3.4.3 活化能与反应速率 05 3.4.2 活化络合物理论
t/ s 0
VSTP(O2)/mLcN 2 O 5/mL o 1
0.000 0.200
l
r/mL o 1s 1 l
7.2 91 05
300
1.15
0.180
大学无机及分析化学第三章化学动力学题附答案

第三章化学动力学基础一判断题1.溶液中,反应物A 在t1时的浓度为c1,t2时的浓度为c2,则可以由(c1-c2 ) / (t1 - t2 ) 计算反应速率,当△t→ 0 时,则为平均速率。
......................................................................()2.反应速率系数k的量纲为1 。
..........................()3.反应2A + 2B → C,其速率方程式v = kc (A)[c (B)]2,则反应级数为3。
................()4.任何情况下,化学反应的反应速率在数值上等于反应速率系数。
..........()5.化学反应3A(aq) + B(aq) → 2C(aq) ,当其速率方程式中各物质浓度均为 1.0 mol·L-1时,其反应速率系数在数值上等于其反应速率。
......................................................................()6.反应速率系数k越大,反应速率必定越大。
......()7.对零级反应来说,反应速率与反应物浓度无关。
...........................................()8.所有反应的速率都随时间而改变。
........................()9.反应a A(aq) + b B(aq) → g G(aq) 的反应速率方程式为v = k [c(A)]a[ c(B)]b,则此反应一定是一步完成的简单反应。
........................()10.可根据反应速率系数的单位来确定反应级数。
若k的单位是mol1-n·L n-1·s-1,则反应级数为n。
...............................()11.反应物浓度增大,反应速率必定增大。
无机及分析化学(第三章化学动力学基础)

反应机理
讨论的问题:一个反应是如何进行的? 1)基元反应与复杂反应(非基元反应) ▲ 反应物分子直接碰撞而发生的化学反应 称为基元反应,它是一步完成的反应。 • 由一个基元反应构成的化学反应称为简单 反应。 • ▲ 由两个或两个以上的基元反应构成的 化学反应称为非基元反应或复合反应。 • ▲ 由一个基元反应构成的化学反应并不 多,因此,一个化学反应方程式,除非特别 注明,都属于化学计量方程式,而不代表基 元反应。 • 例如:
基元反应的化学反应速率方程:
式中:k为反应速度常数 CA、CB为物质A、B的浓度 a为A物质的反应级数 b为B物质的反应级数 a + b则为整个反应的级数。 当: a = 1时,对A物质是1级反应 b = 1时,对为B物质是1级反应 a+b = n时,则整个反应为n级反应。
1)速率常数k
▲上式中的比例系数k称为速率常数。 ▲ k的物理意义:单位浓度时的反应速率。 ▲速率常数 k 取决于反应的本性,其它条 件相同时快反应通常有较大的速率常数; ▲速率常数k与浓度无关; ▲ k 是温度的函数,温度升高, k 值增大。
• 解:求Ea,已知k1 、k2 T1和T2,利用下式:
即可求得Ea;同理,利用给定的条件和求得的 Ea,则可求得速度常数k。
4 反应速率理论和反应机理简介
定量地描述温度、浓度对反应速率影响的速率方程式和 Arrehenius方程都是实验事实的总结,反应为什么能进行,活化 能的本质和物理意义是什么,等等问题靠实验事实不能解决,需 要我们讨论反应速率理论。
可见,总反应(或一般的化学计量反应是由若 干个基元反应组成的。
2)反应的控速步骤(Rate - contralling step)
任何一个复杂反应都是由多个基元反应组成的,
化学动力学基础

c(A)、c(B)为反应物A、B的浓度,mol.L-1。
2014-9-22
11
1.反应总级数:α+β(零、正数、负数或分数)
反 应 反应速率方程式 r=kc(SO2CI2) r=kc(NO2)2 反应级数 1 2
SO2CI2→SO2+CI2 2NO2→2NO+O2
NO2+CO→NO+CO2 2H2+2NO→2H2O+N2
2014-9-22
§3-3 温度对化学反应速率的影响
H2+1/2O2→H2O 常温下觉察不出反应,当 温度升至873K时,则立刻反应并发生爆炸。 夏天,食物臵冰箱可保鲜,放外面易腐败。 结论:升高温度可增大反应速率 规律:一般反应,在反应物浓度相同的条 件下,温度升高10K,反应速率可增加2-10倍。
2014-9-22
18
二、Arrhenius方程的应用
k = k0e
Ea RT
( 1 ) ( 2) ( 3)
Ea ln k = ln k0- RT Ea lg k = lg k0 - 2.303RT
在一定的温度范围内,T变化不大时,Ea和 k0可视为定值。
2014-9-22
19
1.求反应的活化能
(1)以lnk对1/T做图,得直线斜率=-Ea/R, Ea=-8.314×10-3×斜率 (2)由2个不同温度下的k值求E
Ea RT Ea l n k1 = l n k 0- RT1 l n k = l n k 0- ln ( 2) Ea ; l n k 2 = l n k 0- RT2
1 dpB 气相反应:r ( Pa s 1 ) B dt r 1 dcA 1 dcB 1 dcY 1 dcZ a dt b dt y dt z dt
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章 化学动力学基础1. 有A 气体和B 气体进行反应,若将A 气体浓度增加一倍,速率增加400%,若将B 气体的浓度增加一倍,速率增加200%,试写出反应式。
2. 下列生成NO 2的反应:2NO +O 22NO 2 其反应速率表示式为][O [NO]22k =v如果压力增加到原来的两倍,试计算速率之变化。
3. 在抽空的刚性容器中,引入一定量纯A 气体,发生如下反应:A(g)−→−B(g) + 2C(g)。
设反应能进行完全,经恒温到323K 时,开始计时,测定求该反应级数及速率常数4. 若气体混合物体积缩小到原来的1/3,下列反应的初速率变化为多少? 2SO 2 + O 2 → 2SO 35. 在308K 时,反应 N 2O 5(g) → 2NO 2(g) + 1/2O 2(g) 的k = 1.35⨯10-5,在318K 时,k = 4.98⨯10-5,试求这个反应的活化能?6. CH 3CHO 的热分解反应是:CH 3CHO(g) → CH 4(g) + CO(g) 在700K 时,k =0.0105,已知E a=188.1kJ ⋅mol -1,试求800K 时的k 。
7. 已知HCl(g)在1atm 和25℃时的生成热为-88.2kJ ⋅mol -1,反应 H 2(g) + Cl 2(g) = 2HCl(g)的活化能为112.9kJ ⋅mol -1。
试计算逆反应的活化能。
8. 某一个化学反应,当温度由300K 升高到310K 时,反应速率增加了一倍,试求这个反应的活化能。
9. 某化学反应,在300K 时,20min 内反应完成了50%,在350K 时,5min 内反应完成了50%,计算这个反应的活化能。
10. 已知在320℃时反应SO 2Cl 2(g)→SO 2(g)+Cl 2(g)是一级反应,速率常数为2.2⨯10-5s -1。
试求:(1)10.0gSO 2 Cl 2分解一半需多少时间? (2)2.00gSO 2Cl 2经2h 之后还剩多少克?11. 在人体内,被酵母催化的某生化反应的活化能为39kJ ⋅mol -1。
当人发烧到313K 时,此反应的速率常数增大到多少倍?12. 蔗糖催化水解C 12H 22O 11+H 2O 催化剂−→−−2C 6H 12O 6是一级反应,在25℃速率常数为5.7⨯10-5s -1。
试求: (1)浓度为1mol ⋅dm -3蔗糖溶液分解10%需要多少时间?(2)若反应活化能为110kJ.mol -1,那么在什么温度时反应速率是25℃时的十分之一?13. 反应2NO+2H 2→N 2+2H 2O 在一定温度下,某密闭容器中等摩尔的比NO 与H 2混合物在不同初压下的半衰期为p 0(mmHg) 355 340.5 288 251 230 202 t 1/2(min) 95 101 130 160 183 224 求反应级数。
14. 环戊二烯(沸点40℃)易在气相中形成双聚:2C 5H 6(g)→C 10H 12(g)现将0.50cm 3环戊二烯(ρ =0.802g.cm -3)放入容器为1.000dm 3的抽空密闭容器中,加热到130℃,经过一段时间,测定总压的结果如下:t (min) 10 20 30 40 50 60 p 总(kPa) 18.07 16.62 15.63 14.87 14.33 13.88(1) 计算温度升到130℃时尚未聚合的起始压力。
(2) 计算60min 时环戊二烯的分压。
(3) 此反应的反应级数和反应速率常数。
15. 把一定量的PH 3(g)引入含有惰性气体的温度为873K 的反应器中,PH 3(g)可完全分解为P 4(g)求反应级数及速率常数16. 气相反应Cl 2O + 2N 2O 5 → NO 3Cl + NO 2Cl + 2NO 2 + O 2的可能历程是:N 2O 5NO 2 + NO 3 (快平衡)NO 2 + NO 3k 2−→−NO + O 2 + NO 2 (慢) NO + Cl 2O k 3−→−NO 2Cl + Cl (快) Cl + NO 3k 4−→−NO 3Cl (快)而N 2O 5分解历程如下:N 2O 5NO 2 + NO 3 (快平衡)NO 2 + NO 3k 2−→−NO + O 2 + NO 2 (慢) NO + NO 3k 3−→−2NO 2(快) 试求这两个反应的速度方程式,你能从这两个结果得出什么结论?17. 2NO(g) + O 2 → 2NO 2(g)存在三种可能的机理,试写出每一种机理的分步反应,若反应速率v =kc NO 2c O2,问上述反应按哪种机理进行?18. N 2O(g)的热分解反应为2N 2O(g)−→−k 2N 2(g) + O 2(g),从实验测出不同温度时各个起反应温度T / K 967 967 1030 1030 初始压力 p 0 / kPa 156.787 39.197 7.066 47.996 半衰期 t 1/2 / s38015201440212(1) 求反应级数和两种温度下的速率常数(2) 求活化能E a(3) 若1030K 时,N 2O(g)的初始压力为54.00kPa ,求压力达64.00kPa 时所需的时间。
19. 反应Co(NH 3)5F 2+ + H2OH +Co(NH 3)5(H 2O)3+ + F -被酸催化。
若反应速率公式为rate = 352+α+β298 298 308 [Co(NH 3)5F 2+] (mol · dm -3)0.1 0.2 0.1 [H +] (mol · dm -3) 0.01 0.02 0.01 t 1/2×102 / s 36 18 18 t 1/4×102 / s723636请计算 (1) 反应级数α和β的值(2) 不同温度下的反应速率常数k (3) 反应实验活化能E a 值20. N 2O 5分解反应的历程如下:① N 2O 5NO 2 + NO 3 ② NO 2 + NO 32k −−→NO + O 2 + NO 2 ③ NO + NO 33k−−→2NO 2 (1) 当用O 2的生成速率表示反应速率时,试用稳态近似法证明:212112k k k k r +=-[N 2O 5](2) 设反应②为决速步骤,反应①为快速平衡,用平衡态近似法写出反应的速率表达式r 2。
(3) 在什么情况下,r 1 = r 2?-1 k 121. 已知反应2NO + O 2−→−2NO 2,其r = k [NO]2[O 2],试写出一种符合该速率方程的反应历程。
22. 在生命系统中,酶在很多化学反应中扮演重要角色。
一些酶的催化反应可以用如下的Michaelis-Menten 机理描述:E + SES 2k−−→E + P ,E 为酶,S 为受体,P 为最终产物忽略第二步的逆向速率,也可以假设酶和受体是很快达到平衡的。
(1) 在285K 温度下进行实验,实验中, 初始的速率(P 的生成)可由不同的受体浓度来决定,维持酶的总浓度为1.5×10– 9 M (mol·dm -3) 可得到下图 ① 当[S]很小时,曲线呈线性;当[S]很大时,曲线与横坐标平行,则速率接近常数,请证明该图与Michaelis-Menten 机理是一致的 ② 试写出速率常数k 2③ 当[S]= 1.0×10– 4 M 时,初始速率为多少? ④ 试求E + S ES 的平衡常数 (2) 在310K ,重复相同的酶浓度,得到一相似的曲线,试计算ES 转换成E 和P 时所需要的活化能。
初始速率[ S ]3.0×10-6M ·S-1T = 285K1.5×10-6M ·S-15.0×10-5M初始速率T = 310K8.0×10-5M[ S ]6.0×10-6M ·S-13.0×10-6M ·S-123. 14C 放射性蜕变的半衰期t 1/2 = 5730年,今在一考古样品中,测得14C 占C 的含量只有72%,问该样品已存在多少年了?24. 在1100K 时,研究NO(g) + H 2(g)的反应动力学 (1) 当p 0 (NO) = p 时,测得如下数据:t 1/2 / s 81 224 p 0 / Pa335202试求该反应的总反应级数k -1k 1(2) 在不同初始压力下,测定初始反应速率,结果如下:)H (02p / kPa p 0 (NO) / kPa -(d P / dt ) t →0 (kPa · s -1)① 53.3 ② 53.3 ③ 38.5 ④ 19.640.0 20.3 53.3 53.30.137 0.033 0.213 0.105如该反应的速率方程为,-d P / dt = 2(NO)(H)x yk p p ⋅试求x 、y25. 氯甲酸·三氯甲酯高温分解反应:ClCOOCCl 3(g) −→−2COCl 2(g) 是单向一级反应。
将一定量的ClCOOCCl 3迅速放入恒温、恒容反应器中,测量时刻t 的总压力p 及完全反应后的总压力p ∞。
两个温度下的实验数据如下:Exp. T / K t / s p / kPa p ∞ / kPa (1) 553 454 2.476 4.008(2)5783202.8383.554计算反应的活化能26. 溶液反应A + B −→−P ,当[A]0 = 1.00×10-4 mol · dm -3,[B]0 = 1.00×10-2 mol · dm -3,测得不同反应温度时的吸光度随时间变化数据如下:T / K t / min 0 27 130 ∞ 298 D 1 1.390 1.030 0.706 0.100 308D 21.4600.542 0.210 0.110当[A]0 = 1.00×10-4 mol · dm -30,在298K 时测得t 1/2数据如下:[B]0 / mol · dm -31.00×10-22.00×10-2t 1/2 / min12030若速率方程为r = k [A]α[B]β,试求α、β、k 和E a27. 已知每克陨石中含238U 6.3×10-8g ,4He 为20.77×10-6cm 3(标准状态下)。
238U 的衰 变反应为:238U −→−206Pb + 8 4He ,由实验测得的半衰期t 1/2 = 4.51×109年,试求该陨石的年龄。
