第一节元素周期表第一课时PPT课件
合集下载
元素周期表 第一课时ppt课件

共七个副族
VIII 族:
包括8、9、10三个纵行。 位于Ⅶ B 与ⅠB中间
零族:
稀有气体元素组成的族
短周期(第————1周.2期.3)
周期——个7 (共——个横行7)
长周期(第————周4.期5.6)7
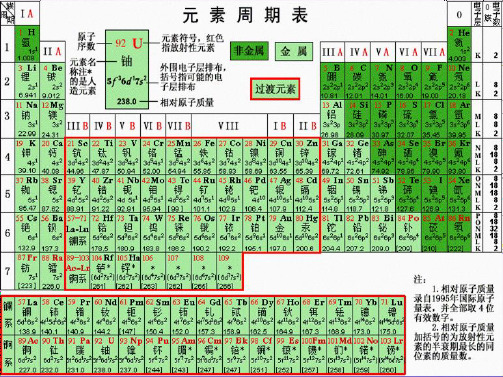
元 素 周 期 表
主族————7个,用——字母表示A
族—1—6个(共——个纵1行8 ) 判断元素在周期表中的位置!
11、 、什什么 么叫 叫周 周期 期? ? 周期表横行中,元素电子层相同,按原子序数递增的顺序从左到右排列,我们将 2这、横什行么称叫为族周?期。 2、什么叫族? 3纵、行表最中外的层A电、子B的数相含同义,是按什电么子?层递增的顺序从上而下排列而成我们将纵行称为 族。 3、表中的A、B的 含义是什么? A代表主族,B代表副族。
18
4
37-54
18
5
55-86
32
6
87-112
26
7
练一练
1)已知某原子的结构示意为
A、该元素位于第二周期VIII族 B、该元素位于第二周期IA族 C、该元素属于非金属类 D、该元素属于金属元素
,则下+列10说法正2确的8是?
C
A、B、C是周期表中相邻的三种元素,原子序数依次增大,其中A、B是相邻同周期元素, B、C是同主族元素。此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、 C分别为什么元素?
例1 甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子
序数不可能是
A.x+2
B.x+4
C.x+8
D.x+18
例2 A为ⅡA主族元素,B为ⅢA主族元素,A、B同周期,其原子序数分别是M,N,甲乙 为同一主族相邻元素,其原子序数分别为X、Y。则下列选项中的两个关系式均正确的是:
元素周期表1ppt课件

Li +3 2 1 Na +11 2 8 1
K +19 2 8 8 1
ⅡA
+4 2 2 +12 2 8 2
+20 2 8 8 2
Rb +37 2818 81
+38 2818 82
C主s 族+55 序28 1数8 18 8=1最外层 电子数 +56 28 18 18 8 2
ⅢA
+5 2 3 +13 2 8 3 +31 2 8 18 3
8
2、元素周期表的结构
ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ 1H 2 Li Be 3 Na Mg 4 K Ca 5 6
7
ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0 He
B C N O F Ne Al Si P S Cl Ar
9
1 2种元素
2 8种元素
短周期
横的方面 (7个横行)7个周期14源自 识记类别周期 序数
1
短周期
2
3
4
长周期
5
6
不完全 周期
7
包括元 素种数
2 8 8 18 18 32
26
稀有气体 原子序数
2 10 18 36 54 86
118
15
练习 1、 推算原子序数为6,13,34,53,88,82 的元素在周期表中的位置。
第6号元素: 6-2=4 第13号元素: 13-10=3 第34号元素: 34-36=-2 第53号元素: 53-54=-1 第88号元素: 88-86 =2 第82号元素: 82-86 =-4
2、
周
3 8种元素
4 18种元素 5 18种元素
K +19 2 8 8 1
ⅡA
+4 2 2 +12 2 8 2
+20 2 8 8 2
Rb +37 2818 81
+38 2818 82
C主s 族+55 序28 1数8 18 8=1最外层 电子数 +56 28 18 18 8 2
ⅢA
+5 2 3 +13 2 8 3 +31 2 8 18 3
8
2、元素周期表的结构
ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ 1H 2 Li Be 3 Na Mg 4 K Ca 5 6
7
ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0 He
B C N O F Ne Al Si P S Cl Ar
9
1 2种元素
2 8种元素
短周期
横的方面 (7个横行)7个周期14源自 识记类别周期 序数
1
短周期
2
3
4
长周期
5
6
不完全 周期
7
包括元 素种数
2 8 8 18 18 32
26
稀有气体 原子序数
2 10 18 36 54 86
118
15
练习 1、 推算原子序数为6,13,34,53,88,82 的元素在周期表中的位置。
第6号元素: 6-2=4 第13号元素: 13-10=3 第34号元素: 34-36=-2 第53号元素: 53-54=-1 第88号元素: 88-86 =2 第82号元素: 82-86 =-4
2、
周
3 8种元素
4 18种元素 5 18种元素
元素周期表_1-课件

•
14、意志坚强的人能把世界放在手中 像泥块 一样任 意揉捏 。2021年2月27日星期 六2021/2/272021/2/272021/2/27
•
15、最具挑战性的挑战莫过于提升自 我。。2021年2月2021/2/272021/2/272021/2/272/27/2021
•
16、业余生活要有意义,不要越轨。2021/2/272021/2/27Februar y 27, 2021
◆要点导航
△课时要点 △要点全解
★元素周期表
◆拓展延伸
*元素周期表简介 及意义
◆基础达标 ◆能力提升
◆要点导航
△课时要点 △要点全解
★元素周期表
◆拓展延伸
*元素周期表简介 及意义
◆基础达标 ◆能力提升
◆要点导航
△课时要点 △要点全解
★元素周期表
◆拓展延伸
*元素周期表简介 及意义
◆基础达标 ◆能力提升
◆要点导航
△课时要点 △要点全解
★元素周期表
◆拓展延伸
*元素周期表简介 及意义
◆基础达标 ◆能力提升
◆要点导航
△课时要点 △要点全解
★元素周期表
◆拓展延伸
*元素周期表简介 及意义
◆基础达标 ◆能力提升
◆要点导航
△课时要点 △要点全解
★元素周期表
◆拓展延伸
*元素周期表简介 及意义
◆基础达标 ◆能力提升
•
9、有时候读书是一种巧妙地避开思考 的方法 。2021/2/272021/2/27Saturday, February 27, 2021
•
10、阅读一切好书如同和过去最杰出 的人谈 话。2021/2/272021/2/272021/2/272/27/2021 6:29:22 PM
第一节元素周期表(共40张PPT)
第ⅦA 族
与水缓慢反应
(2)原子结构特点 Cl2+H2O=HCl+HClO
静置后,液体分为两层。
通一过个以 12上C相质比量较同×,1点/思12考:钠和钾最的外性质层有 7个电子
静置后,液体分为两层。
和递变性。 (氧化性:Cl2 >I2)
核电荷数依次增多
不同点: 电子层数依次增多 上层无色,下层分别呈橙红色、紫红色
第一章 物质结构、元素周期律
第一节 元素周期表 一、元素周期表的结构
原子序数:依原子核电荷数由小到大的顺序给元素编号,这种
编号叫原子序数。
原子序数=核电荷数=质子数=核外电子数 (一)元素周期表的编排原则
1、横行: 把电子层数相同的各种元素按原子序数递增顺序
从左到右排列。
2、纵行: 把最外层电子数相同的各种元素按电子层数递增顺序 从上而下排成。
性逐渐增强,非金属性逐渐减弱。
2. 元素性质与原子结构有有密切的关系,主要与原子
核外的排布,特别是最外层电子数有关。原子结构
相似的一族元素,它们在化学性质上表现出相似性 和递变性。
1、砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或
砹的化合物不可能具有的性质是( B)
A、砹易溶于某些有机溶剂 B、砹能与水剧烈反应
应越来越
,剧生烈成的氧化物越来越
。
最高复价杂氧化物对应水化物的碱性越来越 。
强
讨论1:Li与K 应如何保存? Li封存于固体石蜡中, 少量K保存于煤油中。
讨论2:碱金属与盐酸: 2R+2H+= 2R++H2 ↑ 讨论3:碱金属与盐溶液: 先与水反应
讨论4:Li+、Na+、K+、Rb+、Cs+也具有强还原性吗? 没有。 有较弱的氧化性。 氧化性: Li+ > Na+ > K+ > Rb+ > Cs+
第一章第一节元素周期表1PPT课件

8
[实验1]将一干燥的坩埚加热,同时取一小块钾,擦干 表面的煤油后,迅速的投入到热坩埚中,观察现象。同 钠与氧气的反应比较。
[实验2]在培养皿中放入一些水,然后取绿豆大的钾, 吸干表面的煤油,投入到培养皿中,观察现象。同钠 与水的反应进比较.
钠
钾
与氧气的反应 生成淡黄色的固体, 钾熔化成小球,剧烈燃烧,
中X为17的是 B、D
7 X
33
A
8 B
X34 C
9 10 10X X
36 36
D 7
二、元素性质与原子结构的关系 1、碱金属
[科学探究] 分析碱金属原子结构的共同之处:
从碱金属原子的结构可推其化学性质如何?是否完全相同? 元素化学性质与元素原子的最外层电子数密切相关. 碱金属元素原子的最外层上都只有一个电子,因此它 们应该具有相似的化学性质.
长周期 不完全
周期
周期 序数
1 2 3 4 5 6
7
起止元素
H—He Li—Ne Na—Ar K—Kr Rb—Xe Cs—Rn
起止原 包括元 核外电 子序数 素种数 子层数
1—2
2
1
3—10 8
2
11—18 8
3
19—36 18
4
37—54 18
5
55—86 32
6
Fr—112号 87—112 26
ቤተ መጻሕፍቲ ባይዱ
金属性逐渐 增强 .因此,它们与氧气或水反应时,钾比
钠的反应 剧烈 ,铷、铯的反应 更剧烈 。
除了化学性质上的相似与递变外,碱金属在物理 性质上也表现出一些相似形和递变性。P7
11
2、卤族元素
阅读课文,完成P7[学与问]
[实验1]将一干燥的坩埚加热,同时取一小块钾,擦干 表面的煤油后,迅速的投入到热坩埚中,观察现象。同 钠与氧气的反应比较。
[实验2]在培养皿中放入一些水,然后取绿豆大的钾, 吸干表面的煤油,投入到培养皿中,观察现象。同钠 与水的反应进比较.
钠
钾
与氧气的反应 生成淡黄色的固体, 钾熔化成小球,剧烈燃烧,
中X为17的是 B、D
7 X
33
A
8 B
X34 C
9 10 10X X
36 36
D 7
二、元素性质与原子结构的关系 1、碱金属
[科学探究] 分析碱金属原子结构的共同之处:
从碱金属原子的结构可推其化学性质如何?是否完全相同? 元素化学性质与元素原子的最外层电子数密切相关. 碱金属元素原子的最外层上都只有一个电子,因此它 们应该具有相似的化学性质.
长周期 不完全
周期
周期 序数
1 2 3 4 5 6
7
起止元素
H—He Li—Ne Na—Ar K—Kr Rb—Xe Cs—Rn
起止原 包括元 核外电 子序数 素种数 子层数
1—2
2
1
3—10 8
2
11—18 8
3
19—36 18
4
37—54 18
5
55—86 32
6
Fr—112号 87—112 26
ቤተ መጻሕፍቲ ባይዱ
金属性逐渐 增强 .因此,它们与氧气或水反应时,钾比
钠的反应 剧烈 ,铷、铯的反应 更剧烈 。
除了化学性质上的相似与递变外,碱金属在物理 性质上也表现出一些相似形和递变性。P7
11
2、卤族元素
阅读课文,完成P7[学与问]
人教版高中化学必修二第一章第一节《元素周期表》第一课时 (共23张PPT)

_________________________________________________________ (3)写出单质Z与钠反应的化学方程式:_________________。
最后,给一个任务:记忆前20号元素名称 原子 序数 1 2 3 4 5 6 7 8 9 10 元素 名称 氢 氦 锂 铍 硼 zxxk __ __ __ __ __ 原子 序数 11 12 13 14 15 16 17 18 19 20 元素 名称 __ __ __ __ __ __ __ 氩 钾 钙
有相差1, 有相差11, 有相差25。
3.A、B分别为同周期ⅡA、ⅢA族的元素,则下列A、B
的原子序数关系不正确的是( C )
A.A+1=B
B.A+11=B
C.A+18=B
D.A+25=B
4.(双选)某元素X,它的原子最外层电子数是次外层电
子数的2倍,则X在周期表中位于 (AC )
A.第二周期 B.第三周期
(3)主族序数与最外层电子数的关系: 主族序数 = 最外层电子数
(4)一些族的别称
ⅠA称为_______碱__金__属___元素 ⅦA称为_____卤__族_______元素 零族称为___稀__有__气__体_____元素 第ⅢB~ⅡB族为_____过__渡___元素
元素周期表
一、元素周期表
(一)元素周期表的结构 数一数,每一个周期有多少种元素?
①主族:在罗马数字后标A表示:
ⅠA、Ⅱ___A_、___Ⅲ__A__、___Ⅳ__A__、__Ⅴ___A__、__Ⅵ__A__、___Ⅶ__A________
②副族:在罗马数字后标B表示:
ⅠB、__Ⅱ__B__、__Ⅲ___B__、__Ⅳ__B__、___Ⅴ__B__、__Ⅵ__B__、___Ⅶ__B_______
最后,给一个任务:记忆前20号元素名称 原子 序数 1 2 3 4 5 6 7 8 9 10 元素 名称 氢 氦 锂 铍 硼 zxxk __ __ __ __ __ 原子 序数 11 12 13 14 15 16 17 18 19 20 元素 名称 __ __ __ __ __ __ __ 氩 钾 钙
有相差1, 有相差11, 有相差25。
3.A、B分别为同周期ⅡA、ⅢA族的元素,则下列A、B
的原子序数关系不正确的是( C )
A.A+1=B
B.A+11=B
C.A+18=B
D.A+25=B
4.(双选)某元素X,它的原子最外层电子数是次外层电
子数的2倍,则X在周期表中位于 (AC )
A.第二周期 B.第三周期
(3)主族序数与最外层电子数的关系: 主族序数 = 最外层电子数
(4)一些族的别称
ⅠA称为_______碱__金__属___元素 ⅦA称为_____卤__族_______元素 零族称为___稀__有__气__体_____元素 第ⅢB~ⅡB族为_____过__渡___元素
元素周期表
一、元素周期表
(一)元素周期表的结构 数一数,每一个周期有多少种元素?
①主族:在罗马数字后标A表示:
ⅠA、Ⅱ___A_、___Ⅲ__A__、___Ⅳ__A__、__Ⅴ___A__、__Ⅵ__A__、___Ⅶ__A________
②副族:在罗马数字后标B表示:
ⅠB、__Ⅱ__B__、__Ⅲ___B__、__Ⅳ__B__、___Ⅴ__B__、__Ⅵ__B__、___Ⅶ__B_______
第1课时元素周期表ppt课件

质子 原子核
原子
中子
核外电子 2.元素: 具有相同 核电荷数 (即 质子数 )的同一类原
子的总称。
严 格 执 行 突 发事件 上报制 度、校 外活动 报批制 度等相 关规章 制度。 做到及 时发现 、制止 、汇报 并处理 各类违 纪行为 或突发 事件。
一、元素周期表的发展历程
门捷列夫
核电荷数
严 格 执 行 突 发事件 上报制 度、校 外活动 报批制 度等相 关规章 制度。 做到及 时发现 、制止 、汇报 并处理 各类违 纪行为 或突发 事件。
严 格 执 行 突 发事件 上报制 度、校 外活动 报批制 度等相 关规章 制度。 做到及 时发现 、制止 、汇报 并处理 各类违 纪行为 或突发 事件。
纸牌→元素周期表
1867年,俄国圣彼德堡大学里来了一位年轻的化学教授,他就 是门捷列夫。他手里总捏着一副纸牌,颠来倒去。两年后的一天, 俄罗斯化学会专门邀请专家进行一次学术讨论。主持人问:“门捷 列夫先生,可有什么高见?”门捷列夫在桌子上列成一个牌阵,竖 看就是红、橙、黄、绿、青、蓝、紫各一列,横看7种颜色的纸牌 就像画出的光谱段,有规律地每隔七张就重复一次。坐在旁边的老 师气得胡子都撅了起来,一拍桌子站了起来,以师长的严厉声调说 道:“快收起你这套魔术吧,摆摆纸牌就想发现什么规律,这些元 素难道就由你这样随便摆布吗?”但是,门捷列夫坚信自己是对的, 回家后继续摆着这副纸牌,遇到什么地方连接不上时,他就断定还 有新元素没被发现,暂时补一张空牌,就这样他一口气预言了11种 未知元素,制出了第一张元素周期表。
棱 台 型 元 素 周 期 表
严 格 执 行 突 发事件 上报制 度、校 外活动 报批制 度等相 关规章 制度。 做到及 时发现 、制止 、汇报 并处理 各类违 纪行为 或突发 事件。
元素周期表完整(33张)ppt课件

短周期元素中,族序数等于周期序数的元素有 ___H__、__B_e_、__A_l__,族序数等于周期序数2倍的元素有 ___C__、__S_,周期序数等于族序数2倍的元素有__L_i___。
ppt精选版
28
4.判断正误
× (1)最外层电子数为2的元素一定在第ⅡA族。( )
2He
如:氦
10Ne
√ (2)若发现了115号元素,则该元素肯定位于第7周期第ⅤA族。( 18Ar)
6个横行 6个周期
第Ⅷ族
18个纵行,16个族 ppt精选版
金属与 非金属 分界线
26
2.下列各图为元素周期表的一部分,表中的数字为原子序数, 其中M为37的是( C )
35 36
35
×
×
37 38
√
ppt精选版
27 45
×
27
3.第3周期第ⅣA族的元素是__S_i_____;Na元素的原子 序数为11,其相邻的同族元素的原子序数是__3_、__1_9__;
6
ppt精选版
螺
旋
时
钟
式
元
素
周
期
表
7
ppt精选版
塔 式 元 素 周 期 表
8
棱
台
型
元
素
周
期
ppt精选版
表
9
ppt精选版
层 式 元 素 周 期 表
10
ppt精选版
螺 旋 式 元 素 周 期 表
11
ppt精选版
透 视 式 元 素 周 期 表
12
ppt精选版
螺 旋 式 元 素 周 期 表
13
Mn= 55 Rh=104.4 Pt= 197.4
ppt精选版
28
4.判断正误
× (1)最外层电子数为2的元素一定在第ⅡA族。( )
2He
如:氦
10Ne
√ (2)若发现了115号元素,则该元素肯定位于第7周期第ⅤA族。( 18Ar)
6个横行 6个周期
第Ⅷ族
18个纵行,16个族 ppt精选版
金属与 非金属 分界线
26
2.下列各图为元素周期表的一部分,表中的数字为原子序数, 其中M为37的是( C )
35 36
35
×
×
37 38
√
ppt精选版
27 45
×
27
3.第3周期第ⅣA族的元素是__S_i_____;Na元素的原子 序数为11,其相邻的同族元素的原子序数是__3_、__1_9__;
6
ppt精选版
螺
旋
时
钟
式
元
素
周
期
表
7
ppt精选版
塔 式 元 素 周 期 表
8
棱
台
型
元
素
周
期
ppt精选版
表
9
ppt精选版
层 式 元 素 周 期 表
10
ppt精选版
螺 旋 式 元 素 周 期 表
11
ppt精选版
透 视 式 元 素 周 期 表
12
ppt精选版
螺 旋 式 元 素 周 期 表
13
Mn= 55 Rh=104.4 Pt= 197.4
元素周期表第一课时.ppt

返回
2.编排原则
电子层数
最外层电子数
原子序数 电子层数
优化方案系列丛书
第1章 物质结构 元素周期律
课 前 自 主 学 案
课 堂 互 动 讲 练
探 究 整 合 应 用
山东水浒书业有限公司·
知 能 优 化 训 练
返回
优化方案系列丛书
第1章 物质结构 元素周期律
课 前 自 主 学 案
返回
优化方案系列丛书
第1章 物质结构 元素周期律
课
前
3.过渡元素
自 主 学
案
元素周期表中从ⅢB到ⅡB共10个纵行,包括了第
课
Ⅷ族和全部副族元素,共60多种元素,全部为金
堂 互
动
属元素,统称为过渡元素。
讲 练
特别提醒:元素周期表中主、副族的分界线:
探 究
整
(1)第ⅡA族与第ⅢB族之间,即第2、3列之间;
优化方案系列丛书
第1章 物质结构 元素周期律
课 前 自 主 学 案
课 堂 互 动 讲 练
探 究 整 合 应 用
(2)原子序数与原子结构的关系
知
能
原子序数=_核__电__荷__数___=__质__子__数___=核__外__电__子__数_
优 化
训
练
山东水浒书业有限公司·
() A.只有第2列元素的原子最外层有2个电子 B.第14列元素形成的化合物种类最多 C.第3列元素种类最多 D.第16、17列元素都是非金属元素
优化方案系列丛书
第1章 物质结构 元素周期律
课
10. 下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
前 自
主
第一节元素周期表PPT课件

第一节 元素周期表
第二课时
二、元素的性质与原子结构
1.碱金属元素 1.查阅元素周期表有关信息,填写下表
元素 元素符 核电 原子结构示 最外层 电子
名称 号
荷数 意图
电子数 层数
锂 Li 3
+3 2 1
12
原子半径 nm
0.152
钠 Na 11
+11 2 8 1
1
3
0.186
碱
金钾
K
19
+19 2 8 8 1
第四周期第ⅥA 族。
第53号元素: 53-54=-1 第88号元素: 88-86 =2
第五周期第ⅦA 族。 第七周期第ⅡA 族。
第82号元素: 82-86 =-4
第六周期第ⅣA 族。
练习与思考:
1、推算原子序数为6、13、34、53、88的 元素在周期表中的位置。
原子 序数
6
周期 2
13 34 53 88
碱金属在物理性质上的相似性和规律性。
Li Na K Rb Cs
相
颜色
似
硬度
密度 点
熔沸点
均为银白色(Cs略带金色) 柔软 较小 较低
导电导热性
递 变
密度变化
性 熔沸点变化
很好 逐渐增大(K特殊) 单质的熔沸点逐渐降低
通过比较碱金属单质与氧气、水的反应, 我们可以看出,元素性质与原子结构有密 切关系,主要与原子核外电子的排布,特 别是 最外层电子数 有关。原子结构相 似的一族元素,它们在化学性质上表现出
ⅠA
0
ⅡA ⅢA Ⅳ A ⅤA ⅥA ⅦA
主族序数=最外层电子数
注 意
七主七副和零族,最后莫忘第Ⅷ族。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
8 6
1
7
8 7
8 8
89 - 10 10 10 10 4 5 6
10 10 10 11 11 11 78 9 0 1 2
3
过渡元素
镧 系 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71
锕 系
89
90
91
92
93
94
95
96
97
98
99
10 0
10 1
10 2
+3
+11 +19 +37 +55
结论:主族序数 = 最外层电子数
短周期:3个(第1、2、3周期)
周期:7个 长周期:3个(第4、5、6周期) (7个横行) 不完全周期:1个(第7周期) 周期表
主族:7个 族:16个 副族:7个
(18个纵行)
第Ⅷ 族:1个
0族:1个
周期序数=电子层数 元素位置
主族序数=最外层电子数
ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。
11 12 13 14 15 16 17 18
②过渡元素:
从ⅢB族到ⅡB族10个纵行的元素。它包括 了第Ⅷ族和全部副族元素,这些元素都是金属 元素。
第ⅠA族(除氢外):碱金属元素 第ⅣA族:碳族元素 第ⅤA称:氮族元素 第ⅥA族:氧族元素 第ⅦA族:卤族元素 0族:稀有气体元素
Au=197?
Bi=210
Tl=204 Pb=207
棱台型元素周期表
扇形元素周期表
螺旋型周期表
实物元素周期表
一、元素周期表
请同学们仔细观察元素周期表,阅读4-5页, 思考: 1、最早的元素周期表是以什么原则编排? 2、什么是原子序数?原子序数与原子结构有何关
系? 3、现在的周期表以什么原则编排?有多少横行?
高一化学必修2多媒体教学课件
第一章 第一节《元素周期表》
桃源九中高一化学备课组
1
1869年门捷列夫在继承和分析了 前人工作的基础上,对大量实验事实 进行了订正、分析和概括,成功地对 元素进行了科学分类。将化学性质相 似的元素放在一个纵行制出了第一张 元素周期表,揭示了化学元素的内在 联系,使其构成一个完整的体系成为 化学发展史上重要的里程碑之一。
10 3
横行叫周期,共有7周期;3、4分长短,第7不完全。 纵行称作族,总共十六族;一八依次现,一零再一遍; Ⅷ族最特殊,三行是一族:二三分主副,先主后副族; 镧锕各十五,均属ⅢB族;构位性一体,相互可推断。
①各族在元素周期表中的位置:
ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ,
1 2 3 4 5 6 7 8910
Zr=90 Nb=94 Mo=96 Rh=104.4 Ru=104.4 Pd=106.6 Ag=108 Cd=112 Ur=116 Sn=118 Sb=122 Te=128? I=127 Cs=133 Ba=137
?=180 Ta=182 W=186 Pt=197.44 Ir=198 Os=199 Hg=200
本节基本规律 ➢原子序数=核电荷数=质子数=核外电子数 ➢周期序数=电子层数 ➢主族序数=最外层电子数 ➢各周期的元素数目:2,8,8,18,
18,32,26(32) ➢稀有气体的原子序数:2,10,18, 36,54,86 ➢记住1~20号元素的名称和符号 ➢记住0族元素的序号
思考:Cl的位置描述:
第三周期VIIA族
第III周期 第3周期 第三周期
第七主族
VIIห้องสมุดไป่ตู้ VIIA族
电子层数周期数 最外层电子 主 数族序数
3、元素在周期表中位置确定方法
①结构简图法
本方法常用于原子序数小于18号元素或已知某 微粒的核外电子排布。其步骤为:原子序数→ 原子结构简图→ 电子层数周期数
Li=7
Na=23
K=39
Ca=40
?=45
?Er=56
?Yt=66
In=75
Ti=50 V=51 Cr=52 Mn=55 Fe=56 Ni=Co=59 Cu=63.4 Zn=65.2 ?=68 ?=70 As=75 Se=79.4 Br=80 Rb=85.4 Sr=87.6 Ce=92 La=94 Di=95 Th=118?
他还预言了一些未知元素的性质都 得到了证实。但是由于时代的局限, 门捷列夫揭示的元素内在联系的规律 还是初步的,他未能认识到形成元素 性质周期性变化的根本原因。
门捷列夫的第一张周期表
H=1
Be=9.4
Mg=24
B=11
Al=27.4
C=12
Si=28
N=14
P=31
O=16
S=32
F=19
Cl=35.5
多少周期?每周期有多少元素?有多少纵行? 有多少族?如何分布?
原子序数=核电荷数=质子数=核外电子数
一、元素周期表
1、编排原则:
① 按原子序数递增原则,从左到右排布
② 横行: 将电子层数相同的元素排成一个横行
③纵行: 把最外层电子数相同的元素按电子层数递增 的顺序从上到下排成纵行
2、结构
2、结构
(1)周期(横行) 具有相同的电子层数而又按原子序数递
增的顺序排列的一系列元素,称为一个周期。
周期序数 = 电子层数
练习
2、结构
(1)周期(横行)
周期
短周期:第一、二、三周期
(元素种数:分别为:2、8、8)
长周期:第四、五、六周期
(元素种数:分别为:18、18、32)
不完全周期:第七周期
(现已有元素26种)
2 2
2 3
2 4
2 5
2 6
2 7
2 8
2 9
3 0
3 1
3 2
3 3
3 4
3 5
3 6
5
3 7
3 8
3 9
4 0
4 1
4 2
4 3
4 4
4 5
4 6
4 7
4 8
4 9
5 0
5 1
5 2
5 3
5 4
5
6
5 5
5 767
7 2
7 3
7 4
7 5
7 6
7 7
7 8
7 9
8 0
8 1
8 2
8 3
8 4
8 5
原子结构或原子序数
周
期
I A
1 1 II
A
23 4
主 族
元素周期表
0
2 III IV V VI VI
K2
A A A A IA
副
族
5
6
7
8
9
1 0
L K
8 2
3
1 1
1 2
II I IV BB
V B
V
I
VI
IB
B
VIII
I II BB
1
1
1
1
1
1
M L
18 8
345678 k 2
4
1 9
2 0
2 1
三短三长一不全
2、结构
(2)族(纵行) 七主七副零八族
①主族:
由短周期元素和长周期元素共同构成的族。 表示方法:在族序数后面标一“A”字。ⅠA、ⅡA、 ⅢA、…
②副族:
完全由长周期元素构成的族。 表示方法:在族序数后标“B”字。如ⅠB、ⅡB、 ⅢB、…
③第VⅢ族:(“八、九、十” 三个纵行) ④0族:稀有气体元素
