分子间力氢键
分子内氢键与分子间氢键

分子内氢键与分子间氢键分子内氢键和分子间氢键是化学中两个重要的概念,它们在分子结构和性质上起着至关重要的作用。
本文将分别对这两个概念进行介绍和分析。
一、分子内氢键分子内氢键是指分子内部形成的氢键。
氢键是一种静电作用力,通常发生在含有氢原子的分子中,其中氢原子与较电负性的原子(如氧、氮、氟)形成的键。
氢键的形成与原子之间的电子云的相互作用有关。
分子内氢键在分子结构上起着至关重要的作用。
它可以影响分子的构象、稳定性和化学性质。
例如,DNA的双螺旋结构就是由分子内氢键所稳定的。
分子内氢键还可以影响分子的物理性质,如沸点、溶解度等。
因此,研究分子内氢键对于理解分子结构和性质具有重要意义。
二、分子间氢键分子间氢键是指分子之间形成的氢键。
分子间氢键是分子间相互作用的一种重要形式。
与分子内氢键不同,分子间氢键是在分子之间形成的。
它可以影响分子的聚集态和物理性质。
分子间氢键在许多领域中都具有重要的应用价值。
例如,在药物设计中,分子间氢键可以影响药物的溶解度和生物活性。
在材料科学中,分子间氢键可以影响材料的结晶性质和力学性能。
因此,研究分子间氢键对于合理设计和优化材料性能具有重要意义。
分子内氢键和分子间氢键在分子结构和性质上起着重要作用。
分子内氢键影响分子的构象和稳定性,而分子间氢键影响分子的聚集态和物理性质。
研究这两个概念对于理解分子的行为和性质具有重要意义,也有助于开发新的材料和药物。
希望通过本文的介绍,读者能对分子内氢键和分子间氢键有更深入的了解,并能进一步探索这两个概念在化学和材料科学中的应用。
化学键分子间作用力氢键

化学键分子间作用力氢键化学键指的是分子内原子之间的相互作用力,而分子间作用力则是指不同分子之间的相互作用。
分子间作用力一般分为三种类型:范德华力、电子偶极相互作用力和氢键。
其中氢键是分子间作用力中最为强大、常见和重要的一种。
氢键是指氢原子与较电负的原子发生作用力的一种静电相互作用力。
可以说,氢键是生命之源和物质世界的基础。
一、氢键的定义氢键是指氢原子与较电负的原子(如氮、氧和氟)上的孤对电子或π电子的相互作用力。
通俗的说,就是一个分子中的氢原子与另一个分子中的氧、氮、氟等原子之间的作用力,在分子中扮演着重要的角色。
氢键是一种独特的静电相互作用力,发生在分子之间,不同于共价键和离子键。
二、氢键的形成原理氢键的形成是因为氢原子与氧、氮、氟等元素的电负性相差较大,氢原子中心的正电荷和氧、氮、氟原子上的负电子相吸引,导致氢、氮、氧、氟之间发生静电相互作用力。
在氢键中,氢原子所带的正电性与氮、氧和氟原子上带有的负电性相互吸引形成一个小的电偶极。
因此,可以说氢键是氢与氧、氮、氟等元素之间的一种电子偶极相互作用力。
三、氢键的种类氢键根据成键方向可以分为线性氢键和非线性氢键。
线性氢键的配置形成氢键的方向是一条直线,而非线性氢键的配置则是对称的,可以是任意角度。
1. 线性氢键线性氢键是氢原子与较电负的原子上孤对电子或π电子成键的一种形态。
线性氢键通常是由两个分子之间相互作用所形成,成键的方向是成一条直线。
线性氢键除了O–H…O型的氢键外还有N–H…O型的,两者基本相同,只是其中的H原子的反应物不同。
2. 非线性氢键非线性氢键是指氢键的成键方向并不是线性,而是是不对称的。
除了H-O-H型氢键以外,有OH…π,NH…π和CH…O等类型的非线性氢键。
四、氢键在生物体系中的作用氢键在生物体系中发挥着多种多样的作用。
例如在DNA 的双螺旋结构中,两个串联的DNA链之间的成键就是O-H…O 型的氢键;在蛋白质的三维结构中,氢键是蛋白质分子内的一种重要的成键方式,涉及到蛋白质的稳定、折叠和功能性;在蛋白质与DNA相互作用后形成的复合物中,氢键也是重要的成键方式之一。
分子间力与氢键的形成与特性

分子间力与氢键的形成与特性引言:分子间力是指分子之间的相互作用力,它对于物质的性质和行为起着重要的影响。
其中,氢键作为一种特殊的分子间力,在化学和生物学领域中扮演着至关重要的角色。
本文将探讨分子间力的基本概念、氢键的形成与特性,并探讨其在化学和生物学中的应用。
一、分子间力的基本概念分子间力是指分子之间的相互作用力,它可以分为两种类型:吸引力和排斥力。
吸引力包括范德华力、静电引力和氢键等,而排斥力则由分子之间的电子云重叠引起。
这些力的作用决定了物质的相态、溶解度和化学反应速率等性质。
二、氢键的形成与特性氢键是一种特殊的分子间力,它是由氢原子与较电负的原子(如氧、氮和氟)之间的相互作用形成的。
氢键的形成需要满足三个条件:氢原子与较电负原子的共价键连接、氢原子与另一个较电负原子之间的静电引力以及分子间的适当排列。
氢键通常比范德华力要强,但比共价键要弱。
氢键具有以下特性:1. 强度和方向性:氢键通常比范德华力要强,但比共价键要弱。
它的强度与氢键中的氢原子和较电负原子之间的距离有关。
此外,氢键是有方向性的,即氢原子与较电负原子之间的键是直线状的。
2. 形成与断裂动力学:氢键的形成和断裂速率较快,这使得分子在氢键的存在下可以进行快速的结构变化和反应。
3. 影响物质性质:氢键对物质的性质和行为起着重要的影响。
例如,氢键可以影响物质的沸点、溶解度和晶体结构等。
三、氢键在化学中的应用氢键在化学中有广泛的应用,以下是其中几个方面的例子:1. 溶剂效应:溶剂中的氢键可以影响化学反应的速率和平衡。
例如,在水溶液中,氢键可以促进离子的溶解和反应。
2. 分子识别:氢键可以用于分子识别和分离。
例如,通过氢键的形成,可以选择性地将某些分子从混合物中分离出来。
3. 催化反应:氢键可以在催化反应中起到重要的作用。
例如,许多酶催化的生物反应中,氢键可以稳定过渡态和中间体,从而促进反应的进行。
四、氢键在生物学中的应用氢键在生物学中也有重要的应用,以下是其中几个方面的例子:1. 蛋白质结构:氢键在蛋白质的二级结构(如α-螺旋和β-折叠)中起到关键的稳定作用。
基础化学教学课件:1.6 分子间力与氢键

分子间力与氢键
共价键的极性 分子的极性 分子间作用力
氢键
共价键的极性
非极性键
H
H
氢气(H2)
极性键
H
Cl
氯化氢(HCl)
H
H
非极性键
H
Cl
极性键
同种元素的原子之间形成的共价键一定 是非极性键。
不同种元素的原子之间形成的共价键一 定是极性键。
共价键的极性
根据电荷分布是否均匀
共价键有非极性和极性之分
饱和性
共价键H原子通常只能形成1个氢键
方向性
以H原子为中心的3个原子X-H···Y尽可能在一条直线上
③ 使物质有较高的熔沸点,更易溶于水;
④ 解释一些反常现象(冰的密度比水小)。
谢谢
研究分子极性的意义
体系的分类
研究分子极性的意义
1.影响溶解性
“相似相溶”原理
极性分子的溶质易溶于极性溶剂 非极性分子的溶质易溶于非极性溶剂中
体系的分类
研究分子极性的意义
2.影响熔沸点 相对分子质量相近的分子,分子的极 性越强,分子间的范德华力越大,物 质的熔沸点越高。
范德华力
体系的分类
范德华力
氢键
氢键
同族元素的氢化物的沸点和熔点一般随相对分子 质量的增大而增高。
HF 的沸点和熔点比HCl的沸点和熔点高
HF分子之间存在范德华力和氢键两种作用力
氢键
形成条件
氢原子与原子半径较小,电负性大的原子 (N、O、F)形成氢键。
表示方法
X—H…Y—H
氢键
氢键的特点
① 比化学键弱,但比范德华力强;
② 具有饱和性和方向性;
分子间作用力的关系
分子间力 氢键 晶体
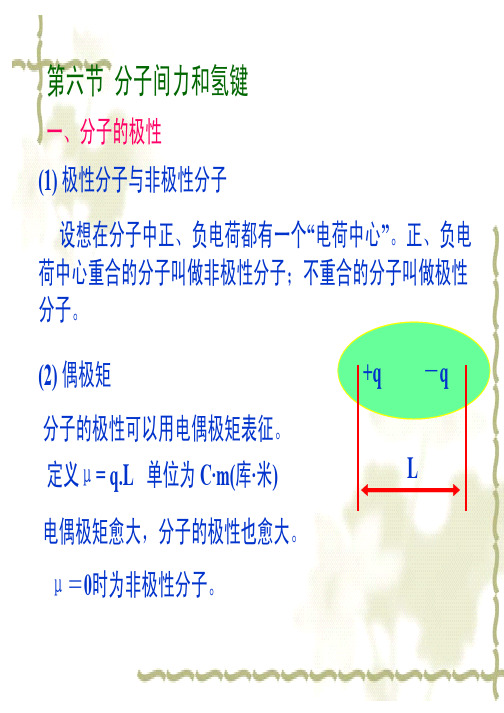
(1)极分子与极分子在分子中、负一个“中心”。
正、负中心合的分子叫做极分子;合的分子叫做极分子。
(2) 偶极分子的极可以偶极征。
+q -qL 定义μ= q.L 单位为C·m(库·)偶极愈大,分子的极也愈大。
μ=0时为极分子。
一、分子的极六分子力和氢(3) 分子的极与的极的关双原子分子分子的极与的极一。
三原子以上的分子分子的极,仅与的极关,与分子的构型关。
的极极:同原子形成的化学极:原子形成的化学双原子分子:H2Cl2—极分子,HCl,CO—极分子多原子分子: CH4, BF3, BeCl2, S8 ——极分子NH3, H2O, CH3Cl ——极分子,(1) 固偶极——极分子的中心叠二、分子力(2) 导偶极——外场作下,分子的中心发生对位产生的偶极。
电场撤去,导偶极消失。
极分子、非极分子在外加场的作下产生导偶极1.分子的偶极偶极子是指大小,号反,彼为d 的两个(+q,-q)所成的(2) 时偶极——分子中原子的子和核的对动会使分子的中心发生时的对位产生时偶极.何分子产生时偶极,时偶极存在时极,却反复发生。
2. 分子力的⑴取向力极分子中永久偶极的互作力。
极分子的取向力意图-+-++--+⑵诱导力导偶极与永久偶极的作力。
⑶色散力偶极的作力。
对大多数分子来,散力是主的(水外)。
±+-+-+-注意1.极分子与极分子 取向力、诱导力、色散力2.极分子与极分子 导力、色散力3.极分子与极分子 散力3.分子力的特征①是弱作力。
比化学小1-2个数。
O中,分子力47.28kJ.mol-1如H2E(OH)=463kJ.mol-1②是力。
在300pm-500pm效,且与r7成反比。
③无方向和和。
分子的极同,三力的比例也同,但散力是主的,存在于一切分子之。
其强度与分子的大小关,分子的增大增大。
4..氏力对物物理的影响构似的同列物(如卤、稀气体),分子大,偶极,分子作力强,物的熔沸;分子或,体大的变形大,熔沸。
分子间氢键原理

分子间氢键原理
分子间氢键原理
分子间氢键是一种分子间的相互作用力,它是由于氢原子与较电负的原子(如氧、氮、氟等)形成的电荷分布不均而产生的。
这种相互作用力在生物化学、有机化学、物理化学等领域中都有广泛的应用。
氢键的形成原理是基于分子间的电荷分布不均。
在分子中,氢原子的电子云密度较小,而氧、氮、氟等原子的电子云密度较大。
当这些原子之间距离较近时,氢原子的电子云会被邻近原子的电子云所吸引,从而形成一个电荷分布不均的局部区域。
这个局部区域被称为氢键供体。
另一方面,邻近原子的电子云也会被氢原子的电子云所吸引,形成一个电荷分布不均的局部区域,被称为氢键受体。
当氢键供体和氢键受体之间的距离适当时,它们之间会形成一个弱的相互作用力,即氢键。
氢键的强度较弱,通常只有分子间的范德华力的1/10到1/3。
但是,氢键在分子的结构和性质中起着至关重要的作用。
例如,在蛋白质的空间结构中,氢键是维持蛋白质的稳定性和功能性的重要因素。
在DNA分子中,氢键是维持DNA双螺旋结构的重要因素。
在有机化学中,氢键是分子间反应的重要催化剂。
总之,氢键是一种重要的分子间相互作用力,它在生物化学、有机化学、物理化学等领域中都有广泛的应用。
了解氢键的形成原理和特性,对于理解分子的结构和性质,以及分子间相互作用的机理具有重要的
意义。
分子间作用力、氢键、不同类型的晶体

晶体的类型
离子晶体 分子晶体 原子晶体 金属晶体
根据晶体构成 微粒和相互作 用不同分为四 种类型:
1、离子晶体
氯化钠晶体和晶体模型
氯 化 钠
Cl-
Na+
1、离子晶体
• 定义:
离子化合物中的阴、阳离子间按一定方式 有规则地排列而成的晶体叫做离子晶体。
构成微粒 阴、阳离子 作用力
离子键
形成离子晶体的物质: 离子化合物(NaCl、Na2O、BaSO4、铵盐等) 物理性质: 具有 的熔沸点,有 的硬度, 固态时 导电,在熔融状态或水溶液中 导电, 有些离子晶体 于水,有些 溶于水。
【问题探究1】
①在NaCl晶体中每个Na+同时吸 6 引着_个Cl ,每个Cl 同时吸引 着_个 6 Na+。
【问题探究2】
②在NaCl晶体中是否存在单 个的NaCl分子? 不存在
符号“NaCl”表示什么含义?
归纳 离子晶体一般熔沸点 较高、硬度较大,不 导电,但在熔融状态 时能导电。
2、分子晶体
原子晶 晶体类型 离子晶体 分子晶体 体 熔沸点 硬 度 较高 较硬
金属晶体
很低
一般很软
很高 很硬
有高有低 有硬有软
晶体不导 晶体不导 导电情况 电、熔化 电、熔化 不导电 能导电 微粒种类 离子 分子 微粒间的 作用力 离子键
一般 不导电 大多良好
原子 共价键
分子间 作用力
总结:1、物质熔沸点高低的比较
化学键
原子间 或离子间
作用力大 作用力小
影响化学性质和 物理性质
范德华力
分子之间
影响物理性质 (熔沸点等)
分子之间无化学键
一些氢化物的沸点
分子间形成氢键的条件和原因。

分子间形成氢键的条件和原因一、氢键的概念和特点1. 氢键是一种非共价的相互作用力,通常出现在分子间。
2. 在氢键中,氢原子与高电负性的原子(如氧、氮或氟)形成相互作用,通常以H...X的方式表示,其中X代表较高电负性的原子。
3. 氢键能够影响分子之间的结构、性质和反应,具有重要的生物学、化学和材料学意义。
二、形成氢键的条件1. 构成氢键的原子必须具有较高的电负性,如氧、氮或氟等元素。
2. 氢原子与高电负性原子形成氢键时,氢原子的正电荷与原子间的电子对产生吸引力,使得氢键形成。
3. 氢键的形成需要一定的几何构型条件,通常要求氢原子、接受氢键的原子和共价键中的原子在同一平面上。
三、氢键形成的原因1. 电负性差异:氢键形成的基本条件是原子间的电负性差异,如氢与氧、氮、氟等高电负性元素之间的相互作用。
2. 构型效应:氢键的形成还受到分子构型的影响,通常要求形成氢键的原子处于一定的构型条件下。
3. 距离效应:氢键的形成受到原子间距离的影响,通常要求形成氢键的原子之间的距离在一定的范围之内。
4. 分子间的相互作用力:除了氢键,分子之间的范德华力、静电作用等相互作用力也可能影响氢键的形成。
四、氢键的应用和意义1. 生物学中的应用:生物分子(如蛋白质、DNA)的结构和功能受到氢键的影响,深入研究氢键有助于理解生物分子的结构和活性。
2. 化学反应中的影响:在化学反应中,氢键的存在和破坏可能影响反应的进行和速率,对于理解和控制化学反应具有重要意义。
3. 材料学中的作用:在材料的设计和合成过程中,氢键的形成常常影响材料的结构和性质,有助于开发具有特定功能的新材料。
通过对分子间形成氢键的条件和原因进行系统的研究和理解,不仅有助于深入理解分子间相互作用的基本机制,也为相关领域的研究和应用提供了重要的理论基础。
希望未来能够深入探索氢键在生物学、化学和材料学等领域中的更广泛应用,推动相关领域的发展和创新。
五、氢键在生物学中的应用1. 蛋白质结构中的氢键:蛋白质是生物体内最重要的功能分子之一,在蛋白质的二级、三级结构中,氢键起到了至关重要的作用。
分子间力和氢键

上页 下页 返回 帮助
§1–6 分子间力和氢键
三、氢键
第一章 物质结构基础
【实例分析】如表1-6所示,多数卤素氢化物的熔、沸点 随相对分子质量增大而升高,但HF的熔、沸点却反常高。
表1-6 卤化氢的熔、沸点
卤化氢 熔点/K 沸点/K
HF 190 293
HCl 159 188
上页 下页 返回 帮助
§1–6 分子间力和氢键
(3)色散力 见图1-19。
± ±
第一章 物质结构基础
由瞬时偶极之间的作用而产生的分子间力。
+-
+-
图1-19 非极性分子相互作用示意图
色散力是普遍存在于各类分子之间的一种分子间力, 除强极性的水分子之间以取向力为主外,其余分子均以色 散力为主。
2.分子间力对物质性质的影响
AB3
五原子分子 AB4 AB3C
三角锥形
正四面体 四面体
极性
非极性 极性
NH3,NF3,PCl3,PH3
CH4,CCl4,SiH4,SnCl4 CH3Cl,CHCl3
上页
下页
返回
帮助
§1–6 分子间力和氢键
第一章 物质结构基础
分子的极性可用偶极矩衡量。偶极分子正电荷重心的 电量(q)与正、负电荷重心距离(d)的乘积,称为偶极 矩(μ)。即
这种已经和电负性很大的原子形成共价键的H原子,
又与另一电负性很大,且含有孤对电子的原子之间较强的 静电吸引作用,称为氢键。 氢键形成示意:X-H…Y。X、Y可以相同,也可不同。
上页 下页 返回 帮助
§1–6 分子间力和氢键
如图1-21所示
H H O H F
分子间力和氢键

分子间力和氢键
1.5.1 分子的极性 分子间力—Van der Waals力
1.5.2
1.5.3
氢键
1.5.1 分子的极性
电荷重心: 不重合时→偶极→极性分子 重合时→不具有偶极→非极性分子
+ + -
非极性分子
极性分子
分子的极性 键矩 例:C=O C-H O-H N-H 0 偶极矩=
4
氢键
氢键是特殊的分子间作用力。其作用力远 大于范德华力,但小于共价键作用,只有在特 殊的条件下才能存在,通常单独讨论。
(1)形成的条件 (2)氢键的类型
(3) 氢键的键能
(4)氢键的性质
(5)氢键对物性的影响
(1)形成的条件
H与电负性极强的元素相结合时,共用电子 对强烈偏向于高电负性原子,使H原子几乎成了 不带电子、半径极小的带正电的核,进而对电 子对表现出较强的吸引力,这种作用力就是氢 键。一般与H结合的元素应具有下列两个条件: 电负性差异大 原子半径小(F、O、N等)
分子
H2 Ar Xe CO HCl HBr HI NH3 H2O
色散能
0.17 8.49 17.41 8.74 16.82 28.45 60 0.00 0.008 1.10 0.71 0.31 1.55 1.92
取向能
0.00 0.00 0.00 0.003 3.30 1.09 0.59 13.30 36.36
分子中所含电子多,分子变形性增大,色散力所占 比例增大。
1. 2.
3.
对于分子晶体,晶体质点之间的作用力为分子间力. 而一般分子,分子量越大,分子体积越大,则变形性也越大,分子 间的色散力也会越大,即分子间作用力也越大,所以分子晶体的 熔沸点就会越高. 至于分子的溶解度符合"相似相溶"原则.即极性物质易溶于极 性溶剂中,非极性物质易溶于非极性溶剂中.
高中化学:分子间作用力和氢键知识点

高中化学:分子间作用力和氢键知识点[知识详解]一.分子间作用力1.定义:分子间存在着将分子聚集在一起的作用力,称分子间作用力。
分子间作用力也叫范德华力.2.实质:一种电性的吸引力.3.影响因素:分子间作用力随着分子极性.相对分子质量的增大而增大.分子间作用力的大小对物质的熔点.沸点和溶解度都有影响.一般来说.对于组成和结构相似的物质来说,相对分子质量越大,分子间作用力越强,物质的熔沸点也越高.4.只存在于由共价键形成的多数化合物,绝大多数非金属单质分子和分子之间. 化学键是分子中原子和原子之间的一种强烈的作用力,它是决定物质化学性质的主要因素。
但对处于一定聚集状态的物质而言,单凭化学键,还不足以说明它的整体性质,分子和分子之间还存在较弱的作用力。
物质熔化或汽化要克服分子间的作用力,气体凝结成液体和固体也是靠这种作用力。
除此以外,分子间的作用力还是影响物质的汽化热、熔化热、溶解黏度等物理性质的主要因素。
分子间的作用力包括分子间作用力(俗称范德华力)和氢键(一种特殊的分子间作用力)。
分子间作用力约为十几至几十千焦,比化学键小得多。
分子间作用力包括三个部分:取向力、诱导力和色散力。
其中色散力随分子间的距离增大而急剧减小一般说来,组成和结构相似的物质,分子量越大,分子间距越大,分子间作用力减小,物质熔化或汽化所克服的分子间作用力减小,所以物质的溶沸点升高温度止200 150 100, 50 0 -50 -100 -150 -200熔温度尺200 150叫0 -50 -100 -150 -200熔叫相对分子质■筑卤化碳的熔.沸点与相对分子质量的关系化学键与分子间作用力比较化学键分子间作用力概念 相邻的原子间强烈的相互作用 物质分子间存在的微弱的相互作用能量 较大很弱性质影响主要影响物质的化学性质主要影响物质的物理性质.氢键一特殊的分子间作用力1.概念:氢键是指与非金属性很强的元素(主要指N 、O 、F )相结合的氢原子与另一个分子中非金属性极强的原子间所产生的引力而形成的.必须是含氢 化合物,否则就谈不上氢键。
第四讲分子间作用力和氢键

键的极性与分子的极性 共价键有非极性键与极性键之分。由共价键构 建的分子有非极性分子与极性分子之分。 度量分子极性大小的物理量叫做偶极矩(m)。偶 极矩是偶极子的电量q和偶极子两极的距离l的乘积 (m=qXl)。
q+
l
q_
偶极子与偶极矩(m=qXl)
偶极矩m=0的共价键叫做非极性共价键;偶极矩 m≠0的共价键叫做极性共价键。偶极矩m=0的分子叫做 非极性分子;偶极矩m≠0的分子叫做极性分子。
在细胞内合成蛋白质过程中, 先是在细胞核中以DNA为模板,
通过“氢键”的“牵引”合成
RNA,然后由RNA在细胞质中 又通过“氢键”的“牵引”由 氨基酸合成蛋白质的一级结 构——多肽链。
蛋白质变性与分子内氢键
蛋白质变性与分子内氢键分不开。煮熟的鸡蛋孵不出 小鸡,这是蛋白质变性而失去生物活性的结果。蛋白质凭
范德华力和氢键是两类最常见的分子间力 化学键能: H–H 436 kJ/mol F–F 155 kJ/mol
O=O 708 kJ/mol
NN 945 kJ/mol >200kJ/mol 分子间作用力 <10 kJ/mol 氢键 10 –30 kJ/mol
Cl–Cl
243 kJ/mol
300 ~500pm
_ _ O O + O m=0 D
H
H C +
N _
m= D
色散力 相对于电子,分子中原子的位置相对固定,而分子 中的电子却围绕整个分子快速运动着。
于是,分子的正电荷重心 与负电荷重心时时刻刻不重合, 非极性分子 产生瞬时偶极。分子相互靠拢 _ _ 时,它们的瞬时偶极矩之间会 + + 产生电性引力,这就是色散力。 产生瞬时 色散力不仅是所有分子都有的 偶极 最普遍存在的范德华力,而且 _ + _ + 经常是范德华力的主要构成。
分子间力及氢键

(5)分类: 分子间氢键: 分子内氢键: (6)存在
NaHCO3固体中的氢键 邻硝基苯酚 邻羟基苯甲醛 固体(HF)n中的氢键
氢键存在广泛,如蛋白质分子、H2O、NH3、HF、DNA、醇、 羧酸分子及结晶水合物等分子之间。 (7)氢键对物质性质的影响:①溶质分子和溶剂分子间形成氢键, 溶解度骤增。如氨气极易溶于水;②分子间氢键的存在,使物 质的熔沸点升高。③有些有机物分子可形成分子内氢键,则此 时的氢键不能使物质的熔沸点升高。 例:NH3、H2O、HF中由于存在氢键,使得它们的沸点比同族 其他元素氢化物的沸点反常地高。
分子间作用力
概念 物质分子之间普遍存在的一种相 互作用力,又称范德华力
氢键
由已经与电负性很强的原子形成 共价键的氢原子与另一个分子中 电负性很强的原子之间的作用力
共价键
原子间通过共用电子对所形成 的相互作用
分类 特征 作用 微粒 强度 比较 影响 强度 的因 ①随着分子极性和相对分子质量 的增大而增大②组成和结构相似 的物质,相对分子质量越大,分 无方向性、无饱和性 分子或原子(稀有气体)
I2 > Br2 > Cl2 > F2。
2.氢键 (1)定义:氢键是一种既可以存在于分子之间又可以存在于分子 内部的作用力。它比化学键 弱 ,比范德华力 稍强 。当氢 原子与电负性大的原子X以共价键结合时,H原子能够跟另一个 电负性大的原子Y之间形成氢键。 (2)形成条件 ①化合物中有氢原子,即氢原子处在X—H„Y其间。 ②氢只有跟电负性很大且其原子半径较小的元素化合后,才有 较强的氢键,像这样的元素有N、O、F等。 (3)氢键基本上还是属于静电作用,它既有 方向 性,又有 饱和 性。 (4)通常用X—H„Y表示氢键,其中X—H表示氢原子和X原子 以共价键相结合。氢键的键能是指X—H„Y分解为X—H和Y所 需要的能量。
分子间作用力和氢键

【2】液态水汽化后化学性质是否发生了变化?
【A】没有
液态水汽化所需的能量大还是气态水分解所需的能量大? 液态水100摄氏度就可以汽化,而气态水在2000摄氏度时才会分解,因此气态水分解所需要的能量大,也就是说,分子间作用力的能量要远远小于化学键的能量
【Q】干冰汽化是物理变化还是化学变化?
【A】物理变化
【Q】干冰的化学性质有没有发生变化?
【A】没有
D. H │ H—N…H—O │ │ H H
【其他特点】
【1】分子间作用力比化学键弱得多,分子间作用力的能量远远小于化学键的能量
【2】由分子构成的物质,其熔点,沸点,溶解度等物理性质主要由分子间作用力大小决定
C. H │ H—N…O—H │ │ H H
D. H │ H—N…H—O │ │ H H
D
氨气溶于水时,大部分NH3 与H2O以氢键(用…)表示结合成NH3 ·H2O分子。根据氨水的性质可推知NH3 ·H2O的结构式为( )
B. H │ N—H …H—O │ │ H H
A.H │ N—H …O—H │ │ H H
C. H │ H—N…O—H │ │ H H
课堂练习
下列事实与氢键有关的是 ( ) A.水加热到很高的温度都难以分解 B.水结成冰体积膨胀,密度变小 C.CH4、SiH4、GeH4 、 SnH4的熔点随相对分子质量的增大而升高 D.HF、HCl、HBr、HI的热稳定性依次减弱
B
课堂练习
固体冰中不存在的作用力是 ( ) A.离子键 B.极性键 C. 氢键 D. 范德华力
干冰气化过程中有没有破坏其中的化学键?
那为什么干冰气化过程仍要吸收能量呢?
分子间力和氢键

分子间力和ห้องสมุดไป่ตู้键
2. 诱导力
当极性分子与非极性分子相邻时,非极性分子在极 性分子的作用下,正、负电荷中心发生偏移,这一过程 叫做分子的极化,所产生的偶极叫做诱导偶极。由诱导 偶极产生的分子间力叫做诱导力。诱导力不仅存在于极 性分子与非极性分子之间,也存在于极性分子之间,因 为一个极性分子在其他极性分子的作用下也会产生诱导 偶极,而使分子的偶极矩增大。
分子间力和氢键
1. 取向力
当两个极性分子相互靠近时,分子间因同极相斥、异 极相吸而使极性分子发生转动,并按两个极性分子异极相 邻的状态排列,这种分子间的相互作用现象叫做取向。由 于极性分子的取向而产生的分子间力叫做取向力。取向力 存在于极性分子之间,其大小主要决定于极性分子的偶极 矩,分子的偶极矩越大,则分子间取向力也越大。
分子间力和氢键
二、 分子间作用力的种类
H2、Cl2、CO2等物质在常温时是气体,在降低温度、增 大压强时,能够凝聚为液体,进一步能凝固为固体。气态物 质能够变为液态和固态,也就是说气态物质分子能缩短分子 间的距离,并由无规则运动变为有规则排列,这说明物质的 分子之间存在着作用力,这种作用力叫做分子间力。分子间 力是荷兰物理学家范德华(1837—1923年)在研究气体性质时首 次提出的,所以分子间力也叫做范德华力。
分子间力和氢键
四、 氢键 1. 氢键的形成
分子间力和氢键
色散力是由于分子内电子和原子核的相对运动而产 生的,所以不仅存在于非极性分子之间,也存在于极性 分子之间。影响色散力大小的因素是分子的分子量,分 子量越大,分子越容易变形,色散力也越大。
分子间力是色散力、诱导力、取向力的总和,除了 强极性分子外,分子间力以色散力为主。
分子间力和氢键
分子间力和氢键的区别

分子间力和氢键的区别
分子间力指的是分子的永久偶极和瞬间偶极引起的弱静电相互作用,包括范德华力、盐键、疏水作用力、芳环堆积作用、卤键等。
而氢键则是一种特殊的分子间作用力,是活泼的非金属原子与氢原子之间形成的强极性键(A-H)上的氢核,与电负性很大的、含孤电子对并带有部分负电荷的原子B之间的静电引力。
氢键的本质是强极性键上的氢核与电负性很大的、原子半径较小且带有未共享电子对的原子(如O、N、F等)之间的静电引力。
这种力一般在
40kJ/mol以下,比一般的键能小得多。
因此,分子间力和氢键在定义和性质上存在明显的差异。
如需了解更多关于分子间力和氢键的区别,建议查阅化学专业书籍或咨询化学专家。
分子内氢键和分子间氢键对电离

分子内氢键和分子间氢键对电离
氢键是一种分子间相互作用力,它在化学和生物学中起着至关重要的作用。
氢键可以分为分子内氢键和分子间氢键,它们对分子的电离过程有着重要的影响。
首先,让我们来了解一下分子内氢键和分子间氢键的概念。
分子内氢键是指同一分子内部的氢键作用,通常是由一个分子内的氢原子与该分子内的电负性较强的原子(如氧、氮或氟)形成氢键。
而分子间氢键则是指不同分子之间的氢键作用,通常是由一个分子内的氢原子与另一个分子内的电负性较强的原子形成氢键。
分子内氢键和分子间氢键对分子的电离过程有着不同的影响。
在分子内氢键作用下,分子内的氢键结构会影响分子内部的电子分布,从而影响到分子的电离性。
分子内氢键可以增强或减弱分子的电离性,具体取决于氢键的强度和位置。
另一方面,分子间氢键也会对分子的电离性产生影响。
分子间氢键可以影响分子的空间结构和分子之间的相互作用,从而影响到分子的电离过程。
分子间氢键的形成会改变分子的极性和稳定性,进而影响到分子的电离性。
总的来说,分子内氢键和分子间氢键对分子的电离过程都有着重要的影响。
它们可以通过调控分子的结构和相互作用来影响分子的电离性,进而影响到化学反应和生物过程。
因此,深入理解分子内氢键和分子间氢键对电离的影响机制,对于理解化学和生物学中的许多重要现象具有重要意义。
为什么分子间氢键和分子内氢键

为什么分子间氢键和分子内氢键首先,我们要了解分子间氢键和分子内氢键的定义。
所谓氢键,是指氢原子与电负性较强的原子(如氧、氮或氟)形成的一种非共价键。
当氢原子与另一个原子形成氢键时,氢原子的部分正电荷会与另一个原子的部分负电荷相互作用,从而产生一种相对稳定的相互作用力。
分子间氢键是指不同分子之间的氢键,而分子内氢键是指同一分子内的氢键。
分子间氢键和分子内氢键都有其独特的特点。
首先,分子间氢键通常是不同分子之间的相互作用力,其作用距离较远,通常在1.5到2.5埃之间。
而分子内氢键则是在同一分子内部产生的氢键,其作用距离较短,通常在1.5埃以内。
其次,分子间氢键和分子内氢键在形成的过程中所涉及的原子数量也有所不同。
分子间氢键通常涉及到两个不同分子之间的原子,而分子内氢键通常是在同一分子内的原子之间形成的。
最后,分子间氢键和分子内氢键在稳定性和作用力上也有所不同。
分子间氢键通常较为稳定,由于不同分子之间的作用力较强,而分子内氢键在分子内部的环境中受到的其他相互作用力比较复杂,因此稳定性较为复杂。
分子间氢键和分子内氢键在化学和生物学中都具有重要的作用。
在有机化学中,分子间氢键和分子内氢键常常是分子结构和性质的重要决定因素。
由于氢键的存在,许多有机分子的形状、构象和性质都受到了很大的影响。
在药物设计和生物医学领域,研究氢键对于理解药物与受体之间的相互作用也具有重要意义。
另外,在生物大分子的结构和功能研究中,氢键在蛋白质、核酸等生物大分子的稳定性和功能性中也起到了关键的作用。
总结以上所述,分子间氢键和分子内氢键在化学和生物学中都具有重要的作用。
它们的存在影响着分子的结构、性质和功能,对于药物设计、材料科学、生物医学等领域都具有重要意义。
因此,深入了解分子间氢键和分子内氢键的特点和作用对于进一步推进化学和生物学研究具有重要意义。
分子间形成氢键

分子间形成氢键
分子间氢键是分子间有氢键的液体,一般粘度较大。
例如甘油、磷酸、浓硫酸等多羟基化合物,由于分子间可形成众多的氢键,这些物质通常为黏稠状液体。
熔点、沸点分子间有氢键的物质熔化或气化时,除了要克服纯粹的分子间力外,还必须提高温度,额外地供应一份能量来破坏分子间的氢键,所以这些物质的熔点、沸点比同系列氢化物的熔点、沸点高。
分子间形成氢键的条件:
与电负性大、半径小的原子X(氟、氧、氮等)以共价键结合,若与电负性大的原子Y(与X相同的也可以)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的键,称为氢键。
对物质熔沸点的影响:
分子间能形成氢键的物质,一般都具有较高的熔点和沸点,这是因为固体熔化或液体汽化时除了破坏范德华力外,还必须破坏分子间氢键,从而需要消耗更多的能量。
在同类化合物中能形成分子间氢键的物质,其熔沸点比不能形成分子间氢键的高。
如,第VIA 族元素的氢化物,由H2Te、H2Se 到H2S,随相对分子量的递减,分子间作用力递减,熔沸点依次降低;但H2O 分子间形成了O-H…O 氢键,分子间作用力增强,H2O 的熔沸点陡然升高。
对物质溶解性的影响:
如果溶质分子与溶剂分子之间形成氢键,则溶质的溶解度会骤增。
如,氨在水中的溶解度大于其他气体,在20℃时,1 体积水吸收700 体积的氨。
氨在水中的溶解度特别大,是由于水分子和氨分子通过氢键互相结合形成氨的水合物;乙醇、乙二醇、丙三醇等可与水以任意比混溶,皆源于此。
如果溶质分子形成分子内氢键,则在极性溶剂中的溶解度减小,在非极性溶剂中的溶解度增大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
