有机化学汪小兰第十一章取代酸
有机化学课后习题参考答案完整版(汪小兰第四版)

目录第一章绪论 (1)第二章饱和烃 (2)第三章不饱和烃 (6)第四章环烃 (14)第五章旋光异构 (23)第六章卤代烃 (28)第七章波谱法在有机化学中的应用 (33)第八章醇酚醚 (43)第九章醛、酮、醌 (52)第十章羧酸及其衍生物 (63)第十一章取代酸 (71)第十二章含氮化合物 (77)第十三章含硫和含磷有机化合物 (85)第十四章碳水化合物 (88)第十五章氨基酸、多肽与蛋白质 (99)第十六章类脂化合物 (104)第十七章杂环化合物 (113)Fulin 湛师第一章 绪论1.1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2 NaCl 与KBr 各1mol 溶于水中所得的溶液与NaBr 及KCl 各1mol 溶于水中所得溶液是否相同?如将CH 4及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么? 答案:NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na +,K +,Br -, Cl -离子各1mol 。
由于CH 4与CCl 4及CHCl 3与CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合物。
1.3碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624H CCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4写出下列化合物的Lewis 电子式。
a.C 2H 4b.CH 3Clc.NH 3d.H 2Se.HNO 3f.HCHOg.H 3PO 4h.C 2H 6i.C 2H 2j.H 2SO 4 答案:a.C C H H HHCC HH HH或 b.H C H c.H N Hd.H S He.H O NO f.O C H Hg.O POO H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OH H或1.5下列各化合物哪个有偶极矩?画出其方向。
有机化学课后习题参考答案(汪小兰第四版)之欧阳育创编

绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2NaCl与KBr各1mol溶于水中所得的溶液与NaBr及KCl各1mol溶于水中所得溶液是否相同?如将CH4 及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol的混合物是否相同?为什么?答案:NaCl与KBr各1mol与NaBr及KCl各1mol溶于水中所得溶液相同。
因为两者溶液中均为Na+ , K+ , Br-, Cl-离子各1mol。
由于CH4 与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:1.4写出下列化合物的Lewis电子式。
a. C2H4b. CH3Clc. NH3d. H2Se. HNO3f. HCHOg.H3PO4 h. C2H6i. C2H2 j. H2SO4答案:1.5 下列各化合物哪个有偶极矩?画出其方向。
a. I2b. CH2Cl2c. HBrd. CHCl3e. CH3OHf. CH3OCH3答案:1.6根据S与O的电负性差别,H2O与H2S相比,哪个有较强的偶极-偶极作用力或氢键?答案:电负性O > S , H2O与H2S相比,H2O有较强的偶极作用及氢键。
1.7下列分子中那些可以形成氢键?答案:d. CH3NH2e. CH3CH2OH1.8醋酸分子式为CH3COOH,它是否能溶于水?为什么?答案:能溶于水,因为含有C=O和OH两种极性基团,根据相似相容原理,可以溶于极性水。
第二章 饱和烃2.1 卷心菜叶表面的蜡质中含有29个碳的直链烷烃,写出其分子式。
C29H602.2 用系统命名法(如果可能的话,同时用普通命名法)命名下列化合物,并指出(c)和(d) 中各碳原子的级数。
有机化学课后习题参考答案(汪小兰第四版)之欧阳音创编

绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2NaCl与KBr各1mol溶于水中所得的溶液与NaBr及KCl各1mol溶于水中所得溶液是否相同?如将CH4 及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol的混合物是否相同?为什么?答案:NaCl与KBr各1mol与NaBr及KCl各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na+ , K+ , Br-, Cl-离子各1mol。
由于CH4 与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:1.4写出下列化合物的Lewis电子式。
a. C2H4b. CH3Clc. NH3d. H2Se. HNO3f. HCHOg. H3PO4h. C2H6i. C2H2 j. H2SO4答案:1.5 下列各化合物哪个有偶极矩?画出其方向。
a. I2b. CH2Cl2c. HBrd. CHCl3e. CH3OHf. CH3OCH3答案:1.6根据S与O的电负性差别,H2O与H2S相比,哪个有较强的偶极-偶极作用力或氢键?答案:电负性O > S , H2O与H2S相比,H2O有较强的偶极作用及氢键。
1.7 下列分子中那些可以形成氢键?答案:d. CH3NH2e. CH3CH2OH1.8 醋酸分子式为CH3COOH ,它是否能溶于水?为什么?答案:能溶于水,因为含有C=O 和OH 两种极性基团,根据相似相容原理,可以溶于极性水。
第二章 饱和烃2.1 卷心菜叶表面的蜡质中含有29个碳的直链烷烃,写出其分子式。
C29H602.2 用系统命名法(如果可能的话,同时用普通命名法)命名下列化合物,并指出(c)和(d) 中各碳原子的级数。
有机化学课件第五版汪小兰第11章取代酸

当一个无分支直链直接与两个以上羧基相连时,则以直 接连接羧基最多的链烃的名称加后缀“某羧酸”来命名
COOH OH
水杨酸 邻羟基苯甲酸
CH COOH 柠 檬 酸 HO C COOH
2-羟 基 -1,2,3-丙 烷三 羧 酸 CH COOH
3-羟基-3-羧基戊二酸
HO CH COOH 异柠 檬 酸 CH COOH CH COOH 1-羟 基 -1,2,3-丙 烷三 羧 酸
例题2:
OO CH3CCH2COC2H5 C2H5ONa
OO CH3CCHCOC2H5 -Na+
Br
OO
CH3CHCH3 CH3CCHCOC2H5
CH(CH3)2
C2H5O-Na+
OO CH3CCCOC2H5 -Na+
CH(CH3)2
乙酰乙酸乙酯的钠盐还可以和卤代酮或卤代羧酸酯或酰卤作用,
则可在碳上分别引入-CH2COR,-CH2COOR,-COR等多种基 团
OO
O H O
H 3 C CC H 2 CO C 2 H 5
H 3 CC HC H CO C 2 H 5
酮 式 (9 2 .5 % )
互 变 异 构 烯 醇 式 (7 .5 % )
CH
H3C C
C OC2H5
OO
烯醇形 成 分 子内氢键
H
碱性条件下,有利于烯醇存在,特殊条件下,可分离 出烯醇。
乙酰乙酸乙酯的在有机合成中的应用
H C 3 C HC O O H O H 乳 酸
[O]
H C 3 CC O O H O 丙 酮 酸
3. α-羟基酸脱羧反应
CH3O CH H COO 稀H△H 2SO4 CH3CHO + HCOOH
最新《有机化学》(汪小兰编-第三版)
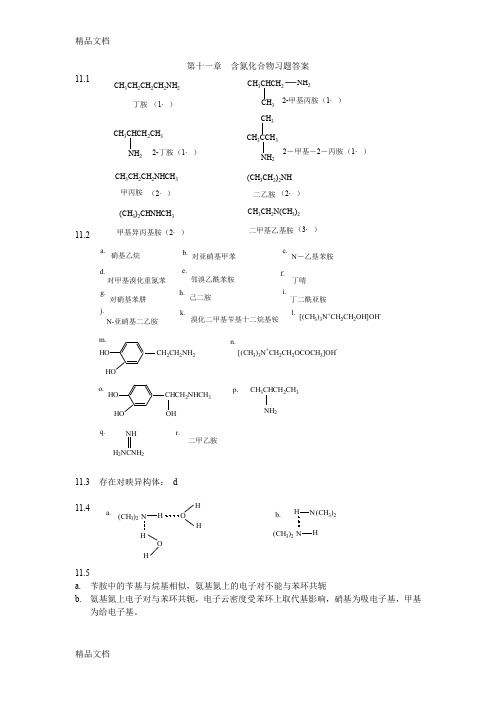
第十一章 含氮化合物习题答案11.111.211.3 存在对映异构体: d11.411.5a. 苄胺中的苄基与烷基相似,氨基氮上的电子对不能与苯环共轭b. 氨基氮上电子对与苯环共轭,电子云密度受苯环上取代基影响,硝基为吸电子基,甲基为给电子基。
a.硝基乙烷b.对亚硝基甲苯c.N -乙基苯胺d.对甲基溴化重氮苯e.邻溴乙酰苯胺f.丁啨g.对硝基苯肼h.己二胺i.j.N-亚硝基二乙胺k.溴化二甲基苄基十二烷基铵l.[(CH 3)3N +CH 2CH 2OH]OH -m.2CH 2NH 2[(CH 3)3N +CH 2CH 2OCOCH 3]OH -n.o.CHCH 2NHCH 3OH p.CH 3CHCH 2CH 3NH 2q.H 2NCNH 2NH r.二甲乙胺丁二酰亚胺(CH 3)2N H HO H H O H a. b.(CH 3)2N H H N (CH 3)2CH 3CH 2CH 2NHCH 3甲丙胺(2·)(CH 3CH 2)2NH 二乙胺(2·)(CH 3)2CHNHCH 3(2·)甲基异丙基胺CH 3CH 2N(CH 3)2(3·)CH 3CH 2CH 2CH 2NH 2丁胺(1·)CH 3CHCH 2CH 3NH 22-丁胺(1·)CH 3CHCH 2NH 232-甲基丙胺(1·)CH 3CCH 3CH 3NH 22-甲基-2-丙胺(1·)二甲基乙基胺11.611.7 a.叔胺 b. 伯胺 c.叔胺盐 d. 伯胺盐 e. 季铵盐f.叔胺g.仲胺h.仲胺盐11.8 作为亲核试剂的是:a ,b ,c ,d ,e ,f11.9(+)-酒石酸+(±)-仲丁胺(+)-仲丁胺.(+)-酒石酸.(+)-酒石酸(+)-仲丁胺(-)-仲丁胺a.3H 2SO 4NH 2b.NH 23NHCOCH 3NHCOCH 332H O/H +NH 2NO 2c.CH 3COOH 3CH 3COONH 4CH 3CONH 2d.CH 3CH 2OH K Cr O 24CH 3CHO C H MgBr H 2O/H CH 3CHCH 2CH 3OH CH 3CHCH 2CH 3Br NH CH 3CHCH 2CH 3NH 2过量233NO 2NH 2f.NO 2Br Br NH 22H +Br N 2+Cl -N=N NH 211.1011.11 a. FeCl 3,苯磺酰氯/NaOH b. AgNO 311.1211.13 苯磺酰氯/NaOH11.14 a<c<b<d<e11.153g.NH 22H N 2+Cl -CH 33CH 3CH 3OHN=N CH3a.N N b.N N N O=CCH 3c.CH 3d.N CH 3CH 3+I -Ne.N 2f.N O=CCH 2CH 3g.N=O N CH 3HNO 2-+h.CH 3HCl -+N H 2Cl -+a. b.c. d.(C 2H 5)3N +Br -3)2(CH 3)3N +(CH 2)3CH 3CH 3NCH 3COCH 2CH 3NO N(C 2H 5)2苄胺苄醇对甲苯酚水层(对甲苯酚钠)有机层H CO 对甲苯酚HCl 有机层(苄醇)NaOH 苄胺11.16有关反应式略A. B.C.CH 3CHCH 2CH(CH 3)2NH 2CH 3CHCH 2CH(CH 3)2OHCH 3CH=CHCH(CH 3)2。
有机化学答案汪小兰第四版

答案:
a. 2-乙基-1-丁烯
2-ethyl-1-butene
b. 2-丙基-1-己烯
propyl-1-hexene c. 3,5-二甲基-3-庚烯 3,5-dimethyl-3-heptene
d. 2,5-二甲基-2-己烯 2,5-dimethyl-2-hexene
Br
CH3
a.
H CH3
Br H
H CH3
Br H
Br
CH3
答案: a 是共同的
CH3
Br
b. Br H
H
CH3
H3C
Br H
H
CH3 Br
2.13 用纽曼投影式画出 1,2-二溴乙烷的几个有代表性的构象。下列势能图中的 A,B,C,D 各 代表哪一种构象的内能?
答案:
BrBr
A
HH
H
H
Br
BH
Br
1、 含有两个三级碳原子的烷烃 2,3-dimethylbutane 2、 含有一个异丙基的烷烃 2-methylpentane
3、 含有一个四级碳原子和一个二级碳原子的烷烃 2,2-dimethylbutane
2.7 用 IUPAC 建议的方法,画出下列分子三度空间的立体形状:
H
Cl
CH3
HC H
3.4 用系统命名法命名下列键线式的烯烃,指出其中的 sp2 及 sp3 杂化碳原子。分子中的σ 键有几个是 sp2-sp3 型的,几个是 sp3-sp3 型的?
3-ethylhex-3-ene
3-乙基-3-己烯,形成双键的碳原子为 sp2 杂化,其余为 sp3 杂
化,σ键有 3 个是 sp2-sp3 型的,3 个是 sp3-sp3 型的,1 个是 sp2-sp2 型的。
有机化学课后习题参考答案(汪小兰第四版)之欧阳学创编

绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2NaCl与KBr各1mol溶于水中所得的溶液与NaBr及KCl各1mol溶于水中所得溶液是否相同?如将CH4 及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol 的混合物是否相同?为什么?答案:NaCl与KBr各1mol与NaBr及KCl各1mol溶于水中所得溶液相同。
因为两者溶液中均为Na+ , K+ , Br-, Cl-离子各1mol。
由于CH4 与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:1.4写出下列化合物的Lewis电子式。
a. C2H4b. CH3Clc. NH3d. H2Se. HNO3f. HCHOg. H3PO4 h. C2H6i. C2H2 j. H2SO4答案:1.5 下列各化合物哪个有偶极矩?画出其方向。
a. I2b. CH2Cl2c. HBrd. CHCl3e. CH3OHf. CH3OCH3答案:1.6根据S与O的电负性差别,H2O与H2S相比,哪个有较强的偶极-偶极作用力或氢键?答案:电负性O > S , H2O与H2S相比,H2O有较强的偶极作用及氢键。
1.7下列分子中那些可以形成氢键?答案:d. CH3NH2e. CH3CH2OH1.8醋酸分子式为CH3COOH,它是否能溶于水?为什么?答案:能溶于水,因为含有C=O和OH两种极性基团,根据相似相容原理,可以溶于极性水。
第二章 饱和烃2.1 卷心菜叶表面的蜡质中含有29个碳的直链烷烃,写出其分子式。
C29H602.2 用系统命名法(如果可能的话,同时用普通命名法)命名下列化合物,并指出(c)和(d) 中各碳原子的级数。
第十一章取代酸教程
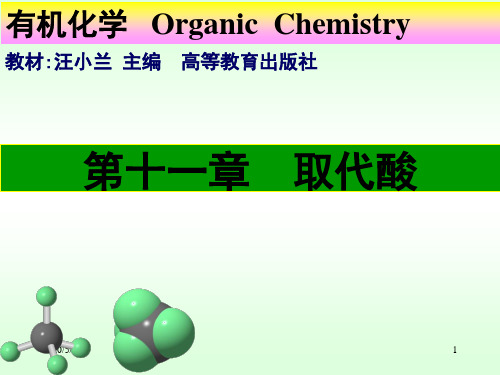
1、 酸性
醇酸:
pKa CH3CHCOOH OH 3.87
丙酸:4.87
> CH2CH2COOH OH 4.51
COOH
酚酸
pKa
2018/12/31
COOH
COOH OH
COOH
OH
OH
4.17
3.0
4.12
4.54
13
a、邻位效应:不论是钝化基团还是活化基团 (氨基除外)在邻位时,都能使苯甲酸的 酸性增强。这种特殊影响叫邻位效应。
17
4、 失水反应
• 醇酸的热稳定性较差,加热时 易发生脱水反应,但脱水反应 随羟基的位置不同而得到不同 的产物。
2018/12/31
18
A)α-醇酸脱水----交酯
α-羟基酸受热时,发生分子间羧基和羟基 的交叉脱水反应,生成六元环的交酯。
H O H3C C C OH O H
H O HO C C CH3 O H
24
羟基酸的重要化合物
① 乳酸: 存在:酸牛奶(外消旋)、蔗糖发 酵(左旋)、肌肉中(右旋)。 用途:具有很强的吸湿性;工业上 作除钙剂(钙盐不溶于水);食品 工业中作增酸剂;钙盐可补钙。 ② 苹果酸(α-羟基酸)
H H3C C COOH OH
乳酸
H C
存在:未成熟的果实内;植物的叶 子中;自然界中存在的是左旋体。
-2H2O
O C H3C CH O O CH CH3 C O 19
2018/12/31
B)β-醇酸脱水----α,β-不饱和酸
H3C
CH CH COOH -H2O OH H
H3C
2018/12/31
CH
CH COOH
有机化学答案汪小兰

有机化学答案汪小兰【篇一:汪小兰有机化学答案】>1.2绪论nacl与kbr各1mol与nabr及kcl各1mol溶于水中所得溶液相同。
因为两者溶液--中均为na+ , k+ , br, cl离子各1mol。
由于ch4 与ccl4及chcl3与ch3cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3c+624hcy2pz2p2s2pxhch4中c中有4个电子与氢成键为sp3杂化轨道,正四面体结构ch4sp3杂化1.4a.hcchhhc.d.或hchchhb.hhh或hhhhhshe.hof.ohchg.hhhhhh.hhhhi.hcchj.hho或hh1.5b.clc.hbrd.h3ce.hf.h3c31.6电负性 o s , h2o与h2s相比,h2o有较强的偶极作用及氢键。
1第二章饱和脂肪烃2.1a. 2,4,4-三甲基-5-正丁基壬烷5-butyl-2,4,4-trimethylnonaneb. 正己烷 hexanec. 3,3-二乙基戊烷3,3-diethylpentaned. 3-甲基-5-异丙基辛烷5-isopropyl-3-methyloctanee. 2-甲基丙烷(异丁烷)2-methylpropane (iso-butane)f. 2,2-二甲基丙烷(新戊烷) 2,2-dimethylpropane (neopentane)g. 3-甲基戊烷3-methylpentaneh. 2-甲基-5-乙基庚烷5-ethyl-2-methylheptane2.2a = b = d = e为2,3,5-三甲基己烷c = f 为2,3,4,5-四甲基己烷2.3a.错,应为2,2-二甲基丁烷b.c.d.e.f.错,应为2,3,3-三甲基戊烷g.错,应为2,3,5-三甲基庚烷h.2.5c b e a d 2.63 种1clcl23cl2.7 a是共同的 2.8abcd2.10这个化合物为2.11 稳定性 c a b第三章不饱和脂肪烃3.1 用系统命名法命名下列化合物a. 2-乙基-1-丁烯2-ethyl-1-buteneb. 2-丙基-1-己烯2-propyl-1-hexenec. 3,5-二甲基-3-庚烯 3,5-dimethyl-3-heptened. 2,5-二甲基-2-己烯 2,5-dimethyl -2-hexene 3.22a.b.错,应为1-丁烯c.d.e.h.f.错,应为2,3-二甲基-1-戊烯g.错,应为2-甲基-3-乙基-2-己烯3.4 下列烯烃哪个有顺、反异构?写出顺、反异构体的构型,并命名。
有机化学课后习题参考答案完整版(汪小兰第四版)

______________________________________________________________________________________________________________目录第一章绪论 (1)第二章饱和烃 (3)第三章不饱和烃 (8)第四章环烃 (19)第五章旋光异构 (30)第六章卤代烃 (37)第七章波谱法在有机化学中的应用 (44)第八章醇酚醚 (58)第九章醛、酮、醌 (69)第十章羧酸及其衍生物 (83)第十一章取代酸 (93)第十二章含氮化合物 (100)第十三章含硫和含磷有机化合物 (111)第十四章碳水化合物 (114)第十五章氨基酸、多肽与蛋白质 (129)第十六章类脂化合物 (136)第十七章杂环化合物 (148)______________________________________________________________________________________________________________ Fulin 湛师第一章绪论1.1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2 NaCl与KBr各1mol溶于水中所得的溶液与NaBr及KCl各1mol溶于水中所得溶液是否相同?如将CH4及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol的混合物是否相同?为什么?答案:NaCl与KBr各1mol与NaBr及KCl各1mol溶于水中所得溶液相同。
因为两者溶液中均为Na+,K+,Br -, Cl-离子各1mol。
由于CH4与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
有机化学课后习题答案(汪小兰,第三版)

第一章 绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
1.2NaCl 与KBr 各1mol 溶于水中所得的溶液与NaBr 及KCl 各1mol 溶于水中所得溶液是否相同?如将CH 4 及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么?答案: NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na + , K + , Br -, Cl -离子各1mol 。
由于CH 4 与CCl 4及CHCl 3与CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624HCCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4 写出下列化合物的Lewis 电子式。
a. C 2H 2b. CH 3Clc. NH 3d. H 2Se. HNO 3f. HCHOg. H 3PO 4 h. C 2H 6 i. C 2H 2 j. H 2SO 4答案:a.C C H H H HCC HH HH或 b.H C H c.H N HHd.H S He.H O NO f.O C H Hg.O P O O H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OH H或1.5 下列各化合物哪个有偶极矩?画出其方向。
a. I 2b. CH 2Cl 2c. HBrd. CHCl 3e. CH 3OHf. CH 3OCH 3 答案:b.ClClc.HBrd.He.H 3COHH 3COCH 3f.1.6 根据S 与O 的电负性差别,H 2O 与H 2S 相比,哪个有较强的偶极-偶极作用力或氢键? 答案:电负性 O > S , H 2O 与H 2S 相比,H 2O 有较强的偶极作用及氢键。
《有机化学》(汪小兰编-第三版)
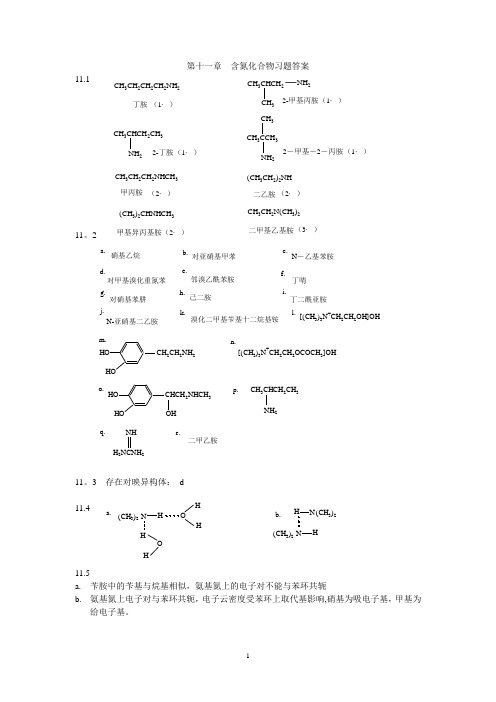
第十一章 含氮化合物习题答案11.111。
211。
3 存在对映异构体: d11.411.5a. 苄胺中的苄基与烷基相似,氨基氮上的电子对不能与苯环共轭b. 氨基氮上电子对与苯环共轭,电子云密度受苯环上取代基影响,硝基为吸电子基,甲基为给电子基。
a.硝基乙烷b.对亚硝基甲苯c.N -乙基苯胺d.对甲基溴化重氮苯e.邻溴乙酰苯胺f.丁啨g.对硝基苯肼h.己二胺i.j.N-亚硝基二乙胺k.溴化二甲基苄基十二烷基铵l.[(CH 3)3N +CH 2CH 2OH]OH -m.2CH 2NH 2[(CH 3)3N +CH 2CH 2OCOCH 3]OH -n.o.CHCH 2NHCH 3OH p.CH 3CHCH 2CH 3NH 2q.H 2NCNH 2NH r.二甲乙胺丁二酰亚胺(CH 3)2N H HO H H O H a. b.(CH 3)2N H H N (CH 3)2CH 3CH 2CH 2NHCH 3甲丙胺(2·)(CH 3CH 2)2NH 二乙胺(2·)(CH 3)2CHNHCH 3(2·)甲基异丙基胺CH 3CH 2N(CH 3)2(3·)CH 3CH 2CH 2CH 2NH 2丁胺(1·)CH 3CHCH 2CH 3NH 22-丁胺(1·)CH 3CHCH 2NH 2CH 32-甲基丙胺(1·)CH 3CCH 3CH 3NH 22-甲基-2-丙胺(1·)二甲基乙基胺11。
611.7 a.叔胺 b. 伯胺 c 。
叔胺盐 d. 伯胺盐 e. 季铵盐f 。
叔胺g 。
仲胺h 。
仲胺盐11。
8 作为亲核试剂的是:a ,b ,c ,d ,e ,f11.9(+)-酒石酸+(±)-仲丁胺(+)-仲丁胺.(+)-酒石酸.(+)-酒石酸(+)-仲丁胺(-)-仲丁胺a.3H 2SO 4NH 2b.NH 23NHCOCH 3NHCOCH 332H O/H +NH 2NO 2c.CH 3COOH 3CH 3COONH 4CH 3CONH 2d.CH 3CH 2OH K Cr O 24CH 3CHO C H MgBr H 2O/H CH 3CHCH 2CH 3OH CH 3CHCH 2CH 3Br NH CH 3CHCH 2CH 3NH 2过量233NO 2NH 2f.NO 2Br Br NH 22H +Br N 2+Cl -N=N NH 211.1011.11 a. FeCl 3,苯磺酰氯/NaOH b 。
汪小兰有机化学第四版课后答案

第一章 绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:离子键化合物 共价键化合物 熔沸点 高 低溶解度 溶于强极性溶剂 溶于弱或非极性溶剂 硬度 高 低1.2 NaCl 与KBr 各1mol 溶于水中所得的溶液与NaBr 及KCl 各1mol 溶于水中所得溶液是否相同?如将CH 4 及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么?答案: NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na + , K + , Br -, Cl -离子各1mol 。
由于CH 4 与CCl 4及CHCl 3与CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624H+11CCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化HHHH C 1s 2s 2p 2p 2p y zx 2p yx yz2p zxyz2p xxyz 2sH1.4 写出下列化合物的Lewis 电子式。
a. C 2H 2b. CH 3Clc. NH 3d. H 2Se. HNO 3f. HCHOg. H 3PO 4h. C 2H 6i. C 2H 2j. H 2SO 4答案:a.C C H H H HCC HH HH或 b.H C H H Clc.H N HHd.H S He.H O NOO f.O C H Hg.O P OO O H H Hh.H C C HHH H HO P O O OH HH或i.H C C Hj.O S O HH OOO S O OOH H或1.5 下列各化合物哪个有偶极矩?画出其方向。
有机化学课后习题参考答案完整版(汪小兰第四版)

目录第一章绪论 (1)第二章饱和烃 (2)第三章不饱和烃 (6)第四章环烃 (14)第五章旋光异构 (23)第六章卤代烃 (28)第七章波谱法在有机化学中的应用 (33)第八章醇酚醚 (43)第九章醛、酮、醌 (52)第十章羧酸及其衍生物 (63)第十一章取代酸 (71)第十二章含氮化合物 (77)第十三章含硫和含磷有机化合物 (85)第十四章碳水化合物 (88)第十五章氨基酸、多肽与蛋白质 (99)第十六章类脂化合物 (104)第十七章杂环化合物 (113)Fulin 湛师第一章 绪论1.1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2 NaCl 与KBr 各1mol 溶于水中所得的溶液与NaBr 及KCl 各1mol 溶于水中所得溶液是否相同?如将CH 4及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么? 答案:NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na +,K +,Br -, Cl -离子各1mol 。
由于CH 4与CCl 4及CHCl 3与CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合物。
1.3碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624H CCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4写出下列化合物的Lewis 电子式。
a.C 2H 4b.CH 3Clc.NH 3d.H 2Se.HNO 3f.HCHOg.H 3PO 4h.C 2H 6i.C 2H 2j.H 2SO 4 答案:a.C C H H HHCC HH HH或 b.H C H c.H N Hd.H S He.H O NO f.O C H Hg.O POO H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OH H或1.5下列各化合物哪个有偶极矩?画出其方向。
汪小兰版有机化学答案全

绪论1.1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2NaCl与KBr各1mol溶于水中所得的溶液与NaBr及KCl各1mol溶于水中所得溶液是否相同?如将CH4及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol的混合物是否相同?为什么?答案:NaCl与KBr各1mol与NaBr及KCl各1mol溶于水中所得溶液相同。
因为两者溶液中均为Na+,K+,Br-,Cl-离子各1mol。
由于CH4与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:CH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2s1.4写出下列化合物的Lewis 电子式。
a.C 2H 4b.CH 3Clc.NH 3d.H 2Se.HNO 3f.HCHOg.H 3PO 4h.C 2H 6i.C 2H 2j.H 2SO 4答案:a.C C H H CC HH HH或 b.H C H c.H N Hd.H S He.H O NO f.O C H Hg.O P O O H H Hh.H C C HH HO P O O H HH或i.H C C Hj.O S O HH OO H H或1.5下列各化合物哪个有偶极矩?画出其方向。
a.I 2b.CH 2Cl 2c.HBrd.CHCl 3e.CH 3OHf.CH 3OCH 3 答案:b.ClClc.HBrd.He.H 3COHH 3COCH 3f.1.6 根据S 与O 的电负性差别,H 2O 与H 2S 相比,哪个有较强的偶极-偶极作用力或氢键?答案:电负性O>S,H2O与H2S相比,H2O有较强的偶极作用及氢键。
汪小兰版有机化学答案全

绪论1.1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2NaCl与KBr各1mol溶于水中所得的溶液与NaBr及KCl各1mol溶于水中所得溶液是否相同?如将CH4及CCl4各1mol混在一起.与CHCl3及CH3Cl各1mol的混合物是否相同?为什么?答案:NaCl与KBr各1mol与NaBr及KCl各1mol溶于水中所得溶液相同。
因为两者溶液中均为Na+,K+,Br-,Cl-离子各1mol。
由于CH4与CCl4及CHCl3与CH3Cl在水中是以分子状态存在.所以是两组不同的混合物。
1.3碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时.碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624H CCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4写出下列化合物的Lewis 电子式。
a.C 2H 4b.CH 3Clc.NH 3d.H 2Se.HNO 3f.HCHOg.H 3PO 4h.C 2H 6i.C 2H 2j.H 2SO 4答案:a.C C H H H HCC HH HH或 b.H C H c.H N HHd.H S He.H O NO f.O C H Hg.O P O O H H h.H C C HHH H HO P O O H H或i.H C C Hj.O S O HH OO H H或1.5下列各化合物哪个有偶极矩?画出其方向。
a.I 2b.CH 2Cl 2c.HBrd.CHCl 3e.CH 3OHf.CH 3OCH 3 答案:b.ClClc.HBrd.He.H 3COHH 3COCH 3f.1.6 根据S 与O 的电负性差别.H 2O 与H 2S 相比.哪个有较强的偶极-偶极作用力或氢键? 答案:电负性O>S,H 2O 与H 2S 相比.H 2O 有较强的偶极作用及氢键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
②γ—羟基丁酸钠具有麻醉作用,但不影响基础代谢和呼吸, 故经常将它用于呼吸功能不全的患者手术时的麻醉剂。
3.酚酸的脱羧反应 (1)反应实例
(2)应用:生物体内的脱羧及氧化、脱水等反应
9.2.2 羰基酸
一、羰基酸的概念、分类和命名
(一)概念:脂肪酸分子烃基上的氢原子被氧原子取代的化合物
一、羟基酸的分类及命名
(一)分类:醇酸和酚酸
(二)命名:
(二)羟基酸的物理性质 许多醇酸(液体)还具有旋光性;水中溶解度大;而酚酸是固体。
(三)羟基酸的化学性质 —— 主要介绍复合官能团所产生的特殊性质
1.酸性
2.脱水反应 (1)α—羟基酸
(2)β-羟基酸 (3)γ-和δ-羟基酸
★应用 ①内酯在酸、碱存在下发生水解反应,在碱存在下,来自生成稳第十一章 取代酸
概念:羧酸分子中烃基上的氢原子被其他具有官能团性质的原 子或基团取代的化合物称为取代羧酸
分类:根据取代官能团的不同,可分为卤代酸、羟基酸、羰基 酸和氨基酸
意义:许多羟基酸和羰基酸是生物代谢的中间产物;一些羟基 酸还对某些疾病具有治疗价值;氨基酸则是构成蛋白质的本结构单 元
9.2.1 羟基酸
③应用 ●生物体内糖代谢过程中就包含着α-酮酸和β-酮酸的脱羧
反应
●酮体的概念和意义 α—丁酮酸、β—羟基丁酸及丙酮三者总称酮体(ketonebody)
酮体是脂肪酸在人体内不完全氧化的中间产物。健康人血液中 酮体含量在0.8~5mg·100mL-1,一昼夜随尿排出的酮体为40mg。 当体内代谢发生障碍时,血液酮体的含量可增加到300—400mg·100 ml-1以上,判断一个人是否患有糖尿病,除检查尿中葡萄糖含量外, 还可化验是否有丙酮存在。晚期糖尿病人血液中酮体含量增多,可 引起酸中毒致死。
2.酸式分解
9.2.3 酮式—烯醇式互变异构
一、乙酰乙酸乙酯的“不可思议”反应
乙酰乙酸乙酯能与FeCl3溶液发生颜色反应;使溴水褪色;并与 金属钠作用放出氢气。
二、为什么?
像这种不同分异构体之间能以一定比例平衡存在,并能相互转 化的现象称为互变异构现象(tautomerism),两种互为平衡的异构体 称为互变异构体。酮式与烯醇式之间的互变异构现象叫酮式烯醇式 互变异构现象
(二)分类:醛酸和酮酸
(三)命名:羰基酸的命名与醇酸相似,也是以羧酸为母体,羰基 的位置用阿拉伯数字或希腊字母表示。
二、羰基酸的化学性质
—— 主要介绍复合官能团所产生的特殊性质 (一)α-酮酸的分解反应
(二)α-酮酸的氨基化反应
★应用
(三)β-酮酸的分解反应 1.酮式分解 ①反应实例
②反应特点:β-酮酸只有在低温下稳定,在室温以上易脱羧生 成酮,β-酮酸受热时比α-酮酸更易脱羧。为什么?
三、乙酰乙酸乙酯存在酮式烯醇式互变异构的实验证明
晶体羰基反应酮式 -78℃ 石油醚
油状液体烯醇式反应烯醇式
四、乙酰乙酸乙酯存在酮式烯醇式互变异构的理论根据
活泼亚甲基 共轭体系 分子内氢键 结论凡具有下列结构特点的化合物,即能观察到酮式—烯醇式 互变异构体的存在 ①分子中的亚甲基受两个相邻极性基团的影响,使氢原子酸 性增强。 ②形成的烯醇式结构中,共轭体系有所延伸,使体系内能降 低,更趋于稳定。 ③烯醇式结构可形成分子内氢键,增强烯醇式的稳定性。
(下页还有一个图表)
