化合物溶解性全表
常见有机溶剂的溶解性汇总

也有一定的刺激性。不同有机溶剂其作用的主要靶*****和作用的强弱也不同,这决定于每一种有机溶剂 的化学结构、溶解度、接触浓度和时间,以及机体的敏感性。 毒性 ①神经毒性。以脂肪烃(正己烷、戊烷、汽油)、芳香烃(苯、苯乙烯、丁基甲苯、乙烯基甲苯)、氯化烃(三 氯乙烯、二氯甲烷),以及二硫化碳、磷酸三邻甲酚等脂溶性较强的溶剂为多见。有机溶剂对神经系统的损 害大致有三种类型:第一种为中毒性神经衰弱和植物神经功能紊乱。病人可有头晕、头痛、失眠、多梦、 嗜睡、无力、记忆力减退、食欲不振、消瘦,以及多汗、情绪不稳定,心跳加速或减慢、血压波动、皮肤 温度下降或双侧肢体温度不对称等表现;第二种为中毒性末梢神经炎。大部分表现为感觉型,其次为混合 型。可有肢端麻木、感觉减退、刺痛、四肢无力、肌肉萎缩等表现;第三种为中毒性脑病,比较少见,见 于二硫化碳、苯、汽油等有机溶剂的严重急、慢性中毒。 ②血液毒性。以芳香烃,特别是苯最常见。苯达到一定剂量即可抑制骨髓造血功能,往往先有白细胞减少, 以后血小板减少,最后红细胞减少,成为全血细胞减少。个别接触苯的敏感者,可发生白血病。 ③肝肾毒性。多见于氯代烃类有机溶剂,如氯仿、四氯化碳、三氯乙烯、四氯乙烯、三氯丙烷、二氯乙烷 等中毒。中毒性肝炎的病理改变主要是脂肪肝和肝细胞坏死。临床上可有肝区痛、食欲不振、无力、消瘦、 肝脾肿大、肝功能异常等表现。有机溶剂引起的肾损害多见为肾小管型,产生蛋白尿,肾功能呈进行性减 退。 ④皮肤粘膜刺激。多数有机溶剂均有程度不等的皮肤粘膜刺激作用,但以酮类和酯类为主。可引起呼吸道 炎症、支气管哮喘、接触性和过敏性皮炎、湿疹、结膜炎等。 防治 生产和使用有机溶剂时,要加强密闭和通风,减少有机溶剂的逸散和蒸发。采用自动化和机械化操 作,以减少操作人员直接接触的机会。应使用个人防护用品,如防毒口罩或防护手套。皮肤粘膜受污染时, 应及时冲洗干净。勿用污染的手进食或吸烟。勤洗手、洗澡与更衣。应定期进行健康检查,及早发现中毒 征象时,进行相应的治疗和严密的动态观察。
溶解性表详解

部分酸、碱和盐的溶解性表(室温)
阳 离
阴离子 OH - (氢氧根) NO3 - (硝酸根) Cl- (盐酸根)
子
H+
NH
+ 4
1.写出所有的阳离子与CO32-结合所生成的
K+
化合物的化学式和名称。
Na + 2.生成的化合物有什么共性?什么是盐酸
Ba2+
盐?
Ca 2+ Mg2+
3.共有几种?几种可溶、几种微溶、几种 不溶?
Fe2+
3.除BaSO4不溶,CaSO4、Ag2SO4微
Fe3+
溶,11种硫酸盐可溶。
Cu2 +
Ag +
SO4 2- (硫酸根) CO32 - (碳酸根)
H2SO4 (硫酸) (NH4)2SO4(硫酸铵) K2SO4 (硫酸钾) Na2SO4 (硫酸钠) BaSO4 (硫酸钡) CaSO4 (硫酸钙) MgSO4 (硫酸镁) Al2(SO4)2 (硫酸铝) MnSO4 (硫酸锰) ZnSO4 (硫酸锌) Fe SO4 (硫酸亚铁) Fe2(SO4)3 (硫酸铁) CuSO4 (硫酸铜) Ag2SO4 (硫酸银)
Ag +
AgCl(氯化银)
SO4 2- (硫酸根) CO32 - (碳酸根)
2.它们的阴离子全部是Cl - , 酸根离子全部是Cl- 离子的 化合物叫盐酸盐。 3.除AgCl不溶,12种盐酸 盐可溶。
部分酸、碱和盐的溶解性表(室温)
阳 离
阴离子 OH - (氢氧根) NO3 - (硝酸根) Cl- (盐酸根)
NH
+ 4
K+
NH 3.H2O (铵水) KOH (氢氧化钾)
溶解性口诀总汇(附溶解性表)

溶 解 性硝酸盐,Fra bibliotekO₃~都易溶。
亚硝酸盐,NO₂ˉ
除AgNO₂难溶外都易溶。
醋酸盐,C₂H₃O₂ˉ
除Ag⁺,Hg₂²⁺,Bi³⁺⁵等盐难溶外都易溶。
氯化物,Cl⁻
除Ag⁺,Hg₂²⁺,Pb²⁺,Cu²⁺⁶等盐难溶外都易溶。
溴化物,Br⁻
除Ag⁺,Hg₂²⁺,Pb²⁺,Pt²⁺÷等盐难溶外都易溶。
碘化物,I⁻
除Ag⁺,Hg₂²⁺,Pb²⁺,Cu²⁺,Bi³⁺⁶等盐难溶外都易溶。
硫酸盐,so₄²⁻
除Pb²⁺,Ba²⁺,Sr²⁺,Ca²⁺等盐难溶外都易溶。
亚硫酸盐,so₃²⁻
除Na⁺,K⁺,NH₄⁺³等盐难溶外都易溶。
硫代硫酸盐,S₂O₃²⁻
除Ba²⁺,Pb²⁺,Ag⁺≤等盐难溶外都易溶。
硫化物,s²⁻
砷酸盐,AsO₄³⁻
除Na⁺,K⁺,NH₄⁺等盐难溶外都难溶。
草酸盐,C₂O₄²⁻
除Na⁺,K⁺,NH₄⁺等盐难溶外都难溶。
硫代氰酸盐,SCN⁻
除Pb²⁺,Cu²⁺Ag⁺,Hg₂²⁺,Cd²⁺等盐难溶外都易溶。
氧化物,o²⁻
除Na⁺,K⁺,Ba²⁺,Sr²⁺,Ca²⁺等盐难溶外都难溶。
氢氧化物, OH⁻
除Na⁺,K⁺,Ba²⁺,等的氢氧化物外都难溶, Sr²⁺,Ca²⁺的氢氧化物微溶。
除Na⁺,K⁺,NH₄⁺,Ca²⁺,sr²⁺,Ba²⁺⁵等盐难溶外都难溶。
磷酸盐,PO₄³⁻
除Na⁺,K⁺,NH₄⁺等盐难溶外都难溶。
亚砷酸盐,AsO₄³⁻
除Na⁺,K⁺,NH₄⁺¹等盐难溶外都难溶。
碳酸盐,CO₃²⁻
除Na⁺,K⁺,NH₄⁺等盐难溶外都难溶。
二甲基硫脲溶解度表_概述说明以及解释

二甲基硫脲溶解度表概述说明以及解释1. 引言1.1 概述二甲基硫脲是一种常见的有机化合物,广泛应用于工业和科研领域。
其溶解度在不同溶剂中具有一定变化规律,因此对于准确了解其溶解性能,制定相应的应用措施具有重要意义。
本文旨在对二甲基硫脲溶解度表进行总结和分析,并对其中的数据进行解释与讨论。
1.2 文章结构本文共分为五个部分。
首先在引言部分概述了文章的目的和架构。
接下来,在第二部分我们将详细介绍二甲基硫脲的定义、性质以及溶解度的定义和意义。
第三部分将重点解释二甲基硫脲溶解度表中的数据来源、可靠性评估,并进行数据分析与比较,最后讨论影响二甲基硫脲溶解度的因素。
第四部分将介绍二甲基硫脲在工业上的实际应用情况以及未来研究方向和发展趋势。
最后在结论部分对本文所涉及的内容进行总结归纳。
1.3 目的本文旨在全面了解二甲基硫脲的溶解度表,并对其中的数据进行解读和分析。
通过对可靠性评估、数据分析和比较,我们将揭示二甲基硫脲在不同溶剂中的溶解度变化规律,并讨论影响其溶解度的因素。
同时,本文还将介绍二甲基硫脲在工业上的实际应用情况,并展望未来研究方向和发展趋势。
通过这些内容的探讨,旨在提供关于二甲基硫脲溶解度表研究的重要意义和应用价值,为相关领域的科学家和工程师提供参考和指导。
2. 二甲基硫脲溶解度表概述说明:2.1 二甲基硫脲的定义和性质二甲基硫脲是一种有机化合物,其化学式为C3H8N2S。
它常用作热稳定剂、促进剂和胺类抗氧化剂等添加剂,并且在工业上具有广泛的应用。
该化合物具有无色结晶或结晶性粉末的形态,在室温下可以溶解于多种有机溶剂中。
此外,二甲基硫脲也可用作某些药物和农药的原料。
2.2 溶解度的定义和意义溶解度是指在特定温度和压力条件下,固体物质在溶液中溶解的最大量。
它通常以摩尔分数、摩尔浓度或质量浓度等单位来表示。
对于粉末、晶体或其他固体样品来说,了解其在不同溶剂中的溶解度变化是非常重要的,因为这能够影响到其实际应用领域。
初中溶解性表

NO3
SO4
CO3
PO4
H
hno3
硝酸
溶挥
HCl盐酸溶挥
H2SO4
硫酸溶
H2CO3
碳酸溶挥
H3PO4
磷酸溶
K
KOH
氢氧化钾溶
kno3硝酸钾溶
KCl
氯化钾溶
K2SO4
硫酸钾溶
K2CO3碳酸钾溶
KPO4
磷酸钾溶
Na
NaOH氢氧化钠溶
NaNO3
硝酸钠溶
KCl
氯化钠溶
Na2SO4硫酸钠
溶
Na2CO3
碳酸钠溶
碳酸亚铁
不
Fe3(PO4)2磷酸亚铁不
Fe
+3
Fe(OH)3氢氧化铁
不
Fe(NO3)3硝酸铁
溶
氯化铁溶
Fe2(SO4)3硫酸铁溶
Fe2(CO3)3碳酸铁不
FePO4
磷酸铁不
Cu
+2
Cu(OH)2
氢氧化铜不
CU(NO3)2硝酸铜
溶
CuCl2氯化铜
溶
CuSO4硫酸铜
溶
CuCO3碳酸铜不
CU3(PO4)2磷酸铜不
溶
AlCl3
氯化铝溶
Al2(SO4)3硫酸铝溶
A%磷酸铝不
Z+n
Zn(OH)2
氢氧化锌不
Zn(NO3)2硝酸锌
溶
ZnCl2
氯化锌溶
ZnSO4硫酸锌
溶
ZnCO3
碳酸锌不
Zn3(PO4)2磷酸锌不
Fe
+2
Fe(OH)2
氢氧化亚铁不
Fe(NO3)2
物质溶解性表及沉淀颜色

物质溶解性表及沉淀颜色1.Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解溶液呈黄色铁器除锈2.Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解3.CuO+H2SO4=CuSO4+H2O 黑色固体溶解溶液呈蓝色4.ZnO+H2SO4=ZnSO4+H2O 白色固体溶解5.MgO+H2SO4=MgSO4+H2O 白色固体溶解6.2NaOH+H2SO4=Na2SO4+2H2O7.Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解8.Ca(OH)2+H2SO4=CaSO4+2H2O9.Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解10.2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解11.2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解溶液呈黄色12.Ba(OH)2+ H2SO4=BaSO4+2H2O 生成白色沉淀不溶解于稀硝酸检验SO42的原理13..BaCl2+ H2SO4=BaSO4+2HCl 生成白色沉淀不溶解于稀硝酸检验SO42的原理14.Ba(NO3)2+H2SO4=BaSO4+2HNO3 生成白色沉淀不溶解于稀硝酸检验SO42的原理15.Na2O+2HNO3=2NaNO3+H2O 白色固体溶解16.CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解溶液呈蓝色17.ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解18.MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解19.CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解20.NaOH+HNO3=NaNO3+ H2O21.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解22.Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解23.Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解24.Ca(OH)2+2HNO3=Ca(NO3)2+2H2O25.Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解溶液呈黄色26.3NaOH + H3PO4=3H2O + Na3PO427.3NH3+H3PO4=(NH4)3PO428.2NaOH+CO2=Na2CO3+ H2O 吸收COO2H2中的CO229.2NaOH+SO2=Na2SO3+ H2O2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)30.FeCl3+3NaOH=Fe(OH)3+3NaCl 溶液黄色褪去有红褐色沉淀生成1.碳与氧气(不足)的反应2C+O2==== 2CO 碳与氧气(充足)的反应C+O2==== CO22.一氧化碳与氧气的反应2CO+O2==== 2CO23.二氧化碳与碳的反应CO2+C==== 2CO4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+2NaOH9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== C aCO3↓+Na2CO3+2H2O10.碳酸氢钠加热的反应2NaHCO3==== Na2CO3+ H2O+CO2↑11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑12.碳酸钙加热的反应CaCO3==== CaO+CO2↑13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2= === Ca(HCO3)2二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O14.氮气与氧气的反应N2+O2==== 2NO15.一氧化氮与氧气的反应2NO+O2==== 2NO216.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO17.氮气与氢气的反应N2+3H2========= 2NH318.氨气与水的反应NH3+H2O==== NH3•H2O19.氨气与盐酸的反应NH3+HCl==== NH4Cl20.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO421.氨气与强酸的离子的反应NH3+H+==== NH4+22.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O23.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O24.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O26.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2==== CaCl2+2 NH3↑+2H2O27.氯化铵与氢氧化钠的反应NH4Cl+ NaOH==== NaCl+NH3↑+H2O28.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH==== Na2C O3+NH3↑+2H2O29.碳酸氢铵与氢氧化钙的反应NH4HCO3+Ca(OH)2==== CaC O3↓+NH3↑+2H2O30.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O31.铜与浓硝酸的反应Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+ 2H2O32.铜与稀硝酸的反应3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O33.铁与浓硝酸的反应Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+ 3H2O34.铁与稀硝酸的反应Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H 2O35.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2 O36.一氧化氮与一氧化碳的反应2NO+2CO====== N2+2CO237.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO338.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO339.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH+NO2+NO= === 2NaNO2+ H2O40.氨气(过量)与氯气的反应8NH3+3Cl2==== 6NH4Cl+N2氨气(少量)与氯气的反应2NH3+3Cl2==== 6HCl+N241.二氧化氮生成四氧化二氮的反应2NO2==== N2O442.硫与铜的反应S+2Cu==== Cu2S43.硫与铁的反应S+Fe==== FeS44.硫与钠的反应S+2Na==== Na2S45.硫与铝的反应3S+2Al==== Al2S346.硫与汞的反应S+Hg==== HgS47.硫与氧气的反应S+O2==== SO248.硫与氢气的反应S+H2==== H2S49.硫与氢氧化钠的反应3S+6NaOH==== 2Na2S+Na2SO3+3H2O50.硫与浓硫酸的反应S+2H2SO4(浓)==== 3SO2+2H2O51.黑火药点燃S+2KNO3+3C==== K2S+3CO2↑+N2↑52.二氧化硫(少量)与氢氧化钠的反应SO2+2NaOH==== Na2SO3+ H2O二氧化硫(过量)与氢氧化钠的反应SO2+NaOH==== NaHSO3 53.二氧化硫与氢氧化钙的反应SO2+Ca(OH)2==== CaSO3↓+H2O54.二氧化硫与亚硫酸钙溶液的反应SO2+CaSO3+H2O ==== Ca (HSO3)255.二氧化硫与水的反应SO2+H2O==== H2SO356.二氧化硫与硫化氢的反应SO2+2H2S==== 3S↓+2H2O57.二氧化硫与氧气的反应2SO2+O2====== 2SO358.二氧化硫与过氧化钠的反应SO2+Na2O2==== Na2SO459.二氧化硫与氯水的反应SO2+ Cl2+2H2O==== H2SO4+2HCl60.三氧化硫与水的反应SO3+H2O==== H2SO461.亚硫酸与氧气的反应2H2SO3+O2==== 2H2SO462.亚硫酸钠与氧气的反应2Na2SO3+O2==== 2Na2SO463.浓硫酸与铜的反应2H2SO4(浓)+Cu==== CuSO4+SO2↑+2H2 O64.浓硫酸与碳的反应2H2SO4(浓)+C==== CO2↑+2SO2↑+2H2O 寿65.工业制备硫酸(初步) 4FeS2+11O2==== 8SO2+2Fe2O366.实验室制备硫酸(初步) Na2SO3+H2SO4(浓)==== Na2SO4+SO 2↑+H2O67.硫化氢(少量)与氢氧化钠的反应H2S+2NaOH==== Na2S+2H2O硫化氢(过量)与氢氧化钠的反应H2S+NaOH==== NaHS+H2O 68.硫化氢(少量)与氨气的反应H2S+2NH3==== (NH4)2S硫化氢(过量)与氨气的反应H2S+NH3==== NH4HS69.硫化氢与氧气(不足)的反应2H2S+O2==== 2S↓+2H2O 2H2S+ O2==== 2S+2H2O硫化氢与氧气(充足)的反应2H2S+3O2==== 2SO2+2H2O70.硫化氢与氯气的反应H2S+Cl2==== 2HCl+S↓71.硫化氢与浓硫酸的反应H2S+H2SO4(浓)==== S↓+SO2↑+2H2 O72.硫化氢的制备FeS+H2SO4==== FeSO4+H2S↑73.电解饱和食盐水(氯碱工业) 2NaCl+2H2O==== 2NaOH+H2↑+C l2↑74.电解熔融状态氯化钠(制单质钠) 2NaCl==== 2Na+Cl2↑75.海水制镁(1) CaCO3==== CaO+CO2 (2) CaO+H2O==== Ca (OH)2(3) Mg2++2OH2-==== Mg(OH)2↓(4) Mg(OH)2+2HCl==== MgC l2+2H2O(5) MgCl2==== Mg+Cl2↑76.镁在空气中燃烧(与氧气的反应) 2Mg+O2==== 2MgO(与氮气的反应) 3Mg+N2==== Mg3N2(与二氧化碳的反应) 2Mg+CO2==== 2MgO+C77.镁与氯气的反应Mg+Cl2==== MgCl278.镁与水的反应Mg+2H2O==== Mg(OH)2+H2↑79.镁与盐酸的反应Mg+2HCl==== MgCl2+H2↑80.镁与氢离子的反应Mg+2H+==== Mg2++H2↑81.二氮化三镁与水的反应Mg3N2+6H2O==== 3Mg(OH)2↓+2NH3↑82.镁与溴水的反应(颜色退去) Mg+Br2==== MgBr2(产生气泡) Mg+2HBr==== MgBr2+H2↑83.溴与水的反应Br2+H2O==== HBr+HBrO84.溴与氢氧化钠的反应Br2+2NaOH==== NaBr+NaBrO+H2O85.溴与氢气的反应Br2+H2==== 2HBr86.溴与铁的反应3Br2+2Fe==== 2FeBr387.碘与铁的反应I2+Fe==== FeI288.溴与碘化钾的反应Br2+2KI==== 2KBr+I289.氯气与溴化钾的反应2KBr+Cl2==== 2KCl+Br290.硅与氧气的反应Si+O2==== SiO291.硅与氯气的反应Si+2Cl2==== SiCl492.硅与氢气的反应Si+2H2===== SiH493.二氧化硅与氟的反应Si+2F2==== SiF494.硅与碳的反应Si+C==== SiC95.硅与氢氧化钠溶液的反应Si+2NaOH+H2O==== Na2SiO3+2H2↑96.硅与氢氟酸的反应Si+4HF==== SiF4+2H2↑97.单质硅的制备(1.制备)SiO2+2C==== Si+2CO(2.提纯)Si+2Cl2==== SiCl4(3.提纯)SiCl4+2H2==== Si+4HCl98.二氧化硅与氢氧化钠的反应SiO2+2NaOH==== Na2SiO3+H2O99.二氧化硅与氧化钠的反应SiO2+Na2O==== Na2SiO3100.二氧化硅与碳酸钠的反应SiO2+Na2CO3==== Na2SiO3+ CO2↑101.二氧化硅与氧化钙的反应SiO2+CaO==== CaSiO3102.二氧化硅与碳酸钙的反应SiO2+CaCO3==== CaSiO3+CO2↑103.二氧化硅与氢氟酸的反应SiO2+4HF==== SiF4+2H2O104.硅酸的制备Na2SiO3+ CO2+H2O==== H2SiO3↓+ Na2CO3 105.硅酸加热分解H2SiO3==== SiO2+H2O106.铝与氧气的反应4Al+3O2==== 2Al2O3107.铝与氯气的反应2Al+3Cl2==== 2AlCl3108.铝与盐酸的反应2Al+6HCl==== 2AlCl3+3H2↑109.铝与氢氧化钠的反应2Al+2NaOH+6H2O==== 2Na[Al(OH)4]+3 H2↑110.铝与水的反应2Al+6H2O==== 2Al(OH)3+3H2↑111.铝与三氧化二铁的反应(铝热反应)2Al+Fe2O3==== 2Fe+Al2O3112.铝与二氧化锰的反应(铝热反应)4Al+3MnO2==== 3Mn+2AlO3 113.氧化铝与盐酸的反应Al2O3+6HCl==== 2AlCl3+3H2O114.氧化铝与氢氧化钠的反应Al2O3+2NaOH+3H2O==== 2Na[Al (OH)4]115.电解氧化铝2Al2O3==== 4Al+3O2↑116.硫酸与与一水合氨的反应Al2(SO4)3+6NH3•H2O==== 2Al(OH) 3↓+3(NH4)2SO4117.氯化铝与一水合氨的反应AlCl3+3NH3•H2O==== Al(OH)3↓+3NH4Cl118.氯化铝与氢氧化钠(少量)的反应AlCl3+3NaOH==== Al(OH)3↓+3NaCl119.氢氧化铝与氢氧化钠的反应Al(OH)3+NaOH==== Na[Al(OH)4]120.氯化铝与氢氧化钠(过量)的反应AlCl3+4NaOH==== Na[Al(OH) 4]+3NaCl121.四羟基合氯酸钠与盐酸(少量)的反应Na[Al(OH)4]+HCl==== Al (OH)3↓+NaCl+H2O122.氢氧化铝与盐酸的反应Al(OH)3+3HCl==== AlCl3+3H2O 123.四羟基合氯酸钠与盐酸(过量)的反应Na[Al(OH)4]+4HCl==== A lCl3+NaCl+4H2O124.四羟基合氯酸钠与氯化铝的反应3Na[Al(OH)4]+AlCl3==== 4Al (OH)3↓+3NaCl125.向四羟基合氯酸钠中通入过量二氧化碳Na[Al(OH)4]+CO2==== Al(OH)3↓+NaHCO3126.铜在潮湿空气中被腐蚀2Cu+O2+H2O+CO2==== Cu2(OH)2C O3127.铜与氧气的反应2Cu+O2==== 2CuO128.铜与氯气的反应Cu+Cl2==== CuCl2129.铜氧化在高温下转化4CuO==== 2Cu2O+O2↑130.硫酸铜与水的反应CuSO4+5H2O==== CuSO4•5H2O1.与碱反应产生气体 (1)(2)铵盐:O H NH NH 234+↑−→−+碱2.与酸反应产生气体(1) (2)()()()2332222332HH HCO HCO CO S HS HS SO HSO SO +++------⎧−−→↑⎪⎪−−→↑⎨⎪−−→↑⎪⎩化合物3.Na 2S 2O 3与酸反应既产生沉淀又产生气体:S 2O 32-+2H +=S ↓+SO 2↑+H 2O4.与水反应产生气体(1)单质 (2)化合物5.强烈双水解⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−↑−−→−2222222222342342342NO SO SO S CO NO CO SO C NO NO SOH HNO SO H HNO SOH HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓⎪⎩⎪⎨⎧↑+=+↑+=+22222422222O HF O H F H NaOH O H Na()()()⎪⎪⎩⎪⎪⎨⎧↑+=+↑+↓=+↑+↓=+↑+=+22222232323222322222326233422H C OH Ca O H CaC S H OH Al O H S Al NH OH Mg O H N Mg O NaOH O H O Na ()()⎪⎧↓+↑−−→−----+232323322OH Al CO HCO CO O H OH6.既能酸反应,又能与碱反应(1)单质:Al (2)化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
有机化合物的物理性质表

1.3390
-30.4
74.1
1.437920
C2H5OH,(C2H5)2O,CHCl3
CH2ClCHCl2
1,1,2-三氯乙烷
133.40
1.4397
-36.5
113.8
1.471420
C2H5OH,(C2H5)2O,C6H6
CHCl2CHCl21,1,2,2-四氯乙烷
167.85
1.5953
有机化合物的性质
Properties of Organic Compounds
有机化合物的一般性质
General Properties of Organic Compounds
下 表给出了有机化合物常用的物理常数。其中以分子式中碳原子的数目多少为序排列。表中符号说明如下。
Mr——相对分子质量;
ρ——密度,单位为g/ml。除 注明者外,均指在20.0℃状态下。其上角标若有其他数值,则表示在该温度下测得的密度;
45.08
0.68040
-93.0
7.4
1.35017
H2O,C2H5OH,(C2H5)2O
C2H5NH2乙胺
45.08
0.6829
-81.0
16.6
1.366320
H2O,C2H5OH,(C2H5)2O
H2NCH2CH2SH
2-氨基乙硫醇
77.14
-
99.0~100.0
-
-
H2O,C2H5OH
H2NCH2CH2OH
1.447220
H2O,C2H5OH,CH3COCH3
HCONHNH2甲酰肼
60.06
-
54.0
-
-
溶解性表详解讲解

NH 3.H2O (溶、挥) KOH (溶)
NaOH (溶) Ba(OH )2(溶) Ca(OH)2 (微) Mg(OH)2(不) Al(OH )3 (不) Mn(OH )2(不) Zn(OH)2(不) Fe(OH)2(不)
Na2SO4 (溶)
Na2CO3 (溶)
BaSO4
CaSO4
(不)
(微)
BaCO3
SO4 2- (硫酸根) CO32 - (碳酸根)
H2SO4 (硫酸) H2CO3 (溶) (NH4)2SO4(硫酸铵) K2SO4 (硫酸钾) (NH4)2CO3(溶) K2CO3 (溶)
H+ NH 4+ K+ Na + Ba2+ Ca 2+ Mg2+ Al 3+ Mn2+ Z n2+ Fe2+ Fe3+ Cu2 + Ag +
H+ NH 4+ K+ Na + Ba2+ Ca 2+ Mg2+ Al 3+ Mn2+ Z n2+ Fe2+ Fe3+ Cu2 + Ag +
NH 3.H2O (铵水) KOH (氢氧化钾)
NaOH (氢氧化钠) Ba(OH )2(氢氧化钡) Ca(OH)2 (氢氧化钙) Mg(OH)2(氢氧化镁) Al(OH )3 (氢氧化铝) Mn(OH )2(氢氧化锰) Zn(OH)2(氢氧化锌) Fe(OH)2( 氢氧化亚铁)
(不)
(不) (微) ——
CaSO4
(硫酸钙)
Mg(NO3)2(硝酸镁)
MgSO4 (硫酸镁) Al2(SO4)2 (硫酸铝) MnSO4 (硫酸锰)
700种无机有机化合物溶解度

叠氮化钙 Ca(N3)2
磷酸二氢 钙 Ca(H2PO4)2 氟化钙 CaF2
氟硅酸钙 CaSiF6
甲酸钙
Ca(HCO2)2
16.1
16.6 4.303×10-3
17.1
磷酸氢钙 CaHPO4 氢氧化钙 Ca(OH)2 碘酸钙 碘化钙 钼酸钙 硝酸钙 Ca(IO3)2 CaI2 CaMoO4 Ca(NO3)2 · 2O 4H Ca(NO2)2 亚硝酸钙 · 2O 4H 草酸钙 CaC2O4 高氯酸钙 Ca(ClO4)2 高锰酸钙 Ca(MnO4)2 磷酸钙 硒酸钙 硫酸钙 钨酸钙 氟化锆 硫酸锆 砷酸镉 溴酸镉 溴化镉 碳酸镉 氯酸镉 氯化镉 Ca3(PO4)2 CaSeO4· 2O 2H CaSO4· 2O 2H CaWO4 ZrF4 Zr(SO4)2· 2O 4H Cd3(AsO4)2 Cd(BrO3)2 CdBr2 CdCO3 Cd(ClO3)2 CdCl2 299 100 308 135 56.3 75.4 9.73 0.223 9.77 0.244 63.9 102 115 0.189 9×10-2 64.6 0.182
4.642×10-2 124 123 130 130 220 2.727×10-2 1.352×10-6 4.351×10-7 3.246×10-5 2.313×10-3 2.266×1012
152
高氯酸铬 Cr(ClO4)3
325
407 4.277×10 25 1.1 0.08
-2
455
499
0.4 4.82
0.56 25 6.57 9.3 2.372×10-3 6×10-3
0.66 8.34
0.91 10.2
草酸汞 硫化汞
HgC2O4 HgS Co(BrO3)2
有机溶剂极性、沸点、溶解性、毒性表

溶解能力强,超过二氧六环、苯、和吡啶,与水 腐蚀皮肤,刺激眼和 混溶,溶解丙酮、苯、乙醚、甲醇、乙醇、乙二 结膜,蒸汽引起肝肾 醇、2-己酮、蓖麻油、松节油、松脂等 病变 能与醇、醚、脂肪烃、芳香烃、和有机氯化物等 低于苯,损害中枢系 多种有机溶剂混溶 统 与乙二醇一甲醚相似,但是极性小,与水、醇、 低毒类,二级易燃液 醚、四氯化碳、丙酮混溶 体 不溶于水,与醇、醚和其他有机溶剂混溶 一级易燃液体
与醇、醚、氯仿、丙酮、苯等混溶,部分溶解低沸 有毒品,刺激眼睛, 点脂肪烃,无机物一般不溶 催泪 与苯混溶,溶于水和醇,不溶于醚 一级易燃液体 溶于乙醇、乙醚、乙酸、甘油、氯仿、二硫化碳 高毒类,对皮肤、黏 和苯等,男溶于烃类溶剂,65.3℃以上与水混 膜有强烈腐蚀性,可经 溶,65.3℃以下分层 皮吸收中毒 与水、乙醇、乙醚、氯仿、丙酮等多种有机溶剂 低毒,吸湿,不宜静 混溶 注 与水、甲醇、乙醇、乙二醇、甘油、乙醛、丙酮 微毒,对眼有刺激性 乙酸乙酯吡啶、芳烃混溶 微溶于水,能与乙醇、乙醚、苯、氯仿、乙二醇 、甘油等混溶 参照甲酚
与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、 中等毒性,大量吸入 氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶, 蒸气,引起急性中毒 但是不与饱和烃混溶 与乙醇、乙醚、氯仿、水混溶 与乙醇、乙醚、氯仿、四氯化碳等多种有机溶剂 混溶 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种 有机溶剂混溶。能溶解各种树脂,还是二氧化硫 、氯代甲烷、乙烯等气体的优良溶剂 不溶于水,与乙醇.乙醚、丙酮、苯、乙酸乙酯、 脂肪族氯代烃、汽油混溶 水:18.7以下混溶,以上微溶。易溶于氯仿、丙 酮,溶于乙醇、乙醚 微毒,类似乙醇 高毒性、致癌 吸入和经口低毒 有机有毒品 易爆,皮肤黏膜刺激 性强
与水、醇、醚、石油醚、苯、油类混溶。能溶多 低毒,皮肤黏膜刺激 种有机物和无机物 性 能与乙醇、乙醚、苯等大多数有机溶剂和动植物 毒性和局部刺激性较 油相混溶 强 溶于水、乙醇、苯和乙醚,微溶于庚烷 与醇、醚、苯混溶 刺激皮肤、眼睛 低毒,大于乙醇3倍
初中化学溶解性表

1.2Mg+O 2点燃或Δ2MgO化学反响现象:激烈燃烧.刺眼白光.生成白色固体.放热.产生大量白烟 运用:白色旌旗灯号弹2.2Hg+O 2点燃或Δ2HgO化学反响现象:银白液体.生成红色固体运用:拉瓦锡试验3.4Al+3O2Δ2Al2O3化学反响现象:银白金属变成白色固体4.3Fe+2O点燃Fe3O4化学反响现象:激烈燃烧.火星四射.生成黑色固体.放出大量热5.C+O2点燃CO2化学反响现象:激烈燃烧.白光.放热.使石灰水变污浊6.S+O点燃SO2化学反响现象:激烈燃烧.放热.刺激味气体.空气中淡蓝色火焰.氧气中蓝紫色火焰7.2H2+O点燃2H2O化学反响现象:淡蓝火焰.放热.生成使无水CuSO4变蓝的液体(水)运用:高能燃料8.4P+5O点燃2P2O5化学反响现象:激烈燃烧.大量白烟.放热.生成白色固体运用:证实空气中氧气含量9.CH4+2O2点燃2H2O+CO2化学反响现象:蓝色火焰.放热.生成使石灰水变污浊气体和使无水CuSO4变蓝的液体(水)运用:甲烷和自然气的燃烧10.2KClO3MnO2Δ 2KCl +3O2↑化学反响现象:生成使带火星的木条复燃的气体运用:试验室制备氧气11.2KMnO4Δ K2MnO4+MnO2+O2↑化学反响现象:紫色变成黑色.生成使带火星木条复燃的气体运用:试验室制备氧气12.2HgOΔ2Hg+O2↑化学反响现象:红色变成银白.生成使带火星木条复燃的气体运用:拉瓦锡试验13.2H2O通电2H2↑+O2↑化学反响现象:水通电分化为氢气和氧气运用:电解水14.Cu2(OH)2CO3Δ2CuO+H2O+CO2↑化学反响现象:绿色变黑色.试管壁有液体.使石灰水变污浊气体运用:铜绿加热15.NH4HCO3ΔNH3↑+ H2O +CO2↑化学反响现象:白色固体消掉.管壁有液体.使石灰水变污浊气体运用:碳酸氢铵长期吐露空气中会消掉16.Zn+H2SO4=ZnSO4+H2↑化学反响现象:有大量气泡产生.锌粒逐渐消融运用:试验室制备氢气17.Fe+H2SO4=FeSO4+H2↑化学反响现象:有大量气泡产生.金属颗粒逐渐消融18.Mg+H2SO4 =MgSO4+H2↑化学反响现象:有大量气泡产生.金属颗粒逐渐消融19.2Al+3H2SO4=Al2(SO4)3+3H2↑化学反响现象:有大量气泡产生.金属颗粒逐渐消融20.Fe2O3+3H2Δ 2Fe+3H2O化学反响现象:红色逐渐变成银白色.试管壁有液体运用:冶炼金属.运用氢气的还原性21.2Na+Cl2Δ或点燃2NaCl化学反响现象:激烈燃烧.黄色火焰运用:离子化合物的形成.22.H2+Cl2点燃或光照 2HCl化学反响现象:点燃惨白色火焰.瓶口白雾运用:共价化合物的形成.制备盐酸23.CuSO4+2NaOH=Cu(OH)2↓+Na2SO4化学反响现象:蓝色沉淀生成.上部为澄清溶液运用:质量守恒定律试验24.2C +O点燃2CO运用:煤炉中罕有反响.空气污染物之一.煤气中毒原因25.2CO+O2点燃2CO2化学反响现象:蓝色火焰运用:煤气燃烧26.C + CuO 高温2Cu+ CO2↑化学反响现象:黑色逐渐变成红色.产生使澄清石灰水变污浊的气体运用:冶炼金属27.2Fe2O3+3C 高温4Fe+ 3CO2↑Fe3O4+2C高温3Fe + 2CO2↑运用:冶炼金属28.C + CO高温2CO29.CO2 + H2O = H2CO3化学反响现象:碳酸使石蕊变红运用:证实碳酸的酸性30.H2CO3ΔCO2↑+ H2O化学反响现象:石蕊红色褪去31.Ca(OH)2+CO2= CaCO3↓+ H2O化学反响现象:澄清石灰水变污浊运用:运用CO2磨练和石灰浆粉刷墙壁32.CaCO3+H2O+CO2 = Ca(HCO3)2化学反响现象:白色沉淀逐渐消融运用:溶洞的形成,石头的风化33.Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑化学反响现象:白色沉淀.产生使澄清石灰水变污浊的气体运用:34.2NaHCO3ΔNa2CO3+H2O+CO2↑化学反响现象:产生使澄清石灰水变污浊的气体运用:小苏打蒸馒头35.CaCO3高温 CaO+ CO2↑运用:工业制备二氧化碳和生石灰36.CaCO3+2HCl=CaCl2+ H2O+CO2↑化学反响现象:固体逐渐消融.有使澄清石灰水变污浊的气体运用:试验室制备二氧化碳.除水垢37.Na2CO3+H2SO4=Na2SO4+H2O+CO2↑化学反响现象:固体逐渐消融.有使澄清石灰水变污浊的气体运用:泡沫灭火器道理38.Na2CO3+2HCl=2NaCl+ H2O+CO2↑化学反响现象:固体逐渐消融.有使澄清石灰水变污浊的气体运用:泡沫灭火器道理39.CuO +CO Δ Cu + CO2化学反响现象:黑色逐渐变红色,产生使澄清石灰水变污浊的气体运用:冶炼金属40.Fe2O3+3CO高温 2Fe+3CO2运用:冶炼金属道理41.C2H5OH+3O点燃2CO2+3H2O化学反响现象:蓝色火焰.产生使石灰水变污浊的气体.放热运用:酒精的燃烧42.Fe+CuSO4=Cu+FeSO4化学反响现象:银白色金属概况笼罩一层红色物资运用:湿法炼铜.镀铜43.Mg+FeSO4= Fe+ MgSO4化学反响现象:溶液由浅绿色变成无色44.Cu+2AgNO3=2Ag+ Cu(NO3)2化学反响现象:红色金属概况笼罩一层银白色物资运用:镀银45.Zn+CuSO4= Cu+ZnSO4化学反响现象:青白色金属概况笼罩一层红色物资运用:镀铜46.Fe2O3+6HCl=2FeCl3+3H2O化学反响现象:铁锈消融.溶液呈黄色运用:铁器除锈47.Al2O3+6HCl=2AlCl3+3H2O化学反响现象:白色固体消融48.CuO+2HCl=CuCl2+H2O化学反响现象:黑色固体消融.溶液呈蓝色49.MgO+2HCl=MgCl2+ H2OCaO+2HCl=CaCl2+ H2O配合的化学反响现象:白色固体消融50.NaOH+HCl=NaCl+ H2O化学反响现象:白色固体消融51.Cu(OH)2+2HCl=CuCl2+2H2O化学反响现象:蓝色固体消融52.Mg(OH)2+2HCl=MgCl2+2H2O化学反响现象:白色固体消融53.Al(OH)3+3HCl=AlCl3+3H2O化学反响现象:白色固体消融运用:胃舒平治疗胃酸过多54.Fe(OH)3+3HCl=FeCl3+3H2O化学反响现象:红褐色沉淀消融.溶液呈黄色55.Ca(OH)2+2HCl=CaCl2+2H2O56.HCl+AgNO3= AgCl↓+HNO3化学反响现象:生成白色沉淀.不消融于稀硝酸磨练Cl—的道理57.Fe2O3+3H2SO4= Fe2(SO4)3+3H2O化学反响现象:铁锈消融.溶液呈黄色铁器除锈58.Al2O3+3H2SO4= Al2(SO4)3+3H2O化学反响现象:白色固体消融59.CuO+H2SO4=CuSO4+H2O化学反响现象:黑色固体消融.溶液呈蓝色60.2NaOH+H2SO4=Na2SO4+2H2O61.Cu(OH)2+H2SO4=CuSO4+2H2O化学反响现象:蓝色固体消融62.2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O化学反响现象:白色固体消融63.2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O化学反响现象:红褐色沉淀消融.溶液呈黄色64.Ba(OH)2+ H2SO4=BaSO4↓+2H2O化学反响现象:生成白色沉淀.不消融于稀硝酸磨练SO42—的道理65.BaCl2+ H2SO4=BaSO4↓+2HCl化学反响现象:生成白色沉淀.不消融于稀硝酸磨练SO42—的道理66.Ba(NO3)2+H2SO4=BaSO4↓+2HNO3化学反响现象:生成白色沉淀.不消融于稀硝酸磨练SO42—的道理67.CuO+2HNO3=Cu(NO3)2+H2O化学反响现象:黑色固体消融.溶液呈蓝色68.NaOH+HNO3=NaNO3+ H2O69.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O化学反响现象:蓝色固体消融70.Fe(OH)3+3HNO3=Fe(NO3)3+3H2O化学反响现象:红褐色沉淀消融.溶液呈黄色71.2NaOH+CO2=Na2CO3+ H2O化学反响现象:接收CO.O2.H2中的CO2.72.2NaOH+SO2=Na2SO3+ H2O2NaOH+SO3=Na2SO4+ H2O处理硫酸工场的尾气(SO2)73.FeCl3+3NaOH=Fe(OH)3↓+3NaCl化学反响现象:溶液黄色褪去.有红褐色沉淀生成74.AlCl3+3NaOH=Al(OH)3↓+3NaCl化学反响现象:有白色沉淀生成75.MgCl2+2NaOH = Mg(OH)2↓+2NaCl76.CuCl2+2NaOH = Cu(OH)2↓+2NaCl化学反响现象:溶液蓝色褪去.有蓝色沉淀生成77.CaO+ H2O = Ca(OH)2化学反响现象:白色块状固体变成粉末生石灰制备石灰浆78.Ca(OH)2+Na2CO3=CaCO3↓+2NaOH化学反响现象:有白色沉淀生成工业制烧碱.试验室制少量烧碱79.Ba(OH)2+Na2CO3=BaCO3↓+2NaOH化学反响现象:有白色沉淀生成80.Ca(OH)2+K2CO3=CaCO3↓ +2KOH化学反响现象:有白色沉淀生成81.CuSO4+5H2O= CuSO4·H2O化学反响现象:白色粉末变成蓝色磨练物资中是否含有水82.CuSO4·H2OΔ CuSO4+5H2O化学反响现象:蓝色晶体变成白色粉末83.AgNO3+NaCl = AgCl↓+NaNO3化学反响现象:白色不消融于稀硝酸的沉淀(其他氯化物相似反响)运用于磨练溶液中的氯离子84.BaCl2 + Na2SO4 = BaSO4↓+2NaCl化学反响现象:白色不消融于稀硝酸的沉淀(其他硫酸盐相似反响)运用于磨练硫酸根离子85.CaCl2+Na2CO3= CaCO3↓+2NaCl化学反响现象:有白色沉淀生成86.MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓化学反响现象:有白色沉淀生成87.CaCO3+2HCl=CaCl2+H2O+CO2↑88.MgCO3+2HCl= MgCl2+H2O+ CO2↑89.NH4NO3+NaOH=NaNO3+NH3↑+H2O化学反响现象:生成使潮湿石蕊试纸变蓝色的气体运用:运用于磨练溶液中的铵根离子90.NH4Cl+ KOH= KCl+NH3↑+H2O化学反响现象:生成使潮湿石蕊试纸变蓝色的气体。
溶解性表详解

Al2(SO4)2 (硫酸铝)
——
MnSO4 (硫酸锰) ZnSO4 (硫酸锌)
MnCO3 (不) ZnCO3 (不)
Fe2+
Fe(OH)2( 氢氧化亚铁) Fe(NO3)2 (硝酸亚铁) FeCl2 (氯化亚铁) Fe SO4 (硫酸亚铁) FeCO3 (不)
Fe3+
Fe(OH )3(氢氧化铁) Fe2(NO3)3(硝酸铁) FeCl3(氯化铁)
Ag +
AgCl(氯化银)
SO4 2- (硫酸根) CO32 - (碳酸根)
2.它们的阴离子全部是Cl - , 酸根离子全部是Cl- 离子的 化合物叫盐酸盐。 3.除AgCl不溶,12种盐酸 盐可溶。
部分酸、碱和盐的溶解性表(室温)
阳 离
阴离子 OH - (氢氧根) NO3 - (硝酸根) Cl- (盐酸根)
NH4NO3(硝酸铵)
KOH (氢氧化钾) KNO3 (硝酸钾)
Na +
NaOH (氢氧化钠) NaNO3(硝酸钠)
Ba2+
Ba(OH )2(氢氧化钡) Ba(NO3)2 (硝酸钡)
Ca 2+
Ca(OH)2 (氢氧化钙) Ca(NO3)2 (硝酸钙)
Mg2+
Mg(OH)2(氢氧化镁) Mg(NO3)2(硝酸镁)
Mg(NO3)2(硝酸镁)
Al2(NO3)3 (硝酸铝)
Mn(NO3)2 (硝酸锰) 2.除HNO3外,13种盐的阴离子全部是NO3 - , Zn(NO3)2 (硝酸锌) 酸根离子全部是NO3 - 离子的化合物叫硝酸盐。
Fe(NO3)2 (硝酸亚铁) 3.13种硝酸盐全溶。
Fe2(NO3)3(硝酸铁)
常用化合物在不同温度下的溶解度
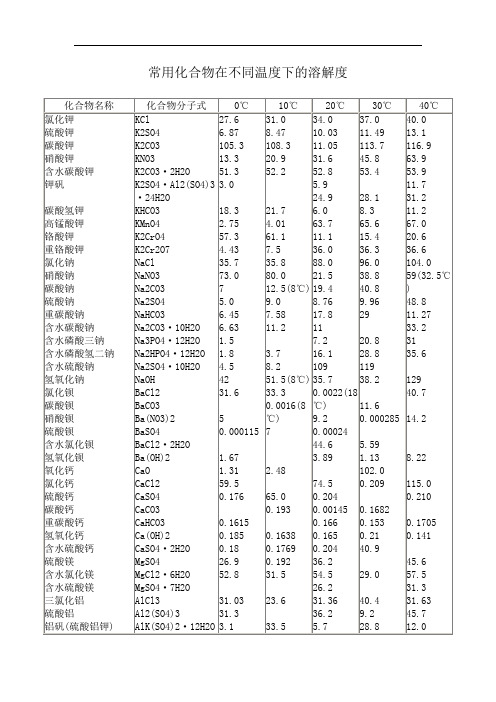
33.2
Na3PO4·12H2O 1.5
7.2
20.8
31
Na2HPO4·12H2O 1.8
3.7
16.1
28.8
35.6
Na2SO4·10H2O 4.5
8.2
109
119
NaOH
42
51.5(8℃) 35.7
38.2
129
BaCl2
31.6
33.3
0.0022(18
40.7
BaCO3
0.0016(8 ℃)
53.4
53.9
K2SO4·Al2(SO4)3 3.0
5.9
11.7
·24H2O
24.9
28.1
31.2
KHCO3
18.3
21.7
6.0
8.3
11.2
KMnO4
2.75
4.01
63.7
65.6
67.0
K2CrO4
57.3
61.1
11.1
15.4
20.6
K2Cr2O7
4.43
7.5
36.0
36.3
36.6
BaCl2
43.6 46.4
58.8
BaCO3
27
Ba(NO3)2
17.1 20.3
34.2
BaSO4
0.00033
0.00041
BaCl2·2H2O
0.210
CaCO3
0.193 0.00145 0.1682
CaHCO3
0.1615
0.166 0.153 0.1705
Ca(OH)2
0.185 0.1638 0.165 0.21
化合物溶解度表(很实用)

6
263
磷
酸 氢
BaHPO4
钡
1.3×10
-2
亚 磷 酸 BaHPO3 氢 钡
0.687
氢
氧 化
Ba(OH)2· 1.
8H2O
67
2.4 8
3.89
钡
5.59 8.22
20. 9
101
碘 酸 Ba(IO3)2 钡
3.5×10 4.6× 5.7×
-2
10-2
10-2
碘 化 BaI2 钡
18 2
201
1.096× 10-10
1.561× 10-20
3.109× 11
1.352× 10-7
3.144× 10-4
(II I)
氟 化 钚 PuF4 (IV )
碘 酸 钚 Pu(IO3)4 (IV )
3.622× 10-4
7.998× 10-2
[编辑] 氮、镝
物 质
化学式
0° 10 C °C
20°C
NH4I
155 163 172 182 191
209
229
250
硝酸 铵
NH4NO3
118 150 192 242 297
421
580 740 871
高碘 酸铵
(NH4)5IO6
2.7
草酸 铵
(NH4)2C2O
4
2.2
3.21 4.45
6.09 8.18
高氯 酸铵
NH4ClO4
12
16.4 21.7 37.7 34.6
173
铵
氟硅 (NH4)2Si 酸铵 F6
18.6
甲酸 铵
NH4HCO2
氯化镁溶解度与温度对照表

氯化镁溶解度与温度对照表1. 引言1.1 研究背景氯化镁是一种常见的化合物,广泛用于水处理、药物制备和工业生产中。
它在水中的溶解性是一个重要的物理化学性质,对于理解氯化镁在溶液中的行为以及相关应用具有重要意义。
研究氯化镁在水中的溶解性可以帮助我们更深入地了解其溶解过程和影响因素。
通过实验和数据分析,我们可以探究溶解过程中的动力学和热力学特性,为其在工业生产和科学研究中的应用提供有效的参考。
氯化镁溶解度与温度的关系也是一个重要的研究课题。
温度对溶解度的影响是一种常见的物理化学现象,通过研究氯化镁在不同温度下的溶解度变化规律,可以进一步揭示其溶解过程的机理和热力学性质。
本文旨在通过实验方法和数据分析,探讨氯化镁的溶解性及其与温度的关系,从而为进一步的研究提供基础和参考,同时对相关领域的理论和实践具有一定的指导意义。
1.2 研究目的研究目的:本实验旨在探究氯化镁在水中的溶解性随温度变化的规律,通过实验数据的收集和分析,验证氯化镁溶解度与温度之间的关系。
通过这一研究,我们不仅可以了解氯化镁在不同温度下的溶解度是如何变化的,还可以进一步探讨溶液中溶质粒子的活动性和溶质在水溶液中的分布情况。
通过实验结果的分析,我们可以得出基于实验数据的结论,从而为氯化镁在工业生产和实验室中的应用提供更为准确和可靠的参考数据。
最终的目的是为了深化对氯化镁溶解性与温度之间关系的理解,为相关领域的研究和应用提供科学依据和支撑。
通过本次实验,希望能够揭示氯化镁溶解度与温度的内在规律,为未来更深入的研究提供基础。
2. 正文2.1 氯化镁在水中的溶解性氯化镁是一种无色无味的盐类化合物,其化学式为MgCl2。
在常温下,氯化镁可以溶解于水中,形成氯化镁溶液。
氯化镁在水中的溶解性是指单位体积水溶液中所能溶解的氯化镁的质量。
根据溶解度曲线的实验结果,可以得知在特定温度下,氯化镁溶解性是固定的,也就是说在一定条件下只能溶解一定量的氯化镁。
氯化镁溶解性与水温有一定的关系,一般情况下随着温度的升高,氯化镁的溶解性也会增加。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HCl
不溶
HCl
HCl
HCl
HCl
略溶
HCl
HCl
微溶
水
水
水
水
水
水
水
水
水
水
水
水
水
略溶,HCl
略溶,HCl
Sr2+
HCl
HCl
HCl
HCl
HCl
HCl
HCl
略溶
HCl
HCl
不溶
略溶
水
水
水
水
水
水
水
水
水
水
水
水
HCl
略溶,HCl
Ba2+
HCl
HCl
略溶
HCl
HCl
HCl
HCl
HCl
HCl
HCl
不溶
HCl
-
-
-
-
-
HCl
水解,HCl
水解,HCl
水
-
略溶,HNO3
HNO3
HCl
Hg2+
HCl
HCl
水
HCl
HCl
HCl
HCl
-
-
HCl
略溶
HCl
王水
水
-
不溶
-
水
HCl
水
水
水
水
水
HCl
-
Pb2+
HNO3
HNO3
略溶,HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
溶解性全表
维基百科,自由的百科全书
(重定向自溶解性总表)
[编辑]全表
CO32−
C2O42−
F−
SO32−
AsO33−
AsO43−
PO43−
BO2−
SiO32−
C4H4O62−
SO42−
CrO42−
S2−
CN−
[Fe(CN)6]4−
[Fe(CN)6]3−
S2O32−
SCN−
I−
Br−
Cl−
CH3COO−
水解,HCl
水
-
-
HCl
HCl
Sb3+
-
HCl
略溶,HCl
-
-
-
HCl
-
-
HCl
HCl
-
浓HCl
-
-
-
-
-
水解,HCl
水解,HCl
水解,HCl
-
-
-
HCl
HCl
As3+
-
-
-
-
-
-
-
-
-
-
-
-
HNO3
-
-
-
-
-
水
水解,HCl
水解,HCl
-
-
-
HCl
-
Cd2+
HCl
HCl
略溶,HCl
HCl
HCl
HCl
不溶
不溶
HNO3
HNO3
略溶,HNO3
不溶
沸水
水
水
水
HNO3
HNO3
Hg22+
HNO3
HNO3
水
HNO3
HNO3
HNO3
HNO3
-
-
略溶,HNO3
略溶
HNO3
王水
-
-
-
-
HNO3
HNO3
HNO3
HNO3
水
水
略溶,HNO3
HNO3
-
Ag+
HNO3
HNO3
水
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
略溶
HNO3
HNO3
不溶
不溶
不溶
HNO3
不溶
不溶
不溶
不溶
略溶
热水
水
HNO3
-
注释:
水
该物质溶于水
略溶
该物质略溶于水
微溶
该物质微溶于水
HCl
该物质可溶于盐酸
HNO3
该物质可溶于硝酸
王水
该物质可溶于王水
不溶
该物质不溶于水、盐酸、硝酸和王水
氧还
该物质的阴阳离子在水中会发生氧化还原反应而不存在
解
该物质的阴阳离子在水中会发生彻底双水解反应而不存在
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
水
HCl
HNO3
HNO3
不溶
不溶
水
水
水
水
水
水
水
水
HCl
HCl
Mn2+
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
略溶,HCl
水
略溶,HCl
HCl
HCl
HCl
不溶
水
水
水
水
水
水
水
水
HCl
HCl
Fe2+
HCl
HCl
略溶,HCl
HCl
HCl
弱
该物质溶于水但为弱电解质
挥
该物质溶于水且有挥发性
水
略溶,HCl
水
水
HCl
水
水
水
水
水
水
水
HCl
HCl
Zn2+
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
水
水
HCl
HCl
不溶
不溶
水
水
水
水
水
水
水
水
HCl
HCl
Co2+
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
水
水
HCl
HNO3
HNO3
不溶
不溶
水
水
水
水
水
水
水
水
HCl
HCl
Ni2+
HCl
HCl
HCl
HCl
水
HCl
HNO3
HCl
不溶
不溶
水
HCl
水
水
水
水
水
水
HCl
HCl
Cu2+
HCl
HCl
略溶,HCl
HCl
HCl
HCl
HCl
HCl
HCl
水
水
水
HNO3
HCl
不溶
不溶
-
HNO3
略溶
水
水
水
水
水
HCl
HCl
Bi3+
HCl
HCl
HCl
-
HCl
HCl
HCl
HCl
HCl
HCl
略溶
HCl
HNO3
NO2−
NO3−
O2−
OH−
NH4+
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
解
水
Na+
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
K+
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
Mg2+
略溶
水
HCl
水
HCl
HCl
HCl
HCl
HCl
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
HCl
HCl
Ca2+
HCl
HCl
HCl
HCl
HCl
水
氧还
HCl
不溶
不溶
不溶
水
水
水
水
水
水
-
水
HCl
HCl
Fe3+
解
HCl
略溶,HCl
解
HCl
HCl
HCl
HCl
HCl
水
水
水
HCl
-
不溶
水
-
水
水
水
水
水
水
水
HCl
HCl
Cr3+
-HCl水-源自-HClHCl
