陕西师范大学考研物理化学资料PPT课件
陕师大物理化学课件11

第十一章 化学动力学基础(二)在化学反应速率理论的发展过程中,先后形成了碰撞理论,过渡状态理论和单分子反应理论。
碰撞理论是在气体分子运动论的基础上建立起来的,而过渡状态理论是在动力学和量子力学发展中形成的。
但到目前为止,现有的速率理论还不能令人满意,目前正在不断发展之中。
第一节 碰撞理论(Simple Collision theory )(SCT )一、碰撞理论基本论点:分子碰撞理论是在接受了阿仑尼乌斯活化态、活化能概念的基础上,利用分子运动论于1918年由路易斯建立起来的。
其基本论点是:(1)反应物分子要发生反应必须碰撞,反应物分子间的接触碰撞是发生反应的前提。
(2)不是任何反应物分子间的碰撞均能发生反应,只有那些能量较高的活化分子、并满足一定的空间配布几何条件的碰撞反应才能发生。
(3)活化分子的能量较普通能量高,它们碰撞时,松动并部分破坏了反应物分子中的旧键,并可能形成新键,从而发生反应,这样的碰撞称为有效碰撞或非弹性碰撞,活化分子愈多,发生化学反应的可能性就愈大。
(4)若从Z 表示单位时间、单位体积内A ,B 分子碰撞总数,以q 代表有效碰撞在总碰撞数Z A,B A,B,d[A]=-=dt A BZ r q L 中所占的百分数,则反应速率可表示为 二、双分子的互碰频率两个分子碰撞过程就是在分子的作用力下,两个分子相互靠近到一定距离时又相互排斥开来的过程。
两个分子的质心在碰撞过程所能到达的最短距离称为有效直径(或碰撞直径)。
其数值往往要稍大于分子本身的直径。
在分子碰撞理论中,采用了刚球模型,设A 、B 两种分子都是完全弹性的、无压缩性的刚球,二者半径各为A 12d B 12d ,和。
设单位体积中A 的分子数为A NV,A 分子运动的平均速率为〈〉。
假定B 分子是静止的,那么一个A 分子与静止B分子的碰撞次数为A u )(21B A AB d d d +=AB Z',A 、B 分子的碰撞直径为,碰撞截面为。
最新陕西师范大学-物理化学-复习题1

复习试题一1.有一系统在某一过程中,吸热30J ,对外做功50J ,则内能变化量为 ;2.已知反应C(s)+O 2(g)=CO 2(g) 的标准平衡常数为K 1;CO(g)+1/2O 2(g)=CO 2(g)的标准平衡常数为K 2; 2C(s)+O 2(g)=2CO(g) 的标准平衡常数为K 3;则K 3与K 1、K 2的关系为 _____________ ; 3.某理想气体在20℃、100kPa 下的摩尔体积为 ;4.焓、吉布斯自由能的定义式分别为 、;1.下列各种条件下,CO 2在水中溶解度最大的是( )A 高压低温B 低压低温C 高压高温D 低压高温2.在 400K ,液体A 的蒸气压为4×104 Pa ,液体B 的蒸气压为6×104 Pa ,两者组成理想液态混合物。
当气-液平衡时,在溶液中A 的摩尔分数为0.6,则在气相中B 的摩尔分数应为( ) A 0.31 B 0.40 C 0.50 D 0.603.在0.1 kg 水中含 0.0045 kg 某纯非电解质的溶液,于272.685 K 时结冰,水的凝固点降低常数 K f 为1.86 K.mol -1.kg -1,则该溶质的摩尔质量大约为( ) A 0.135 kg/mol B 0.172 kg/molC 0.090 kg/molD 0.180 kg/mol4. PCl 5的分解反应是PCl 5(g )=PCl 3(g) + Cl 2(g),在473 K 达到平衡时, PCl 5(g)有48.5%分解,在573 K 达到平衡时,有97%分解,则此反应为( )A 放热反应B 吸热反应C 即不放热也不吸热D 这两个温度下的平衡常数相等一、填空题(共4小题,将适当的内容填入题中划线处。
每空3分,满分15分)二、选择题( 共4题,将判断结果填入题后的括号中。
每题3分,满分12分)( )1. 某一化学反应的标准摩尔吉布斯函数△r G m $> 0,这就说明该反应不能自发进行; ( )2. 在通常情况下,对于二组分系统平衡共存时最多相数为3; ( )3. 米和面混合的十分均匀,再也无法彼此分开,则该系统有一个相; ( )4. 水的三相点和水的冰点不是一回事;( )5. 标准平衡常数改变了,平衡一定会移动。
(NEW)陕西师范大学《730物理化学(含结构化学)》历年考研真题汇编(含部分答案)

2013年陕西师范大学730物理化学(含结构化学)考研真题 2012年陕西师范大学730物理化学(含结构化学)考研真题 2011年陕西师范大学730物理化学(含结构化学)考研真题及详解 2010年陕西师范大学730物理化学(含结构化学)考研真题及详解 2009年陕西师范大学730物理化学(含结构化学)考研真题及详解 2008年陕西师范大学647物理化学(含结构化学)考研真题 2006年陕西师范大学341物理化学(含结构化学)考研真题 2005年陕西师范大学341物理化学(含结构化学)考研真题 2004年陕西师范大学341物理化学考研真题 2003年陕西师范大学341物理化学考研真题
2004年陕西师范大学341物理化学 考研真题
2003年陕西师范大学341物理化学 考研真题
2013年陕西师范大学730物理化学 (含结构化学)考研真题
2012年陕西师范大学730物理化学 (含结构化学)考研真题
2011年陕西师范大学730物理化学 物理化学 (含结构化学)考研真题及详解
2009年陕西师范大学730物理化学 (含结构化学)考研真题及详解
2008年陕西师范大学647物理化学 (含结构化学)考研真题
2006年陕西师范大学341物理化学 (含结构化学)考研真题
2005年陕西师范大学341物理化学 (含结构化学)考研真题
陕西师范大学考研物理化学资料
2 1
E分解
电压E
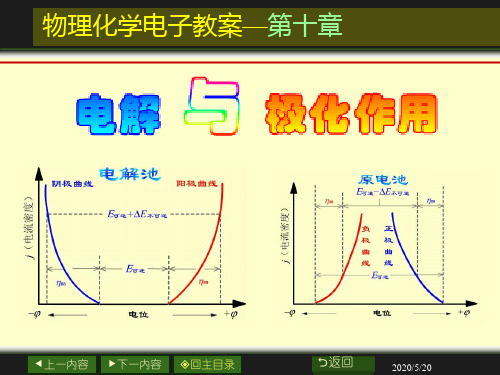
测定分解电压时的电流-电压曲线
返回
2013-11-11
分解电压的测定
将I-E曲线中2-3段的 直线部分外延到I = 0处所
得的电压就是Eb, max 。
这是使某电解液能连 续不断发生电解时所必须
电 流 I
3
的最小外加电压——使电
解池不断工作所必需外加 的最小电压,称为电解液 的分解电压。
返回
2013-11-11
分解电压
分解电压:使某电解质溶液能连续不断发生电解反应
所必须外加的最小电压称为电解质溶液的分解电压。
理论分解电压在数值上等于该电解池作为可逆电池时
的可逆电动势。
E(理论分解 ) E(可逆)
由于电池回路的电压降和阴、阳极的极化所产生的超
电势,使得实际分解电压要比理论分解电压大。
η阴
负 极 曲 线
正 极 曲 线
E可逆
上一内容 下一内容
电位
返回
2013-11-11
原电池中两电极的极化曲线
回主目录
极化曲线(polarization curve)
上一内容
下一内容
回主目录
返回
2013-11-11
氢超电势
电解质溶液通常用水作溶剂,在电解过程中,H+ 在阴极会与金属离子竞争还原。
上一内容 下一内容 回主目录
返回
2013-11-11
分解电压的测定
原电池产生了一个与 外加电压方向相反的反电 动势Eb。外加电压必须克 服这反电动势。
电 流 I
3
继续增大外加电压, 电极上就有H2和Cl2继续产 生并向溶液中扩散,因而 电流也有少许增加,相当 于I-E曲线上的1-2段。
陕西师范大学考研物理化学资料

反应分子数(Molecularity of reaction)
反应分子数:是指在基元反应过程中参与反应 的粒子(分子、原子、离子、自由基等)的数
目,只可能是1,2或3(不大于3的正整数)。
根据反应分子数可以将化学反应分为单分子反
应,双分子反应,三分子反应,三分子以上的
反应目前还未发现。
单分子反应
速率方程中各反应物浓度项的指数称为该反应
物的反应级数。 所有浓度项指数的代数和称为该反应的总级数,
通常用n表示。n的大小表明浓度对反应速率的影响
程度。 反应级数可以是正数、负数、整数、分数或零,
有的反应无法用简单的数字来表示级数,称为无级数
反应。 反应级数是由实验测定的。
反应级数(Order of reaction) 例如:
下,反应机理还要给出所经历的每一步的立体化学结
构图。
同一反应在不同的条件下,可有不同的反应机
理。了解反应机理可以掌握反应的内在规律,从而 更好的调控反应。
简单反应
一步能够完成的反应叫简单反应,简单反应由
一个基元反应组成。且质量作用定律可直接用于每 一基元反应,而简单反应本身是由一个基元反应组 成,故质量作用定律可直接用于简单反应。
(3)取值不同:反应级数可以为0、1、2、3、分数、 负数,而且对指定反应,反应级数可依反应条件变化 而改变。反应分子数只能为1、2、3,对指定的基元 反应为固定值。
(4)对于简单反应来说,反应分子数和反应级数不
一定一样,如蔗糖水解是双分子反应,但为一级反应。 (5)简单级数反应不一定有简单的机理;一种级数
dcA kc cA cB dt
dpA k p pA pB dt
pB = cBRT ,由(1)和(2)式可得kp与kc的关系:
物理化学ppt课件

状态改变了,不一定所有性质都改变,但性质改 变了,状态一定改变。
例:理气的等温过程:(P1,V1)→(P2,V2) 状态改变了,T不变
3 状态改变时,状态函数的变化量只与变化的始末 态有关,而与变化的途径无关。
14
状态函数在数学上具有全微分的性质。
若x为状态函数,系统从状态A变化至状态B:
经验定律特征: 1. 是人类的经验总结,其正确性由无数次实验事实
所证实; 2. 它不能从逻辑上或其他理论方法来加以证明(不
同于定理)。
4
4.热力学研究方法
严格的数理逻辑的推理方法,即演绎法 (1) 广泛性:只需知道体系的起始状态、最 终状态,过程进行的外界条件,就可进行相 应计算;而无需知道反应物质的结构、过程 进行的机理,所以能简易方便地得到广泛应 用。
Ⅱ AⅠB
有: xⅠ xⅡ xⅢ xB xA
xA Ⅲ xB
dx 0
AB A
微小变化
若如x,理y想,气z皆体为:状V态函nR数T,且即z:=Vf(x,fy)(,p,T则) :
p
15
16字口诀: 异途同归,值变相等;周而复始,数值还原。
☻单值、连续、可微的函数――具全微分性质
z z( x, y )
1.2 热和功
热(heat)
体系与环境之间因温差而传递的能量称为热, 用符号Q 表示。
功(work)
体系与环境之间传递的除热以外的其它能量都 称为功,用符号W表示。功可分为体积功W和 非体积功W’两大类。
符号规定: 系统吸热,Q>0;系统放热,Q<0 。 系统得功,W>0;系统做功,W<0。
23
热和功的特点:
陕西师范大学硕士研究生招生考试“730-物理化学”考试大纲

本《物理化学(含结构)》考试大纲适用于陕西师范大学化学学科各专业硕士研究生招生考试。
《物理化学(含结构)》是化学学科的一门基础理论课,本课程的目的在于运用物理和数学的有关理论和方法研究化学系统中物质的结构及其变化规律。
它的主要内容包括:化学热力学、统计热力学、化学动力学、电化学、表面化学和胶体化学。
要求考生熟悉基本概念、掌握基本原理和综合分析解决问题。
一、考试的基本要求要求考生比较系统地理解物理化学的基本概念和基本理论,掌握物理化学的基本思想和方法,应用物理化学原理分析解决问题。
掌握原子、分子和晶体结构,以及结构与性质之间的联系。
二、考试方法和考试时间物理化学考试采用闭卷笔试形式,试卷满分为150分,考试时间为180分钟。
三、考试内容(一)化学热力学1.热力学概论和热力学的基本概念2.热和功3.热力学第一定律和热力学能4.焓5.热容,热量的计算6.准静态过程与可逆过程7.热力学第一定律的应用8.Carnot循环9.Joule-Thomson效应10.热化学11.Hess定律12.几种热效应13.反应焓变与温度的关系—Kirchhoff定律14.绝热反应15.自发变化的共同特征16.热力学第二定律17.Carnot定理18.熵的概念19.Clausius不等式与熵增加原理20.热力学基本方程与T-S图21.熵变的计算22.熵和能量降退23.热力学第二定律的本质和熵的统计意义24.吉布斯自由能和亥姆霍兹自由能25.吉布斯自由能变化的计算与判据应用26.变化的方向与平衡条件27.热力学函数间的基本关系式28.热力学第三定律与规定熵29.多组分系统的组成表示法30.偏摩尔量和化学势概念31.混合气体中各组分的化学势32.稀溶液的两个经验定律33.理想液态混合物34.理想稀溶液各组分的化学势35.稀溶液的依数性36.活度与活度因子37.分配定律—溶质在两互不相溶液相中的分配38.相律39.克拉贝龙—克劳修斯方程40.单组分体系的相图及应用41.二组分体系的相图及应用42.三组分体系的相图及应用43.化学反应的平衡条件—反应进度和化学反应的亲和势44.化学反应的平衡常数和等温方程式45.平衡常数的表示式46.复相化学平衡47.标准摩尔生成吉布斯自由能48.温度、压力及惰性气体对化学平衡的影响49.平衡常数的计算与应用50.同时平衡和反应的藕合51.近似计算(二)统计热力学1.统计热力学概论2.玻兹曼统计3.配分函数4.分子的全配分函数5.用配分函数计算标准吉布斯自由能和反应的平衡常数(三)电化学1.电化学中的基本概念和电解理论2.离子的电迁移和迁移数3.电解质溶液的电导4.电解质溶液的离子平均活度与活度因子5.强电解质溶液理论简介6.可逆电池和可逆电极7.电动势的测定8.可逆电池的书写方法及电动势的取号9.可逆电池的热力学10.电动势产生的机理11.电极电势和电池的电动势12.电动势测定的应用13.分解电压,极化作用,超电势14.电解时电极上的竞争反应15.金属的电化学腐蚀、防腐与金属的钝化16.化学电源(四)化学动力学1.反应速率的表示与测定2.速率方程与速率系数,质量作用定律3.一、二、三、零级反应4.反应级数的测定5.温度对反应速率的影响6.对峙反应、平行反应与连串反应7.链反应8.碰撞理论和过渡态理论9.单分子反应理论10.溶液中化学反应动力学11.光化学反应12.催化反应动力学(五)表面化学1.表面张力与表面吉布斯自由能2.弯曲表面上的附加压力和蒸汽压3.溶液的表面吸附4.液-液界面性质5.膜6.液-固界面现象7.表面活性剂的性质及其应用8.固体表面的吸附9.气-固相表面催化反应(六)胶体化学1.胶体与胶体的基本特性2.分散体系的种类和性质3.溶胶的制备与净化4.溶胶的动力性质5.溶胶的光学性质6.溶胶的电学性质7.双电层理论和ζ电势8.溶胶的稳定性与聚沉作用9.乳状液10.凝胶11.大分子溶液12.高分子溶液的渗透压,唐南平衡(七)量子力学基础与原子结构1.实物微粒的波粒二象性2.微观粒子的运动状态及其运动规律3.量子力学基本假设4.势箱中运动的粒子5.单电子原子的薛定谔方程及其解6.量子数及其意义7.波函数和电子云的图形8.多电子原子的结构9.原子光谱(八)分子的结构、性质和对称性1.H2+的结构和共价键的本质2.分子轨道理论双原子分子的结构3.异核及双原子分子的结构单电子原子的薛定谔方程及其解4.分子的点群5.分子对称性与偶极矩和旋光性的关系6.休克尔分子轨道理论及应用7.分子轨道对称性和反应机理(九)晶体结构1.晶体的点阵结构2.晶体的对称性3.球的密堆积和金属单质的结构4.离子键和点阵能5.典型离子化合物的结构四、主要参考书目[1]《物理化学》,傅献彩等编,第五版,高等教育出版社,2006.[2]《结构化学》,周公度、段连运编,第五版,北京大学出版社,2017.出师表两汉:诸葛亮先帝创业未半而中道崩殂,今天下三分,益州疲弊,此诚危急存亡之秋也。
陕师大物理化学课件10

第十章 化学动力学基础(一)第一节 化学动力学的任务和目的在我们的周围,乃至整个宇宙,时刻发生着无数的化学反应,有的缓慢,如生命的演化过程中甲烷的生成;有的很快可瞬时完成,如离子反应、爆炸反应等。
在化工生产中,人们希望有的反应尽可能快些,而在有些场合人们希望反应尽可能慢些,如铁的生锈、食物的腐烂、塑料的老化。
关于反应速率的研究就十分重要。
那么反应速率如何表示,影响反应速率的主要因素是什么?如何控制反应速率?化学反应的机理如何?这些问题都是化学动力学主要研究的问题:一、化学动力学的任务和目的化学热力学主要研究反应的方向、限度和外界因素对平衡的影响。
解决反应的可能性,即在给定条件下反应能不能发生,及反应进行的程度?而化学动力学主要研究反应的速率及反应机理。
主要解决反应的现实性问题。
例如反应:()()()2221H g +O g H O 12→ 的,说明该反应向右进行的趋势是很大的,但是在通常情况下若把H ()1r m ,237.2kJ mo G T p θθΔ=−⋅l −2、O 2放在一起几乎不发生反应。
计算表明:283 K 时,要生成0.15 %的水需长达10.60亿年的时间。
但如果将温度升至1073 K (800 ℃)时,该反应以爆炸的方式瞬时完成。
又例如:合成氨反应,在300p 及500℃ 时,按热力学计算,此反应的最大可能转化率为26 % 左右,但是如果不加催化剂,这个反应速率非常慢,当有铁触媒作催化剂时,反应才能较快地进行。
化学动力学的基本任务是:了解反应速率;讨论各种因素(浓度、压力、温度、介质 、催化剂等)对反应速率的影响;研究反应机理、讨论反应中的决速步等。
二、化学动力学发展概况1850年,人们提出浓度与反应速率的关系;十九世纪末:范霍夫、阿仑尼乌斯讨论了反应速率与温度的关系;二十世纪化学动力学、催化等有了新的发展,特别是许多新技术如:激光、交叉分子束、计算机等用于动力学的研究,目前动力学的研究已从宏观动力学的研究进入到态-态反应动力学的研究。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在硬球碰撞示意图上,A
和B两个球的碰撞直径d AB 与
相对速度 u r 之间的夹角为 。
通过A球质心画平行于 u r
的平行线,两平行线间的距离
ur
b
B
d AB A
b
就是碰撞参数b 。
硬球碰撞理论
bdABsin bmax dAB
b 值愈小碰撞愈激烈, b 0 迎头碰撞,最激烈。
上一内容 下一内容 回主目录
上一内容 下一内容 回主目录ຫໍສະໝຸດ 返回2020/7/30
两个分子的一次碰撞过程
v
v
b
o
上一内容 下一内容 回主目录
返回
2020/7/30
有效碰撞直径和碰撞截面
运动着的A分子和B分子,两者质心的投影落在
半径为 d AB的圆截面之内,都有可能发生碰撞。
d A B 称为有效碰撞直
径(两个分子的质心在碰
撞时所能达到的最短距 离),数值上等于A分子 和B分子的半径之和。
互碰频率为:
ZAB
dA 2B
NA V
NB V
8RT
uA
8RT πM A
uB
8 RT πM B
上一内容 下一内容
或ZABdA 2BL2 8RT[A][B]
式中 MAMB
MA MB
NA[A]L NB[B]L
V
V
回主目录
返回
2020/7/30
两个A分子的互碰频率
当体系中只有一种A分子,两个A分子互碰的相对
12.1 碰撞理论 12.2 过渡态理论 12.3 单分子反应理论 12.4 分子反应动态学简介 12.5 在溶液中进行的反应 12.6 快速反应的测试 12.7 光化学反应 12.8 化学激光简介 12.9 催化反应动力学
上一内容 下一内容 回主目录
返回
2020/7/30
12.1 碰撞理论
碰撞理论的基本论点
物理化学电子教案—第十二章
上一内容 下一内容 回主目录
返回
2020/7/30
整体概述
概况一
点击此处输入相关文本内容 点击此处输入相关文本内容
概况二
点击此处输入相关文本内容 点击此处输入相关文本内容
概况三
点击此处输入相关文本内容 点击此处输入相关文本内容
上一内容 下一内容 回主目录
返回
第十二章 化学动力学基础(二)
d AB
A
B
虚线圆的面积称为
碰撞截面(collision cross
section),数值上等
于
d
2 AB
。
分子间的碰撞和有效直径
上一内容 下一内容 回主目录
返回
2020/7/30
A与B分子互碰频率
将A和B分子看作硬球(完全弹性的、无压缩性的刚 球) ,根据气体分子运动论,它们以一定角度相碰。
相对速度为: ur uA 2 uB2
返回
2020/7/30
碰撞参数(impact parameter)
bdABsin
ur
b
B
d AB
A
b
硬球碰撞理论
上一内容 下一内容 回主目录
返回
2020/7/30
有效碰撞分数
分子互碰并不是每次都发生反应,只有相对平 动能在连心线上的分量大于阈能的碰撞才是有效的, 所以绝大部分的碰撞是无效的。
和 m B ,折合质量为,运动速度分别为 u A 和 u B ,
总的动能为
E1 2mAuA 21 2mBuB 2
将总的动能表示为质心整体运动的动能 g 和分
子相E 对运动g 的 动能r r 1 2 ,(m Am B )ug 21 2ur2
两个分子在空间整体运动的动能对化学反应没有
贡献,而相对动能可以衡量两个分子相互趋近时能量
碰撞理论基本论点
分子碰撞理论是在接受了阿仑尼乌斯活化态、活 化能概念的基础上,利用分子运动论于1918年由路易 斯建立起来的,其基本论点是:
(1) 反应物分子要发生反应必须碰撞,反应物分子间的 (2) 接触碰撞是发生反应的前提。
(2) 不是任何反应物分子间的碰撞均能发生反应,只有 那些能量较高的活化分子、并满足一定的空间配布 几何条件的碰撞反应才能发生。
反应阈能
两个分子的一次碰撞过程 反应截面
有效碰撞直径和碰撞截面 碰撞理论计算速率系数
A与B分子互碰频率
的公式
两个A分子的互碰频率
反应阈能与实验活化能的
硬球碰撞模型
关系
碰撞参数
概率因子
有效碰撞分数
碰撞理论的优缺点
上一内容 下一内容 回主目录
返回
2020/7/30
反应速率理论的共同点
与热力学的经典理论相比,动力学理论发展 较迟。先后形成的碰撞理论、过渡态理论都是20 世纪后建立起来的,尚有明显不足之处。
速度为:
ur
2 8RT πM A
每次碰撞需要两个A分子,为防止重复计算,在
碰撞频率中除以2,所以两个A分子互碰频率为:
ZAA 22dA 2A(N VA)2
8RT
MA
2dA2A(NVA)2
RT
MA
2dA2AL2
RT [A]2
MA
上一内容 下一内容 回主目录
返回
2020/7/30
硬球碰撞模型
设A和B为没有结构的硬球分子,质量分别为m A
理论的共同点是:首先选定一个微观模型, 用气体分子运动论(碰撞理论)或量子力学(过渡态 理论)的方法,并经过统计平均,导出宏观动力学 中速率系数的计算公式。
由于所采用模型的局限性,使计算值与实验 值不能完全吻合,还必须引入一些校正因子,使 理论的应用受到一定的限制。
上一内容 下一内容 回主目录
返回
2020/7/30
r =d[A] =ZA,B q dt L
上一内容 下一内容 回主目录
返回
2020/7/30
两个分子的一次碰撞过程
两个分子在相互的作用力下,先是互相接近,接 近到一定距离,分子间的斥力随着距离的减小而很快 增大,分子就改变原来的方向而相互远离,完成了一 次碰撞过程。
粒子在质心体 系中的碰撞轨线可 用示意图表示为:
的大小,有可能发生化学反应。
上一内容 下一内容 回主目录
返回
2020/7/30
硬球碰撞模型
三对分子对具有相同的相对动能,但碰撞的剧烈程度显 然不同, 分子间碰撞有效性还取决于分子间的相对位置。
上一内容 下一内容 回主目录
返回
2020/7/30
碰撞参数(impact parameter)
碰撞参数 描述粒子碰撞激烈的程度,用字母b表示。
上一内容 下一内容 回主目录
返回
2020/7/30
碰撞理论基本论点
(3) 活化分子的能量较普通分子能量高,它们碰撞时, 松动并部分破坏了反应物分子中的旧键,并可能形 成新键,从而发生反应。这种能导致旧键破裂的碰 撞称为有效碰撞。活化分子愈多,发生化学反应的 可能性就愈大。
(4) 若 ZA,B 表示单位时间、单位体积内A、B分子碰撞 总数,以q代表有效碰撞在总碰撞数ZA,B中所占的百 分数,则反应速率可表示为
