乙酰苯胺及其衍生物的氯甲基化反应 (1)
第六章酰基化反应
精选版课件ppt
31
5.2 C—酰基化反应
精选版课件ppt
32
5.2 C—酰基化反应
➢ 3.芳环上的甲酰化反应
➢ (1) Gattermann反应
➢ 以德国化学家路德维希·加特曼(Ludwig Gattermann)命名 ➢ Gattermann发现可以用两种方法在芳环上引入甲酰基 ➢ 一种方法是氰化氢法,即以氢氰酸和氯化氢为酰化剂,氯
5.1 N—酰基化反应
➢ 2.用酸酐的N—酰化 ➢酸酐对胺类进行酰化反应的通式为:
➢反应特点:反应是不可逆的,反应可以在水介质中进行。
➢对于二元胺类,如果只酰化其中一个氨基时,可以先用等摩尔比的盐酸, 使二元胺中的一个氨基成为盐酸盐加以保护,然后按一般方法进行酰化。 ➢例如.间苯二胺在水介质中加入适量盐酸后,再于40℃用乙酐酰化,先 制得间氨基乙酰苯胺盐酸盐.经中和可得间氨基乙酰苯胺,它是一个有用 的中间体。
精选版课件ppt
34
5.2 C—酰基化反应
精选版课件ppt
35
5.2 C—酰基化反应
➢ 另一种方法是用一氧化碳和氰化氢在催化剂三氯化铝、氯化 亚铜存在下,与芳环反应使芳环上引入一甲酰基。此法被称 作一氧化碳法,或称Gattermann-Koch(加特曼-科赫反应)反
应,属于傅-克酰基化反应(Friedel-Crafts acylation)的一种 。 ➢ 反应主要用于烷基苯、烷基联苯等具有推电子取代基的芳甲
30
5.2 C—酰基化反应
2.Hoesch(霍本-赫施)反应
➢ 腈类化合物与氯化氢在Lewis酸氯化锌催化下.与含羟 基或烷氧基的芳烃进行反应,可生成相应的酮亚胺,再经 水解得含羟基或烷氧基的芳香酮,此反应被称为Hoesch反 应。该反应以腈为酰基化试剂,间接地在芳环上引入酰基, 是合成酚或酚醚类芳酮的一个重要方法。 ➢反应历程是腈化物首先与氯化氢结合,在无水氯化锌的 催化下,形成具有碳正离子活性的中间体,向苯核作亲电 进攻,经σ—络合物转化为酮亚胺,再经水解得芳酮。
苯甲酸衍生物的氯甲基化方法[发明专利]
![苯甲酸衍生物的氯甲基化方法[发明专利]](https://img.taocdn.com/s3/m/5960fdda31126edb6e1a1055.png)
专利名称:苯甲酸衍生物的氯甲基化方法专利类型:发明专利
发明人:易章国
申请号:CN200910272486.3
申请日:20091023
公开号:CN101928233A
公开日:
20101229
专利内容由知识产权出版社提供
摘要:本发明涉及一种苯甲酸衍生物的氯甲基化方法,具体包括苯甲酸酯、苯甲酰胺、苯甲腈和二苯甲酮与多聚甲醛和三氯化铝反应,生成间位氯甲基取代的苯甲酸的衍生物。
间位氯甲基化取代的苯甲酸的衍生物是重要的精细化工、农药和医药中间体。
申请人:湖北迅达药业股份有限公司
地址:435400 湖北省武穴市永宁大道东117号湖北迅达药业股份有限公司
国籍:CN
更多信息请下载全文后查看。
乙酰苯胺的制备

中毒时,皮肤、粘膜严重青紫,呼吸困难,抽搐,甚至昏迷,休克。出现溶血性黄疸、中毒性肝炎
及肾损害。可有化学性膀胱炎。眼接触引起结膜角膜炎。慢性中毒:患者有神经衰弱综合征表现, 伴有轻度紫绀、贫血和肝、脾肿大。皮肤接触可引起湿疹。
•
环境危害:对环境有危害,对水体可造成污染。
•
燃爆危险:该品可燃,有毒。
(2)急救措施
三、工业生产方法
1、苯胺经乙酸乙酰化 由苯胺经乙酸乙酰化而得,生产中大多采用冰醋酸作为酰化剂,在较高温度下进行较长时间的
回流。C6H5NH2+CH3COOH→C6H5NHCOCH3+H2O 步骤
将苯胺和碳酸钠水溶液混合,在搅拌下滴加醋酐,加完后冷却,过滤,冷水洗涤,干燥的粗品, 用水重结晶即得产品。苯胺和醋酸的配料比为1:1.33(摩尔比),碳酸钠的用量应恰好中和反应 中生成的乙酸。本法收率为90%。
急救措施
• 皮肤接触:立即脱去被污染的衣着,用肥皂水和清水彻底冲洗皮肤。就医。 眼睛接触:立即提起眼 睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。就医。
• 吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进 行人工呼吸。就医。
• 食入:误服者用水漱口,给饮牛奶或蛋清。就医。 • 灭火方法:二氧化碳、干粉、1211灭火剂、砂土。禁止用水或泡沫灭火。
(3)危险性
• 闪点(℃):39 • 爆炸极限(%):4.0-17 • 静电作用:可能有聚合危害 • 燃烧性: 自燃温度 • 危险特性:能与氧化剂发生强烈反应,与氢氧化钠与氢氧化钾等反应剧烈。稀释后对金属有腐蚀性。 • 消防方法:用雾状水、干粉、抗醇泡沫、二氧化碳、灭火。用水保持火场中容器冷却。用雾状水驱
(必考题)高中化学选修三第一章《有机化合物的结构特点与研究方法》测试卷(含答案解析)(1)

一、选择题1.(0分)[ID :140198]下列化合物的1H-NMR 谱图中吸收峰的数目不正确的是 A .(2组) B .(5组)C .(3组)D .(4组)2.(0分)[ID :140193]某混合气体由两种气态烃组成。
2.24L 该混合气体完全燃烧后,得到4.48L 二氧化碳(气体体积均已换算成标准状况下的体积)和3.6g 水。
则这两种气体可能是A .4CH 和38C HB .4CH 和43C H C .24C H 和43C HD .24C H 和26C H 3.(0分)[ID :140177]分子式为C 5H 10Cl 2且结构中只含有一个甲基的有机物共有(不考虑立体异构)A .5种B .6种C .7种D .8种4.(0分)[ID :140172]设N A 为阿伏加德罗常数的值。
下列叙述中正确的是A .1molFe 与高温水蒸气完全反应,转移电子的数目为3N AB .28gC 5H 10的烃分子中,含有的碳碳双键的数目为0.4N AC .常温常压下,7.0g 由丁烯与丙烯组成的混合气体中含有的氢原子数目为N AD .5mL0.1mol/LCH 3 COOH 溶液和10mL 0.5mol/L CH 3COOH 溶液中所含CH 3COOH 分子数相等5.(0分)[ID :140165]某烯烃氢化后得到的烃是,该烃可能有的结构简式有A .1种B .2种C .3种D .4种 6.(0分)[ID :140147]分子式为C 4H 8O 2的有机物,属于酯类分子最多有 A .2种B .3种C .4种D .5种 7.(0分)[ID :140134]下列分子表示的物质一定是纯净物的是 A .C 5H 10B .C 2H 4O 2 C .C 2H 5ClD .C 2H 4Cl 2 8.(0分)[ID :140125]分子式为C 4H 8O 2的有机物,属于酯类的同分异构体有 A .3种B .4种C .5种D .6种 9.(0分)[ID :140117]为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是 选项被提纯物质 除杂试剂 分离方法 A酒精(水) 生石灰 蒸馏 B 乙醇(乙酸) Na 2CO 3溶液 分液C乙烷(乙烯) 酸性KMnO 4溶液 洗气 D 溴苯(溴) CCl 4 萃取A .AB .BC .CD .D10.(0分)[ID :140113]下列说法错误的是A .甲烷的填充模型为:B .含8个中子的碳原子的符号为:146CC .金刚石、石墨和C 60互为同位素D .()3232CH CH CH 和()32CH CHCH CH 互为同分异构体11.(0分)[ID :140109]烃的含氧衍生物A 的蒸气密度是相同状况下H 2的37倍。
Vilsmeier-Haack甲酰化反应
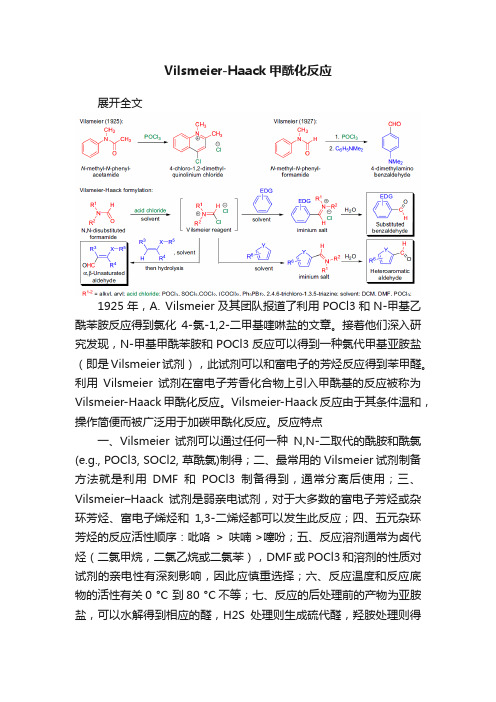
Vilsmeier-Haack甲酰化反应展开全文1925年,A. Vilsmeier及其团队报道了利用POCl3和N-甲基乙酰苯胺反应得到氯化4-氯-1,2-二甲基喹啉盐的文章。
接着他们深入研究发现,N-甲基甲酰苯胺和POCl3反应可以得到一种氯代甲基亚胺盐(即是Vilsmeier试剂),此试剂可以和富电子的芳烃反应得到苯甲醛。
利用Vilsmeier试剂在富电子芳香化合物上引入甲酰基的反应被称为Vilsmeier-Haack甲酰化反应。
Vilsmeier-Haack反应由于其条件温和,操作简便而被广泛用于加碳甲酰化反应。
反应特点一、Vilsmeier试剂可以通过任何一种N,N-二取代的酰胺和酰氯(e.g., POCl3, SOCl2, 草酰氯)制得;二、最常用的Vilsmeier试剂制备方法就是利用DMF和POCl3制备得到,通常分离后使用;三、Vilsmeier–Haack试剂是弱亲电试剂,对于大多数的富电子芳烃或杂环芳烃、富电子烯烃和1,3-二烯烃都可以发生此反应;四、五元杂环芳烃的反应活性顺序:吡咯> 呋喃 >噻吩;五、反应溶剂通常为卤代烃(二氯甲烷,二氯乙烷或二氯苯),DMF或POCl3和溶剂的性质对试剂的亲电性有深刻影响,因此应慎重选择;六、反应温度和反应底物的活性有关0 °C 到80 °C不等;七、反应的后处理前的产物为亚胺盐,可以水解得到相应的醛,H2S处理则生成硫代醛,羟胺处理则得到腈,或者还原则生成胺;八、反应有区域选择性,优先在位阻更小的位点反应(苯环对位),但是电子效应也影响反应位点的选择;九、富电子烯烃可以发生此反应水解后得到α,β-不饱和羰基化合物。
十、-OH,-OR,-NR1R2,CH(OR)等基团不影响反应。
反应机理首先DMF和三氯氧磷反应,生成强亲电子的Vilsmeier 中间体,接着芳香族化合物进行亲电取代(SEAr)反应。
然后加水分解得到甲酰化产物。
关于规范化工企业自动控制技术改造工作的意见苏安监

关于规范化工企业自动控制技术改造工作的意见苏安监〔2009〕109 号江苏省安全生产监督管理局(意见)各市安全生产监督管理局:为加快推进化工生产过程自动控制,逐步实现化工企业本质安全化,有效防范危险化学品事故的发生,依据《安全生产法》、《安全生产许可证条例》、《国务院安委会办公室关于进一步加强危险化学品安全生产工作的指导意见》和《省政府办公厅转发省安监局关于进一步加强危险化学品安全生产工作实施意见的通知》要求,现就规范我省化工企业自动控制技术改造工作提出如下意见。
一、总体目标以科技进步为支撑,以安全生产行政许可为手段,按照“安全可靠、经济适用、突出重点、分步实施”的原则,推进化工企业自动控制技术改造工作。
2010年底前,生产过程涉及危险工艺以及储存剧毒、易燃易爆化学品的化工企业,必须完成自动控制技术改造,提高企业安全保障能力。
二、改造范围1、生产装置:涉及硝化、氯化、氟化、氨化、磺化、加氢、重氮化、氧化、过氧化、裂解、聚合等危险工艺的生产装置。
2、储存设施:涉及剧毒、易燃易爆化学品的储罐区、库区;构成重大危险源的液化气体、剧毒液体等重点储罐。
三、改造要求涉及改造范围内的生产装置和储存设施的化工企业要根据工艺特点、装置规模、储存形式和可控程度等,设置相应的安全联锁,温度、压力、液位的超限报警,可燃、有毒气体浓度检测信号的声光报警,自动泄压、紧急切断、紧急联锁停车等自动控制方式,或采用智能自动化仪表、可编程序控制器(PLC)、集散控制系统(DCS)、紧急停车系统(ESD)、安全仪表系统(SIS)等自动控制系统,尽可能减少现场人工操作,提高企业的安全自动控制水平。
1、新建涉及改造范围内的生产装置或储存设施,必须装备自动控制系统,选用安全可靠的自动控制仪表、联锁保护系统,配备必要的有毒有害、易燃易爆气体泄漏检测报警系统和火灾报警系统。
投资规模1亿元人民币(含1亿元)以上和有高度危险(裂解、加氢、聚合、氟化、硝化、过氧化工艺等,下同)的生产装置,要在实现自动控制的基础上装备紧急停车系统。
强心药物左西孟旦的合成综述

强心药物左西孟旦的合成综述左西孟旦是新一代钙增敏剂类强心药物,具有独特的双重作用机制,其在临床上得到越来越广泛的应用,市场前景广阔,本文综述了左西孟旦的合成方法,并对各种方法进行了比较分析,总结出各自的优缺点。
标签:强心药物;左西孟旦;合成1 以乙酰苯胺为原料Kato[3]等人以乙酰苯胺为原料,经傅克酰化反应得到4-丙酰基乙酰苯胺,再与甲醛进行Mannich反应、季铵化、氰化、水解、环合反应制得关键中间体1(6-(4-氨基苯基)-5-甲基-4,5-二氢-3(2H)-哒嗪酮)。
国内张丽娟[4]采用该路线得到关键中间体1后,再采用L-酒石酸进行拆分、重氮化反应、与丙二腈加成得到目标产物左西孟旦,总收率为18.4%。
该路线需使用毒性较强的氰化物和昂贵不易得的碘甲烷,缺乏实验操作性和经济性。
孟繁浩[5]等人以乙酰苯胺为起始原料,与丙酰氯在二硫化碳,无水AlCl3条件下,搅拌回流反应后得到4-丙酰基乙酰苯胺,经溴化后得到4-(2-溴丙酰基)-乙酰苯胺,再与丙二酸二乙酯在氢化钠条件下缩合,再经脱羧,环合得关键中间体1,再经拆分、重氮化、加成反应得目标产物,总收率达18.9%。
该工艺避免了使用剧毒品氰化钾和价格较高的碘甲烷,但合成过程中使用易燃易爆的二硫化碳和氢化钠,强腐蚀性的溴和较昂贵的二苯醚为溶剂,不利于工业化生产。
郑士才[6]等人以乙酰苯胺与2-氯丙酰氯为起始原料,经傅克酰化,缩合,水解脱羧及环合得到关键中间体1。
该路线与路线一、二相比减少了一步反应,不用氰化物、溴、氢化钠等危险有害物质,简化了操作,降低了成本,适合工业化生产,收率64.6%(中间体1的收率)。
许佑君[7]等人以乙酰苯胺和3-氯-2-甲基丙酰氯为起始原料,在AlCl3的催化反应下得到4-(3-氯-2-甲基丙酰基)乙酰苯胺,再在碱性条件下与氰化物反应,水解,环合得到中间体1。
该合成路线较短,反应条件温和,但3-氯-2-甲基丙酰氯来源困难,且需使用剧毒物质氰化物。
精细有机合成化学与工艺学第11章-酰化说课讲解

-R C O O H
-R C O O H
第二个酰基非常活泼,容易水解消除。将二酰化物 (或一酰化与二酰化的混合物)在含水的溶剂(稀 酒精)中重结晶时,最终只得到一酰化产物。
⑺ 用 CO 作甲酰化剂
CO 是甲酸酸酐,不活泼,可从合成气中分离出来, 成本低,适用于在大型生产中作为甲酰化剂。
例,将无水二甲胺和含 甲醇钠 的 甲醇溶液 连续地压入 喷射环流反应器,110 ~ 120 ℃ 和 1.5 ~ 5 MPa 与CO 反应,即得 N,N - 二甲基甲酰胺。
例,对氯苯胺 80 ~ 90 ℃ 溶于石脑油中,慢慢加入乙酸酐, 80 ~ 85 ℃ 保温 2 h,冷至 15 ~ 20 ℃,过滤、水洗、 干燥,即得 对氯乙酰苯胺,mp 176 ~ 177 ℃。
⑶ 用 乙酸 或 乙酸酐 作 溶剂
例,n(3-氨基-N,N-二甲基苯胺) : n(乙酸) : n(乙酸酐) = 1 : 1 : 1.1 的摩尔比在 60 ℃ 保温 30 min,反应物 在搅拌下倒入水中,滤出固体用乙醇和水重结晶, 得N,N - 二甲基 - 3 - 乙酰氯基苯胺,mp 84 ~ 86 ℃。
② 低碳脂羧酰氯的N - 酰化反应速度较快,可在水 中进行,为减少酰氯水解,滴加酰氯时应不断地滴 加
NaOH、Na2CO3 溶液;固体 Na2CO3 、Ca(OH)2, 控
制例,反氯应代液乙的酰p氯H 非值常始活终泼在,7可~在8低。温下完成酰化反应。
S
NH2 ClCH2COCl S
最常用的是乙酸酐,活性较高,20 ~ 90 ℃即可顺利 进 行乙酰化。乙酸酐用量一般只需过量 5 % ~ 10 % 。
⑴ 胺和酰化产物的熔点都不太高,反应可不加溶剂
例,在搅拌和冷却下,将乙酸酐加入到间甲苯胺中,60 ~ 65 ℃保温 2 h,即得间甲基乙酰苯胺。
乙酰苯胺
基本思路
乙酰苯胺
由于-NH-CO-CH3 为第一类(邻、对位) 定位基,但因空间位 阻效应的影响,普通 反应条件下对位卤代 产物占大多数。
反应机理
有机 溶剂
催化剂
X
卤源
反应机理:取代反应,由于乙酰基的供电 子作用,使苯环的活性加强, 接下来的反应可以顺利进行。 由于催化剂的定向作用,使得邻位的活 性增加,邻位的产物将占主要。
现有技术
目前乙酰苯胺的选择性卤代都是采 用有机溶剂,在反应过程中需要用到有 机强酸如对甲基苯磺酸或三氟甲基苯磺 酸。 不仅造成价格昂贵,而且有机溶剂 容易挥发,在污染环境的同时还伤害健 康。
改进措施
利用离子液体的低挥发性和对 物质溶解性好的特点,构成一新 的反应体系,以达到降低污染和 成本的目的。
国内外进展 国外做了大量关于Pd或者Cu催化的芳 香C—H键转化为C—X键的研究, 主要是对 贫电子芳烃进行卤化。在二价钯催化下, 使用氟离子作为氟源,醋酸钯作为催化剂 实现了一系列吡啶化合物的氟化,主要产 物是邻位氟化产物,芳环上连有强吸电子 和给电子基团均能发生此反应。
国内外进展 国内在C—H活化方面也取得了很多成 果,发展了用Pd(OAc)2/Cu(OAc)2/CuCl2混 合体系,其设计原理是用Pd( OAc)2 作为催 化剂Cu(OAc)2作为氧化剂 CuCl2作为氯源 成功的实现了钯催化的乙酰苯胺类底物的 邻位氯化。
R1 N R2
R3 R4
+
谢谢观赏!
乙酰苯胺的 邻位卤代
背景 芳香卤代烃一直作为一种重要的化学 原料及医药中间体被广泛应用。卤素原子 可有效改变化合物的空间结构,改变化合 物的亲水亲油性,从而改变化合物的物化 性质和生理活性;同时卤代芳香的卤素官 能团能有效的转化为其他官能团,如还原, 亲核取代,亲核加成等等,这些使得芳香 卤代烃成为重要的化学中间体,同时也使 得芳香卤代化反应成为重要的化学反应。
联苯的氯甲基化及其衍生物的合成研究

联苯的氯甲基化及其衍生物的合成研究
联苯是一种重要的有机化合物,它是由苯环之间的两个相对位置
上的碳原子通过单键相连而形成的。
联苯具有广泛的应用和重要的生
物活性,因此其化学研究具有重要的价值和意义。
其中,联苯的氯甲
基化及其衍生物的合成也是一项热门研究课题。
联苯的氯甲基化是指在联苯分子中的碳原子上引入一个氯基和一
个甲基,以形成氯甲基苯环。
因此,这种反应的关键是氯甲基化试剂
的选择。
一般来说,氯甲基化试剂有三种:少量次氯酸钠(NaClO)、
氯甲酸甲酯(CH3OCOCl)和三氯甲烷(CHCl3)。
其中,次氯酸钠和氯
甲酸甲酯是两种较常用的试剂,它们的反应机理也不同。
次氯酸钠可
以通过氯化和脱氯两个步骤将甲基和氯原子引入到联苯分子中,而氯
甲酸甲酯则是通过预处理实现的,一般需要用碱来加速反应。
在氯甲基化反应完成后,我们可以进一步合成氯甲基苯环的衍生物。
例如,我们可以通过在氯甲基苯环上引入苯基,从而合成二苯基
甲基苯(DPMB)。
这一过程是一个亲核取代反应,需要使用亲核试剂(如溴苯)和催化剂(如氧化铜)辅助完成。
另外,如果在氯甲基苯
环上引入羧基或醇基等官能团,则可以合成一系列有机化合物。
总之,联苯的氯甲基化及其衍生物的合成是有一定难度和挑战性
的化学反应,需要研究人员在合适的条件下选择合适的试剂和催化剂,以轻松高效地完成反应。
通过这种方法,我们可以合成出多种有机化
合物,这些化合物可能具有广泛的应用价值和重要的生物活性,值得
我们深入探究。
乙酰苯胺的合成(酰基化反应)

乙酰苯胺的合成(酰基化反应)实验目的(1)了解从苯胺制备乙酰苯胺的方法;(2)学习重结晶基本操作,巩固分馏操作技术;(3)了解乙酰苯胺的性质和用途。
产品的性质和用途乙酰苯胺是白色有光泽片状结晶或白色结晶粉末,在水中再结晶析出呈正交晶片状。
无臭或略有苯胺及乙酸气味。
熔点114.3℃,沸点304℃,闪点173.9℃,自燃点546℃,相对密度1.219(15/4℃),在空气中稳定。
溶解情况:溶解度(g/100g):水0.56(25℃)、3.5(80℃)、18(100℃);乙醇36.9(20℃),甲醇69.5(20℃),氯仿3.6(20℃),微溶于乙醚、丙酮、甘油和苯。
不溶于石油醚。
可燃,呈中性或极弱碱性。
遇酸或碱性水溶液易分解成苯胺及乙酸。
乙酰苯胺是合成磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。
实验原理苯胺(C6H5NH2)与乙酰基化试剂如冰乙酸、(CH3CO)2O、CH3COCl等反应可制得乙酰苯胺。
本实验采用过量冰乙酸,并及时将生成的水蒸出,以使苯胺完全反应,提高反应产率。
反应方程式为:主要仪器和试剂(1)器材:锥形瓶(25mL),韦式分馏柱,温度计(150℃),抽滤瓶,布氏漏斗,量筒,热水漏斗,接液管,烧杯,表面皿(2)药品: C6H5NH2 ,冰乙酸Zn粉活性碳实验内容和步骤(1)制备在25mL锥形瓶中,加入5mL新蒸馏的苯胺,7.5mL冰乙酸及少许Zn粉(约0.1g)。
装上一支韦式分馏柱,柱顶接分馏头,分馏头上端放一支温度计(150℃),支管接尾接管,用一量筒接收蒸馏出的水。
加热锥形瓶,维持柱顶温度在105℃左右约50min,当温度下降或瓶内出现白雾时反应基本完成,停止加热。
在不断搅拌下,将反应物趁热以细流慢慢倒入盛有100mL冷水的烧杯中,剧烈搅拌,冷却,待乙酰苯胺完全析出时,减压抽滤,用5~10mL冷水洗涤,以除去酸液,抽干,得粗品乙酰苯胺。
(2)提纯将粗品乙酰苯胺转入盛有100mL热水的烧杯中,加热至沸,使之溶解,如仍有未溶解的油珠,可补加热水,至油珠全溶。
氯甲基化反应综述

经 典 的 氯 甲 基 化 反 应 是 以 一 C \一 HC O) 一 H HO 、 ( H 、 ( HO)与 HC HC L为氯 甲基 化试剂 ,尽管它们 反应活性较 低 、 应 时间长 、 率不高 , 是它们价 格低 、 存 运输方 反 产 但 贮 便、 毒性较小 , 文献 中应用此类 氯 甲基源 的报道 任然最多 , 其 中 所 用 的 盐酸 可 以是 普 通 液 态 浓 盐 酸 , 可 以是 盐 酸气 。 也 1 . 通盐 酸气 .1 1 例如 : 乙酰 苯 胺 及 其衍 生 物 的氯 甲基 化 反 应 在带有气体导入管 的装置 中,依次加入 干燥苯 3 m 、 0l
西 医 的 心理 护理 相 比 , 以 看 出实 验 组 明显 优 于 对 照组 。 可 痰 湿 互结 型 , 理 上 侧 重 功 能 锻炼 , 皮下 积液 和患 肢 水 肿 的 护 在 发 生 率 上 明 显低 于对 照 组 。 血 两 虚 型 , 理 上 以 食疗 和皮 气 护
对此患者我们采用耳穴压籽 , 一般取 用神 门 , , , 心 肝 脑干等 穴位 , 可祛除焦虑和恐惧 , 减轻疼痛 , 改善 睡眠 , 进一步促 进
夺 ・ >・ > 孛 ・ ・ >・ ・ ・ - ・ ・ ・ ・ ・ ・ ・ ・ ・ ・ ・ ・ ・ ・ ・ > 夺 ・ > - ・ ・ ・ ・ ・ ・ ・ ・ - 夺 ・ ・ ・ ・ ・ ・ ・ ・ - - ・ 夺 - 夺 夺 夺 寺 夺 ÷ 寺 夺 夺 孛 幸 寺 牵 夺 牛 寺 专 夺 - ・ 4 4 4 4 - ・ >寺 孛 夺 夺 夺 寺 夺 - ・ 寺 夺 夺 寺 寺 夺 4 4 4
21 0 0年 8月上 第 2卷 第 l 5期
Au u t g s 2 0 01 Vo. 1 2 No 1 .5
乙酰苯胺氯磺化反应的新方法

乙酰苯胺氯磺化反应的新方法乙酰苯胺氯磺化反应(Acylationofanilineswithchlorosulfonicacid)是一种重要的有机合成反应,用于制备苯胺衍生物及其他多种有机合成化合物。
近年来,学者们一直致力于开发新的温和的、低成本的乙酰苯胺氯磺化反应方法,以更有效地提高有机合成化学中的手性合成效率。
最近,一项在《Angewandte Chemie International Edition》上发表的研究表明,在乙酰苯胺氯磺化反应中,使用丙酮锡(ketostannane)作为酰氯剂及氯磺酸带入剂可以有效提高反应效率。
这将成为开发更为温和的方法的基础。
首先,丙酮锡可以有效地用作反应的酰氯剂,而不需要使用更具危险性的酰氯剂。
其次,由于丙酮锡与氯磺酸易于混合,使用这种方法可以有效地提高反应效率,并且可以在低温下高效地完成反应。
此外,丙酮锡催化的乙酰苯胺氯磺化反应不仅可以高效完成,而且还可以获得优质的产物,因此可以有效地提高有机合成化学中的手性合成效率。
除了上述优点外,这种新方法还具有环境友好的优势。
首先,它使用了低毒性的丙酮锡,而不是常用的有毒的有机溶剂。
其次,该反应只是在低温下完成,反应条件温和,反应产物易于分离,清洗简单,因此对环境有利。
在总结中,本文介绍了一种新的乙酰苯胺氯磺化反应方法,该方法使用了丙酮锡作为酰氯剂及氯磺酸带入剂。
与传统的方法相比,该反应具有更高的效率,更温和的反应条件,更有效的手性合成,更低的成本,以及更友好的环境效果。
因此,该反应将会成为有机合成化学的新方法,可为未来的手性合成提供新的解决方案。
当然,未来仍有诸多问题需要解决。
例如,我们需要开发更多的可替代的催化剂,以抑制乙酰苯胺氯磺化反应中的立即竞争反应;我们还需要深入研究该反应的机理,以进一步提高反应效率。
最后,未来还需要对该反应进行更深入的研究,以进一步拓展反应的使用范围。
总之,本研究为全新的乙酰苯胺氯磺化反应方法的研究和开发提供了重要的理论支撑,为未来的有机合成化工提供了新的挑战和机遇。
乙酰苯胺及其衍生物的氯甲基化反应_于丽君

研究简报乙酰苯胺及其衍生物的氯甲基化反应于丽君1,宁兆伦2,王恩思1,2,张福中3,杨世忠4(1.吉林大学药学院,长春130021;2.吉林大学生命科学学院,长春130023;3.通辽出入境检验检疫局,通辽028000;4.长春中医学院附属医院,长春130021)摘要:考察了乙酰苯胺及其衍生物在多聚甲醛2盐酸体系下的氯甲基化反应,结果表明,N 2氯甲基化反应的产物是主要产物.关键中间体及最终化合物的结构经核磁共振氢谱及碳谱确证.关键词:乙酰苯胺;衍生物;氯甲基化;反应中图分类号:O 621126 文献标识码:A 文章编号:167125489(2004)0120110203Studi es on chloro methylati on of acetan il i de and its der i vati vesYU L i 2jun 1,N I N G Zhao 2lun 2,WAN G En 2si 1,2,ZHAN G Fu 2zhong 3,YAN G Sh i 2zhong4(1.Colleg e of P har m acy ,J ilin U niversity ,Chang chun 130021,China ;2.Colleg e of L if e S cience ,J ilin U niversity ,Chang chun 130021,China ;3.T ong liao E ntry 2E x it Insp ection and Q uarantine B reau ,T ong liao 028000,China ;4.Colleg e of Chang chun Chinese M ed icine A ttach H osp ital ,Chang chun 130021,China )Abs trac t :T he ch l o rom ethylati on of acetan ilide and its derivatives in a polyfor m aldehyde 2HC l syste m gave N 2substituted p roducts as the m aj o r p roduct .T he structures of the inter m ediates and the target mo leculew ere confir m ed by 1H NM R and 13C NM R s pectra in our experi m ents.Keyw o rds :acetan ilide ;derivative ;ch l o rom ethylati on ;reacti on 收稿日期:2003202220.作者简介:于丽君(1965~),女,硕士研究生,从事药物化学研究,E 2m ail :zhangfuzhong @vi p .sina .com .联系人:王恩思(1955~),男,博士,教授,博士生导师,从事天然药物合成及绿色化学研究,E 2m ail :W angss @jlu .edu .cn .N 2(Α2烷氧基烷基)芳胺在生物有机化学和有机合成中具有重要作用[1,2].Barluenga 等人[3]报道芳胺在醇钠存在下与多聚甲醛反应制备该类化合物.W einberg 等人[4]在氢氧化钾的甲醇体系中电解合成该类化合物.Katritzky 等人[2]利用醇钠 醇体系的置换法制备该类化合物.我们在前文[5]报道利用芳胺的氯甲基化继之以醇解可获较好收率的该类化合物.本文考察了乙酰苯胺及其衍生物的氯甲基化反应,实验结果表明,该反应的主要产物为N 2氯甲基化产物产物.反应式如下: G N HA c (CH 2O )n HC l G N CH 2C l A c E tOH G N CH 2O E tA c ,G =H (化合物2,3);o 2M e (化合物4,5);m 2M e (化合物6,7);o 2C l (化合物8,9);p 2A c (化合物10,11);m 2CO 2E t (化合物12,13);m 2CO 2E t 2p 2O E t (化合物14,15).1 实 验111 仪器与试剂 熔点用XT 4显微熔点仪测定,温度未经校正.红外光谱用FT S 2135型(B I O 2RAD第42卷 第1期 吉林大学学报(理学版) V ol .42 N o .12004年1月 JOU RNAL O F J I L I N UN I V ER S IT Y (SC IEN CE ED IT I O N )Jan 2004公司)红外光谱仪测定,KB r 压片.1H NM R 和13C NM R 用UN IT Y 2400型(V arian 公司)核磁共振仪测定,TM S 为内标.柱层析用青岛海洋化工厂分厂硅胶G (200~300目或300~400目);其余试剂及溶剂均为国产A 1R 1级试剂.112 氯甲基化反应 在带有气体导入管的装置中,依次加入干燥苯30mL 、乙酰胺苯016g (414mmo l ),40℃搅拌下使乙酰胺苯溶解,加入多聚甲醛013g (916mmo l ),在回馏搅拌下通入干燥HC l 气体1~2h ,用TL C 跟踪反应进程,反应结束后冷至室温,有机层用饱和N aC l 洗至中性(3×20mL ),无水N a 2SO 4干燥,过滤,旋转蒸除溶剂得粗品,粗品经硅胶G 柱层析[洗脱液:V (乙酸乙酯) V (石油醚)=2 1]得精品化合物2016g (71%).用类似方法可得化合物4,6,8,10,12和14.化合物4粗品未经精制直接用于下一步醇解反应,化合物6,8,10,12和14的1H NM R 和13C NM R 分析数据见表1和表2.Table 1 1H N M R da t a of co m pounds 3~15[C DCl 3 T M S ,∆,J (Hz )]37145~7133(m ,3H ,A r );7129~7121(m ,2H ,A r );5108(s ,2H ,N CH 2O );3165(q ,J =618,2H ,OC 2H 5);1188(s ,3H ,CH 3CO );1121(t ,J =618,3H ,OC 2H 5)57135~7113(m ,4H ,A r );5142(d ,J =12,1H ,N CH 2O );4167(d ,J =6,1H ,N CH 2O );3167(q ,J =6,2H ,OC 2H 5);2125(s ,3H ,CH 3CO );1181(d ,J =12,3H ,A rCH 3);1121(t ,J =12,3H ,OC 2H 5)67134~7119(m ,4H ,A r );5114(s ,2H ,N CH 2C l );2138(s ,3H ,CH 3CO );2109(s ,3H ,A rCH 3)77129~7126(m ,1H ,A r );7117~7110(m ,1H ,A r );7102~7100(m ,2H ,A r );5107(s ,2H ,N CH 2O );3164(q ,J =8,2H ,OC 2H 5);2138(s ,3H ,CH 3CO );1189(s ,3H ,A rCH 3);1122(t ,J =8,3H ,OC 2H 5)87153~7134(m ,4H ,A r );5157(d ,J =10,1H ,N CH 2C l );4154(d ,J =10,1H ,N CH 2C l );1185(s ,3H ,CH 3CO )97151~7148(m ,2H ,A r );7135~7129(m ,2H ,A r );5153(d ,J =10,1H ,N CH 2O );4161(d ,J =10,1H ,N CH 2O );3168(q ,J =712,2H ,OC 2H 5);1182(s ,3H ,CH 3CO );1120(t ,J =712,3H ,OC 2H 5)108107(d ,J =418,1H ,A r );7194(d ,J =818,1H ,A r );7162(d ,J =818,1H ,A r );7144(d ,J =418,1H ,A r );5152(s ,2H ,N CH 2C l );2163(s ,3H ,CH 3CO );2157(s ,3H ,CH 3CO )117189(d ,J =814,2H ,A r );7123(d ,J =814,2H ,A r );4194(s ,2H ,N CH 2O );3147(q ,J =618,2H ,OC 2H 5);2147(s ,3H ,CH 3CO );1182(s ,3H ,CH 3CO );1108(t ,J =618,3H ,OC 2H 5)128106~7190(m ,2H ,A r );7152~7146(m ,2H ,A r );5116(d ,J =12,2H ,N CH 2C l );4138(q ,J =6,2H ,OC 2H 5);1188(s ,3H ,CH 3CO );1,41(t ,J =6,3H ,OC 2H 5)138106(s ,1H ,A r );7191(d ,J =4,1H ,A r );7151~7146(m ,2H ,A r );5116(d ,J =8,2H ,N CH 2O );4140(q ,J =4,2H ,OC 2H 5);3172(q ,J =4,2H ,OC 2H 5);1188(s ,3H ,CH 3CO );1140(t ,J =4,3H ,OC 2H 5);1124(t ,J =4,3H ,OC 2H 5)147164(d ,J =2,1H ,A r );7134(dd ,J =2,J =712,1H ,A r );6198(d ,J =618,1H ,A r );5103(s ,2H ,N CH 2C l );4139(q ,J =516,2H ,OC 2H 5);4115(q ,J =516,2H ,OC 2H 5);1189(s ,3H ,CH 3CO );1147(t ,J =516,3H ,OC 2H 5);1138(t ,J =516,3H ,OC 2H 5)157162(s ,1H ,A r );7129(d ,J =712,1H ,A r );6199(d ,J =618,1H ,A r );5106(s ,2H ,N CH 2OC 2H 5);4139(q ,J =6,2H ,OC 2H 5);4115(q ,J =516,2H ,OC 2H 5);3166(q ,J =8,2H ,N CH 2OC 2H 5);1188(s ,3H ,CH 3CO );1149(t ,J =516,3H ,OC 2H 5);1137(t ,J =6,3H ,OC 2H 5);1123(t ,J =8,3H ,N CH 2OC 2H 5)Table 2 13C N M R da t a of co m pounds 3~15(C D 3Cl T M S ,∆)317113,14211,12914,12914,12813,12813,12810,7710,6410,2217,1510517019,13919,13417,13015,12814,12717,12614,7519,6318,2115,1617,1413717113,14211,13914,12912,12817,12815,12510,7619,6410,2217,2111,1510817210,13913,13216,13010,13010,12919,12810,7214,22111019618,17010,14419,13712,12919,12917,12811,11819,7711,2614,22161119616,17015,14611,13610,12913,12912,12911,12717,7712,6319,2613,2215,14181217110,16513,14211,13217,13214,12916,12911,12819,7513,6112,2217,14111317110,16513,14211,13216,13210,12915,12910,12818,7610,6111,5718,2216,1811,14101417212,16514,15718,13414,13213,13014,12117,11410,7311,6418,6110,2215,1414,14101517116,16515,15810,13414,13219,13112,12119,11411,7817,6510,6412,6111,2218,1511,1416,1412111 第1期于丽君,等:乙酰苯胺及其衍生物的氯甲基化反应 113 醇解反应 在室温下,化合物2016g (916mmol )经硅胶G 柱层析(洗脱液:乙醇),得精品化合物3016g (71%).用类似方法可得化合物5,7,9,11,13和15.化合物3,5,7,9,11,13和15的1H NM R 和13C NM R 分析数据见表1和表2.2 结果与讨论采用乙酰苯胺及其衍生物在多聚甲醛2盐酸体系下的氯甲基化继之以醇解反应合成N 2(Α2烷氧基烷基)芳胺的衍生物,该法虽收率适中(见表3),但价格较低,毒性较小,且实验操作方便.值得注意的是,化合物7和9的收率较低是由于原料与产物的R f 值接近不能得到很好的分离所致.Table 3 Y i eld of co m pounds 2~15Compound23456789101112131415Yield (%)8571806684328621735781827480参考文献[1] Barluenga J ,Bayon A M ,Campos P .P reparati on of N ,O 2am inals as synthetic equivalents of H 2CNA r and (H 2C N HA r )+i ons [J ].J Che m S oc P erk in T ransl ,1988,(7):163121636.[2] Katritzky A R ,Fan W Q ,L ong Q H .A conveniet synthesis of N 2(Α2alkoxyalkyl )and N 2(Α2alkylth i ol )alkylam ines [J ].S y nthesis ,1993,(2):2292232.[3] Barluenga J ,Bayon A M ,A sensi o G .M onoalkylati one of p ri m aryarom atic am ine via N 2(alkoxym ethyl )arylam ine[J ].J Che m S oc Che m Co mm un ,1983,(19):110921110.[4] W einberg N L ,B row n E A .T he anodic oxidati on of organic compoundsthe electroche m ical alkoxylati on oftertiary am ines [J ].J O rg Che m ,1966,31:405824061.[5] YU L i 2jun (于丽君),ZHAN G Fu 2zhong (张福中),WAN G En 2si (王恩思).Studies on ch l orom ethylati on of52acetylam ino 222ethoxy 2benzoic acid ethyl ester (22乙氧基252乙酰氨基苯甲酸乙酯的氯甲基化反应)[J ].J ournal of Inner M ong olia U niversity f or N ationalities [内蒙古民族大学学报(自然科学学报)],2003,18(1):17219.(责任编辑:李桂英)Br i ef I n troducti on to“Journal of J il i n Un i versity (Sci ence Editi on )”“Journal of J ilin U niversity (Science Editi on )”is a comp rehensive acade m ic Journal in the fields of science s pons ored by J ilin U niversity and adm inistrated by the Educati onalM inistry of the peop le’s R epublic of Ch ina .T he j ournal started publi 2cati on in 1955.T he original nam e at starting publicati on w as “Journal of N atural Science of N ortheast Peop le’sU niversity ”,w h ich w as changed into “A cta Scientiarum N aturalium J ilinesis“(ISS N 052920279)in 1958ow ing to the nam e change of the university .T he p resent j ournal nam e has been begun since the beginning of 2002after a ne w J ilin U ni 2versity w as set up ,w h ich com es from the am algam ati on of the original J ilin U niversity ,J ilin U niversity of T echnol ogy ,Bethune M edicine U niversity ,Changchun U niversity of Science and T echnol ogy and Changchun Post and T elecomm uni 2cati on Institute on June 12,2000.T he dom estic j ournal num ber is CN 2221340 O ,and the internati onal j ournal num ber ISS N 167125489.T he editorial board of the j ournal consists of 47m e m bers w ho are all w ell know n p rofess ors.Among the m there are five A cade m icians of the Ch inese A cade m y of Sciences ,they are P rofs.Shen J ia 2cong (che m ist ),Sun J ia 2zhong (che m ist ),W u Sh i 2shu (physicist ),Xu R u 2ren (che m ist )and Zou Guang 2tian (physicist ).P rof .Q iu Sh i 2lun (V ice P resident of J ilin U 2niversity ,T he Chair m an of “973”p roject of P .R .Ch ina ,H ead ofM ac D iar m id L aboratory )holds the post of the editor 2in 2ch ief .T he j ournalm ainly covers the latest scientific research results ach ieved in basic theoretical research ,app lied and devel 2oped researches ,the contents of w h ich are contained in the colum ns of theses ,revie w s ,research notes and letters in the fields of m athe m atics ,physics ,che m istry ,life science ,computer science ,electricity and electronics ,environm ent science and s o on .(下转142页)211 吉林大学学报(理学版)第42卷 。
酰基化反应

HNO 3 CH3 COOH HNO 3 (CH3 CO)2 O
O2N
NHCOCH 3 NHCOCH 3 NO 2
H3 O+ △
H3 O+ △
O2N NH 2 NO 2
NH 2
——将苯胺溶于浓硫酸中,成为铵盐后再硝化。因―N+H3是强吸
电子基团,可使苯环钝化防止氧化,但硝化产物主要是间位异构体
NH 2
n HO(CH2)nOH
O(CH2)nOOCNH
NHCOO(CH2)nOOCNH
n
聚合时,添加少量水,某些二异氰酸酯与水生成二胺和二氧化碳。 CO2气泡保留在聚合体中,产品呈海绵状。此即聚氨酯泡沫塑料
CH3 NCO CH3 NH2
2H2O
+
2019/2/24
NCO
+
NH2
2CO2
4
磺酰化——兴斯堡反应(Hinsberg reaction)。
HCl
+ CH 3COONO 2 + N SO3
+
- 5 ℃~ - 30 ℃ O O Cl
ClCH CH2 Cl 2
- + SO3 N
O
SO3H
+ H2SO4(浓 )
20 ℃
S
SO3H + H 2O
N H
+ ?(CH
3 CO) 2 O
150 ℃ ~200 ℃
N H NO 2 (22 %)
HgSO4 200 ℃ ~300 ℃
——绝大多数药物、香料、染料都是杂环化合物。在所有有机化合 物中,杂环化合物约占1/3
故杂环化合物在人们的现实生活中有着极其重要的地位
2019/2/24
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
研究简报乙酰苯胺及其衍生物的氯甲基化反应于丽君1,宁兆伦2,王恩思1,2,张福中3,杨世忠4(1.吉林大学药学院,长春130021; 2.吉林大学生命科学学院,长春130023;3.通辽出入境检验检疫局,通辽028000;4.长春中医学院附属医院,长春130021)摘要:考察了乙酰苯胺及其衍生物在多聚甲醛-盐酸体系下的氯甲基化反应,结果表明,N -氯甲基化反应的产物是主要产物.关键中间体及最终化合物的结构经核磁共振氢谱及碳谱确证.关键词:乙酰苯胺;衍生物;氯甲基化;反应中图分类号:O621.26 文献标识码:A 文章编号:1671-5489(2004)01-0110-03Studies on chloromethylation of acetanilide and its derivativesYU Li-jun 1,NING Zhao-lun 2,WANG En-si 1,2,ZHANG Fu-zhong 3,YANG Shi-zhong 4(1.College of P har macy ,J ilin U niversity ,Chang chun 130021,China ; 2.College of L if e Science ,J ilin U niv er sity ,Changchun 130021,China ; 3.T ong liao Entry -Ex it I nsp ection and Quarantine Br eau ,T ongliao 028000,China ;4.College of Changchun Chinese M ed icine A ttach H osp ital ,Changchun 130021,China )Abstract :The chlorom ethylation of acetanilide and its derivatives in a poly formaldehyde -HCl system gave N -substituted products as the major product.T he structures of the interm ediates and the targ et m olecule w ere confirmed by 1H NMR and 13C NMR spectra in our experiments.Keywords :acetanilide ;derivative ;chloromethylation ;reaction收稿日期:2003-02-20.作者简介:于丽君(1965~),女,硕士研究生,从事药物化学研究,E-mail:zhangfuzh ong @.联系人:王恩思(1955~),男,博士,教授,博士生导师,从事天然药物合成及绿色化学研究,E-m ail:W angss@.N -( -烷氧基烷基)芳胺在生物有机化学和有机合成中具有重要作用[1,2].Barluenga 等人[3]报道芳胺在醇钠存在下与多聚甲醛反应制备该类化合物.Weinberg 等人[4]在氢氧化钾的甲醇体系中电解合成该类化合物.Katritzky 等人[2]利用醇钠/醇体系的置换法制备该类化合物.我们在前文[5]报道利用芳胺的氯甲基化继之以醇解可获较好收率的该类化合物.本文考察了乙酰苯胺及其衍生物的氯甲基化反应,实验结果表明,该反应的主要产物为N -氯甲基化产物产物.反应式如下: G NHAc (CH 2O)nHCl G N CH 2ClAc EtOH G N CH 2OEt Ac ,G=H(化合物2,3);o -M e(化合物4,5);m -M e(化合物6,7);o -Cl(化合物8,9);p -Ac(化合物10,11);m -CO 2Et(化合物12,13);m -CO 2Et-p -OEt(化合物14,15).1 实 验1.1 仪器与试剂 熔点用XT4显微熔点仪测定,温度未经校正.红外光谱用FTS-135型(BIO-RAD第42卷 第1期 吉林大学学报(理学版) V ol.42 N o.12004年1月 JOU RN A L OF JIL IN U N IV ERSIT Y (SCIEN CE EDIT ION )Jan 2004公司)红外光谱仪测定,KBr 压片.1H NMR 和13C NM R 用U NIT Y -400型(Varian 公司)核磁共振仪测定,TM S 为内标.柱层析用青岛海洋化工厂分厂硅胶G(200~300目或300~400目);其余试剂及溶剂均为国产A.R.级试剂.1.2 氯甲基化反应 在带有气体导入管的装置中,依次加入干燥苯30mL 、乙酰胺苯0.6g (4.4m mol),40℃搅拌下使乙酰胺苯溶解,加入多聚甲醛0.3g (9.6mmol),在回馏搅拌下通入干燥HCl 气体1~2h,用T LC 跟踪反应进程,反应结束后冷至室温,有机层用饱和NaCl 洗至中性(3×20mL ),无水Na 2SO 4干燥,过滤,旋转蒸除溶剂得粗品,粗品经硅胶G 柱层析[洗脱液:V (乙酸乙酯) V (石油醚)=2 1]得精品化合物20.6g (71%).用类似方法可得化合物4,6,8,10,12和14.化合物4粗品未经精制直接用于下一步醇解反应,化合物6,8,10,12和14的1H NM R 和13C NM R 分析数据见表1和表2.Table 1 1H NMR data of compounds 3~15[CDCl 3/TMS , ,J (Hz )]37.45~7.33(m ,3H ,A r );7.29~7.21(m ,2H ,Ar ); 5.08(s ,2H ,NCH 2O ); 3.65(q ,J =6.8,2H ,O C 2H 5); 1.88(s,3H,CH 3CO ); 1.21(t,J =6.8,3H,O C 2H 5)57.35~7.13(m ,4H ,Ar ); 5.42(d ,J =12,1H ,N CH 2O ); 4.67(d ,J =6,1H ,N CH 2O ); 3.67(q ,J =6,2H ,OC 2H 5); 2.25(s,3H,CH 3CO ); 1.81(d,J =12,3H,A rCH 3); 1.21(t,J =12,3H,OC 2H 5)67.34~7.19(m ,4H ,Ar ); 5.14(s ,2H ,NCH 2Cl ); 2.38(s ,3H ,CH 3CO ); 2.09(s ,3H ,A rCH 3)77.29~7.26(m ,1H,A r );7.17~7.10(m,1H,A r );7.02~7.00(m ,2H,Ar ); 5.07(s,2H,N CH 2O ); 3.64(q ,J =8,2H ,O C 2H 5); 2.38(s ,3H ,CH 3CO ); 1.89(s ,3H ,A r CH 3); 1.22(t ,J =8,3H ,OC 2H 5)87.53~7.34(m ,4H,Ar ); 5.57(d,J =10,1H,NCH 2Cl); 4.54(d,J =10,1H,NCH 2Cl); 1.85(s,3H,CH 3CO )97.51~7.48(m ,2H ,Ar );7.35~7.29(m ,2H ,A r ); 5.53(d ,J =10,1H ,N CH 2O ); 4.61(d ,J =10,1H ,N CH 2O );3.68(q,J =7.2,2H,OC 2H 5); 1.82(s,3H,CH 3CO ); 1.20(t,J =7.2,3H,OC 2H 5)108.07(d,J =4.8,1H,A r );7.94(d,J =8.8,1H,A r);7.62(d,J =8.8,1H,Ar );7.44(d,J = 4.8,1H,Ar ); 5.52(s,2H,N CH 2Cl); 2.63(s,3H,CH 3CO); 2.57(s,3H,CH 3CO)117.89(d,J =8.4,2H,A r );7.23(d,J =8.4,2H,A r); 4.94(s,2H,N CH 2O); 3.47(q,J = 6.8,2H,OC 2H 5); 2.47(s,3H,CH 3CO ); 1.82(s,3H,CH 3CO); 1.08(t ,J =6.8,3H,OC 2H 5)128.06~7.90(m ,2H,Ar );7.52~7.46(m ,2H,A r); 5.16(d,J =12,2H,NCH 2Cl); 4.38(q,J =6,2H,OC 2H 5);1.88(s,3H,CH 3CO );1,41(t,J =6,3H,O C 2H 5)138.06(s,1H,Ar );7.91(d,J =4,1H,Ar );7.51~7.46(m,2H,A r ); 5.16(d,J =8,2H,N CH 2O ); 4.40(q,J =4,2H,O C 2H 5); 3.72(q,J =4,2H,OC 2H 5); 1.88(s,3H,CH 3CO ); 1.40(t ,J =4,3H,OC 2H 5); 1.24(t ,J =4,3H ,OC 2H 5)147.64(d,J =2,1H,A r );7.34(dd,J =2,J =7.2,1H,Ar ); 6.98(d,J =6.8,1H,A r); 5.03(s,2H,N CH 2Cl); 4.39(q ,J = 5.6,2H ,O C 2H 5); 4.15(q ,J = 5.6,2H ,O C 2H 5); 1.89(s ,3H ,CH 3CO ); 1.47(t ,J =5.6,3H ,OC 2H 5);1.38(t ,J =5.6,3H,OC 2H 5)157.62(s,1H,A r );7.29(d,J =7.2,1H,A r ); 6.99(d,J = 6.8,1H,Ar ); 5.06(s,2H,N CH 2O C 2H 5); 4.39(q ,J =6,2H ,O C 2H 5); 4.15(q ,J = 5.6,2H ,O C 2H 5); 3.66(q ,J =8,2H ,N CH 2O C 2H 5); 1.88(s ,3H ,CH 3CO );1.49(t ,J =5.6,3H,OC 2H 5); 1.37(t,J =6,3H,OC 2H 5); 1.23(t,J =8,3H,N CH 2OC 2H 5)Tabl e 2 13C NMR data of compounds 3~15(CD 3Cl /TMS , )3171.3,142.1,129.4,129.4,128.3,128.3,128.0,77.0,64.0,22.7,15.05170.9,139.9,134.7,130.5,128.4,127.7,126.4,75.9,63.8,21.5,16.7,14.37171.3,142.1,139.4,129.2,128.7,128.5,125.0,76.9,64.0,22.7,21.1,15.08172.0,139.3,132.6,130.0,130.0,129.9,128.0,72.4,22.110196.8,170.0,144.9,137.2,129.9,129.7,128.1,118.9,77.1,26.4,22.611196.6,170.5,146.1,136.0,129.3,129.2,129.1,127.7,77.2,63.9,26.3,22.5,14.812171.0,165.3,142.1,132.7,132.4,129.6,129.1,128.9,75.3,61.2,22.7,14.113171.0,165.3,142.1,132.6,132.0,129.5,129.0,128.8,76.0,61.1,57.8,22.6,18.1,14.014172.2,165.4,157.8,134.4,132.3,130.4,121.7,114.0,73.1,64.8,61.0,22.5,14.4,14.0111 第1期于丽君,等:乙酰苯胺及其衍生物的氯甲基化反应 1.3 醇解反应 在室温下,化合物20.6g (9.6m mol )经硅胶G 柱层析(洗脱液:乙醇),得精品化合物30.6g (71%).用类似方法可得化合物5,7,9,11,13和15.化合物3,5,7,9,11,13和15的1H NMR 和13C NMR 分析数据见表1和表2.2 结果与讨论采用乙酰苯胺及其衍生物在多聚甲醛-盐酸体系下的氯甲基化继之以醇解反应合成N -( -烷氧基烷基)芳胺的衍生物,该法虽收率适中(见表3),但价格较低,毒性较小,且实验操作方便.值得注意的是,化合物7和9的收率较低是由于原料与产物的R f 值接近不能得到很好的分离所致.Tabl e 3 Yield of compounds 2~15Compo und23456789101112131415Y ield(%)8571806684328621735781827480参考文献[1] Bar lueng a J,Bay on A M ,Campos P.P repar ation of N ,O -aminals as sy nthet ic equiv alents of H 2CN Ar and (H 2C N HA r )+ions [J].J Chem Soc Perk in T r ansl ,1988,(7):1631-1636.[2] Kat ritzky A R ,F an W Q ,L ong Q H.A conveniet sy nt hesis of N -( -alkox yalkyl)and N -( -alkylthiol)alky lamines [J].Sy nthesis ,1993,(2):229-232.[3] Bar lueng a J ,Bay on A M ,A sensio G .M onoalkylatione of pr imary aromatic amine via N -(alkox ymethy l )ary lamine[J ].J Chem Soc Chem Commun ,1983,(19):1109-1110.[4] Weinber g N L ,Brow n E A.T he anodic ox idation of or ganic compounds Ⅱthe electrochemical alkox ylation oftertiar y amines [J].J Or g Chem ,1966,31:4058-4061.[5] YU L i -jun (于丽君),ZHA NG F u -zhong (张福中),W A NG En -si (王恩思).Studies o n chloromethy latio n of5-acety lamino -2-ethox y -benzoic acid ethyl ester (2-乙氧基-5-乙酰氨基苯甲酸乙酯的氯甲基化反应)[J ].J our nal of I nner M ong olia U niv er sity f or N ationalities [内蒙古民族大学学报(自然科学学报)],2003,18(1):17-19.(责任编辑:李桂英)Brief Introduction to“Journal of Jilin University (Science Edition )”“Journal of Jilin U niversity (Science Edit ion)”is a comprehensive academic Journal in the fields of science sponso red by Jilin U niv er sit y and administr ated by the Educational M inistry of t he people's R epublic of China.T he jour nal start ed publi-cation in 1955.T he original name at star ting publication was “Jour nal o f N atural Science o f N or theast P eople'sU niver sity ”,w hich w as chang ed into “A cta Scient iarum Naturalium Jilinesis “(I SSN 0529-0279)in 1958ow ing to the name change of the university.T he present jo urnal name has been beg un since the beg inning of 2002after a new Jilin U ni-versity w as set up,w hich comes from the amalg amation of the original Jilin U niversity ,Jilin U niv ersity of T echnolo gy ,Bethune M edicine U niversity ,Changchun U niv ersity of Science and T echnology and Chang chun P ost and T elecommuni-cation Institute o n June 12,2000.T he domestic journal number is CN 22-1340/O ,and the international journal number ISSN 1671-5489.T he editorial board of the journal co nsists of 47member s w ho ar e all well kno wn professors.Am ong them ther e are fiv e A cademicians o f the Chinese A cademy of Sciences ,they ar e Pro fs .Shen Jia -co ng (chemist ),Sun Jia -zhong (chemist ),Wu Shi-shu(phy sicist),Xu Ru-ren(chemist )and Z ou Guang-tian(phy sicist).P rof.Qiu Shi-lun (V ice Pr esident of Jilin U -niversity ,T he Chair man of “973”project of P.R.China,Head of M acDiarmid L aborator y)holds the post of the editor-in-chief.T he journal mainly covers the latest scientific resear ch r esults achieved in basic theoretical r esearch ,applied and dev el-oped resear ches,t he contents of w hich are contained in the columns of theses,review s,r esear ch notes and letters in the fields of mathematics,phy sics,chemist ry ,life science,computer science,electricity and electronics,envir onment science and so on .(下转142页)112 吉林大学学报(理学版)第42卷 。
