《联合制碱》课件
专项侯氏制碱法人教版高中化学必修一教学课件

CO2在NaCl中的溶解度很小,先通入NH3使食盐水显碱性(用无色酚酞溶液检验), 能够吸收大量CO2气体,产生高浓度的HCO3-,才能析出NaHCO3晶体。 ②侯氏制减法有何优点? 提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本
专项侯氏制碱法课件人教版高中化学 必修一
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化 钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分 析说明是否可行? _不__可_行__。__K_H__C_O_3_的__溶__解_度__大__,与__K__C_l的__溶__解__度_差__别__小__,向__K_C__l、__N_H__3的__饱___ _和__溶_液__中__通__入__C_O_2_不__析__出_K__H_C_O__3 _。
专项侯氏制碱法课件人教版高中化学 必修一
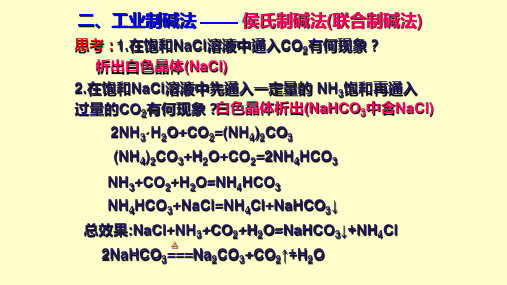
(NH4)2CO3+H2O+CO2=2NH4HCO3
NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NH4Cl+NaHCO3↓ 总效果:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 2NaHCO3=△==Na2CO3+CO2↑+H2O
专项侯氏制碱法课件人教版高中化学 必修一
专项侯氏制碱法课件人教版高中化学 必修一
专项侯氏制碱法课件人教版高中化学 必修一
例1.实验室利用下列物质制备氧气时,产生等量的氧气,电子转移数最少
的是
( B)
A.高锰酸钾 B.过氧化钠 C.氯酸钾 D.硝酸钠
3.2专项侯氏制碱法课件-人教版高中化学必修一
钾肥: KCl、K2SO4、K2CO3
复合肥: KH2PO4、NH4H2PO4
微量元素:ZnSO4、FeSO4--------
例1.为了同时施用分别含N、P、K3种元素的化肥,对于下列5种化肥:
①K2CO3 ②KCl ③Ca(H2PO4)2 ④(NH4)2SO4 ⑤氨水,合适的组合是 ( B ) A.①③④ B.②③④ C.①③⑤ D.②③⑤
KCl、K2SO4、K2CO3
2
①K2CO3 ②KCl ③Ca(H2PO4)2 ④(NH4)2SO4 ⑤氨水,合适的组合是 ( )
风化 白色粉末状物质
(NaOH潮解) (生成Na CO •10H O) ___________________________。
总效果:CO+Na2O2=Na2CO3 分别取样加盐酸,再检验是否有使澄清石灰水变浑浊的气体产生
下列反应方程式中正确的是
(C )
① 2Na2O2+2Mn2O7=4NaMnO4+O2↑
② 2Na2O2+2NO2=2NaNO2+O2
③ 2N2O3+2Na2O2=4NaNO2+O2
④ 2N2O5+2Na2O2=4NaNO3+O2
A.只有①
B.②③ C.①④ D.②③④
只用两两混合就能鉴别的物质 思考:可用类似方法鉴别的物质还有哪些? (1)强酸和可溶性碳酸盐、亚硫酸盐 (2)Al3+与OH-
①草木灰的主要成分是K CO Ca(H2PO4)2(重钙) 、KH2PO4、
铵态氮肥不易随水流失。
23
②草木灰不能与氨态氮肥混用 与H+结合生成气体快慢:HCO3->CO32-;
(3)AlO2-与H+
化工生产纯碱的制备(课堂PPT)

5
(一)氨碱法生产纯碱(索尔维制碱法) 比利时化学家——索尔维
6
索尔维制碱法(氨碱法)
1862年比利时人索尔维以NaCl、CaCO3、NH3 和H2O为主要原料,制得纯净的碳酸钠,叫索尔维制 碱法。其主要操作是:
①在氨化饱和食盐水中通入二氧化碳,制得 小苏打;
氨碱法(索氏)
联合制碱法(候氏)
原料低廉,成本降低, 氨循环利用;产品纯度 高;制造步骤简单
原料利用率高,充分利 用能量,几乎无污染, 生产碳酸钠和氯化铵两 产品,降低了生产成本
氯化钠未能充分利用, 耗能大,产生氯化钙废 弃物
联合制碱法:析出碳酸氢钠后母液中继续加入食 盐,通入氨气,使氯化铵析出,得到碳酸钠和氯 化铵两种产品
①联合制碱法将氯化铵作为一种化工产品,不再 生产氨循环使用; ②对分离出碳酸氢钠和氯化铵后含氯化钠的溶液 循环使用。
19
1、下图为纯碱生产工艺,生产流程可简要表示如下:
(1)上述生产纯碱的方称 侯德榜制碱法 , 副产品的一种用途为 化 肥 。
(2)沉淀池中发生的化学反应方程式: NaCl+NH3+CO2 +H2O → NaHCO3↓+NH4Cl
9
(一)氨碱法生产纯碱(索尔维制碱法)
CaCO3→CO2+CaO
CaO+H2O→Ca(OH)2
NaCl NaCl+NH3+CO2+H2O→NaHCO3+NH4Cl
2NaHCO3→N产a2品CO3+CO2+H2O
2NH4Cl+Ca(OH)2 →2NH3+CaCl2+2H2O
5.3化工生产――纯碱的制备PPT课件

(5)如何验证D中试管中的产物?
1
23 4 5
6
A
B
C
D
E
3、已知纯碱试样中含有NaCl杂 质。为测定纯碱的质量分数,可 用图中装置进行实验。
主要实验步骤如下: ① 按图组装仪器,并检查装置的气密性 ② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液 ③ 称量盛有碱石灰的U型管的质量,得到 b g ④ 从分液漏斗滴入6 mol / L的硫酸,直到不再产生气体时为止 ⑤ 从导管A处缓缓鼓入一定量的空气 ⑥ 再次称量盛有碱石灰的U型管的质量,得到c g ⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
(4 )→(5 )。 (3)各装置中盛放的试剂是A——C—a—(O——H—)—2——N—H——4C——l —B——H—C—l———C—a—C—O—3
C—饱——和——N—a—H—C——O—3—溶——液——D——冰—水—————————。 (4)D装置试管中应有的现象是—产——生——白——色——沉—淀————;用烧杯中的冰水
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量 试样溶于水后,再滴加
_____稀__硝__酸__和__硝__酸__银__溶__液___。
2、中国化学家侯德榜发明的“侯氏制碱法”大大提高了原料的利用率。化学实
验室利用有关原理制备碳酸氢钠,模拟工业流程。其方法是:把固体氯化钠溶
解在浓氨水里制成饱和溶液,再通入二氧化碳气体,即有碳酸氢钠析出。有关
方程式为:NH3+CO2+NaCl+H2O
NaHCO3+NH4Cl+Q
联合制碱法

联合制碱法氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步。
第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为它的溶解度较小。
根据NH4Cl 在常温时的溶解度比NaCl 大,而在低温下却比NaCl 溶解度小的原理,在278K ~283K(5 ℃~10 ℃ ) 时,向母液中加入食盐细粉,而使NH4Cl 单独结晶析出供做氮肥。
化学原理侯氏制碱法又名联合制碱法(1)NH3+H2O+CO2=NH4HCO3 (2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓ (3)2NaHCO3(加热)=Na2CO3+H2O+CO2↑ 即:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓ ②2NaHCO3(加热)=Na2CO3+H2O+CO2↑优点保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96 %;NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气CO 转化成CO2 ,革除了CaCO3 制CO2 这一工序。
注:纯碱就是碳酸钠国外研究情况(1862年至一战前)碳酸钠用途非常广泛。
虽然人们曾先后从盐碱地和盐湖中获得碳酸钠,但仍不能满足工业生产的需要。
1862年,比利时人索尔维(Ernest Solvay 1838—1922)发明了以食盐、氨、二氧化碳为原料制取碳酸钠的“索尔维制碱法”(又称氨碱法)。
此后,英、法、德、美等国相继建立了大规模生产纯碱的工厂,并组织了索尔维公会,对会员以外的国家实行技术封锁。
第一次世界大战期间,欧亚交通梗塞。
由于我国所需纯碱都是从英国进口的,一时间,纯碱非常缺乏,一些以纯碱为原料的民族工业难以生存。
1917年,爱国实业家范旭东在天津塘沽创办了永利碱业公司,决心打破洋人的垄断,生产出中国的纯碱。
他聘请正在美国留学的侯德榜先生出任总工程师。
侯氏制碱法的产生和发展1920年,侯德榜先生毅然回国任职。
他全身心地投入制碱工艺和设备的改进上,终于摸索出了索尔维法的各项生产技术。
纯碱生产方法课件

7 2 - 7 4 % , 且 仅 利 用 部 分 Na+ , 2 6 - 2 8 % Na+ ? 和 全 部 C
全部废弃, 总利用率为30%;
• (2) 产生大量废水,且废水不易处理。
8
7.1.3 联合制碱法
• 1942年,侯德榜发明了“索尔维制碱工艺与合成氨
=100:100:35.5(质量) 。 产品中含纯碱95%。
• 1791年建立了第一套日产300kg的吕布兰制碱
工厂。
• 其后,采用此法生产纯碱遍布整个欧洲,1880
年最高年产量为60万吨。
• 该法的实施,不仅提供了制碱方法,也促进了
硫酸、盐酸等工业的发展。
• 缺点:该法是在固相范围内进行生产,不能连
2NaHCO3(s) →NaCO3(s)+CO2↑+H2O↑+128 kJ
• 副反应:
NH4HCO3→NH3↑+CO2↑+H2O↑
NH4Cl+NaHCO3→NaCl+CO2↑+H2O↑+NH3↑
31
• 煅进烧 行回所收得。的炉气除CO2,H2O外,还有NH3,应 • 一般经除尘、冷却、洗涤后,可得浓度超过
• 1、 氨母液I中 NH3与CO2之比
NH3/CO2 =2. 1-2.4 , 吸氨目的: 使母液I中 的HCO3 - 转 化 为 CO32- , 防 止 NaHCO3, 与 NH4Cl共 析 。
过低共析,过高,氨分压高,氨损失增大。
• 2、 氨母液II中 NH3与NaCl之比
NH3/ NaCl= 1 . 0 4 - 1 . 1 2 , 使 NaHCO3析 出 若NH3/NaCl太高如1.15-1.20时, 易析出NH4HCO3。
纯碱PPT学习课件PPT课件

【两种除钙法比较】
• 石灰-碳酸铵法可用尾气中的氨,省原 料,但生成的氯化铵对碳酸化过程不 利,使其转化率降低。
• 石灰纯碱法用产品碱除钙虽损耗了部 分产品,但没有氯化铵生成,对后续 工序碳酸化有利。
【设备——除钙塔】
• 用石灰-碳酸铵法的除钙塔构造如图。
• 气体从塔底经菌帽齿缝后与溶液充分 接触;残气进入上部用水洗涤后排空, 洗涤水送去溶盐。
第11页/共52页
【设备——吸氨塔】
• 氨从中下部引入,引入处反应 剧烈,温升大,所以将部分吸 氨液循环冷却以提高吸收率。 上部各段都有溶液冷却循环以 保证塔内温度。
• 澄清桶的目的是除去少量钙镁 盐沉淀,达到杂质含量少于 0.1kg/m-3的标准。
• 操作压力略低于大气压,减少 氨损失和循环氨引入。
CO240% 的窑气
段 (
往往设置1个清洗塔,4个制碱塔。采用新鲜氨盐
析
水和稀CO2使碳酸氢盐生成碳酸盐从而溶解除去。
• 氨盐水停留时间 1.5-2h(有充分水解时间)
含
出 结 晶
• 钠利用率 75%;氨利用率 72%-73%;晶浆含
CO290%
)
NaHCO345%-50%
的重碱煅
烧炉气图 4.8
第17页/共52页
当氨盐比为1:1且原盐水饱和时,碳酸化度与 CO2平衡分压的关系如图4.9。
0.28MPa
图 4.9
1.9
第18页/共52页
• 在塔内碳酸化过程进行情况及碳酸化度沿塔高 分布如图4.10。
图 4.10
第19页/共52页
(4)碳酸氢钠的过滤及煅烧
【重碱过滤】
• 碳化塔底的母液仅含45%-50%的晶 浆,煅烧分离前需过滤。
项目十四 联合法生产纯碱与氯化铵

❖
好的事情马上就会到来,一切都是最 好的安 排。上 午3时58分6秒 上午3时 58分03:58:0620.12.9
❖
每天都是美好的一天,新的一天开启 。20.12.920.12.903:5803:58:0603:58:06Dec- 20
❖
务实,奋斗,成就,成功。2020年12月9日星 期三3时58分6秒 Wednesday, December 09, 2020
化学工业出版社
图11-4 含(NH4)2CO3的NaCl-NH4Cl-H2O体系
化学工业出版社
制碱过程分析
❖ 制碱过程是使母液Ⅱ吸氨及碳酸化,与氨碱法相同, 需要考察Na+、NH4+∥Cl-、HCO3-+H2O体系。在 30℃时的Na+、NH4+∥Cl-、HCO3-+H2O干盐图 (图11-5)中,氨碱法的基本过程是NaCl(A)与 NH4HCO3(C)作用,物系总组成为Y,反应生成P1 母液和析出NaHCO3结晶。从图中读出,进料NH3 对NaCl的配比为AY:YC接近于1。对生成物来说, NaHCO3:P1母液=P1Y:YD,其值约为0.72。
化学工业出版社
❖ Ⅱ过程:过滤重碱后的母液,称母Ⅰ经吸氨 后制成氨母Ⅰ,用以清洗结晶器内的结疤, 然后与Ⅰ过程的母Ⅱ进行热交换,使氨母Ⅰ 降温后进入冷析结晶器,通过外冷器冷却析 出一部分NH4Cl,结晶器上清液称半母Ⅱ, 溢流到盐析结晶器,加入洗盐或洁净盐,因 盐析之故,使剩余的NH4Cl从溶液中析出, 经离心机分离后,送到沸腾干铵炉内干燥而 得成品;产品经造粒后便于施肥。本方法每 生产1吨纯碱产品同时联产约1吨NH4Cl,因 此原盐的利用率可达到95%以上。
化学工业出版社
❖ 联合制碱法即侯氏制碱法又称循环制碱法,此法的 基本出发点是为了消除氨碱法废液的排放,杜绝污 染,将碳化过滤的母液不加石灰乳蒸馏回收氨,而 是将其再吸收氨,使溶解度小的HCO3-盐反应成溶 解度大的CO32-盐,然后冷却并加入洗盐或洁净盐, 使NH4Cl先冷却析出、然后再用盐析法析出。联合 制碱法的要点是利用同离子效应,配合以冷却或冷 冻,降低氯化铵在母液中的溶解度,使氯化铵从母 液中结晶析出,析出氯化铵结晶后的母液循环利用。 滤过NH4Cl的母液再吸收氨,然后进行碳化,这时 析出重碱,经分离、煅烧而得到纯碱;过滤的母液 循环使用,故称循环制碱,其过程示意图见图11-1。 联合制碱法的生产过程中不产生大量废弃物,产品 是纯碱和氯化铵。
沪科版高中化学《氨碱法和联合制碱法》

讨论:
1.针对上节课分析的两个缺点问题,关键是原料的利用 率问题。追根求源,原料的利用率低出现在工艺的哪个 环节?能否进行改进?
?
2.石灰石的作用是什么?
提供原料气CO2和NH3
3.能否不用石灰石CaCO3?
寻找CO2和NH3的新途径 → 1905年哈珀建成合成氨厂
(3)为什么能够得到碳酸氢钠固体呢?
为什么饱和食盐水中通入氨气和 CO2能有碳酸氢钠沉淀产生?
四种盐在不同温度下的溶解度(g/100g水)表
0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃ 100℃
NaCl
35.7 35.8 36.0 36.6 36.6 37.0 37.3 39.8
NH4Cl NH4HCO3 NaHCO3
二、侯氏制碱法(联碱法1942年)
侯德榜制碱法(联碱法)
1、原料:NaCl、NH3、CO2 (焦碳、空气、水)
2、反应原理:
①向饱和食盐水中通入过的NH3和CO2。 NaCl + NH3 + CO2 + H2O → NH4Cl + NaHCO3 ↓ ②再将所得NaHCO3焙烧制得纯碱
2NaHCO3
氨碱法与联合制碱法
• 纯碱(Na2CO3)的应用
制皂
纺织等
制玻璃
造纸
• 碳酸钠别名:纯碱、苏打
纯碱发现史
人类获得碱开始是从草木灰中获得碳酸钾,后来 又从盐碱地或盐湖中获得碳酸钠。 随着工业革命的进 行,人类对碱的需求越来越大,远远不能够满足工业 生产的需要。
1788年法国勒布朗发明了路布兰制碱法。其原理 是:
CO2↑ + Na2CO3+ H2O
联碱设备简介ppt课件

碳化塔的型号数量: 碳化工段共有碳化塔24台: φ2500碳化塔12台套, φ3000/φ3400异径碳化塔12台套,
滤碱机
过滤机的作用及简介 转鼓真空过滤机是应用在化工生产过程中的分离机械之一,它是利用压力差将含有大量固相和液相分离开来。 在纯碱生产中,采用转鼓真空过滤机来分离碳化取出液中的悬浮粗NaHCO3(俗称重碱)。它的工作原理是:转鼓真空过滤机的滤鼓内腔通过错气与真空管道相连同,当转鼓旋转的时候,在真空抽吸的作用下,将碱液槽内碱液中的粗NaHCO3吸附在滤鼓的外表面上,再经过洗涤、抽吸、辊压后,被刮刀刮下,送往煅烧工序。
煅烧炉(回转炉)型号及数量: 煅烧工段共有轻灰煅烧炉8台,重质碱煅烧炉1台,凉碱炉3台 φ2500轻灰煅烧炉5台套, φ3000轻灰煅烧炉2台套, Φ3600轻灰煅烧炉1台套, Φ2500重灰煅烧炉1台套 φ2500凉碱炉3台套
结晶工段
氯化铵结晶是使氨母液Ⅰ在结晶器中,借冷却和加盐的作用使氯化铵结晶析出,同时得到合乎制碱要求的母液Ⅱ送回碳化工序制碱用
通过联碱工艺知识讲座,相信大家对联碱分厂的联合制碱法工艺已经有了一定的认识和了解,下面将结合实际生产工艺情况,简单的给大家介绍和讲解下相关的设备知识。 联碱分厂的主要产品是轻质纯碱(Na2CO3)和农用氯化氨(NH4CL);另外还规模性生产重质纯碱(Na2CO3)和小苏打 (NaHCO3)。其采用的工艺流程是比较成熟的联合制碱法,简称联碱法,由我国著名科学家侯德榜博士于上世纪三四十年代发明的。其工艺流程示意图如下: 该制碱法主要分为两个过程,第一过程为生产纯碱的过程,简称制碱过程;第二过程为生产氯化氨的过程,简称制铵过程。两个过程构成一个循环系统,向循环系统中连续加入原料氨、氯化钠、二氧化和水,不断的生产出纯碱和氯化氨两种产品。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碳酸氢钠溶解度小。
(4):析出碳酸氢钠后的母液中还存在哪些离子? 哪些离子的数目发生了较大变化?
还有、NH4+ 、CI-, Na+ 、HCO3-浓度减小。
(5)向母液中加入研细的氯化钠后,为什么会析
出固体氯化铵呢? 溶解度
50
NH4Cl
40
30
NaCl
20
10
0
10 20 图301 40 50 60 温度
设计实验在实验室中的模拟侯氏制碱法
小结:侯氏制碱法的反应原理
NaCl(饱和) + NH3+ H2O + CO2 →NaHCO3↓+ NH4Cl
△
2NaHCO3 → Na2CO3 + H2O + CO2↑
• 纯碱的应用
制皂
纺织等
制玻璃
造纸
(2005年上海)我国化学家侯德榜(右图)改革国外的
纯碱生产工艺,生产流程可简要表示如下:
1921年10月侯德榜在美国获得博士学位,为了创 建中国的制碱工业,受爱国实业家范旭东之聘请, 毅然从美国启程回国,决心自己开发制碱新工艺, 经过600多次研究实验,分析了2000多个样品,历时 5年,于1942年发明了氨碱法与合成氨联合生产的改 进工艺,被命名为“联合制碱法”也叫“侯氏制碱 法”从而开创了世界制碱工业的新纪元。
选择生产条件时主要考虑的几个因素
(1)尽可能提高反应混合物中所需物质的百分含量; (2)尽可能缩短反应到达平衡所需要的时间; (3)尽可能降低对耐高压设备所需材料的要求; (4)考虑符合绿色化学原则。
绿色化学
• 绿色化学是研究和寻找能充分利用的无毒害原 材料,最大程度的节约能源,在各环节上实现 净化和无污染的反应途径。它的过程为零排放 和污染。具体内还体现在五个“R”上。 1、减量(Reduction) 2、重复使用(Reuse) 3、回收(Recycling) 4、再生(Regeneration) 5、拒用(Rejection)
食盐 水
CO 2
X
合成 氨 厂 NH 3 沉淀 池
煅 烧 炉 Na 2CO
NH 3
母液
(提取副产品)
(1) 副产品的一种用途为 。 (2)使原料氯化钠的利用率从70%提高到90%以上,主要 是设计了 的循环。
巩固与提高: 1862 年 比 利 时 人 索 尔 维 以 NaCl 、 CO2 、 NH3 和 H2O为主要原料,制得纯净的碳酸钠,叫索尔维制 碱法。其主要操作是:①在氨化饱和食盐水中通 入二氧化碳,制得小苏打;②把小苏打在250℃下 焙烧以制得碳酸钠,二氧化碳循环使用;③析出 小苏打的母液里加入生石灰,使氨循环使用。阅 读上述材料,回答以下问题: 1)饱和食盐水要先氨化,再通入二氧化碳的原因 是__N_H_3比__C_O_2_溶_解__度__大_,__先_使__氨__饱_和__有_利__用_于__C_O_2_吸__收_ 在这个生成NaHCO3过程中,两步相关的化学方程 式是:NH3+CO2+H2O → NH4HCO3;NH4HCO3+NaCl → NaHCO3+NH
法
两种原料的成分里只利用了一半
缺 点
食盐的利用率只有72%-74%
侯氏制碱法工业流程图
饱
过滤
和 食
通氨气
氨 洗涤 盐
盐 水
水 通CO2
煅烧 碳酸氢钠
加氯化钠 细粉、通 滤液 氨气
氨气
NH4Cl NaCl
二氧化碳
冷却、 过滤、 洗涤、 干燥
二氧化碳 (循环 使用)
纯碱(产品)
氯化铵(产品)
饱和NaCl(循环 使用)
Na+、NH4+ 、CI-、 HCO3-
(2)Na+、NH4+ 、CI-、 HCO3-四种离子可 以大量共存吗?它们可Байду номын сангаас组成集中物质?
NaCl NH4HCO3 NaHCO3 NH4Cl
(3)为什么能够得到碳酸氢钠固体呢?
溶解度数据
运用离子反应的知识解释氨碱法原理
(3)为什么能够得到碳酸氢钠固体呢?
_______________________________________
2)在析出NaHCO3的母液中加入生石灰时,发生 反应的化学方程式是_C_a_O_+_2N_H_4_C_l _→_C_a_C_l2+_2_N_H_3+_H_2。O 3)我国著名的科学家侯德榜于1940年冲破了“索 尔维法”技术封锁,并加以改进,在析出小苏打 的母液中加入食盐,使氯化铵晶体析出,析出氯 化铵的母液再通入氨气进行氨化,循环使用,这 便是举世闻名的“侯氏制碱法”。你认为侯氏制 碱法与索尔维制碱法相比,它的主要优点是: __少_用__一__个__原_料__C。aO;减少无大用途的CaCl2;增加了可作
氨碱法原理
1、原料: 氯化钠、 碳酸钙、 氨气
2、原理: NH3+CO2+H2O → NH4HCO3
NaCl+NH4HCO3 → NaHCO3↓+NH4Cl
△
2NaHCO3 → Na2CO3 + H2O + CO2↑
运用离子反应的知识解释氨碱法原理
(1)通入氨气和二氧化碳后的溶液中哪些 溶质离子大量存在?
候氏制碱法的模拟过程:
气体A的 Ⅰ 饱和A的
Ⅱ
饱和溶液加入食盐 盐水 不断通入足量气体
B
Ⅲ
Ⅳ
过滤
晶体
纯碱
悬浊液
其中A、B分别是CO2和NH3之一。已知NH3在水 中溶解度为1:700,CO2为1:1,请分析A、B分别 是什么气体?说明理由。
• 索尔维制碱法工业流程图
饱
过滤
和 食
通氨气
氨 洗涤 盐
联合制碱
• 侯氏制碱法 • •
纯碱发现史
古代,人们从草木灰中提取碳酸钾,后来又从盐 碱地和盐湖等天然资源中获取碳酸钠,但量太小。
1862年,比利时人索尔维以食盐、氨、二氧化碳 原料发明的制碱法,即索尔维制碱法。该法实现了 连续化生产,食盐利用率得到提高,使纯碱价格大 大降低,并且产品质量纯净,故被称纯碱。
合成氨工厂
联 食盐的利用率提高到96%以上 合 制 碱 综合利用了氨厂的二氧化碳和碱厂 法 的氯离子,生产出纯碱和氯化铵。
“侯氏制碱法”流程图
侯氏制碱法的主要步骤:
①向饱和的NaCI溶液中通入NH3至饱和 ,再 通入过量CO2得到固体NaHCO3 ②再将所得NaHCO3焙烧制得纯碱 ③向析出小苏打的母液中加入研细的NaCI, 还得到另一产品NH4CI固体
盐 水
水 通CO2
煅烧 碳酸氢钠
二氧化碳(循环 使用)
纯碱(产品)
滤液 加热
NH4Cl NaCl Ca(OH)2
氨(循环使用) 废液CaCl2、NaCl
煅烧 石灰石
二氧化碳
CaO
Ca(OH)2石灰乳
优 原料(食盐、石灰石)便宜 点 产品(纯碱)纯度高
氨
副产品氨、二氧化碳可循环使用
碱
步骤简单,适用于大规模生产
