1.2 燃烧热 能源
1.2燃烧热 能源

知识点1 知识点2 知识点3
解析:A项,C(s)燃烧未生成稳定氧化物CO2(g),故其反应热不能叫 燃烧热;B项,符合燃烧热的定义;C项,H2虽然转变成了稳定的氧化 物H2O(l),但由于其反应热表示的是2 mol H2 完全燃烧时的热量变 化,故不能叫燃烧热;D项,参加燃烧的H2虽然是1 mol,但其生成 H2O(g),而不是H2O(l),故它的反应热也不是H2的燃烧热。
目标导航
知识梳理
重难聚焦
典例透析
3.对“完全燃烧生成稳定的氧化物”的理解 是指单质或化合物燃烧后变为最稳定的氧化物。
完全燃烧时,下列元素对应的稳定氧化物分别 为:C→CO2,H→H2O(l),S→SO2。C→CO 不是完全燃烧,而 S→SO3 不 能一步生成,SO3 不是 S 的燃烧产物,生成的水为液态不能是气态。
C3H8
和
CO
燃烧,产生的热量比值为
2 219.9 答案:(1)C+H2O(g) CO+H2 (2)39∶5 (3)14∶5 (4)来源丰富, 燃烧产物无污染等
知识点1 知识点2 知识点3
点拨选择燃料可以从以下几个方面确定其优劣:①物质的燃烧热; ②燃料的储量;③燃料的开采、运输;④燃料储存的条件、价格;⑤ 燃料对生态环境的影响。例如:液化石油气中的丙烷,燃烧时放出 的热量大,地下石油储量丰富,开采较容易,燃烧时产生CO2、H2O, 对环境污染小;缺点是储存、运输不方便。
A.C(s)+12O2(g) CO(g) ΔH=+110.5 kJ·mol-1
B.C(s)+O2(g) CO2(g) ΔH=-393.5 kJ·mol-1
C.2H2(g)+O2(g) ΔH=-571.6 kJ·mol-1
20-21版:1.2 燃烧热 能源(步步高)

第二节 燃烧热 能源[核心素养发展目标] 1.宏观辨识与微观探析:在理解反应热和中和热的基础上,从宏观上理解辨识燃烧热的概念,能正确书写关于燃烧热的热化学方程式,学会关于燃烧热的相关计算。
2.科学态度与社会责任:在日常生活和化工生产中,形成科学合理利用化学反应中能量变化的意识和能源节约意识,认识化学在解决能源危机中的重要作用。
一、燃烧热1.燃烧热的概念(1)概念:101 kPa 时,1 mol 纯物质完全燃烧生成稳定的氧化物所放出的热量。
(2)要求:①完全燃烧。
②生成稳定的氧化物。
如 C →CO 2 H →H 2O(l)S →SO 2(g) 2.燃烧热的单位 kJ·mol-1或kJ/mol 。
3.燃烧热的意义甲烷的燃烧热为890.31 kJ·mol -1,或ΔH =-890.31 kJ·mol -1,它表示25 ℃、101 kPa 时,1 mol 甲烷完全燃烧生成CO 2和液态H 2O 时放出890.31 kJ 的热量。
4.表示燃烧热的热化学方程式的书写书写表示燃烧热的热化学方程式时,以燃烧1 mol 可燃烧物为标准来配平其余物质的化学计量数。
同时可燃物要完全燃烧且生成的氧化物状态稳定。
例如, H 2(g)+12O 2(g)===H 2O(l) ΔΗ=-285.8 kJ·mol -1(1)在101 kPa 下,1 mol 纯物质完全燃烧所放出的热量就是其燃烧热( ) (2)1 mol H 2完全燃烧生成1 mol 水蒸气时放出的热量为H 2的燃烧热( ) (3)H 2+Cl 2===2HCl(g) ΔH =-184.6 kJ·mol-1是表示H 2燃烧热的热化学方程式( )(4)燃烧热的数值与参与反应的可燃物的物质的量成正比( ) (5)所有物质的燃烧热其ΔH 均小于0( ) 答案 (1)× (2)× (3)× (4)× (5)√1.下列热化学方程式中的反应热是否为燃烧热?请说明原因? ①CH 4(g)+32O 2(g)===CO(g)+2H 2O(l) ΔH =-607.3 kJ·mol -1②H 2(g)+Cl 2(g)===2HCl(g) ΔH =-184.6 kJ·mol -1提示均不是,①中CO不是稳定氧化物,CO2才是C的稳定氧化物。
1.2 燃烧热能源
风能的利用
能源的分类
标准
分类
定义
从自然界 直接取得 一次能源 按转 的自然资 换 源 过程 一次能源 分 经过加工 二次能源 转换后获 得的能源
举例 煤、原油、天 然气等化石能 源,水能、风 能、生物质能、 太阳能等 各种石油制品、 煤气、蒸气、 电力、氢能、 沼气等
能源的分类
标准
分类
定义
举例
不限量 不 生成物的量 同 1mol反应物完全 点 反应热 燃烧时放出的热 的含义 量;不同的物质 燃烧热不同
二、能源
1、能源就是能提供能量 自然资源,包括 化石燃料(煤、石油、天然气) 、阳光、生物能、 风能、地热能、海洋(潮汐)能 等。 2、我国目前使用的主要能源是化石燃料 ,是不能 再生 3、能源是国民经济和社会发展的重要物质基础,它的开 发和利用情况,可以用来衡量一个国家或地区的经济发 展和科学技术水平 4、解决能源的办法是 开源节流 ,即开发 新的能源 和节约 现有能源 ,提高能源的 利用率 。 5、现在探索开发的新能源有 太阳能、氢能、地热能、海洋(潮汐)能、生物能 等, 新能源的主要优势是 资源丰富,可以再生,污染少 。
能源问题
2、我国的能源状况如何? (1)目前使用的主要 能源是何种能源?煤 (2)我国的能源储量 储量据世界第一 (3)我国的人均能源拥有量 人均值不高 (4)近年来我国能源的总消 费量与人均消费量情况。
à º 76.2%
Ë µ ® ç 5.1% Ì È ì » Æ ø 2.1%
Ê Ó ¯ Í 16.6%
C.1moL乙炔和2moL碳 D.淀粉和纤维素
燃烧热与反应热的关系
中和热 燃烧热 反应热
溶解热 。。。
燃烧热与中和热的区别与联系
1.2 燃烧热-能源

1mol
不确定 25℃、101kPa时, 1mol纯物质完全燃烧 生成稳定的氧化物时 所放出的热量 燃烧热为akJ·mol-1 或ΔH=-akJ·mol-1
不一定为1mol
生成水的量为1mol 在稀溶液里,酸与碱发 生中和反应生成1mol水 时所放出的热量 中和热为57.3kJ·mol-1 或ΔH=-57.3kJ·mol-1
⑵不可再生能源:经过千百万年形成的、短期内 无法恢复的能源,称之为不可再生能源。 如:煤炭、石油、天然气等。
3、按转换传递过程分
⑴一级能源:自然界中以现成形式提供的能源称为 一级能源。 如:原煤、原油、天然气、太阳能、水力、潮汐能、 地热能、生物质能、风能、海洋温差能等。 ⑵二级能源,需依靠其它能源的能量间接制取的能源称为 二级能源。 如:电能、氢能、煤气、水煤气、蒸汽、焦炭、汽油、煤 油、柴油、液化石油气、沼气能等。
【例2】 葡萄糖是人体所需能量的重要来源之一。葡萄糖 燃烧的热化学方程式为:
C6H12O6(s)+6O2(g)= 6CO2(g)+6H2O(l) ΔH=-2 800 kJ/mol
葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化 学方程式相同。计算 100 g葡萄糖在人体中完全氧化时所 产生的热量。
2.能源危机的解决方法 (1)开源节流,提高能源的利用率。调节和 优化能源结构,降低燃煤在能源结构中的 比率,节约油气资源,加大科技投入,提 高管理水平,改善开采、运输、加工等各 个环节,科学地控制燃烧反应,使燃料充 分燃烧,提高能源利用率。 (2)开发太阳能、燃料电池、风能和氢能等 最有希望的新能源。这些新能源资源丰富, 可以再生,在使用时对环境几乎没有污染, 很可能成为未来的主要能源。
⑤单位:kJ·mol-1。 ⑥文字叙述燃烧热时,用“正值”或“ΔH” 表示。例如,CH4的燃烧热为890.3kJ·mol -1,或ΔH=-890.3kJ·mol-1。
人教版化学选修四1.2燃烧热 能源课件

与这些碳完全燃烧相比,损失的热量是( C )
A.172.5 kJ
B. 1149 kJ
C.283kJ
D. 517.5 kJ
人教版化学选修四1.2燃烧热 能源课件(共22张PPT)
人教版化学选修四1.2燃烧热 能源课件(共22张PPT)
练习2
O(g) ② 稀溶液中,
人教版化学选修四1.2燃烧热 能源课件(共22张PPT)
人教版化学选修四1.2燃烧热 能源课件(共22张PPT)
练习1
在36 g 碳不完全燃烧所得气体中,CO占1/3体积,
CO2占2/3体积,且
C(s) + 1/2O2(g) = CO(g) △H = -110.5 kJ/mol
CO(g) + 1/2O2(g) = CO2(g) △H = -283 kJ/mol
2.已知:
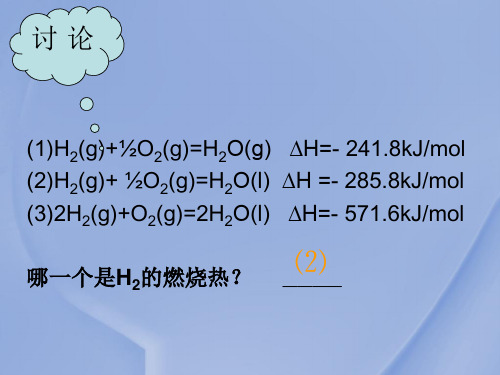
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
H2(g)+1/2O2(g)答=H:Δ2HO=(g-2)8Δ5.H8 =kJ-/2m4o1l.8
k3J.下/m列o各l 组物质的燃烧热相等的是:( B)
求A.氢碳和气一的氧燃化烧碳热。
B.1moL碳和2moL碳
C.1moL乙炔和2moL碳 D.淀粉和纤维素
4.写出下列物质燃烧热的热化学方程式: (1)CH4(g)的燃烧热为890.31KJ/mol (2)C6H6(l)的燃烧热为3267.5KJ/mol (3)金刚石的燃烧热为395.0KJ/mol
4、有关燃烧热的计算
【例1】 在 101 kPa时,1mol CH4 完全燃烧生成CO2和 液态H2O,放出 890 kJ的热量,CH4 的燃烧热为多少? 1000 L CH4(标准状况)燃烧后所产生的热量为多少?
课件14:1.2 燃烧热 能源

5.新能源开发 (1)新能源特点:资源丰富、可再生,对环境无污染或 很少污染。 (2)最有希望的新能源:太阳能、燃料电池、风能和氢 能等。 (3)我国调整和优化能源结构方向是降低燃煤,节约油气, 加快开发水电、核电和新能源。
思考:用H2作能源有哪些优点和缺点?
提示:氢能有三大优点:(1)单位质量的氢气燃烧热值 高;(2)资源丰富;(3)产物是水,无污染。缺点:储存 和运输困难。
注:研究条件: 101 kPa 可燃物用量: 1mol 反应程度:完全燃烧并生成稳定的氧化物 如:C→CO2(g) ,H→H2O (l),S→SO2(g), N→N2(g), Cl→HCl(g) 没有特别说明燃烧一般是在氧气中燃烧 燃烧热: ∆H<0
例如,H2的燃烧热为285.8 kJ·mol-1,指的是25℃、101 kPa 时,1 mol H2在O2中完全燃烧生成液态水时所放出的热量, 而不是在Cl2中。
第二节 燃烧热 能源
由于反应的情况不同,反应热可分为燃烧热、中和热等,其中 以燃烧热的实际应用最广泛。
思考 ? 我们知道物质燃烧都会放出热量,那么不同物质燃烧放出的热 量一样吗?是不是燃烧所放出的热量就叫燃烧热呢?
一. 燃烧热
1. 定义: 101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时 所放出的热量。 2. 单位:kJ·mol-1。 燃烧热属反应热的一种,可利用仪器由实验测得。
4.一定量可燃物完全燃烧时放出的热量 Q放=n(可燃物) × |ΔH|
5. 文字叙述燃烧热时,用“正值”或“ΔH”表示。 例如,CH4的燃烧热为890.3 kJ·mol-1, 或ΔH=-890.3 kJ·mol-1。
【例】由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ, 该反应的热化学方程式为 _H__2_(g_)_+____O_2_(g_)_=_=_H__2_O_(_g_),__Δ__H_=__-__2_4_1_._8_k_J_·_m_o_l_-_1_____ 。 若1g水蒸气转化为液态水放热2.444kJ,则氢气的燃烧热为 _2_8_5_.8__ kJ·mol-1 。
1.2_燃烧热__能源

【例3】一定质量的无水乙醇完全燃烧时放出的热量为Q,它生 成的CO2用过量饱和石灰水完全吸收可得100gCaCO3沉淀。 则完全燃烧1mol无水乙醇时放出的热量C是( )
A. 0.5Q
B. Q
C. 2Q
D. 5Q
CO2 ~ CaCO3
C2H5OH ~ 2CO2
n(CO2)=n(CaCO3)=100g÷100g/mol=1mol
的氧
★注意事项★:
(1)条件:
;(2)可燃物的用量:
;
(3)生成
的氧化物:
如:C 完全燃烧应生成
,S生成
,
对于H2,若在25℃时, H2燃烧生成 。
(4)单位:
;
(5)书写燃烧热的热化学方程式时,以
可燃物为配平标准,
【练习1】 25℃时,H2的燃烧热为285.8 kJ / mol所表示的含义是 ? 25℃、101KPa时,1mol H2 完全燃烧生成液态水时放出的
△H/ (kJ·mol-1)
-393.5
-395.0
-283.0
-285.8 -890.3 -726.5
名称
乙烷 乙烯 乙炔 乙醇 丙烷
苯
化学式
△H/ (kJ·mol-1)
C2H6(g) C2H4(g) C2H2(g) C2H5OH(l) C3H8(g) C6H6(l)
-1559.8 -1411.0 -1299.6 -1366.8 -2219.9 -3267.6
化石燃料:煤、石油、天然气
解决的办法 :开 节 ;即开发新能源,节约现有能源, 提高能源的利用率。
措施:科学地控制燃烧反应,使燃料 利用率。
燃烧,提高能源的
新能源:太阳能、氢能、风能、地热能、海洋能和生物能。
教学设计3:1.2燃烧热 能源

第二节燃烧热能源教学目标:①理解并掌握燃烧热的涵义,能正确书写燃烧反应的燃烧热的热化学方程式并会计算燃烧热②通过查阅资料知道如何选择能源③知道并体会节约能源,提高能源利用率,开发新能源的实际意义④通过查阅资料,能认识能源是人类生存和发展的重要基础,了解化学在解决能源危机中的重要作用教学难点:燃烧热的概念及计算教学方法:阅读、边讲边练教学过程:[复习引入]:①什么叫反应热?其符号和单位是什么?②什么叫热化学方程式?热化学方程式书写时应注意什么?[过渡]:由于反应的情况不同,反应热有多种形式。
如燃烧热、中和热、溶解热等。
本节课我们就来学习实际应用较广的反应热——燃烧热[板书]:一、燃烧热[阅读]:指导学生重点阅读燃烧热的定义,并板书1、定义:25℃101Kpa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量,单位为kJ/mol[练习]:判断下列说法是否正确?若不正确,请说明理由.(建议教师先不分析燃烧热的讲义,做完此练习后让学生体会,再归纳小结)①H2(g)+1/2O2(g)=H2O(g) △H= —241.8KJ/mol ∴H2的燃烧热为241.8KJ/mol②H2(g) +1/2O2(g)=H2O(l) △H=—285.8KJ/mol H2的燃烧热为285.8KJ/mol③2H2(g) +O2(g)=2H2O(l) △H= —571.6KJ/mol ∴H2的燃烧热为571.6KJ/mol④C(s) +1/2O2(g)=CO(g) △H= -110.5KJ/mol ∴石墨的燃烧热为110.5 KJ/mol (以上在学生回答的基础上,由其他学生加以点评,最后归纳总结掌握燃烧热的定义应注意的问题)[总结并板书]:2 注意点:25℃101Kpa;1mol纯物质;完全燃烧;稳定的化合物;放出的热量△H〈0;单位:kJ/mol[思考]:稳定的化合物中稳定的含义。
并举例说明:[小结]:状态稳定或生成的化合物不能再燃烧。
学案3:1.2 燃烧热 能源

第二节燃烧热能源课标要求1.通过查阅资料说明能源是人类生存和发展的重要基础,了解化学在解决能源危机中的重要作用。
2.知道节约能源,提高能量利用率的实际意义。
课标解读1. 理解燃烧热的概念,并掌握有关燃烧热的计算。
2.了解能源的重要性及化学在解决能源危机的重要作用。
3.了解如何节约能源,并提高能源的利用率。
燃烧热1.定义101 kPa时,1 mol纯物质完全燃烧生成稳定氧化物时所放出的热量。
单位:kJ/mol,ΔH<0。
2.意义例如:C2H2的燃烧热为1 299.6 kJ/mol,表示在101 kPa时,1 molC2H2完全燃烧生成CO2和H2O(l)时放出1 299.6 kJ的热量。
思考交流1.(1)可燃物的物质的量发生变化,其燃烧热变吗?(2)如何配平燃烧热的热化学方程式?【提示】(1)燃烧热指1 mol可燃物燃烧放出的热量,与可燃物的物质的量无关。
(2)先把可燃物的系数定为1,再配平其他物质。
能源能提供能量的资源,它包括化石燃料、阳光、风力、流水、潮汐以及柴草等。
1.分类(1)化石燃料包括煤、石油、天然气,它们为非再生能源。
(2)新能源主要有太阳能、氢能、风能、地热能、海洋能和生物质能等,是可再生能源。
2.地位能源是国民经济和社会发展的重要物质基础,它的开发和利用情况可以衡量一个国家或地区的经济发展和科学技术水平。
3.解决能源危机的方法开发新能源,节约现有的能源,提高能源的利用率。
思考交流2.怎样能使燃料充分燃烧?【提示】 ①要有足够的空气;②燃料与空气有足够大的接触面积。
燃烧热的理解及计算【问题导思】①燃烧热中生成稳定的氧化物指什么?【提示】 指单质或化合物燃烧后生成的最稳定的氧化物。
②燃烧热如何表示?【提示】 a .ΔH =-Q kJ/mol b .燃烧热为Q kJ/mol 。
③如何计算可燃物的燃烧热? 【提示】 燃烧热ΔH =-QnkJ/mol 。
1.对燃烧热的理解(1)反应条件:25 ℃和101 kPa(书中给出的燃烧热数值均为此条件下测得)。
课件3:1.2 燃烧热 能源

气污染,住宅环境、居室空气的污染则更严重。
2.推广使用天然气(相对于管道煤气和液化气)为 什么是城市燃气的发展方向?
管道煤气是一种清洁燃料,然而这是相对于住宅、 居室环境而言的,从城市大环境看,并没有改善城 市大气的污染程度。原因很简单,制造煤气要燃煤, 使用煤气没有降低城市的煤炭消耗量,原来一家一 户煤球炉的废气仅仅变成由数家煤气厂排放而已。 液化气是发热量最高的优质清洁燃料,但液化气使 用不便,且要消耗宝贵的石油资源,天然气则是一 种既有管道煤气的方便,又有液化气无毒、发热量 高的优点且不易爆的燃料,所以,推广使用天然气 是城市燃气产业的发展方向。
2.葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热 化学方程式为: C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l)ΔH=-2 800 kJ/mol 葡萄糖在人体组织中氧化的热化学方程式与它 燃烧的热化学方程式相同。计算100 g葡萄糖在人体中完全氧 化时所产生的热量。
解析:根据题意,葡萄糖的燃烧热为2 800 kJ/mol,100 g葡萄糖 的物质的量为: n(C6H12O6)==0.556 mol 1 mol C6H12O6完全燃烧放出2 800 kJ的热量,0.556 mol C6H12O6 完全燃烧放出的热量为: 0.556 mol×2 800 kJ/mol=1 557 kJ 答案:100 g葡萄糖在人体中完全氧化时产生1 557 kJ的热量。
物。
③燃烧物的物质的量:1 mol ④研究内容:放出的热量。(ΔH<0,单位 kJ/mol) ⑤在未有特别说明的情况下,外界压强一般指 25℃ ,101 kPa.所谓完全燃烧也是完全氧化, 它是指物质中的下列元素完全转变成对应的稳 定物
课件12:1.2 燃烧热 能源

教材习题答案 1. 燃烧热数据对生产、生活有什么实际意义?
提示:在生产和生活中,可以根据燃烧热的数 据选择燃料。如甲烷、乙烷、丙烷、甲醇、 乙醇、氢气的燃烧热值均很高,它们是良好 的燃料。
2.石油资源总有一天会枯竭,现在就应该寻求相应 的措施。目前已使用甲醇、乙醇作为汽油的替代品, 这样做的好处是什么?
解决能源危机的办法是开源节流,即 开发新能源和节约现有的能源,提高能 源的利用率。
4.新能源的开发 1)新能源包括太阳能、生物能、风能、氢能、 地热能、海洋能。
太阳能草坪灯
秸秆沼气罐、 沼气炉
风车发电
液氢燃料飞机
西藏地热发电站
波浪发电装置
2)新能源的主要优势是:资源丰富,可以再生,为 再生性能源,对环境没有污染或污染少,很可能成 为未来的主要资源。
提示:公交车的个人耗油和排出污染物量为私人 车的20%,从经济和环保角度看,发展公共交通 更为合理。
本节内容结束
更多精彩内容请登录:
3.用氢气作燃料有什么优点?在当今的技术条 件下有什么问题?它的发展前景如何?
提示:氢气是最轻的燃料,而且单位质量的燃烧热值最高, 因此它是优异的火箭燃料,再加上无污染,氢气自然也是 运输工具的优秀燃料。在当前,有氢气作燃料尚有困难, 意识氢气易燃、易爆,极易泄露,不便于贮存、运输,二 是制造氢气尚需电力或别的化石燃料,成本高。如果用太 阳能和水廉价地制取氢气的技术能够突破,则氢气能源将 具有广阔的发展前景。
4.科学家发现海底存在大量水合甲烷,请 你谈谈甲烷燃料开发的前景。
提示:甲烷是一种优质的燃料,它存在于天然气中。 已探明的天然气矿藏有限,这是人们所担心的。 现已发现海底存在大量水合甲烷,其储量约是已 探明的化石燃料的2倍。如果找到了适用的开采 技术,将大大缓解能源危机。
课件13:1.2 燃烧热 能源

25 ℃、101 kPa时, 1 mol 纯物质完全燃烧生成 稳定 氧化
物时所放出的热量。 2.单位及符号
单位为 kJ·mol-1 ,ΔH < 0。
3.意义 25 ℃、101 kPa时甲烷的燃烧热ΔH=-890.31 kJ/mol, 热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.31 kJ/mol。 说明:1 mol 甲烷完全燃烧生成CO2(g)和H2O(l)时放出 890.31 kJ的热量。
(1)H2的燃烧热为________,C3H8的燃烧热为 _______________________。 (2)1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量 为________。 (3)现有H2和C3H8的混合气体共5 mol,完全燃烧时放热3 847 kJ,则在混合气体中H2和C3H8的体积比是 ________________________________。
第二节 燃烧热 能源
由于反应的情况不同,反应热可分为多种,例如燃烧热、 中和热、溶解热等,其中以跟燃料品质相关的燃烧热实 际应用较广。
学习目标 1. 掌握燃烧热的概念,掌握有关燃烧热的计算。 2. 了解资源、能源是当今社会的重要热点问题。 3. 常识性了解使用化石燃料的利弊及新能源的开发。
一. 燃 烧 热
教材整理2 燃烧热的热化学方程式 已知25 ℃、101 kPa时下列物质的燃烧热:
序号 名称
①
苯
② 一氧化碳
③
乙醇
④
乙烯
⑤
乙炔
⑥
丙烷
化学式 C6H6(l) CO(g) C2H5OH(l) C2H4(g) C2H2(g) C3H8(g)
1.2燃烧热 能源

在相同条件下,燃烧时对大气污染程度最小 的 A 燃料是( ) A. 液化气 B. 煤油 C. 煤饼 D. 木柴
关于用水制取二级能源H2,以下研究方向中 不正确的是(AC ) A. 构成水的氢和氧是可以燃烧的物质,因此, 可研究在水不分解的情况下,使氢成为二级能 源 B. 设法将太阳能聚焦,产生高温,使水分解 产生H2 C. 寻找高效催化剂,使水分解产生H2,同时 释放能量 D. 寻找特殊的化学物质,用于开发廉价能源, 以分解水制取H2
二、能源
㈡分类: 3、按转换传递过程分 ⑴一级能源:自然界中以现成形式提供的能源称为 一级能源。 如:原煤、原油、天然气、太阳能、水力、潮汐能、 地热能、生物质能、风能、海洋温差能等。 ⑵二级能源,需依靠其它能源的能量间接制取的能源 称为二级能源。 如:电能、氢能、煤气、水煤气、蒸汽、焦炭、汽油、 煤油、柴油、液化石油气、沼气能等。
【补充习题】 一定质量的无水乙醇完全燃烧时放出的热 量为Q,它生成的CO2用过量饱和石灰水 完全吸收可得100gCaCO3沉淀。则完全燃 烧1mol无水乙醇时放出的热量是( C ) A. 0.5Q B. Q C. 2Q D. 5Q
我国发射的“神舟五号”载人飞船的燃料是铝粉与 高氯酸铵的混合物。点燃时,铝粉氧化放热引发高 氯酸铵反应2NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑ △H<0 。关于该反应叙述不正确的是 ( ) D
∴在表示燃烧热的热化学方程式中常出现化学计量 数为分数的情况
例:表示H2燃烧热的热化学方程式 H2(g)+1/2O2(g)=H2O(l) △H=-285.8 kJ/mol
一、燃烧热
【概念要点 】
③可燃物完全燃烧生成稳定的氧化物 如C → CO2、 S → SO2、H → H2O(l) ④燃烧热属于反应热,也用△H表示,单位也为 kJ/mol 燃烧热通常可利用仪器通过实验测得
1.2 燃烧热 能源

燃烧热 能源
燃烧热 能源
一、燃烧热 1.定义:在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放
出的热量,叫做该物质的燃烧热。
2.理解:
①燃烧热属于反应热,也用ΔH表示,单位也为 kJ/mol。
叙述时直接读出“数值” 如甲烷的燃烧热为890.31kJ/mol
也可用ΔH表示,如ΔH=-890.31kJ/mol
燃烧热 能源
4.研究燃烧热的意义
通过对燃烧热的学习,可以帮助我们更充分地利用能源。
燃烧热 能源
燃烧热 能源
燃烧热 能源
问题导学
化石燃料(煤、石油、天然气) 、阳光、 阅读课文,讨论下列问题: 生物能、风能、地热能、海洋(潮汐)能 能量 的自然资源,包括___________________等。 1.能源就是能提供_______ 再生的 化石燃料 2.我国目前使用的主要能源是________________ ,是不能___________ 。 开源节流 ,即开发_______ 新能源 和节约__________ 现有能源 , 3.解决能源的办法是___________ 利用率 提高能源的________________ 。
燃烧热与中和热的区别与联系 相 同 点 燃烧热 中和热
能量变化 ΔH 反应物的量
放热反应 ΔH<0 , 单位 kJ/mol
1mol可燃物
H2O 1mol
酸碱中和生成1molH2O时放 出的热量, 约为57.3kJ/mol
不 生成物的量 同 1mol反应物完全燃烧时放 反应热 点 出的热量;不同的物质燃烧 的含义 热不同
太阳能、氢能、地热能、海洋(潮汐)能、生物能 4.现在探索开发的新能源有_____________________________________ 资源丰富,可以再生,污染少 等,新能源的主要优势是______________________________ 。
课件6:1.2燃烧热 能源

一氧化碳
烧
热
甲烷
甲醇
化学式 C(s) C(s) CO(g) CH4(g) CH3OH(l)
△H/(kJ·mol-1) -393.5 -395.0 -283.0 -890.3 -726.5
思考与交流
你认为应根据什么标准来选择燃料?
思考与交流 应根据什么标准来选择燃料?
物质的燃烧热 燃料的储量 燃料的开采、运输
将太阳能转化为化学能而贮存在生物质内部的能量。 煤、石油和天然气等化石能源也是由生物质能转变而来的。 生物质能是可再生能源,
绿色能源 (也称清洁能源)
狭义的绿色能源:是指可再生能源,如水能、生 物能、太阳能、风能、地热能和海洋能。这些能 源消耗之后可以恢复补充,很少产生污染。
广义的绿色能源:则包括在能源的生产、及其消 费过程中,选用对生态环境低污染或无污染的能 源,如天然气、清洁煤(将煤通过化学反应转变 成煤气或“煤”油,通过高新技术严密控制的燃 烧转变成电力)和核能等。
燃料储存的条件、价格 燃料对生态环境的影响
例:丙烷
燃烧热值高 石油中储量丰富 开采容易 燃烧时污染小 储存、运输不方便
二、能源 ㈠概念: 凡是能提供某种形式能量的物质。
能源分类
按转换过程分 按利用历史分
按性质分
一级 能源
常规 能源
可再生能源 风能、水能、 不可再生能源 煤炭、石油、天然气等
太阳能、
【练习2】 分析以下几个热化学方程式,表示25℃时 燃烧热的是( BE ) A.C(s)+O2(g)=CO(g); ΔH= -110.5 kJ/mol B.C(s)+O2(g)=CO2(g); ΔH=-393.5 kJ/mol C.2H2(g)+O2(g)=2H2O(l); ΔH=-571.6 kJ/mol D.H2(g)+1/2O2(g)=H2O(g);ΔH=-241.8 kJ/mol E. H2(g)+1/2O2(g)=H2O(l);ΔH=-285.8 kJ/mol
化学1.2燃烧热能源课件用2
终止 温度 t2/℃
温度差 (t2-t1)/℃
1 20.2 20.2 20.2 23.6 3.4
2 20.2 20.1 20.15 23.5 3.35
3 20.2 20.3 20.25 23.6 3.35
[数据处理]
计算公式:
ΔH=-(50
g+50
g)×4.18 J/(g/℃)×(t终-t始)= n mol
用50 mL 0.50mol·L-1的盐酸与50 mL 0.55 mol·L-1的氢氧化钠溶液在如图所 示的装置中进行中和反应,通过测定反应 过程中所放出的热量可计算中和热.回答 下列问题:
[探究活动] 1.在 500 mL 大烧杯底部垫上泡沫塑料(或纸条), 使放入的 100 mL 的小烧杯杯口与大烧杯杯口相平。然 后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧 杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个 小孔,正好使温度计和环形玻璃搅拌棒通过,如图所示。
答案:C
2.(2009四川理综)25℃,101kPa时,强酸与 强碱的稀溶液发生中和反应的中和热为 57.3kJ/mol,辛烷的燃烧热为5518kJ/mol. 下列热化学方程式书写正确的是( )
D.2C8H18(g)+25O2(g)===16CO2(g)+ 18H2O(l);ΔH=-5518kJ/mol
1.我国“神七”已于2008年10月成功发射 升空,中国航天员实现了首次太空行 走.发射“神七”的一级火箭可用肼 (N2H4)作为火箭发动机的燃料,NO2为氧 化剂,反应生成氮气和水蒸气.已知:
(1)N2(g)+2O2(g)===2NO2(g) ΔH=+ 67.7 kJ/mol
(2)N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ/mol
21-22版:1.2 燃烧热 能源(步步高)

1.阅读教材,并判断下列关于“能源”的叙述是否正确。
(1)能源是能提供某种形式能量的资源,它是人类取得能量的来源( √ )
(2)能源包括已开采出来的可供使用的自然资源与经过加工或转移的能源
(√)
(3)能源可分为一次能源(如太阳能、地热能等)和二次能源(如电能等)
(√) (4)化石燃料包括煤、石油、天然气,按其来源它们属于一次能源( √ )
(3)现有H2和C3H8的混合气体共5 mol,完全燃烧时放热3 847 kJ,则在混 合气体中H2和C3H8的体积之比是 3∶1 。
解析 设H2、C3H8的物质的量分别为n1、n2,则有 n1+n2=5 mol n1×285.8 kJ·mol-1+n2×2 220 kJ·mol-1=3 847 kJ 解得 n1≈145 mol,n2≈54 mol,在相同 p、T 时,V(H2)∶V(C3H8)=n(H2) ∶n(C3H8)=3∶1。
1 2 3 4 5 6 7 8 9 10 11 12 13
解析 解答本题的关键:
1 2 3 4 5 6 7 8 9 10 11 12 13
2.25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是ΔH=
-393.5 kJ·mol-1、ΔH=-285.8 kJ·mol-1、ΔH=-890.31 kJ·mol-1、
思维聚焦
关于燃烧热计算的方法
由标准燃烧热定义可知:25 ℃、101 kPa时,可燃物完全燃烧产生的热量
=一下可求燃物物质的的物标质准的燃量烧×热其:标Δ准H燃=烧-热n可,Q燃即放 物Q放
=n(可燃物)×|ΔH|;或变换 。此公式中的ΔH是指物质
的标准燃烧热,而不是指一般反应的反应热。
返回
二、能源
1.2燃烧热和能源

1.2燃烧热和能源?我们知道物质燃烧都会放出热量,那么是不是物质燃烧放出的热量就叫燃烧热呢?一.燃烧热研究的条件燃烧物的量在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
反应程度C -- CO2 (g) S C SO2 (g) HC H2O(l)反应程度单位为kJ/mol燃烧热通常可利用仪器由实验测得。
强调:H2(g)+ O2(g)=H2O(l) H =- 285.8kJ/mol①燃烧热为放出热量,△H0。
(在叙述时用正值描述)H2的燃烧热为285.8kJ/mol,表示在101kPa时,1molH2完全燃烧放出285.8kJ的热量表示为:△H =-285.8kJ/mol ②燃烧热规定了可燃物的物质的量为1mol.讨论(1)H2(g)+O2(g)=H2O(g) H=- 241.8kJ/mol (2)H2(g)+O2(g)=H2O(l) H =- 285.8kJ/mol (3)2H2(g)+O2(g)=2H2O(l) H=- 571.6kJ/mol哪一个是H2的燃烧热?――――⑵二、燃烧热的计算及应用【练习1】H2的燃烧热为285.8 kJ / mol所表示的含义是?【练习2】已知:2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) △H=一__kJ/mol C8H18的燃烧热是多少? △H=-5518kJ/mol 【练习3】分析以下几个热化学方程式,表示25℃时燃烧热的是( BE)A. C(s)+O2(g)=CO(g);B. C(s)+O2(g)=CO2(g);C. 2H2(g)+O2 (g)=2H2O(l);D. H2(g)+1/2O2 (g)=H2O(g);E. H2(g)+1/2O2(g)=H2O(l);ΔH= - 110.5 kJ/mol ΔH= - 393.5 kJ/mol ΔH= - 571.6 kJ/mol ΔH= - 241.8 kJ/mol ΔH=-285.8kJ/mol【练习4】已知下列两个热化学方程式:2H2(g)+O2(g) =2H2O(l) △H=-571.6 kJ mol-1 C3H8(g)+5O2(g) =3CO2(g)+4 H2O(l) △H=-2 220 kJ mol-1 285.8 kJ mol-1 2 220 kJ mol-1 (1)H2的燃烧热为____________,C3H8的燃烧热为____________ (2)2gH2和2mol C3H8组成的混合气体完全燃烧放出的热量为____________4725.8 kJ燃烧热和中和热的区别与联系相同能量变化点ΔH 反应物的量燃烧热中和热放热反应ΔH0 , 单位kJ/mol1mol可燃物不限1mol H2O 稀酸稀碱中和生成1molH2O 时放出的热量,不同的反应物的中和热大致相同生成物的不不限量量同1mol纯物质完全燃点反应热的烧生成稳定氧化物时放出的热量;不同含义的物质燃烧热不同【练习5】在101 kPa时,1mol CH4 完全燃烧生成CO2和液态H2O,放出890 kJ的热量,CH4 的燃烧热为多少?1000 L CH4 (标准状况)燃烧后所产生的热量为多少?根据题意,在101 kPa时,1mol CH4 完全燃烧的热化学方程式为:CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH=-890 kJ/mol 即CH4的燃烧热为890 kJ/mol。
1.2 燃烧热 能源

第二节 燃烧热 能源1.25℃、101 kPa 时,1 mol 纯物质完全燃烧生成稳定的氧化物所放出的热量叫做该物质的燃烧热,单位是“kJ/mol ”。
2.稳定氧化物的含义是指:①生成的氧化物不能再燃烧,②该氧化物在25℃、101 kPa 时为稳定聚集状态。
如C →CO 2(g)、H →H 2O(l)、S →SO 2(g)。
3.文字描述可燃物的燃烧热时用“正值”,如甲烷的燃烧热为890 kJ/mol 。
4.太阳能、风能、地热能、核能、氢能、生物质能属于新能源。
燃 烧 热1.概念101 kPa 时,1_mol 纯物质完全燃烧生成稳定氧化物时所放出的热量。
2.单位燃烧热属于反应热的一种,单位为“kJ/mol ”。
3.意义25℃时,甲烷的燃烧热为890.31 kJ/mol ,热化学方程式为:CH 4(g)+2O 2(g)===CO 2(g)+2H 2O(l) ΔH =-890.31 kJ/mol 。
表示1_mol 甲烷完全燃烧生成CO 2(g)和H 2O(l)时放出890.31 kJ 的热量。
[师生互动·解疑难](1)对燃烧热的理解:①外界条件:25℃、101 kPa ; ②可燃物用量:1 mol ;③燃烧结果:C →CO 2(g)、H →H 2O(l)、S →SO 2(g);④表示方法:燃烧热是反应热的一种,ΔH 均小于零,文字叙述燃烧热时用“正值”或ΔH 表示,如甲烷的燃烧热为890.31 kJ/mol 或ΔH =-890.31 kJ/mol 。
(2)对表示燃烧热的热化学方程式的理解:可燃物的化学计量数为1,其他物质的化学计量数可以是分数。
如:C 8H 18(l)+252O 2(g)===8CO 2(g)+9H 2O(l)ΔH =-5518 kJ/mol 。
(3)燃烧热和中和热的比较:燃烧热中和热相同点能量变化放热反应ΔH及其单位ΔH<0,单位均为“kJ/mol”不同点反应物的量可燃物为1 mol 不一定为1 mol生成物的量不确定生成的水为1 mol含义101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量在稀溶液里,酸与碱发生中和反应生成1 mol水时所放出的热量1.判断下列描述的正误(正确的打“√”,错误的打“×”)。
课件7:1.2燃烧热 能源

1.理解燃烧热的定义及燃烧热的化学方程式的书写。 2.了解我国的能源结构和新能源的开发利用。
一、燃烧热
1.定义:__1_0_1__k_P_a_时,_1__m_o_l_纯物质完全燃烧生成_稳__定__氧__化__物__ 时所放出的热量。单位:_k_J_·_m_o_l_-_1_。 2.意义:H2的燃烧热ΔH=-285.8 kJ·mol-1所表示的含义: _2_5_℃__、__1_0_1__k_P_a_时,1 mol H2完全燃烧生成液态水时所放出的 热量为_2_8_5_._8__k_J_。
【知识链接】 [1]海洋能 依附在海水中的可再生能源,海洋通过各种物理过程接收、储 存和散发能量,主要包括温差能、潮汐能、波浪能、潮流能、 海流能、盐差能等。潮汐能和潮流能源自月球、太阳和其他 星球的引力,其他海洋能均源自太阳辐射。
[2]生物质能 太阳能以化学能形式贮存在生物质中的能量形式,即以生物质 为载体的能量。它直接或间接地来源于绿色植物的光合作用, 可转化为常规的固态、液态和气态燃料,取之不尽、用之不竭, 是一种可再生能源。生物质能的原始能量来源于太阳。
ΔH=-1 367.0 kJ·mol-1(燃烧热) B.NaOH(aq)+HCl(aq)====NaCl(aq)+H2O(l)
ΔH=+57.3 kJ·mol-1(中和热)
C.S(s)+O2(g)==== SO2(g) ΔH=-269.8 kJ·mol-1(反应热)
D.2NO2====O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
一次能源经 过加工转换 后获得的能 源
举例 煤、原油、天然气等化 石能源,水能、风能、 生物质能、太阳能等
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节 燃烧热 能源[目标要求] 1.理解燃烧热的概念。
2.了解化学在解决能源危机中的重要作用,知道节约能源、提高能量利用率的实际意义。
一、燃烧热1.概念 101_kPa 时,1_mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,单位kJ·mol -1。
2.燃烧热与中和热的重要区别(1)反应环境的区别:燃烧热必须是燃烧反应而且是完全燃烧,有O 2参加;而中和热是稀溶液中的酸碱中和反应。
(2)反应实质不同:燃烧反应是氧化还原反应;中和反应是复分解反应。
(3)规定物质不同:燃烧热是1 mol 纯物质被燃烧;中和热是生成1_mol_H 2O 。
二、能源1.能源是能提供能量的资源,它包括化石燃料(煤、石油、天然气)、阳光、风力、流水、潮汐以及柴草等。
2.解决能源危机的方法 (1)科学地控制燃烧反应,使燃料充分燃烧,提高能源的使用效率。
(2)寻找新的能源,现正探索的新能源有太阳能、氢能、风能、地热能、海洋能和生物质能等,它们资源丰富,可以再生,没有污染或很少有污染。
知识点一 燃烧热1.下列关于燃烧热的说法中正确的是( )A .1 mol 物质燃烧所放出的热量B .常温下,可燃物燃烧放出的热量C .在25℃、1.01×105 Pa 时,1 mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量D .燃烧热随化学方程式前的化学计量数的改变而改变2.以下几个热化学方程式,能表示有关物质燃烧时的燃烧热的热化学方程式是( )A .C(s)+12O 2(g)===CO(g) ΔH =+110.5 kJ·mol -1 B .C(s)+O 2(g)===CO 2(g) ΔH =-393.5 kJ·mol -1 C .2H 2(g)+O 2(g)===2H 2O(l) ΔH =-571.6 kJ·mol -1D .H 2(g)+12O 2(g)===H 2O(g) ΔH =-241.8 kJ·mol -1 知识点二 能源3.关于能源,以下说法中不正确的是( )A.煤、石油、天然气等燃料的最初来源都可追溯到太阳能B .柴草燃烧时释放的能量是生物能C .核能和地热能来自地球自身D .潮汐能来源于月球引力做功4.下列叙述正确的是( )A .水能是二次能源B .电能是二次能源C .天然气是可再生能源D .水煤气是可再生能源练基础落实1.下列热化学方程式中ΔH 的数值表示可燃物燃烧热的是( )A .CO(g)+12O 2(g)===CO 2(g) ΔH =-283 kJ·mol -1 B .CH 4(g)+2O 2(g)===CO 2(g)+2H 2O(g) ΔH =-802.3 kJ·mol -1 C .2H 2(g)+O 2(g)===2H 2O(l) ΔH =-571.6 kJ·mol -1 D .H 2(g)+Cl 2(g)===2HCl(g) ΔH =-184.6 kJ·mol -1 2.已知H 2的燃烧热为-285.8 kJ·mol -1,CO 的燃烧热为-282.8 kJ·mol -1;现有H 2和CO 组成的混合气体5.6 L(标准状况),经充分燃烧后,放出总热量为71.15 kJ ,并生成液态水。
下列说法正确的是( )A .CO 燃烧的热化学方程式为2CO(g)+O 2(g)===2CO 2(g) ΔH =-282.8 kJ·mol -1 B .H 2燃烧的热化学方程式为2H 2(g)+O 2(g)===2H 2O(g) ΔH =-571.6 kJ·mol -1 C .燃烧前混合气体中CO 的体积分数为60%D .燃烧后的产物全部与足量的过氧化钠作用可产生0.125 mol O 23.根据以下3个热化学方程式2H 2S(g)+3O 2(g)===2SO 2(g)+2H 2O(l) ΔH =-Q 1 kJ·mol -1 2H 2S(g)+O 2(g)===2S(s)+2H 2O(l) ΔH =-Q2 kJ·mol -1 2H 2S(g)+O 2(g)===2S(s)+2H 2O(g) ΔH =-Q 3kJ·mol -1 判断Q 1、Q 2、Q 3三者关系正确的是( )A.Q1>Q2>Q3B.Q1>Q3>Q2C.Q3>Q2>Q1 D.Q2>Q1>Q3 4.已知化学反应:C(s)+1/2O2(g)===CO(g)ΔH1<0CO(g)+1/2O2(g)===CO2(g)ΔH2<0C(s)+O2(g)===CO2(g)ΔH3<0;下列说法正确的是(相同条件下)()A.56 g CO和32 g O2所具有的总能量小于88 g CO2所具有的总能量B.碳的燃烧热是ΔH3 C.ΔH1<ΔH3D.28 g CO的总能量比44 g CO2的总能量高5.下列热化学方程式书写正确的是(ΔH的绝对值均正确)()A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热)B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热)C.S(s)+O2(g)===SO2(g)ΔH=-296.8 kJ·mol-1(反应热)D.2NO2===O2+2NOΔH=+116.2 kJ·mol-1(反应热)6.一些烷烃的燃烧热如下表:化合物ΔH/(kJ·mol-1) 化合物ΔH/(kJ·mol-1)甲烷-891.0 正丁烷-2 878.0乙烷-1 560.8 异丁烷-2 869.6丙烷-2 221.5 2-甲基丁烷-3 531.3 下列说法正确的是()A.正戊烷的燃烧热大约是-3 540 kJ·mol-1B.热稳定性:正丁烷>异丁烷C.乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g)ΔH=-1 560.8 kJ·mol-1D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多练方法技巧燃烧热的热化学方程式的书写方法7.(1)在101 kPa时,H2在1 mol O2中完全燃烧生成2 mol液态水,放出571.6 kJ的热量,H2的燃烧热为________,表示H2燃烧热的热化学方程式为__________________________。
(2)1.00 L 1.00 mol·L-1硫酸与2.00L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ的热量,该反应的中和热为____________,表示其中和热的热化学方程式为__________________。
8.0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649. 5 kJ热量,其热化学方程式为_____________________________________________;又已知H2O(l)===H2O(g)ΔH=+44 kJ·mol-1,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是________kJ 。
练综合拓展9.城市使用的燃料,现大多用煤气、液化石油气。
煤气的主要成分是一氧化碳和氢气的混合气体,它由煤炭与水(蒸气)反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学方程式:________________________________________________________________________ ________________________________________________________________________。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为C 3H 8(g)+5O 2(g)===3CO 2(g)+4H 2O(l) ΔH =-2 220.0 kJ·mol -1,已知CO 气体燃烧的热化学方程式为CO(g)+12O 2(g)===CO 2(g) ΔH =-282.57 kJ·mol -1,则相同物质的量的C 3H 8和CO 燃烧产生的热量比值约为______________。
(3)已知氢气燃烧的热化学方程式为2H 2(g)+O 2(g)===2H 2O(l) ΔH =-571.6 kJ·mol -1,则相同质量的氢气和丙烷燃烧,产生的热量的比值约为______________。
(4)氢气是未来的能源,除产生的热量大之外,还具有的优点是________________________________________________________________________。
10.目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民开始使用东海天然气作为民用燃料,管道煤气的主要成分是CO 、H 2和少量烃类,天然气的主要成分是CH 4,它们的燃烧反应如下:2CO +O 2=====点燃2CO 2 2H 2+O 2=====点燃2H 2O CH 4+2O 2――→点燃CO 2+2H 2O根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是__________,因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是________________________________________________________________________ (填“增大”或“减小”)进风口,如不作改进可能产生的不良结果是_______________。
管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:乙烷 丙烷 丁烷 熔点(℃)-183.3 -189.7 -138.4 沸点(℃) -88.6 -42.1 -0.5 试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是________________________________________________________________________________________________________________________________________________。
