GSP认证质量领导小组的质量管理职责
新版GSP认证的最新要求

(一)批发公司一、管理职责:1、质量管理领导小组由公司自定建立,不作强迫性要求。
2、质量管理小组因负责公司平时质量管理工作,新GSP 中还要求负责录入质量管理基础数据,故需建立。
3、质量查收组是公司物流管理环节之一,需建立。
4、药品保养组(员)职能有变化,主假如对储藏条件、储藏环境进行监测并管理。
5、质量管理文件:对操作程序提出了更高的要求,根绝天下文章一大抄现象,要求结共计算机软件编写,能让一个不熟习的人员按操作程序也能达成相应的工作(或操作)。
二、人员与培训1、增添计算机信息管理员岗位,负责公司药质量量信息安全。
2、不再建立计量员岗位。
3、突出质量管理机构负责人权责,建议公司设质量负责人,质量负责人可兼职质量管理机构负责人。
4、执业药师注册体制已较完美,八小时外可兼职其余单位,但不得从事零售卖药等有关工作。
三、设备设备管理1、全部库房需 24 小时自动监测库房温度,365 天不中断,每个库房不小于 2 个探头,每增添500 平方米需增设 2 个探头;3、因南北湿度差别较大,故撤消了湿度管理的有关要求。
4、冷库为 2-8℃;阴凉库调整为2-25℃;常温库不变。
5、批发公司不再同意分装或零货称取中药饮片,撤消了分装室及零货称取库(区)。
6、不再提“避光”,改称“遮光”,库房窗户遮光可用窗帘、有色玻璃、毛玻璃等,朝北窗可不用窗帘。
7、安全照明要求库房无灰暗区,有便于商品表记的识其余光芒强度,即灯光无死角。
8、库房整件货与拆零货分开储藏。
9、冷库温度除有自动监测设备外,还需有超出规定温度时有自动报警设备,报警器需设在24 小时价班室和保养室这二个地方。
四、进货管理1、撤消了首营公司和首营品种的观点,对进货的管理更严格,要求全部经营药品不论从何渠道购入,都需讨取产品合法资格证明文件,并成立档案,需在计算机中(指公司在用的购销存软件或GSP 管理软件)成立基础数据资料库(该数据库可能需包含产品证明文件的电子文档)。
药品经营质量管理规范(GSP)认证知识讲座(二)——药品批发企业GSP认证基本条件(组织机构、人员培训和硬

药品经营质量管理规范(GSP)认证知识讲座(二)——药品批发企业GSP认证基本条件(组织机构、人员培训和硬件设施)海峡药学2004年第16卷第1期例2,女,27岁,因脑震荡,头皮血肿,多处皮肤挫伤入院治疗.既往无药物过敏史.治疗期间并发急性上呼吸道感染,予静滴鱼腥草注射液对症治疗.患者在静滴血活素注射液6mL加入至5%葡萄糖注射液250mi完毕后,静脉续滴鱼腥草注射液(贵州六枝大华制药有限公司,批号200202061O2,规格100mL)100mL,约静滴5min时,突然出现寒战,颜面部紫绀,四肢乏力,但无呼吸急促及胸闷,急查血压16/10kPa,心率86次/min,当即停止输液,改静滴10葡萄糖注射液,密切观察,约10min后上述症状缓解,但体温升高至39.5C,予肌注柴胡注射液及冰枕物理降温后热退.但当日夜间再次出现发热,测T40.0C,予肌注柴胡注射液及冰枕物理降温,口服扑感敏片,静滴氟罗沙星,菌必治后体温逐渐下降至正常.例3,男,33岁,临床诊断为慢性乙型病毒性肝炎.既往无药物过敏史.入院后予静滴舒肝注射液(贵州瑞和制药有限公司,批号2002042203,规格10mL?支)10mL加至10葡萄糖注射液250mL中,约静滴8min时,突然出现寒战,头晕,全身不适,测血压13/9kPa.立即停止输液,予肌注非那根注射液25mg后寒战缓解,但随即出现高热,测T41C,肌注柴胡及物理降温后症状无明显缓解,约4h后症状加重,伴发胸闷不适,血压降至l1/7kPa,立即予吸氧,静注地塞米松注射液5mg,快速静滴氢化可的松注射液10mg加至平衡液50mL中,5min后再次测血压8.5/4kPa,考虑为过敏性休克.立即予以静滴多巴胺,问羟胺,低分子右旋糖酐,碳酸氢钠等抗过敏性休克治疗,2h后上述症状消失,血压恢复至12/8.5kPa, 生命体征正常.停用舒肝注射液,其他治疗方案不变,未再出现不良反应.讨论影响中药制剂发生ADRs的因素十分复杂.目前国内中药制剂的生产工艺还普遍不高,质量标准要求也不甚统一,其成份复杂,纯度不高是引发ADRs的一个重要因素.如黄芪注射液含有氮基酸类,黄酮及黄酮类似物黄芪皂甙,多糖及微量无素等成分;鱼腥草注射液的主要成分包括甲基正壬酮,癸酰乙醛,月桂醛等多种挥发油;舒肝注射液为茵陈,栀子,黄芩, 板蓝根,灵芝等提取物的复合制剂.中药制剂的某些成分,如植物蛋白可作为抗原或半抗原,进入机体后激发机体免疫系统,使之产生特导性抗体或致敏淋巴细胞,引起机体发生过敏反应(I型),如药物疹.中药制剂的ADRs除与其自身因素有关外,患者的个体差异,药物配伍,药物相互作用等因素也是不容忽视的.因此, 在使用前详细询问患者既往用药史及药物过敏史是很必要的.还应注意药物配伍,特别是中药注射液或粉针剂应尽量避免与其它药物混合使用.配伍不当容易产生不良的药物相互作用,致使ADRs发生的机率增加.同时,在用药过程中应密切观察患者用药后的反应,如出现异常情况应立即停药并及时对症处理,以免造成严重后果.总之,我们在呼吁尽快统一中药制剂生产质量规范的同时,作为医疗机构的药师及医护人员应切实加强中药制剂的合理使用,并重视其ADRs的监测.只有这样,才能最大限度地避免或减少中药制剂ADRs的发生,保障病人的安全用药与身体健康.?讲座?药品经营质量管理规范(GSP)认证知识讲座(二)——药品批发企业GSP认证基本条件(组织机构,人员培训和硬件设施)黄良民(福建省药学会福州350001)摘要:本文阐述药品批发企业GSP认证的基本条件,即组织机构的建立,质量管理文件的编制,岗位人员的配置,硬件设施的配备等.关键词:GSP认证;组织机构;人员培训;硬件设施中图分类号:R95文献标识码:B文章编号:10063765(2004)0101l()0药品批发企业必须结合企业自身的管理实际,按照GSP的各项要求建立完善质量管理体系,确保体系运行的适宜性,有效性和充分性.质量管理体系各要素,即组织机构的建立,质量管理文件的编制,岗位人员的配置,硬件设施的配备作者简介:黄良民.男(1943.4一).大专学历.现任福建省药学会副理事长兼秘书长.中国药学会高级会员,省科协六届委员?110?以及管理过程的控制等,都应以企业法人单位及其所属的各分支机构为统一整体建立和运行.从而使GSP切实有效地在企业得以贯彻和实施.1组织机构1.1企业管理组织及机构设置企业组织机构的设置将按照精简高效,事权明确,管理科学的原则,逐步趋于合理和完善.药品批发企业一般可按照以下的模式设置组织机构.药品批发企业组织机构(见StraitPharmaceuticalJournalV ol16No.12004图1).图1企业臂理组织及机构设置1.2质量领导组织1.2.1质量领导组织:质量领导组织负责人应由董事长或董事长授权的总经理担任,质量领导组织成员应由进货,销售,储运,直属经营机构等业务部门负责人和质量管理机构负责人及与质量管理工作有关部门人员组成.企业主要负责人,分管质量负责人,分管业务负责人及质量管理机构负责人是领导组织的核心,承担各自的质量责任(见图2).西一;匿]圃匿卤圆圈暖I耋f2质量领导组织1.2.2质量领导组织的性质:质量领导组织为企业非行政性常设组织,在企业主要负责人领导下,专门承担质量管理工作中重大事项的决策及质量管理体系的建立与维护.1.2.3质量领导组织的职责:主要体现在以下三方面:有效建立企业的质量管理体系,确保药品监督管理法律法规及行政规章的有效实施,保证企业药品经营质量与服务质量符合法定标准,满足社会需求;监督实施企业质量方针,落实质量职责.确保质量目标的有效实现;积极创造条件,确保质量管理工作人员有效行使职权.1.2.4质量领导组织的职责示例:质量领导组织的设立及任命文件:×××××公司文件经公司董事会(办公会议)研究决定,从发文之Ft起成立公司质量领导小组,小组成员为×××,×××,…….同时,任命×××为质量领导小组组长,具体负责质量领导小组各项工作的开展.质量领导小组的职责是:(1)组织并监督企业实施《药品管理法》,《药品经营质量管理规范≯等法律,法规和行政规章;(2)建立企业的质量管理体系.并维护质量管理体系的有效运行;(3)组织并监督实施企业质量方针目标;(4)设置企业质量管理机构.确保企业质量管理工作人员有效行使职权;(5)监督并保证质量管理部门有效实施质量裁决权和否决权;(6)审定企业质量管理体系文件;(7)定期召开质量领导小组会议,研究并处理企业质量管理工作中的重大问题;(8)确定企业质量奖惩措施并保证有效落实,在企业中充分树立"质量第一"的经营管理理念.1.3企业质量管理机构药品批发企业应设置与其经营规模相适应的专门的质量管理机构.质量管理机构应下设质量管理组,质量验收组等.质量管理机构对药品质量具有最终的裁决权.企业还应设置与经营规模相适应的药品养护组或养护员(见图3).图3企业质量管理机构注:企业在设置质量管理机构时应注意以下问题:①必须下设质量管理组,质量验收组.②应与企业的经营规模,经营模式相适应,如企业规模较大,可按照不同的工作内容,设置若干质量管理,检查验收组; 迫j必须设置专门的质量管理机构,保证质量管理机构能独立行使职权,开展工作;④质量管理机构在企业的组织结构中,应具有直属行政部门的地位.不得在行政级别上低于其它部门或隶属于其它部门1.3.1质量管理机构的职责示例:质量管理部设立及任命文件:×××××公司文件经公司董事会(办公会议)研究决定,从发文之Et起成立公司质量管理部,质量管理部下设质量管理组和质量验收组.同时,任命×××为质量管理部经理,具体负责质量管理部各项工作的开展.质量管理部的职责是:(1)坚持"质量第一"的原则,贯彻执行有关药品质量管理的法律,法规和行政规章;(2)具体负责并维护质量管理体系的正常运行;(3)负责组织起草,编制企业质量管理制度,工作程序和质量职责等质量管理文件,并指导,督促质量管理文件的执行;(4)在企业内部对药品质量行使裁决权;(5)协助质量领导组织编制,分解企业年度质量目标计划,并督促,指导目标计划的实施I【6)负责?】1]?海峡药学2004年第16卷第1期药品的质量验收.指导监督药品保管,养护和运输中的质量工作,接受企业内部有关部门关于质量技术问题的咨询;(7)收集,分析药品质量信息,调查处理药品质量查询,投诉和质量事故,组织企业质量工作分析和重大质量事故处理;(8)负责首营企业与首营品种的质量审核;(9)规范企业各项原始记录,凭证及统计报表,建立包括质量标准在内的药品质量档案,掌握并控制质量数据信息,编制企业质量报表;(1O)审核不合格药品,对不合格药品的处理过程实施监督;(11)协助人力资源部门开展对企业员工药品质量方面的教育或培训;(12)制定企业质量管理工作,质量方针目标考核办法并组织实施考核;(13)每年定期组织对《药品经营质量管理规范》的实施情况进行内部评审工作;(14)负责药品不良反应信息的收集及报告工作;(15)完成其它相关的质量管理工作.质量验收组职责是:①坚持"质量第一"的原则,严格履行质量否决权,对验收质量不合格药品予以拒收;②按照法定标准和合同规定的质量条款对购进药品,销后退回药品的质量进行逐批验收;③检查验收时应对药品的包装,标签,说明书以及药品合格证等有关证明文件进行逐一检查;④验收时按照规定的要求抽样检查,抽取的样品应具有代表性;⑤检查验收应真实完整地做好检查验收记录.验收记录保存至超过药品有效期一年,但不得少于三年;@验收首营品种,应检查有无相同批号的药品出厂检验表l质量相关岗位人员资格要求一览表报告书;⑦检查验收应在符合规定的场所进行.在规定时限内完成;⑧对验收合格的药品.及时同仓储部门办理入库交接手续.药品养护组的职责是:大中型企业应设立药品养护组.小型企业应设立药品养护组或药品养护员. 养护组或养护人员在行政上可隶属于质量管理部门,也可隶属于仓储部门,但业务上必须接受质量管理机构的监督指导.药品养护工作的主要职责是: 按照企业的有关规定.对储存药品及储存环境实施有效的养护管理,确保药品储存质量;②指导保管人员对药品进行合理储存;③检查在库药品的储存条件,配合保管人员进行仓间温湿度等储存条件的管理;④对库存药品进行定期质量检查,并做好检查记录;⑤对中药材和中药饮片按其特性,采取干燥,降氧,熏蒸等方法养护;⑥对于因异常原因可能出现质量问题的药品和库存时间较长的药品.报请质量管理机构复查处理;⑦对检查中发现的问题及时通知质量管理机构复查处理;⑧定期汇总,分析和上报药品养护检查的质量信息;⑨定期向质量管理机构上报近效期及长时间储存药品的报表;⑩负责验收养护用仪器设备,仓储设施设备的管理工作;0建立药品养护档案.2人员与培训2.1人员条件企业从事与质量相关工作的人员应符合相应的资格要求,具体规定(见表1).验收,养护,企业规模企业主要负责人质量管理工作负责人质量管理机构负责人质量管理工作人员销售人员大型批发企业主管药师或药学相执业药师或主管药师或药学相关专业应具有专业技术关专业工程师(含)工程师(含)以上职称职称,熟悉国家有以上职称药师以上技术职称关药品管理的法高中含以上文化中型批发企业或中专(含)以上药程度律,法规,规章和学或相关专业学历所经营药品的知药师或药学相关专执业药师.或药师或药学相关专业助理识业助理工程师(含)小型批发企业以上技术职称工程师(含)以上技术职称能坚持原则,有实践经验,可独立解决在岗要求在职在岗不得兼职经营过程中的质量问题在职在岗不得兼职在职在岗不得兼职人数从事质量管理,验收,养护及计量工作的专职人员数量不少于企业职工总数的4%.上述几类专职人员的总和应不少于3人,,{:保持相对稳定.说明:l,本表中主管药师含主管药师,主管中药师;药师含药师,中药师2,药学相关专业指医学,生物,化学等专业;3,执业药师视同中级专业技术职称2.2执业和职业准人制度执业药师:执业药师是指经全国统一考试合格,取得《执业药师资格证书》并经注册登记.在药品生产,经营,使用单位中执业?112?的药学技术人员.从业药师:对符合相关条件的药学技术人员,由药品监督管理部门组织考试考核,合格者认定为从业药师.从业药师在规定期限主要履行StraitPharmaceuticalJournalV ol16No.12004以下职责:负责处方的审核,调配和药品的发放,保存处方档案;提供用药咨询与药品信息服务,指导合理用药,开展临床药学工作.在GSP认证工作中,可担任质量管理,质量验收,药品养护,仓储保管及销售岗位工作,但在资质条件上,从业药师只被视同于初级专业技术职称.中药购销员,医药商品购销员,中药调剂员必须通过职业技能鉴定并取得职业资格证书后方可上岗.2.3培训教育药品批发企业从事质量管理,质量验收,药品养护,仓储,保管及销售工作的人员应定期和不定期接受不同级别的专业教育与培训,具体要求如下:①培训教育分类:培训可分为外部培训和内部培训,强制性培训和非强制性培训,定期和不定期培训,基本知识培训和专业技能培训,岗前培训和在岗培训等类型.③培训内容及要求:岗前培训(见表2).继续教育(见表3),外部培训,企业应积极选派质量,经营管理方面的高层管理或关键岗位人员, 参加由药品监督管理部门,政府相关部门,行业协作组织,业务合作单位等组织的各类专业研讨及培训.③培训计划与实施:培训计划应由质量管理部门在征求人力资源部门意见的基础上,按年度定期制定, 报企业主管负责人审批同意后实施.编制培训计划时,应结合企业的质量工作计划和员工自身素质的实际需求,着重解决实际问题,并对培训效果进行考核,建立培训考核与员工聘用,激励措施相结合的管理机制.培训实施应按照培训计划的要求.质量管理部门应协助人力资源部门实施相关的培训教育工作.质量管理部门应负责落实和确定质量培训的内容,师资,培训对象和考核方法等工作.对培训过程实施有效监控并做好记录.培训应采取有效的考核手段,将考核结果与员工的上岗,激励机制紧密结合.④培训教育档案:分企业内部培训教育档案.和员工个人培训教育档案,前者包括培训教育管理制度;年度培训教育计划;历次培训教育方案;培训教育工作记录及总结;培训教育考核结果及所采取的措施;后者包括培训教育登记表;学历,职称证明及历次培训教育证明(复印件);其它相关资料.衰2质量相关岗位工作人员上岗培训要求岗位质量管理验收,养护,销售杲管运辐应经专业培训和省应经岗位培训和地药监部级药品监督管理部市级(含)以上药品门培训门考试合格.取得合监督管理部门考试合格.取得岗位合格格证后方可上岗.证书后方可上岗.企业内以本企业质量管理制度,质量职责,工作程序为主要部培训培训内容.结合岗位操作技能,考核合格方可上岗. 表3质量相关岗位工作人员继续教育要求保管,销售,岗位质量管理验收,养护运输每年应接受省级药定期接受企(sP要求品监督管理部门组业组织的继织的继续教育续教育企业定期组织以本企业质量管理制腰,质量职贾,上企业组织作程序为主要内容.并结合岗位操作技能开展的继续教育药品批发企业应每年定期组织在质量管理,药品验收,养护,保管等直接接触药品岗位工作的人员在卫生行政部门认可的健康体检机构进行健康检查质量验收,养护人员除相应项目检查外应增加"视力","色盲"检查项目.并建立健康检查档案.发现患有精神病,传染病或其他可能污染药品疾病的人员,应立即调离直接接触药品的岗位.对员工的健康检查情况及资料应及时记入或存入健康档案,健康档案应分为企业档案和员工个人档案,每一个员工从进入企业起,即应接受就业健康检查或上岗体检,并建立健康档案,包括企业档案和个人档案.企业档案包括:每年体检的工作安排,每年体检的总人员名单,体检汇总表,采取措施.个人体检档案包括:上岗体检表及资料;每年体检表及资料;患病离岗,治疗,体检,再上岗资料(体检情况应原件保存).3硬件设施药品经营企业必须具有与所经营药品相适应的经营场所,设备,仓储设施(如果采用租用或其他合作方式,则要具有合法,有效的租赁使用的契约.并在当地药监部门进行备案).3.1营业场所及库区药品批发企业仓库与相关场所条件一览表企业规模大型企业中型企业小型企业仓库建筑面不低于1500m0不低于1000m0利于500m!积养护室面积不小于50m不小于40m不小于20m2cf,药饮片分如有分装业务.应有固定分装室.面积与设备应装场所与分装要求相适应适合进行拆零与拼箱发货.装卸作业场所应有顶收发货场所棚物料存储场设置包装物料的存储场所和相关设备所营业场所与经营规模相适应.明亮,整洁3.1.1仓库选址要求:远离居民区,地势高通风良好,交通方便,水电供应好并远离汽车库,油库.3.1.2库区环境:地面平坦并硬化或绿化.无积水.环境整洁.?ll3?海峡药学200,1年第16卷第1期3.1.3库区划分:应分为药品储存作业区(包括库房,货场及保管员办公场所),辅助作业区(包括验收养护室,分装室)及办公生活区(包括仓库办公室,宿舍,车库,卫生间等).各作业区之间应有一定距离或分隔措施,应确保办公生活区人流,物流不对储存作业区造成影响,杜绝库区管理的质量隐患.3.1.4库区标识:各库房应按照其用途及性质设立明显的标识,企业可在库区或库房适宜位置展示仓库平面示意图.库房标识所采用的颜色应符合药品仓储色标管理的规定,标明所储存药品的质量管理状态.3.2库房条件仓库建筑与装修:仓库建筑设计及所用材料应符合国家有关规定.库内环境:库内地面平整,无缝隙,不起尘;办公场所与储存作业应有效隔离.门窗结构严密.保温效果好.3.3库房区域设置①按照药品的质量状态要求.应将仓库划分为:待验库(区),合格品库(区),不合格品库(区),退货库(区),及中药饮片零货称取库(区).库房各类库或区的划分方式,应由企业经营规模及经营特点决定.如企业经营规模较大,库房数量较多,可以按库进行划分管理;如企业经营规模较小.库房数量有限.可在库房内实行划区管理;企业也可以实行库房分类与库内划区的方式进行管理. 但是,危险品,特殊管理药品,易串味药品,中药材和中药饮片应设置单独库房.②按照药品分类保管和储存温温度条件要求,药品经营企业应根据国家药品标准规定的相应储存条件,将库房设置为特定温湿度条件的恒温库,相对划分为:冷库(2~10C),阴凉库(≤20C),常温库(0~3OC),各类型仓库的相对湿度应保持在45~75之间.③中药材,中药饮片应按性质要求分别设置相应的阴凉库,常温库.④按特殊管理药品的库房应划分为麻醉药品库,精神药品库,毒性药品库,放射性药品库等.麻醉药品和精神药品可同库分区存放.3.4设施设备配置库房及验收养护室应配备以下设施设备:(1)有保持药品与地面间距在1Ocm以上的底垫及货架;(2)库房应采取避免日光直射的措施.储存条件规定为密闭,遮光的拆零药品储存区, 应采取有效的避自然光线的措施;(3)仓库应配备必?114?要的通风设备.窗户应有防护窗纱,排风扇应配置防护百叶;(4)应有检测温度的设备,每个仓间至少配备一台温湿度检测仪.悬挂位置选择应以检测记录人员平视为宜;(5)应配置能有效调节控制库房温湿度条件的设备;(6)应有防尘,防潮,防霉,防污染及防虫,防鸟,防鼠等设备.(7)应有符合安全用电要求的照明设备,灯具应配置灯罩,储存危险药品的库房应安装防爆灯;(8)配备符合规定要求的消防,安全设施;(9)特殊管理药品的专用仓库应具有相应的安全保卫措施.(10)验收养护室应配有千分之一天平, 澄明度检测仪,标准比色液等;经营中药材,中药饮片的还应配置水分测定仪,紫外荧光灯,解剖镜或显微镜;(¨)验收养护室,中药标本室应有必要的防潮,防尘设备,应配有空调;(12)企业对所用设施设备应定期进行检查,维修,保养并建立管理档案.3.5储存条件控制①应确保库房内配置与所经营药品规模相适应的底垫及货架,药品在任何区域及质量管理状态均不得与地面直接接触;②库房通风严禁采用开门通风的方式,严禁在库房墙壁设置通风明孑L;③库房配置的温湿度检测仪数量应与库房的面积相适应,一般应每300m仓储面积至少应有一台检测仪;④温湿度检测仪的悬挂位置应科学, 合理,应选择能正确反映库房平均温湿度条件的位置;⑤卫生及其它储存作业工具应实行定置管理,定位存放.3.6中药饮片分装中药饮片分装系指药品经营企业,按照规定的程序和操作要求.将购进的较大规格包装的中药饮片分装为符合销售要求的包装规格.开展中药饮片分装应具备以下条件:①应符合规定的中药饮片分装室,其面积应能满足分装作业的要求;②中药饮片分装室环境应整洁,卫生,墙壁顶。
药品质量控制小组及其工作职责

药品质量控制小组及其工作职责
背景
药品质量控制小组是一个专门负责药品质量控制工作的团队。
他们的主要职责是确保药品的质量和安全性,以保护公众的健康和安全。
工作职责
药品质量控制小组的工作职责包括但不限于以下几个方面:
1. 药品质量评估和监管:负责对药品的质量进行评估和监管,确保药品符合相关的法律法规和标准要求。
他们会对药品进行抽样检验,并进行质量评估,以确保药品的成分、纯度、稳定性等方面符合规定标准。
2. 药品生产过程监控:负责监控药品的生产过程,确保生产过程符合药品质量控制的要求。
他们会进行定期的检查和评估,以确保生产过程的合规性和质量稳定性。
3. 药品不良事件的调查和处理:负责调查和处理药品不良事件。
当发生药品质量问题或安全事件时,药品质量控制小组会迅速采取
行动,调查原因,并采取相应的措施以防止类似事件再次发生。
4. 药品质量培训和教育:负责组织药品质量培训和教育活动,
提高团队成员的质量意识和专业水平。
他们会定期组织培训课程,
包括药品质量管理的基本知识、相关法律法规和标准要求等内容。
5. 药品质量改进和优化:负责药品质量的改进和优化工作。
他
们会定期评估和分析药品质量控制的效果,并提出改进意见和措施,以进一步提高药品的质量和安全性。
总结
药品质量控制小组在药品质量管理中起着重要的作用。
他们通
过评估、监管、调查和改进等工作,确保药品的质量和安全性,保
障公众的健康和安全。
他们的工作需要高度的专业知识和技能,以
及独立决策能力和责任心。
新版gsp认证质量管理制度

认证质量管理制度gsp新版.、定义:质量管理体系文件是指一切涉及药品经营质量的书面标准和实施过程中记1 录的,贯穿药品质量管理全过程的连贯有序的文件。
目的:制定质量管理标准文件的编制、修订、审核、批准、撤销、印制及保管、分2 以促进本公司质量管理体系的有效运行。
发的规定,规范本企业质量管理文件的管理,号)等法律法903、依据:《药品管理法》《药品经营质量管理规范》(卫生部令第规。
、适用范围:适用于对质量管理制度、岗位职责、操作程序和各项记录相关文件的4 管理。
5、责任:质量领导小组对本制度的实施负责。
6、内容:、公司质量管理文件的编制、审核、修订、换版、解释、培训、指导、检查及分6.1 发,统一由质量管理部负责,各部门协助、配合其工作。
、当发生以下状况时,公司应对质量管理体系文件进行相应内容的调整、修订。
6.2如:质量管理体系需要改进时;有关法律法规修订后;组织机构职能变动时;使用中认证检查或内部质量体系评审后需要修改时,以及其他需要修GSP发现问题时;经过改的情况。
一般两年至少一次。
、文件编码要求:为规范公司内部文件管理,有效分类,便于检索,对各类文件6.3 实行统一编码管理。
编码应做到格式规范,类别清晰,一文一号。
个英文字母的文件类别代24个英文字母的公司代码、(1)、编号结构:文件编号有 4位阿拉伯数字的年号编码组合而成,详如下图:码、3位阿拉伯数字的序号加□□□□——□□□□□—□□□年号文件序号文件类别代码公司代码)、公司代码:取公司名称“浙江滋福堂医药有限公司”中的“滋福堂”中每的(21第一个汉语拼音字母用大写英文字母“ZFT”表示。
(3)、文件类别:质量管理制度的文件类别代码,用英文字母“QM”表示,质量职责的文件用类别代码,用“QD”表示,质量管理工作程序文件的文件类别代码,用“QP”表示。
6.4、文件序号:质量管理体系文件按文件类别分别用3位阿拉伯数字,从“001”开始顺序编码。
药店GSP质量管理职责

质量领导小组质量职责1.目的建立和明确质量领导小组职责,落实质量责任,保证质量管理工作规范性、有效性。
2.依据《药品经营质量管理规范》3.适用范围适用于质量领导小组职责管理。
4、岗位职能:建立药店的质量体系,实施药店质量方针,并保证药店质量管理工作人员行使职权。
5、主要职责:5.1、组织并监督药店员工实施《药品管理法》等药品管理的法律、法规和行政规章;5.2、建立药店的质量管理体系;5.3、制定药店的质量方针和质量目标,组织并监督实施;5.4、负责设置各岗位的质量管理职能;5.5、审定药店质量管理制度;5.6、研究和确定药店质量管理工作的重大问题;5.7、制定药店质量奖惩措施。
6、领导责任:在药店质量方针、质量目标、质量管理制度的执行,研究和确定药店质量管理工作等重大问题的质量管理工作中负领导责任。
7、主要权力:7.1、审核药店的质量管理体系运行情况;7.2、根据药店情况修订公司的质量方针和质量目标;7.3、调整各岗位的质量管理职能;7.4、审定药店质量管理制度;7.5、对各岗位质量管理执行情况有奖罚权。
8、主要考核指标:8.1、药店质量方针目标实施情况;8.2、质量管理体系运行情况。
企业负责人职责1.目的建立和明确企业负责人岗位职责,落实质量责任,保证质量管理工作规范性、有效性。
2.依据《药品经营质量管理规范》3.适用范围适用于总经理职责管理。
4.岗位职能建立质量管理体系,并使之有效运行,对药品质量负主要责任,全面负责药店日常理,为药店质量管理提供必要的条件。
5.主要质量职责5.1、承担药店药品质量的主要责任。
5.2、负责药店的日常管理。
5. 3、负责提供必要的工作条件,保证药店质量管理员有效履行职责。
5.4、确保企业按照本《规范》要求经营药品。
5.5、负责药店质量管理机构的设置,参与各岗位质量管理职能。
5.6、参与审定药店质量管理制度。
5.7、研究和确定药店管理工作的重大问题。
5.8、确定药店人员质量奖惩措施。
GSP认证管理制度

北京格瑞纳健峰生物技术有限公司质量管理文件目的:规范公司药品经营质量管理规范(GSP)认证工作的管理。
依据:《药品管理法》、《药品管理法实施条例》、《药品经营许可证管理办法》、《药品经营质量管理规范认证管理办法》、《药品经营质量管理规范》、《药品经营质量管理规范实施细则》、《药品批发企业GSP认证检查评定标准》。
适用范围:适用于企业GSP认证工作的发起、认证前准备、认证过程及通过认证后由认证到实施过渡四个工作流程的管理。
内容:1.GSP认证工作的发起。
分为两类:初次认证和重新认证。
1.1初次认证是指获得《药品经营许可证》的企业,在经营活动开始之前,依法申请药品监督管理部门对药品经营企业药品经营质量管理进行监督检查,对药品经营企业实施《药品经营质量管理规范》情况进行检查、评价,并依法获得认证证书的过程。
初次认证的发起,应由总经理提出认证要求,由总经理办公室会同质量管理部门初步确定认证期限、认证范围,最后通过人事行政部发放通知,通知物流部、销售部、总经办、质量管理部、工程部、人事行政部,通知内容应包含认证动员、认证期限、认证范围等。
1.2重新认证是指已获得《药品经营质量管理规范认证证书》的企业,在证书到期前3个月内,申请省、自治区、直辖市药品监督管理部门依照《药品经营质量管理规范认证管理办法》的认证程序,对申请企业进行检查和复审,并换发证书的过程。
重新认证的发起,应由质量管理部门提出认证要求,总经理批准后,由总经理办公室会同质量管理部门确定认证期限及认证范围,最后通过人事行政部发放通知,通知物流部、销售部、总经办、质量管理部、工程部、人事行政部,通知内容应包含认证动员、认证期限、认证范围等。
2.认证前的准备2.1组织准备:建立GSP认证领导小组,以领导、指挥、协调认证工作。
组长由企业法人或者企业法人授权的总工程师担任,成员包括各职能部门负责人、技术骨干。
领导小组下分设:人员培训、硬件、软件系统工作小组。
GSP认证质量管理职责
****医药有限公司文件1.质量领导小组质量职责一.部门职能:建立公司完善的质量管理体系,实施质量方针目标,保证公司质量管理工作人员有效的行使其职权。
二.工作内容:1.组织并监督企业实施《中华人民共和国药品管理法》和《药品经营质量管理规范》等有关药品监督管理法律、法规和行政规章;2.建立公司的质量管理体系,并维护其有效运行;3.组织并监督实施公司质量方针、目标;4.负责拟订公司质量管理部门的设置方案,制定各部门的质量管理职能,确保公司质量管理工作人员有效行使其职权;5.审定公司的质量管理体系文件;6.监督并保证公司质量管理部门有效行使其质量管理职能;7.研究和确定公司质量管理工作的重大问题;8.确定公司的质量奖惩措施,在企业中充分树立“质量第一”的经营管理理念;三.领导责任:在公司质量方针和目标的确定、质量管理体系的有效运行、质量管理工作的研究和确定等工作中负领导责任;四.主要权利:1. 审核公司的质量管理体系运行情况;2. 修订公司的质量方针和质量目标;3. 审定质量管理制度;4. 对各部门、岗位质量管理执行情况有奖罚权;五.主要考核内容:1. 质量方针与目标实施情况;2. 质量管理体系运行情况;六.人员组成:公司总经理、质量副总经理、业务副总经理、业务部经理、质管部经理、储运部经理;****医药有限公司文件2.质量管理部质量职责一.部门职能:根据公司质量方针与目标,组织建立与运行质量管理体系,并进行经营管理服务过程中各流程的改进、实施与控制,确保药品和服务质量。
二.主要质量责任:1.贯彻执行《药品管理法》和《药品经营质量管理规范》等有关药品管理的法律、法规和行政规章;行使质量管理职能,在企业内部对药品质量具有裁决权;2.负责起草、编制公司质量管理制度、工作程序和质量职责等质量管理文件,并指导督促质量管理文件的执行;3.具体负责并维护公司质量管理体系的正常运行;4.协助公司质量管理领导小组编制、分解企业年度质量目标,并督促、指导目标计划的实施;5.负责组织进货情况的质量评审,参与药品购进计划的审核,确保购进药品质量的可靠性;6.负责首营企业和首营品种的质量审核;7.负责建立企业所经营药品并包含质量标准等内容的质量档案;8.负责药品质量的查询和药品质量事故或质量投诉的调查、处理及报告;9.负责药品的验收,指导和监督药品保管、养护和运输中的质量工作;10.负责质量不合格药品的审核,对不合格药品的处理过程实施监督;11.负责收集和分析药品质量信息,并及时传递和处理;12.负责药品不良反应的收集及报告工作;13.协助资源部开展对公司员工药品质量管理方面的教育或培训,推进各项工作的规范化;14.完成其他相关的质量管理工作;三.主要考核内容:1.药品质量的全过程监控;2.质量管理体系运行的有效性;3.质量管理体系运行的效率;4.各项职责的完成情况;****医药有限公司文件3.业务部质量职责一.部门职责:负责药品购进和销售过程中质量管理工作的实施;确保购进、销售药品的质量和数量,为客户提供满意的服务。
GSP各岗位职责上墙版 Microsoft Word 97 - 2003 Document

1.企业负责人岗位职责一、组织职工贯彻执行《药品管理法》和《GSP》等有关法律法规,对公司所经营的药品质量负主要责任;二、制定企业质量方针、目标和质量管理工作发展规划,建立质量管理责任制;三、建立健全质量管理体系并保证其正常运行;四、主持经理办公会议,提议审批各职能部门经理及高层管理人员的任免、报酬、奖惩等;五、负责公司日常各项经营管理工作;六、在经营质量管理中提供必要的质量管理条件,落实质量否决权;七、负责重大质量问题和质量事故的处理;八、主持质量领导小组工作例会,负责实施《GSP》内审;审批、签发质量管理体系。
2.质量管理副总经理岗位职责一、全面负责公司药品质量管理工作,贯彻执行《药品管理法》、《GSP》等有关法律法规;二、组织制定和修订公司质量管理体系文件;三、负责首企、首营的审批和《GSP》内审工作;四、根据公司质量方针目标,组织、制定、分解有关质量管理目标和计划;五、主持公司质量管理日常工作,负责实施《GSP》和认证工作;六、对药品质量问题,行使裁决权。
七、依据《GSP》质量环节,选择质量要素,进行质量职能分配,推进质量体系运行,实施质量改进,组织质量体系评审;八、召开质量分析会,分析存在问题,提出整改措施;九、负责处理质量事故及客户质量投诉;十、负责公司员工教育培训和岗前培训工作;3.营销总监岗位职责一、在企业负责人领导下,负责业务部、仓储部的日常经营管理工作;二、贯彻执行国家有关药品监督管理的法律、法规及行政规章制度;三、根据年度所需药品计划,储存情况,组织制订采购计划;四、负责购进合同和年销协议的审批;五、负责审查购销单位和人员的合法资格;六、协助质管部处理质量事故等药品质量问题;七、初步审核不合格药品,负责对不合格药品的销毁工作;八、负责向各相关部门及时通报经营品种信息;九、督促业务部做好产品推广、客户网络建设等工作;十、督促仓储部做好药品收货,存储、复核、出库及运输工作;4.行政部长岗位职责一、在企业负责人领导下制定质量管理考核奖惩办法;二、负责公司工作计划、总结、工作报告等文案的起草;三、负责公司会议的准备、组织、记录和接待工作;四、负责文印、办公及劳保用品管理及其他事务性的工作;五、负责检查工作计划的落实情况, 组织考核各部门质量指标执行情况;六、负责公司仪器、设施设备的购置、调配、维修;七、负责公司人员招聘、岗位调动等档案管理;八、负责公司对外联络, 协调部门处理公司内外关系;九、负责公司员工的质量教育和培训工作,建立培训档案;十、负责公司员工年度健康检查,并建立健康档案;十一、完成公司领导交办的其他事项。
gsp岗位职责9篇

gsp岗位职责9篇在现实社会中,越来越多地方需要用到岗位职责,订立岗位职责可以减少违章行为和违章事故的发生。
订立岗位职责需要注意哪些问题呢?它山之石可以攻玉,以下内容是差别网为您带来的9篇《gsp岗位职责》,假如对您有一些参考与帮忙,请共享给最好的伙伴。
gsp岗位职责篇一1、在总经理的领导下,认真贯彻执行国家药品质量方针、政策、法规和有关质量方面的文件规定,全面抓好公司质量管理工作。
2、依据公司质量方针,组织订立分解有关质量管理目标和计划,并层层落实,组织实施。
3、负责公司质量管理日常工作,及GSP在本公司的监督与实施和GSP认证工作。
4、主持公司质量管理体系的建设,帮忙总经理做好质量管理工作,依据GSP确定质量环节,选择质量管理体系要素,进行质量职能调配,推动质量管理体系运行,实施质量改进,组织质量管理体系评审。
5、依照《质量领导小组质量管理职责》,组织订立和修订公司质量管理制度,明确公司各部门各环节药品质量管理职责,即首营企业、首次经营品种质量的审批,药品入库的质量验收,在库药品的。
保管与养护,出库药品的复核以及对近效期药品的催销,退货药品、不合格药品的管理等等。
并负责组织实施监督检查。
6、依据工作情况召开公司质量分析研究专题会或现场会,检查质量管理目标计划执行情况,分析存在的问题,提出解决的措施。
7、依据《质量事故管理规定》《质量查询管理规定》和《质量投诉的管理规定》,组织协调处理质量事故及客户有关质量问题的投诉,把质量管理考核工作与各级各类人员的责任奖惩挂钩。
对部门和个人在药品质量和服务质量工作中,作出成绩和显现的问题,结合月度、季度或年终工作提出嘉奖或惩罚的建议。
8、依据《质量方面教育、培训及考核的管理规定》,帮忙综合部组织公司员工学习《药品管理法》《药品经营质量管理规范》,抓好培训工作,提高员工质量管理业务技能。
9、依据《用户访问管理规定》,加强与客户的联系,定期组织收集客户对药品质量和服务质量的看法,听取合理化建议,促使改进质量管理工作。
GSP运行检查及处罚规定
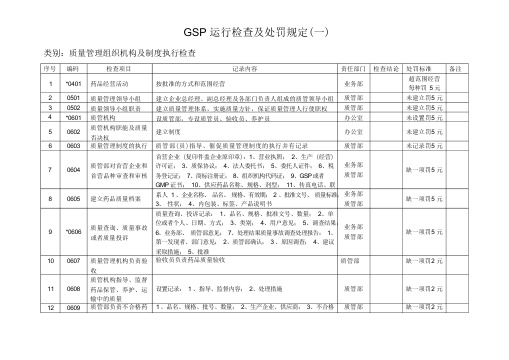
GSP 运行检查及处罚规定(一)类别:质量管理组织机构及制度执行检查序号12 3 45 67 8 9101112 编码*040105010502*06010602060306040605*0606060706080609检查项目药品经营活动质量管理领导小组质量领导小组职责质管机构质管机构职能及质量否决权质量管理制度的执行质管部对首营企业和首营品种审查和审核建立药品质量档案质量查询、质量事故或者质量投诉质量管理机构负责验收质管机构指导、监督药品保管、养护、运输中的质量质管部负责不合格药记录内容按批准的方式和范围经营建立企业总经理、副总经理及各部门负责人组成的质管领导小组建立质量管理体系,实施质量方针,保证质量管理人行使职权设质管部,专设质管员、验收员、养护员建立制度质管部(员)指导、催促质量管理制度的执行并有记录首营企业 (复印件盖企业原印章):1、营业执照;2、生产 (经营)许可证;3、质保协议;4、法人委托书;5、委托人证件;6、税务登记证;7、商标注册证;8、组织机构代码证;9、GSP 或者GMP 证书;10、供应药品名称、规格、剂型;11、传真电话、联系人1、企业名称、品名、规格、有效期;2 、批准文号、质量标准;3、性状;4、内包装、标签、产品说明书质量查询、投诉记录:1、品名、规格、批准文号、数量;2、单位或者个人、日期、方式;3、类别;4、用户意见;5、调查结果;6、业务部、质管部意见;7、处理结果质量事故调查处理报告:1、第一发现者、部门意见;2、质管部确认;3 、原因调查;4、建议采取措施;5、批准验收员负责药品质量验收设置记录:1 、指导、监督内容;2、处理措施1 、品名、规格、批号、数量;2、生产企业、供应商;3、不合格责任部门业务部质管部质管部办公室办公室质管部业务部质管部业务部质管部业务部质管部质管部质管部质管部检查结论处罚标准备注超范围经营每种罚5 元未建立罚5 元未建立罚5 元未设置罚5 元未建立罚5 元未记录罚5 元缺一项罚5 元缺一项罚5 元缺一项罚5 元缺一项罚2 元缺一项罚2 元缺一项罚2 元被检查部门负责人:检查人:检查时间:原因传递、汇总、分析、整理,每年不少于2 次。
GSP认证质量手册

医药公司GSP认证质量管理手册质量文件管理制度一、目地:保证公司在经营管理活动中制定有效的文件,有可遵循的依据。
二、适用范围:公司药品经营管理的一切活动。
三、工作程序(一)文件的制订、批准、发布、修订。
1、制订的要求①文件的标题应能清楚的说明文件的性质,以与其他文件相区别。
②文件使用的语言应确切、易懂、简练,指令性内容必须以命令形式写出。
③各类文件应有便于识别其文本、类别和日期,该文件的使用方法、使用人。
④需用填写数据的文件应留有足够的空间,以便于填写内容,在多项内容之间应有适当的空隙,每项的标题要准确明了。
⑤文件的制订、审查、批准负责人应签字。
2、制订的原则①指令性原则:在企业内部具有法律效应。
②系统性原则:文件之间要相互联系。
③符合性原则:要与现行的法律、法规及公司的实际情况相符合,及时修订不符合的部分。
④协调性原则:各部门、各环节的文件要相互协调,不要出现管理上的真空和矛盾。
⑤先进性原则:鼓励企业采用先进、科学的模式和手段。
⑥可行性原则:制度的制订必须能实行,具有可操作性。
⑦可查性原则:清楚制度执行情况的衡量标准,可量化的要制订量化标准。
3、质量文件的批准、发布、修订。
①文件的起草由各相应部门完成,经部门负责人审查后报公司负责人批准印发实施。
②实施的文件应定期审阅,及时修订。
修订、撤消文件程序与修订时相同,发布修订后的文件,原文件应收回予以废止,以防误用。
(二)质量文件包括:管理制度、标准、记录和凭证。
1、管理制度:制度是要求企业员工共同遵守的办事规程或行为准则。
制订管理制度的目的是保证企业为了行使经营计划,指挥控制等管理职能,并使之规范化、标准化,为企业经营组织药品经营活动提供必需的依据和手段。
管理制度包括业务经营制度、质量管理、卫生管理等方面。
2、标准:标准是依据科学技术的实践经验在充分协商的基础上,对具有多样性、相关性特征的事物,以特定程序和形式颁发的统一规定。
可分为工作标准和技术标准。
GSP质量管理职责

ⅩⅩⅩⅩ药业有限责任公司质量管理职责文件目录XX-XX-001 质量领导小组质量管理职责 (3)XX-XX-002质管部质量管理职责 (5)XX-XX-003仓储部质量管理职责 (7)XX-XX-004业务部质量管理职责 (9)XX-XX-005行政部质量管理职责 (11)XX-XX-006财务部质量管理职责 (13)XX-XX-007信息部质量管理职责 (15)XX-XX-008企业负责人质量管理职责 (16)XX-XX-009质量副企业负责人质量管理职责 (18)XX-XX-010营销总监质量管理职责 (20)XX-XX-011质管部长质量管理职责 (22)XX-XX-012信息部长管理职责 (24)XX-XX-013仓储部长质量管理职责 (26)XX-XX-014行政部部长质量管理职责 (28)XX-XX-015业务部部长质量管理职责 (30)XX-XX-016财务部长质量管理职责 (32)XX-XX-017质管员质量管理职责 (34)XX-XX-018验收员质量管理职责 (36)XX-XX-019养护员质量管理职责 (40)XX-XX-020保管员质量管理职责 (42)XX-XX-021业务员质量管理职责 (44)XX-XX-022开票员质量管理职责 (46)XX-XX-023系统管理员质量管理职责 (48)XX-XX-024药品配送员质量管理职责 (50)XX-XX-025会计人员质量管理职责 (52)ⅩⅩⅩⅩ药业有限责任公司文件XX-XX-001 质量领导小组质量管理职责1.目的:建立质量领导小组质量管理职责。
2.依据:《药品管理法》、《药品经营质量管理规范》等法律法规。
3.范围:适用于质量领导小组。
4.责任:质量领导小组:组长、副组长、成员。
5.内容:5.1.组织企业认真学习《药品管理法》等药品管理的法律、法规。
5.2.组织督促实施《药品经营质量管理规范》、《药品经营质量管理规范现场检查指导原则》及附录。
GSP认证质量负责人的岗位职责

质量负责人的岗位职责
1、在总经理的直接领导下,分管质量管理工作,贯彻执行《药品管理法》《药品经营质量管理规范》等法律法规、执行国家有关药品监督管理的法律、法规及行政规章;
2、负责建立、实施和维护公司质量管理体系的有效运行,主持质量管理体系的审核活动,负责向总经理报告质量管理体系的运行情况;
3、具体领导公司质量方针、目标的制定、实施和检查考核;
4、按规定的管理职责、质量职责,对公司的质量管理进行计划、指导、实施和协调,对分管工作的质量负责;
5、协助总经理研究、部署、检查质量工作,对质量工作奖惩办法提出建议,并根据总经理的授权具体实施质量奖惩。
gsp认证质量管理制度

gsp认证质量管理制度****医药文件1.质量体系文件治理制度一.制定目的:为保证药品经营过程的质量操纵和规范治理,结合本公司经营实际制定本制度,gsp认证质量治理制度。
二.适用范畴:本制度适用于本公司各类质量相关文件的治理。
三.定义:质量治理体系文件:是指一切涉及药品经营质量的书面标准和实施过程中的记录结果组成,贯穿药品质量治理全过程的连贯有序的系列文件,是质量治理体系运行的依据,能够起到沟通意图、统一行动的作用。
四.制定依据:《药品治理法》、《药品经营质量治理规范》等相关法律、法规。
五.说明:公司各项质量治理体系文件的起草、编制、审核、修订、换版、说明、培训、指导、检查及分发,统一由质量治理部负责,各部门协助、配合其工作。
六.内容:1.公司质量治理体系文件分为四类,即:质量治理制度、质量治理职责、质量治理程序与质量记录、质量治理制度考核制度等;当发生以下状况时,公司应对质量治理体系文件进行相应内容的调整、修订。
如:质量治理体系需要改进时;有关法律、法规修订后;组织机构变动时;使用中发觉问题时;通过GSP认证检查或内部质量体系评审后以及其它需要修改的情形。
3.文件编码要求:为规范内部文件治理,有效分类、便于检索,对各类文件实行统一编码治理,编码应做到格式规范,类别清晰,一文一号。
4.编号结构:4.1文件编号由4个英文字母的公司代码、2个英文字母的文件类别代码、3位阿拉伯数字的序号组合而成。
本公司“****医药”代码为:****。
文件类别:质量治理制度的文件类别代码,用英文字母“QM”表示; 质量治理职责的文件类别代码,用英文字母“QD”表示; 质量治理程序的文件类别代码,用英文字母“QP”表示; 质量治理记录类的文件类别代码,用英文字母“QR”表示; 质量治理制度考核制度的文件类别代码,用英文字母“QC”表示; 详见下图:公司代码文件类别代码文件序号如:**** QMQDQPQRQC 001?文件序号:质量治理体系文件按文件类别分别用3位阿拉伯数字,从“001”开始顺序编码。
连锁总部GSP质量管理职责

1、岗位名称:质量领导小组2、直属上级:公司董事会3、直属下级:公司各部门、各连锁店4、岗位职责:4.1建立企业的质量管理体系,实施企业质量方针,并保证企业质量管理工作人员行使职权。
4.2组织并监督企业员工实施《中华人民共和国药品管理法》、《GSP》、《消费者权益保护法》等法律法规和行政规章。
4.3建立企业的质量管理体系,落实企业组织构架,每年定期或不定期组织企业质量体系内部审核,以完善质量管理体系。
4.4制定企业的质量方针和质量目标,分解落实到各部门并监督实施过程,定期组织目标考核。
4.5负责拟订企业质管部门的设置方案,制定各部门的质量管理职能。
4.6审定企业质量管理制度,提请总经理批准实施。
4.7研究和确定企业质量管理工作的重大问题。
4.8制定企业质量工作奖惩措施。
4.9在企业质量方针与目标的确定、质量管理体系的有效运行、企业质量管理工作的研究与确定等工作中负领导责任。
5、岗位权限:5.1审核企业的质量管理体系运行情况。
5.2根据企业情况修订企业的质量方针和质量目标。
5.3调整各部门岗位的质量管理职能。
5.4审定企业的质量管理制度5.5对各部门岗位质量管理制度执行情况有奖罚权。
5.6创造一切条件保证质量管理人员行使质量否决权。
6、考核内容:6.1企业质量方针与质量目标实施情况。
6.2质量管理体系运行评审情况。
7、人员组成:企业主要负责人、企业质量负责人、质管部负责人、采购部负责人、运营部负责人、行政部负责人、财务部负责人、信息部负责人、门店经理等。
2、直属上级:总经理3、直属下级:4、岗位职责:4.1根据公司的经营、质量方针和目标,协同质管部门对公司质量管理工作进行监督、考核,并负责公司行政管理和人力资源管理。
4.2负责公司人员档案资料的建档和更新,建立员工花名册和人员档案。
4.3负责公司员工教育培训管理,会同质管部制订年度培训计划,并组织实施。
负责安排培训内容、时间、地点、师资等事项,建立培训档案。
GSP质量体系文件(药品批发企业委托第三方物流适用-2019修正版)

一委托第三方物流适用.版本号:- V5LL.,IXXX邓药有限公司文件生效令〈批发企业药品GSP文件V5 版〉已于2019 年 XX月 XX日- XX月 XX 日进行再次修订,并经公司办公会议审议通过,自 XXXX年 XX月 XX日起实施。
总经理:XXXX 年 XX月 XX日修订说明(V5)因公司增加经营范围,为了符合《药品经营质量管理规范》的要求,确保实际操作和文件规定的一致性,特作本次修订。
修订的主要内容如下:1、增加《不合格药品报告处理、报损销毁操作规程》、《与第三方医药物流单据操作规程》,对上一版文件未细化规定进行补充。
2、对《部门及岗位职责》、《质量管理制度》、《工作操作规程》中委托第三方医药物流进行的内容进行了细化规定,作为评审第三方医药物流质量工作的评审依据(参考)。
3、修订《质量风险管理制度》,使之更切合药品经营企业的质量管理工作。
4、对质量管理制度和工作操作规程涉及“中药饮片”的内容进行补充。
5、勘误文件中的错别字。
1 XXX-ZZ-V5-01 质量领导小组职责 12 XXX-ZZ-V5-02 法定代表人职责2 3 XXX-ZZ-V5-03 企业负责人(总经理)职责 3 4 XXX-ZZ-V5-04 质量负责人(副总经理)职责 4 5 XXX-ZZ-V5-05 副总经理职责 5 6 XXX-ZZ-V5-06 副总经理助理职责 6 7 XXX-ZZ-V5-07 质量管理部职责 7 8 XXX-ZZ-V5-08 质量管理部经理职责 8 9 XXX-ZZ-V5-09 质量管理员职责 9 10 XXX-ZZ-V5-10 验收员职责 10 11 XXX-ZZ-V5-11 采购部职责 11 12XXX-ZZ-V5-12采购部经理职责 12 13 部 XXX-ZZ-V5-13 采购员职责 13 14 门 XXX-ZZ-V5-14 销售一部职责 14 15 及 XXX-ZZ-V5-15 销售一部总监职责 15 岗 16 XXX-ZZ-V5-16 位 招商经理职责 16 17 职 XXX-ZZ-V5-17 销售客服职责 17 18 责XXX-ZZ-V5-18 销售二部职责 18 19 XXX-ZZ-V5-19 销售二部总监职责 19 20 XXX-ZZ-V5-20 销售经理职责 20 21 XXX-ZZ-V5-21 财务部职责 21 22 XXX-ZZ-V5-22 财务部经理职责 23 23 XXX-ZZ-V5-23 会计人员职责 24 24 XXX-ZZ-V5-24 出纳人员职责 25 25 XXX-ZZ-V5-25 储运事务部职责 26 26 XXX-ZZ-V5-26 储运事务部经理职责 27 27 XXX-ZZ-V5-27 储运专员职责 28 28 XXX-ZZ-V5-28 药品储存员职责 29 29 XXX-ZZ-V5-29 药品养护人员职责 30 30XXX-ZZ-V5-30出库复核人员职责3131 XXX-ZZ-V5-31运输送货人员职责 32 32 部 33 门 XXX-ZZ-V5-32 信息管理部职责 33 XXX-ZZ-V5-33 信息管理部经理职责 34 岗 34 及 XXX-ZZ-V5-34 信息管理人员职责 35 35 XXX-ZZ-V5-35 位 行政人事部职责 36 36 职 XXX-ZZ-V5-36 行政人事部经理职责 37 37 责XXX-ZZ-V5-37 行政文员职责 38 38 XXX-ZZ-V5-38 人事专员职责3939 XXX-ZD-V5-01 质量管理体系内审管理制度 40 40 XXX-ZD-V5-02 质量否决权管理制度 42 41 XXX-ZD-V5-03 质量管理体系文件管理制度 44 42 XXX-ZD-V5-04 质量信息管理制度47 43 XXX-ZD-V5-05 供货单位及其销售人员资格审核制度49 44 XXX-ZD-V5-06 购货单位及其采购、收提货人员资格审核制度51 45 XXX-ZD-V5-07 药品采购管理制度 53 46 XXX-ZD-V5-08药品收货管理制度 55 47 XXX-ZD-V5-09 质 药品验收管理制度 57 48 量 XXX-ZD-V5-10 药品储存管理制度 59 49 管 XXX-ZD-V5-11 药品养护管理制度 61 50 理 XXX-ZD-V5-12 药品销售管理制度 62 51 制 XXX-ZD-V5-13 药品出库管理制度 63 52 度XXX-ZD-V5-14 药品运输管理制度 65 53 XXX-ZD-V5-15 专门管理类药品管理制度 67 54 XXX-ZD-V5-16 药品有效期管理制度68 55 XXX-ZD-V5-17 不合格药品、药品销毁管理制度 69 56 XXX-ZD-V5-18 药品退货管理制度 71 57 XXX-ZD-V5-19 药品召回管理制度 73 58 XXX-ZD-V5-20 质量查询管理制度 74 59 XXX-ZD-V5-21 质量事故管理制度 76 60 XXX-ZD-V5-22质量投诉管理制度7861 XXX-ZD-V5-23 药品不良反应报告管理制度79 62 XXX-ZD-V5-24 卫生环境、人员健康、个人卫生管理制度 81 63 XXX-ZD-V5-25 质量方面的教育、培训及考核管理制度 82 64XXX-ZD-V5-26设施设备保管和维护管理制度 8465 质 66 量 67管 XXX-ZD-V5-27 设施设备验证和校准管理制度 85 XXX-ZD-V5-28 记录和凭证管理制度 89 XXX-ZD-V5-29 计算机系统管理制度 9168 理 XXX-ZD-V5-30 药品经营追溯管理制度 94 69 制 XXX-ZD-V5-31 质量风险管理制度97 70 度XXX-ZD-V5-32 温湿度自动监测系统管理制度 102 71 XXX-ZD-V5-33 直调药品管理制度104 72 XXX-ZD-V5-34 冷链药品储存和运输应急预案 105 73 XXX-ZD-V5-35 药品追回管理制度108 74 XXX-ZD-V5-36 第三方医药物流审计管理制度 109 75 XXX-SOP-V5-01 药品采购操作规程 111 76 XXX-SOP-V5-02 药品收货操作规程 113 77 XXX-SOP-V5-03 药品验收操作规程 116 78 XXX-SOP-V5-04 药品储存操作规程 119 79 XXX-SOP-V5-05药品养护操作规程 121 80 XXX-SOP-V5-06 工 药品销售操作规程 123 81 作 XXX-SOP-V5-07 药品出库复核操作规程 125 82 操 XXX-SOP-V5-08 药品运输操作规程 127 83 作 XXX-SOP-V5-09 计算机管理系统操作规程 129 84 规 XXX-SOP-V5-10 质量体系文件管理操作规程 133 85 程XXX-SOP-V5-11 投诉管理操作规程136 86 XXX-SOP-V5-12 冷藏药品经营管理操作规程 138 87 XXX-SOP-V5-13 验证管理操作规程 144 88 XXX-SOP-V5-14 冷库使用管理操作规程 148 89 XXX-SOP-V5-15 保温箱使用管理操作规程 151 90XXX-SOP-V5-16冷藏车使用管理操作规程15391 XXX-SOP-V5-17 供、购货单位质量管理体系评价操作规程15692 XXX-SOP-V5-18 药品采购综合质量评审操作规程15893 XXX-SOP-V5-19工质量管理体系评审操作规程16094 作XXX-SOP-V5-20 药品召回、追回操作规程16295 操XXX-SOP-V5-21 第三方医药物流评审操作规程16496 作XXX-SOP-V5-22 药品退货操作规程16597 规XXX-SOP-V5-23 药品招商操作规程16698 程XXX-SOP-V5-24 首营资质交换操作规程16799 XXX-SOP-V5-25 不合格药品报告、报损、销毁操作规程169 100 XXX-SOP-V5-26 与第三方医药物流单据交接操作规程171文件名称:质量领导小组职责编号:XXX-ZZ-V5-01质量领导小组职责修订人:修订日期:年月日审核人:审核日期:年月日批准人:批准日期:年月日生效日期:年月日版本号:V5分发保管:各部门,各部门保管目的:明确质量领导小组职责,以利于其开展工作。
GSP内审机构和质量管理职责

*01711
质量管理部门应当组织验证、校准相关设施设备.
1。企业应当对温湿度自动监测系统进行验证,确认相关设施、设备及监测系统能够符合规定的设计标准和要求,并能安全、有效地正常运行和使用,药品在储存、运输过程中的质量安全;是□ 否□
2.质量管理部门负责组织仓储、运输等部门共同实施验证工作。是□ 否□
1。应建立质量负责人任命文件,规定是高层管理人员;是□ 否□
2。相关岗位设置、职责、质量文件和记录等应能体现质量负责人行使高层管理人员的权力;是□ 否□
3.质量负责人应独立履行职责,不得在其他企业兼职或在本企业兼职其他业务工作;是□ 否□
4.质量负责人在企业内部对药品质量管理应具有裁决权。是□ 否□
01717
质量管理部门应当协助开展质量管理教育和培训。
质量管理部门应当协助其他部门开展质量管理教育和培训.是□ 否□
01718
质量管理部门应当承担其他应当由质量管理部门履行的职责。
其他应当由质量管理部门履行的职责。是□ 否□
内审组长:检查人员签字:
01712
质量管理部门应当负责药品召回的管理。
1。质量管理部门应当负责药品召回的管理;是□ 否□
2。应建立药品召回记录.是□ 否□
01713
质量管理部门应当负责药品不良反应的报告.
1.质量管理部门应当负责药品不良反应的报告,并建立相应记录。是□ 否□
2。质量管理部门应当指定专人负责药品不良反应的收集和报告,并有相应的任命书。是□ 否□
企业质量管理部门的职责不得由其他部门及人员履行。
1。质量管理文件中应明确规定:其他部门及人员不得代其行使质量职权;
是□ 否□
