2020年高考化学二轮复习讲义:第八讲 硅及其化合物
高考化学 硅及其化合物-无机非金属材料课件 人教版

• ①SiO2+2NaOH===Na2SiO3+
H2O( )
• ②SiO2+Na2CO3 Na2SiO3+CO2↑( )
• ③SiO2+2C
Si+2CO↑( )
• ④SiO2+3C
SiC+2CO↑( )
• ⑤SiO2+4HF===SiF4↑+2H2O( )
• A.作为玻璃的成分被消耗而使玻璃被腐 蚀
• 答案:A
• 1.新型无机非金属材料的特性
• (1)能承受高温,强度高,例如:氮化硅 陶瓷在1200℃左右的高温下,仍具有很 高的硬度,可用来制造汽轮机叶片、轴 承、永久性模具等。
• (2)具有电学特性,一些新型无机非金属 材料可以作绝缘体,有的可作半导体、 导体、超导体等,一些绝缘性材料常被 用于做集成电路的基板。
• B.氧化性 • C.酸性氧化物的通性 • D.将挥发性的酸酐从其盐中置换出来 • E.未参加氧化还原反应
• 解析:本题全面考查SiO2的性质,将所 给选项结合实际一一对应查找。A用来雕 刻玻璃,应有氢氟酸(HF)参与反应;B中 强氧化性是指反应物SiO2中Si得电子, 化合价降低;D是挥发性酸酐,应为CO2 而不是CO;表现酸性氧化物的通性是指 SiO2与碱的反应。
硅及其化合物 无机非金属材 料
• 1.硅和二氧化硅的结构及性质。 • 2.常见的硅酸盐及表示方法。 • 3.硅酸盐材料。 • 4.新型无机非金属材料。
• ●基础知识回顾 • 一、硅 • 1.存在 • 地壳中含量仅次于氧,全部以化合 态的形
式存在。正四面体型 • 2.晶体结构 原子 •氟气、氢氟酸、强碱的空间网状结构,属于 半导体
1 ∶ 2 的原子个数比组成的原子晶体,故 SiO2晶体中不存在“SiO2”分子。
2020年高考化学二轮复习讲义:第八讲 硅及其化合物

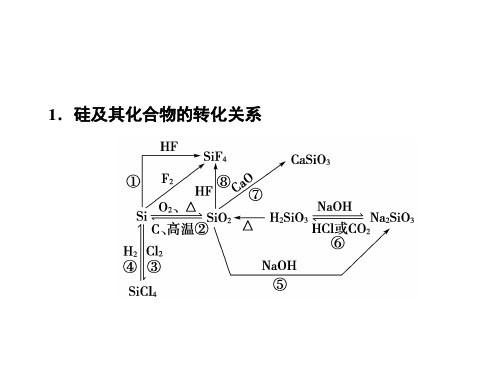
第八讲硅及其化合物测试内容测试要求考情追踪1. 知道硅元素在自然界中以二氧化A 2014、2015(选) 硅及硅酸盐的形式存在,知道晶体硅是良好的半导体材料2. 了解硅单质的主要用途 B Ⅰ2012、2015(选)3. 了解二氧化硅与氢氟酸、碱性氧化B 2015(选)物、强碱等的反应1. 硅及二氧化硅二氧化物质硅硅存在形式物理性质化学性质用途2. 硅酸、硅酸盐和硅酸盐材料(1) 硅酸:溶于水,制备反应的化学方程式为。
(2) 硅酸钠:溶于水,水溶液俗称。
可用于制、、。
(3) 硅酸盐材料。
1. 二氧化硅可与氢氟酸发生反应:SiO2+4HF===SiF4↑+2H2O,氢氟酸常用于刻蚀玻璃。
2. 由于二氧化硅可与碱发生反应:SiO2+2NaOH===Na2SiO3+H2O,所以盛放碱性溶液的试剂瓶只能用橡胶塞。
3. 工业上制造普通玻璃的主要原料是纯碱、石英和石灰石,主要设备是玻璃熔炉。
主要原料熔化后发生反应,普通玻璃的成分是Na2SiO3、CaSiO3、SiO2。
4. 硅的制备。
粗硅的制备:SiO 2+2C=====高温Si +2CO ↑ 粗硅的提纯:Si ――→Cl 2SiCl 4――→H 2Si +HClSi +2Cl 2=====高温SiCl 4 SiCl 4+2H 2=====高温Si +4HCl5. 硅及其化合物之间的转化关系【例1】(2017届南师附中模拟)下列说法正确的是() A. 石英玻璃和普通玻璃成分相同B. 工艺师可用盐酸刻蚀玻璃制作工艺品C. 由石英砂制备单晶硅不涉及氧化还原反应D. Si 可用于信息存储,SiO 2可用于光纤通讯笔记:【例2】 (2017届无锡一中模拟)下列说法中,正确的是( )A. SiO 2溶于水显酸性B. CO 2通入水玻璃可以得到白色沉淀C. 由Na 2CO 3+SiO 2=====高温Na 2SiO 3+CO 2↑可知,硅酸的酸性比碳酸的酸性强D. SiO 2是酸性氧化物,它不溶于任何酸笔记:1. (2015年江苏省普通高中学业水平测试)手机芯片是一种在半导体材料上集合多种电子元器件的电路模块。
2020-2021高考化学硅及其化合物推断题的综合热点考点难点附详细答案

2020-2021高考化学硅及其化合物推断题的综合热点考点难点附详细答案一、硅及其化合物1.有A、B、C三种不溶于水的固体。
A是某元素的一种单质,它在氧气中完全燃烧得到一种无色气体,此气体能使澄清石灰水变浑浊,另外测得这种气体密度为同温、同压下氧气密度的1.375倍。
B固体能溶于热氢氧化钠溶液,再往所得溶液中加入过量盐酸时,析出白色胶状沉淀D。
此沉淀干燥后,成为不溶于水的白色粉末,这是一种比碳酸酸性还弱的酸。
将B与石灰石、纯碱按比例混合加热得到C,C在高温时软化,无固定熔点。
(1)根据以上事实,形成单质A的元素名称为__, C的名称为__。
(2)B固体溶于热氢氧化钠溶液的化学方程式是__。
(3)生成白色胶状沉淀D的化学方程式是__。
(4)由B制取C的化学方程式是__。
【答案】碳普通玻璃 SiO2+2NaOH=Na2SiO3+H2O Na2SiO3+2HCl=2NaCl+H2SiO3↓Na2CO3+SiO2Na2SiO3+CO2↑、CaCO3+SiO2CaSiO3+CO2↑【解析】【分析】A是某元素的一种单质,它在氧气中完全燃烧得到一种无色气体,此气体能使澄清石灰水变浑浊,这种气体为氧气密度的1.375倍(标准状况)的气体,则该气体的相对分子质量=32×1.375=44,应是CO2,所以A为碳,B固体能溶于热氢氧化钠溶液,再往所得溶液中加入过量盐酸时,析出白色胶状沉淀,此沉淀干燥后,成为不溶于水的白色粉末,这是一种比碳酸酸性还弱的酸,则该酸应为硅酸,将B与石灰石、纯碱按比例混合加热得到C,C 在高温时软化,无固定熔点,该反应为工业制普通玻璃的反应,所以B为SiO2,C为普通玻璃,据此答题。
【详解】A燃烧后生成的气体的相对分子质量为32×1.375=44,且能使澄清石灰水变浑浊,该气体是二氧化碳,则A为碳元素的一种单质。
B物质能与氢氧化钠反应,且能继续与过量的盐酸反应生成一种比碳酸还弱的酸,则B为二氧化硅。
高中化学一轮复习讲义(解析版):硅及其化合物 无机非金属材料

硅及其化合物 无机非金属材料【学习目标】1. 硅及其化合物的性质及用途2. 常见的无机非金属材料◆感知高考1. [2020·浙江7月选考,24]35Ca SiO 是硅酸盐水泥的重要成分之一,其相关性质的说法不正确...的是( )A. 可发生反应:Δ3543232Ca SiO 4NH ClCaSiO 2CaCl 4NH 2H O +++↑+B. 具有吸水性,需要密封保存C. 能与2SO ,反应生成新盐D. 与足量盐酸作用,所得固体产物主要为2SiO【答案】D【解析】 A.Ca 3SiO 5与NH 4Cl 反应的方程式为:Ca 3SiO 5+4NH 4Cl Δ CaSiO 3+2CaCl 2+4NH 3↑+2H 2O ,A 正确;B.CaO 能与水反应,所以需要密封保存,B 正确;C.亚硫酸的酸性比硅酸强,当二氧化硫通入到Ca 3SiO 5溶液时,发生反应:3SO 2+H 2O+ Ca 3SiO 5=3 CaSO 3+H 2SiO 3,C 正确;D.盐酸的酸性比硅酸强,当盐酸与Ca 3SiO 5反应时,发生反应:6HCl+ Ca 3SiO 5=3CaCl 2+H 2SiO 3+2H 2O ,D 不正确;故仅D 选项符合题意。
2.[2018·天津]下图中反应①是制备SiH 4的一种方法,其副产物MgCl 2·6NH 3是优质的镁资源。
回答下列问题:(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。
反应②的必备条件是_______________。
上图中可以循环使用的物质有_______________。
硅及其化合物复习课件
(3)装置 B 的作用之一是观察 SO2 的生成速率,其中的液体 最好选择________。
a.蒸馏水 b.饱和 Na2SO3 溶液 c.饱和 NaHSO3 溶液 d.饱和 NaHCO3 溶液
实验中,为使 SO2 缓慢进入烧瓶 C,采用的操作是________。 已知反应(Ⅲ)相对较慢,则烧瓶 C 中反应达到终点的现象是
(4)Na2S3O3 和 Na2SO3 的存在对 SO24-的检验有干扰,要先除 去。根据题给信息,可先加入过量的稀盐酸将二者除去。
【答案】 (1)液柱高度保持不变 防止倒吸 NaOH(合理即 得分)
(2)2∶1 (3)c 控制滴加硫酸的速度(合理即得分) 溶液变澄清(或浑 浊消失) ad (4)取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤, 取滤液),滴加 BaCl2 溶液,若出现沉淀则说明含有 Na2SO4 杂质 (合理即得分)
(3)若生成 3 mol Na2S2O3,根据方程式的关系可知需要 3 mol S 和 3 mol Na2SO3;生成 3 mol S 需 2 mol H2S;而生成 2 mol H2S 需 2 mol Na2S 且同时生成 2 mol Na2SO3;故需要的 Na2S 为 2 mol、 Na2SO3 为 1 mol,其物质的量之比为 2∶1。
________。反应后期可用酒精灯适当加热烧瓶 A,实验室用酒精
灯加热时必须使用石棉网的仪器还有________。
a.烧杯
b.蒸发皿
c.试管
d.锥形瓶
(4)反应终止后,烧瓶 C 中的溶液经蒸发浓缩、冷却结晶即
可析出 Na2S2O3·5H2O,其中可能含有 Na2SO3、Na2SO4 等杂质。 利用所给试剂设计实验,检测产品中是否存在 Na2SO4,简要说
2020-2021高考化学硅及其化合物推断题的综合热点考点难点附答案解析

2020-2021高考化学硅及其化合物推断题的综合热点考点难点附答案解析一、硅及其化合物1.A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气。
请回答下列问题:(1)写出各物质的化学式:A________;B________;C________;D________;E________。
(2)写出反应①的化学方程式:______________________________________,该反应中氧化剂与还原剂的物质的量之比为________。
(3)写出反应④的离子方程式:______________________________________。
(4)写出反应⑤的离子方程式:______________________________________。
(5)H2CO3的酸性强于E的,请用离子方程式予以证明:________________________________。
【答案】SiO2 CaSiO3 Na2SiO3 Si H2SiO3 SiO2+2C Si+2CO↑ 1∶2 Si+2OH-+H2O=SiO32-+2H2↑ SiO32-+Ca2+=CaSiO3↓ SiO32-+CO2+H2O=H2SiO3↓+CO32-【解析】【分析】A、B、C、D、E五种物质中均含有同一种非金属元素,该元素(用R表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气,则可推知该元素为硅元素,根据题中各物质转化关系,结合硅及其化合物相关知识可知,A与焦碳高温下生成D,则A为SiO2,D为Si,C 为Na2SiO3,根据反应②或反应⑤都可推得B为CaSiO3,根据反应⑥推知E为H2SiO3。
【详解】(1)根据上面的分析可知,A为SiO2,B为CaSiO3,C为Na2SiO3,D为Si,E为H2SiO3;(2)反应①的化学方程式为SiO2+2C Si+2CO↑,根据方程式可知,该反应中氧化剂是个与还原剂碳的物质的量之比为1:2;(3)反应④的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑;(4)反应⑤的离子方程式为SiO32-+Ca2+=CaSiO3↓;(5)H2CO3的酸性强于H2SiO3,根据复分解反应的规律:强酸制取弱酸,则可以向Na2SiO3的水溶液中通入CO2气体,发生反应产生硅酸和碳酸钠,反应的离子方程式是:SiO32-+CO2+H2O=H2SiO3↓+CO32-。
人教课标版 高考专题复习:非金属及其化合物PPT

A、Fe2(SO4)3
C、KNO3
B、Na2CO3
D、FeSO4
下列关于浓硝酸和浓硫酸的叙述错误的是( A )。 A.都是常用的干燥剂 B.分别露置在空气中,容器内溶质的物质的量浓 度都降低 C.都可以储存于铝制槽罐中 D.和铜反应中都表现出强氧化性和强酸性
下列的各组离子能大量共存的是 A、Na+、Fe2+、、NO3-、H+ B、Ca2+、K+、Cl-、NO3C、Al3+、K+、OH-、NO3D、Na+、Ca2+、NH4+、OH( B )
D、硫元素的化合价都是+6价
为了除去镀在铝表面的铜镀层,可选用的 试剂是( B ) A、稀硝酸 C、浓硫酸 B、浓硝酸 D、浓盐酸
将铁屑溶于滴有KSCN溶液的过量盐酸后,再加 入下列物质,溶液呈红色的是(B D ) A、硫酸 B、氯水 C、氯化铜 D、硝酸锌
铜粉放入稀硫酸溶液中,加热后无明显现象 发生,当再加入下列一种物质后,铜粉的质量减 少,溶液呈蓝色,同时有气体逸出。加入的物质 是 ( C )
△
MnO2
+4H++2Cl-==Mn2++
Cl2↑+2H2O
还原剂、酸性
。 。
在此反应中,浓盐酸的作用是
用此法制得的氯气中常混有HCl气体和水蒸气,已知HCl 气体极易溶于水,氯气溶于水而难溶于饱和氯化钠溶液, 要制得干燥纯净的氯气,应将上述方法所制得的氯气依 次通过盛有 饱和食盐水 和 浓硫酸 的洗气瓶。
非金属及其化合物
一、硅及其化合物 1、硅 原子结构:+14
284
在地壳中含量仅次于氧,主要以氧化 存在形式: 物和硅酸盐形式存在。单质硅有晶体 和无定形两种。 主要性质: 灰黑色、熔点高、硬度大、有脆性、 半导体、性质不活泼 主要用途: 半导体材料、制光电池等
【2020高考化学考点剖析】考点18 硅及其化合物的特殊性(解析版)

考点18 硅及其化合物的特殊性化学学习有一条原则:抓住规律,记住特殊性,这样遇到问题才能思路清晰、逻辑严密,防止出现低级错误。
硅及其化合物有诸多特殊性质,掌握这些特性,对于理解硅及其化合物的知识十分重要。
1.(2019浙江4月选考)下列说法不正确...的是A.液氯可以储存在钢瓶中B.天然气的主要成分是甲烷的水合物C.天然石英和水晶的主要成分都是二氧化硅D.硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等【答案】B【解析】A.液氯就是液态的氯气,与钢瓶不反应,可以储存在钢瓶中,A项正确;B.天然气的主要成分是甲烷,可燃冰的主要成分是甲烷的水合物,B项错误;C.石英、水晶、硅石、沙子的主要成分均为二氧化硅,C项正确;D.硫在地壳中主要以硫化物、硫酸盐等形式存在,火山口处有硫单质,D项正确。
2.(2018浙江11月选考)下列说法不正确的是A.电解熔融氯化镁可制取金属镁B.电解饱和食盐水可制取氯气C.生产普通玻璃的主要原料为石灰石、纯碱和晶体硅D.接触法制硫酸的硫元素主要来源于硫黄或含硫矿石【答案】C【解析】A、制取金属镁时,由于镁的活泼性很强,故一般电解熔融的氯化镁制取金属镁,选项A正确;B、电解饱和食盐水生成氢氧化钠、氢气和氯气,可制取氯气,选项B正确;C、生产普通玻璃的主要原料为石灰石、纯碱和石英,选项C不正确;D、接触法制硫酸的硫元素主要来源于硫黄或含硫矿石,硫与氧气反应生成二氧化硫或煅烧硫铁矿生成二氧化硫,选项D正确。
答案选C。
3.(2017海南)分别将足量下列气体通入稀Na2S溶液中,可以使溶液变浑浊的是A.CO B.SO2C.HCl D.CO2【答案】B【解析】A、CO不与Na2S发生反应,因此没有沉淀产生,故A错误;B、SO2具有弱氧化性,与Na2S发生氧化还原反应,即SO2+2S2-+4H +3S↓+2H2O,故B正确;C、利用酸性强的制取酸性弱的,即发生2H++S2-H2S,没有沉淀产生,故C错误;D、不产生沉淀,故D错误。
人教版高三化学复习课件 硅及其化合物

用氢氟酸在玻璃上雕刻或写字能够得到花纹
③与Na2CO3 、CaCO3高温反应
SiO2 + Na2CO3 =高=温== Na2SiO3 + CO2 ↑
2019/9/20
6
[注]该反应用于玻璃制造工业;必须注意的 是:这个反应之所以能够发生并不是因为酸 性H2SiO3〉 H2CO3,也不是弱酸制强酸的特例
KCl (l)+ Na(l)=8=50=℃NaCl (l)+ K (g)
2019/9/20
7
5、用途
光导纤维 石英:耐高温化学仪器、
石英电子表石英钟 水晶:电子工业的重要部件、
感谢您下载包图网平台上提供的PPT作品,为了您和包图网以及原创作者的利益,请勿复制、传播、销售,否则将承担法律责任!包图网将对作品进 行维权,按照传播下载次数进行十倍的索取赔偿!
SiO2 +2C 高温 Si(粗硅)+2CO↑
(2)与氯反应:感谢您下载包图网平台上提供的PPT作品,为了您和包图网以及原创作者的利益,请勿复制、传播、销售,否则将承担法律责任!包图网将对作品进 行维权,按照传播下载次数进行十倍的索取赔偿! Si +2Cl2 = SiCl4 (温度为400~500℃)
Si + 2NaOH + H2O == Na2SiO3 +2H2 ↑
与氧气
点燃
Si + O2 ===SiO2
加热条件下: 与氢气
高温
Si + 2H2 ===SiH4
2019/9/20
与氯气
高温
Si + 2Cl2 ===SiCl4 3
四、硅的制备
(1)在工业上,用碳在高温下还原二氧化硅的方 法制得粗硅。
高三化学复习 硅及其化合物 无机非金属材料教案

高三化学复习硅及其化合物无机非金属材料教案【高考考点】1.硅和二氧化硅2.无机非金属材料3.硅的用途【知识要点】一.硅1.晶体硅的结构2.硅的存在和物理性质⑴存在:只以态存在,主要以和,在地壳中含量居第位。
⑵物理性质:晶体硅是一种色具有光泽,硬而脆的固体,熔沸点较高,能导电,是良好的材料。
3.化学性质:⑴与单质(O2、F2)反应⑵与酸(HF)反应⑶与强碱(如NaOH)溶液反应4.用途制造、、、5.工业制法二.二氧化硅1.晶体结构2.物理性质3.化学性质4.用途制造,,,,等。
三.硅酸硅的常见含氧酸有原硅酸、硅酸。
原硅酸是一种色溶于水的胶状物,易失水变为白色粉末状的硅酸(溶于水),硅酸在一定条件下继续失水可转变成。
硅酸是一种酸,酸性比碳酸还要。
实验室制取硅酸常用Na2SiO3(aq)与稀HCl (aq)或向Na2SiO3(aq)中通入CO2(g)(首先生成原硅酸)。
写出上述有关反应的化学方程式。
、四.硅酸盐硅酸钠 Na2SiO3(Na2O·SiO2)高岭石 Al2(Si2O5)(OH)4(Al2O3·2SiO2·2H2O)常见可溶性硅酸盐是硅酸钠,其水溶液俗名,是一种无色粘稠液体,是一种矿物胶,用作黏合剂,还可用作。
五.无机非金属材料1.传统无机非金属材料——硅酸盐材料硅酸盐工业是以为原料,经制成的。
如制造、、等产品的工业。
水泥、玻璃和陶瓷生产的有关比较2.新型无机非金属材料⑴新型无机非金属材料的特性主要有:①。
②具有特性③具有特性④具有⑵重要的新型无机非金属材料——高温结构陶瓷和光导纤维①高温结构陶瓷——、、②光导纤维【高考试题】1.下列物质的晶体中,不存在分子的是A.二氧化硅 B.二硫化碳 C.二氧化硫 D.二氧化碳2.下列物质属于原子晶体的化合物是A.金刚石 B.晶体硅 C.二氧化硅 D.干冰3.光纤是一种很好的通讯材料,制造光导纤维的主要原料是A.CaCO3 B.CaO C.SiO2 D.Na2CO34.固体熔化时必须破坏非极性共价键的是A.冰 B.晶体硅 C.溴 D.二氧化硅5.X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。
2020-2021高考化学硅及其化合物推断题的综合热点考点难点及答案解析

2020-2021高考化学硅及其化合物推断题的综合热点考点难点及答案解析一、硅及其化合物1.已知:甲、乙、丙、丁为常见化合物,A、B为单质,相互转化关系如图。
其中甲是天然气的主要成分。
回答下列问题:(1)丁物质的名称:______,丙物质的化学式:_________________________________________。
(2)检验化合物乙的化学方程式:___________________________________________________。
(3)试剂X可能的化学式:________、________(要求:所选物质类别不同)。
(4)通过分析表明:燃料充分燃烧的条件之一是______________________________。
(5)取变红溶液于试管中加热,观察到的现象有_______________________________________。
【答案】水 CO CO2+Ca(OH)2=CaCO3↓+H2O O2 CuO 充足的氧气红色溶液变成紫色,有气泡冒出【解析】【分析】甲是天然气的主要成分,则甲是甲烷,甲与A,B与A能燃烧,则A是氧气,丁电解生成A、B,则B是氢气,丁是水,乙与水加入紫色石蕊试液后溶液变红,则乙是二氧化碳,丙与乙可以相互转化,则丙是一氧化碳,据此分析解答。
【详解】(1)根据分析可知丁是水,丙是CO,故答案为:水;CO;(2)检验二氧化碳的方法是将气体通入澄清石灰水,反应方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;(3)由丙转化到乙,则试剂X可以是氧气,也可以是氧化铜等物质,所属的类别分别是单质和氧化物;故答案为:O2;CuO;(4)通过分析表明:燃料充分燃烧的条件之一是要有充足的氧气;故答案为:充足的氧气;(5)取变红溶液于试管中加热会发生碳酸分解的过程,故可以观察到的现象是红色溶液变成紫色,有气泡冒出;故答案为:红色溶液变成紫色,有气泡冒出。
2020-2021高考化学硅及其化合物推断题的综合复习附答案解析

2020-2021高考化学硅及其化合物推断题的综合复习附答案解析一、硅及其化合物1.在下列物质的转化关系中,A是一种固体单质,且常作半导体材料,E是一种白色沉淀,F是最轻的气体单质。
据此填写:(1)B的化学式是____________,目前在现代通迅方面B已被用作_____________主要原料。
(2)B和a溶液反应的离子方程式是_____________________。
(3)A和a溶液反应的离子方程式是_____________________。
(4)C和过量盐酸反应的离子方程式是____________________。
【答案】SiO2制光导纤维 SiO2+2OH-=SiO32-+H2O Si+2OH-+H2O=SiO32-+2H2↑SiO32-+2H+=H2SiO3↓【解析】【分析】A是一种固体单质,且常作半导体材料,则A是Si,所以B为SiO2,由图中转化关系可知E为H2SiO3,a为NaOH,C为Na2SiO3,D为H2O,由于 F是最轻的气体单质,则F为H2。
【详解】A是一种固体单质,且常作半导体材料,则A是Si,所以B为SiO2,由图中转化关系可知E为H2SiO3,a为NaOH,C为Na2SiO3,D为H2O,由于 F是最轻的气体单质,则F为H2,(1)B的化学式是SiO2,目前在现代通迅方面B已被用作光导纤维主要原料;(2)B和a溶液反应的离子方程式是SiO2+2OH-=SiO32-+H2O;(3)A和a溶液反应的离子方程式是Si+2OH-+H2O=SiO32-+2H2↑;(4)C和过量盐酸反应的离子方程式是SiO32-+2H+=H2SiO3↓。
2.下图中的每一方格表示相关的一种反应物或生成物。
其中B是一种单质,其余物质也都是含有B元素的化合物。
C是一种钠盐,E是C对应的酸,B的结构类似金刚石,D为氧化物。
请回答下列问题:(1)A、D、E的化学式分别为________、________、________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第八讲硅及其化合物测试内容测试要求考情追踪1. 知道硅元素在自然界中以二氧化硅及硅酸盐的形式存在,知道晶体硅是良好的半导体材料A 2014、2015(选)2. 了解硅单质的主要用途 B Ⅰ2012、2015(选)3. 了解二氧化硅与氢氟酸、碱性氧化物、强碱等的反应B 2015(选)1. 硅及二氧化硅物质硅二氧化硅存在形式物理性质化学性质用途2. 硅酸、硅酸盐和硅酸盐材料(1) 硅酸:溶于水,制备反应的化学方程式为。
(2) 硅酸钠:溶于水,水溶液俗称。
可用于制、、。
(3) 硅酸盐材料。
1. 二氧化硅可与氢氟酸发生反应:SiO2+4HF===SiF4↑+2H2O,氢氟酸常用于刻蚀玻璃。
2. 由于二氧化硅可与碱发生反应:SiO2+2NaOH===Na2SiO3+H2O,所以盛放碱性溶液的试剂瓶只能用橡胶塞。
3. 工业上制造普通玻璃的主要原料是纯碱、石英和石灰石,主要设备是玻璃熔炉。
主要原料熔化后发生反应,普通玻璃的成分是Na2SiO3、CaSiO3、SiO2。
4. 硅的制备。
粗硅的制备:SiO 2+2C=====高温Si +2CO ↑ 粗硅的提纯:Si ――→Cl 2SiCl 4――→H 2Si +HClSi +2Cl 2=====高温SiCl 4 SiCl 4+2H 2=====高温Si +4HCl 5. 硅及其化合物之间的转化关系【例1】(2017届南师附中模拟)下列说法正确的是( ) A. 石英玻璃和普通玻璃成分相同 B. 工艺师可用盐酸刻蚀玻璃制作工艺品 C. 由石英砂制备单晶硅不涉及氧化还原反应 D. Si 可用于信息存储,SiO 2可用于光纤通讯笔记:【例2】 (2017届无锡一中模拟)下列说法中,正确的是( ) A. SiO 2溶于水显酸性B. CO 2通入水玻璃可以得到白色沉淀C. 由Na 2CO 3+SiO 2=====高温Na 2SiO 3+CO 2↑可知,硅酸的酸性比碳酸的酸性强D. SiO 2是酸性氧化物,它不溶于任何酸笔记:1. (2015年江苏省普通高中学业水平测试)手机芯片是一种在半导体材料上集合多种电子元器件的电路模块。
下列可用作半导体材料的是()A. 铝B. 硅C. 碳D. 铁2. (2015年江苏省普通高中学业水平测试)实验室制备硅酸的反应为Na2SiO3+2HCl===2NaCl+H2SiO3↓,该反应属于()A. 化合反应B. 分解反应C. 置换反应D. 复分解反应高温3. (2014年江苏省普通高中学业水平测试)反应SiCl4+2H2===== Si(纯)+4HCl可用于工业上制纯硅。
该反应属于()A. 化合反应B. 复分解反应C. 置换反应D. 分解反应4. (2014年江苏省普通高中学业水平测试)下列物质属于硅酸盐产品的是()A. 尼龙绳B. 保鲜膜C. 青花瓷D. 金刚石5. (2012年江苏省普通高中学业水平测试)下列有关物质用途的说法,错误的是()A. 过氧化钠可用作潜艇里氧气的来源B. 单质硅是光导纤维的主要成分C. 乙醇可用作燃料D. 食醋可用于清除暖水瓶中的水垢 6. (2011年江苏省普通高中学业水平测试)制太阳能电池需要高纯硅,工业上用粗硅制高纯硅可通过以下反应实现:①Si +3HCl(g)=====300℃SiHCl 3(g)+H 2;②SiHCl 3(g)+H 2=====900℃Si +3HCl(g)。
对上述两个反应的叙述错误的是( ) A. 都是置换反应 B. 都是氧化还原反应 C. 反应中硅元素都被还原 D. 都不是离子反应1. (2018届扬州市第二次模拟测试)紫水晶在西方国家代表着“爱的守护石”,其主要成分SiO 2属于( )A. 碱性氧化物B. 酸性氧化物C. 碱D. 盐2. (2018届徐州市第一次模拟测试)如今人们已经步入“4G”时代,以光导纤维为基础的高速信息通道尤为重要。
制造光导纤维的材料是( )A. 铜合金B. 橡胶C. 聚乙烯D. 二氧化硅3. (2018届南京市模拟测试)水能参与很多化学反应。
下列物质不能与水反应的是( )A. NaB. Cl 2C. CaOD. SiO 24. (2018届南京市金陵中学模拟测试)下列物质间的转化不能通过一步化学反应实现的是( )A. Fe →FeCl 3B. SiO 2→H 2SiO 3C. NO 2→NOD. Na →Na 2O 25. (2018届南京市模拟测试)下列物质的制备正确的是()A. 蛋白质水解可得葡萄糖B. 二氧化锰和稀盐酸混合加热可得氯气C. 硅酸钠溶液中滴加盐酸可得硅酸D. 硫酸铝溶液与过量的氢氧化钠溶液反应可得氢氧化铝6. (2017届南京市模拟)硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1) 下列物质不属于硅酸盐的是(填字母)。
A. 陶瓷B. 玻璃C. 水泥D. 生石灰(2) SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为,工艺师常用(填物质名称)来雕刻玻璃。
(3) 用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作。
Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是(填字母)。
A. 普通玻璃坩埚B. 石英玻璃坩埚C. 氧化铝坩埚D. 铁坩埚高温Si+2CO↑制备硅单质,(4) 工业上常利用反应2C+SiO2=====该反应中所含元素化合价升高的物质是(填化学式,下同),氧化剂是。
7. (2017届苏州中学模拟)如图所示:A是一种固体单质,B的晶体是一种立体网状结构,E是一种白色沉淀,请回答下列问题:(1) 写出B的化学式:。
(2) 写出C―→E的离子方程式:。
(3) 写出B与a溶液反应的离子方程式:。
第八讲硅及其化合物知识扫描1.物质硅二氧化硅存在形式自然界中均是化合态,可制成晶体硅和无定形硅硅石、石英、玛瑙、硅藻土物理性质熔沸点高、硬度大、有金属光泽的灰黑色固体,良好的半导体熔沸点高、硬度大、难溶于水化学性质a. 常温下除氟气、氢氟酸和强碱外,与其他物质都不反应Si+2F2===SiF4Si+4HF ===SiF4↑+2H2↑Si+2NaOH+H2O===Na2SiO3+2H2↑b .一定条件下与氧气、氯气等反应:Si+O2=====△SiO2Si+2Cl2 =====△SiCl4a. 常温下除氢氟酸和强碱外,与其他物质都不反应SiO2+4HF===SiF4↑+2H2O(刻蚀玻璃)SiO2+2NaOH ===Na2SiO3+H2O(盛放碱性溶液的试剂瓶只能用橡胶塞)b. 高温下二氧化硅与金属氧化物反应:SiO2 +CaO =====高温CaSiO3用途制半导体材料制耐火材料,如坩埚;制作饰品,如水晶项链、石英表等;光导纤维等2. (1) 不Na2SiO3+2HCl===2NaCl+H2SiO3↓(2) 可水玻璃硅胶防火剂防腐剂(3)硅酸盐材料玻璃水泥陶瓷原料纯碱、石灰石、石英黏土、石灰石、石膏(调节水泥凝结时间)黏土设备玻璃熔炉水泥回转窑—反应SiO2+CaCO3=====高温CaSiO3+CO2↑SiO2+Na2CO3=====高温Na2SiO3+CO2↑复杂的物理、化学变化—成分Na2SiO3、CaSiO3、SiO23CaO·SiO2, 2CaO·SiO2,3CaO·Al2O3硅酸盐典例分析【例1】D解析:石英玻璃成分是二氧化硅,普通玻璃成分是硅酸钠、硅酸钙和二氧化硅,A项错误。
工艺师可用氢氟酸而不是用盐酸刻蚀玻璃制作工艺品,发生的反应为SiO 2+4HF===SiF 4↑+2H 2O ,B 项错误。
由石英砂制备单晶硅主要反应有:①SiO 2+2C=====高温Si +2CO ↑;②Si +2Cl 2=====高温SiCl 4;③SiCl 4+2H 2=====高温Si +4HCl ,这三个反应均为氧化还原反应,C 项错误。
Si 可用于信息存储,SiO 2可用于光纤通讯,D 项正确。
点拨导引:由石英砂制备单晶硅,反应①制得粗硅,通过反应②③进一步得到高纯硅。
【例2】 B 解析:SiO 2不溶于水,也不与H 2O 反应,所以水溶液不显酸性。
H 2CO 3的酸性强于H 2SiO 3,所以发生反应:Na 2SiO 3+CO 2+H 2O===Na 2CO 3+H 2SiO 3↓。
Na 2CO 3与SiO 2的反应之所以能发生是因为反应是在高温、无水条件下进行的,反应后生成的CO 2脱离反应体系。
SiO 2虽为酸性氧化物,但是它可与氢氟酸反应。
点拨导引:强酸制弱酸规律适用于溶液中的酸与盐之间的复分解反应,而反应Na 2CO 3+SiO 2=====高温Na 2SiO 3+CO 2↑则是在高温下进行的。
真题荟萃1. B2. D3. C4. C5. B6. C 仿真体验1. B2. D3. D4. B5. C6. (1) D(2) SiO 2+2NaOH===Na 2SiO 3+H 2O 氢氟酸 (3) 防火剂 D (4) C SiO 27. (1) SiO2(2) SiO2-3+2H+===H2SiO3↓(3) SiO2+2OH-===SiO2-3+H2O。
