荧光定量 CR 方法 探针法 VS 染料法
荧光定量PCR办法探针法VS染料法

荧光定量PCR办法探针法VS染料法精⼼整理荧光定量PCR⽅法:探针法VS染料法?荧光定量PCR⼜称qPCR,是⼀项⾮常常见的分⼦⽣物学实验技术。
荧光定量PCR 荧光为基础对核酸进⾏定量分析,其应⽤⾮常⼴泛,可以⽤于检测基因的表达量(RNA 的丰度),验证表达谱芯⽚或转录组测序的数据,确定病原体的载量,对⽚段的拷贝数(CNV)进⾏分析,对基因进⾏分型等等。
⼤部分研究者主要的应⽤是对基因的表达量进⾏测定,其原理为通过监控反应体系中荧光强度的变化,记录检测荧光达到阈值时的循环数(Ct值)。
从理论上说,起始模板量和Ct值密切相关,因此我们通过判读Ct值从⽽对样本进⾏定量。
在进⾏荧光定量PCR时,从技术和产品来说,我们往往会有许多选择,尤其是⽅法的选择,对最终结果的准确性⾄关重要。
荧光定量PCR从⽅法上来说可以分为染料法和探针法两种。
探针法?染料法⼀、染料法在国内,染料法⼀般采⽤DNA染料SYBRGreenⅠ,染料法使⽤简单,成本也相对较低,因此会有很多国内研究者会选择使⽤染料法进⾏后续实验。
在染料法荧光定量PCR实验中,染料能够与双链结合,从⽽发光,⽽在游离状态下,SYBRGreenI发出微弱的荧光。
所以,⼀个反应发出的全部荧光信号与出线的双链DNA量呈⽐列,且会随扩增产物的增加⽽增加。
但是染料法检测的是体系中的所有双链DNA,因此⼀些⾮特异性扩增或者引物⼆聚体的出现,会极⼤的影响真实结果的准确性。
为此,⼀些⼚商提供ROX作为内部荧光参考标准,⽤来校正背景,但是即便如此,染料法是否只有⼀种。
⼆、TaqMan探针法光探针。
FAM 或Hex扩增时(在延伸阶段),Taq酶的5'-3'链,就有⼀个荧光分⼦形成,实现了荧光信号的累积与PCR产物形成完全同步,这也就是探针法定量的原理。
探针法与染料法的最⼤区别在于,理论上探针法中的荧光信号只来源于⽬标序列,也就是不受⾮特异性扩增及引物⼆聚体的影响。
除此之外,⼈们还可以利⽤不同探针,在⼀个体系中使⽤不同的荧光标记同时检测多种指标,达到节省实验成本的⽬的。
实时荧光定量PCR技术

千里之行,始于足下。
Real-time PCR for mRNA quantitation一、原理实时荧光定量PCR技术是通过检测PCR产物中荧光讯号强度来达到定量PCR产物的目的,目前该技术已在动植物基因工程,微生物和医学领域中得到广泛应用。
实时定量PCR 包括探针法和染料法两种,探针法是利用与靶序列特异杂交的探针来指示扩增产物的增强,特异性高,如Taq Man TM技术;染料法则是利用染料来指示扩增的增强,特异性相对较低,但简便易行。
染料法的原理是在PCR 反应体系中,参加过量荧光染料,荧光染料特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的染料分子不会发射任何荧光信号,从而保证荧光信号的增强与PCR产物的增强彻低同步。
荧光染料发射出的荧光讯号强度与DNA 产量成正比,检测PCR 过程中的荧光讯号便可得知靶序列初始浓度,从而达到定量目的。
目前染料法实时荧光定量PCR主要使用的是美国Molecular Probes 公司的SYBR Green 1 和SYBR Gold 染料。
二、实验步骤一)、单链cDNA 摸板的合成(参照相关资料)二)、Real-time PCR操作主意(TIANGEN 公司RealMasterMix(SYBR Green) PCR Kit)1、20×SYBR Green solution 在室温下平衡并彻底混匀。
2、将125μL 20×SYBR Green solution 参加至1.0 ml 2.5×ReaMasterMix 中并轻轻混匀。
3、照表1决定多个PCR反应混合物并分装到各个PCR管中。
4、将PCR管放入热循环仪并启动循环程序(表2)。
三、计算在定量PCR中,需要经过数个循环后荧光信号才干够被检测到。
荧光域值的缺省设置是3-15 个循环的荧光信号的标准偏差的10 倍。
在实际操作中普通以前15个循环的荧光信号作为荧光本底信号。
荧光定量PCR中一个关键的数据是“Ct(threshold cycle)值”,其中“t”是Threshold ,即PCR管内荧光超过本底(达到可检测水平)时的临界数值;第 1 页/共 3 页朽木易折,金石可镂。
荧光定量PCR中探针法与染料法的区别

荧光定量PCR中探针法与染料法的区别:一、荧光定量PCR中探针法与染料法的描述:1.荧光定量PCR探针法:探针法即除了引物外另外设置一个探针,在探针的两端分别带上发光集团和淬灭集团,这个时候,两个平衡不发光,但是当DNA通过引物合成的时候,探针被折断,释放出发光集团和淬灭集团,两个距离较远,发光集团产生荧光,被机器收集到信号,从而检测基因的量2、荧光定量PCR SYBR Green染料法:染料能够与双链结合,当PCR扩增的时候,染料结合到D NA上,从而发光,单个的染料不发光,这样就能收集到信号,我们可以看出,染料法特异性不强,只要是双链的DNA都回结合发光。
二、荧光定量PCR中探针法与染料法的优缺点1、探针法通过探针可以增加反应收集信号的特异性,只有探针结合的片段上发生扩增才能收集到信号,能够用多重体系反应的方法,能够预测和提前进行反应条件的优化,缺点是要合成探针,成本高2、染料法经济实惠,可以做溶解曲线,分析全部PCR产物的T M值,缺点就是特异性没有探针法好【分享】定量pcr仪选则宝典:各自精彩的选择如何选择合适的定量PCR仪定量P CR仪主要由两部分组成,一个是PCR系统,一个是荧光检测系统。
选择定量PC R仪的关键——由于定量PC R必需借助样本和标准品之间的对比来实现定量的,对于定量PCR系统来说,重要的参数除了传统PCR的温控精确性、升降温速度等等,更重要的还在于样品孔之间的均一性,以避免微小的差别被指数级放大。
至于荧光检测系统,多色多通道检测是当今的主流趋势——仪器的激发通道越多,仪器适用的荧光素种类越多,仪器适用范围就越宽;多通道指可同时检测一个样品中的多种荧光,仪器就可以同时检测单管内多模版或者内标+样品,通道越多,仪器适用范围越宽、性能就更强大。
荧光定量PCR中探针法与染料法的区别

荧光定量PCR中探针法与染料法的区别:一、荧光定量PCR中探针法与染料法的描述:1.荧光定量PCR探针法:探针法即除了引物外另外设置一个探针,在探针的两端分别带上发光集团和淬灭集团,这个时候,两个平衡不发光,但是当DNA 通过引物合成的时候,探针被折断,释放出发光集团和淬灭集团,两个距离较远,发光集团产生荧光,被机器收集到信号,从而检测基因的量2、荧光定量PCR SYBR Green 染料法:染料能够与双链结合,当PCR扩增的时候,染料结合到DNA上,从而发光,单个的染料不发光,这样就能收集到信号,我们可以看出,染料法特异性不强,只要是双链的DNA都回结合发光。
二、荧光定量PCR中探针法与染料法的优缺点1、探针法通过探针可以增加反应收集信号的特异性,只有探针结合的片段上发生扩增才能收集到信号,能够用多重体系反应的方法,能够预测和提前进行反应条件的优化,缺点是要合成探针,成本高2、染料法经济实惠,可以做溶解曲线,分析全部PCR产物的TM值,缺点就是特异性没有探针法好【分享】定量pcr仪选则宝典:各自精彩的选择如何选择合适的定量PCR仪定量PCR仪主要由两部分组成,一个是PCR系统,一个是荧光检测系统。
选择定量PCR仪的关键——由于定量PCR必需借助样本和标准品之间的对比来实现定量的,对于定量PCR系统来说,重要的参数除了传统PCR的温控精确性、升降温速度等等,更重要的还在于样品孔之间的均一性,以避免微小的差别被指数级放大。
至于荧光检测系统,多色多通道检测是当今的主流趋势——仪器的激发通道越多,仪器适用的荧光素种类越多,仪器适用范围就越宽;多通道指可同时检测一个样品中的多种荧光,仪器就可以同时检测单管内多模版或者内标+样品,通道越多,仪器适用范围越宽、性能就更强大。
荧光检测系统主要包括激发光源和检测器。
激发光源有卤钨灯光源、氩离子激光器、发光二极管LED光源,前者可配多色滤光镜实现不同激发波长,而单色发光二极管LED价格低、能耗少、寿命长,不过因为是单色,需要不同的LED才能更好地实现不同激发波长。
1、试述荧光定量pcr技术的原理、方法、注意事项及其在临床与科研中的应用

1、试述荧光定量pcr技术的原理、方法、注意事项及其在临床与科研中的应用
荧光定量PCR是一种在PCR反应过程中,通过荧光信号的检测来对PCR产物进行实时定量分析的技术。
1. 原理:
荧光定量PCR利用荧光染料或者荧光探针,标记扩增过程中的每一个循环的产物,这些荧光标记的产物在激发光的作用下会发出荧光。
随着反应的进行,PCR产物不断累积,荧光信号也随之增强。
通过对荧光信号的实时监测,可以推断出样本中起始模板的数量。
2. 方法:
主要方法包括探针法、SYBR Green I染料法和分子信标法等。
探针法使用与目标序列特异性结合的荧光探针来标记PCR产物。
SYBR Green I染料法则是利用染料与双链DNA的结合特性,将染料添加到反应体系中,随着PCR产物的增加,染料的荧光信号也增强。
3. 注意事项:
荧光定量PCR对样品纯度要求较高,应避免杂质的干扰。
反应体系中的成分和浓度需要精确控制,以确保实验结果的准确性。
荧光定量PCR的结果解读需要参考标准曲线,以确定未知样本中的目标序列数量。
4. 在临床与科研中的应用:
在临床应用中,荧光定量PCR被广泛用于病原体检测、基因突变分析、遗传病诊断以及癌症研究等。
例如,用于检测病毒如HIV、HBV等的载量,或者检测癌症相关基因的表达水平。
在科研领域,荧光定量PCR可用于基因表达分析、基因组学和表观遗传学研究中。
例如,比较不同组织或细胞类型的基因表达差异,或者研究表观遗传修饰对基因表达的影响。
总的来说,荧光定量PCR技术是一种高灵敏度、高特异性的核酸定量分析方法,对于临床诊断和科学研究具有重要意义。
实时荧光定量PCR原理与分析方法

实时荧光定量PCR原理与分析方法实时荧光定量PCR(qPCR)是一种基于PCR技术的DNA定量方法,可以在实时反应过程中实时监测PCR产物的累积情况。
与传统的终点PCR相比,qPCR具有更高的灵敏度和准确性,可以定量检测非常低浓度的目标DNA。
实时荧光定量PCR的原理是利用荧光染料与PCR产物结合发出荧光信号,通过监测荧光信号的强度来测定PCR产物的数量。
qPCR有两种常用的检测方法:SYBR Green I染料法和探针法(如TaqMan探针法)。
SYBR Green I染料法是一种简单而常用的qPCR检测方法。
SYBR Green I是一种DNA结合荧光染料,在PCR反应过程中会与PCR产物的DNA结合,从而产生荧光信号。
这种方法的优点是简便、经济,但缺点是非特异性,可能产生假阳性结果。
探针法是一种更为特异和准确的定量PCR方法。
在这种方法中,需要设计一对特异性引物和一个包含荧光探针的引物。
在PCR反应过程中,引物与目标DNA特异性结合,探针结合在引物的靶区上,当PCR反应进行到延伸阶段时,Taq聚合酶会切割探针上的荧光标记,导致断裂,这样就分离出信号的发射荧光信号。
探针法具有高特异性和准确性,能够避免假阳性结果。
无论是SYBR Green I染料法还是探针法,实时荧光定量PCR的分析方法都是通过构建标准曲线并计算目标DNA的模板数量来定量分析样品中的目标物质。
首先,需要用已知浓度的目标DNA制备标准品,根据不同浓度标准品的CT值(荧光信号阈值)绘制标准曲线。
然后,将样品DNA与引物一起进行PCR扩增反应,监测荧光信号强度并记录CT值。
利用标准曲线可以计算出样品中目标物质的浓度。
实时荧光定量PCR技术原理

实时荧光定量PCR技术原理一、PCR反应:PCR反应是qPCR的关键步骤,它利用DNA聚合酶酶及其附加的DNA 引物扩增靶序列,产生大量特异性放大的DNA片段。
PCR的过程包括三个主要阶段:变性、退火和扩增。
1. 变性(Denaturation):在94-96℃的高温下,DNA双链解旋为两条单链,使其变性成为模板。
2. 退火(Annealing):将反应体温降至40-65℃, DNA引物与目标序列的互补部分结合,引物与模板序列的退火温度由其碱基组成决定。
3. 扩增(Extension):将反应体温升至67-72℃,DNA聚合酶酶依托DNA引物的引导进行DNA链合成,合成一个新的DNA链。
PCR通过不断的循环变性、退火和扩增步骤,每一个循环的两倍增加靶序列的数量,从而迅速放大特定的DNA片段。
二、定量方法:实时荧光定量PCR具有准确、快速、高灵敏度和高特异性的特点,可以定量分析目标序列的初始数量。
qPCR主要通过引入荧光标记和检测体系监测PCR反应的进程,并根据监测到的荧光信号的强弱来确定目标序列的起始浓度。
常用的定量方法包括SYBR Green染料和探针法两种。
1. SYBR Green染料法:这是最常用的定量方法,它利用SYBR Green 染料与DNA结合发出荧光信号。
SYBR Green染料结合到PCR反应中的靶序列上,DNA双链解旋后,SYBR Green染料就可以与靶序列结合,并发出荧光信号。
荧光信号的增加与PCR反应进行的循环次数成正比,荧光信号的曲线由荧光分析仪实时记录,通过建立标准曲线或比较Ct值(Ct,Cycle Threshold,荧光阈值周期,即荧光信号超过背景噪音的最小反应周期数)来确定目标序列起始浓度。
2.探针法:探针法需要合成特异性的探针序列,包含荧光物质和有机磷酸盐类物质。
PCR反应中,探针与靶序列的互补部分结合,作为DNA聚合酶酶的模板,聚合酶在待测的DNA靶序列上进行链合成,荧光小分子物质与酶切开的探针结合发出荧光信号,荧光信号与目标序列的起始浓度成正比。
线粒体膜电位检测方法

线粒体膜电位检测方法线粒体膜电位是细胞内线粒体膜的电压差,是维持细胞内稳态的重要参数之一。
线粒体膜电位的变化与细胞内能量代谢、细胞凋亡等生物学过程密切相关,因此对线粒体膜电位的检测具有重要的生物学意义。
本文将介绍几种常用的线粒体膜电位检测方法,希望能够对相关研究工作者提供一定的参考。
1. 荧光探针法。
荧光探针法是一种常用的线粒体膜电位检测方法。
通过使用荧光探针染色细胞,荧光信号的变化可以反映线粒体膜电位的变化。
常用的线粒体膜电位荧光探针包括JC-1、TMRE等。
这些荧光探针在不同的线粒体膜电位下会发生荧光信号的变化,可以通过流式细胞仪或荧光显微镜来检测和分析线粒体膜电位的变化。
2. 膜电位敏感染料法。
膜电位敏感染料法是另一种常用的线粒体膜电位检测方法。
通过使用膜电位敏感染料,如Rhodamine 123等,可以对线粒体膜电位进行实时监测。
这些膜电位敏感染料可以在不同线粒体膜电位下发生荧光信号的变化,通过荧光显微镜或荧光酶标仪等设备可以对线粒体膜电位进行定量检测和分析。
3. 膜电位探针法。
膜电位探针法是一种新型的线粒体膜电位检测方法。
通过使用膜电位探针,如刚果红等,可以对线粒体膜电位进行高灵敏度的监测。
这些膜电位探针可以在不同线粒体膜电位下发生颜色的变化,通过比色法或光谱法可以对线粒体膜电位进行定量检测和分析。
4. 膜电位记录仪法。
膜电位记录仪法是一种直接记录线粒体膜电位变化的方法。
通过使用膜电位记录仪,可以实时监测线粒体膜电位的变化情况。
这种方法对线粒体膜电位的变化有较高的时间分辨率和灵敏度,可以对线粒体膜电位的动态变化进行准确的记录和分析。
总结。
以上介绍了几种常用的线粒体膜电位检测方法,包括荧光探针法、膜电位敏感染料法、膜电位探针法和膜电位记录仪法。
这些方法各有特点,可以根据具体的实验要求和设备条件选择合适的方法进行线粒体膜电位的检测。
希望本文对相关研究工作者有所帮助,促进线粒体膜电位的研究和应用。
荧光标记的染料法和探针法

荧光标记的染料法和探针法荧光标记的染料法和探针法,听起来是不是有点晦涩难懂?但其实说白了,这就是两种非常有趣、非常有用的实验方法,专门用来“追踪”和“观察”细胞或者分子里面的神奇世界。
要是用大家能听懂的语言解释,就是这些方法让我们能看到一些平时眼睛看不见的小东西——细胞里发生了什么,某个特定的分子在不在,甚至它们是不是还在忙着做着一些复杂的反应。
就好像你能用一个特殊的眼镜,看清楚别人眼中看不到的东西一样。
首先说到“荧光标记的染料法”,它其实就是利用一些能发光的染料来做标记,这些染料特别神奇,吸收光之后,自己会发出不同颜色的光。
你可以想象这些染料就像是一只会发光的小螃蟹,它们一碰到特定的东西,就会发出五光十色的亮光,瞬间把目标引入了你的视野。
这些染料就像是“指路明灯”,你可以用它们标记细胞的特定区域,或者是细胞里特定的分子,然后利用显微镜什么的观察到它们的样子。
比如说,我们研究一种新的药物效果,怎么知道药物是不是成功作用到细胞了?就可以把药物和一些荧光染料结合在一起,看看药物是不是在细胞里亮了起来。
这样一来,研究人员就能通过“光芒”看到药物的“到达现场”,不再是靠猜和推测了。
荧光染料法有个最大好处,那就是它能让你看得非常清楚,而且时间上也挺灵活,你可以随时观察标记的分子,看看它们是如何随着时间的推移发生变化。
你还能标记不同的东西,用不同颜色的荧光染料,看看它们是怎么“同场竞技”的。
这就像是你在看一场盛大的舞会,荧光染料们就像是舞池里的小明星,每一个都穿着不同颜色的闪亮衣服,光芒四射,想不注意都难。
不过呢,染料法虽然好,但是也有一些“小毛病”。
染料并不是永远稳定的,它们可能会因为实验条件变化,发出的光不稳定,甚至可能“耗尽电力”——就是说发光时间变短或者干脆不发光了。
那时候你可能就需要换一个新染料,或者调整实验条件,调皮的小染料可不好对付呢。
接着说说“探针法”,这个听起来是不是也有点像是间谍电影里的那种秘密武器?其实说白了,探针法就是用一些非常特殊的分子,去“探测”细胞或者分子里的某些东西。
荧光定量PCR中探针法与染料法的区别

荧光定量PCR中探针法与染料法的区别:一、荧光定量PCR中探针法与染料法的描述:1.荧光定量PCR探针法:探针法即除了引物外另外设置一个探针,在探针的两端分别带上发光集团和淬灭集团,这个时候,两个平衡不发光,但是当DNA 通过引物合成的时候,探针被折断,释放出发光集团和淬灭集团,两个距离较远,发光集团产生荧光,被机器收集到信号,从而检测基因的量2、荧光定量PCR SYBR Green 染料法:染料能够与双链结合,当PCR扩增的时候,染料结合到DNA上,从而发光,单个的染料不发光,这样就能收集到信号,我们可以看出,染料法特异性不强,只要是双链的DNA都回结合发光。
二、荧光定量PCR中探针法与染料法的优缺点1、探针法通过探针可以增加反应收集信号的特异性,只有探针结合的片段上发生扩增才能收集到信号,能够用多重体系反应的方法,能够预测和提前进行反应条件的优化,缺点是要合成探针,成本高2、染料法经济实惠,可以做溶解曲线,分析全部PCR产物的TM值,缺点就是特异性没有探针法好【分享】定量pcr仪选则宝典:各自精彩的选择如何选择合适的定量PCR仪定量PCR仪主要由两部分组成,一个是PCR系统,一个是荧光检测系统。
选择定量PCR仪的关键——由于定量PCR必需借助样本和标准品之间的对比来实现定量的,对于定量PCR系统来说,重要的参数除了传统PCR的温控精确性、升降温速度等等,更重要的还在于样品孔之间的均一性,以避免微小的差别被指数级放大。
至于荧光检测系统,多色多通道检测是当今的主流趋势——仪器的激发通道越多,仪器适用的荧光素种类越多,仪器适用范围就越宽;多通道指可同时检测一个样品中的多种荧光,仪器就可以同时检测单管内多模版或者内标+样品,通道越多,仪器适用范围越宽、性能就更强大。
荧光检测系统主要包括激发光源和检测器。
激发光源有卤钨灯光源、氩离子激光器、发光二极管LED光源,前者可配多色滤光镜实现不同激发波长,而单色发光二极管LED价格低、能耗少、寿命长,不过因为是单色,需要不同的LED才能更好地实现不同激发波长。
染料法和探针法荧光定量PCR(RT-qPCR)的优缺点比较

染料法和探针法荧光定量PCR(RT-qPCR)的优缺点比较一、荧光染料法(SYBR Green)其原理是:在PCR反应体系中加入过量荧光染料,DNA扩增的过程中,荧光染料特异性地掺入DNA双链,发射荧光信号,随着反应的进行,荧光强度逐渐增强,并且可以实时测量。
如果你要扩增你的目标样品40个循环,在最后一个循环结束时检测到的荧光会比在第10个循环测得的荧光强很多。
优点:1、成本较低,适合大规模的实验。
2、在实验设计阶段非常省时,因为它只需要合适的引物设计。
缺点:1、特异性不是很高。
染料可以插入任何双链DNA,包括引物二聚物和非特异性产物。
2、如果引物二聚体存在或者产物受到污染,得到的结果会不可靠。
3、更容易与低丰度的目标产生非特异性荧光。
需要更多的时间进行结果分析。
二、寡核苷酸探针(Taqman)这种方法涉及使用荧光标记的寡核苷酸(短DNA分子),探针通常在5 端和3 端都被标记。
在探针的5’端有报告基团,3’端设计淬灭基团,当报告基团接近淬灭基团时,不会检测到荧光信号。
RT-qPCR反应时,寡核苷酸两个基团分离,即可检测到荧光信号,并与PCR产物同步。
使用这种方法的荧光检测依赖于两个过程:1)引物与目标序列的结合(2)探针与引物下游互补序列的结合。
优点:1、更有可能只放大所需的产物,由于引物和探针的结合具有特异性。
2、不需要解离曲线,只有探针与正确的目的序列结合时才能检测到荧光。
3、由于具有特异性,数据更可靠。
4、数据分析时节省时间。
缺点:1、需要大规模实验时耗费成本高。
2、需要更长的时间来设计实验,因为需要好的引物和探针。
总的来说,这两种荧光检测方法都很有效,但对于你的具体实验,可以选择适合的方法。
染料法和探针法的原理

染料法和探针法的原理哎呀,说起染料法和探针法,这俩家伙可真是生物实验里的好帮手。
不过,别急,我可不会跟你讲那些枯燥的科学术语,咱们就像朋友一样,边喝着咖啡边聊聊。
先说说染料法吧。
这玩意儿,其实就是给细胞上色,让它们在显微镜下变得五颜六色,好让我们这些肉眼凡胎能看清楚细胞里的各种结构。
想象一下,你手里拿着一支彩笔,对着一张白纸,想画啥就画啥。
染料法也是这样,我们用不同的染料,就能标记细胞里的不同部位。
比如,我们用一种叫“苏木精”的染料,它就特别爱和细胞核里的DNA亲热,一涂上去,细胞核就变得蓝汪汪的。
这就像是你给一张白纸画了个大大的蓝色圆圈,一眼就能看出来。
然后是探针法,这个就更神奇了。
你可以把它想象成一种特殊的“钓鱼”技术。
我们用一种叫做“探针”的东西,它就像是鱼钩上的诱饵,专门吸引细胞里的特定分子。
比如说,我们想要找到细胞里的某种特定的RNA,我们就做一个和这种RNA能配对的探针。
这就像是你把一个特制的鱼饵扔进水里,只有那种特定的鱼才会上钩。
一旦探针和目标分子配对成功,我们就能通过一些化学反应让这个位置发光或者变色,这样在显微镜下就能看到那些特定的分子在哪里了。
记得有一次,我在实验室里做实验,要用染料法来观察细胞分裂。
我小心翼翼地把染料滴在载玻片上,然后盖上盖玻片。
那时候,我的心情就像是在等待一个魔术揭晓一样,既紧张又兴奋。
我把载玻片放到显微镜下,调整好焦距,哇塞,那些细胞核一个个蓝得发亮,就像是夜空中最亮的星星。
我看着它们,心里想,这些小家伙们每天都在进行着这么奇妙的变化,而我们通过染料法,就能窥探到这个秘密。
至于探针法,那次我是为了检测一种罕见的基因表达。
我制作了特制的探针,然后开始了我的“钓鱼”行动。
我把探针加到细胞样本里,然后就是等待。
你知道那种等待鱼儿上钩的感觉吗?就是那种既期待又有点焦虑的心情。
几个小时后,我再次观察样本,那些特定的基因位置真的亮了起来,就像是在跟我说:“嘿,我在这里!”那一刻,我简直比钓到大鱼还要兴奋。
定量PCR原理及PCR仪光学原理

定量PCR原理及PCR仪光学原理1.荧光染料法:在PCR反应混合液中添加荧光染料,该染料只与双链PCR产物结合并产生荧光信号,因此只有在扩增过程中产生双链PCR产物时才会有荧光发光。
PCR反应过程中,荧光信号会随着扩增产物的积累而增加。
可以通过荧光强度与PCR循环数的关系来计算出初始模板的初始数量。
2.探针法:在PCR反应中加入探针,该探针通常包含两个部分:荧光染料基团和辅助基团。
辅助基团可以竞争性结合PCR产物,从而导致荧光信号减弱或熄灭。
当PCR过程中产生PCR产物时,探针会被酶水解并释放出荧光染料基团,从而导致荧光信号增强。
通过测量荧光信号的变化,可以测量PCR 产物的数量。
PCR仪光学原理:PCR仪是用于定量PCR实验的专用仪器,它具有特殊的光学系统来测量荧光信号的强度。
PCR仪的光学原理通常基于光衰减原理。
PCR仪中使用的荧光染料或探针一般会发出荧光信号,该信号在PCR过程中会通过光学系统进行收集和测量。
PCR仪的光学系统一般包括以下几个组件:1.光源:PCR仪通常使用特定波长的光源来激发荧光信号的发生。
常见的光源有LED或氙气灯。
2.滤光片:滤光片用于选择特定波长的荧光信号传递到探测器,并阻挡其他波长。
滤光片通常由凹凸面组成,以控制特定光线的传播方向和传播方式。
3.检测器:检测器用于测量荧光信号的强度。
常见的检测器有光电二极管(photodiodes)或光电倍增管(photomultiplier tubes),它们可以将荧光信号转化为电信号。
4.放大器和转换器:放大器用于增强电信号的强度,并将其转换为数字信号。
5.软件和分析系统:PCR仪通常配备专门的软件和分析系统,用于处理和分析测量的数据。
这些软件可以计算出初始模板的初始数量,并生成相应的曲线和图表。
总结:定量PCR是一种用于测量DNA或RNA在样本中的定量浓度的技术,依赖于PCR过程中的荧光信号的监测。
荧光染料法和探针法是常用的定量PCR方法。
实时荧光定量PCR技术的两种方法原理简述

实时荧光定量PCR技术的两种方法原理简述依据所使用的技术不同,实时荧光定量PCR可以分为:荧光探针和荧光染料两种方法。
现将其原理简述如下:1. TaqMan荧光探针TaqMan探针法是高度特异的定量PCR技术,其核心是利用Taq酶的3'5'外切核酸酶活性,切断探针,产生荧光信号。
PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团。
探针完整时,报告基团发射的荧光信号被淬灭基团吸取;PCR扩增时,Taq酶的3'5'外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分别,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成wan全同步。
而新型TaqMan—MGB探针使该技术既可进行基因定量分析,又可分析基因突变(SNP),有望成为基因诊断和个体化用药分析的shou选技术平台2. SYBR荧光染料在PCR反应体系中,加入过量SYBR荧光染料,SYBR荧光染料非特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的SYBR染料分子不会发射任何荧光信号,从而保证荧光信号的加添与PCR 产物的加添wan全同步。
SYBR仅与双链DNA进行结合,因此可以通过溶解曲线,确定PCR反应是否特异。
SYBR荧光染料法定量PCR的基本过程是:① 开始反应,当SYBR染料与DNA双链结合时发出荧光;② DNA变性时,SYBR染料释放出来,荧光急剧削减;③ 在聚合延长过程中,引物退火并形成PCR引物;④ 聚合完成后,SYBR染料与双链产物结合,定量PCR系统检测到荧光的净增量加大。
实时荧光定量PCR技术依据化学原理可以分为探针类和非探针类。
探针类实时荧光定量 PCR 技术紧要是利用与靶序列特异杂交的探针来指示扩增产物的加添;非探针类实时荧光定量 PCR 技术紧要通过荧光染料来指示产物的加添。
QPCR定量简介

荧光定量PCR一、原理所谓实时荧光定量PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
荧光定量PCR所使用的荧光化学可分为两种:荧光探针和荧光染料。
原理简述如下:1)TaqMan荧光探针:PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团。
探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。
优点:重复性好,特异性高,灵敏性高,可多重PCR;缺点:只适合特定目标,价格较贵,本底信号较高。
2)SYBR荧光染料:SYBR荧光染料是一种可以结合在DNA双螺旋小沟区域具有绿色激发波长的燃料。
在PCR 反应体系中,加入过量SYBR荧光染料,SYBR荧光染料特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的SYBR染料分子不会发射任何荧光信号,从而保证荧光信号的增加与PCR产物的增加完全同步。
优点:引物设计方便,价格优势;缺点:特异性差,引物要求高,灵敏度差,不能进行多重定量。
二、内标在传统定量中的意义1.几种传统定量PCR方法简介:1)内参照法:在不同的PCR反应管中加入已定量的内标和引物,内标用基因工程方法合成。
上游引物用荧光标记,下游引物不标记。
在模板扩增的同时,内标也被扩增。
在PCR产物中,由于内标与靶模板的长度不同,二者的扩增产物可用电泳或高效液相分离开来,分别测定其荧光强度,以内标为对照定量待检测模板。
2)竞争法:选择由突变克隆产生的含有一个新内切位点的外源竞争性模板。
在同一反应管中,待测样品与竞争模板用同一对引物同时扩增(其中一个引物为荧光标记)。
荧光定量pcr探针法

荧光定量pcr探针法荧光定量PCR探针法引言:荧光定量PCR探针法(Fluorescent Quantitative PCR Probe Method)是一种基于荧光探针的PCR技术,通过特异性探针与目标DNA序列的结合,利用荧光信号的强度来定量分析PCR产物。
该方法在生物医学领域广泛应用,能够高效、准确地检测和定量目标基因的表达水平。
本文将详细介绍荧光定量PCR探针法的原理、步骤、优势和应用。
一、原理:荧光定量PCR探针法是在常规PCR反应的基础上引入荧光探针,通过监测荧光信号的变化来定量PCR产物。
探针通常由两部分组成:荧光染料和一个与目标DNA序列特异性结合的DNA探针。
在PCR反应过程中,探针与目标DNA序列结合后,荧光信号强度增加,而在无目标序列或非特异性结合的情况下,荧光信号强度较低。
通过测量荧光信号强度的变化,可以推断目标基因的表达水平。
二、步骤:1. 样本准备:提取目标DNA样本并进行纯化处理,确保样本的质量和纯度。
2. 引物设计:根据目标基因序列设计引物和荧光探针,确保其特异性和高度敏感性。
3. PCR反应:将目标DNA样本与引物和荧光探针加入PCR反应管中,进行PCR扩增。
4. 荧光信号检测:在PCR反应过程中,使用荧光实时检测仪器实时监测荧光信号强度的变化。
5. 数据分析:根据荧光信号强度的变化,计算目标基因的表达量,并进行数据统计和分析。
三、优势:1. 高灵敏度:荧光定量PCR探针法具有高度敏感性,可以检测到低浓度的目标DNA序列,适用于分析稀有基因或低表达基因。
2. 高特异性:通过引物和荧光探针的设计,荧光定量PCR探针法能够准确识别和定量目标DNA序列,避免了假阳性结果的发生。
3. 高精确度:荧光定量PCR探针法可以实时监测PCR反应过程中荧光信号的变化,提供准确的定量结果,避免了传统PCR方法中终点检测的不确定性。
4. 高通量:荧光定量PCR探针法可以在同一反应体系中同时检测多个基因或多个样本,提高了实验效率和数据可靠性。
三种荧光定量PCR检测方法比较

三种荧光定量PCR检测方法比较定量pcr:以参照物为标准,对PCR终产物进行分析或对PCR过程进行监测,从而达到评估样本中靶基因的拷贝数,称为定量PCR。
定量PCR的可行性定量一般是在PCR扩增的指数期进行的。
常见荧光定量PCR检测方法可分为以下几类:<1> SYBR Green I 检测模式SYBR Green I 是一种能与双链DNA 结合发光的荧光染料。
其与双链DNA 结合后, 荧光大大增强。
因此, SYBR Green I 的荧光信号强度与双链DNA 的数量相关,可以根据荧光信号检测出PCR 体系存在的双链DNA 数量。
SYBR Green I 的最大吸收波长约为497nm,发射波长最大约为520nm。
PCR 扩增程序一般为94℃~55℃~72℃三步法,40 个循环。
SYBR Green I 的缺点:由于SYBR Green I 没有特异性,不能识别特定的双链,只要是双链就会结合发光,对PCR 反应中的非特异性扩增或引物二聚体也会产生荧光,通常本底较高,所以在临床上使用可能会有假阳性发生。
SYBR Green I 的优点:SYBR Green I 的优点是因为其缺点产生,由于它能所有的双链DNA相结合,所以对不同模板不需特别定制不同的特异性探针,通用性较好,并且价格相对较低。
这对科研是很有利的,因此国内外在科研中使用比较普遍。
<2> 水解探针模式<taq man探针>TaqMan 探针是一种寡核苷酸探针,荧光基团连接在探针的5’末端, 而淬灭剂则在3’末端。
当探针与靶序列配对时,荧光基团发射的荧光因与3’端的淬灭剂接近而被淬灭。
在进行延伸反应时,聚合酶的5’外切酶活性将探针切断,使得荧光基团与淬灭剂分离,发射荧光。
一分子的产物生成就伴随着一分子的荧光信号的产生。
随着扩增循环数的增加,释放出来的荧光基团不断积累。
因此Taqman 探针检测的是积累荧光。
PCR 扩增程序通常是:94℃~60 ℃40 个循环。
荧光定量PCR:染料法VS探针法精选全文

可编辑修改精选全文完整版荧光定量PCR:染料法VS探针法实时荧光定量PCR(quantitative PCR, qPCR)通过对PCR扩增反应中的每一个循环产物荧光信号的实时监测从而实现对起始模板的定性及定量分析。
目前它主要通过两种方式——荧光染料或者荧光标记的探针对PCR产物进行标记跟踪,实时在线监控反应过程,并结合相应的软件对产物进行分析,计算待测样品模板的初始浓度。
荧光定量PCR,qPCR荧光染料法在PCR反应体系中,加入过量荧光染料,该染料只与双链DNA 小沟结合,并不与单链DNA链结合,而且在游离状态不发出荧光,只有掺入DNA双链中才可以发光,因此,在PCR体系中,随着特异性PCR产物的指数扩增,每个循环的延伸阶段,染料掺入双链DNA中,其荧光信号强度与PCR产物的数量呈正相关。
EvaGreen、SolisGreen、SYBR染料荧光染料包括饱和荧光染料和非饱和荧光染料,非饱和荧光染料的典型代表就是现在最丨常用的SYBR GreenⅠ,EvaGreen、SolisGreen属于饱和荧光染料。
非饱和荧光染料在浓度高的时候会对PCR过程产生抑制,所以在荧光定量实验时使用浓度稍低,染料不能占据DNA双链上的所有位置。
当PCR随着温度上升,双链逐渐解链,染料会从已解开的单链上脱落,然后结合到临近的尚未解链的双链中去继续发荧光。
这种染料重排导致在较小的温度变化内,虽然DNA双链的解链过程不同,但荧光值是几乎不变的,也就是说,其溶解曲线不能精确反应双链的解链情况。
所以,对于非饱和染料,其溶解曲线分辨率相对较低,只能区分特异性的产物,不能分辨单碱基的差异。
饱和荧光染料在DNA双链中所有可结合位点内都会有染料分子存在,染料与DNA的结合呈饱和状态,随着温度上升,在双链解链、染料脱离过程中,未解链的双链部分不存在染料可以结合的位点,染料不能发生重排。
所以使用饱和染料制作的溶解曲线分辨率很高,可以精确反映DNA双链随着温度的解链情况,精度可以达到单碱差异的区分。
荧光定量PCR方法简介

实时荧光定量PCR方法简介一.实时荧光定量PCR的基本原理理论上,PCR过程是按照2n(n代表PCR循环的次数)指数的方式进行模板的扩增。
但在实际的PCR反应过程中,随着反应的进行由于体系中各成分的消耗(主要是由于聚合酶活力的衰减)使得靶序列并非按指数方式扩增,而是按线性的方式增长进入平台期。
因此在起始模板量与终点的荧光信号强度间没有可靠的相关性。
如采用常规的终点检测法(利用EB染色来判断扩增产物的多少,从而间接的判断起始拷贝量),即使起始模板量相同经PCR 扩增、EB染色后也完全有可能得到不同的终点荧光信号强度。
为了能准确判断样品中某基因转录产物(mRNA)的起始拷贝数,实时荧光定量PCR采用新的参数——Ct值,定量的根本原理是Ct值与样品中起始模板的拷贝数的对数成线性反比关系。
Ct值是如何得到的在实时荧光定量PCR的过程中,靶序列的扩增与荧光信号的检测同时进行,定量PCR仪全程采集荧光信号,实验结束后分析软件自动按数学算法扣除荧光本底信号并设定阈值从而得到每个样品的Ct值。
Ct值的定义Ct值中的“C”代表Cycle(循环),“t”代表检测threshhold(阈值),其含义是PCR扩增过程中荧光信号强度达到阈值所需要的循环数;也可以理解为扩增曲线与阈值线交点所对应的横坐标。
Ct值与样品中模板的对应关系Ct值与样品中起始模板的拷贝数的对数成线性反比关系(y=ax+b,x代表起始模板拷贝数的对数,y代表Ct值)。
与终点法相比利用Ct值的优势由于Ct值是反映实际PCR反应过程中扩增即将进入指数期的参数,该参数几乎不受试剂消耗等因素的影响,因此利用Ct值判断的起始模板拷贝数更加精确,重复性也更好。
传统的终点检测法是在PCR扩增经历了指数扩增期进入平台期后利用EB等染料染色来判断扩增产物的多少,从而间接的判断起始拷贝量,这种方法的精确度不高、重复性也不好。
下图中是96个复孔的实时扩增曲线(完全相同的反应体系、相同的反应protocol、相同的样品起始浓度),可以看到Ct值具有很好的重复性,而终点的荧光信号强度差异达到300个单位。
荧光定量PCR中探针的荧光修饰基团
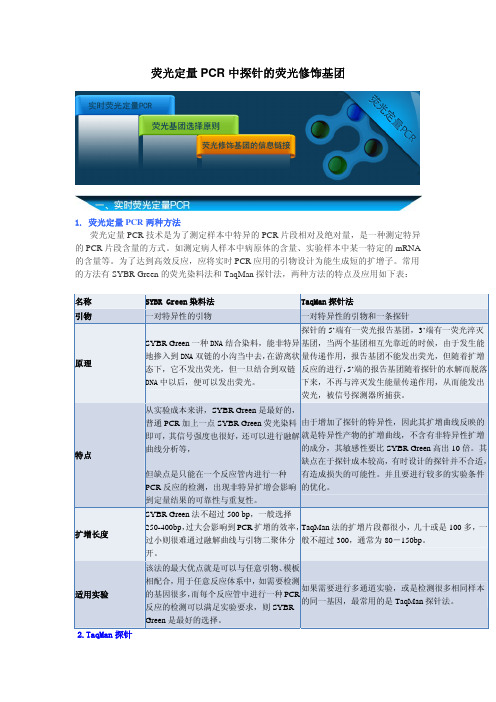
荧光定量PCR中探针的荧光修饰基团1. 荧光定量PCR两种方法荧光定量PCR技术是为了测定样本中特异的PCR片段相对及绝对量,是一种测定特异的PCR片段含量的方式。
如测定病人样本中病原体的含量、实验样本中某一特定的mRNA 的含量等。
为了达到高效反应,应将实时PCR应用的引物设计为能生成短的扩增子。
常用的方法有SYBR Green的荧光染料法和TaqMan探针法,两种方法的特点及应用如下表:名称SYBR Green染料法TaqMan探针法引物一对特异性的引物一对特异性的引物和一条探针原理SYBR Green一种DNA结合染料,能非特异地掺入到DNA双链的小沟当中去,在游离状态下,它不发出荧光,但一旦结合到双链DNA中以后,便可以发出荧光。
探针的5’端有一荧光报告基团,3’端有一荧光淬灭基团,当两个基团相互先靠近的时候,由于发生能量传递作用,报告基团不能发出荧光,但随着扩增反应的进行,5’端的报告基团随着探针的水解而脱落下来,不再与淬灭发生能量传递作用,从而能发出荧光,被信号探测器所捕获。
特点从实验成本来讲,SYBR Green是最好的,普通PCR加上一点SYBR Green荧光染料即可,其信号强度也很好,还可以进行融解曲线分析等,但缺点是只能在一个反应管内进行一种PCR反应的检测,出现非特异扩增会影响到定量结果的可靠性与重复性。
由于增加了探针的特异性,因此其扩增曲线反映的就是特异性产物的扩增曲线,不含有非特异性扩增的成分,其敏感性要比SYBR Green高出10倍。
其缺点在于探针成本较高,有时设计的探针并不合适,有造成损失的可能性。
并且要进行较多的实验条件的优化。
扩增长度SYBR Green法不超过500 bp,一般选择250-400bp,过大会影响到PCR扩增的效率,过小则很难通过融解曲线与引物二聚体分开。
TaqMan法的扩增片段都很小,几十或是100多,一般不超过300,通常为80-150bp。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
荧光定量 PCR 方法:探针法 VS 染料法?
荧光定量 PCR 又称 qPCR,是一项非常常见的分子生物学实验技术。
荧光定量 PCR 荧光为基础对核酸进行定量分析,其应用非常广泛,可以用于检测基因的表达量(RNA 的丰度),验证表达谱芯片或转录组测序的数据,确定病原体的载量,对片段的拷贝数(CNV)进行分析,对基因进行分型等等。
大部分研究者主要的应用是对基因的表达量进行测定,其原理为通过监控反应体系中荧光强度的变化,记录检测荧光达到阈值时的循环数(Ct 值)。
从理论上说,起始模板量和 Ct 值密切相关,因此我们通过判读 Ct 值从而对样本进行定量。
在进行荧光定量 PCR 时,从技术和产品来说,我们往往会有许多选择,尤其是方法的选择,对最终结果的准确性至关重要。
荧光定量 PCR 从方法上来说可以分为染料法和探针法两种。
?探针法? 染料法
一、染料法
在国内,染料法一般采用 DNA 染料 SYBRGreenⅠ,染料法使用简单,成本也相对较低,因此会有很多国内研究者会选择使用染料法进行后续实验。
在染料法荧光定量 PCR 实验中,染料能够与双链结合,从而发光,而在游离状态下,SYBR Green I 发出微弱的荧光。
所以,一个反应发出的全部荧光信号与出线的双链 DNA 量呈比列,且会随扩增产物的增加而增加。
但是染料法检测的是体系中的所有双链 DNA,因此一些非特异性扩增或者引物二聚体的出现,
会极大的影响真实结果的准确性。
为此,一些厂商提供 ROX 作为内部荧光参考标准,用来校正背景,但是即便如此,染料法特异性的问题依旧无法与探针法相比。
另外染料法无法在同一个反应中检测多个目的片段,对于复杂序列,如果难以扩增的话,也会受到脱靶效应(如引物二聚体)的影响。
在这种情况下,就需要在实验前期进行熔解曲线分析,判断扩增所得产物是否只有一种。
二、TaqMan 探针法
TaqMan 探针法 PCR 扩增时,在加入一对扩增引物的同时再加入一个特异性的荧光探针。
Taqman 探针为一段线性的寡核苷酸,两端分别标记一个荧光报告基团(FAM 或 Hex 等)和一个荧光淬灭基团,当探针完整时,报告基团发射的荧光信号被淬灭基团吸收,PCR 仪检测不到荧光信号;当 PCR 扩增时(在延伸阶段),Taq 酶的 5' -3' 外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条 DNA 链,就有一个荧光分子形成,实现了荧光信号的累积与 PCR 产物形成完全同步,这也就是探针法定量的原理。
探针法与染料法的最大区别在于,理论上探针法中的荧光信号只来源于目标序列,也就是不受非特异性扩增及引物二聚体的影响。
除此之外,人们还可以利用不同探针,在一个体系中使用不同的荧光标记同时检测多种指标,达到节省实验成本的目的。
在样本量比较大的情况下,成本甚至可以低于染料法。
因此我们可以看到,在选择荧光定量实验时,探针法在特异性和准确性方面远远优于廉价的染料法,但在实际使用时,TaqMan 探针高昂的价格常常让人望而却步。
目前,上海捷瑞生物工程有限公司在强大的探针合成能力的前提下,推出了探针法荧光定量 PCR 服务,以染料法的价格,享受探针法的服务,在相同的经费情况下,提高实验的准确性和特异性。
