手性3-取代联二萘酚衍生物的合成及在不对称环氧化中的应用
立体化学关于萘酚催化剂

1 ,1’-联二萘酚类化合物的拆分、合成及其应用摘要手性是自然界的普遍现象,也是生命物质区别于非生命物质的重要标志,手性化合物在医药、农药、材料科学、生物和生命科学等众多方面具有重要作用。
不对称合成是获得光学活性化合物的有效方法,其中利用催化量的手性源实现不对称反应的手性催化循环,诱导合成出具有高光学活性的手性产物的不对称催化的方法显示出勃勃的生机和活力,并已有相当的工业化实例,许多优良的手性催化剂被人们誉为“化学酶”。
不对称催化作为不对称合成的重要手段之一,在有机合成中日益显示出其重要的作用。
本文主要就1 ,1’- 联二萘酚类化合物的拆分,合成及其在反应中的应用研究进展作简要概述。
关键字手性;不对称催化;1 ,1’-联二萘酚1 ,1’-联二萘酚化合物是典型的具有C2轴不对称联芳香族化合物,它们具有独特的立体化学性质(分子的轴不对称性;刚性和柔性;官能团) [1],且易于拆分成高纯度的对映体[2,3],从而使其在有机合成、燃料、农药尤其是医药等行业有着重要用途。
作为拆分剂,联萘酚中的2个羟基可与某些化合物的氢键形成分子络合物,利用形成的一对非对映异构体的分子络合物的性质差异,可达到拆分异构体的目的。
与二乙基锌形成的络合物作为引发剂可参与取代硫杂丙烷的不对称聚合反应,其作用与酶相似;作为不对称诱导试剂参与联芳烃的不对称合成,可得到高光学纯度的联芳烃化合物;锌络合物作为不对称催化剂参与不饱和醛的分子内环化反应,可直接由不饱和醛一步反应生成高光活性的环醇;含手性联二萘酚单元的冠醚对有机胺、氨基酸衍生物具有手性识别作用,发展了主-宾化学,制成了氨基酸拆分的“机器”[1];与LiAlH4和BH3的络合物可作为不对称还原剂在多种化合物(如不饱和酮、饱和酮、亚胺、锡酮、酸酐、二羰基亚胺等)的立体选择性还原中有突出表现[4,5];最近,Deussen利用联二萘酚作为刚性体和手性中心,从手性6 ,6’-二溴-1 ,1’-联萘-2 ,2’-二酚出发,合成了一系列具有“推-拉”型结构的手性双偶极 6 ,6’- 双取代联萘衍生物,并发现具有二阶非线性光学性质,为开发其在材料化学方面的应用打下了基础[6]。
联二萘胺及其衍生物的合成进展
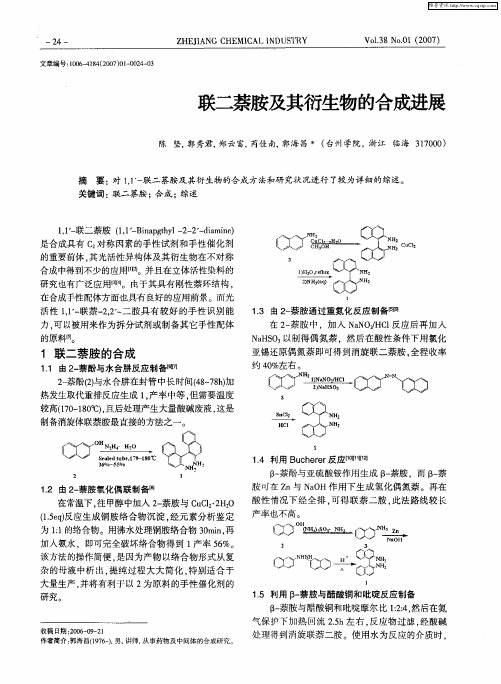
24 手 性 R 一 , U 催化 剂 的合 成 【 日 4
()1 8 喹啉磺酰氯的反应可生成配体() R一 与 一 R一
1 ,R) 1 O ( 一 O和 R c 在 异丙 醇 中 回流 1 ,可制 得手 ul 2 h
酸性情况下经全排 , 可得联萘二胺 , 此法路线较长 产率也不高 。
为 1 的络合物。用沸水处理铜胺络合物 3 rn再 : 1 0 i, a 加入氨水 ,即可完全破坏络合物得到 l 产率 5 %。 6
该方法的操作简便 , 是因为产物 以络合物形式从 复
杂的母液中析 出 , 提纯过程大大简化 , 特别适合 于
热发生取代重排反应生成 1产率中等 。 , 但需要温度
较高( 0 10 ) 1 ~8  ̄ , 7 C 且后处理产生大量酸碱废液 , 这是
\ [ Zt \ )S NO a ̄ l
, 』 0
制备消旋体联萘胺最直接的方法之一。
14 利 用 B c ee 反 应[[【 . u h rr 1”’ o l 1 司
o
,
r 丫N uIm e :q ,、 N H CC— m (1 ) , f H a 2 e
\
3
器
M M e t2h 7 OH , 4%
.
/
.
.
,
N
1
COD) ) CI 2
2 联二萘胺衍 生物 的合成
21 一 . 2 萘胺 和 2 萘酚 氧化 偶联 一
产率在 5 % 6%t 0 ~0 5  ̄ 。
《浙 江 化 工 》
一2 一 5
在 d 酰胺 基 丙 烯 酸 氢 化 前 . 述 手 性 B P B 一 上 D A
手性有机催化剂在不对称合成中的应用

手性有机催化剂在不对称合成中的应用导言:不对称合成是有机合成领域中的重要分支,通过构建手性化合物(分子)来合成具有特定活性和药理学效应的化合物。
手性有机催化剂作为一种重要的工具,已经在不对称合成中发挥了重要的作用。
本文将介绍手性有机催化剂的定义和分类、应用领域以及未来的发展前景。
一、手性有机催化剂的定义与分类1. 手性有机催化剂定义手性有机催化剂是能够引发不对称转化的有机分子,具有手性结构,能够通过催化作用加速反应速率,并且在反应过程中保持手性不变。
2. 手性有机催化剂的分类根据功能团的不同,手性有机催化剂可以分为酸碱型、氧化还原型、配位催化型等。
酸碱型手性有机催化剂通过质子转移、亲电或核负电子云的机制实现不对称催化。
氧化还原型手性有机催化剂通过电子转移实现不对称催化。
配位催化型手性有机催化剂通过形成物种激活催化的底物。
二、手性有机催化剂的应用领域1. 不对称氢化反应不对称氢化反应是手性有机催化剂的重要应用领域之一。
通过手性有机催化剂的催化作用,可以将不对称亲核试剂与不对称元素试剂在氢化反应中进行底物的选择性催化还原,从而产生优选手性的产物。
2. 不对称酯化反应手性有机催化剂在不对称酯化反应中也有广泛的应用。
通过手性有机催化剂的作用,使酸和醇的酯化反应具有高选择性,得到具有高催化效率和高产率的手性酯产物。
3. 不对称亲核试剂与不对称叔亲试剂反应不对称亲核试剂与不对称叔亲试剂反应是手性有机催化剂的另一个重要应用领域。
通过手性有机催化剂的引导,亲核试剂和叔亲试剂可以进行高度对映选择性的反应,生成手性中心。
4. 不对称氧化反应手性有机催化剂在不对称氧化反应中具有重要的应用价值。
通过手性有机催化剂的作用,可以选择性氧化底物,产生手性醇、醛和酮等有机化合物。
三、手性有机催化剂的发展前景手性有机催化剂在不对称合成中的应用已经取得了令人瞩目的成果,但仍然有许多挑战和机遇等待我们探索和发现。
未来的发展趋势包括拓宽应用领域,发展更高效的催化剂,优化合成方法,提高催化效率等方面。
新型含联萘骨架的手性Brφnsted酸催化剂的合成

新型含联萘骨架的手性Brφnsted酸催化剂的合成谭道养【摘要】近年来,手性磷酸被广泛应用于催化不对称反应。
通过以手性(R)-BINOL为原料,在联萘骨架的3,3'-位上通过醚化、取代、磷酸化等制备得到喹啉取代的新型含联萘骨架的手性Br nsted酸催化剂。
所有化合物的结构用核磁碳谱、氢谱对进行了标征鉴定。
我们并对目标化合物的刚性结构进行了讨论。
%In recent years,chiral phosphoric acid was widely used in catalytic asymmetric reactions.The chiral(R)-BINOL as raw materials,the binaphthyl skeleton 3,3′-by etherification,replace,and phosphorylation,quinoline substituted binaphthyl backbone of novel chiral Br nsted acid catalyst was prepared.Characterization was carried out on all products through 13C NMR and 1H NMR spectroscopy.The compound rigid structure was discussed.【期刊名称】《广州化工》【年(卷),期】2012(040)004【总页数】2页(P50-51)【关键词】不对称催化;联萘骨架;手性磷酸;合成【作者】谭道养【作者单位】贵州大学,贵州贵阳50025【正文语种】中文【中图分类】O621.3不对称合成是当前有机化学研究的热点,开发高效、高选择性的手性催化剂已经成为发展手性合成的核心问题。
目前应用的手性催化剂往往只对特定的反应有较好的手性诱导能力,并且催化剂用量较大,通常情况下实用价值不大。
1,1'-联二萘酚化合物的合成研究进展

1,1'-联二萘酚化合物的合成研究进展
张占辉;李同双;王继业
【期刊名称】《河北大学学报(自然科学版)》
【年(卷),期】2001(021)003
【摘要】综述了近年来1,1'-联二萘酚类化合物合成研究进展,引用文献51篇.【总页数】8页(P333-340)
【作者】张占辉;李同双;王继业
【作者单位】河北大学化学与环境科学学院;河北大学化学与环境科学学院;河北师范大学化学系
【正文语种】中文
【中图分类】O625.313
【相关文献】
1.手性化合物1,1'-联二萘酚的合成及其在不对称氧化还原反应中的应用 [J], 白鹏;李晓峰;朱良伟;李鑫钢
2.6,6'-取代1,1'-联二萘酚衍生的手性磷酸的合成 [J], 王稚京;郑远勤;叶玲;杨学军;李雪锋
3.1,1′-联二萘酚化合物的合成研究新进展 [J], 刘焕梅;王红;尚晓娴;李国才;赵宝莹
4.金属化合物催化的1,1′-联二萘酚-4,4′-二乙酸酯和二(2-乙基己醇)碳酸酯的酯交换 [J], 平学真;邱醒宇
5.1,1′-联二萘酚的合成及其在不对称合成中的应用 [J], 施秀芳;张明杰;李靖
因版权原因,仅展示原文概要,查看原文内容请购买。
新型树状结构手性联二萘酚衍生物的合成及催化性能研究

Vol.24高等学校化学学报 No.2 2003年2月 C HEM IC AL JOURNAL OF CHINES E UN IVE RSITIES 274~277 新型树状结构手性联二萘酚衍生物的合成及催化性能研究范青华1,杨夕强1,刘国华1,陈晓闽1,陈新滋2(1.中国科学院化学研究所分子科学中心,北京100080;2.香港理工大学应用生物及化学科技系,香港)摘要 报道了树状结构的手性联二萘酚(BIN OL)配体的合成及其在二乙基锌对醛的不对称加成反应中的应用.(R)-2,2′-二羟基-1,1′-联萘-3,3′-二羧酸与末端为氨基的Frechet聚芳醚型树状分子经缩合反应,以中等产率得到0~3代的树状分子配体,用1H N M R,I R和M AL DI-TO F质谱进行了结构表征.这些树状手性配体与Ti(O Pr i)4在无水甲苯溶液中形成的配合物是二乙基锌对醛不对称加成反应的高效催化剂,树状分子载体的体积对催化剂的对映选择性没有明显的影响.以邻氯苯甲醛为底物时,反应的对映选择性随树状分子代数的增加而有所提高.关键词 1,1-联萘-2-酚;树状手性大分子;不对称催化中图分类号 O625.23 文献标识码 A 文章编号 0251-0790(2003)02-0274-04高分子负载手性催化剂有可能解决催化剂的分离和回收问题,近年来得到了广泛的应用[1].然而,传统的以交联高分子树脂负载的手性催化剂往往导致催化剂的催化活性和对映选择性下降,成功的例子很少[2~4].最近,以可溶性大分子为载体,设计合成用于“均相催化-两相分离”的负载型手性催化剂取得了较大进展[5,6].其中,树状大分子载体由于具有精确可控、可剪裁的三维结构以及特殊的物理化学性能而引起人们的极大兴趣[7].最近,我们报道了系列树状结构的手性BIN AP[6]和BINOL[8]配体的合成,及其在不对称催化氢化和加成反应中的应用,结果显示了明显的“树状分子载体”效应.但在树状结构BINOL配体与Ti(O Pr i)4形成的配合物催化的二乙基锌对醛的不对称烷基化反应中,产物的e.e.值随着树状分子的代数增加而减少,呈现负的“树状分子载体”效应.为了进一步调节由联二萘骨架与其3,3′-位上连接的树状分子载体所形成的手性微环境,优化树状结构的手性BINOL配体的手性诱导性能,本文设计合成了一系列新的树状结构BINOL衍生物,并以二乙基锌对醛的不对称加成反应作为模型反应,初步研究了所合成的树状大分子手性配体的手性诱导性能.1 结果与讨论1.1 配体的合成合成路线如Schem e1所示.文献[9]中已报道很多手性BINO L的衍生物,功能化的位置一般选择在萘环的3,3′-位或6,6′-位,我们选择3,3′-位取代羧酸的BINOL衍生物(R)-1为研究对象,目的在于使树状分子载体更靠近活性中心,为研究载体结构与配体性能的关系提供基础.化合物(R)-1参照文献[10]方法合成.胺端基树状分子化合物2由溴端基的Frechet型树状分子[11]经盖布瑞尔(Gabriel)方法转换而成.化合物(R)-1与SOCl2反应生成酰氯,然后与化合物2反应得到树状结构手性联二萘酚衍生物(R)-3,反应产率及化合物3的M ALDI TO F质谱测定值和比旋光值列于表 1.收稿日期:2001-12-03.基金项目:国家自然科学基金(批准号:29904009和20132010)资助.联系人简介:范青华(1966年出生),男,博士,副研究员,从事不对称合成研究.E-mail:fanqh@Scheme 1 Route of synthesis不同代数的化合物3均经1H NM R,IR 和M ADALI-TOF-M S 表征.不同代数化合物3都给出了具有很好分辨率的1H NM R 谱图,表明树状结构的手性BINOL 分子在溶液中保持了原有的C 2对称性.由表1可以看出,这些树状结构BINOL 衍生物的质谱结果同计算值相符,进一步证明化合物3为单分散的树状大分子.化合物3的比旋光值和摩尔比旋光值(表1)结果表明,随树状结构的代数增加,其比旋光值[T ]D 减少,而摩尔比旋光值没有特别明显的变化,说明这些树状结构BINO L 衍生物的手性主要源于BINO L 分子中的轴不对称中心.Table 1 Characterizat ion of ch iral dendritic BINOLs (R )-3Compd.Yiel d (%)Calcd.mass M ass found [M +Na ]+[T ]20D (c 1.0,CHCl 3)M ol ar rotation (R )-3a60.0976.37999.69+52.0508.1(R )-3b75.01824.711849.36+22.0401.8(R )-3c 72.03521.383545.65+10.0352.41.2 配体3与四异丙基氧钛的配合物催化二乙基锌对醛的不对称加成反应为了考察所合成的配体的催化性能,选择二乙基锌对醛的不对称加成作为模型反应,经过实验优化出反应条件,即在催化反应中,使用相对底物20%(摩尔分数)的手性配体和80%(摩尔分数)的四异丙基氧钛,在甲苯中低温反应7h.反应结果列于表 2.Tabl e 2 Asymmetric addition of diethyl zinc to aldehydes catalyzed by the dendr iticBI NOL l igands 3in the presence of Ti (OPri )4EntryLigand Al d ehyde Conv.(%)e .e .(%)Entry Ligand Aldeh yd e Conv.(%)e .e .(%)13a PhC HO 9771.7(73.7[8])63c 2-Cl-Ph CHO >9972.823b PhC HO 9965.8(53.8[8])73a 3-Cl-Ph CHO >9951.933c PhC HO >9970.1(52.2[8])83b 3-Cl-Ph CHO >9946.543a 2-Cl-Ph C HO >9967.693c 3-Cl-Ph CHO 9845.753b 2-Cl-Ph C HO >9969.2 从表2可以看出,不同代数的树状分子配体3与Ti (OPr i )4生成的配合物催化剂均表现出很高的反应活性及较好的对映体选择性.特别值得注意的是随着树状分子载体代数的增加,亦即体积的增大,产物的e .e .值没有明显的降低,并且在以邻氯苯甲醛为底物时,产物的e .e .值还有所提高(见表2).这与我们近期报道的以醚键为连接基团的3,3′-位连有树状分子载体的BINOL 衍生物的手性诱导性能不同[8],其手性诱导性能随着树状分子载体代数的增加而明显降低.这可能是因为一方面与醚键相比,连接基团酰胺键的刚性增加,有助于形成较稳定的活性中间体;另一方面,连接基团酰胺键中275N o.2范青华等:新型树状结构手性联二萘酚衍生物的合成及催化性能的研究 的N —H 可能参与了Ti 或Zn 离子的配位作用,从而改变了催化活性中间体的结构或构象.这也正是我们在配体设计时所考虑的,连接基团酰胺键对催化活性的影响正在进一步研究中.总之,通过在BINOL 分子萘环骨架的3,3′-位连接树状分子,成功合成了系列树状大分子BINO L 衍生物,它们的钛配合物催化剂在催化二乙基锌对醛的不对称加成反应中表现出较好的催化活性和对映体选择性.更重要的是提供了一种优化和回收手性配体或金属催化剂的方法,即通过剪裁树状分子载体结构,调节手性微环境,从而达到优化配体手性诱导性能的目的.2 实验部分2.1 仪器与试剂Bruker IFS 25傅里叶变换红外光谱仪;Bruker DM X300(300M Hz)核磁共振谱仪;AA-10R 自动旋光测定仪;Varian 6000气相色谱仪[Supelco U -Dex 120GLC (0.25mm ×30m )手性色谱柱].甲苯经金属钠重蒸后使用,二氯甲烷经氢化钙处理重蒸后使用.底物醛在实验前用氢化钙重蒸.所有的实验在氮气保护下进行.2.2 化合物(R )-3a ~(R )-3c 的合成在50m L 两口烧瓶中,加入0.3g (0.8m mol)(R )-1,10m L 二氯亚砜,加热回流4h,冷却,减压除去二氯亚砜.加入5m L 二氯甲烷,冷至0℃,滴加 1.535g (4.8mm ol)化合物2(n =0)的5m L 二氯甲烷溶液,滴加完毕后,反应0.5h .然后加入5%盐酸酸化终止反应,用二氯甲烷萃取3次,每次10m L,合并有机相,分别用饱和碳酸氢钠、水及饱和氯化钠洗涤,经无水硫酸钠干燥;柱分离[V (石油醚)∶V (乙酸乙酯)=1∶1]得淡黄色固体(R )-3a 0.485g,产率60%.m.p.82~83℃;[T ]20D =+52(c 1,CHCl 3);IR(KBr,ν~/cm -1):3372,3080,2863,1651,1595,1532,1452,1296,1262,1152,1028,802,738;1H NM R (CDCl 3),W :11.9(s ,2H ),8.07(s ,2H ,BINOL —H ),7.68(d ,J =7.7Hz ,2H ,BINO L —H ),7.39~7.21(m ,26H ,Ar —H ),7.09(d ,J =8.04Hz ,2H ,BINOL —H ),6.61~ 6.55(m ,6H,Ar —H), 4.99(s,8H,Ph —CH 2), 4.60(dd,J 1= 5.3Hz,J 2=14.3Hz,2H,Ph —CH 2), 4.52(dd ,J 1= 5.3Hz ,J 2=14.2Hz ,2H ,Ph —CH 2);M ALDI -TOF -M S ,m /z :999.69[M +Na ]+.化合物(R )-3b 为淡黄色固体,产率75%.m.p.80~81℃;[T ]20D =+22(c 1,CHCl 3);IR(KBr,ν~/cm -1):3356,3033,2873,1650,1595,1529,1451,1295,1152,1053,831,737;1H NM R (CDCl 3),W :12.1(s ,2H ),8.05(s ,2H ,BINOL —H ),7.63(d ,J =7.8Hz ,2H ,BINOL —H ),7.40~7.29(m,40H,Ar —H ),7.22~7.09(m ,8H,Ar —H), 6.69~ 6.58(m ,18H,Ar —H),5.01~ 4.92(m ,24H,Ph —CH 2), 4.53~ 4.49(dd,J 1= 5.3Hz,J 2=14.3Hz,2H,Ph —CH 2),4.77~ 4.70(dd ,J 1=5.3Hz ,J 2=14.3Hz ,2H ,Ph —C H 2);M ALDI -TOF -M S ,m /z :1849.36[M +Na ]+.化合物(R )-3c 为淡黄色固体,产率72%.m.p.78~80℃;[T ]20D =+10(c 1,C HCl 3);IR(KBr,ν~/cm -1):3380,3031,2870,17261596,1448,1297,1151,1044,829,738;1H N M R(CDCl 3),W:12.0(s ,2H ),8.05(s ,2H ),7.68(s ,2H ,BINOL —H ),7.43~7.10(m ,88H ,Ar —H ), 6.70~6.52(m,42H,Ar —H),5.07, 4.99, 4.95(s,56H,Ph —CH 2), 4.60(dd,J 1= 5.4Hz,J 2=14.4Hz,2H,Ph —CH 2), 4.48(dd,J 1= 5.4Hz,J 2=14.4Hz,2H,Ph —CH 2);M ALDI-TOF-M S,m /z :3545.65[M+Na ]+.2.3 催化反应过程在氮气保护下,将化合物3a(24.4m g,0.025mmol )溶于1m L 甲苯中,10min 后加入40μL Ti(OPr i )4(0.10mmol),于室温搅拌10min,加入0.375m L(1.0mol /L)二乙基锌的正己烷溶液,继续搅拌10min;冰浴冷却至0℃,加入13μL(0.125mmol)的苯甲醛,反应7h;反应完毕后,加入2.0m L(1.0mol /L)的盐酸溶液终止反应,过滤除去不溶物,分出有机层,依次用饱和碳酸氢钠溶液、水及饱和氯化钠溶液洗涤,有机层用无水硫酸镁干燥,过滤,浓缩,过短硅胶柱得到无色的1-苯基-1-276 高等学校化学学报V ol.24丙醇油状物.在气相色谱仪上用手性柱(Chiral BETA DEX TM 120,0.25mm ×30m )分析产物的e .e .值.通过与已知物对比确定产物为R 构型.参 考 文 献[1] Fan Q.H .,Li Y.M.,Chan A.S. C..Ch em.Rev.[J],2002,102:3385—3466[2] Yang X .W .,Su W .,Liu D .X .et al ..Tetrah edron [J ],2000,56:3511—3516[3] W ANG Heng -Sh an (王恒山),SU Wu (粟 武),LIU Da -Xue (刘大学)et al ..Chem .J .Chinese Univers ities (高等学校化学学报)[J ],2000,21(10):1524—1526[4] Hu J .,Zhao G .,Yang G .et al ..J .Org.Chem.[J ],2001,66:303—304[5] Fan Q.H .,Ren C.Y.,Yeung C.H.et al ..J .Am.Chem.Soc.[J],1999,121:7407—7408[6] Fan Q .H .,Ch en Y .M .,Chen X .M .et al ..Ch em .Commun .[J ],2000:789—790[7] As truc D .,Chardac F ..Chem .Rev .[J ],2001,101:2991—3023[8] Fan Q.H .,Liu G.H.,Chen X.M.et al ..Tetrah edron :Asymmetry [J],2001,12:1559—1565[9] Pu L..Ch em.Rev.[J],1998,98:2405—2494[10] Kitaj ima H.,Ito K.,Aoki Y.et al ..Bull.Chem.Soc.J pn.[J],1997,70:207—217[11] Haw ker C .J .,Fr éch et J .M .J ..J .Am .Chem .Soc .[J ],1990,112:7638—7647S ynthesis of New Dendritic C hiral BINOL Ligands and TheirApplications in Enantioselective Lewis Acid CatalyzedAddition of Diethyl zinc to AldehydesFAN Qing-Hua 1*,Y ANG Xi-Qiang 1,LIU Guo-Hua 1,CHEN Xiao-Min 1,Albert S. C.Chan2(1.Center for Molecular Science ,Institute of Chemistry ,Chines e Academy of Sciences ,Beijing 100080,China ; 2.Open Laborator y of Chirotechnolog y and Department of Applied Biologyand Chemical Technology ,Hong Kong ,China )Abstract The series of new dendritic chiral BINOL ligands(3)w ere synthesized by condensation reactionof (R )-2,2′-dihydroxy -1,1′-binaphthyl -3,3′-dicarbox ylic ac id (1)and Fr échet -type poly (aryl ether )den-dro ns(2)with an amino g roup at the focal point in moderate reaction yields.All ligands w ere characterized by 1H NM R,IR and M ALDI-TOF-M S spectra,which clearly demonstrated the fo rmation of mo nodis-persed dendritic BINOLs.The titanium com plexes of these dendritic lig ands obtained by mixing (3)withTi (OPr i )4in dry toluene w ere found to be efficient catalysts in asymmetric addition of diethylzinc to alde-hydes.The size of the dendritic w edges did not sig nificantly influence the enantioselectivity of the cataly st.Most interesting ly ,w hen ortho -chlorobenzaldehyde was used as substrate,w e found that enantioselectivity increased slightly with increasing generation of the dendrimers .Keywords 1,1′-BINOL ;Chiral dendrim er ;Asymmetric catalysis (Ed.:H,J,Z)277N o.2范青华等:新型树状结构手性联二萘酚衍生物的合成及催化性能的研究 。
联二萘酚衍生手性二胺催化的不对称Aldol反应

以手 性 胺 2 a~2 ( hr 1 和 手 性 磷 酸 3 j C a ) t a一3 i
的手 性胺 能有 效 催 化 醛 与 酮 之 间 的 Adl 应 ; lo 反 20 0 8年冯小 明等 发 展 了一 类 新 的手性 二 胺 催 化剂 , 化 Ad1 具 有 非 常好 的反 应 活 性 和 在催 lo 种
( hr2 为催化 剂 , C a ) t 考察芳基 甲基酮 (a f与三 1 —l) 氟 甲基 酮酸酯 的不对称 Adl lo反应 (ce e1 。 Shm )
1 实验 部分
1 1 仪 器与试 剂 .
立体选择性。在此基础 了, 我们 以联二萘酚为
原料合成 了一类性 能优 良的手 性二胺 催化剂 。 Adl l 反应尽 管取得 了极大 的成 功 , 其底 物 o 但 仅 限于 丙 酮 等脂 肪 酮 , 酮 如 苯 乙酮 作 为 Adl 芳 l o
受 到 广 泛 关 注 , 取 得 了 令 人 瞩 目 的进 展 。 并 20 0 7年程津 培等 发 现 具 有 一 级 一三 级胺然具有重要的意 义。我们设想手性二胺催化剂也许能催化苯乙酮
的不对 称 Adl 应 。 lo反
有机化合物中氟原子取代后其物理化学性质
Ab t a t s r c :A e iso n n ime i x e sp o u t n 8 % y ed wih 7 % e r y t e ie y te s re fe a t o rc e c s r d csi 0 il t 3 ewe e s n h sz d b h
As m m e rc Al o a t n y t i d lRe c i o
联二萘酚配合物催化的不对称异原子Diels-Alder反应研究进展

配合物作为手性 Lws e i酸催化剂 , 能够对映选择性地催化许多重要的不对称反应 , 如不对称的 De -l r is d 反 lA e 应 ( A反应 ) 杂原 子 Des le( D 反 应 、 er D 及 i — drH A) lA H ny反应 、n E e反应 和烷 基 锌加 成 反应 等 , 因此 已经 广 泛地 应 用于不 对称 催化 和 高效 液 相 色谱 的 手 性 固定 相 中 .关 于 联 二 萘 酚 及 其 衍 生 物 的 研 究 已经 有 了 许 多 综
c n e r . Ne c ia aay t, n w t o s a d n w o di o s b s d o a iu p ia ur i e ty a s w h r lc tl ss e meh d n e c n t n a e n v ro s o tc lp e b - i
n p t o r i e v t e a e b e p l d i s mmer aa yi er o Dil・ d rr a t n i e・ a h h lo s d r a i sh v e n a p i n a y t i v e t c c t lt h t ・ es Al e e ci n r ・ i c e ・ ・ o
维普资讯
第1 8卷 第 2期
20 0 7年 6月
化
学 研
究
Vo . 8 No. 11 2
CHE CAL R E MI ES ARCH
Jn 07 u .2 0
联 二萘 酚 配合 物 催 化 的不 对 称异 原 子 D e - le i s d r反应 研 究进 展 lA
催化 的异原子 De . l r isAd 反应中的应用.总结 了各 种基 于联 二萘 酚及其衍 生物 的用 于异原子 De ・ l r l e isAd 反应 l e 的新 的催化剂 , 以及能有效不对称催化该反应 的新 条件及新方法. 关键词 : 联二萘酚 ; 异原 子 De l r il Ad 反应 ; s e 不对称 催化 ; 综述 中图分类号 : 2 . ; Q2 3 1 06 13 T 4 . 文献标 识码 : A 文章编号 :0 8—1 1 (0 7 0 0 9 0 10 0 1 2 0 )2— 0 3— 5
不对称K-F反应合成研究进展

Recent Progress in Asymmetric Synthesis of Kabachnik-Fields Reaction
Wan, Dehui Wu, Mingshu* Ma, Jingya
(Key Laboratory of Tropical Medicinal Plant Chemistry of the Ministry of Education and Hainan Province, College of Chemistry & Chemical Engineering, Hainan Normal University, Haikou 571158)
Feng 等[29]于 2009 年报道了用手性环状氧化胺为配 体和 Sc(III)形成的配合物作催化剂催化芳香醛、2-氨基 酚 21 和亚膦酸二苯酯 20 三组分 Kabachnik-Fields 反应 1 h, 反应产率为 86%~96%, 立体选择性 ee 值为 78%~ 83%获得了光学活性的 α-氨基膦酸酯 19, 比 Ma 的 α-支 链醛的 Kabachnik-Fields 反应时间(168 h)大大缩短. 催 化剂具有大规模合成手性 α-氨基膦酸酯的潜力(Eq. 4).
有 机 化 学 DOI: 10.6023/cjoc114224
由3,3‘-大位阻基团取代的1,1’-联二萘酚衍生的手性磷酸的合成研究

西南民族大学学报 ・ 自然科学版
J o u r n a l o f S o u t h we s t Un i v e r s i t y f o r Na t i o n a l i t i e s ・ Na t u r a l S c i e n c e E d i t i o n
金 项 目( 1 1 N Z YB S 0 5 )
5 2 6
西南民族 大学学报 - 自 然科学版
第3 9卷
1 实验 部分
1 . 1 药品及仪器 9 一 葸硼[ 9 - 1 0 1 酸按文献方法制备. 手性 1 , l ’ . 联二萘酚连云港手性化学公司;丁基锂 购自 A f a r - A e s a r 公司; 四三
文 献标 识码 : A
文章编号: l 0 0 3 - 4 2 7 l ( 2 0 1 3 ) 0 4 . 0 5 2 5 - 0 5
3 , 3 ‘ . 双取代的 l , 1 ’ . 联二萘酚衍生的手性磷酸是一种高选择性 的有机小分子催化剂 J .自2 0 0 4 年A k i y a m a J 和T e r a d a t 4 1 小组报导手性磷酸催化的亚胺的不对称 Ma n n i c h反应 以来, 手性磷酸在亚胺参与的碳碳键形成 、 碳氮键形成 J 、碳氧键形成 等反应中表现 出了优 良的选择性, 合成 了一系列具有生物活性的手性胺化合物. 与 此同时,国内外的研究小组还发现手性磷酸不仅 有效地 活化亚胺, 而且能够高活性地催化醛 J 、硝基烯烃 等其 它类型亲 电试剂 的亲核加成反应, 表现出广泛的催化活性. 早期的研究已经表 明, 只有在联二萘酚的 3 , 3 ’ 一 位引 入取代基、 尤其是位阻较大的 9 - 蒽基和 2 , 4 , 6 一 三异丙基苯基时, 手性磷酸才能够取得优异的对映选择性¨ . 虽然 大位阻的基 团的引入取得 了高对映选择性 , 但这些基团的位阻同时给手性磷 酸的制备带来一定 的困扰. 基于 以 上考虑, 我们对传统的偶联方法进行了适当改进, 在联二萘酚的 3 , 3 ’ 一 位成功引入大位阻的9 一 葸基和 2 , 4 , 6 - 三异丙 基苯基, 成功地得到 了相应的手性磷酸 1 a 和1 b .
手性BINOLC—Ti自组装催化剂的合成及其在不对称催化硫醚氧化中的应用

中心 的构 象是 非均 相 化 后 生成 的催 化 剂 获得 高 的 催化 性能 的关 键. 常 , 通 自然状 态 下 自发 的 自组 装 能 生成 和保 持这种 理想 的构 象. 性 多齿有 机配 体 手 与 具有催 化 活性 的金 属离 子 的 自组装 很 容 易 形 成
一
基苯 乙烯 与 乙醛酸 乙酯 的 cr o y—n ab n l e的反 应 , e 反 应 产率 和 e 值 分 别高达 9 6 9 . e 9/、8/ 9 9 6
J n 20 u. 08
文 章 编 号 :10 —10 2 0 )20 2—4 0 01 9 ( 0 80 —2 80
手性 B N L — i I O C T 自组装催化剂 的合成及 其在不对称催化硫醚 氧化中的应用
袁 小 亚 ,王 晓天
( . 庆 交 通 大 学 理 学 院 , 庆 4 0 7 ;2 南 开 大学 高 分 子 化 学 研 究 所 , 津 3 0 7 ) 1重 重 004 . 天 0 0 1
能l , 且 这类 负 载方 法 制 备 步 骤 繁冗 , 组 制 备 了“ 靠 背 ” 链 ( I 该 背 桥 R,
R)双 B NOL 将 其 用 于 催 化 环 已一一 酮 与 二 苄 一 I . 2烯 基 马来 酸酐 的不对 称 mi al 成 反 应 , c e加 h 研究 表 明
ay s mme rc o i a i n o h o t e t i x d t ft i e h r o
硫 醚不对称氧 化是合成手性 亚砜 的最 简便 的方
法. 鉴于亚砜是一 种重要 的有 机合成 中间体 , 方法 该
已引起人们 的广泛关注 和深入研究 . m r[ Ue ua” 等最
手性磷酸催化剂在不对称合成中的应用资料

手性磷酸催化剂在不对称合成中的应用卫格非3130000884摘要手性磷酸是一类具有新型结构的高效,高对映选择性强酸性 Brφnsted酸催化剂,21 世纪以来的研究进展迅速,已经成为有机小分子催化剂的一个重要部分。
手性磷酸催化剂分子内同时含有Lewis 碱性位点和 Brφnsted 酸性位点,可同时活化亲电与亲核底物。
作为一种新型双功能有机催化剂,手性磷酸具有较高的催化活性和对映选择性,广泛应用于各式各样的有机不对称合成反应中。
关键词手性磷酸;不对称有机催化,对映选择性手性合成一直是有机合成方面研究的重点之一,通过反应获得单一手性化合物的方法主要有三种:手性源直接合成;手性诱导;不对称催化合成。
而不对称催化分为酶催化与化学催化。
由于手性酶催化剂价格高昂,难以通过人工合成,故化学催化的意义十分重大。
而化学催化又可以根据所用到的催化剂种类不同,细分为金属催化和有机小分子催化。
因为金属催化大多需要用到重金属,不仅成本较高,而且易造成重金属污染,所以有机小分子催化剂的研究作为一个新兴的催化领域在全世界范围内受到了极大的关注。
有机催化剂大致可划分为 Lewis 酸、Lewis 碱、Brφnsted 酸、 Brφnsted 碱四类,其中手性 Brφnsted 酸有机催化剂是一个正在飞速发展的研究领域。
手性 Brφnsted 酸催化剂通过与底物形成氢键或向底物转移质子,从而活化底物,类似于酶通过氢键与底物形成活化过渡态的过程,是一种催化不对称反应极为有效的途径。
磷酸衍生物与其它 Brφnsted 酸有机催化剂不同,是一种具有较强酸性的催化剂。
手性磷酸分子中,磷原子处于一个环状的结构中,无法通过单键自由旋转,因此催化剂具有刚性立体构型,从而具有一定的立体构型 , 通过调节其周围的取代基便可改变分子在催化过程中的对映选择性;磷原子上所连的羟基可作为 Brφnsted 酸的酸性位点提供质子或与底物形成氢键,而磷原子上的双键氧又可以作为 Lewis 碱性位点提供孤对电子,因此手性磷酸类化合物本身具有双性催化剂的特点,同时活化亲电试剂与亲核试剂,这不仅可进一步提高其催化活性,而且还可以在反应中更有效地控制立体选择性,从而实现高对映选择性合成。
负载于孔道内部的手性酸碱催化不对称Aldol反应

负载于孔道内部的手性酸碱催化不对称Aldol反应
李华;吕小兵
【期刊名称】《催化学报》
【年(卷),期】2009(30)7
【摘要】将手性的伯胺-叔胺与B酸组成的酸碱对负载到介孔材料SBA-15孔道的内表面,得到了一种非均相双功能催化剂.该催化剂在催化丙酮和不同醛的aldol反应时得到了中等的活性和对映体选择性,重复使用6次后活性没有明显下降.与以硅胶为载体的催化剂相比,以介孔SBA-15分子筛为载体的催化剂ee值更高,这可能是由于介孔孔道限制效应引起的.
【总页数】3页(P587-589)
【作者】李华;吕小兵
【作者单位】大连理工大学精细化工国家重点实验室,辽宁大连,116012;大连理工大学精细化工国家重点实验室,辽宁大连,116012
【正文语种】中文
【中图分类】O643
【相关文献】
1.主链含双层倍半硅氧烷的C2-对称双脯氨酰胺手性聚合物催化剂的合成及在不对称Aldol反应中的应用 [J], 沈金瑞;周哲;周远;卢翠芬;杨桂春;陈祖兴
2.手性螺环双膦氧化物催化的不对称还原-Aldol反应 [J], 张攀科;刘家旺;王正;丁奎岭
3.固载脯氨酸类手性催化剂的制备及在不对称Aldol反应中的催化作用 [J], 沈宗
旋;焦崇峻;丁一;马济美;顾佳;张雅文
4.联二萘酚衍生的手性二胺催化剂催化的丙酮与α酮酸酯不对称Aldol反应及机理研究 [J], 夏友付;刘全忠;邵周恒;赵晶
5.C_(2)轴手性双硫脲催化不对称Sulfa-Michael/Aldol串联反应 [J], 秦婷;陈平平;李淼;陈治明
因版权原因,仅展示原文概要,查看原文内容请购买。
手性聚合Salen - Co (Ⅲ) 配合物的合成及其催化性能

结论
可以用二醛和三醛合成相互交联的salen– Co(III)配合物。 合成的催化剂具有很高的活性和对映选择性。
2,6二甲基吡啶 Toluene甲苯 Benzaldehyde苯甲醛 Acetone丙酮 DMAP: 4-二甲氨基吡啶 DIC:N, N-二异丙基碳二亚胺 THF:四氢呋喃 Diaminocyclohexane己二胺 1,2-diaminocyclohexane 1,2环己二胺 2,6-lutidinium p-toluenesulfonate(LTPS)
手性聚合Salen - Co (Ⅲ) 配合物的合成及 其催化性能
近年来,手性聚合Salen - Co ( Ⅲ) 配合物 在催化烯烃不对称环氧化领域中的应用越来 越受关注。研究发现,以二聚或多聚的手性 Salen 配体合成的多核金属配合物在不对称 催化反应中可能有良好的催化活性。此外, Salen金属配合物在DNA的选择性绑定和环氧 化物共聚方面具有非常广泛的应用。 因此,我们设计合成了以供电子的苄氧基 为连接链的二聚水杨醛衍生物,将其与(1 R , 2 R) -环己二胺缩合制备出手性低聚Salen 配体, 再将该配体与Co3 + 配位,以期得到不易失活, 又能得到电子效应相关信息的手性聚合Salen - Co ( Ⅲ) 配合物。
水杨醛类衍生物是合成Salen 化合物的中间体, 不同取代基的水杨醛衍生物不论是空间效应还是电 子效应均对以此生成Salen 金属配合物的催化活性 有较为明显的影响。因此,水杨醛衍生物的合成对 Salen类金属配合物的分子修饰具有十分重要的意义。
典型的salen–Co(III) 催化剂
这种新型的催化剂的催化效率是传统催化剂的100 倍,而Hale Waihona Puke 它的应用范围更广。催化剂的制备
联二萘类配体的手性催化剂在

HR Hs N (C 2H 5)2
[R h((S )-B IN A P )]+
m yrcene
g eranyld ieth ylam ine
Hs HR N (C 2H 5)2
H3O+
CHO
Z n B r2
(R )-citrone lla l en am ine 96% ee~99% ee
(R )-citronellal
.
.
2.烯烃的不对称氢硅烷化反应
20世纪70年代初,人们利用手性膦-钯催化剂催化前 手性烯烃的不对称氢硅烷化反应生成手性的烷基硅 烷,但反应的对映选择性较差,最好的只有50%左 右。进入90年代以后才有了突破性的进展。1991年, 首次报道了单齿膦配体MOP和钯组成的催化剂在末 端烯烃的不对称氢硅烷化反应中获得97%的高对映 选择性。在此之后,MOP成为催化烯烃不对称氢硅 烷化反应的一个重要手性配体。
D iels-A lder 反应是构建复杂分子的一方法, 特 别是杂D iels-A lder 反应。此反应的几个重要 特征是: 协同性、区域选择性及由此产生的手 性中心的立体化学。以BINAL 2H 衍生物作为 不对称合成的催化剂,首次解决了D iles-A lder 反应中的立体化学问题[17 ] (图8)。
R3
R2
R1
R2 R3CONH
COOR1
PO(OCH3)2 R NHCHO
R3
R2
R1
R2 R3CONH
COOR1
PO(OCH3)2
R
NHCHO
.
1.2烯胺的不对称氢化
在下烯胺的不对称氢化反应中,,反应产物α-
芳基(Ar=Ph)-α-乙酰胺基乙烷的官学产率最
不对称催化在药物合成工业中的应用

不对称催化在药物合成工业中的应用不对称催化在药物合成工业中的应用1. 引言不对称催化是一种重要的有机化学方法,它在药物合成工业中发挥着至关重要的作用。
通过引入ir分子配体,不对称催化可以实现手性化合物的合成,这对于药物研发和合成具有极大的影响力。
本文将探讨不对称催化在药物合成工业中的应用,并分析其优点和挑战。
2. 不对称催化的基本原理不对称催化的基本原理是通过引入手性配体使催化剂具有手性,从而实现对手性分子的选择性催化。
利用选择性催化反应可以有效地合成手性分子,如手性药物。
3. 不对称催化在药物合成中的应用不对称催化在药物合成中有着广泛的应用。
举例来说,不对称氢化反应是一种常用的不对称催化反应,可以用于合成手性醇和手性氨基醇等化合物,这些化合物是药物研发中的重要中间体。
还有不对称Michael反应、不对称烯烃加成反应等催化反应可以用于合成药物中的手性分子。
这些不对称催化反应提供了高效、高选择性和经济可行的方法来合成手性药物。
4. 不对称催化的优势不对称催化在药物合成中有着显著的优势。
不对称催化可以实现对手性分子的高选择性催化,避免了对手性化合物的分离和纯化过程,提高了合成效率。
不对称催化反应的底物范围广泛,可以适用于各种不同结构的化合物。
不对称催化反应通常使用金属催化剂,具有良好的催化活性和催化效果。
5. 不对称催化的挑战不对称催化在药物合成中也面临着一些挑战。
催化剂的选择是一个重要的问题。
不同的反应需要不同的手性配体,因此要根据具体反应的要求选择合适的配体。
合成手性配体的方法也是一个关键问题。
目前,人们正在积极研究和开发新的手性配体,以满足不同反应的需求。
不对称催化反应的条件和反应性质也需要进一步优化和改进。
6. 总结回顾不对称催化在药物合成工业中的应用是至关重要的。
通过引入手性配体,不对称催化可以实现对手性分子的高选择性催化,为药物研发和合成提供了高效、高选择性和经济可行的方法。
不过,不对称催化还面临着一些挑战,包括催化剂的选择、合成手性配体的方法以及反应条件的优化。
不对称催化制备手性药物的研究及应用

不对称催化制备手性药物的研究及应用手性药物是治疗疾病的重要药物之一,它们具有具有对称性的立体异构体,其中至少存在一个手性中心。
手性药物的药效、代谢以及副作用往往会因为它们的对映异构体而产生差异。
因此,对手性药物的合成制备研究具有重要意义。
在手性药物制备中,不对称催化成为目前最为有效的制备手性药物的手段之一。
一、不对称催化的概念与分类不对称催化是指在反应体系中加入具有手性催化剂促进对映异构体产率不同的催化反应。
不对称催化可以被分为金属催化和非金属催化两类。
金属催化是通过一系列匹配的金属离子和手性配体组成复杂体系,使得金属催化剂得到对映异构体产率不同的结果。
非金属催化则主要依靠有机小分子催化剂,通过空间位阻等效应催化反应进行不对称反应,实现对手性药物的制备。
二、不对称催化在手性药物制备中的应用1. 脯氨酸和异亮氨酸的不对称合成脯氨酸和异亮氨酸是人体必需氨基酸,被广泛使用在医药和日用化工等行业。
对于脯氨酸和异亮氨酸的不对称合成,钯催化在手性Cbz谷氨酰胺上(DmsL)与戊烯的羰基重排反应中,将不对称催化转化为了一种非对称环合成方法,成功合成了手性脯氨酸和异亮氨酸类似物。
2. 不对称羟醛合成不对称羟醛的制备是合成手性化合物的一种重要方式。
其一般是通过催化剂诱导的不对称重排反应或不对称醛缩合反应性(如错合反应)形成。
在不对称羟醛合成中,黄教授组提出的新的手性罗丹明催化剂分子是根据原子转移催化(ATC)理论设计的,在非常优异的对映选择性和接受性下,优化反应条件使得合成产率提高到80%以上。
三、不对称催化面临的挑战尽管不对称催化可以推动手性药物制备的进步,但这项技术还是面临着一些挑战。
1. 反应缺陷不对称催化由于催化剂选择性差,容易受到其他反应物影响,导致反应失效。
2. 催化剂的研究尽管已经有许多有效的催化剂,但因催化剂选择性有限或副反应严重,仍需要更有效、更选择性的催化剂。
3. 抗酸碱性钯催化剂在反应中很容易受到酸碱催化剂的影响,进而导致催化剂失去活性,因此需要选择稳定的催化剂或优化反应条件,来提高催化剂的抗酸碱性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
B I NO L d e r i v a t i v e s( 4 - 5 ) w e r e s u c c e s s f u l l y s y n t h e s i z e d a n d a p p l i e d i n t h e a s y m me t r i c e p o x i d a t i o n o f c h a l c o n e . T h e o p t i c a l a c t i v e e p o x i d e w a s o b t a i n e d i n h i g h y i e l d( 8 8 %)a n d mo d e r a t e e e v a l u e( 4 6 %)w i t h 3 一 h y d r o x y l —
S y n t h e s i s o f 3 - S u b s t i t u t e d BI NOL d e r i v a t i v e s a n d a p p l i c a t i o n i n
a s y mm e t r i c e po x i da t i o n r e a c t i o n
Y o u Q i a n g , Wa n g L i n , S o n g Hu a ,H e Y u l i n , Mo u Y a o , Wa n g Q i n , Wa n g L i D e p a r t me n t o f P h a r ma c y ; l D r u g Di s c o v e r y R e s e a r c h C e n t e r , L u z h o u Me d i c a l C o l l e g e
A b s t r a c t Ob j e c t i v e : T o s t u d y t h e a s y mm e t r i c e p o x i d a t i o n o f 仪, [ 3 - u n s a t u r a t e d k e t o n e w i t h B I NO L d e i r v a t i v e
c o o r d i n a t e d wi t h F e .L a o r A1 t o c a t a l y z e t h e a s y mme t r i c e p o x i d a t i o n o f c h a l c o n e . Re s u l t s : T h e 3 一 s u b s t i t u t e d
尤强 , 王琳 , 宋华 , 何 玉玲 , 牟瑶 , 王钦 , 王力
( 泸州医学院药学院 ; 药物 与 功 能性 食 品研 究 中心 , 四 川泸 州 6 4 6 0 0 0 )
摘 要 目的 : 研究 o 【 , B不饱 和 酮 的 不对 称 环 氧 化 反应 。方 法 : 利用手性的 3 一 取 代联 二 萘 酚 和 F e 3 、 L a ”、 A 1 3 的配 和 物 诱 导 不 对 称 环 氧 化 反应 。结 果 : 成功合成了三个 3 取代联二萘酚衍生物 , 并 将 其 运 用 于 不 对 称 环 氧 化 反 应 。手性 L 配 合 物 催 化 的环 氧 化 反应 , 取得 8 8 %的产 率以 及 4 6 % 对 映异 构体 过 量 ; 手性 F e , 和 A l ” 配合物体 系 , 环氧化产率较高 , 产 物 为 消 旋 体 。结 论 : 手 性 的 3 一 羟 甲基 联 二 萘酚 镧 配 合 物 能 够 催 化 0 【 , B不 饱 和 酮 的 不 对 称 环 氧 化 反 应 并 获得 较 高 产 率 和 中 等 的 对 映 选择 性 。对该 不对 称 环
泸州 医学 院学 报
2 0 1 3年
第 3 6卷
第 4期
3 6 5
J o u r n a l o f L u z h o u Me d i c a l Co l l e g e Vo 1 . 3 6 No . 4 2 0 1 3
手性 3 一 取代联二萘酚衍 生物 的合成及在 不 对 称环 氧化 中 的应 用
氧 化 反应 的研 究 , 为合 成 光 活性 环 氧 化 物 类药 物 中 间体 提 供 了 新 方 法 。
关键词 3 一 取 代 联 二 萘 酚 衍 生物 ; 仅, B不饱 和 酮 ; 不 对 称 环 氧化
中图 分 类 o i : 1 0 . 3 9 6 9 6 . i s s n . 1 0 0 0 — 2 6 6 9 . 2 0 1 3 . 0 4 . 0 1 3
me t h y l n a p h t h 0 l / L a 。 a s c a t a l y s t , w h i l e p o o r e n a n t i o s e l e c t i v i t y w a s o b s e r v e d w h e n t h e 3一 h y d r o x y l me t h y l n a p h t h o l /
