第五章 不对称环氧化
jacobsen 不对称环氧化反应的最新进展

图6 卟啉环的结构图
有效模拟物可在温和的条件下活化分 子氧, 从而实现烯烃的环氧化。 4个 meso和8个β位都可以引入手性 基团,形成手性金属卟啉(图6)。
8
手性salen催化剂的研究进展
• 1990 年, Jacobsen 和 Katsuki报道了含手性碳
jacobsen 不对称环氧 化反应的最新进展
报告人
1
jacobsen 不对称环氧化反应的最新进展
1.生物酶催化的非官能化 烯烃不对称环氧化反应
2.手性salen催化剂的研 究进展
2
生物酶催化的非官能化烯烃不对称环氧化反应
1.氧化酶细胞色素P450
salen络合物是一个与氧化酶细胞色素P450有关的仿生试剂。
图 7 非对称手性 Mn(salen)化合物的催化剂 4
图 8
非对称手性 Mn(salen)化合物的催化剂 5
11
手性salen催化剂的研究进展
1997 年, Hashihayata 用非手性的 salen Mn(Ⅲ)催 化剂(图 9), 加入助催化剂4-PPNO 时催化烯烃环氧 化反应, 得到了较好的产率。
的催化效果及对映选择性。
•
1993 年, Katsuki第二代手性催化剂 (图 6), 催化顺式烯烃时, 取得了 86%~91%的 ee 值。
图 5
Katsuki 催化剂 2
图 6
Katsuki 第二代手性催化剂 3
10
手性salen催化剂的研究进展
20 世纪 90 年代中后期 Kureshy 与Kim报道了一系列的非对称手性 Mn(salen) 化合物的催化剂(图 7、图 8), 并用于烯烃的环氧化反 应.打开了不对称 Schiff 碱化合物合成的新局面. 这种方法很容易获得不同的立体效应与电子效应, 而这 两点是 salen 配合物之所以拥有很好催化性能的重要 因素.
第5章第四节 利用前手性原料制备手性药物

要点:
不对称合成概念 手性源合成 手性合成子与手性辅剂 一个成功的不对称合成反应的标准
不对称合成分为对映体选择性合成和非对映异构体选择性 合成两类 对映体选择性合成指潜手性底物在反应中有选择的生 成一种对映异构体; 非对映异构体选择性合成指手性底物在生成一个新的 不对称中心时,选择性生成一种非对映异构体。例如潜手 性烯烃和手性烯烃的环氧化反应,前者需手性催化剂的不 对称诱导作用,而后者本身结构中的不对称中心具有不对 称诱导作用,不需另加手性催化剂。 不对称合成反应成为合成手性药物的重要途径,与经 典的拆分技术和酶催化的不对称合成反应等技术一道广泛 地用于工业生产。
萘普生合成
二、手性源的组成和应用 手性源中相对便宜的手性原料有糖类、羟基酸 类、氨基酸类、萜类和生物碱类。
手性药物合成实例 地尔硫卓(Diltiazem) 地尔硫卓属于钙离子拮抗剂,适用于缺血 性心脏病、运动性心绞痛及陈旧性心肌梗塞引 起的心绞痛。
随着酶催化动力学拆分技术的发展,发现粘 质沙雷氏菌中的酯酶可选择性地水解(2S,3R)环氧化物,有效地拆分Darzen反应的一对产物, 得到(2R,3S)-环氧化物。在这条路线中,拆分 一步提前至第二步,且反应总步骤缩短为6步, 逐渐取代了旧路线。
4.不对称催化氢化等还原反应 手性二膦铑催化剂的发现与应用,改变丁烯烃、 烯胺、羰基不对称催化氢化的发展进程,并使 不对称催化氢化成为制备各种光学纯化合物的 最有效最方便的方法之一。
例如:抗高血压药物L-多巴中的烯胺还原 采用DIPAMP手性铑催化剂立体选择性可达95%。
5. Sharpless环氧化反应 20世纪80年代初发现的烯丙基伯醇的 Sharpless环氧化反应,已经成为催化不对称 合成中的经典反应。Sharpless环氧化利用可 溶性的四异丙氧基钛(DET)和酒石酸二乙酯 (DIPT)或酒石酸二异丙酯(TBHP)为催化 剂,叔丁基过氧化物为氧化剂,得到立体选择 性大于95%和化学收率70%-90%的环氧化物。
烯烃的不对称环氧化反应

烯烃的不对称环氧化反应***** ********摘要本文主要论述了传统的烯烃环氧化反应的不足之处,并简述了Sharpless以及Jacobsen 等人在不对称环氧化反应发面的研究成果及其贡献。
并简要讨论了未来的研究方向。
关键词烯烃环氧化手性合成催化剂前言手性化合物具有十分重要的应用价值,然而其合成具有很大的难度。
因此,目前有机合成化学家们在手性合成这一领域展开了大量的研究工作,新的不对称合成反应和合成路线不断涌现。
在不对称合成中最具有挑战性的是不对称催化反应,它是利用催化剂的不对称中心来诱导产生产物的手性。
研究类容及讨论通常在没有手性催化剂的条件下,实验室中常用有机过酸作环氧化试剂。
环氧化反应是顺势加成,所以环氧化合物的构型与原料烯烃的构型保持一致。
因为环氧化反应可以在双键平面的任一侧进行,所以当平面两侧空阻相同,而产物的环碳原子为手性碳原子时,产物是一对外消旋体。
当平面两侧的空阻不同时,位阻小的反应快,如此便能得到以某种构型为主的混合产物。
因该方法只能用于大量合成空间位阻较小的产物,并不能满足手性合成的需求,因此化学工作者们作出了进一步探究。
其中最著名的是20世纪80年代初Sharpless发展的不对称环氧化。
在该反应中D-酒石酸二乙酯作为手性源控制环氧化只从双键平面的一边进行。
如果在反应中用L-酒石酸二乙酯,那么环氧化将从双建平面的另一边进行。
只需要催化剂量的光学纯酒石酸二乙酯就可以实现高度对映选择性的环氧化。
【1】图2. Sharpless不对称环氧化反应Sharpless的不对称环氧化适用于双键α位上含羟基的底物——烯丙醇类化合物。
20世纪90年代初,Jacobsen开发了一类含C2对称轴的手性配体,这些配体与Mn(Ⅲ)形成的络合物可以高度对映选择性地催化非烯丙醇类烯烃双键的环氧化。
该反应迅速得到了广泛应用。
图4. Jacobsen不对称环氧化反应反应最常用的氧化剂为亚碘酰苯(用于有机溶剂)或次氯酸钠水溶液(用于水介质)。
sharpless不对称环氧化机理

sharpless不对称环氧化机理
Sharpless不对称环氧化是一种重要的不对称催化反应,它可以用来合成复杂的有机分子。
Sharpless不对称环氧化机理是由美国化学家K. Barry Sharpless在1980年提出的,它是
一种催化反应,可以用来合成复杂的有机分子。
Sharpless不对称环氧化机理的基本原理是,在一个有机反应体系中,一种特定的催化剂(如铂催化剂)可以诱导一种不对称的环
氧化反应,从而产生一种不对称的有机分子。
Sharpless不对称环氧化机理的催化反应可以分为三个步骤:第一步是催化剂的活化,第
二步是环氧化反应,第三步是催化剂的去活化。
在第一步,催化剂(如铂)被活化,从而
使它能够与有机物质发生反应。
在第二步,催化剂诱导有机物质发生环氧化反应,从而产
生不对称的有机分子。
在第三步,催化剂被去活化,从而结束反应。
Sharpless不对称环氧化机理的优点是,它可以用来合成复杂的有机分子,而且反应的速
度很快,可以在短时间内完成反应。
此外,Sharpless不对称环氧化机理的反应产物具有
高度的不对称性,可以用来合成复杂的有机分子。
总之,Sharpless不对称环氧化机理是一种重要的不对称催化反应,它可以用来合成复杂
的有机分子,而且反应的速度很快,可以在短时间内完成反应,反应产物具有高度的不对
称性。
因此,Sharpless不对称环氧化机理在有机合成中具有重要的应用价值。
不对称氧化反应

第五章不对称氧化反应氧原子直接与不对称碳原子相连的含氧取代基广泛存在于天然产物和药物中,同时也容易被其它基团如氨基,卤原子,硫原子甚至烷基等取代,成为所合成化合物重要的官能部分。
不对称氧化反应可以直接在反应物中引入含氧取代基,使所连接的碳原子具有手性,是极其重要的一类反应,对这类反应的研究,已经取得了引人瞩目的发展,但仍然是不对称合成研究的重点。
3.1 烯丙醇烯烃的不对称环氧化3.1.1 Sharpless反应及特点烯烃的环氧化最开始使用过酸作氧化剂来完成的,因此很早就有人使用手性的过酸来进行不对称环氧化,但e.e.值一般都低于20%,普遍认为这是由于手性中心离反应中心太远了。
后来发现了过渡金属催化的环氧化反应,因此很多手性配体的金属配合物用于不对称环氧化的研究,但结果都不是特别好。
Sharpless在经过10年多的潜心研究后,终于在1980年发展了高效的金属钛-酒石酸酯不对称环氧化催化剂,这种催化剂适用于非常广泛的烯丙醇类烯烃,具有能和生物酶比美的高的催化活性和对映体选择性,容易得到,价格便宜,自从发现以来广为人们用于合成手性的烯丙醇的环氧化物。
因此,Sharpless 获得了2001年的诺贝尔化学奖。
Sharpless不对称环氧化催化剂使用钛酸异丙酯中的钛作为催化中心,天然或者人工合成的作为手性配体,叔丁基过氧化氢(TBHB)为供氧剂,以无水的二氯甲烷为溶剂,在-20o C下对烯丙醇类烯烃进行环氧化,反应一般在24小时左右完成,产率70-90%,对映体选择性大于90%。
Me COOH, Ti(O-i-Pr)22o70 - 90%OR2R1R3OH >90% eeD-(-)-tartrateL-(+)-tartrate将等摩尔的钛酸异丙酯和酒石酸二异丙酯(DIPT)混合,即释放出2当量的异丙醇,同时生成Ti(O-i-Pr)2(DIPT)2配合物。
通过分子量测定,以及红外光谱和核磁共振谱分析,配合物Ti(O-i-Pr)2(DIPT)2是以二聚体的形式存在的。
jacobsen不对称环氧化反应

Jacobsen不对称环氧化反应是有机合成领域中一种重要的反应,它可以有效地将不对称性引入到环氧化合物的合成中。
本文将从反应机理、应用领域和未来发展方向等方面进行详细介绍。
一、反应机理Jacobsen不对称环氧化反应是由美国化学家Jacobsen等人于20世纪90年代初首次提出的。
它的反应机理如下:手性金属配合物与碳碳双键发生配位作用,形成一个活性中间体。
过氧化物与金属配合物发生氧化还原反应,从而实现环氧化合物的合成。
在反应过程中,手性金属配合物起到催化剂的作用,使得环氧化合物具有不对称结构。
二、应用领域Jacobsen不对称环氧化反应在有机合成领域具有广泛的应用。
它可以用于合成医药领域中的药物分子。
由于手性分子在生物活性中起到重要作用,因此能够合成具有不对称结构的环氧化合物对于开发新型药物具有重要的意义。
Jacobsen反应还可以应用于材料领域,合成具有特定空间结构的高分子材料,从而拓展新型功能材料的应用范围。
Jacobsen不对称环氧化反应还在农药合成和天然产物全合成中得到了广泛的应用。
三、未来发展方向随着有机化学合成领域的不断发展,Jacobsen不对称环氧化反应也在不断进行改进和拓展。
未来,可以通过改变金属配合物的结构和配体,提高反应的催化效率和选择性。
另外,还可以探索新的反应底物和反应条件,进一步拓展该反应的应用范围。
结合计算化学和实验方法,研究反应机理,也是未来发展的重要方向之一。
Jacobsen不对称环氧化反应是有机合成领域中一种重要的反应,它可以有效地引入不对称结构,拓展了有机合成的方法和应用领域。
随着有机合成领域的不断发展,相信Jacobsen不对称环氧化反应在未来会有更广阔的应用前景。
四、改进方法为了提高Jacobsen不对称环氧化反应的效率和选择性,研究人员可以通过改进金属配合物的结构和配体,来优化反应条件。
通过设计合适的手性配体,可以提高金属配合物对底物的识别能力,提高反应的立体选择性。
《不对称环氧化》课件

05
不对称环氧化的实验技术与 操作
实验前的准备
实验材料准备
实验设备检查
确保所有实验材料都经过质量检查,并按 照实验要求进行准备。包括但不限于催化 剂、试剂、溶剂、玻璃器皿等。
对实验所需的所有设备进行检查,确保其 正常工作。如搅拌器、温度计、压力计等 。
实验环境准备
实验人员培训
确保实验室环境符合实验要求,如温度、 湿度、清洁度等。
《不对称环氧化》PPT课件
目录 Contents
• 引言 • 不对称环氧化的基础知识 • 不对称环氧化的反应机制 • 不对称环氧化的催化剂研究 • 不对称环氧化的实验技术与操作 • 不对称环氧化的研究进展与展望
01
引言主题介绍对称环氧化一种有机化学反应,涉及环氧基 团在有机分子中的形成。
不对称环氧化
不对称环氧化的原理
总结词
不对称环氧化是指在环氧化反应中,选择性地在一个特定位 置的碳-氢键上发生氧化反应,生成具有手性中心的三元环氧 化物。
详细描述
不对称环氧化的原理基于手性中心的诱导和传递作用。通过 使用手性催化剂,可以控制环氧化反应的立体化学,使得特 定的碳-氢键优先被氧化,生成具有特定构型的不对称环氧化 物。
不对称环氧化的应用
总结词
不对称环氧化在有机合成、药物合成和材料科学等领域具有广泛的应用。
详细描述
不对称环氧化生成的环氧化物可以作为合成其他复杂有机化合物的重要中间体,例如醇、醚、羧酸等。在药物合 成中,不对称环氧化可用于合成具有特定立体构型的药物分子,提高药物的生物活性和选择性。此外,不对称环 氧化在材料科学中也具有应用价值,例如在合成功能性高分子材料和手性功能材料等方面。
考虑催化剂的经济性、可回收利用性 和环境友好性。
不对称氧化反应pppt课件

2、Sharpless环氧化反应的特点:
(1)简易性: 所有的反应组份都是廉价的,并且
是商品化的; (2)可靠性:
虽然大的R取代基是不利的,但对于 大多数烯丙醇,反应都能成功;
13
(3)高光学纯度: 一般>90% d.e.,通常 > 95% d.e. ;
(4)对底物中的手性中心相对不敏感: 在已带有手性中心的烯丙醇底物中,手
于图所示的规律尚未见有例外。 (6)2,3-环氧醇作为中间体的多用性:
新的选择性转化扩大了该反应的实用 性和意义。
19
3、Sharpless环氧化反应的机理:
在Sharpless环氧 化反应体系中,存 在着多种Ti-酒石酸 酯配合物,其中, 以双核配合物(见 右图)占主导地位。
20
21
反应经过Ti(IV)混合型配合物A (带有烯丙氧基和TBHP阴离子为配体) 进行,烷基过氧化物二齿配位于Ti(IV) 中心而受到亲电活化,氧转移至烯键上 产生了配合物B。
再以重氮甲烷酯化,合成得到环氧化合 物(2), 76%-80% e.e.;
接着以叠氮开环得到(3),经过一系 列反应后,得到紫杉醇侧链(4)。
33
反应条件如下:
34
(2) X2—Ti(OPri)4参与的开环反应:
在化学计量的Ti(OPri)4存在下,用等 摩尔量的卤素(Br2,I2)处理 2,3-环氧 醇,可以在温和条件下,高通用性、高区 域选择性的合成得到卤代醇。
不对称氧化反应
Asymmetric Oxidation
1
主要讲解内容择要
1、 Sharpless环氧化反应(AE反应); 2、非官能团化烯烃的不对称氧化; 3、不对称双羟基化反应(AD反应); 4、不对称羟氨化反应(AA反应)。
不对称烯烃的环氧化反应

10
不同金属卟啉催化剂在相同条件下催化苯乙烯环氧 化反应检测结果如表:
11
可见,卟啉化合物中苯环上的取代基对金属卟啉催 化剂的催化性能影响很大 , 随着取代基的变化 , 催 化活性依次增强。通过考察这些基团的电子效应, 当它们连于苯环时,其供电子能力从1到5依次增强。
因此, 可以得出这样的结论 : 随着卟啉苯环上取代 基供电子能力的增强,金属卟啉化合物的催化活性 逐渐减弱,这一规律通过对金属卟啉催化烯烃的环 氧化反应的催化机理可得到较满意的解释。
12
在此催化过程中,金属卟啉化合物首先与吡啶形成配 合物,然后与ClO-结合,进而生成催化反应的关键中 间体a,图示如下:
13
手性过渡金属-Salen锰配合物
手性过渡金属 -Sciffoase( 希夫碱 ) 配合物作环氧 化催化剂的研究只对 Mn(Ⅲ)配合物作了大量报道。
相对于手性过渡金属卟啉配合物来说手性过渡金 属 -Salen 配合物的合成简单 , 易控制配体的电子 , 立体因素 , 不对称中心更易于接近金属中心 , 在环 氧化的立体控制上有更好的效果。
不对称烯烃的环氧化反应
目录
第一 过渡金属配合物催化烯烃不对称环氧化 反应 第二 手性酮催化的烯烃不对称环氧化反应
2
第一 过渡金属配合物催化烯烃不 对称环氧化反应
对于顺式烯烃、三取代烯烃和四取代烯烃,以过 渡金属为络合中心的配合物催化剂都可以进行有 效的对映体选择性催化环氧,这类催化反应称之 为过渡金属催化不对称环氧化。其中包括:Salen 锰、金属卟啉,以及手性钼等的催化体系。
20
手性酮与KHSO5可原位产生手性二氧杂环丙烷
后者无论是对富电子烯烃还是贫电子烯烃都是 一种很有效的有机氧化剂,它能快速实现反应并 且后处理简单。
《不对称环氧化》课件

反应温度和反应时间的 优化
反应温度和反应时间的选择 与底物、催化剂的特性、溶 剂特性和反应条件等密切相 关,需要具体问题具体分析。
反应底物的选择
底物的选择需要根据具体的 不对称合成需求而定,其中 一些关键性质如手性、活性 和稳定性等同样需要考虑。
应用案例
对药物合成的应用
对天然产物合成的应用
利用不对称环氧化合成手性中间 体,是生产药物原料的重要方法。 如甲硝唑、费洛巴美辛结果等药 物中有些原料就应用了不对称环 氧化技术。
2 局限性和未来发展方向
目前,不对称环氧化技术还存在一些局限性,但未来有望通过新型催化剂和反应条件的 不断改进,开发更高效、更有选择性的不对称合成方法。
应用领域
应用领域广泛,包括医药、 农药、香料、光电材料等, 是一项非常有前途的不对称 合成技术。
不对称环氧化的机制
环氧化反应简述
环氧化反应是一种加氧反应,通 过环氧化剂对双键进行环氧化得 到环氧化物产物。
不对称环氧化的机制
不对称环氧化是通过使用手性催 化剂实现不对称的环氧化反应, 产生手性环氧产物。
不对称环氧化
本课件主要介绍不对称环氧化的机制、催化剂、反应条件和应用案例。不对 称合成技术的重要性越来越被人们所认识,我们将通过多个实际应用案例展 示这一技术的用途和前景。
简介
什么是不对称环氧化?
不对称环氧化是利用不对称 催化剂介导的环氧化反应得 到不对称产物的反应。
不对称产物的重要性
重 要原料。
外消旋底物与内消旋中间体
外消旋底物在催化剂作用下形成 内消旋中间体,中间体再进一步 环氧化得到手性环氧产物。
不对称环氧化的催化剂
1
铱催化剂
2
铱催化剂有较好的活性和对映选择性,
不对称环氧化反应最新研究进展

1 烯丙醇的不对称环氧化
1 1 烯丙醇的 S ap ̄s . hrl —Ka u s t l 对称环氧化 (A s d不 S E) 18 90年 , B S apes K. . hrl 等成功 地进 行 了烯丙 醇 不对 称 s 环氧化 的合成 , 被认为是 不对称催 化领域的重大突破之一 。 S ̄pe 等人用酒石酸二酯 和四异丙 氧基钛作 催化剂 , l ls - s 叔丁基过氧化氢 ( H ) 1 作氧化 剂 , 使烯丙 醇环氧 化产物 地
光学活性 的环氧化 物是一类 重要 的生理活性化合 物 , 不 但是许多天然产物 的活性 中心 , 而且也是一种重 要的有机 反
对聚合物负载金属络合物以及新型手性配体 BN L催化的 IO 各类不对称催化环氧化体系及最新进展与应用进行述评。
应中间体。此类化合物的环上有两个手性碳原子, 通过选择 性开环 和官能 团转化等 反应 , 以合成许多有价值 的手性 化 可
关键 词 :BN L 不对称环氧化; B 不饱和酮 ; IO ; ,一 非官能化烯烃; 聚合物; 负载
r l ts s a c De eo m e so y m erc Ep x da i n S se s I eLa e tRe e r h v l p nt fAs m 1 ti o i to y tm
b s mm erce p xd t n ra t n .S v r l tae i ra y y ay t x i o ia i ec i s e ea r tg e f s mm er p x d t n o lf sweed v lp di o o s s o ti e c o iai f e n r e eo e o o i n rc n er . Vaiu e cin d t e d v lp n s o s m merc e x d t n y tms wee rve d Th e e tya s ro s r t s a h e e me t fay a o n o t p i ais se r e iwe . i o o e
第五章氧化反应

SeO2试剂 (shìjì)
(82%)
精品资料
二 羰基 位活性烃基的氧化
1.形成a-羟酮 (1)反应 (fǎnyìng)通式
精品资料
• (2)影响(yǐngxiǎng)因素
加BF3可催化(cuī huà)酮的烯醇化, 从而有利于乙酰化。
精品资料
(86%)
O2氧化(yǎnghuà)
或用Zn/CH3COOH代替 (dàitì)P(OC2H5)3亦可
CH3 CrO3-吡啶 / CH2Cl2
CH3 (68%)
O
氧化时发生(fāshēng)烯丙双键移位。
用铬酸叔丁酯CrO3-t-BuOH也可烯丙位羟基氧化。
OAc
OAc
AcO
CrO3-t-BuOH
AcO
精品资料
(60%) O
3. 用过酸酯氧化 (yǎnghuà)
精品资料
脂肪族烯烃氧化时,发生(fāshēng)异 构化作用
被氧C化H;2CH3
SeO2
CH2CH3 HO
精品资料
⑤末端双键氧化(yǎnghuà)时,发生烯丙位重排, 羟基引入末端
以上(yǐshàng)为Guillemonat规 则(1939)
精品资料
SeO2
•酮
• 烯丙位氧化-双键位置(wèi zhi)氧化,电子云 密度高则易氧化
精品资料
精品资料
2 CrO3-吡啶(bǐdìng)复合物(Collins试剂)
[Ce(NH4)2(NO3)6,CAN]选择性好
• ②铬酰氯为氧化剂
CrO2Cl2
精品资料
• (3)影响(yǐngxiǎng)因素 • ①反应温度
精品资料
• ②电子效应的影响(yǐngxiǎng)
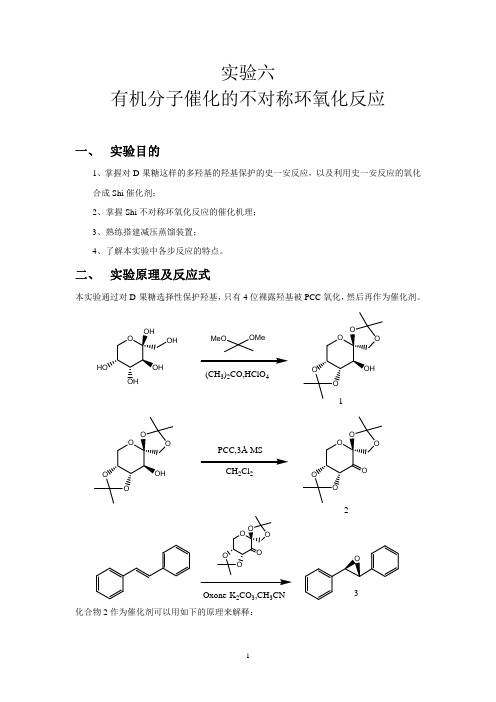
实验六-有机分子催化的不对称环氧化反应
OH
O
OH
HO
OH
OH
MeO
OMe
(CH3)2CO,HClO4
O
O
O
O
OH
O
1
O
O
O
O
OH
O
PCC,3Å MS CH2Cl2
O OO
O
O
O
Oxone-K2CO3,CH3CN 化合物 2 作为催化剂可以用如下的原理来解释:
O
O
O
O
O
O
2
O
3
1
O
O
O
O
O
O
O
HSO5
O
O
O
O
O
O
O
SO42
O
O
O
O O
O O O
五、注意事项:
浓缩 溶液
制备板 纯化
产物3
1、 制备 1 时,70%高氯酸和有机物的反应可能会出现着火甚至爆炸,无水HClO4是威力很 大的爆炸物。操作这种化合物一定要小心。
2、 制备 1 中,搅拌 5h,悬浊液在 1-2h 后会变成澄清清澈的无色溶液。目标化合物是反应 的动力学产物,会很容易异构化为另外一种热力学产物。反应时间控制对减少热力学产 物的生成是很重要的。
四、操作步骤:
1、 目标化合物 1 的制备
D-果糖(0.9g,5mmol)、2,2-二甲氧基丙烷(0.4ml,3.1mol)和丙酮 15ml 加入一个 50ml 圆底烧瓶,加磁子。烧瓶在冰浴中冷却 15min,然后一次加入 0.2ml 70%高氯酸。 所得悬浮物在 0℃下搅拌 5h。然后加 0.25ml浓氨水将酸中和,再保持于 25℃下旋转蒸发除 去溶剂,得到白色固体。将固体溶在 10ml二氯甲烷中,并用饱和氯化钠溶液洗涤,加无水 Na2SO4干燥,过滤,再旋蒸发浓缩成固体。加入 5ml沸腾的石油醚和 2ml二氯甲烷,然后烧 瓶自然冷却到室温,可看到产物析出。继续冷却到-25℃放 4h可以结晶出第二批晶体。抽滤 分出固体,用冷却的石油醚洗涤,得到 0.326g目标化合物很好的白色针状晶体。
不对称环氧化

不对称环氧化:
S h a r pless体系(仅对烯丙醇类底物有效)
分子筛存在下,钛酸四异丙酯(Ti(OiPr)4):酒石酸二乙酯(DET)(D或L)用量,,TBHP(叔丁基过氧化氢)。
手性Salen催化体系(催化顺式烯烃环氧化较高选择性):Salen-Mn(III)催化剂,NaClO水溶液、H2O2,亚碘酰苯,
Jacobsen 催化剂
Katsuki 催化剂
手性酮催化体系:
KHSO5为氧化剂,与手性酮原位生成dioxirane,后者可进行不对成环氧化烯烃,
手性金属卟啉催化体系:
负载手性催化体系:
不成熟方法:
手性亚胺盐催化剂
聚氨基酸催化剂
手性季铵盐催化剂
唐除痴周正洪《不对称反应概论》
《不对称催化反应.。
第五章不对称环氧化.

Ti(TBHP)(烯丙醇)(DET)
Ti(O-t-Bu)( 环氧醇)(DET)
Ti的二聚体是起催化作用的活性中间体
R2 R1 E OR Ti E HO O t-Bu
O
O
RO
O Ti
O O
R' E O
RO
E = COOR
5.1.2 与反应相关的因素
5.1.2.1 氧化剂---TBHP或三苯甲基过氧氢 5.1.2.2 水---绝对无水 5.1.2.3 分子筛---使AE反应成为催化反应 5.1.2.4 氢化钙和硅胶---大大缩短反应时间 5.1.2.5 催化剂的制备与老化 5.1.2.6 酒石酸配体
有关环氧化物的应用
1. 有关环氧化物的选择性开环可参阅文献1。 2. Sharpless AE 反应是手性技术的重大突破。 但该反应有局限性: (1)它仅适合于烯丙醇底物; (2)使用的氧化剂TBHP不太稳定。 3. Jacobsen、 Katsuki、杨丹、史一安等的手性 催化剂是对Sharpless体系的补充和完善。
Ph Ph Ph Ph Ph Ph Ph Me Cl Ph
Ph
转化率(%):
99 82 98 83 70 85 83
% e. e.
47 87 50 33 18 <5 18
在杨丹合成的此催化剂存在下,反式二取代或三取代烯烃的AE反应都能 取得高产率和中等至良好的e.e.值转化为环氧化物,顺式和末端不理想。
烯丙仲醇的动力学拆分
光学活性的酒石酸酯是Sharpless AE 反应的手性源。 就动力学拆分而言, DIPT—酒石酸二异丙酯 是一个好的手性助剂,比DMT—酒石酸二 甲酯或DET—酒石酸二乙酯好的多。 在外消旋烯丙仲醇的动力学拆分相对速度 分别为19,36,104。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
平面过渡态
J. Org. Chem., 1993, 58, 7615 J. Am. Chem. Soc., 1992, 114, 7202; 105,3123; 106,1410 J. Am. Chem. Soc., 1997, 119, 11224
Julia-Colonna环氧化
O
聚-L-亮氨酸 NaOH, H2O, 甲苯 Ph 48 h 92% Ph
5.1.4 烯丙仲醇的动力学拆分
R2 R2 H
O
R2
OH
OH
+
R1
OH
R1
R1 40-45%, >99 % e.e.
40-45%, >99 % e.e.
用动力学拆分同时得到对映提纯烯的丙醇和环氧醇
J. Chem. Soc., Chem. Commum., 1986, 1323 Tedrahedron, 1988, 44, 4073 Chem, Lett., 1989, 2163 Tedrahedron Lett., 1987, 28, 6351 J. Org. Chem., 1982, 47, 1371
R2
R
R1 R2
O a O b
KHSO4
R
手性二氧杂环丙烷(dioxirane)
5.4 手性酮催化的非官能团化反式烯 烃的环氧化反应
5.4.1 由联萘二羧酸衍生的手性酮催化的AE 反应 5.4.2 由果糖衍生的手性酮催化的AE反应 5.4.3 酮催化的烯烃环氧化反应的过度态
5.4.1 由联萘二羧酸衍生的手性酮催化的 AE反应
J. Am. Chem. Soc., 1996, 118, 491 J. Am. Chem. Soc., 1996, 118, 11311
5.4.2 由果糖衍生的手性酮催化的AE反应
HO
O O
O
O
O O
O
OH
PCC CH2Cl2, rt 93%
O
HO OH
OH
HClO4, 0oC 53%
O O
OH
Jacobsen 催化剂的制备
R R R R
N N N N
Mn(OAC)2 R2 OH HO R2 EtOH
4H2O/LiCl 回流 R2 O
Mn Cl O R2
R1
R1
R1
R1
Jacobsen催化剂
Ph Ph Me Jacobsen 催化剂 NaOCl水溶液 73%
O
Me
81-92% e.e.
J. Am. Chem. Soc., 1990, 112, 2801
5.1.2.6 酒石酸配体
酒石酸酰胺也可作为AE反应的手性配体。
O
a: R1=R2=NHCH2Ph R
1
HO
b: R1=NHCH2Ph, R2= N c: R1=R2= N d: R1=R2=NHCH2CH2CH3
R2 HO
O
立体选择性: b>a>d>c
5.1.3 烯丙醇的不对称环氧化反应
各种结构的烯丙醇所进行的AE反应在 绝大多数情况下都能给出90 %以上的对映 选择性。见P141,表5-1。
J. Am. Chem. Soc., 1983, 105, 5791 J. Am. Chem. Soc., 1991, 113, 6865 Chem. Lett., 1989, 1269
5.4 手性酮催化的非官能团化反式烯 烃的环氧化反应
O R
R1
C O
KHSO5 (Oxone)
R
e.e.<20 %
L-(+)-DET(天然的) R3
OH
DET—酒石酸二乙酯
在AE催化循环过程中钛络合物配体的交换
TBHP Ti(OR)4 + DET 2ROH Ti(OR)2(DET) ROH k1 Ti(OR)(TBHP)(DET)
ROH
烯丙醇 k 2' TBHP
ROH
烯丙醇 k2
Ti(OR)(烯丙醇)(DET) ROH k1' k1k2 = k1'k2'
5.3 手性金属卟啉催化的非官能团化 烯烃的环氧化反应
NH
N
N
HN
卟啉 (Porphyrin)
Groves手性卟啉络合物催化剂AE反应
O I=O I
催化剂
+
Cl
+
Cl
甲苯 0oC
51% e.e.
J. Am. Chem. Soc., 1983, 105, 5791
Groves手性卟啉络合物催化剂
5.1.2.5 催化剂的制备与老化
烷氧基钛(IV)和酒石酸酯在-20oC与 溶剂混合(一般用CH2Cl2 作溶剂),在此温 度下老化20-30 min,然后加入TBHP和烯 丙醇。 老化催化体系是反应成功的保证。
5.1.2.6 酒石酸配体
光学活性的酒石酸酯是Sharpless AE 反应的手性源。 DMT—酒石酸二甲酯 DET—酒石酸二乙酯 DIPT—酒石酸二异丙酯
R
O
R
O
O O O
KHSO5
O O
O O
O
O
R
R
R=H, Cl, Br, I, Me, CH2OCH3, SiMe3 etc.。
J. Am. Chem. Soc., 1996, 118, 491 J. Am. Chem. Soc., 1996, 118, 11311
5.4.1 由联萘二羧酸衍生的手性酮催化的AE反应
R*
R*
N
Cl Fe
N
R* =
N
CONH-CO2CH3
N
O
R*
R*
J. Am. Chem. Soc., 1983, 105, 5791
卟啉催化剂
Cl Fe
O
O
Cl Mn
Ru
O
苯乙烯类底物的AE反应
R1 R2
I=O
R1
催化剂 甲苯 0 C
o
R2
I
+
+
O
1. 在卟啉催化烯烃的AE反应中,顺式烯烃比反式 烯烃活泼。 2. 缺电子底物的AE反应中能获得很高的对映选择 性(88~96% e.e.)。
O O
O
史一安配体
史一安手性酮在反式二取代或三取代烯烃的AE反 应表现出很的催化活性和优秀的立体选择性。 见P161,表5-6。
J. Am. Chem. Soc., 1997, 119, 11224
2,2-二取代乙烯基硅烷的AE反应及其 影响因素
R1 TMS R2
史一安配体 KHSO5
50~82% R2
N N N N
OH
HO
OH
HO
Salen A
R R
Salen B
N
N
Mn R2 O X O R2
R1
R1
Jacobsen催化剂
Jacobsen (Salen) 配体的制备
R OH
N N
R
R
R
R1
CHO EtOH/H2O 回流 R2 OH HO R2
+ 2
H 2N NH2
R2
R1
R1
J. Am. Chem. Soc., 1990, 112, 2801
1林国强等,《手性合成》(第二版),科学出版,
2005,232~244
5.1.1 原理和反应历程 5.1.2 与反应相关的因素 5.1.3 烯丙醇的不对称环氧化反应 5.1.4 烯丙仲醇的动力学拆分
5.1.1 原理和反应历程
R2 D-(-)-DET (非天然的)
O
R1
OH R2 R1 Ti(O-i-Pr)4 TBHP OH R3
O
R3
CH2Cl2, -20oC R2 R1
C-2 开环
J. Org. Chem., 1988, 53, 5185
环氧醇用X2-Ti(O-i-Pr)4开环反应
OH I2-Ti(O-i-Pr)4 0.5 h, 0 C
O
o
OH
I OH
OH
OH O-i-Pr
Br2-Ti(O-i-Pr)4
O
4 h, 20~25oC Br
J. Org. Chem., 1990, 55, 3429
外消旋环氧化物的动力学拆分
O
催化剂(0.5~2 mol%) R 50~55% H2O, rt R
O
OH
+
R
OH
(± )
40~49% 96~99% e.e.
40~49% 96~99% e.e.
H
N N
H
Co t-Bu O OAc O t-Bu
t-Bu
t-Bu
催化剂
J. Org. Chem., 1999, 64, 2164
有关环氧化物的应用
1. 有关环氧化物的选择性开环可参阅文献1。 2. Sharpless AE 反应是手性技术的重大突破。 但该反应有局限性: (1)它仅适合于烯丙醇底物; (2)使用的氧化剂TBHP不太稳定。 3. Jacobsen、 Katsuki、杨丹、史一安等的手性 催化剂是对Sharpless体系的补充和完善。
烯丙仲醇的动力学拆分
光学活性的酒石酸酯是Sharpless AE 反应的手性源。 就动力学拆分而言, DIPT—酒石酸二异丙酯 是一个好的手性助剂,比DMT—酒石酸二 甲酯或DET—酒石酸二乙酯好的多。 在外消旋烯丙仲醇的动力学拆分相对速度 分别为19,36,104。
5.2 Jacobsen非官能团化烯烃的环 氧化反应
OH OH Nu: H-, N3-, CN-
2 OH
