基础有机化学(邢其毅、第三版)第一章PPT
11 基础有机化学(邢其毅、第三版)醛酮

C=O -CN
可逆
CH3 CH3
C
CN H2O CH3 O- 不可逆 CH3
C
CN OH
*3 反应条件 反应必须在弱碱性条件下进行。
35
36
6
Xiezx (3)醛、酮与炔化钠的加成
-Lzu
R-C≡C-Na+ +
NaNH2 (-NH3)
R-C≡CH
C=O NH3(液) 或乙醚
C C
CR H2O
ONa
-Lzu
*3a 提纯醛酮 鉴别醛酮
重结晶 稀酸
C=O + H2N-Z H2N-OH H2N-NH2
C=N-Z H2N-NH-C6H5 H2N-NH-C6H3(NO2)2
C=O O H2N-NHCNH2
羟胺
肼
苯肼
2,4-二硝基苯肼
氨基脲
(产物:肟)(产物:腙) (产物:苯腙)
(产物:缩氨脲)
*3b 保护羰基
1716
Xiezx -Lzu
1717
13
14
Xiezx -Lzu
Xiezx -Lzu
CHO
1700
15
16
Xiezx 第五节 醛酮的制备
-LzuLeabharlann 一 制备概貌1氧化烯烃
1 水合 2 硼氢化-氧化
炔烃
1 氧化
2 傅氏酰基化
3 Gattermann-Koch反应
芳烃
醇
1 氧化 2 频哪醇重排
醛酮
氧化
取代
羧酸
A B
C=O
+ H2NR
A
参与反应 稀酸
B C=NR
A' B' C=O
有机化学-邢其毅课件(全)

供电子诱导效应(+ I):
O
COO
(CH 3)3C
(CH 3)2CH
CH3CH2
CH3
H
§有机化学反应的类型和试剂的分类
一、共价键的断裂方式:
1、 均裂:成键的一对电子平均分给两个原子或原子 团。均裂生成的带单电子的原子或原子团称为自由基, 或游离基。
自由基不带电荷,呈电中性。有很高的化学活性。 自由基反应:通过共价键的均裂而进行的反应。
键矩:极性共价键正或负电荷中心的电荷(q)与两 个电荷中心之间的距离(d)的乘积叫键矩(u)。
化学键的极性:以键矩又称偶极矩()来量度。
偶极矩是向量,带有方向性,一般以“ ”来表示,
箭头表示从正电荷到负电荷的方向。
Cl
多原子分子的偶极矩是分子中各个 键的偶极矩的向量和。 H Br
μ = 2.60 × 10-30 C.m
有机化学的任务
1.发现新现象(新的有机物,有机物的新的来源、 新的合成方法、合成技巧,新的有机反应等) 2.研究新的规律(结构与性质的关系,反应机理等) 3.提供新材料 (提供新的高科技材料,推动国民经 济和科学技术的发展) 4.探索生命的奥秘(生命与有机化学的结合)。
6、 学习有机化学的要求
1)、认真听课,作好笔记。 2)、勤思考、多提问,再理解的基础上记忆。 3)、学完每章,应归纳、总结。掌握该章的重点、难 点和规律。 4)、按时独立的完成作业。 5)、参阅有关的资料(参考书、杂志)。 6)、重视有机实验,以实验促进学习。
键角反映了分子的空间形象。 键矩和键的极化性反映了分子的化学反应活性,并影 响它们的物理性质。
键能:气态时原子A和原子B结合成1molA-B双原子分子(气 态)所放出的能量。通常键能愈大,键愈牢固。
邢其毅《基础有机化学》(第3版)(上册)配套题库【课后习题】第1章~第3章【圣才出品】

圣才电子书 十万种考研考证电子书、题库视频学习平台
(ii)哪些化合物分子中的原子都在一条直线上? (iii)哪些化合物分子中的原子处在两个相互垂直的平面中? (iv)哪些化合物分子中的碳原子都是 sp3 杂化轨道? 解:(i)乙炔、乙烯、苯分子中的原子都在同一平面中。 (ii)乙炔分子中的原子都在同一直线上。 (iii)丙二烯分子中的原子处在两个相互垂直的平面中。 (iv)甲烷、环己烷分子中的原子都是 sp3 杂化。
;极性化合物为:
;非极性化合
物为:
。
习题 1-6 结合教材(P18)表 1-3 中的数据回答下列问题:
(i)甲烷、乙烯、乙炔中的C—H键键长为什么不同?
(ii)乙烷、乙烯、乙炔中碳碳键键长为什么不同?
(iii)卤甲烷中的碳卤键的键长为什么不同?
解:(i)甲烷、乙烯、乙炔中,碳原子的杂化方式不同,甲烷中碳为 sp3 杂化,乙烯中
习题 1-8 将下列各组化合物按键解离能(只考虑下划线的键)由大到小排列成序。 (i)
(ii) (iii)
解:参考教材表(P19)1-5 中的一些常见键的解离能,可知:
(i)
>
>
>
>
5 / 76
圣才电子书 十万种考研考证电子书、题库视频学习平台
>
>
>
(ii)
>
>
>
(iii) > >
>
>
>
>
>
>
习题 1-9 按酸碱的质子论,下列化合物哪些为酸?哪些为碱?哪些既能为酸,又能为 碱?
HI NH2OH SO42- H2O HCO3- NH4+ HClO4 HS- I- CN- 解:根据酸碱质子论,酸是质子的给予体,碱是质子的接受体。根据该理论,所以:
邢其毅有机化学.ppt

25
• 离去基团和α氢原子必须处于反式共平面状态
使H-C-C-X四个原子在同一个平面上只有两种可能的情况
• 一种是分子取对交叉构象,进行 反式消除, • 一种是分子取重叠构象,进行顺 式消除.
对交又构象比较稳定,故卤代烷的E2消除是反式消除(anti elimination).
机理进行.
19
• 偶极溶剂有利SN2反应
在质子溶剂中进行SN2反应时, • 由于溶剂化作用,有利于离去基团的离去, • 由于亲核试剂可以被溶剂分子所包围,因此必须付出能量,先在亲 核试剂周围除掉一部分溶剂分子,才能使试剂接触底物而进行反应。 最后的影响是两种作用的共同结果.
在偶极溶剂中反应时, • 对于负离子很少溶剂化,亲核试剂一般可以不受偶极溶剂分子包围,
弱
4
若两个或多个试剂的碱性大小和可极化性大小的顺序是 相反的,亲核性大小主要取决于哪一个因素则与溶剂有关
同一族的元素,由上至下碱性减小,可极化性增大
5
溶剂对碱性和亲核性的影响
碱性决定亲核性
可极化性决定亲核性决定
6
溶剂对碱性和亲核性的影响
原因:
可极化性受溶剂的影响 不大,但碱性与溶剂的 关系很大
31
6.9.2 E2反应和SN2反应的并存与竞争
卤代烃放在碱性体系中加热,常常 会得到亲核取代和消除两种产物
32
E2机理
SN2机理
• 试剂亲核性强、碱性弱、体积小时,有利于SN2反应. • 试剂碱性强、浓度大、体积大、反应温度高时有利于E2反3应3
6. 10. E1反应
单分子消除反应用E1表示. E表示消除反应.1代表单分子 过程 • 大多数卤代烃在碱作用下的消除反应都是按E2机理进行的 • 三级卤代烷在无碱存在时的消除反应却是按E1机理进行的.
基础有机化学(邢其毅主编)01绪论

H2C CH2
CH3CH2OH
OH
O
N
ƒ上一内容
„下一内容
²回主目录
O返回
2005-10-11
七、有机化合物的分类和构造的表示
二、按官能团分类
H3C H H3 C C C OH NO2 O H3C
ƒ上一内容
H CH3
H
C O
C
CH3 H3C
X CN
H3C
CH2CH3 H3C SO3H
NH2 O
O H H3C
键线式 (骨架式)
OH
C H2
ƒ上一内容
„下一内容
²回主目录
O返回
2005-10-11
八、 有机酸碱的概念
(一)勃朗斯德酸碱理论 凡是能给出质子的分子或离子称为酸, 凡是能接收质子的分子或离子称为碱。 酸 ↔ 碱 + 质子 H2PO4- ↔ HPO42- + H+ HAc ↔ Ac- + H+ Ar-OH ↔ Ar-O- + H+ 共轭酸碱:彼此之间相差一个H+
-
酸性强度 RCH2OH 碱性强度 RCH2O-
RCH2ONa
ƒ上一内容 „下一内容 ²回主目录
NaOH
O返回
2005-10-11
(一)勃朗斯德酸碱理论
酸性的 强 弱 取 决 于与氢 结 合 原 子 的 种类 (电 负 性、 大小、原子半径大小)。 1、同一周期中,电负性越大,酸性越强。(离子 容纳电子能力大) 酸的强度 碱的强度 H-CH3﹤H-NH2﹤H-OH﹤H-F
O返回
2005-10-11
温度升高,有利于共价键的断裂。 共价键断裂容易顺序
ƒ上一内容 „下一内容 ²回主目录
有机化学 邢其毅 第1章绪论

有机化学是一门迅速发展的学科
有机合成化学 天然有机化学 生物有机化学 金属与元素有机化学 物理有机化学 有机分析化学 药物化学 香料化学 农药化学 有机新材料化学 ...... 等学科
生命科学 材料科学 环境科学 化学生物学 能源、工业、农业 ...... 等方面
1901-2005年,诺贝尔化学奖共96项,其中有机化学方面的化学奖 72项。
2pz
平面型
乙烯(CH2=CH2)的成键示意
H p轨道 C
+
H H C H H
sp2轨道 H
C C
H H
p轨道
键 侧面交叠 (电子云结合较松散)
键(sp2-s) H C H C H 键(sp2-sp2) 键 (p-p) H H H C C CH3 H O C CH3 键(sp2-sp2) 键 (p-p) H
八隅体 (Octet):原子总是倾向获得与惰性气体相同的价电 子排布 (价电子层达到8个电子的稳定结 构)
离子键 (ionic bond): 原子间通过电子转移产生的正负离 子相互结合而成键
共价键 (covalent bond):原子间通过共用电子对相互结 合而成键(电子共享)
C: 1s22s22p2
A(气) + B(气)
A—B(气) + 键能
多原子分子的键能:
H( kJ/mol) CH4 CH3 CH2 CH C CH3 CH2 CH C H H H H 435.1 443.5 443.5 338.9
H 键的键能为: 415.2 kJ/mol
键的极性:
极性键与非极性键
例: CH3δ+ Clδ偶极矩(D) μ= qd q: 中心电荷 d:正负电荷中心的距离
邢其毅《基础有机化学》课件讲义

基础有机化学背景综合大学化学系使用的有机化学教学大纲第一次是于1980年在长春制订的,当时规定的教学时数为129学时(讲授120学时,机动9学时),第二次于1982年于宜昌召开的教育部属综合性大学理科化学系课程结构研讨会上讨论确定,总的教学时数减少为108学时,并对原大纲内容作了部分调整。
经过多年的实践,我系基础有机化学的教学总时数为90学时,在2004年以前,采用的教材是邢其毅、徐瑞秋、周政、裴伟伟编写的《基础有机化学》(第二版),该书是根据1977年教育部在武昌召开的高等学校理科化学教材会议精神编写的,第一版于1980年由高等教育出版社出版(该书曾获国家优秀教材奖),第二版于1993年由高等教育出版社出版(该书于1997年获国家教委科技进步二等奖)。
从2005年9月开始,将采用的教材是邢其毅、裴伟伟、徐瑞秋、裴坚编写的《基础有机化学》(第三版),与平行的教材相比该书的内容十分丰富,具有一定的深度。
地位和作用基础有机化学历来是化学系的四大门基础课之一。
相对于其它三门基础课而言,有机化学的发展异常迅速,新的有机化合物不断涌现。
这些层出不穷的有机化合物不仅带动了有机化学学科本身的发展,也成了其它化学学科的研究对象。
因此,无论从事化学哪一个领域的工作,都必须具备有机化学的基础知识。
而新的有机反应、新的有机研究领域也在不断产生,它们使有机化学的面貌日新月异,气象万千。
有机化学的另一个特点是它与其它学科之间的交叉渗透十分广泛。
例如:发展很快的生物有机是有机化学与生物学之间的边缘科学,它对于研究生命现象十分重要;有机金属化合物的化学则是有机化学与无机化学之间的边缘科学;迅速发展的材料科学则是有机、高分子和无机化学交叉渗透的新型学科。
综合治理环境也需要有比较全面的有机化学知识。
此外,有机化学在国民现代化生活中的影响也越来越大。
这一切都使有机化学在化学各学科中占有十分特殊的地位,在科学技术和国民经济的发展中起着十分重要的作用。
基础有机化学第3版邢其毅第1章_绪论解析

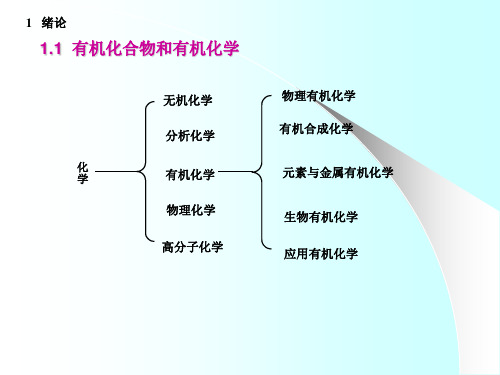
1.1 有机化合物和有机化学
1.1.2 有机化学
有机化学简史 • 1806年,柏则里提出“有机化学”这一名词和“生命力”学说; • 1828年, F.Wohler由氰酸铵NH4OCN合成尿素NH2CONH2; • 1845年Kolbe合成醋酸; • 1854年,柏赛罗合成油脂; • 1850-1900年,合成有机化学时代,煤焦油化学时代; • 1900-1940年,有机化学工业时代,煤焦油→染料、药物、炸药; • 1940年-,石油化工时代,石油→三大合成材料(橡胶、塑料、
1.2 有机化合物的特性
1.2 有机化合物的特性
组成
除C、H以外,只含有O、N、S、P、X等少数元素。 有机物数目繁多
结构
原子间通常以共价键的方式结合; 同分异构现象普遍。
性质
易燃、易爆;热稳定性差;熔、沸点低;难溶于水; 反应速度慢。 例:HOAc: m.p 16.1℃ b.p 116℃;
NaCl: m.p 800 ℃ b.p 1440 ℃
SP3杂化轨道
2P2 2S2
基态
SP杂化:
2P2 2S2
基态
激发 2P
2S 激发态
SP2杂化
P轨道 SP2杂化轨道
激发 2P
2S 激发态
SP杂化
P轨道 SP杂化轨道
(i) sp3杂化
甲烷分子中的碳原子采取sp3杂化。杂化的结果:
sp 3 ①sp3轨道具有更强的成键能力和更大的方向性。 ②四个sp3杂化轨道完全相同,取最大的空间距离为正四 面体构型,轨道夹角为109.5°。
例如,橡胶在国民经济中的占有 重要地位:
一辆汽车需橡胶 200 Kg
一架飞机需橡胶 600 Kg 一艘35,000吨的轮船
基础有机化学1绪论

Formaldehyde reacted with each other to become sugars, and some of these sugars(糖), together with inorganic phosphates(磷酸酯), combined with purines and pyrimidines to become simple molecules of ribonucleic acids (RNAs) and DNA.
DNA
Protein
2
We live in an Age of Organic Chemistry:
ClothingHousehld itemsMedicine
4. Billion years ago most of the carbon atoms on the earth existed as CH4 (几十亿年前地球上的碳原子主要以甲烷形式存在)
CH4, H2O, NH3, H2 were the main components of the primordial atmosphere(原始大 气).
Electrical discharges(放电) and other forms of highly energetic radiation(高能辐射) caused these simple compounds to fragment(碎裂) into highly reactive(高活性的) pieces which combine into more complex compounds such as amino acids(氨基酸), formaldehyde(甲醛), hydrogen cyanide(氰化氢), purines(嘌呤), and pyrimidines (嘧啶).
有机化学课件邢其毅
常见有机基团
中文名称
化学式
英文代号 中文名称
化学式
英文代号
甲基 丙基 丁基 叔丁基
CH3CH3CH2CH2CH3CH2CH2CH2-
(CH3)3C-
Methyl n-Propyl n-Butyl t-Butyl
vinyl propenal
Ar-
1 绪论
1.3 有机化合物的命名原则
1.3.1 有机化合物的系统命名法 1.3.1.2 化合物书写
1 书写时根据主链碳原子数目的多少进行命名。当主链碳原子数在10以内时,分 别用甲,乙,丙,丁,戊,己,庚,辛,壬,癸表示;当主链碳原子数超过10时,则直接用中 文数字表示。
的其它部分,这种作用称为诱导效应(inductive effect)。常用“I”表示 。
δδCδ
δCδ
δ
C
δCl
γ
β
α
●诱导效应通过化学键传递时,随着传递的化学键增多,诱导效应迅速减弱。 ●诱导效应是一种永久效应,它影响化合物的分子极性。 ●诱导效应的比较标准是氢原子。
给电子效应:用“+I”表示;吸电子基效应:用“-I”表示。
1 根据化合物中所含官能团的情况,确定母体.
2 选取含母体官能团的最长碳链作为主链
3 主链碳原子上其它支链全部作为取代基
4 用文字表达命名
1 绪论
1.3 有机化合物的命名原则
1.3.1 有机化合物的系统命名法
母体选择顺序(排在前面的优先)为:
-+NR3(铵) -COOH(羧酸) -SO3H(磺酸) -COOR(酯) -COX(酰卤) -CONH2(酰胺) -CN(腈) -CHO(醛) -COR(酮) -OH(醇,酚) -NH2 (胺) -R(烷基) -OR(烷氧基)
有机化学绪论ppt课件

44
4、键的极性和可极化性
当成键原子相同时,形成的共价键无极性
(H-H)。当成键原子电负性不同时,电负性 大的原子带部分负电荷(δ-);电负性小的原 子带部分正电荷(δ+)。键的极性强弱用偶极 矩或键矩,即部分电荷与电荷之间距离的乘积
(μ)来衡量。μ=q.d(C.m)
δ+
H
δ-
Cl H
Cl μ=3.57x10-30(C.m)
(二) 按分子不饱和程度的不同
饱和脂肪族化合物、不饱和脂肪族化合物和芳香 族化合物
2021精选ppt
51
1. 链状化合物(无环化合物,脂肪族化物)
如:丁烷,丙烯,乙酸,丙醇等。 2. 环族化合物 (按环的特点,分为两类) (A)脂环族化合物
OH
(B)芳香族化合物
O H
3. 杂环化合物
N O 2
O
N
Pauling于20世纪30年代提出杂化轨道 理论。
基本要点: (1) 原子在成键时,可以变成激发态;而且
能量相近的原子轨道可以重新组合形成 新的原子轨道,既杂化轨道。 (2) 杂化轨道的数目等于参加杂化的原子轨 道的数目。 (3) 杂化轨道的方向性更强,成键能力更大。
2021精选ppt
30
C原子的电子排布如下
节面
2021精选ppt
38
线性组合:最大重叠原则、能量近似原则、对称性匹配原则 电子排布:Pauling不2相021容精选原pp则t 、能量最低原则、Hund规则 39
第三节 共价键的几个参数和断裂方式
一、几个重要参数
1、键长 形成共价键的两个原子核间的距
离称为键长。下表是常见共价键平均键长。
共价键 CC CH CN CO CF
第一章 有机化学绪论

层次:原子——分子——大分子 相关课程:生物化学、组织胚胎学、生物学、分子
生物学、药物化学、药理学等…
17
§1.2 有机结构理论初步
离子键:原子间电子转移
八隅体规则
共价键:原子键共用电子对 化学键 配位键 金属键:自由电子与金属离子作用; 多原子键,无方向性和饱和性
18
离子键
11
§1.1 有机化合物 和有机化学 有机化合物概念
早期 从来源定义:“有生机之物” 德国化学家(1824: F. Wöhler)
NH4+ NCO heat H2N O NH2
现代 从元素组成定义:含碳化合物及衍生 物(C、H、N、O、卤素….)
12
13
有机化合物 (organic compounds)—— 含碳的化合物
4
成绩评定
期末: 60% 期中: (~Chapters 1-9,时间为教学第十周左右)30% 平时(作业 + 出勤): 10%
综合评定成绩
5
如 何 学 习
有
机
化
学?
6
有机化学知识结构特点
知识点 缺失
构成犹如 倒金字塔 的稳定结构
7
如果某知识点 缺失…..
知识结构倒塌 !!!
8
本课程的知识需要不断的积累
1
时间:周三 3-4
周五 3-4 地点:H3101
Contact:
Email: qrwang@
Tel: 65643978
助教: 周丽君 邱观音生 姚子健
2
教
材
3
参 考 书 目 录
基础有机化学(第3版)(上下册),邢其毅,裴伟伟,徐瑞秋,裴坚 编,高等教育出版社,2005. 大学有机化学基础(上、下册),荣国斌主编,华东理工大学出版社, 2006. 有机化学(第七版),吕以仙主编,人民卫生出版社,2010. 有机化学(第二版), 陆国元主编,南京大学出版社,2010. 有机化学,古练权,汪波,黄志纾,吴云东编写,高等教育出版社, 2008. 有机化学核心教程,裴伟伟编,科学出版社,2008. 有机化学(第4版), 汪小兰编,高等教育出版社,2005. L.G. Jr. Wade, Organic Chemistry 5th ed., Prentice Hall International Edition, Bruice, 2002. T. W. Graham Solomons, Organic Chemistry, 8th ed., John Wiley & Sons, Inc., 2004. John MucMurry, Organic Chemistry 7th ed., Thomson Leaning, Inc., 2008.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NO2
NO2
NO2
CH3
+NO2 O-
CH3 H
NO2
CH3 H
NO2
CH3 H
NO2
CH3 H
NO2
CH3
CH3
+NO2 p-
H
NO2
CH3
CH3
H
NO2
H
NO2
CH3
H
NO2
CH3
+NO2 m-
CH3
H NO2
CH3
H NO2
CH3
CH3
H NO2
H NO2
NO2
+NO2 m-
NO2
H NO2
蛋白质,糖 (生物化学基础)
周环反应
硝基化合物, 胺,腈 (含氮有机物)
负碳离子机理 羧酸及衍生物 (酯, 酰卤, 酰胺, 酸酐)
亲核加成
醛, 酮
醇,酚,醚
卤代烷 亲核取代,消除反应 芳香烃 亲电取代 烯烃,炔烃,二烯烃 亲电加成 烷烃 自由基机理
§1.3 有机化学反应的分类
1.按反应类型分类:
不饱和度:使化合物变成开链的饱和烃, 理论上所需的氢分子的个数
3 H2
H2
2 H2
H2
C.消除反应:
由不饱和度相对较低的化合物变成不饱 和度相对较高的化合物的反应。
Br OH-
OH H2SO4
D.重排反应:
仅仅是碳骨架发生变化的反应
OCH2-CH=CH2
OH
CH2-CH=CH2 Claisen重排反应
CH2=CH-CH=CH2 ↔CH2-CH=CH-CH2
-
+
-+
↔CH2-CH=CH-CH2 ↔ CH2-CH-CH=CH2
+-
+-
↔CH2-CH-CH=CH2 ↔ CH2=CH-CH-CH2
-+
↔CH2=CH-CH-CH2
写共振极限式的原则:• 原子顺序不动 • 未成对电子数相同
§1 绪 论
§1.1 有机化学发展简史
1、有机化学概念的提出:
19世纪以前:人们把自然界的物质分成—动 物、植物和矿物三大类
19世纪初期:把来源于动物、植物的物质称 作有机物—有生机的物质;把来源于矿物 的物质称作无机物—无生机的物质。
定性分析表明:一般只含有C、H、O、N、 S、P等很少的几种元素
C、轨道的交盖趋向于最大化
Br2 Br
Br
D、能量相近的原子轨道可以发生杂化
而生成能量相同的杂化轨道
sp3杂化 sp3杂化轨道
2p 2s
激发
2p
2s
sp2杂化
2p
sp2杂化轨道
sp杂化 2p
sp杂化轨道
sp3杂化轨道
H
CH4
H
HH
2p sp2杂化轨道
H
H
CC
H
H
H
H
CC
H
H
2p
H CCH
sp杂化轨道
3、易燃 烧:
绝大多数有机物易燃, (但也有例外,CCl4 是灭火剂)
4、熔点低:
大多数有机物的熔点<400°C,一般以气 态、液态或低熔点的固态存在
5、难溶于水, 易溶于有机溶剂 6、反应速度慢:
(乙酸乙酯放置十年才达到平衡)
CH3COOH + CH3CH2OH
CH3COOCH2CH3 + H2O
CH3C
O18
O-
CH3C
H+ O18
CH3C
+
O-Na+
CH3C
O18
-
O
CH3C
O O18-
O18 OH
O O18H
CH2=CH
CH3
Br2 hr
CH2=CH
CH2Br
CH2=CH
CH2=CH CH2.
C14H3
Br2 hr
CH2=CH
C14H2Br
+ 14CH2=CH CH2Br
CH2=CH C14H2
A.取代反应:分子中的原子或基团被其
它的原子或基团所替代的反应。
如:
CH2Br H2O
CH2OH
C
CH H2
Cat.
C CH2 H
KMnO4
H C CH2 OH OH
(CH3CO)2O
H C CH2 O O COCH3 COCH3
B.加成反应:由不饱和度相对较高的化合
物变成不饱和度相对较低的化合物的反 应。
共振极限式稳定性原则:• 电荷分散稳定 • 共价键多稳定
b.等价的极限结构构成的体系具有 共振稳定作用
c.参与共振的极限结构式越多越稳定
共振论核心思想——用不存在的(虚拟) 结构描述真实的结构。
4,分子轨道理论
A.分子轨道理论基本内容 a,分子轨道中电子的运动状态用波函数Ψ表示 b.分子轨道(Ψ)是由原子轨道(ϕ1,ϕ2…) 的线性组合而成 c,线性组合的条件 •能量相近 —— 一个档次 •最大重叠 —— 倾其所有 •对称相同 —— 志趣相同
概念: 有机化学是研究碳化合物的化学 1874年:肖莱马(Schorlemmer C.)完善了有机化学
概念:有机化学是研究碳氢化合物及其 衍生物的化学 有机化合物—碳氢化合物及其衍生物
2. 有机化学发展趋势 A.定性--- 定量 德国人李比希(1803—1873) 留学法国盖-吕萨克 实验室工作,1823年与维勒各自分离了一种氰 酸,盖-吕萨克认为分子式相同,提出同分异 构概念,并创立结构化学 1824 年李比希回到德国,在吉森大学建立有机
A.组成元素的单一性与化合物性质多样性 之间的矛盾;
B.元素种类的稀少与构成分子的原子数目 众多之间的矛盾;
C.原子种类的有限性与形成化合物数目的 无限性之间的矛盾
1806年:
瑞典化学家柏则里(J .Berzelius),为区别于 无机物及无机化学,第一个提出了有机化学 的概念:研究有机物的化学为有机化学,并 提出了第一个说明有机物产生的学说—生命 力论(活力论),认为:一切有机物只有在生命 力存在下才能形成,从无机物不能合成有机 物
NO2
H NO2
NO2
NO2
H O2
H NO2
NO2
+NO2 O-
NO2 H
NO2
NO2 H
NO2
NO2 H
NO2
NO2 H
NO2
NO2
NO2
+NO2 p-
H
NO2
NO2
NO2
H
NO2
H
NO2
NO2
H
NO2
D、共平面:所有参与B共r 振的原子应在同一平面
-40oC
1mol Br2
CCl4
80oC
2、结构复杂:
H2N
O H3C
N
O
N
CH3
COOCH2CH2N+H(C2H5)2 Cl-
CH3 N
N
盐酸普鲁卡因
1,3,7-三甲基-2,6-二氧嘌呤 1,3,7-trimethyl-2,6-dioxgen-purine
咖啡因 Caffeine
CH3 N
COOCH3
O C
O
可卡因(Cocaine)
CH2=CH C14H2 CH2 CH =C14H2
CH2---CH---C14H2
Br2
Br2
14CH2=CH CH2Br CH2=CH
C14H2Br
B、数不变:O1未8 配对电子数及配对电子数O不变
CH3C
O-
CH3C
O18-
O18
CH3C -
O
CH2=CH C14H2 CH2 CH =C14H2
有机合成化学
有机分析化学 天然有机化学 金属有机化学
物理有机化学
§1.2 有机化合物的特性
1、数量多:>900万种 主要原因:同分异构现象及立体异构现象 同分异构体—分子式相同,但结构和性质
不同的化合物 如:C2H6O 有两种异构体 乙醇和二甲醚
C10H22 有75种同分异构体 C20H42 有366319种同分异构体
定量分析表明:元素种类虽少,但原子数 目非常多。如:醋酸和硬脂酸都仅含C、 H、O三种元素,但醋酸有8个原子;硬脂酸 (十八碳酸)有56个原子
同分异构现象:元素的种类和数目相同, 但却是不同的化合物。
如:乙醇与二甲醚;丙酮和丙醛
一切现象都与无机物的现象不同,出现了 一系列用无机理论无法解释的矛盾:
B、参与反应的原子可失去或得到电子
C、化学键可断裂,方式有两种:
a、异裂:X Y
X - + Y+
b、均裂: X Y
X +Y
如:
CH3COOH
CH3COO- + H+
CH2Br H2O
CH2OH
Cl2
2 Cl
2、价键 (VB)理论:
要点:A、化学键是由原子轨道的交盖形成的
如:C-H
C-C
B、共价键具有方向性和饱和性
化学研究所,开始了定量分析工作,发明CuO 燃烧法测定C、H
B.分离--- 合成 1805 分离得到第一个生物碱—吗啡
但到1952 才鉴定结构。
C.事实 → 理论
在积累了大量的实验事实之后,人们开始 对有机化学的机理进行了总结研究,并创 建了一系列有机化学基本理论。
D.有机化学的次级学科
有机化学
常采取加热、加催化剂等方法
加快反应速度
7、反应复杂,副反应多:
