2.3大气中污染物的转化(4)
环境化学第2章 大气环境化学-4-转化

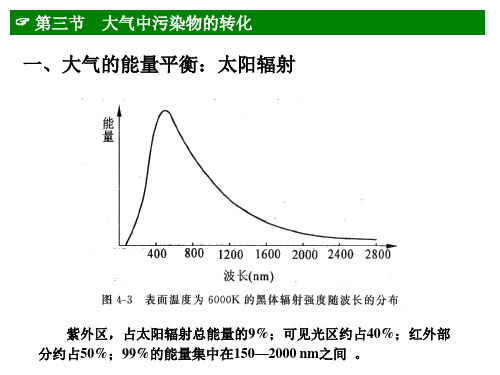
NOX在大气光化学过程起着重要的作用, NO 、NO2、
O3之间存在的光化学循环是大气光化学过程的基础。
NO2 + hv → NO + · O · + O2 + M → O3 + M O O3 + NO → NO2 +O2
★ 3.3.3氮氧化物的气相转化
(1)NO的氧化:
O3为氧化剂: NO+O3 → NO2 + O2
3.3.1 大气中的含氮化合物
大气中主要含氮化合物有N2O、NO、NO2、HNO2、HNO3、 亚硝酸酯、硝酸酯、亚硝酸盐等。 ①氧化亚氮(N2O):是无色气体,是清洁空气的组分,
是低层大气中含量最高的含氮化合物。
来源:主要来自天然源,即环境中的含氮化合物在微生物 作用下分解而产生的。土壤中的含氮化肥经微生物分解可 产生N2O,这是人为产生N2O的原因之一。 性质: N2O在对流层中十分稳定,几乎不参与任何化学反
· 如果是环已烯,HO· 和NO3 可加成到它的双键上。O3 与 环烯烃反应迅速,最终可生成小分子化合物和自由基。
(4)单环芳烃的反应:
大气中的单环芳烃有:如苯、甲苯以及其他化合物。它们 能与芳烃反应的主要是HO· , 主要来源于矿物燃料的燃烧以及一些工业生产过程。 其反应机制主要是加成反应和
氢原子摘除反应。
应,进入平流层后,由于吸收来自太阳的紫外光而光解产
生NO,会对臭氧层起破坏作用。
大气污染化学中的
②一氧化氮和二氧化氮(用NOX表示) 天然来源:
氮氧化物
主要是生物有机体腐败过程中微生物将有机氮转化成
为NO,NO继续被氧化成N2O。另外,有机体中的氨基 酸分解产生的氨也可被HO· 氧化成为NOX。
环境化学(戴树桂)课后习题参考答案

中科院研究生院硕士研究生入学考试《环境化学》考试大纲1.《环境化学》考试大纲适用于中国科学院研究生院环境科学专业硕士研究生入学考试。
《环境化学》是环境科学与工程类专业的重要基础课程,包括了环境化学研究的内容、特点和发展动向,主要环境污染物的类别和它们在环境各圈层中的迁移转化过程,典型污染物在环境各圈层中的归趋和效应。
本考试大纲侧重于环境污染化学,着重于各类有害物质在环境介质中的存在、行为、效应以及减少或消除其产生的理论和方法。
主要内容包括水环境化学、大气环境化学、土壤环境化学及化学物质的生物效应与生态效应等经典内容。
对其中有机污染物的归趋模式、金属离子的存在形态及生物效应、化学物质结构与毒性关系,污染物的生物效应和生物浓缩机制以及全球范围内的温室效应、酸雨、臭氧层破坏等环境问题需加以重点掌握。
要求考生掌握基本概念、基本原理和计算方法,并具备综合运用所学知识分析和解决实际环境问题的能力。
考试内容:环境化学发展及基本内容1.环境化学基本概念、发展动向、研究内容及热点问题水环境化学2.天然水的基本特征组成;3.水体无机污染物的迁移转化。
着重配合作用、氧化-还原作用、沉淀和溶解、水体颗粒物的吸附作用等基本原理及其实际应用。
4.水体有机污染物的迁移转化:环境行为与归趋模式。
着重分配作用、挥发作用、水解作用等典型机制与迁移转化模式。
5.水体的富营养化问题:水体富营养化;水体富营养化的机理;营养物质的来源;富营养化的影响因素;湖水的营养化程度;水体富营养化的危害及其防治对策。
大气环境化学6.大气中污染物的特征;7.大气中污染物的迁移和转化(温室效应;气相大气化学:光化学反应、光化学烟雾、臭氧层的形成与耗损化学;液相大气化学:酸沉降化学、大气中液相反应;大气颗粒物化学);8.重要的大气环境化学问题:光化学烟雾的定义、特征及形成条件;光化学烟雾主要参与物质;光化学烟雾形成机理;光化学烟雾危害及防治;光化学烟雾与硫酸型烟雾的对比;太阳和地球辐射间的能量平衡;温室气体;温室效应;全球变暖及防治对策;降水的化学组成;酸雨的形成;酸雨的影响因素;酸雨的危害及防治;大气平流层的组成;臭氧层的形成和耗损的化学反应;臭氧洞的危害;臭氧层破坏现状及防治。
《环境化学》课件第二章-2

稳定性: C2H5 > (CH3) 3CCH2 > CH2=CH > C6H5 和 CH3 > CF3 D/kJ· mol-1:410 415 431 435 435 443
2-7
《环境化学》 第二章 大气环境化学
(2)自由基的结构和活性 (Structure and Reactivity of Free Radicals) 卤原子夺氢的活性是:F•>Cl•>Br•
增长
终止
2-11
《环境化学》 第二章 大气环境化学
第三节
大气中污染物的转化
(2.3 Transformation of Atmospheric Pollutants)
一、自由基化学基础 (Chemical Foundation for Free Radicals) 二、光化学反应基础 (Foundation for Photochemical Reactions) 三、大气中重要自由基来源 (Source for Important Free Radicals in the
Atmosphere)
四、氮氧化物的转化 (Transformation of NOx) 五、碳氢化合物的转化 (Transformation of Hydrocarbons) 六、光化学烟雾 (Photochemical Smog) 七、硫氧化物的转化及硫酸烟雾型污染 (Transformation of
光化学过程 A* → B1 + B2 +… A* + C → D1 + D2 +… 光解,即激发 态物种解离成 为两个或两个 以上新物种。
2-14
A*与其他分子反应生成新的物种。
《环境化学》 第二章 大气环境化学
22大气中污染物的迁移和转化

22大气中污染物的迁移和转化大气污染是严重影响人类健康和环境质量的问题之一。
大气污染物的迁移和转化是大气环境中重要的过程,它们的行为对空气质量和生态系统的影响至关重要。
本文将介绍22种常见的大气污染物的迁移和转化机制,以加深对大气污染问题的理解。
首先,我们来讨论大气中颗粒物的迁移和转化。
颗粒物是大气污染的主要成分之一,由固体和液体颗粒组成。
颗粒物的迁移主要受到空气流动、重力沉降和湿沉降的影响。
在空气中,颗粒物会受到风力的作用,通过对流和湍流运动的扩散,以及吸附、沉积等机理来传播。
一些较大的颗粒物会因重力作用而沉降到地面,而较小的细颗粒物则更容易被气流携带,并通过湿沉降的方式降落到地表。
对于气态污染物,其迁移主要受到大气扩散、湍流混合和物理吸附的影响。
大气扩散是气态污染物迁移的主要机制之一,它是指气体在浓度差异的作用下发生的传输过程。
气态污染物的浓度差异造成了压力梯度,从而驱动了气体的扩散。
此外,气象因素如气温、风速和湍流运动也会对气态污染物的迁移和扩散起到重要的影响。
转化是大气污染物从一种形式转变为另一种形式的过程。
对于颗粒物而言,转化通常包括物理变化和化学变化两种形式。
物理变化主要是指颗粒物在大气中的扩散和沉降,以及颗粒物的粒径和表面化学性质的变化。
化学变化主要指的是颗粒物与大气中的气态污染物、水汽以及光等作用下发生的化学反应。
这些转化过程可以增加或减少颗粒物的大小、化学成分和毒性,从而对空气质量和人体健康产生重要影响。
气态污染物的转化主要通过化学反应进行。
光化学反应是大气中气态污染物转化的重要机制之一。
例如,大气中的一氧化氮和氧气反应生成二氧化氮,在太阳光的照射下,二氧化氮会进一步分解为氮氧化合物和臭氧。
此外,气态污染物还可以通过化学还原、氧化和水解等反应进行转化。
这些化学反应会引起大气中的各种复杂反应网络,对大气的化学结构和组成产生重要影响。
综上所述,大气污染物的迁移和转化是大气污染问题的核心。
环境化学:第二章大气环境化学 3
-4
λ < 120 nm
N2 + hν
N+N
120 160 200 240
λ (nm)
图2-29 O2吸收光谱(R. A. Bailey, 1978)
第三节 大气中污染物的转化
(2)臭氧的光离解
O + O2 + M 低碰于撞1反00应0 km的大气中,O3 + M
臭氧吸收1180 nm以下的光就可以离解,但主要 吸收290 nm以下的光,较长波长的光可以进入对流 层和地面。
A :B 能量 A+ + BA :B 能量 A·+B·
不对称裂解 对称裂解
自由基——由对称裂解生成的带单电子的原子或原子 团称为自由基。
第三节 大气中污染物的转化
2、自由基反应(free radical reaction)
凡是有自由基生成或由自由基诱发的反应都 叫做自由基反应。
CCl3F + hγ(175~220nm)
c. H2O2 + hν 2·OH
第三节 大气中污染物的转化
1、 HO 自由基的来源
HO最高含量出现在热带,因为那里温度高,太阳辐射强。
第三节 大气中污染物的转化
2、 HO2自由基的来源
a. 甲醛光解(主要来源):
HCHO + hν
H + HCO
H+O2 + M HCO+O2
HO2 + M HO2+CO
第三节 大气中污染物的转化
3、大气中重要吸光物质的光离解 4
(1) O2和N2的光离解
3
2
O2键能493.8KJ/mol。相
1
应波长为243nm。在紫外区 lgε
大气中有机污染物的迁移与转化

大气中有机污染物的迁移与转化大气污染是一个全球性问题,其中有机污染物是主要的成分之一。
这些有机污染物在大气中的迁移与转化对环境和人类健康都产生了深远的影响。
本文将从大气中有机污染物的来源、迁移路径以及转化过程等方面来探讨这一问题。
首先,了解有机污染物在大气中的来源对于研究其迁移与转化至关重要。
有机污染物主要来自于人类活动,如汽车尾气、工业废气和生物质燃烧等。
此外,自然源也会释放一些有机污染物,如植物挥发物和土壤排放物等。
这些有机污染物进入大气后,就开始了它们的迁移与转化过程。
大气中有机污染物的迁移路径主要有两种,水平迁移和垂直迁移。
水平迁移指的是有机污染物在大气中的横向传播,被风力带动,随着大气流动迁移至其他地区。
垂直迁移则是有机污染物在大气中的上升和下降。
一些轻质的有机污染物会随着对流作用上升到较高的海拔,而一些重质的有机污染物则会沉降至地面。
这些不同的迁移路径使得有机污染物在大气中能够广泛分布。
有机污染物在大气中发生转化的过程也是十分复杂的。
其中最常见的转化方式是化学反应。
大气中的氧气、光照、水蒸气等都能够与有机污染物进行反应,从而产生新的物质。
这些转化过程不仅改变了有机污染物的分子结构,也影响了它们的毒性和环境效应。
此外,大气中的微生物和植物也能够通过代谢作用来转化有机污染物。
它们能够利用有机污染物作为能源和营养来源,从而将其转化为无害或低毒的物质。
有机污染物在大气中的迁移与转化对环境和人类健康都带来了一系列的影响。
首先,大气中的有机污染物可以通过沉降、干沉降和湿沉降等方式污染土壤和水体。
这样一来,不仅影响了农作物的质量和产量,也对水域生态系统造成了威胁。
其次,有机污染物还会通过大气-植物系统进入食物链,最终进入人体。
这些有机污染物对人体的健康有潜在的危害,如致癌物质的存在可能导致癌症的发生。
因此,深入研究有机污染物在大气中的迁移与转化有助于更好地控制和预防大气污染对环境和人类的伤害。
综上所述,大气中有机污染物的迁移与转化是一个复杂且重要的研究课题。
大气化学中的污染物迁移与转化

大气化学中的污染物迁移与转化污染物的迁移和转化是影响大气质量的重要因素。
在大气环境中,污染物会经历一系列的化学反应和物理过程,从而发生动态变化,对大气环境和人类健康产生一定的影响。
本文从大气化学的角度探讨污染物的迁移和转化过程,以及对环境和健康的影响。
一、污染物在大气中的迁移过程污染物在大气中能够进行迁移的原因是受到了气体运动的影响。
大气中的污染物可分为两类,一类是颗粒物,一类是气态污染物。
对于颗粒物来说,其迁移过程受到两种运动的影响,分别是大气中的水平输送和垂直扩散。
而对于气态污染物,则主要受空气的输送和扩散作用。
大气中的水平输送主要由风力所驱动,其方向与速度会发生变化。
当空气通过地形的障碍物时,也会受到地形的影响,产生不同的气流。
而大气中的垂直扩散影响来自气压的变化和导致的温度差异。
这种输送和扩散过程,不同的污染物会有不同的迁移特征和影响范围。
在此基础上,可以对不同的污染物采取不同的减排措施。
二、污染物在大气中的转化过程污染物在大气中变化的过程,一部分是受到自然的影响,比如光照、风速等因素的作用,另一部分则是受到人类活动的影响,比如机动车、电厂等的排放。
在大气中,氧气及其他气体的作用,与有机化合物和无机化合物反应,产生了大量的化学反应。
这些反应的产物有时比原始物质更为危险。
大气中的光化学反应是导致污染物转化的主要过程。
该过程可以分为两类,一类是直接光化学反应,一类是间接光化学反应。
直接光化学反应通常涉及有机化合物的氧化反应,如VOCs(挥发性有机物),产生臭氧和其他氧化产物。
间接光化学反应则通常涉及氮氧化物和其他化学物质的作用。
三、对健康和环境的影响空气污染对人类健康和环境产生负面影响。
大气化学在解释污染物对环境和健康的影响方面扮演着重要的角色。
空气污染物对人类健康的影响主要表现为呼吸系统疾病,如哮喘、支气管炎、肺癌等。
此外,空气污染还会造成眼睛病变、心脏病等疾病。
对于环境来说,空气污染造成的主要危害包括气候变化、酸雨、植物和动物的生长和繁殖等问题。
环境化学 第二章 大气环境化学

大气中重要吸光物质的光离解
4 3
(1) O2和N2的光离解
2
1 O2键能493.8KJ/mol。相 应波长为243nm。在紫外区 lgε 0 120-240nm有吸收。
O2 + hν
λ < 240 nm
-1 -2
O· + O·
N2键能:939.4KJ/mol。 对应的波长为127nm。
-3
-4
HNO
3
h ν HO NO
2
2
HO CO CO
H
2
H O 2 M HO 2HO
2
M
(有CO存在时)
H 2O 2 O 2
产生过氧自由基和过氧化氢
(5) SO2对光的吸收
SO2的键能为545.1kJ/mol, 吸收光谱 中呈现三条吸收带,键能大,240 - 400 nm 的光不能使其离解,只能生成激发态:
思考题:
太阳的发射光谱 和地面测得的太阳光 谱是否相同?为什么?
3.3大气中重要自由基来源
自由基 由于在其电子壳层的外层有
一个不成对的电子,因而有很高的活 性,具有强氧化作用。如:
CH 3 C(O)H hv H 3 C HCO
由于高层大气十分稀薄,自由基的半 衰期可以是几分钟或更长时间。自由基参 加反应,每次反应的产物之一是自由基, 最后通过另一个自由基反应使链终止,如:
SO 2 h SO 2
*
240 400 nm
SO2*在污染大气中可参与许多光化学反应。
( P73,图2-32)
(6) 甲醛的光离解
HCHO中H-CHO的键能为 356.5 kJ/mol, 它对 240 – 360 nm 范围内的光有吸收, 吸光后的光解反应为:
大气污染物在环境中的迁移和转化规律

大气污染物在环境中的迁移和转化规律大气污染物的排放对环境和人类健康产生了严重影响,因此研究大气污染物的迁移和转化规律对于减少污染物的排放和保护环境具有重要意义。
本文将探讨大气污染物在环境中的迁移和转化规律。
首先,大气污染物的迁移主要通过空气传播进行。
大气污染物在源地产生后,受到大气风向的影响,通过空气中的颗粒物、气相物质等载体,迁移到远离源地的地区。
例如,来自工业生产、交通尾气和燃煤等活动产生的二氧化硫、氮氧化物等大气污染物会随着风的传播,被带到远离污染源的地区,造成大范围的污染。
其次,大气污染物在迁移过程中会发生转化反应。
大气中的光照、温度、湿度等因素会影响大气污染物的光解、氧化还原和降解反应。
例如,二氧化硫和氮氧化物会与大气中的氧气和水汽发生氧化反应,生成硫酸和硝酸,进而在大气中形成酸雨。
另外,大气中的光照会导致光解反应,产生一氧化碳等有害气体。
大气污染物的迁移和转化还受到大气气象条件的影响。
气象因素如大气湍流、温度逆温层和气压等对大气污染物的扩散和移动起着重要作用。
湍流可以搅拌和扩散大气中的污染物,减少其浓度和影响范围。
而逆温层和气压的变化会影响污染物在大气中的垂直运移。
这些气象因素的变化需要加以考虑和监测,以便更好地预测大气污染物的迁移和转化规律。
另外,大气污染物的迁移和转化还受到地理和人为因素的影响。
地理因素如地形、地貌和地表覆盖等会影响大气污染物的传输和沉降。
例如,山地地形的存在会限制大气污染物的扩散,导致山谷地区出现高浓度的污染物。
此外,人为活动也对大气污染物的排放和迁移产生了重要影响。
随着工业化和城市化的发展,人类活动排放的大气污染物数量不断增加,加剧了环境污染问题。
为了减少大气污染物的排放和保护环境,必须加强大气污染物的监测和控制。
通过监测大气污染物的浓度和变化趋势,可以评估污染物的传播和影响范围,为污染治理提供依据。
此外,还可以利用环境模型和监测数据,预测大气污染物的迁移和转化规律,规划和制定相应的治理措施。
环境科学中的大气污染物迁移与转化机制

环境科学中的大气污染物迁移与转化机制近年来,随着城市化进程的迅猛发展以及工业排放的增加,大气污染问题日益引起人们的关注。
大气污染物不仅对人类健康造成危害,还对生态环境产生负面影响。
因此,研究大气污染物的迁移与转化机制,有助于制定科学的环境保护政策以及控制大气污染的效果评估。
大气污染物的迁移与转化是一个复杂的过程,涉及气象、大气化学、地理环境等众多因素。
首先,大气污染物在大气中的迁移受气象条件的影响。
风向、风速、温度和湿度等因素决定了污染物在空气中的扩散程度和传输速度。
当气象条件不利于扩散时,空气中的污染物容易聚集形成高浓度区域,对周围环境造成更严重的污染。
其次,大气污染物在大气中的转化也是影响其迁移的重要因素。
大气中的氧气、水蒸气和其他化学物质可与污染物发生反应,导致其发生化学变化。
例如,二氧化硫(SO2)可通过与氧气反应形成二氧化硫酸(SO3),进而与水蒸气反应生成硫酸(H2SO4)。
这些新生成的化合物可能会通过湿沉降或干沉降的方式下降到地表,对土壤和水体造成污染。
另外,大气污染物的迁移与转化还受到地理环境的影响。
地表覆盖的不同,如水域、森林、城市等会影响大气污染物的沉积和传输。
例如,城市中密集的建筑物和道路会阻碍风的流动,造成污染物在城市中的积累。
相反,森林和水域能够吸收和吸附污染物,起到净化空气的作用。
此外,大气污染物还可以通过降水形式下降到地表,即湿沉降。
其中,酸雨是一种常见的湿沉降现象。
大气中的污染物与水蒸气和云中的水滴结合形成酸性物质,当降落到地表时,会对土壤、水体和植被造成腐蚀和破坏。
湿沉降还可将大气中的有害物质传递给地表水,对水体生态系统造成危害。
除了湿沉降,大气污染物还可以通过干沉降的方式下降到地表。
干沉降是指污染物直接通过沉降或沉积到地表,而不伴随降水。
这种沉降方式主要受到大气污染物在大气中的颗粒物化状态以及附着剂的影响。
颗粒物中的污染物容易被沉降下来,而气态污染物则更容易保持在大气中。
大气污染物的迁移转化及健康效应

大气污染物的迁移转化及健康效应大气污染物是指空气中存在的对人类健康和环境造成危害的各种物质,在迁移转化过程中,会对人体健康产生重要影响。
本文将探讨大气污染物的迁移转化机制以及其对健康的影响。
一、大气污染物的迁移转化机制1. 大气扩散大气扩散是指大气污染物在空气中随风传播的过程。
风的强弱和方向会影响污染物的传播范围和速度。
风速越大,污染物传播越远;风向改变,污染物也会随之改变传播方向。
2. 干沉降污染物在空气中与颗粒物或气溶胶结合形成悬浮颗粒,随着大气降水或干燥过程,颗粒物逐渐沉降到地面,这个过程被称为干沉降。
颗粒物大小和重力是影响干沉降速度的重要因素。
3. 湿沉降湿沉降是指大气污染物在空气中溶于水蒸气形成气溶胶,随着降水或湿度变化,污染物随水滴一起沉降到地面。
湿沉降是清除大气中污染物最有效的途径之一。
4. 化学反应大气污染物还可以通过化学反应进行迁移转化。
光化学反应是其中重要的一种方式。
例如,光化学反应可以将氮氧化合物转化为臭氧,形成光化学烟雾。
二、大气污染物对健康的影响1. 呼吸系统影响大气污染物包括颗粒物、二氧化硫、氮氧化物等,这些物质进入人体后,通过呼吸道进入肺部,对呼吸系统产生直接影响。
颗粒物可以诱发哮喘、支气管炎等呼吸系统疾病,二氧化硫和氮氧化物可导致肺功能下降。
2. 心血管系统影响大气污染物与心血管疾病之间存在密切关系。
颗粒物、臭氧等大气污染物能进入血液循环系统,导致血管内皮功能受损、血液黏稠度增加、血管内易形成血栓等,最终引发心脏病、中风等心血管疾病。
3. 神经系统影响大气污染物还可能对神经系统产生负面的影响。
部分大气污染物,如苯、甲醛等,具有神经毒性,可损害人体的神经细胞,引发神经系统疾病,如头痛、失眠、注意力不集中等。
4. 癌症与遗传损伤某些大气污染物,如多环芳烃、苯并芘等,被国际癌症研究机构确定为潜在致癌物质。
长期接触这些物质会增加癌症的风险。
此外,一些大气污染物还可能损伤人体的遗传物质,导致基因突变,影响后代的健康。
2019 环境化学 第02章 大气环境化学_08-臭氧破坏_网络教学
第二章 / 第三节 / 3.10 臭氧层的形成与损耗
3.10.4 氟氯烃对臭氧的破坏 二、氟氯烃的用途
用途:清洗剂、制冷剂、喷雾剂、发泡剂
作为清洗剂,使用范围广 有机污物,无机污物
沸点低(CFC-113: 47.6℃)—节省 难燃烧—安全 稳定—使用和保存方便
34
氟利昂的生产和使用情况
3
中间层 平流层
90%臭氧 平流层
高度(km)
对流层
臭氧浓度(个分子/立方厘米)
在大气圈中,臭氧主要分布在平流层
4
第二章 / 第三节 / 3.10 臭氧层的形成与损耗
3.10.1 臭氧分布及南极臭氧空洞 二、什么是臭氧空洞?
1. 测量臭氧总量的单位-道布森
0℃,1个大气压下(标准海平面压力),形成 0.01mm厚纯臭氧层所需要的臭氧分子数,定义 为1个道布森单位(Dobson Unit, D.U.)
(3)O3+ h →O2+O (210nm<λ<290nm)
(4)O3+O →2O2 在没有其它物质存在时, 生成与破坏速度大致相
同;动态平衡, 平均浓度与分布状况基本恒定。
31
第二章 / 第三节 大气中污染物的转化
3.10 臭氧层的形成与耗损
3.10.1 臭氧分布及南极臭氧空洞 3.10.2 臭氧分子结构及性质
第二章 大气环境化学
第三节 大气中污染物的转化
3.10 臭氧层的形成与耗损
(p.122-128)
1
第二章 / 第三节 大气中污染物的转化
3.10 臭氧层的形成与耗损
3.10.1 臭氧分布及南极臭氧空洞 3.10.2 臭氧分子结构及性质
3.10.3 平流层臭氧生成与破坏的化学机理 ★ ★ 3.10.4 氟氯烃对臭氧的破坏 ★ ★
大气环境污染物的迁移与转化

大气环境污染物的迁移与转化近年来,随着工业化和城市化的加速发展,大气环境污染问题日益突出,给人们的生活和健康带来了严重的威胁。
大气环境污染物的来源多样,如工业废气排放、机动车尾气、燃煤等,这些污染物在大气中的迁移与转化过程对于环境治理具有重要意义。
本文将从气候因素、地理因素和人类活动等角度,探讨大气环境污染物的迁移与转化机制。
首先,气候因素对大气环境污染物的迁移与转化具有重要影响。
气候因素包括温度、湿度、风向和风速等。
温度和湿度的变化会直接影响污染物的挥发和沉降速度。
一般情况下,温度越高,污染物的挥发速度越快,湿度越高,污染物的沉降速度越快。
风向和风速则决定了污染物的扩散方向和速度。
当风速较低时,污染物易积聚在地面上,导致局部区域的严重污染,而高风速则有利于污染物的扩散和稀释。
其次,地理因素是影响大气环境污染物迁移与转化的重要因素之一。
地形和地貌的差异会导致污染物在不同地区的分布形式和浓度水平上存在差异。
山区地形通常具有垂直气流和湿度变化较大的特点,这会导致山间污染物的积聚和局部的大气污染。
另外,城市和乡村的地貌特征也会影响污染物的扩散和分布。
城市一般由高楼大厦和道路密集组成,这使得污染物更容易在城市内积累,而乡村地区由于植被覆盖率高,使得污染物在大气中的可见度较低。
最后,人类活动是导致大气环境污染物迁移与转化的主要原因之一。
工业生产、交通运输和能源利用等活动的蓬勃发展,大量排放有害物质进入大气,导致大气环境污染。
工业废气中的硫化物和氧化物会与水蒸气结合形成酸雨,在远处降下对环境和生态系统造成严重破坏。
机动车尾气中的有害物质如二氧化氮和颗粒物会在城市中积累,形成典型的雾霾天气。
而燃煤所排放的二氧化硫和颗粒物则是导致大气环境污染的主要来源之一。
综上所述,大气环境污染物的迁移与转化是一个相当复杂的过程,其中受到气候因素、地理因素和人类活动的共同影响。
了解这些影响因素对于制定环境治理政策和改善大气质量至关重要。
环境化学填空题

环境化学填空题1.环境问题⼀般⼜分为环境污染和环境(⽣态)破坏两⼤类。
如有害物质对⼤⽓、⽔质、⼟壤和动植物的污染造成环境恶化的环境污染问题。
乱砍滥伐引起的森林植被的破坏、过度放牧引起的草原退化、⼤⾯积开垦草原引起的⼟地沙化等环境(⽣态)破坏问题。
2.造成污染的因素有物理的、化学的和⽣物的三⽅⾯,其中因化学物质引起的约占80%~90%。
3.地球上重要的是氧、碳、氮、磷和硫等营养元素的循环4.磷循环:单向流失,最终归宿为深海沉积物5.⼤部分环境污染物是由⼈类的⽣产和⽣活活动产⽣的6.环境效应:⾃然过程或⼈类的⽣产和⽣活活动会对环境造成污染和破坏,从⽽导致环境系统的结构和功能发⽣变化。
7.环境污染物的迁移⽅式:机械迁移,物理化学迁移,⽣物迁移8.环境污染物的转化⽅式:污染物可通过蒸发、渗透、凝聚、吸附和放射性元素蜕变等物理过程实现转化;可通过光化学氧化、氧化还原和配位络合、⽔解等化学作⽤实现转化;也可通过⽣物吸收、代谢等⽣物作⽤实现转化。
9.⼤⽓中的⽔汽含量随时间、地域、⽓象条件的不同⽽变化。
⽔汽在⼲旱地区可低到0.02%,⽽在温湿地带可⾼达6%10.对流层内具有强烈的对流运动→⽔汽和⽓溶胶粒⼦等⼤⽓成分在垂直⽅向上的输送,即污染物易扩散11.对流层顶阻⽌⽔进⼊平流层,否则:H2O + hv →H ·+ HO ·12.臭氧层形成O2 + hv →2 O·O·+ O2→O313.臭氧层作⽤O3 + hv →O·+ O2 (290nm)O·+ O2→O3 + 热O3hv →热14.中间层:NO+,O2+15.热层:NO+,O2+,O+16.污染物物理状态:⽓态污染物,颗粒污染物17.污染物形成过程:⼀次污染物CO, SO2 ,NO等⼆次污染物O3, 硫酸盐颗粒物等18.⼤⽓中的污染物:颗粒物、含硫化合物、含氮化合物、含碳化合物和含卤化合物19.⼀般SO2在⼤⽓中停留3~6.5d,通过光化学氧化、均相氧化及多相催化氧化等⽣成SO3,进⽽⽣成毒性⽐⼆氧化硫⼤10倍的硫酸或硫酸盐,是酸⾬和硫酸烟雾形成的重要因素。
《环境化学》课件第二章-3

NO → NO2 不 需要 O3 参与也 能发生,导致 O3 积累
O3 积累过程导致 许多羟基自由基 的产生
NO和烃类化合物 耗尽
2-7
《环境化学》 第二章 大气环境化学
hν
[O]
[O]
[O] [O]
Generalized scheme for the formation of photochemical smog
图 EKMA方法中的O3等体积分数曲线 (唐孝炎,1990) 0 RH
K
0 NO x
2-10
《环境化学》 第二章 大气环境化学
B.O3 的控制
当[RH]0/[NOx]0 高时,[NOx]0少, O3的生成受[NOx]0的影响明显; [RH]0/[NOx]0 低时,[NOx]0高, O3的生成受[NOx]0的影响不明显;
Oxysulfides and Sulfuric Acid Smog)
八、酸性降水 (Acid Precipitation) 九、温室效应 (Greenhouse Effect) 十、臭氧层的形成与耗损(Formation and Depletion of Ozone Layer)
2-13
《环境化学》 第二章 大气环境化学
Oxysulfides and Sulfuric Acid Smog)
八、酸性降水 (Acid Precipitation) 九、温室效应 (Greenhouse Effect) 十、臭氧层的形成与耗损(Formation and Depletion of Ozone Layer)
2-1
《环境化学》 第二章 大气环境化学
2-4
《环境化学》 第二章 大气环境化学
B. 日变化曲线
第二章-大气环境化学-大气中污染物质的转化-2016

2. HNO3的离解 HNO3 + hν 若有CO存在: HO· +CO H· +O2 +M 2 H O2 ·
HO-NO2键能为 199.4 kJ/mol
HO·+NO2
CO2 + H · H O2· +M H2 O2 +O2
二氧化硫对光的吸收 SO2 + h ν
SO2*
键能为545.1 kJ/mol
光量子能量与化学键之间的对应关 系:
通常波长大于700nm(红外线)的光不能 引起光化学离解。
3.大气中重要的吸光物质的光离解 氧分子和氮分子的光离解
键能为 939.4 kJ/mol
键能为 493.8 kJ/mol
N2+hν O2+hν
N· +N· O· +O·
(波长<243nm) (波长<127nm)
R·
O2
RO2
+ ·
NO
氧化
NO2 + RO ·
甲烷的氧化反应
CH4+HO · CH3 · +H2O
CH4+ O ·
CH3 · +O2
CH3 · +HO ·
CH3O2 ·
大气中的O · 主要来自O3的光解,通过上述反应, CH4不断消耗O ·,可导致臭氧层的损耗,同时可发 生如下反应:
NO+ CH3O2 ·
若NO浓度高时,会伴随如下反应: NO+O3 NO2+O2 NO+NO3 2NO2 NO3与烷烃的反应速度很慢: RH+NO3 R ·+HNO3 这是城市夜间HNO3的主要来源。
这是城市夜 间HNO3 的主要来 源。
大气污染物在环境中的迁移转化

如果有一种以上的卤素,则断裂的是最弱的键。如CFCl3 (氟里昂-11) CF2Cl2(氟里昂-12)的光解:
CFCl3 h (175~ 227nm) CFCl2 Cl
CFCl3 h CFCl 2Cl CF2Cl2 h (175~ 227nm) CF2Cl Cl
污染大气中的基本光化学链:
NO2 h NO O
O O2 M O3 O3 NO NO2 O2
420 nm
(4) SO2对光的吸收 SO2的键能为545.1kJ/mol,相当于218nm光波能量, 吸
收光谱中呈现三条吸收带:340~400nm、 240~330nm 、 小于240nm;显然,240 - 400 nm的光不能使其离解,只能 生成激发态:
天气形势和地理地势对污染物扩散的影响: 1、城市热岛效应 2、逆温
逆温产生的原因及类型:
辐射逆温:由于强烈有效的地球辐射,使地面和近地面大气 层强烈迅速冷却降温,而较上层冷却较慢,出现上暖下冷的 逆温现象。
下沉逆温:在高压区内,气层大规模下沉时,因气压增加及 气层水平方向扩散,使厚度减小而压缩升温形成的逆温。
HNO3 h HO NO2
HO CO CO2 H H O2 M HO2 M 2HO2 H 2O2 O2
产生过氧自由基和过氧化氢。
(有CO存在时)
(6) 甲醛的光离解
HCHO中H-CHO的键能为 356.5 kJ/mol,它对 240~360 nm 范围内的光有吸收,吸光后的光解反应为:
总之,实行清洁生产法:清洁的原料、清洁的生产过程、 清洁的产品。
这是联合国环境规划署于1989年提出的,以提高资源能 源利用率、减少污染物产生量为目标,核心是污染预防,变 传统的末端治理为全过程控制,即源消除法。
大气环境中光化学反应对污染物的转化影响

大气环境中光化学反应对污染物的转化影响污染物是当前社会面临的重要环境问题之一。
随着工业化和城市化的加速推进,大气环境中的污染物排放日益增多,给人们的生活和健康带来了巨大的威胁。
因此,研究大气环境中污染物的转化机制变得尤为重要。
光化学反应作为大气环境中一种重要的污染物转化途径,对污染物的转化产生重要影响。
光化学反应是指气体或气溶胶中的化学物质在太阳光照射下发生化学反应。
太阳光中的紫外线和可见光可以激发大气中的分子,使其达到激发态或离解态,从而促进化学反应的进行。
在光化学反应中,光子的吸收和发射促使大分子上的化学键发生断裂和形成,最终导致各种有机或无机物质的产生和转化。
光化学反应在大气环境中的重要性主要表现在两个方面。
首先,光化学反应可以促进大气中污染物的降解和转化。
例如,光生产的氢氧自由基(OH)在大气中的浓度较高,是一种非常活跃的氧化剂。
它可以与许多污染物发生反应,如一氧化碳、氮氧化物和挥发性有机化合物等,将它们转化为相对无害的产物。
其次,光化学反应可以产生大气中的一些次级污染物。
这些次级污染物通常是由光化学反应的中间过程产生的,如光氧化反应和光解反应。
这些次级污染物可能对人体健康产生更大的危害。
光化学反应可以清除大气中的污染物,但它也可能对环境产生负面影响。
首先,光化学反应产生的次级污染物可能具有更高的毒性和持久性。
例如,光化学烟雾中产生的臭氧是一种强氧化剂,对人体呼吸系统和植物生长产生严重威胁。
其次,太阳光的强烈辐射和大气中的光学反射可能产生臭氧和光化学烟雾,进一步加剧大气污染。
这种正反馈效应可能使大气中的污染物越转化越多,使空气质量变得更糟。
了解光化学反应对污染物转化的影响,对于制定和实施大气环境污染治理策略具有重要意义。
研究人员可以通过实验室模拟和分析实际大气样品来揭示光化学反应的机制和影响因素。
通过准确了解和模拟大气中的光化学反应过程,可以预测和评估不同排放源对大气污染的影响,进而制定有针对性的控制措施。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章:大气环境化学——大气中污染物的转化本节讲述内容:大气中硫氧化合物的转化以及酸雨研究概况一、光化学反应基础二、大气中重要物质的吸光特征和光分解过程三、大气中重要自由基的来源四、大气中氮氧化合物的转化五、大气中碳氢化合物的转化六、光化学烟雾七、大气中硫氧化合物的转化➢由污染源直接排放到大气中的主要硫氧化合物是SO2,人为污染源是含硫矿物的燃烧过程,将矿物中的有机硫或元素硫氧化为SO2。
一般煤中含硫0.5-6%,石油0.5-3%。
就全球范围,人为排放的SO2中有60%来自然煤,30%来自然油。
➢SO2的天然来源是火山喷发,喷发中大部分硫化物是以SO2形式存在的,少部分以H2S形式存在。
H2S在大气中又很快氧化成为SO2。
➢大气中的硫氧化合物包括H2S、二氧化硫、三氧化硫等,其中三氧化硫很容易溶解于水形成硫酸,在与颗粒物作用生成硫酸盐气溶胶。
➢一般情况下SO2不容易直接被O2所氧化,需要将SO2先行激活(光化学的激发态)或者需要氧化性更强的氧化剂来对之进行氧化。
➢实际测定研究结果说明:光强、湿度和氧化剂浓度都对SO2的氧化过程有影响。
➢SO2在大气中转化的最终结果是形成硫酸——酸雨。
1、SO2的气相氧化(1)直接光氧化:●底层大气中SO2的吸光过程是变成激发态SO2分子,而不是造成SO2的直接离解。
激发态的SO2分子有两种:单重态和三重态。
SO2+hv(340-400nm)→3SO2(三重态,电子自旋,平行,能态低)SO2+hv(290-340nm)→1SO2(单重态,电子自旋,反向,能态高)●但单重态的激发态SO2分子很不稳定,立即可以通过放出磷光转变为三重态或基态。
1SO2+M→3SO2+M1SO2+M→SO2+M1SO 2→SO 2+hv● 三重态的SO 2分子在大气中比较稳定,寿命比较长,所以三重态的SO 2对于氧化和酸雨的形成有重要贡献。
● 因为基态的SO 2分子没有三重态3SO 2分子化学性质活波,所以三重态SO 2对于酸雨的贡献更大。
大气中三重态3SO 2分子比基态SO 2分子容易被直接氧化:3SO 2+O 2→SO 4(3SO 2和O 2的结合体,不稳定,分解很快)→SO 3+OO+3SO 2→SO 3 SO 3+H 2O →H 2SO 4● SO 2的宏观氧化速率为:%100][][][02202⨯-SO SO SO t,一般直接光氧化速率0.1% SO 2/h(2)被自由基氧化——间接光氧化:污染大气中含有各类有机污染物的光解以及反应生成的各种自由基,这些自由基大多具有强氧化性,因此SO 2分子很容易被他们氧化⏹ 与HO 自由基的反应是大气中SO 2分子氧化的重要反应:SO 2 + OH • → HOSO 2(25摄氏度,1atm ,k=9×10-13cm 3mol -1s -1) 自由基HOSO 2不稳定,立即进一步与大气中的氧分子作用:HOSO 2+ O 2+M → HO 2+SO 3+M SO 3+H 2O →H 2SO 4HO 2+NO →HO+NO 2 (污染大气中有NO ,所以HO 重生) ⏹ 与其他自由基的反应:✧ 二元活性自由基CH 3CHOO+SO 2→CH 3CHO+SO 3(白天主要与HO 反应,夜间发生该反应,二元自由基来源于前述的臭氧和烯烃的反应) ✧ SO 2 + HO 2• → OH • + SO 3✧ SO 2 + CH 3O 2• → CH 3O • + SO 3✧ SO 2 + CH 3C(O)O 2• → CH 3C(O)O + SO 3 (3)被原子氧、臭氧氧化:◆ NO 2的光解。
NO 2+hv →NO+O k 1 O+SO 2→SO 3 k 4另有反应:O+O 2+M →O 3 +M k 2 由上述反应可得到:]][[]][[][][242221SO O k O O k NO k dtO d --= 稳态时,并且已知k 4<<k1或k2,得到:][][][2221O k NO k O =又因为:]][[][242SO O k dtSO d -= 可以解得:t O k SO SO t ][][][ln 4022-=⎪⎪⎭⎫⎝⎛所以)][ex p(][][4022t O k SO SO t -=现在把SO 2被原子氧氧化而消耗到起始浓度的1/e 所需要的时间用τ表示,并称为与O 氧化的特征时间,则有:][][21422NO k k O k =τ◆ 与污染大气中的O 3+SO 2→SO 3 +O 2◆ 可以定义SO 2在单位时间的转化百分数。
X+SO 2→SO 3 k 则]][[][22SO X k dtSO d -= 所以:)][ex p(][][022t X k SO SO t -=于是1h 二氧化硫转化的百分数可以定义为:()%100)][exp(1%100][][1%100][][][021*******⨯--=⨯⎪⎪⎭⎫ ⎝⎛-=⨯-==t X k SO SO SO SO SO h t ht (%/h ) 2、SO 2的液相氧化◆ 被水直接吸收:大气中存在少量的水和颗粒物,SO 2可溶于大气中的水,也可以被大气的颗粒物所吸收,并溶解在颗粒物表面的水中。
于是SO 2可发生液相反应,并可计算各可溶态浓度:SO 2(g) + H 2O ↔SO 2•H 2O K H 2][22SO H p O H SO K ⋅=, 所以[SO 2·H 2O]=K H p so2SO2·H2O↔H++HSO3-Ks1][]][[2231OHSOHSOHKs⋅=-+,所以][[][][21]2213++-=⋅=HpKKHOHSOKHSO SOsHsHSO3-↔H++SO32- Ks2][]][[3232--+=HSOSOHKs,2213223][][][][2++--==HpKKKHHSOKSO SOssHs因此,溶液中可溶性总四价硫浓度为:[S(Ⅳ)]=[SO2·H2O]+[HSO3-]+[SO32-][S(Ⅳ)]与pso2的关系为:[S(Ⅳ)]=KHpso2[1+]][][2211+++HKKHKsss一般,KH=1.22×10-5molL-1Pa-1Ks1=1.32molL-1Ks2=6.42×10-8molL-1因此得到修正的亨利系数:KH *=]][][1[211++++HKKHKK sssH则根据亨利定律有溶解的四价硫浓度和气态二氧化硫大气分压关系:[S(Ⅳ)]=K*H p so2由上式可见,K*H 总是大于KH,也就是说溶液中硫离子的总量要超过由亨利定律所决定的SO2溶解的量。
而且还可看出,可溶性四价硫的总浓度与pH有关。
现把三种形态[S(Ⅳ)]的摩尔分数与pH之间的关系用如下三个表达式来表示:ɑ0=1221122][][1V)]([][-++⎥⎦⎤⎢⎣⎡++=I⋅HKKHKSOHSOsss,ɑ1=1213][][1)]V([][-++-⎥⎦⎤⎢⎣⎡++=I HKKHSHSOssɑ2=1212223][][1)]V([][-++-⎥⎦⎤⎢⎣⎡++=IsssKKHKHSSO可见,可溶态SO2、HSO3-和SO32-四价硫形态的浓度分数与pH有一定的函数关系(图2-20)。
由图中可见,在高pH范围[S(Ⅳ)]以SO32-为主,中间pH以HSO3-为主,而低pH时以SO·H2O为主。
实际上,由于[S(Ⅳ)]在不同化学反应中存在着不同的形态,如液相反应中出现HSO3-或SO32-时,那么其反应速度将依赖于pH。
被大气中的O3等强氧化剂氧化:污染空气中O3浓度要比清洁空气中高,主要是由于二氧化氮光解导致的。
于是O3可以将溶于大气水中的SO2氧化。
O3+SO2•H2O↔2H++SO42-+O2k0=2.4×104mol-1Ls-1O3+HS O3-↔HSO4-+O2k1=3.7×105mol-1Ls-1O3+SO32-↔SO42-+O2k2=1.5×109mol-1Ls-1根据研究,当[O 3]>0.05ppmv ,并且pH<5.5,则臭氧的氧化作用就大大增加,并超过氧气分子的氧化作用。
但是如果湿度较低,则反应可能进行得很慢。
水相中S(Ⅳ)被O 3氧化的速率可以表示为:]])[[][][(])][()[()]([3232312203221100O SO k HSO k O H SO k O IV S k k k dtIV S d --++⋅-=++-=ααα 由上述反应速率系数可见,一般臭氧与SO 32-反应最快,与SO 2•H 2O 反应最慢,但是一旦溶液的pH 较低,则与SO 2•H 2O 的反应变得最重要,若溶液的pH 较高,则与SO 32-的反应变得最重要。
例题讲解:已知测得某污染大气中[O 3]=0.05ppmv ,[SO 2]=0.01ppmv,大气中气溶胶表面溶液的pH =3.2,试确定S(Ⅳ)被O 3氧化的速率。
解:pH=3.2所以[H +]=10-3.2molL -1[O 3]=0.05ppmv=5×10-8atm=5×10-8×1.01×105Pa=5.05×10-3Pa[O 3]=0.05ppmv=0.054.2248⨯mgm -3=0.0548104.22486-⨯⨯molL -1=2.23×10-9molL -1 [SO 2]=0.01ppmv=1×10-8×1.01×105Pa=1.01×10-3Pa计算各可溶态浓度:(K H =1.22×10-5molL -1Pa -1,K s1=1.32molL -1,K s2=6.42×10-8molL -1) SO 2(g)+H 2O ↔SO 2•H 2O 2][22SO H p O H SO K ⋅=,所以[SO 2·H 2O]=K H p so2=1.23×10-8molL -1SO 2·H 2O ↔H ++HSO 3-][]][[2231O H SO HSO H K s ⋅=-+,]2213[][][+-⋅=H O H SO K HSO s =1.23×10-8molL -1×1.32molL -1/(10-3.2molL -1) =1.62×10-4.8molL -1 HSO 3-↔H ++SO 32-][]][[3232--+=HSO SO H K s ,][][][3223+--=H HSO K SO s=6.42×10-8molL -1×1.62×10-4.8molL -1/(10-3.2molL -1) =1.04×10-8.6molL -1 O 3可以将溶于大气水中的SO 2氧化O 3+SO 2•H 2O ↔2H ++SO 42-+O 2 k 0=2.4×104mol -1Ls -1 O 3+HS O 3-↔HSO 4-+O 2 k 1=3.7×105mol -1Ls -1 O 3+SO 32-↔SO 42-+O 2 k 2=1.5×109mol -1Ls -1]])[[][][()]([323231220O SO k HSO k O H SO k dtIV S d --++⋅-= =-(2.4×104mol -1Ls -1×1.23×10-8molL -1+3.7×105mol -1Ls -1×1.62×10-4.8molL -1+1.5×109mol -1Ls -1×1.04×10-8.6molL -1)×2.23×10-9molL -1 =2.99×10-8molL -1s -1◆ 被大气中的金属离子催化氧化:污染空气中含有Fe 3+、Mn 2+等金属离子,在其溶胶的液相表面,这会导致SO 2的氧化速率大大增加。
