初中物理 趣味故事224 卢瑟福画的原子模型素材 新人教版
2.4 波尔的原子模型

根据:E=hv,λ=c/v
n=1 n=2 n=3 n=4 n=5
又Eδ =1.89eV= 3.03 ×10-19J 所以, λ δ=hc/ Eδ = 6.63×10-34 ×3.0 ×10-8 / 3.03 ×10-19J
n=6
= 6.57 ×10-7(m)
Hδ
Hγ
Hβ
Hα
巴尔 末系 氢吸 收光 谱
C、原子要发出某一频率的光子
D、原子要吸收某一频率的光子
2、氢原子的能级图
5 4 3
E/eV n ∞----------------- 0 eV
布 喇 开 系 普 丰 德 系
-0.54 -0.85 -1.51
-3.4
激 发 态
2
巴 耳 末 系
帕 邢 系
基态 1 -13.6
赖曼系
(巴尔末系)
Hδ Hγ Hβ Hα
1 1 1 R( 2 2 ) n 3,4,5,... 2 n 巴耳末公式 R=1.10 107 m1 里德伯常量
1 Rhc 量: En 2 E1 - 2 n n
(n=1,2,3……)
式中r1 =0.53×10-10 、E1=-13.6ev分别代表第一条 (即离核最近的)可能轨道的半径和电子在这条轨 道上运动时的能量,rn、En 分别代表第n条可能轨道 的半径和电子在第n条轨道上运动时的能量(包括动 能和势能) ,n是正整数,叫量子数。
hv En Em
(h为普朗克常数)
本实验中是利用一定能量的电子与原子碰撞交换能 量而实现,并满足能量选择定则:
eV En Em
(V为激发电位)
夫兰克-赫兹实验玻璃容器充以需测量的气体,本实 验用的是汞。电子由阴级K发出,K与栅极G之间有加速 电场,G与接收极A之间有减速电场。当电子在KG空间经 过加速、碰撞后,进入KG空间时,能量足以冲过减速电 场,就成为电流计的电流。
卢瑟福的核式结构模型

卢瑟福的核式结构模型卢瑟福的核式结构模型可谓是科学界的一次震撼教育,想想看,这个小小的原子,竟然能隐藏如此大的秘密,简直让人惊掉下巴。
卢瑟福当年进行实验时,大家都以为原子就像一块果冻,里面全是混合的材料,谁能想到,他一枪打出去,竟然让原子的核心大白于天下,真是让人瞠目结舌。
就像探险家发现新大陆一样,卢瑟福的实验让人觉得,原来科学的奥秘就藏在我们身边,关键是你敢不敢去探索。
想象一下,那时候的卢瑟福把一颗金属薄膜当成目标,然后用一种叫“α粒子”的小家伙去射击。
结果,大家都知道,部分粒子直接弹回来了,像是打了个乒乓球一样,真是让人捧腹大笑。
可这背后隐藏的道理却是深刻的,弹回来的那些粒子,说明原子里有一个小小的核,这个核就是原子的灵魂。
就像我们每个人,外表可能平平无奇,但内心深处总藏着一个闪闪发光的梦想。
而这个核心啊,不是个简单的东西,它不仅小得可怜,还重得惊人。
想想看,一个原子里,绝大部分的质量竟然集中在这个小小的核里,其他的部分就像围绕着太阳转的行星,轻飘飘的、没什么分量。
真的是令人咋舌,果然是“金子总会发光”的道理。
在那个年代,科学家们可是忙得不可开交,大家都在争着抢着想弄明白这个核到底是个什么玩意儿。
还有一点让人津津乐道的就是,卢瑟福的发现直接推翻了之前的“汤姆森模型”。
那个模型就像是老爸的车,虽然外形看起来还不错,但一开动就摇摇晃晃,根本没法稳定。
而卢瑟福的模型就像是一辆跑车,简洁明了,动力十足。
原子不再是一个复杂的混合物,而是由一个小核和周围的电子组成,真是一下子让人眼前一亮。
再说说这核的构成,里面有质子和中子,这两个小家伙就像是形影不离的好兄弟。
质子带着正电,中子则是个隐形的角色,既不带电也不显山露水,但却在这场科学革命中发挥了至关重要的作用。
简直就像电影里的配角,默默无闻却不可或缺,真是“台上一分钟,台下十年功”的真实写照。
而卢瑟福自己也是个性情中人,他对科学的热爱可不是盖的。
他的实验虽然成功,但他从不以此自满,总是谦虚地说自己只是揭开了冰山一角。
科学家探索原子结构的故事

科学家探索原子结构的故事<<揭开原子秘密的人>>1871年,卢瑟福诞生在新西兰的一个农村。
他家人口很多,卢瑟福从小一边上学一边帮着家里干农活。
少年时的卢瑟福是个很爱动脑筋的孩子,尤其喜欢自己动手做些小玩意。
他曾经“发明”了一种可以发射“远射程炮弹”的玩具火炮,还巧妙地设计出增加炮击距离的方法。
有一次,家里的大钟坏了,卢瑟福便动手把钟拆开来,他的兄弟姐妹都认为一定会受到父母的责罚,但卢瑟福竟把钟修好了,而且以后还走得很准。
后来,他还自制了一架照相机,自己拍摄,自己冲洗,成了个摄影迷。
24岁时,卢瑟福获得一笔奖学金,来到英国剑桥大学凯文迪许实验室进行深造。
从此,他开始了在英国的科学研究生活。
37岁那年,由于他对于放射性现象研究的杰出成就,他获得了诺贝尔化学奖。
但他并没有满足,决心对原子进行更深入的探索。
早在古希腊时代,就有人提出,自然界天地万物是由原子构成的。
长期以来,人们一直认为原子是物质最小的单位,是不可分割的,它的形状像个实心小球。
而此时随着科学的发展,一些科学家认识到原子内部还有着更小的单位,卢瑟福的老师汤姆逊就持这一种观点。
他们认为,原子的模样像西瓜,瓜瓣就像是原子内均匀分布的正电荷,而瓜子就是电子。
“原子果真像老师所说的那样吗?“卢瑟福想通过实验来探究一下自己一直思索的这个问题。
他想,如果原子果真像个西瓜,那么,如果用比原子更小的粒子作“炮弹”来轰击它,就一定很容易地穿过它而笔直地前进。
于是,他决定用一种叫做“a“的粒子做“炮弹”,来轰击原子,看看会发生什么情况。
然而,要做这个实验并不是一件容易的事。
除了要设计一套专门仪器外,实验本身就像是用机关枪扫射几个散落在茫茫草原中的小核桃一样的困难。
在年轻的助手和几个学生帮助下,卢瑟福终于设计出了一个试验装置:一个“a”射线的放射源,就像一挺机关枪,一个金属箔作靶子,就像放核桃的草地,在它的旁边放一个硫化锌的荧光屏,屏后安装一架显微镜,来观察实验的情况。
卢瑟福原子核式结构模型

卢瑟福原子核式结构模型卢瑟福的原子核式结构模型主要包括以下几个要点:1.原子核:卢瑟福认为原子核是原子的中心,其中含有几个质子和一些中子。
原子核的直径约为10^-14米,相对于整个原子而言非常小,并带有正电荷。
2.电子轨道:卢瑟福认为电子沿着特定的轨道绕着原子核运动。
他提出了类似于行星绕着太阳运动的图像,将电子轨道比作类似椭球形的轨道,不同轨道具有不同的能级。
这些电子轨道是固定的,电子不会从一个轨道跃迁到另一个轨道。
3.质子和中子:卢瑟福提出原子核中含有质子和中子。
质子带有正电荷,中子则是中性的。
质子的数目决定了原子的元素,而中子的数目可以不同,即同一元素的同位素。
4.电子云:卢瑟福的模型仍然保留了以前的“电子云”概念,即电子在不同轨道上运动,创造了一个围绕原子核的电子云。
这个电子云能够解释原子的大小和光谱线的现象。
卢瑟福的原子核式结构模型相比于以前的汤姆逊原子模型更为接近现代的原子结构理论。
他巧妙地利用了散射实验来验证他的模型。
在散射实验中,他用α粒子(即带有正电荷的氦原子核)射向了金箔,并观察到了一些氦原子核与金箔上的原子核发生散射的现象。
通过测量和分析散射角度的变化,卢瑟福发现,大部分的α粒子直接穿过金箔,而只有极少数的α粒子发生偏转或反弹。
这一观察结果无法用汤姆逊的原子模型解释,因为汤姆逊的模型认为正电荷均匀分布在整个原子中。
卢瑟福的原子核式结构模型奠定了现代原子结构理论的基础,为后续的量子力学和核物理学发展打下了重要的基础。
他的模型揭示了原子在微观层面上的真实本质,对于理解原子的性质和物质世界的组成具有重要的意义。
卢瑟福的原子核式结构模型

卢瑟福的原子核式结构模型
卢瑟福的原子核式结构模型是20世纪初物理学研究的重要成果之一。
这一模型通过实验证明了原子不是一个均质的球体,而是由一个小而重的原子核和围绕它旋转的电子构成。
此模型的提出,对于人们理解原子结构的本质具有重要意义。
卢瑟福实验的基本原理是,通过将一个α粒子(即带有两个质子和两个中子的氦原子核)轰击到一个金箔上,通过观察α粒子的散射方向来确定原子的结构。
实验结果表明,大部分的粒子通过金箔而不受到偏转,但有一部分粒子受到了较大的偏转。
这表明原子中存在着一个小而重的原子核,而电子则围绕在原子核周围。
卢瑟福模型的核心思想是,原子结构由一个小而重的原子核和围绕其运动的电子构成。
原子核包含质子和中子,质子带有正电荷,中子不带电。
电子则带有负电荷。
原子核的大小约为10^-15米,而整个原子的大小约为10^-10米。
卢瑟福模型对于人们理解化学反应、放射性衰变等现象具有重要意义。
例如,核反应是指原子核之间的反应,而非电子之间的反应。
放射性衰变也是指原子核的变化,而非电子的变化。
此外,原子核式结构模型也为原子核物理学和核能技术的发展提供了重要的理论基础。
卢瑟福的原子核式结构模型是一项重要的物理学成果,它通过实验证明了原子结构由一个小而重的原子核和围绕其运动的电子构成。
这一模型对于人们理解化学反应、放射性衰变等现象具有重要意义。
原子物理学(原子的位型卢瑟福原子模型 ) 39页PPT文档

e/m=v/Hr
1-1-2 电子的电荷和质量(1)
• 密立根油滴实验 (1)
–测得电子电量为:e = 1.6×10-19 C (库仑)
电子质量 me = 9.1×10-31 kg –密立根首次发现了电荷的量子化
• 电荷只能是 e 的整数倍
–若知H+(质子)的荷质比 e
• 带正电物质散射(汤氏模型)(2)
– 正电荷Ze对粒子(2e)的最大力
–散射角
F
1
4 0
2Ze2 R2
p p
p’ p
p
–动量的变化~力乘以粒子在原子度过的时间2R/v
1-2-3 解释 粒子散射实验(3)
• 带正电物质散射(汤氏模型)(3)
–相对动量的变化
e2
p 2FR/v 2Ze2 /(40R)
p
E
E
–一次散射的散射角 103 rad
–重复散射也不会产生大角度
• 重复散射为随机, 平均之后不会朝一个方向 特别不会稳定地朝某一方向散射
–汤姆逊原子模型与实验不符!
1-3 卢瑟福散射公式
1. 库仑散射公式的推导 2. 卢瑟福公式的推导
1-3-1 库仑散射公式的推导(1)
• 远离靶核的入射能量E,电荷Z1e的带电粒子与电 荷Z2e的靶核散射
1-1 背景知识
1. 电子的发现 2. 电子的电荷和质量 3. 原子的大小
1-1-1 电子的发现
• 汤姆逊阴极射线实验+ -
–实验装置
D
C
P1
E
H⊙
P2
A ,B
+
–阴极射线(C)狭缝(A,B)金属板(D,E)荧光屏
人教版选修35第十八章第四节波尔的原子模型(25张PPT+FLASH)

跃迁:原子从一种定态(设能量为E2)跃迁到另一种定
态(设能量为E1)时,它辐射(或吸收)一定频率的光子, 光子的能量由这两种定态的能量差决定, 高能级Em 低能级En。
可见,电子如果从一个轨道到另一个轨道,不是以螺旋 线的形式改变半径大小的,而是从一个轨道上“跳跃”
到另一个轨道上。玻尔将这种现象叫作电子的跃迁。
而被激发,由于实物粒子的动能可部分地被原子吸收,所
以只要入射粒子的能量大于两能级的能量差值 (E=En-Ek),
就可使原子发生能级跃迁。
二.玻尔理论对氢光谱的解释
5 4 3 激 发 态 2
E/eV n ∞----------------- 0 eV
-0.54 -0.85 -1.51
-3.4
巴 耳 末 系
第四节 波尔的原子模型
19世纪末20世纪初,人类叩开了微观世界的大 门,物理学家根据研究提出了关于原子结构的各 种模型,卢瑟福的核式结构模型能够很好的解释 实验现象,得到了多数人的支持,但是与经典的 电磁理论发生了矛盾.
著名的 粒子散射实验
卢瑟福的核式结构模型存在哪些致命的弱点?
按照经典物理学的观点去推 断,在轨道上运动的电子带有电 荷,运动中要辐射电磁波,电子 损失了能量,其轨道半径不断缩 小,最终落在原子核上.由于电 子轨道的变化是连续的,辐射电 磁波的频率也会连续变化.
发生?
光子的发射和吸收
光子的发射和吸收
电子从高能量的轨道跃迁到低能量的轨道时, 会放出光子;
当电子从低能量的轨道跃迁到高能量的轨道时, 会吸收光子。 原子在始、末两个能级Em和En ( Em>En )间跃迁时发射(或吸收) 光子的频率可以由下式决定: 3.频率条件(辐射条件):
化学人教版九年级上册原子发现史资料

课外资料:揭开原子奥秘的化学史1.道尔顿的故事John Dalton,1766~1844道尔顿提出了了世界上第一个原子的理论模型:实心球式。
道尔顿原子理论,是人类第一次依据科学实验的证据,成系统的阐述了微观物质世界,是人类对认识物质世界的一次深刻的,具有飞跃性的成就。
道尔顿原子论认为,物质世界的最小单位是原子,原子是单一的,独立的,不可被分割的,在化学变化中保持着稳定的状态,同类原子的属性也是一致的。
1803年9月,道尔顿利用当时已掌握的一些分析数据,计算出了第一批原子量。
1803年10月21日,在曼彻斯特的“文学和哲学学会”上,道尔顿第一次阐述了他关于原子论以及原子量计算的见解,并公布了他的第一张包含有21个数据的原子量表。
报告中道尔顿已经概括了科学原子论的三个要点:(1)元素(单质)的最终粒子称为简单原子,它们极其微小,是看不见的,是既不能创造,也不能毁灭和不可再分割的。
它们在一切化学反应中保持其本性不变。
(2)同一种元素的原子,其形状、质量和各种性质都是相同的;不同元素的原子在形状、质量和各种性质上则各不相同。
每一种元素以其原子的质量为最基本的特征。
(3)不同元素的原子以简单整数比相结合,形成化学中的化合现象。
化合物原子称为复杂原子。
复杂原子的质量为所含各种元素原子质量的总和。
同一化合物的复杂原子,其组成、质量和性质必然相同。
2.汤姆森的故事J. J. Thomson,1856~1940电子是在1897年由剑桥大学卡文迪许实验室的约瑟夫·约翰·汤姆森在研究阴极射线时发现的。
约瑟夫·约翰·汤姆森提出了葡萄干模型(枣糕模型)。
汤姆逊根据放电管中的阴极射线在电磁场和磁场作用下的轨迹确定阴极射线中的粒子带负电,并测出其荷质比,这在一定意义上是历史上第一次发现电子。
阴极射线cathode ray:当装有2个电极的玻璃管(cathode ray tube)里的空气被抽到相当稀薄的时候,在2个电极间加上几千伏的电压,这时在阴极对面的玻璃壁上闪烁着绿色的辉光,可是并没有看到从阴极上有什么东西发射出来。
卢瑟福Rutherford原子行星模型
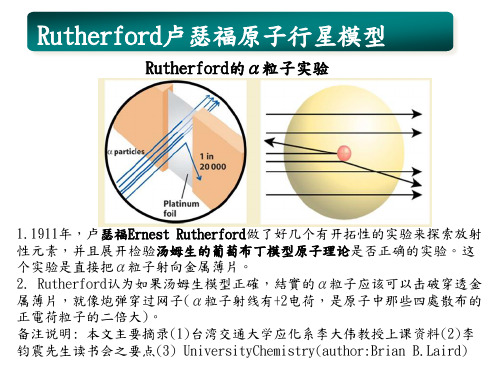
3.他预期绝大多数的α粒子会穿透金属薄片,只有非常少数的α粒子反弹至 其他位置。但是实验结果不如预期。虽然大部分α粒子穿透金属薄片,但是 有许多粒子以很大的角度偏折斜射出去,有一些粒子甚至反射回来,完全没 有碰到金属薄片另一端的测试器,大约20,000个α粒子中,有1个反弹回来。 4.Rutherford从这个实验结果得知,原子结构是葡萄布丁模型的理论并不正 确。造成α粒子大角度偏折斜射出去的原因是,所有正电荷粒子都集中在原 子的中心,同时这些正电粒子也是原子的质量来源。 5.大部分α粒子穿过金属薄片是因为原子的体积大部分的空间是中空的。那 些偏折的α粒子,是因为它们靠近碰到了原子结实的正电中心,少数反射的 α粒子是因为它们直直地撞上原子的正电中心。这些结果只能解释成原子有 原子核nuclear atom,原子有个集中所有正电荷的核,而电子则是围绕原子 核活动;「电子与原子核的距离」,与「原子核的半径」相比是相当大的。 6.电子进行圆周轨道运动,则电子圆周运动所得到向心力等于电子和原子核 的吸引力(静电作用力)相等(注1),电子就可稳定进行行星轨道运动 结论:由于正电荷原子核在原子中心,而负电荷电子在旁边,故布丁模型被修 正为行星轨道模型,而且电子可以在任何半径的轨道作圆周运动
根据rutherford假设电子可在任何大小半径作圆周运动只要符合向心力静电吸引力不同半径有不同的电子挀动频率则电子可有任一挀动频率及任一波长的光谱说明1在某些原子的电子运动中不是一个连续能量分布2如氢原分子在1885年balmer实验中氢原子光谱透过棱镜分光后只有45条线单一波长的光谱而非一个连续性能量的光谱出来如注32根据古典电磁学电子只有在那样的电子挀动频率才能产生那样的光谱3当产生电磁波时就会有能量损耗
Rutherford原子行星轨道模型矛盾:
卢瑟福发现的原子结构

卢瑟福发现的原子结构卢瑟福的发现真是个传奇故事,咱们就从头说起。
想象一下,在上个世纪初,科学家们对原子结构的理解简直就像摸黑走路,谁都不知道路在何方。
这个时候,卢瑟福挺身而出,像个勇敢的探险家。
他在一场经典的实验中,拿出了一些金属箔,大家都知道,这玩意儿薄得像纸一样,甚至能透光。
然后他用一束强烈的粒子撞击这些薄膜,结果惊呆了!一些粒子居然被反弹回来,就像是打乒乓球一样,真是让人目瞪口呆。
哦,大家都知道,原子不是个简单的玩意儿。
之前的科学家们把它想象成个小球球,可能是因为这让人觉得可爱。
但是卢瑟福却说,嘿,这里边可大有文章。
经过他的实验,他发现原子里有个超小的中心,像个小太阳,咱们称它为原子核。
这个核里满是质子,像个不折不扣的“家长”,而电子就像顽皮的小孩,在外面绕圈圈,玩得不亦乐乎。
真是个有趣的家庭啊。
说到这个原子核,真是令人着迷,想想看,它的体积小得惊人,但却能装下大部分的原子质量,简直像个小小的超级大国。
想象一下,整个原子就像个足球场,而原子核在其中就像一个小小的点,哈哈,这让人感到不可思议。
更有意思的是,卢瑟福还发现,电子在外面转圈就像天体运动一样,真是神奇得让人忍不住想鼓掌。
这时候,卢瑟福的发现带来了翻天覆地的变化,许多科学家开始重新审视原子的构造,甚至连物理学的基本理论也因此受到影响。
大家开始琢磨,这小小的原子到底藏着多少秘密。
想想当时的科学界,真是兴奋得像个过年,大家争先恐后地想要揭开原子背后的谜团。
那些个沉闷的理论突然变得生动活泼,科学家们的眼里闪烁着激情的火花。
说实话,卢瑟福不仅仅是个实验高手,他还是个思想家。
他的工作让人们意识到,科学不是一成不变的,而是一个不断探索和发现的过程。
就像人生一样,有时候走着走着就会发现意想不到的美好。
大家都想要深入了解这个原子世界,甚至想要“深挖”出更复杂的东西。
科学的旅程就像一场冒险,不断在未知的领域探索,让人感到无比兴奋。
卢瑟福的成就并不是说就此结束。
初中物理趣味故事224卢瑟福“画”的原子模型素材新人教版

224卢瑟福“画”的原子模型1910年,英国曼彻斯特大学里,卢瑟福领导下的实验室发生了一件意料不到的事,竟然无意之中促成原子模型图的成功。
事情经过是这样的:一天下午,青年助手盖革问卢瑟福,是否可以在放射性方面做点工作;同时让刚来的助手马斯登也一起参加。
卢瑟福同意并建议他们用α粒子去轰击金箔,看看穿过金箔的α粒子向什么方向飞去。
原以为这个实验纯粹是练习性的,没有多大意义。
因为当时的科学家认为原子就像一只葡萄干面包。
原子内部的负电荷电子就好像葡萄干;正电荷好像面粉一样是均匀连续分布的物质。
按照这种想法,可以预料:金原子里的电子根本无法抵挡住比它重几千倍的α粒子炮弹;金原子中的正电荷物质虽然有同α相匹敌的质量,可惜它是均匀地分散在整个原子空间,也不会有什么了不起的抵挡力。
所以,射向金箔的α粒子将继续向前飞去,最多稍微改变一下角度。
盖革和马斯登遵照老师的意见,着手准备这项练习。
整个实验装置非常简单:作为炮弹的α粒子由藏在一只铅室里的放射性元素供给,它们的轰击目标是一张极薄的金箔,在金箔的后面放了一个可以改变方位的闪烁屏,只要α粒子撞到屏上,便马上发生一次闪光。
盖革和马斯登两名炮手,躲在一架低倍显微镜后面观察着这种微弱的闪光,并记下闪光的次数和角度。
第三天,卢瑟福正在自己的办公室里看书,忽然盖革冲了进来,惊慌地报告:“我们竟然看见好几起α粒子被金箔弹回来了!”这真是难以置信的消息。
这等于告诉你用一枚重磅炮弹去轰击一张报纸,炮弹竟然被报纸弹回来了那样荒唐。
卢瑟福很快恢复了镇静,这里面一定有奥妙。
如果这两位学生没有看错的话,莫非是我们以前对原子的看法有问题?卢瑟福紧张地思考了几个星期。
他想,原子中的电子是早就被人观察到了,但是原子中连续分布的正电荷物质,却从来也没有露过脸。
原子里的正电荷难道不是均匀分布,而是集中在一个很小的核心上?因为只有集中了原子质量90%以上的正电核心,才可能有足够的力量来抵挡那些凑巧撞在上面的α粒子,并把它们弹回去。
卢瑟福原子结构模型波尔原子结构模型26页文档

1、最灵繁的人也看不见自己的背脊。——非洲 2、最困难的事情就是认识自己。——希腊 3、有勇气承担命运这才是英雄好汉。——黑塞 4、与肝胆人共事,无字句处读书。——周恩来 5、阅读使人充实,会谈使人构模型
11、获得的成功越大,就越令人高兴 。野心 是使人 勤奋的 原因, 节制使 人枯萎 。 12、不问收获,只问耕耘。如同种树 ,先有 根茎, 再有枝 叶,尔 后花实 ,好好 劳动, 不要想 太多, 那样只 会使人 胆孝懒 惰,因 为不实 践,甚 至不接 触社会 ,难道 你是野 人。(名 言网) 13、不怕,不悔(虽然只有四个字,但 常看常 新。 14、我在心里默默地为每一个人祝福 。我爱 自己, 我用清 洁与节 制来珍 惜我的 身体, 我用智 慧和知 识充实 我的头 脑。 15、这世上的一切都借希望而完成。 农夫不 会播下 一粒玉 米,如 果他不 曾希望 它长成 种籽; 单身汉 不会娶 妻,如 果他不 曾希望 有小孩 ;商人 或手艺 人不会 工作, 如果他 不曾希 望因此 而有收 益。-- 马钉路 德。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
224卢瑟福“画”的原子模型
1910年,英国曼彻斯特大学里,卢瑟福领导下的实验室发生了一件意料不到的事,竟然无意之中促成原子模型图的成功。
事情经过是这样的:
一天下午,青年助手盖革问卢瑟福,是否可以在放射性方面做点工作;同时让刚来的助手马斯登也一起参加。
卢瑟福同意并建议他们用α粒子去轰击金箔,看看穿过金箔的α粒子向什么方向飞去。
原以为这个实验纯粹是练习性的,没有多大意义。
因为当时的科学家认为原子就像一只葡萄干面包。
原子内部的负电荷电子就好像葡萄干;正电荷好像面粉一样是均匀连续分布的物质。
按照这种想法,可以预料:金原子里的电子根本无法抵挡住比它重几千倍的α粒子炮弹;金原子中的正电荷物质虽然有同α相匹敌的质量,可惜它是均匀地分散在整个原子空间,也不会有什么了不起的抵挡力。
所以,射向金箔的α粒子将继续向前飞去,最多稍微改变一下角度。
盖革和马斯登遵照老师的意见,着手准备这项练习。
整个实验装置非常简单:作为炮弹的α粒子由藏在一只铅室里的放射性元素供给,它们的轰击目标是一张极薄的金箔,在金箔的后面放了一个可以改变方位的闪烁屏,只要α粒子撞到屏上,便马上发生一次闪光。
盖革和马斯登两名炮手,躲在一架低倍显微镜后面观察着这种微弱的闪光,并记下闪光的次数和角度。
第三天,卢瑟福正在自己的办公室里看书,忽然盖革冲了进来,惊慌地报告:“我们竟然看见好几起α粒子被金箔弹回来了!”这真是难以置信的消息。
这等于告诉你用一枚重磅炮弹去轰击一张报纸,炮弹竟然被报纸弹回来了那样荒唐。
卢瑟福很快恢复了镇静,这里面一定有奥妙。
如果这两位学生没有看错的话,莫非是我们以前对原子的看法有问题?卢瑟福紧张地思考了几个星期。
他想,原子中的电子是早就被人观察到了,但是原子中连续分布的正电荷物质,却从来也没有露过脸。
原子里的正电荷难道不是均匀分布,而是集中在一个很小的核心上?因为只有集中了原子质量90%以上的正电核心,才可能有足够的力量来抵挡那些凑巧撞在上面的α粒子,并把它们弹回去。
按照这个想法,卢瑟福计算了α粒子穿过原子后面各个方向飞出去的次数,计算结果同盖革、马斯登的测量结果完全一致。
在1911年2月,卢瑟福写了题为《α和β粒子物质散射效应和原子结构》的论文,正式提出了被后人称为卢瑟福的原子模型。
虽然,这个模型以后又被进一步的研究所改进,但是卢瑟福模型的提出开创了原子物理的新纪元,所以今天人们常常用这个模型的图案作为近代物理学的一个标志。
