化工实验--实验热重-差热分析联用法研究CuSO4·5H2O的脱水过程
差热分析实验报告

差热分析实验报告一、引言差热分析(DTA)是在程序控制温度下测量物质和参比物之间的温度差与温度(或时间)关系的一种技术。
描述这种关系的曲线称为差热曲线或DTA曲线。
描述这种关系的曲线称为差热曲线或DTA曲线。
由于试样和参比物之间的温度差主要取决于试样的温度变化,因此就其本质来说,差热分析是一种主要与焓变测定有关并籍此了解物质有关性质的技术。
二、实验目的1、了解差热分析的基本原理和实验基本步骤。
2、测量五水硫酸铜和锡的差热曲线,并简单计算曲线峰的面积。
三、实验原理物质在加热或冷却过程中会发生物理变化或化学变化,与此同时,往往还伴随吸热或放热现象。
伴随热效应的变化,有晶型转变、沸腾、升华、蒸发、熔融等物理变化,以及氧化还原、分解、脱水和离解等化学变化。
另有一些物理变化,虽无热效应发生但比热容等某些物理性质也会发生改变,这类变化如玻璃化转变等。
物质发生焓变时质量不一定改变,但温度是必定会变化的。
差热分析正是在物质这类性质基础上建立的一种技术。
若将在实验温区内呈热稳定的已知物质(参比物)和试样一起放入加热系统中(图1),并以线性程序温度对它们加热。
在试样没有发生吸热或放热变化且与程序温度间不存在温度滞后时,试样和参比物的温度与线性程序温度是一致的。
若试样发生放热变化,由于热量不可能从试样瞬间导出,于是试样温度偏离线性升温线,且向高温方向移动。
反之,在试样发生吸热变化时,由于试样不可能从环境瞬间吸取足够的热量,从而使试样温度低于程序温度。
只有经历一个传热过程试样才能回复到与程序温度相同的温度。
图1加热和测定试样与参比物温度的装置示意图在试样和参比物的比热容、导热系数和质量等相同的理想情况,用图1装置测得的试样和参比物的温度及它们之间的温度差随时间的变化如图2所示。
图中参比物的温度始终与程序温度一致,试样温度则随吸热和放热过程的发生而偏离程序温度线。
当T S-T R=ΔT为零时,因中参比物与试样温度一致,两温度线重合,在ΔT曲线则为一条水平基线。
TG-实验三 热重法测定CuSO4

实验CuSO4·5H2O的热重分析演示实验一、实验目的1.熟悉热重分析的基本原理2.掌握热重分析的实验方法和数据处理方法3.了解CuSO4.5H2O 的脱水机理。
二、基本原理1.热重法原理:热重法(thermogravimetry,简称TG) 是研究在温度程序控制下,物质的质量与温度之间关系的一种方法。
只要物质在加热过程中有质量变化,如含水化合物的失水、无机和有机化合物的热分解、固体和液体物质的升华或蒸发等,就有可能运用热重法进行测定。
通常是将试样以恒定的升温速度加热时,连续测量试样的质量,所得质量m与温度T 的关系图称为热重曲线(TG 曲线)。
图1 某含结晶水物质的TG曲线图1 为某含结晶水物质的TG 曲线。
若在此温度范围内只发生失水反应,则曲线中质量保持基本不变的部分ab、cd、ef,分别代表试样、第一步及第二步失水产物稳定存在的温度区间。
若样品在某一温度开始失重,则在TG 曲线上出现下降的转折,失水率越大,转折线越陡,例如bc、de、fg 部分。
由图可知:第一步(1)第二步(2)依此类推。
用各步失水率与各种可能失水的理论失水率进行比较,即可写出各步失水方程式。
升温速度对热重分析影响很大。
如分解反应的起始温度和终止温度都随着升温速度的增加而升高。
就同一样品而言,升温速度越慢越有利于中间产物的检出。
一般选用速度为5~10 ℃/ min为宜。
2. 仪器装置进行热重分析的仪器称热天平,它既可加热样品,又可测定其质量。
热天平主要由天平测量系统、微分系统和温度控制系统组成,辅之以气氛和冷却风扇,测量结果计算机处理系统,见图2。
图.2 热天平结构示意图热重法的误差来源是多方面的,主要有支持器的空气浮力和炉内气体的对流。
前者往往表现为随温度增加,表观质量亦增加,就是所谓“浮力效应”;后者是由于炉内气体对流引起的表观增重或失重,主要取决于坩埚尺寸和形状。
为了减小这些误差,一般是在相同条件下,作热天平空载热重试验予以校正。
五水硫酸铜CuSO45H2O的脱水

利用校正软件对DSC仪进行校正
没有经过校正的金属铟熔融曲线
针对热阻进行校正后的熔融曲线
针对时间常数与热阻进行校正后的曲线
3、DSC曲线的数据处理方法
称量法: 误差 2%以内。 数格法: 误差 2%—4%。 用求积仪:误差 4%。 计算机: 误差 0.5%。
21
4、DSC法的应用
(1)纯度测定 利用Vant Hoff方程进行纯度测定。
硅酸锂玻璃DTA曲线
12
DTA分析在高分子材料方面的应用
物性测定
可用DTA和DSC技术测定 的高聚物的物性有:玻璃 化转变温度、熔融温度、 结晶转变温度、结晶度, 结晶速率、添加剂含量、 热化学数据(如比热容、熔 化热、分解热、蒸发热、 结晶热、溶解热、吸附与 解吸热、反应热等)以及分
子量等。
6、DTA曲线的解析 (1)含水矿物的脱水
——普通吸附水脱水温度:100-110℃ 。 ——层间结合水或胶体水:400 ℃内,大多数200或300 ℃内。 ——架状结构水:400 ℃左右。 ——结晶水:500 ℃内,分阶段脱水。 ——结构水:450 ℃以上。
五水硫酸铜(CuSO4.5H2O)的脱水
说明: 1、脱去4个结晶水 2、脱去1个结晶水 3-4、 CuSO4→CuO+SO3 样品用量: 虚线:78mg 实线:742mg
热通量式差示扫描量热法
——利用热电堆精确测量试样和参比物温度,灵敏度 和精确度高,用于精密热量测定。
16
功率补偿型 DSC的优点
Sample
Platinum Alloy PRT Sensor
Platinum Resistance Heater
Heat Sink
Reference
cuso4.5h2o
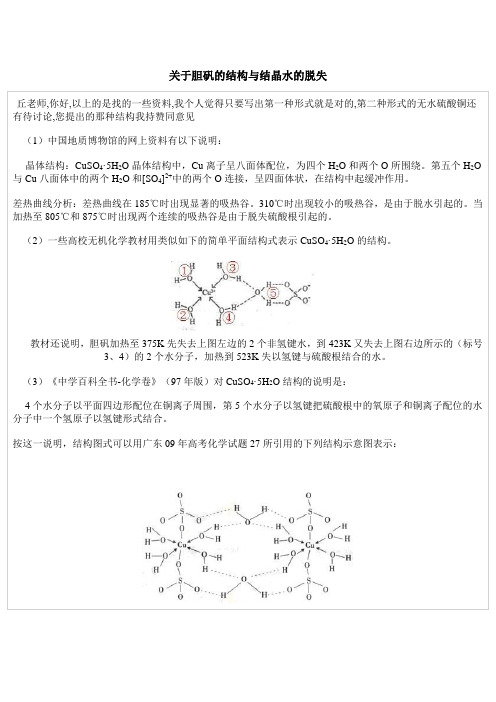
关于胆矾的结构与结晶水的脱失
丘老师,你好,以上的是找的一些资料,我个人觉得只要写出第一种形式就是对的,第二种形式的无水硫酸铜还有待讨论,您提出的那种结构我持赞同意见
(1)中国地质博物馆的网上资料有以下说明:
晶体结构:CuSO4·5H2O晶体结构中,Cu离子呈八面体配位,为四个H2O和两个O所围绕。
第五个H2O 与Cu八面体中的两个H2O和[SO4]2+中的两个O连接,呈四面体状,在结构中起缓冲作用。
差热曲线分析:差热曲线在185℃时出现显著的吸热谷。
310℃时出现较小的吸热谷,是由于脱水引起的。
当加热至805℃和875℃时出现两个连续的吸热谷是由于脱失硫酸根引起的。
(2)一些高校无机化学教材用类似如下的简单平面结构式表示CuSO4·5H2O的结构。
教材还说明,胆矾加热至375K先失去上图左边的2个非氢键水,到423K又失去上图右边所示的(标号
3、4)的2个水分子,加热到523K失以氢键与硫酸根结合的水。
(3)《中学百科全书-化学卷》(97年版)对CuSO4·5H2O结构的说明是:
4个水分子以平面四边形配位在铜离子周围,第5个水分子以氢键把硫酸根中的氧原子和铜离子配位的水分子中一个氢原子以氢键形式结合。
按这一说明,结构图式可以用广东09年高考化学试题27所引用的下列结构示意图表示:。
热分析教案邱金恒物理化学实验教案

白云石分解-气氛的影响
白云石分解为氧化镁和氧化钙的过程分为两个步骤。第一步为碳酸镁分解,第二步为碳酸 钙分解。在氮气气氛下两步分辨得不明显。但是在二氧化碳气氛下两步分解明显分开。其 原因在于,二氧化碳的存在延迟了分解反应,而且对第二步反应的影响尤其显著
非晶态金属
高温DSC仪器可用于检测非晶态金属的 玻璃化转变以及后续的一系列相变。
(2) 阶梯高度 代表经历一个物理或化学过程重量 变化的多少,由它可以计算中间产物或最终产 物的量以及结晶水分子数或水含量等,故阶梯 高度是进行定量计算的基础。
(3) 阶梯斜度 对于同一过程,它与实验条件有关; 而对于相同的实验条件,它取决于变化过程。 阶梯斜度越大,说明对应过程的变化速率越快,
反之,则慢。由于阶梯斜度与反应速率有关, 由此可以求得动力学参数。
熔点与熔融热焓(DSC)
根据熔点,可以对结晶高分子进行大致的定性鉴别。 根据熔点,可以判断体系是无规共聚物还是共混物,以及共混的程度。 根据熔融峰面积,可以计算部分结晶样品的结晶度。 结晶性聚合物共混组成的测定(DSC) 图中对HDPE/PP 共混物的熔融过程进行了测定,可以清楚地看到熔融过程分为两
换句话说,试样在物理变化或化学反应时产生 的热量变化,由于及时输入电功率得到补偿。 所以实际记录的是试样和参比物下面两只加热 器电热补偿的热功率之差随时间t的变化。在程 控线性升温中,也即热功率之差随时间t(或温 度T)的变化,其积分峰面积对应的即为热效应 。 若事先用已知相变热的试样(如纯金属锡、铅、 铟等)的熔化来标定仪器常数,则峰面积就可 以得到 ΔH的绝对值。
1)热重法(TG,Thermogravimetry)
在热重法中,被测物理量即为试样受热反应而 产生的质量变化。许多物质在加热过程中若发 生如熔化、蒸发、升华、吸附等物理变化,或 是脱水、解离、氧化、还原等化学变化,即引 起质量改变。在程序控温的情况下,温度T与 时间t成线性关系。以质量对时间t或温度T作图, 得热重曲线(TG曲线)。TG曲线所提供的信 息主要有:物理或化学过程对应的质量变化以 及温度区间。热重法使用的基本仪器为热天平, 一般包括天平、加热炉、控温系统、记录系统 等几个部分。有的热天平还配有通入气氛或真 空装置。
CuSO4热重分析讲义

CuSO4·5H2O的热重分析一、实验目的1、学习热重分析仪的使用操作,了解热重分析仪的构造。
2、用热重分析仪对CuSO4·5H2O进行热重分析。
3、掌握热重分析仪的基本原理和分析方法。
二、热重分析仪工作原理热重法是在程序温度(升/降/恒温及其组合)过程中,由天平连续测量样品质量随温度(或时间)的变化并将数据传递到计算机中对质量/温度(或时间)进行作图,得到热重曲线。
TG曲线的纵坐标为质量,横坐标为温度(或时间)。
从热重曲线可得到试样组成、热稳定性、热分解温度、热分解产物和热分解动力学等有关数据。
三、影响热重分析的因素1、试样量和试样皿热重法测定,试样量要少,一般2~5mg。
应控制在10mg以内。
试样皿的材质,要求耐高温,对试样、中间产物、最终产物和气氛都是惰性的,即不能有反应活性和催化活性。
通常用的试样皿有铂金的、陶瓷、石英、玻璃、铝等。
2、升温速率升温速度越快,温度滞后越严重,使曲线的分辨力下降,会丢失某些中间产物的信息。
3、气氛的影响热天平周围气氛的改变对TG曲线影响显著,应在惰性气氛中进行。
一般选择氮气。
4、挥发物的冷凝分解产物从样品中挥发出来,往往会在低温处再冷凝,如果冷凝在试样皿上会造成测得失重结果偏低,而当温度进一步升高,冷凝物再次挥发会产生假失重,使TG 曲线变形。
解决的办法,一般采用加大气体的流速,使挥发物立即离开试样皿。
5、浮力浮力变化是由于升温使样品周围的气体热膨胀从而相对密度下降,浮力减小,使样品表观增重。
实用校正方法是做空白试验,(空载热重实验),消除表观增重。
四、TG失重曲线的处理和计算1、TG曲线关键温度表示法(1)典型热重图谱示例TG起始点:热稳定性的表征DTG 峰温:质量变化速率最大的温度点DTG的作用(2)CuSO4·5H2O的热重曲线分析:CuSO4·5H2O热重失水过程第一步:CuSO4·5H2O→CuSO4·3H2O + 2H20第二步:CuSO4·3H2O→CuSO4·H2O + 2H20第三步:CuSO4·H2O→CuSO4 + H20T1→T2:第一步失重为W0-W1,在T2形成稳定相CuSO4·3H2O, 其失重百分数为:T2→T3,在T3生成CuSO4·H2OT3→T4,在T4 CuSO4生成。
差热与热重分析研究五水硫酸铜的脱水过程与差示扫描量热法

差热与热重分析研究五水硫酸铜的脱水过程与差示扫描量热法差热与热重分析研究CuSO4•5H20的脱水过程与差示扫描量热法一.实验目的(1)掌握差热分析法和热重法的基本原理和分析方法,了解差热分析仪,热重分析仪,差热热重联用仪的基本结构,熟练掌握仪器操作。
(2)运用分析软件对测得数据进行分析,研究CuSO4•5H20的脱水过程。
(3)了解差示扫描量热法的基本原理和差示扫描量热仪的基本结构,熟练掌握仪器操作。
二.实验原理1.差热分析法物质在受热或冷却过程中,当达到某一温度时,往往回发生熔化、凝固、晶型转变、分解、化合、吸附、脱附等物理或化学变化,并伴随着焓的改变,因而产生热效应,其表现为体系与环境(样品与参比物)之间有温度差。
差热分析是在程序控温下测量样品和参比物的温度差与温度(或时间)相互关系。
在加热(或冷却)过程中,因物理-化学变化而产生吸热或者放热效应的物质,均可运用差热分析法进行鉴定。
2.热重法物质受热时,发生化学反应,质量也随之改变,测定物质质量的变化就可研究其过程。
热重法(TG)是在程序控制温度下,测量物质质量与温度关系的一种技术。
热重法的主要特点是定量强,能准确地测量物质的变化及变化的速率。
从热重法派生出微商热重法(DTG),即TG 曲线对温度(或时间)的一阶导数。
DTG曲线能精确地反映出起始反应温度,达到最大反应速率的温度和反应终止温度。
在TG曲线上,对应于整个变化过程中各阶段的变化互相衔接而不易分开,同样的变化过程在DTG曲线上能呈现出明显的最大值,故DTG能很好地显示出重叠反应,区分各个反应阶段,而且DTG曲线峰的面积精确地对应着变化了的质量,因而DTG能精确地进行定量分析。
现在发展起来的差热-热重(DTA-TG)联用仪,是将DTA与TG的样品室相连,在同样气氛中,控制同样的升温速率进行测试,同时得到DTA和TG曲线,从而一次测试得到更多的信息,对照进行研究。
3.差示扫描量热法差示扫描量热法(简称DSC)是在程序升温的条件下,测量试样与参比物之间的能量差随温度变化的一种分析方法。
差热-热重分析法测定硫酸铜的热分析图谱实验报告

差热-热重分析法测定硫酸铜的热分析图谱一、实验目的1.了解差热分析法、热重分析法的基本原理。
2.了解差热热重同步热分析仪的基本构造并掌握使用方法。
3.正确控制实验条件,并学会对热分析谱图进行定性分析和定量处理。
二、实验原理1.差热分析法(Differential Thermal Analysis,DTA)差热分析是在程序控制温度下,测量试样与参比物(一种在测量温度范围内不发生任何热效应的物质)之间的温度差与温度关系的一种技术。
许多物质在加热或冷却过程中会发生熔化、凝固、晶型转变、吸附、脱附等物理转变及分解、化合、氧化还原等化学反应。
这些变化在微观上必将伴随体系焓的改变,从而产生热效应,在宏观上表现为该物质与外界环境之间有温度差。
选择一种对热稳定的物质作为参比物,将其与试样一起置于可按设定速率升温的热分析仪中,分别记录参比物的温度以及试样与参比物间的温度差。
以温差对温度作图就可以得到差热分析曲线,简称DTA曲线。
2. 热重法(Thermogravimetry,TG)热重法是在程序控制温度下,测量物质的质量变化与温度关系的一种技术,其基本原理是热天平。
热天平分为零位法和变位法两种。
变位法,就是根据天平梁的倾斜度与质量变化呈比例的关系,用差动变压器等检知倾斜度,并自动记录。
零位法,是采用差动变压器法、光学法或电触点法测定天平梁的倾斜度,并用螺线管线圈对安装在天平系统中的永久磁铁施加力,使天平梁的倾斜复原。
由于对永久磁铁所施加的力与质量变化呈比例,这个力又与流过螺线管的电流呈比例,因此只要测量并记录电流,便可得到质量变化的曲线,以质量对温度作图就可以得到热重曲线,简称TG曲线。
三、实验用品1.仪器日本SHIMADZU DTG-60差热-热重同步热分析仪(TA-60工作站),镊子,坩埚,研钵。
2.药品参比物:α-AL2O3(A.R,原装进口)试样:CuSO4·5H2O(A.R)四、操作步骤1、熟悉差热-热重同步热分析仪的组成及相应旋钮的作用。
差热分析

差热分析法研究五水硫酸铜的脱水过程一、实验目的1、熟悉热重和差热分析法的基本原理; 2、根据热重、差热图谱,对样品进行热重、差热分析,并给予定性解释; 3、掌握 HCT-1 型综合热分析仪的结构与操作特点; 4、了解五水硫酸铜的热谱特性和脱水机理。
二、方法原理热分析是一种非常重要的分析方法,它是在程序控制温度下,测量物质的物理性质与 温度关系的一种技术。
热分析主要用于研究物理变化(晶型转变、 熔融、 升华和吸附等)和化学变化(脱水、 分解、 氧化和还原等)。
热分析不仅提供热力学参数,而且还可给出有一定参考价值的动力学数据。
热分析在固态科学的研究中被大量而广泛地采用, 诸如研究固相反应, 热分解和相变以及测 定相图等。
许多固体材料都有这样或那样的“热活性”, 因此热分析是一种很重要的研究手段。
本实验用 HCT-1 型综合热分析仪来研究 CuSO4.5H2O 的脱水过程。
1、热重法(TG) 热重法(Thermogravimetry, TG)是在程序控温下, 测量物质的质量与温度或时间的关系的 方法,通常是测量试样的质量变化与温度的关系。
(1) 热重曲线 由热重法记录的重量变化对温度的关系曲线称热重曲线(TG 曲线)。
曲线的纵坐标为质 量,横坐标为温度(或时间)。
例如固体的热分解反应为: A(固)→B(固)+C(气) 其热重曲线如图 4.2.27-1 所示。
图中 Ti 为起始温度,即试样质量变化或标准物质表观质量变化的起始温度;Tf 为终止 温度,即试样质量或标准物质的质量不再变化的温度;Tf - Ti 为反应区间,即起始温度与终 止温度的温度间隔。
TG 曲线上质量基本不变动的部分称为平台,如图 4.2.27-1 中的 ab 和 cd。
从热重曲线可得到试样组成、热稳定性、热分解温度、热分解产物和热分解动力学等有 关数据。
同时还可获得试样质量变化率与温度或时间的关系曲线,即微商热重曲线。
m/g a A(固) bcB(固) doTiTfT/℃图 4.2.27-1固体热分解反应的典型热重曲线当温度升至 Ti 才产生失重。
五水硫酸铜脱水过程的三个反应热

五水硫酸铜脱水过程的三个反应热示例文章篇一:《五水硫酸铜脱水过程的三个反应热》嘿,你知道五水硫酸铜吗?那可是一种超级有趣的东西呢。
五水硫酸铜就像是一个小小的魔法晶体,它里面藏着好多的奥秘。
今天呀,咱们就来好好聊聊五水硫酸铜脱水过程中的三个反应热。
我先给你讲讲五水硫酸铜长啥样吧。
它是蓝色的晶体,看起来就像蓝色的宝石一样漂亮。
在我们的化学世界里,它可有着很重要的地位呢。
当五水硫酸铜开始脱水的时候,就像是一个人在慢慢脱掉自己的外套一样。
第一个反应热出现啦。
这个时候,五水硫酸铜脱掉了一部分水,这个过程是有能量变化的。
就好比你从一个很暖和的屋子里走到稍微有点冷的地方,你会感觉到一种变化。
这个反应热的数值呢,是可以通过实验测出来的。
我们可以用一种专门的仪器,就像温度计一样能测量热量变化的仪器。
我问你哦,如果没有这个仪器,你说我们怎么能知道反应热是多少呢?是不是就像在黑暗里找东西,没有灯就很难找到呀。
接着呢,五水硫酸铜又要进行下一个脱水的步骤了。
这就像是它又脱掉了一件衣服。
第二个反应热也跟着出现了。
这个反应热和第一个反应热可能不一样哦。
你看,五水硫酸铜在不同的脱水阶段,就像一个人在不同的季节换不同的衣服,能量的变化也不一样。
这时候的反应热,会让我们看到五水硫酸铜变得更加“简单”了,它里面的水越来越少。
我在想啊,如果五水硫酸铜是一个小生物的话,它每一次脱水是不是就像在成长过程中的一次蜕变呢?然后呀,就到了第三个脱水阶段啦。
这时候的五水硫酸铜就像是已经把最外面的几层衣服都脱掉了,只剩下最核心的部分。
第三个反应热也随之而来。
这个反应热也是很独特的。
这三个反应热就像是三个小伙伴,虽然都和五水硫酸铜的脱水有关,但是它们各自有着自己的特点。
我的好朋友小明,他也对这个很感兴趣呢。
有一次我们在实验室里,看着五水硫酸铜的脱水过程,他就说:“哎呀,这个反应热好神奇啊,就像有魔法一样。
”我就笑着回答他:“是呀,化学世界里到处都是这样的魔法呢。
差热-热重分析法测定硫酸铜的热分析图谱实验报告

差热—热重分析法测定硫酸铜的热分析图谱一、实验目的1.了解差热分析法、热重分析法的基本原理。
2.了解差热热重同步热分析仪的基本构造并掌握使用方法。
3.正确控制实验条件,并学会对热分析谱图进行定性分析和定量处理.二、实验原理1.差热分析法(Differential Thermal Analysis,DTA)差热分析是在程序控制温度下,测量试样与参比物(一种在测量温度范围内不发生任何热效应的物质)之间的温度差与温度关系的一种技术。
许多物质在加热或冷却过程中会发生熔化、凝固、晶型转变、吸附、脱附等物理转变及分解、化合、氧化还原等化学反应。
这些变化在微观上必将伴随体系焓的改变,从而产生热效应,在宏观上表现为该物质与外界环境之间有温度差.选择一种对热稳定的物质作为参比物,将其与试样一起置于可按设定速率升温的热分析仪中,分别记录参比物的温度以及试样与参比物间的温度差。
以温差对温度作图就可以得到差热分析曲线,简称DTA曲线.2。
热重法(Thermogravimetry,TG)热重法是在程序控制温度下,测量物质的质量变化与温度关系的一种技术,其基本原理是热天平.热天平分为零位法和变位法两种。
变位法,就是根据天平梁的倾斜度与质量变化呈比例的关系,用差动变压器等检知倾斜度,并自动记录。
零位法,是采用差动变压器法、光学法或电触点法测定天平梁的倾斜度,并用螺线管线圈对安装在天平系统中的永久磁铁施加力,使天平梁的倾斜复原。
由于对永久磁铁所施加的力与质量变化呈比例,这个力又与流过螺线管的电流呈比例,因此只要测量并记录电流,便可得到质量变化的曲线,以质量对温度作图就可以得到热重曲线,简称TG曲线。
三、实验用品1.仪器日本SHIMADZU DTG—60差热—热重同步热分析仪(TA-60工作站),镊子,坩埚,研钵.2.药品参比物:α—AL2O3(A。
R,原装进口)试样:CuSO4·5H2O(A。
R)四、操作步骤1、熟悉差热—热重同步热分析仪的组成及相应旋钮的作用.2、开启主机电源,整机预热30min。
仪器分析实验 差热与热重分析研究CuSO4

差热与热重分析研究 CuSO4·5H2O 的脱水过程
2015 年 5 月 19 日
差热与热重分析研究 CuSO4•5H2O 的脱水过程
开课实验室:环境资源楼 313
【实验目的】
1、 掌握差热分析法和热重法的基本原理和分析方法:了解差热分析仪、热重分析仪、差热热重联用仪的基本 结构,熟练掌握仪器操作; 2、 用差热—热重联用仪对 CuSO4·5H2O 进行差热及热重分析; 3、 运用分析软件对测得数据进行分析,研究 CuSO4·5H20 的脱水过程。
(1)CuSO4·5H2O:样品质量:8.421mg;M CuSO4·5H2O=249.68g/mol 峰号 Onset 起始温度 Mid 峰顶温度 Endset 结束温度
表1
1 72.66℃ 83.02℃ 90.47℃
2 104.19℃ 109.96℃ 116.85℃
3 213.85℃ 231.36℃ 245.32℃
【仪器与试剂】 1、 仪器: 日本岛津公司 DTA-50 差热分析仪; TGA-50 热重分析仪; DTG60H 差热-热重联用仪; FC60A 气体流量控制器; TA-60WS 工作站;电子天平等。 2、试剂:待测样品 CuSO4⋅5H2O;参比物 Al2O3;金属铟。 【实验步骤】 1、 差热分析(DTA) : (1) 通水通气:接通冷却水,开启水源使水流畅通,保持冷却水流量 300ml/min 以上,根据需要在通气口 通入保护气体,将气瓶出口压力调节到 0.59 到 0.98Mpa;
1
仪器分析实验
差热与热重分析研究 CuSO4·5H2O 的脱水过程
2015 年 5 月 19 日
(2) 开机:打开专用变压器开关、DTA -50 开关、TA-60WS 工作站开关,同时开启计算机开关; (3) 调节气体流量:将仪器左侧流量控制钮旋至 25ml/min 至 50ml/min; (4) 称量及放样:用电子天平称 10mg 样品后放入坩埚内,在另一只坩埚内放入适量参比物(大致比例为 1: 1) ,将两只坩埚轻轻敲打颠实,按 DTA-50 控制面板键,炉子升起,将试样坩埚放在检测支持器 右皿,将参比物坩埚放在左皿,按键放下炉子; (5) 参数设定:进入 TA-60WS Collect 界面,点击 DTA-50-Measure,输入升温速率,终止温度;进入 PID Parameters, 确定 P: 10; I: 10; D: 10; 进入 Sampling Parameters - Sampling time: 10; 进入 File Information, 依次输入测量序号、样品名称、气氛、气体流速等。检查计算机输入的参数,单击“确认”; (6) 测量:回到 Measure,点击 Sart,测量开始。当试样达到预设的终止温度时,测量自动停止; (7) 关机:等炉温降下来再依次关 TA-60WS 工作站开关,DTA -50 开关,专用变压器开关,关冷却水, 关气瓶(为保护仪器,注意炉温在 500C 以上不得关闭 DTA-50 主机电源) ; (8) 数据分析: 进入分析界面 Analysis, 打开所做测量文件, 由所测样品的 DTA 曲线, 选择项目进行分析, 如切线 Tangent 求反应外推起始点,求峰值、峰高、峰面积。最后存盘、打印差热曲线图。 2、 热重分析(TG) : (1) 通气:根据实验需要在通气口通入保护气体,将气瓶出口压力调节到 0.59 到 0.98Mpa; (2) 开机:依次打开专用变压器开关,TGA-50 开关,工作站开关,同时开启计算机及打印机开关; (3) 调节气体流量:将仪器左侧流量控制钮旋至 25ml/min 至 50ml/min; (4) 天平调零 按 TGA-50 控制面板键,炉子下降,将样品托板拨至炉子瓷体端口; (5) 放样:按 down 键,炉子下降,移过样品托板,小心取出坩埚,装入约占坩埚 1/3-1/2 高度的样品,轻轻 敲打坩埚使样品均匀,然后将坩埚放入样品吊篮内,移开样品托板,升起炉子; (6) 测量:进入 TA-60WS COLLECT-TGA-50-Measure,进行实验参数设定,输入升温速率,终止温度等; 进入 PID Parameters,确定 P:10;I:10;D:10;进入 Sampling Parameters,确定 Sampling 炉内开始加热升温,记录开始。当试样达到预设的终止温度时,测量自动停止; (7) 关机:等炉温降下来再依次关 TA-60WS 工作站开关,TGA -50 开关,专用变压器开关,关气瓶; (8) 数据分析:进入分析界面(Analysis) ,打开所做测量文件,对原始热重记录曲线进行适当处理,先对 其求导,得到 DTG 曲线;选定每个台阶或峰的起止位置,算出各个反应阶段的 TG 失重百分比,失 重始温,终温,失重速率最大点温度。最后数据存盘,打印热重曲线图。 3、 差热-热重联用(DTA-TG) : (1) 开机:打开 DTG-60 主机、计算机、TA-60WS 工作站以及 FC-60A 气体控制器; (2) 接好气体管路。 DTG-60 主机后面有 3 个气体入口。测定样品用 “GAS1”入口,通常使用 N2、 He 或 Ar 等惰性气体, 流量控制在 30-50mL/min; 分析样品中用到反应气的情况, 使用“GAS2 (reaction) ” 入口通入气体,通常使用 O2,流量最大 100mL/min;气体吹扫清理样品腔时使用“cleaning”窗口,通 常使用 N、空气,流量控制在 200-300mL/min; (3) 按 DTG-60AH 主机前面板的“OPEN/ CLOSE”键, 炉盖缓缓升起。 把空白坩埚放置于左边参比样品盘, 把空的样品坩埚放置于右边样品盘中,按“OPEN/ CLOSE”键降下炉盖; (4) TG 基线稳定后,按前面板的“DISPLAY”键,前面板屏幕显示重量值,按“ZERO”键,重量值归零, 显示“0.000mg”。如果归零后,读数跳动,可以多按几次“ZERO”键,直到读数为零,或者上下漂移很 小。备注:通过面板上的“DISPLAY”键,可以使显示在温度、电压、质量之间切换; (5) 按“OPEN/ CLOSE”键,升起炉盖,用镊子把右边样品盘上的坩锅取下,装上适量的样品,重新放到右 边的样品盘上。样品质量一般为 3-5mg,请保证样品平铺于坩埚底部,与坩埚接触良好; (6) 按“OPEN/ CLOSE”键,降下炉盖。当屏幕显示 TG 稳定后,内置天平自动精确称出样品重量; (7) 设定测定参数: TA-60WS Collection Monitor-TA-60WS Acquisition-Detector 窗口中选择 DTG-60AHMeasure-Measuring Parameters, 在“Temperature Program”一项中编辑起始温度以及温度程序。 Sampling Parameters-Sampling Time 设定为 1s(标准品校正时设定为 0.1s) 。 在“File Information”窗口中输入 样品样品名称、重量、坩埚材料,使用气体种类、气体流速、操作者等信息。点击“确定”关闭窗口; 2 Time: 10;进入 File Information,依次输入测量序号,样品名称等,回到 Measure,点击 Sart,测量开始,
热分析法研究CuSO4·5H2O结构

第!"卷第#期宁夏大学学报!自然科学版"$"%&年&月!'()*!"+(*#,(-./0)(1+2/34205/267.829:!+09-.0);<27/<7=>292(/";7?@$"%&!文章编号#"$A #B $#$C !$"%&""#B "$D D B "!热分析法研究I E K S -.2R 'S 结构齐之锴$!李!鹏$!房俊卓+!宁夏大学省部共建煤炭高效利用与绿色化工国家重点实验室$宁夏银川!D A ""$%"摘!要#利用热分析法![Z -H ;a "研究五水硫酸铜!a -;J !.A`$J "的热分解过程$并对其脱水机理及硫酸铜!a -;J !"在高温下分解机理进行探索*研究表明$在升温速率为%v -O 2/时$a -;J !.A `$J 的脱水过程为$在D A v 失去$个结晶水$在%""v 又失去$个结晶水$在$%A v 失去最后%个结晶水*a -;J !分解为$a -;J !在D ""v 分解生成氧化铜!a -J "和三氧化硫!;J #"$理论失重率为#$*"k $实际失重率为#%*"k %a -J 在C %"v 进一步分解生成氧化亚铜!a -$J "和氧气!J $"$理论失重率为#*$k $实际失重率为#*$k $理论计算与实际测量值基本吻合*用_B 射线衍射仪!_P H "及扫描电子显微镜!;=U "对a -;J !.A `$J 分解产物进行分析$表征结果与热分析结果相一致$进一步验证了热分析方法的可靠性*关键词#热分析%五水硫酸铜%结晶水%分解分类号#!中图"JE !%*!文献标志码#K收稿日期#$"%&B "#B %$基金项目#宁夏3化学工程与技术4国内一流学科建设基金资助项目!a =[B ,_B $"%D V "E"作者简介#齐之锴!%&C C &"$男$助理实验师$主要从事大型仪器管理与教学工作*+通信联系人#房俊卓!%&E D &"$男$教授$主要从事分析测试技术教学与研究工作$!电子信箱"1L5M N -(!%E #*<(O*!!五水硫酸铜!a -;J !.A `$J "是重要的无机盐$俗称蓝矾+胆矾或铜矾$广泛应用在化学工业+农药及医药等领域*a -;J !.A `$J 的应用特性主要取决于其结构特征$尤其是结晶水的结合状态'%&$(*通常对a -;J !.A `$J 的研究偏重于利用单一的仪器分析方法如热重法![Z "或_B 射线衍射法!_P H "$由于这些方法得出的结论比较片面$不能全面反映a -;J !.A `$J 的失水过程中各中间体的结构+形貌$得出的结论往往不能反映其结构全貌'#&!(*笔者通过热分析技术![Z -H ;a "$分析a -;J !.A `$J 晶体的失水过程$并进一步分析a -;J !的分解过程*同时$借助_B 射线衍射仪!_P H "和扫描电子显微镜!;=U "对a -;J !.A `$J 及其热分解中各产物的结构及形貌进行全面表征$从而揭示a -;J !.A `$J 热分解的机理$最终实现解析其结构的目的*%!实验&*&!仪器H CK H 'K +a =K $A_B射线衍射仪!德国布鲁克公司"%;=[K P KU ;=[;R ;%E 多模块综合热分析仪!法国塞塔拉姆仪器公司"%='"%C 扫描电子显微镜!德国卡尔蔡司公司"*&*'!材料a -;J !.A `$J !X X $K P "为国药集团化学试剂有限公司产品*&*(!实验方法%"热分析![Z -H ;a "实验*取五水硫酸铜!a -;J !.A `$J "样品A O 3在;=[K P KU 同步热分析仪上进行测试$载气为高纯氮气$保护气为高纯氩气$气体体积流量为$"O ]-O 2/$升温速率分别设定为%$A $%"$$"v -O 2/*考查a -;J !.A `$J 在不同升温速度和测试温度条件下的失水过程和热分解变化*$"_B 射线衍射!_P H "实验*将样品用玛瑙研钵研细至没有颗粒$然后装样压片$放入样品台*_B 射线源采用a -靶!8)%"$管电压为!"I '$管电流为#"O K $步长为"*"$g $扫描速度为C g -O 2/*定性分析采用,0>7E *A 分析软件*分析前先对谱图依次进行平滑+扣背底+扣除8)$等操作*#"扫描电子显微镜!;=U "实验*取少许样品用宁夏大学学报!自然科学版"第!"卷导电胶粘附于样品托上$然后将制备好的样品置于离子溅射仪中渡金膜*将处理后的样品放入样品室$在电压为%AG'+电流为%""\K+工作距离为CO O条件下观察样品的形貌*图像观察和保存依据高倍聚焦+低倍照相的原则'A(*$!结果与讨论'*&!热分析'*&*&!a-;J!.A`$J的脱水过程!用;=[K P KU同步热分析仪测定a-;J!.A`$J的脱水过程及a-;J!的分解过程*热重法![Z"测试样品在加热过程中质量随温度的变化情况$可表征失重温度和失重率%差示扫描量热法!H;a"则测试在加热过程中热流随温度的变化$可反映过程的热效应*[Z和H;a同步进行$可从质量变化和热流$个方面对分解过程进行说明*a-;J!.A`$J脱水过程的[Z及[Z-H;a曲线如图%'$所示*由图% '$可知$a-;J!.A`$J的A个结晶水分#步脱除#第%步$在D A v失去$个结晶水$理论失重率为%!*!k$实际失重率为%!*"k%第$步$在%""v又失去$个结晶水$理论失重率为%!*!k$实际失重率为%#*C k%第#步$在$%A v失去最后%个结晶水$理论失重率为D*$k$实际失重率为E*C k*由H;a曲线可知$#个吸热峰与#个失重过程相吻合$表明a-;J!.A`$J中的A个结晶水有#种结合状态'E(*图&!I E K S-.2R'S失水过程的J L曲线'*&*'!a-;J!的分解过程!a-;J!.A`$J升温至#""v后$完全失去A个结晶水后生成a-;J!*若继续升温$a-;J!继续分解$分解全过程如图#'!所示*由[Z曲线可知$a-;J!分解分$步进行#第%步$a-;J!在D""v分解生成a-J和;J#$理论失重率为#$*"k$实际失重率为#%*"k%第$步$a-J在C%"v进一步分解生成a-$J和J$$理论失重率为#*$k$实际失重率为#*$k$理论计算与实际测量值基本吻合'D(*由H;a曲线可知$第%步有$个吸热峰$表明该步分解反应并不是%次完成$而是分图'!I E K S-.2R'S失水过程的J L W!K I曲线图(!I E K S-分解过程的J L曲线图-!I E K S-分解过程的J L W!K I曲线C D $第#期齐之锴等#热分析法研究a-;J!.A`$J结构'Y'!]W射线衍射分析!],!"a-;J!.A`$J及其分解过程中的中间产物a-;J!$a-J$a-$J的_P H图谱如图A所示*由图A可知$a-;J!.A`$J与其分解产物的_P H衍射图谱截然不同$表明其晶体结构已发生转变*与标准衍射数据!\H F卡片"对照可得出结论#a-;J!. A`$J属三斜晶系!\H F.D$B$#A A"$a-;J!属正交晶系!\H F.D$B""&""$a-J属单斜晶系!\H F.D$B "E$&"$而a-$J属立方晶系!\H F.D C B$"D E"$其点阵对称性依次增大*图2!I E K S-.2R'S及其分解产物的],!谱'Y(!K?;形貌分析a-;J!.A`$J分解过程中各产物的;=U形貌如图E所示*a-;J!.A`$J为蓝色晶体$肉眼可见其完整晶形*由图E可知$a-;J!$a-J$a-$J的晶形均不完整$呈不规则状$其粒径依次减小$这是因为a-;J!.A`$J在热分解过程中它的晶体结构类型发生转变所致*图3!I E K S-.2R'S热分解各产物的K?;形貌#!结论%"通过热分析法对a-;J!.A`$J的脱水过程进行定量分析$得出其中A个结晶水脱除过程分#步#在D A v脱去$个结晶水$在%""v脱去$个结晶水$在$%A v脱去最后%个结晶水*脱水温度越高$表明结晶水与中心原子的结合力越牢固$从而推测a-;J!.A`$J及其脱水过程的中间产物结构如图D所示*由图D可知$首先脱去的是仅以配位键与中心原子结合的$个结晶水$由于它们的结合力较弱$对应脱水的温度较低%第$步脱去的$个水分子既与中心原子以配位键结合$又与另一结晶水以氢键结合%最后失去的水分子由于以!个氢键分别与J和`形成氢键$结合力最大$因此最后脱去'C&&(*0a-;J!.A`$J Qa-;J!.#`$J<a-;J!.`$J>a-;J!图4!I E K S-.2R'S脱水过程中各中间体的结构!!$"a-;J!在D""v分解生成a-J和;J#$a-J在C%"v进一步分解生成a-$J和J$*#"在a-;J!分解生成a-J和;J#的过程中$H;a曲线表现出$个吸热峰$说明其分解过程分$步进行而不是%步完成$其分解机理有待进一步探讨*参考文献#'%(!满瑞林$甘源$余嘉耕$等*五水硫酸铜的催化氧化制备',(*湖南化工$%&&C$$C!#"##%B#$*'$(!肖远泉*饲料级五水硫酸铜的生产',(*无机盐工业$%&&!!$"#$A B#"*'#(!陈动*五水硫酸铜结晶水的热失重分析',(*辽宁化&D$宁夏大学学报!自然科学版"第!"卷工$$"%!$!#!%$"#%!D $B %!D !*'!(!马玉文$赵策$高丹*硫酸铜脱水热解制备氧化铜的研究',(*无机盐工业$$"%D $!&!E "##D B #&*'A (!房俊卓$吕俊敏$罗民*扫描电子显微镜在材料测试与表征课程中的应用探索',(*实验技术与管理$$"%C $#A !$"#D E B C "*'E (!顾运琼$胡飞龙$黄志伟$等*_射线衍射和热重法分析五水硫酸铜的结构和失水过程',(*玉林师范学院学报#自然科学$$"%!$#A !$"#!!B !E *'D (!曹新鑫$胡蕾阳$攀斌斌$等*五水硫酸铜脱水机理及硫酸铜高温分解的热力学研究',(*精细与专用化学品',(*$"%%$%&!E "##"B #$*'C (!张靖阳$蔡东龙$刘豫健$等*五水硫酸铜宏观晶面数及水合硫酸铜微观结构',(*大学化学$$"%C $##!%$"#A E B E %*'&(!鲁彬$于化江$武克忠*五水硫酸铜脱水机理的热力学求算',(*河北师范大学学报#自然科学版$$""%$$A !$"#$%%B $%#*,9A 9*G B <=#I E K S -.2R 'SK /G E B /E G 9:%/<J <9G H *0;9/<=>A T /D E /U $/$L /!H #F $+$#F 1J #\E J Y +!;9097G 7:]0Q (.09(.:(1`23N B 7112<27/<:592)2M 092(/(1a (0)0/>Z .77/a N 7O 2<0)=/32/77.2/3$+2/34205/267.829:$R 2/<N -0/D A ""$%$a N 2/0"7F A /G *B /#[N 70.92<)789->27>9N 7.O 0)>7<(O (8292(/?.(<788(1<(??7.8-)1097?7/90N :>.097!a -;J !.A `$J "W 29N 9N 7.O 0)0/0):828
1四氯化三铅组成的测定思考题:1、能否加其他酸如硫酸或盐酸使四氧化三铅分解为甚么答:不可以。
盐酸会与四氧化三铅反应,盐酸被四氧化三铅中的二氧化铅氧化成氯气。
硫酸会与二价铅离子反应生成硫酸铅沉淀,与二氧化铅分离不出来。
故盐酸和硫酸均不可以(不能。
用硝酸分解四氧化三铅中的二价铅与硝酸反应生成易溶于水的硝酸铅,从而使二价铅和二氧化铅分离。
若使用硫酸或者盐酸的话,生成的硫酸铅和氯化铅均难溶于水,不利于二价铅和二氧化铅的分离)2、二氧化铅氧化碘离子需要在酸性介质中进行,能否加硝酸或盐酸以代替醋酸为什么答:醋酸作为缓冲溶液调节溶液的PH值,使溶液环境保持PH=5~6。
若用强酸代替,随着反应的进行,溶液的PH值变化大,不利于二氧化铅氧化碘离子这一反应。
另外硝酸会氧化碘离子变为碘单质,影响硫代硫酸钠的滴定量。
而四氧化三铅中的二氧化铅氧化盐酸,消耗二氧化铅的量。
(不能。
硝酸具有强氧化性,也会将碘离子氧化为碘单质,使实验结果偏大;盐酸中的Cl-具有还原性,易被强氧化剂二氧化铅氧化,消耗一定量的二氧化铅,使实验结果偏小。
)操作题:1、氧化铅的含量测定中开始加入二甲酚橙指示剂与六亚甲基思胺时,溶液的颜色发生什么变化当用EDTA滴定时,溶液的颜色又发生什么变化答:加入二甲酚橙指示剂后溶液从黄色变为橙色。
加入六亚甲基思胺时溶液由橙色变为紫红色。
用EDTA滴定时,溶液由紫红色变为亮黄色。
3、在二氧化铅含量测定中,为什么要加入0.8g固体碘化钾溶液有什么变化答:加入0.8g 固体碘化钾是要使二氧化铅全部被还原与溶解。
此时溶液呈透明棕色。
4、在二氧化铅含量测定中,为什么不一开始加入1mL2%淀粉液,而是到硫代硫酸钠滴定溶液至淡黄色才加入答:淀粉与碘单质络合生成蓝色物质。
若一开始就加入淀粉溶液,淀粉则会络合较多的碘单质,则硫代硫酸钠与碘单质反应的量就少。
到溶液至淡黄色才加入淀粉溶液,此时的碘单质几乎和硫代硫酸钠反应完全,使得碘单质与淀粉反应量较少,减少误差。
热重

典型热重图谱示例
TG /% DTG /(%/min) TG 曲线 起始点 : 424.6 ℃ 80 DTG 曲线 60 40 20 峰值 : 455.0 ℃ 0 300 350 400 450 温度 /℃ 终止点 : 474.5 ℃ 500 质量变化 : -96.34 % -5 -10 -15 -20 0 5
失重率
(2)在病理研究上的应用
在病理研究中应用热分析方法的例子很多,通过这些研究 可阐明这些病变的病理进而可预防这类疾病的发生以及寻找相 应有效的药物和治疗方法。通过热分析方法分析说明肾结石可 分成四种类型:①草酸钙类,占70~80%;②磷酸镁铵类,占 10~15%;③尿酸盐类,占10%;④胱氨酸盐类,占1~2%;它 们的TG曲线如图所示:
应用举例
(1)橡胶中碳黑含量的测定
在橡胶中加入碳黑可提高橡胶制品的拉伸强度等性能。加 到橡胶中碳黑的量会影响橡胶制品的物理性质。可用TG来测 定碳黑的含量。 测定方法是:加入数毫克试样,在氮气氛中加热,到 600 ℃左右除碳黑以外的有机物已分解。有机物分解后通入 氧气,碳黑燃烧掉,从TG失重即可测量碳黑的含量。如图。
同步热分析仪的应用------研究
CuSO4.5H2O 的脱水过程
教 师:XXX Email:@
2014-4-1
一、实验目的
了解同步热分析仪的仪器装置; 熟悉同步热分析仪的操作过程; 掌握热重分析法的基本原理; 测绘CuSO4.5H2O 脱水过程的热分析曲线,并对实 验的数据进行处理分析。
当所测物质失 重过程相对应 的温度范围比 较宽时,TG鉴 别这重物质就 比较困难,特 别是当两个物 质分解温度比 较接近时,但 采用微商热重 法可以解决这 一问题。
100
南京大学物化实验系列热分析

TG/DSC技术对CuSO4•5H2O脱水机理的研究一、教学目的:1、理解TG、DSC热分析技术的基本原理,并掌握仪器的基本使用方法。
2、学会定性并定量地对实验所得图谱进行解析。
3、正确表示出CuSO4•5H2O脱水过程每一步变化对应的脱水温度,重量变化及热效应,写出每步反应方程式。
二、实验原理:热分析技术是指在程序控温下,测量物质的物理性质随温度变化的函数关系的一类技术。
热分析技术根据测定的物理量的不同可以分为几个大类,测定质量随温度变化的有热重法(TG),导数热重法(DTG),逸出气检测法(EGD),逸出气分析法(EGA),测定温度差的有差热分析(DTA),测定热效应的有差示扫描量热法(DSC),还有热膨胀法(TD),等等。
详见下表。
物理性质技术名称简称简介质量热重法TG 在程序控温下,测量物质的质量和温度关系的一种技术导数热重法DTG 在程序控温下,测量物质的质量变化速率和温度关系的一种技术逸出气检测法EGD 在程序控温下,定性检测逸出的挥发性产物和温度关系的一种技术逸出气分析法EGA 在程序控温下,测量挥发性产物的性质或数量和温度关系的一种技术温度差热分析DTA 在程序控温下,测量物质和参比物温度差和温度关系的一种技术焓差示扫描量热法DSC 在程序控温下,测量输入到物质和参比物功率差和温度关系的一种技术尺度热膨胀法TD 在程序控温下,测量物质在可忽略负荷时的尺寸和温度关系的一种技术本实验要掌握的是TG和DSC热分析技术。
1)热重法(TG,Thermogravimetry)在热重法中,被测物理量即为试样受热反应而产生的质量变化。
许多物质在加热过程中若发生如熔化、蒸发、升华、吸附等物理变化,或是脱水、解离、氧化、还原等化学变化,即引起质量改变。
在程序控温的情况下,温度T与时间t成线性关系。
以质量对时间t或温度T作图,得热重曲线(TG曲线)。
TG曲线所提供的信息主要有:物理或化学过程对应的质量变化以及温度区间。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)差热分析法 Differential Thermal Analysis
图 典型的DTA曲线
图中基线相当于DT=0, 样品无热效应发生,向上 和向下的峰反映了样品的 放热、吸热过程。
① 零线:理想状态ΔT=0的线; ② 基线:实际条件下试样无热效应时的曲线部分; ③ 吸热峰:TS<TR ,ΔT<0时的曲线部分; ④ 放热峰:TS>TR , ΔT>0时的曲线部分; ⑤ 起始温度(Ti):热效应发生时曲线开始偏离基 线的温度; ⑥ 终止温度(Tf):曲线开始回到基线的温度; ⑦ 峰顶温度(Tp):吸、放热峰的峰形顶部的温度, 该点瞬间d(ΔT)/dt=0; ⑧ 峰高:是指内插基线与峰顶之间的距离,表示试 样与参比物之间最大温差; ⑨ 峰面积:是指峰形与内插基线所围面积; ⑩ 外推起始点:是指峰的起始边斜率最大处所作切 线与外推基线的交点,其对应的温度称为外推起始 温度(Teo);根据ICTA共同试样的测定结果,以外 推起始温度(Teo)最为接近热力学平衡温度。
钙、锶、钡水合草酸盐的TG曲线与DTG曲线(a)DTG曲线;(b)TG曲线 1、热重曲线中质量(m)对时间(t)进行一次微商从而得到dm/dt-T(或t)曲线,称为微商热重
(DTG)曲线。 2、 它表示质量随时间的变化率(失重速率)与温度(或时间)的关系。 3、 微商热重曲线与热重曲线的对应关系是:微商曲线上的峰顶点(d2m/dt2=0,失重速率最大值
点)与热重曲线的拐点相对应。微商热重曲线上的峰数与热重曲线的台阶数相等,微商热重 曲线峰面积则与失重量成正比。
热重曲线
(2)差热分析法 Differential Thermal Analysis
在程序控制温度下,测量物质与参比物之间的温度差随温 度变化的一种技术。
物质在受热或冷却过程中发生的物 理变化和化学变化伴随着吸热和放 热现象。如晶型转变、沸腾、升华、 蒸发、熔融等物理变化,以及氧化 还原、分解、脱水和离解等等化学 变化均伴随一定的热效应变化。
2、 到达一定温度(即CaC2O4•2H2O的分解温度)结晶水释放完毕,温度升高,重量不会改变, 出现第一个平台,它对应于DTA或DSC上的第一个吸热峰,(分解温度即峰顶部温度)由于原联 接于草酸钙的被束缚的结晶水脱离需外解提供能量,所以要吸热。
(1)热重法 Thermogravimetry, TG
是在温度程序控制下,测量物质质量与温度之间的关 系的技术。
热重法
热重装置结构示意图
(1)热重法 Thermogravimetry, TG
由热重法记录的重量变化对温 纵坐标m为质量,以mg或剩余百分数%表示;
度的关系曲线称热重曲线 (TG曲线)。
横坐标T为温度,热力学温度(K)或摄氏温度
A(固)
(℃);
B(固)+C(气)
Ti 表示表观质量变化的起始温度;
Tf表示终止温度,即累积质量变化到达最大值时
的温度;
Tf-Ti表示反应区间,即起始温度与终止温度的温 度间隔;
曲线中AB 和CD,即质量保持基本不变的部分叫
作平台,BC部分为台阶。
热重曲线
微商热重(DTG)曲线
差热分析
(2)差热分析法 Differential Thermal Analysis
Furnace
Sam ple
.
Q PR
Ref er.
DT
差热分析的基本原理,是把被测试样和一种中性物(参比物)置放在同样的热条 件下,进行加热或冷却,在这个过程中,试样在某一特定温度下会发生物理化学 反应引起热效应变化 ,即试样侧的温度在某一区间会变化,不跟随程序温度升 高,而是有时高于或低于程序温度。而参比物一侧在整个加热过程中始终不发生 热效应,它的温度一直跟随程序温度升高,这样,两侧就有一个温度差,然后利 用某种方法把这温差记录下来,就得到了差热曲线。
度)等
逸出气分析
(EGA – MS, FTIR)
几种常见的热分析法:
1. TG热重法。在程序控制温度下,测量物质的质 量与温度或时程序控制温度下,测量被物 质和参比物的温度差与温度关系的一种方法(即 DTA)。
3. DSC差示扫描量热法。在程序控制温度下,测量 输入到测量物质和参比物的功率差与温度的关系 的一种方法(即DSC)。由于DSC直接测量的是热 量,所以是一种量热法。“差示”是指除用试样 外,还要用参比物。扫描是指温度扫描。即温度 从低到高或从高到低的动态扫描。
热分析主要用于研究物理变化 (晶型转变、熔融、升华和吸附 等)和化学变化(脱水、分解、 氧化和还原等)。热分析不仅提 供热力学参数,而且还可以给出 有一定参考价值的动力学数据。 热分析技术
热分析技术分类
差热分析与差示扫 描量热法
(DTA, DSC)
热重分析法
(TGA)
热机械分析法 (TMA)
介电分析法 (DEA)
差热分析
TG - DTA 同步热分析
W W M M 0
1
CaC2O4 2H2O
CaC2O4
W0
M CaC2O4 2H2O
W0 W2 MCaC2O4 2H2O MCaCO3
W0
M CaC2O4 2H2O
草酸钙的TG与DTA曲线
1、 在0∽800℃范围内DTA有两个峰(另一个超出800℃)一个吸热,另一个放热。而在 0∽800℃范围内,热重曲线上有两个平台。在100℃前为斜坡,产生原因是粉末草酸钙样品吸附 的少量水份随着温度升高逐渐释放出来,使样品重量减轻,当温度继续升高,结晶水也会释放出 来。
导热系数仪 热流法 激光散射法
测量物理与化学过 程(相转变,化学 反应等)产生的热
效应; 比热测量
测量由分解 、挥发、气 固反应等过 程造成的样 品质量随温 度/时间的
变化
测量样品的维度变 化、形变、粘弹性 、相转变、密度等
测量介电常数、 损耗因子、导电 性能、电阻率( 离子粘度)、固 化指数(交联程
热重-差热分析联用法研究 CuSO4·5H2O的脱水过程
一、实验目的:
1.熟悉热重和差热分析法的基本原理。 2.掌握热重-差热分析联用的实验方法和数据
处理方法。 3.了解CuSO4·5H2O 的脱水机理。
二、方法原理:
国际热分析协会(International Confederation for Thermal Analysis ICTA) 1977年对热分析技术的定义: “热分析是在程序控制温度下测量物质的物理性质与温度关系 的一种技术”
