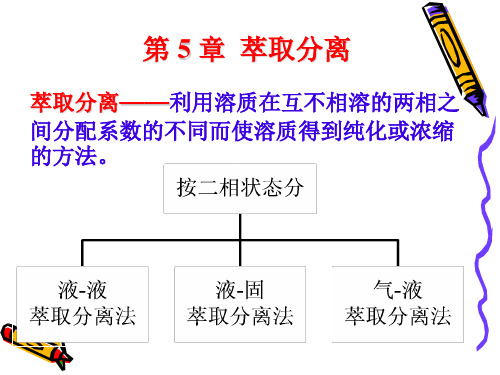
萃取体系分类法
萃取

基本概念
利用组分在两个互不相溶的液相中的溶解度差而将其从一个液相 转 移 到 另 一 个 液 相 的 分 离 过 程 称 为 液 液 萃 取 ( Liquid-liquid extraction),也叫溶剂萃取(Solvent Extraction),简称萃取。 待分离的一相称为被萃相,用做分离剂的相称为萃取相。萃取相中 起萃取作用的组分称为萃取剂,起溶剂作用的组分称为稀释剂或溶 剂。分离完成后的被萃相又称为萃余相。
4.2 互溶度测定方法
1. 化学分析法.
4.2 互溶度测定方法
1. 浊度法.
结线的获取
289
萃取过程计算
萃取过程分析
常用的工业萃取过程根据使用的设备通常分为逐级萃取过程和 微分萃取过程。
1. 逐级萃取过程 (平衡萃取)
以多级混合澄清槽为萃取设备的连续萃取过程。特点是每一个 萃取级构成一个平衡级, 易实现过程分解、组合与控制。
WE
WM
MR RE
WE
WF
RF RE
300
WE
ห้องสมุดไป่ตู้
WM (zM yE
xR ) xR
RF
E´
WE WF RE
WE
WF ( xF xR ) yE xR
F
E
R´
M
R
WR WF WE
xR zM yE
下面一律以物系所处的状态点字母代表物流的量,
三元组成在直角三角形相图中的表示法
M点的组成为:
xA BE 0.4 xB SG 0.3 xS BF 0.3
A
K H·
E
D
M
B
2采样制样

二、几个术语
1.采样单元 2.子样或小样、分样 3.原始平均试样或称为“送检样” 4.分析化验单位或基本批量 5.实验室样品 6.试样 7.样品制备
三、采样的要求
1.采样单元数
总体物料的单元数 1~10 11~49 50~64 65~81 82~101 102~125 126~151 152~181 选取的最小单元数 全部单元 11 12 13 14 15 16 17 总体物料的单元数 182~216 217~254 255~296 297~343 344~394 395~450 451~512 选取的最小单元数 18 19 20 21 22 23 24
2.共沉淀分离 共沉淀现象是由于沉淀的表面吸附作用、 混晶或固溶体的形成、吸留或包藏等所引 起的。利用共沉淀现象分离和富集痕量组 分。 (1)无机共沉淀法 (2)有机共沉淀法
三、溶剂萃取分离法
1.概念:指在被分离物质的水溶液中, 加入与水互不相溶的有机溶剂,借助于 萃取剂的作用,使一种或几种组分进入 有机相,而一些组分仍留在水相,从而 达到分离的目的。
一、气态物料样品的采集
1.采样设备
常用的气体采样装置一般由采样管、过滤 器、冷却器及气体容器等四部分组成。 采样管用玻璃、瓷或金属制成。 过滤器管内装有玻璃丝,用于除去气体中 可能含有的机械杂质。 冷却器有玻璃制的和金属制的。
气体采样装置
1-气体管道;2-采样管;3-过滤器; 4-冷却器;5-导气管;6-冷却水入口; 7-冷却水出口;8,9-冷却管
300~400g/L的氢氧化钠溶液能剧烈分解铝及其合金。
二、干法分解法
干法分解法分为熔融和烧结两类 熔融分解的目的是利用酸性或碱性熔剂与 试样在高温下进行复分解反应,使试样中 的组分转化成易溶于水或酸的化合物。熔 融硅酸盐矿物和其它矿物的熔剂很多,一 般多为碱金属化合物。 半熔法是指熔融物呈烧结状态的一种熔样 方法,又称烧结法。此法在低于熔点的温 度下,让试样与固体试剂发生反应。
第6章、溶剂萃取、双水相萃取和超临界萃取法

式中[A有]——物质A在有机相中的平衡浓度 [A水]——物质A在水相中的平衡浓度。
严格地说,只有当溶剂A在水溶液中的浓度极 低,并在两相中的分子型体相同时,KD在一 定温度下才是常数。而与溶质在整个体系中 的总浓度无关。但在分析实践中,溶质在溶 液中的浓度往往相当大,因此(1)式常发生偏 高,在此情况下,分配系数应以溶质A在两相 中的活度之比PA表示:
第六章 溶剂萃取、双水相萃取和超临界萃取法
基本原理; 溶剂;无机萃取体系的分类; 萃取条件的选择; 萃取分离操作; 逆流萃取;双水相萃取;超临界萃取;固相微萃 取(SPME)技术;反胶束萃取;凝胶萃取。 重点:溶剂、萃取条件的选择和超临界萃取、固 相微萃取技术。
§1. 基本原理
萃取过程的本质
无机盐类溶于水中并发生离解时。便形成水合离子。 如Al(H2O) 63+、Zn(H2O) 42+ 、 Fe(H2O)4Cl4-等,它们易溶于水而难溶于有机溶剂。 这种性质称为亲水性。许多有机化合物(油脂、萘、 蒽等)难溶于水而易溶于有机溶剂,这种性质称为疏 水性。如果要从水溶液中将某些无机离子萃取至有 机溶剂中,必须设法将其亲水性转化为疏水性。因 此萃取过程的本质,是将物质由亲水性转化为疏水 性的过程,其起作用的是萃取剂反应基团的活性。
式中[A]有和[A]水分别代表溶质A在有机相 和水相中的不同化学型体的总浓度。
三、分离系数(分离因数)
在同一体系中有两种溶质A和B,它们的萃取常数分别的为DA 和DB,这两个数的比值称为分离系数(β)
β=l,即DA = DB ,表明A和B不能分离。
β>l,即DA > DB ,表明A和B可分离,而β值越大,分离效 果越好。
萃取化学原理与应用第二章、萃取剂与萃取体系

iV) 酸性双磷萃取剂 (焦磷酸酯R4P2O7及类似物) RO(OH)PO-X-OP(HO)OR (X=O、CH2、CH2-CH2) 二辛基甲基双磷酸 H17C8O(OH)PO-CH2-OP(OH)C8H17
子具有酸性,属于酸性含磷萃取剂;有下列4类: i) 磷酸二烷基酯:磷酸二(2-乙基己基)酯 (HDEHP or D2EHP,P204) (C4H9(C2H5)CHCH2O)2(OH)P=O 双十二烷基磷酸 (C12H25O)2(OH)P=O
第二章、萃取剂与萃取体系(5)
ii) 磷酸一烷基酯:H3PO4分子中有一个-OH被烷基化 十二烷基磷酸 (DDPA) C12H25O(OH)2P=O
条件:螯合物萃取剂的种类很多,并不是所有螯合物都可以作为螯合萃
取剂,只有那些能够生物螯合物、易溶于有机溶剂、不易溶于水相的螯合
物,才能够成为螯合萃取剂。
特点:i) 至少有两个或两个以上、能够与金属离子形成萃合物的反应性
与功能性基团;ii) 有适当长度的疏水基团;iii) 与金属离子能够形成非常稳
定的;iV) 在适当条件下,萃取选择性好、分离系数高、能够达到很高的萃
取率。
不足之处:形成的螯合物因为过于稳定而难以反萃,给分离与纯化带来
困难;价格较贵。
第二章、萃取剂与萃取体系(7)
A. 含氧螯合物萃取剂
i) β-二酮螯合物的萃取剂 R-CO-CH2-CO-R
HAA:乙酰丙酮 CH3-CO-CH2-CO-CH3
HTTA:2-噻吩甲酰三氟丙酮
萃取分离
D = C I2, o =
[ I 2]o
=
KD
C I2, w
[ I 2]w + [I3-]w
1 +K [ I - ]w
可见: 分配比D随[ I- ]W而变!
3. 萃取率E(萃取效率)
E
A在有机相中的总量 A在两相中的总量和
C A,O VO
DVO
C A,O VO C A,W VW DVO VW
D
• 在上述的例子中,
碘+水
CCl4
碘+CCl4;水
• 选用的CCl4——既是萃取溶剂,同时也是萃取 剂。
• 萃取剂——在水中加入某种试剂,使被萃物质与试
剂结合成不带电荷的、难溶于水的分子。这种试剂称萃
取剂。
• 萃取溶剂——主要起改善有机相物理性质的作用。
• 有时有机相由两种溶剂组成,一种是萃取溶剂, 另一种是萃取剂。
校正:若浓度较高(I ≠ 0),则应校正 I 的影
响,即用活度比PD代替浓度比KD。
PD
o w
o[ A]o w[ A]w
o w
KD
只有在稀溶液中,两相中的活度系数为1,此时 KD=PD.
• 讨论:
• 1)不同溶质在不同的溶剂中具有不同的 K 值;
• 2)K 值越大表示该溶质在有机相中的溶解度 越大;
(2) 中性配合萃取体系
• 关键词:中性 • 特 点:中性的萃取剂与中性的被萃物结合生成中性
的配合物。
• 中性配合的萃取剂的分类: – 中性含磷萃取剂:膦酸酯、次膦酸酯、膦氧化物、 焦膦酸酯等; – 中性含氧萃取剂:包括酮、醚、醇、酯和醛等; – 中性含氮溶剂:如吡啶类 – 中性含硫萃取剂:二甲亚砜、二苯基亚砜等
第2章溶剂萃取

常用溶剂的罗氏极性参数
溶剂
正庚烷 正己烷 环戊烷 四氢呋喃
乙酸乙酯 氯仿 甲乙酮 丙酮 乙腈 甲醇 水
P’
ɛ(介电常数)
0.2
1.92
0.1
1.88
-0.2
1.97
4.0
7.6
4.4
6.0
4.1
4.8
4.7
18.5
5.1
5.8
37.8
5.1
32.7
10.2
80
Xe =He/P’ Xd = Hd/P’ Xn= Hn/P’
醋酸
苯酚、氯仿、水
结论
同一个组中的溶剂,具有非常接近的3个选择性 参数,在分离过程中具有类似的选择性,若通过选 择溶剂改善分离,就要选择不同组的溶剂。
溶剂选择一般方法
(1)单一溶剂: 选择与溶质极性尽可能相等的单 一溶剂,使溶质在溶剂中的溶解度达到最大;
在保持溶剂极性不变的前提下,更换溶剂种类, 调整溶剂选择性,使分离选择性达到最佳。
• 极性是一种抽象概念,用以表示分子中电荷不对 称(assymmetry)的程度。
• 表征的参数常有偶极矩、介电常数、油水分配系 数、溶解度参数和罗氏极性参数。
影响分子极性的因素
分子的极性与分子结构及分子大小有关;
——分子结构指分子中所含官能团的种类、数目及 排列方式等综合因素。
——分子大小指分子碳链长度、骨架大小,与分子 量相关。
测定分配系数最常用溶剂系统:正辛醇和水系统, 并用Ko/w或lgP表示分配系数。
KO /W
coctanol c wa te r
lg Ko/ w lg P
典型香味化合物的油水分配系数
萃取技术

β越大,A、B的分离效果越好,即产物与 杂质越容易分离。
四、萃取剂的选择
一个良好的溶剂要满足以下要求: a. 有很大的萃取容量; b. 良好的选择性; c. 与被萃取的液相(通常是水相)互溶度要小, 且粘度低、界面张力小或适中,有利于相的分 散和两相分离; d. 溶剂的回收和再生容易; e. 化学稳定性好,不易分解,对设备腐蚀性小; f. 价廉易得; g. 安全性好,对人体无毒性或毒性低。
双水相萃取
过滤和离心依赖于被分离颗粒的尺寸或密度的差异, 当希望收集微生物的细胞器、分离去除细胞碎片、提 取和浓缩胞内物质时,普通的过滤和离心技术就显得 力不从心了。
溶剂萃取法难于应用于蛋白质分离。
值得注意的是溶液的分相不一定完全依赖于有机溶剂, 在一定条件下,水相也可以形成两相甚至多相。于是 有可能将水溶性的酶、蛋白质等生物活性物质从一个 水相转移到另一水相中,从而完成分离任务。
二、液-液萃取过程机理(×)
萃取过程机理主要有以下四种类型:
(1) 简单分子萃取(物理萃取)
(2) 中性溶剂络合萃取
(3) 酸性阳离心交换萃取 (4) 离子络合萃取
三、分配系数和分配因素
分配定律(表征萃取剂对溶质的萃取能力)
是指在一定温度、压力下,溶质分子分布在 两个互不相溶的溶剂里,达到平衡后,它在 两相的浓度之比为一常数K,这个常数称为 分配系数,即:
,
工业萃取方式
工业萃取的流程 混合 分离
分离器(如碟片式离心机)
溶剂回收
混合器 (如搅拌混合器)
溶剂回收装置 (如蒸馏塔)
固相萃取分类

固相萃取分类固相萃取(Solid-phase extraction,简称SPE)是一种常用的样品前处理方法,广泛应用于化学分析、环境监测、食品安全等领域。
它通过将待分析样品中的目标化合物吸附到固定相上,再用洗脱剂将目标化合物从固相上洗脱下来,从而实现对目标化合物的分离和富集。
固相萃取的分类主要包括以下几种:1. 正相固相萃取(Normal phase solid-phase extraction):正相固相萃取是指固定相表面具有极性官能团,适用于极性化合物的富集。
常用的固定相材料包括硅胶、氨基硅胶等。
正相固相萃取的原理是通过样品溶剂与固定相之间的亲和作用,使样品中的目标化合物在固定相上发生吸附。
随后,使用洗脱剂将目标化合物从固定相上洗脱下来。
2. 反相固相萃取(Reverse phase solid-phase extraction):反相固相萃取是指固定相表面具有疏水性官能团,适用于非极性或疏水性化合物的富集。
常用的固定相材料包括C18、C8等疏水性材料。
反相固相萃取的原理是通过样品溶剂与固定相之间的疏水作用,使样品中的目标化合物在固定相上发生吸附。
随后,使用洗脱剂将目标化合物从固定相上洗脱下来。
3. 混合模式固相萃取(Mixed-mode solid-phase extraction):混合模式固相萃取是指固定相表面同时具有正相和反相性质的官能团,适用于同时富集极性和非极性化合物的样品。
通过在固定相上引入具有不同官能团的化合物,可以实现对不同性质的化合物的选择性富集。
4. 选择性固相萃取(Selective solid-phase extraction):选择性固相萃取是指通过选择特定的固定相材料或添加适当的修饰剂,实现对特定化合物的选择性富集。
常用的选择性固相萃取方法包括分子印迹固相萃取、固相微萃取等。
分子印迹固相萃取通过在固相上引入与目标化合物具有亲和性的模板分子,实现对目标化合物的高选择性富集。
食品分离技术(3)萃取技术1

35
萃取百分率
E
溶质溶 在质 有的 机总 相量 中的量
mo mo mw
coVo coVo cwVw
co
co cw cw Vw
Vo
D DR
其中
R
Vw Vo
称为相比
当 R = 1 时,
E
D D 1
D
1 10 100 1000
E % 50 91 99 99.9
在实际工作中,人们所关注的是被萃物分配在两 相中的实际总浓度各为多少,而不是它们的具体存 在的型体。
分配比
D CA(有机 ) C(A 水)
即,在一定条件下,当达到萃取平衡时,被萃物 质在有机相和在水相的总浓度之比。
9
分配系数和分配比的比较
●概念不同,关注的对象有差别 ●两者有一定的联系
KD表示在特定的平衡条件下,被萃物在两相中的 有效浓度(即分子形式一样)的比值;而D表示实际 平衡条件下被萃物在两相中总浓度(即不管分子以 什么形式存在)的比值。分配比随着萃取条件变化 而改变。
丁酯逆流萃取
萃取液
乳酸沉淀
分解转碱
红霉素乳酸盐 调 pH9.8, 溶于丙酮 红霉素碱
加水
红霉素碱成品
结晶
18
2. 温度T
◆ T↑,分子扩散速度↑,故萃取速度↑ ◆ T影响分配系数
例:pen ― T↑ 水中的溶解度↑ ∴ 萃取时 T↓使K↑;反萃时 T↑使K反↑ 红霉素、螺旋霉素― T↑ 水中的溶解度↓ ∴ 萃取时 T ↑使K ↑ ;反萃时 T ↓使K反↓
16
举例:
青霉素 ( pK2.75 ) 工业钾盐 :
预处理及过滤
发酵液
滤洗液
2-萃取的基础理论

第三节 萃取的理论基础
3、萃取容量 1)饱和容量 在一定萃取体系中,单位体积或单位物质的量的萃取剂对 某种被萃取物的最大萃取量。 萃取饱和容量的单位为:克被萃取物/升有机相或克被萃 取物/摩尔萃取剂。 测定方法: 等温线外切线法 饱和法:用一份有机相同数份新鲜料液相接触,直到有 机相不再发生萃取作用为止,分析此时有机相所含被萃取 物的量则为饱和容量。
第三节 萃取的理论基础
2)被萃取金属的性质—离子半径
a、溶剂络合作用:氧原子与稀土离子配 位时,按静电理论,形成的络合物的 稳定性与它们的电荷大小成正比,而 与离子半径大小成反比。 稀土离子(三价)的电荷相同, 但随原子序数增大,离子半径逐渐减 小(镧系收缩)。因此,P350与稀土 离子形成的络合物的稳定性随原子序 数的增加而增加。 b、水合作用:Z2/r越大,离子的水合作 用越强烈,越不容易被萃取。 而稀土离子的半径随原子序数增 大而减小,水合作用随之而增强,从 而越不容易被萃取。
第三节 萃取的理论基础
3)萃取操作条件 A、酸度的影响 在HNO3浓度不太高时,因D 与[NO3-]的三次方成正比,增 加HNO3浓度可提高D; 在HNO3浓度增加导致 [TBP· HNO3]的增加,降低了 自由萃取剂的浓度,导致D降 低; HNO3浓度继续增加时,水相 盐析作用增加,故D增大。
[M1]……[Mn] :分别为各种形态的被萃物在有机相中的浓度
[M1]……[Mn] :分别为各种形态的被萃物在水相中的浓度
分配比越大,表示该分子越容易被萃入有机相; 分配比是一个变数,随操作条件的不同而不同。
第三节 萃取的理论基础
2、萃取比(E)
指有机相中被萃物的量与平衡水相中被萃物的量之比,即:
第三节 萃取的理论基础
萃取简介及技术

MXn的各级络合物可用下列各反应式表示: βn称为络合物MXn的生成稳定常数,简称稳定 常数。
福劳内乌斯函数:
Yo
TM
M
n i0
i
(X
)i
1
1 ( X
)
2(X
)2
n
(X
)n
n
= 1
i ( X )i
• 有机相-有机溶剂 – 萃取剂
• 是一种能与被萃物作用生成一种不溶于水相而易溶于有 机相的化合物,从而使被萃物从水相转入有机相的有机 试剂。
• 萃合物:萃取剂与被萃取物发生化学反应生成的不易溶 于水相而易溶于有机相的化合物(通常是一种络合物) 称为萃合物。
– 稀释剂
• 指萃取剂溶于其中构成连续有机相的溶剂。例如磺化煤 油。稀释剂虽与被萃物不直接化合,但往往能影响萃取 剂的性能。(改善有机相的物理性质如:密度、粘度、 表面张力 )
溶剂互溶规则
1. 相似性原理
– 结构相似的溶剂容易互相混溶,结构差别 较大的溶剂不易互溶。
表2-1 苯和酚在水中的溶解度
化合物
溶解度 克/100克水(20℃)
C6H5苯 C6H5OH(酚) 1.2-C6H4(OH)2
6.072 9.06 45.1
化合物
甲醇 乙醇 正丙醇 正丁醇 正戍醇 正已醇 正庚醇 正辛醇
溶剂的互溶性规律
1. AB型和N型溶剂几乎完全不互溶。
2. A型和B型溶剂混合前无氢键,混合后形成氢键, 故有利于完全互溶,如氯仿与丙酮。
3. AB型和A型,AB型和B型、AB型与AB型在混合前 后都有氢键形成,互溶度大小视混合前后氢键的强 弱及多少而定。
第三章、萃取分离法(一)

配位键O→M越强,则G3P=O的萃取能力越强。由于烷氧基RO 吸引电子的能力比烷基R强,其配位能力就较弱,所以中性磷类萃 取剂的萃取能力按下列次序递增
R
OR
(RO)3P O < (RO)2P O < R2P O < R3P O
中性磷类萃取剂萃取金属离子的特点是:被萃取物在萃取 过程中以中性分子形式存在与萃取剂结合,生成中性络合物而 进入有机相 。
中性磷类萃取剂是指磷酸
HO
OH PO OH
分子中三个羟基全部为烷基酯化或取代的化合物,按其酯 化或取代的不同可分为四个类别
类别 磷酸三烷基酯(磷 酸酯)
烷基膦酸二烷基酯 (膦酸酯)
二烷基膦酸烷基酯 (次膦酸酯)
通式
(RO) 3P O
R (RO)2P O
OR R2P O
三烷基氧化膦 (膦氧化物)
R3P O
[ A]O,总 [[ A]O,总 VW ]100% [ A]W ,总 [ A]W ,总 VO
D 100 % D VW VO
设R=VO / VW(相比)
E
D D
1
100%
R
萃取率E与分配比D及相比R有关
R一定,D越大,E越大; D一定,R越大,E越大,萃取越完全
当R=1,即用等体积有机溶剂进行萃取时, E D D 1
2.特点
(1)历史悠久,1842年…; (2)应用广泛,常量、微量、痕量分离均可; (3)回收率高、选择性好; (4)仪器设备简单; (5)操作较为烦琐费时; (6)萃取剂价格较昂贵,有机溶剂易挥发易燃,有毒。
第一节 溶剂萃取分离法的一些 定义及特征参数
一、萃取剂和萃取溶剂
萃取剂:指与被萃物有化学反应,而能使被萃物被
7 萃取.

萃取分离是指被分离物质由一相转移到互不 相溶的另一相,从而使其与其它共存物质相互分离 的一种方法。
萃取
萃取(extraction)是利用液体或超临界流体为溶 剂提取原料中目标产物的分离纯化操作,所以,萃取 操作中至少有一相为流体,一般称该流体为萃取剂 (extractant)。以液体为萃取剂时,如果含有目标产 物的原料也为液体,则称此操作为液-液萃取;如果 含有目标产物的原料为固体,则称此操作为液 -固萃 取或浸取(Leaching)。以超临界流体为萃取剂时, 含有目标产物的原料可以是液体,也可以是固体,称 此操作为超临界流体萃取。另外,在液-液萃取中, 根据萃取剂的种类和形式的不同又分为有机溶剂萃取 (简称溶剂萃取)、双水相萃取、液膜萃取和反胶束萃 取等。
+
其中mA和mCl分别为氨基酸和氯离子的分配系数, cA水相氨基酸总浓度 18 cA =[A+] +[A] +[A- ] 从13到18可以推导出下式
+
19
事实上,阴离子氨基酸的离子交换反应需在高于 其等电点的pH范围内进行,所以, 式18中的[A+] 可忽略不计,式19简化成下式 mA=KeCl mCl
A在有机相中的总量 100 % A在两相中的总量
②E=
③经过n次萃取后,水相中剩余A质量仅为mn, 则 mn==
m( 0
V水 DV有 V水
n )
分离系数:表示A、B两组分在萃取中被分离的情况: A / B D A / D B 当DA和DB比较接近时,分离系数β 接近于1,表明A、B两组分难以通过萃取分离。反 之,DA和DB相差越大,二者被分离的程度越好。
溶剂萃取在生化物质的分离和纯化中是一种重 要的手段。这是因为它具有如下的优点: 1.萃取过程具有选择性; 2.能与其他需要的纯化步骤(例如结晶、蒸馏) 相配合; 3.通过转移到具有不同物理或化学特性的第二 相中,来减少由于降解(水解)引起的产品损失; 4.可从潜伏的降解过程中(例如代谢或微生物 过程)分离产物; 5.适用于各种不同的规模, 6.传质速度快,生产周期短,便于连续操作, 容易实现计算机控制。
生物分离工程第四章萃取

的物理量)
编辑课件
12
二、分配定律与分配平衡
化学势是活度的函数:
编辑课件
13
二、分配定律与分配平衡
所以,分配定律只有在较低浓度范围内成立。A是一个重要
的特征参数,与溶质浓度和两相性质有关。
• 分配系数:在多数情况下,溶质在各相中并非以一种分子
形态存在,特别是在化学萃取中,通常用溶质在两相中的 总浓度之比表示溶质的分配平衡,该比值称为分配系数。
到平衡时料液相和萃取相中溶质编的辑课浓件度。
17
三、液液萃取设备及其设计的理论基础
• 萃取因子或萃取因素E
溶质在萃取相和萃余相中数量(质量或物质的量)的比值
• 萃余分率( ):萃余相中溶质的数量与料液相中溶质的
初始数量之比。
• 收率或萃取分率:萃取相中溶质的数量与料液相中溶质
的初始数量之比。
编辑课件
或
编辑课件
14
二、分配定律与分配平衡
• 相比:指一个萃取体系中,一个液相和另一个液相的体积之
比。用R表示:
R = V1
V2
• 分离系数β(分离因子)
生物工程中料液一般含多种溶质,我们为了表示萃取剂对两 种溶质A和B的分离能力的大小,引入了分离系数:一定条件 下进行萃取分离时,被分离的两种组分的分配系数的比值。 是目标产物分离纯化程度的指标。
编辑课件
3
一、基本概念
②萃取依据:萃取原理
a.物理萃取 b.化学萃取 • 物理萃取:溶质根据相似相容原理在两相间达到分配平 衡,萃取剂与溶质不发生化学反应(物理因素)。
• 化学萃取:利用脂溶性萃取剂与溶质之间发生化学反应 (如离子交换和络合反应)生成脂溶性复合分子实现溶 质向有机相的分配。
萃取化学原理与应用第四章、中性络合萃取体系

i) 假设萃合物的组成为: Mw(NO3)y • mR3P=O • pH2O
ii) H2O的配位数:利用Karl Fisher滴定的方法进行确认
mR3P=O(O) + wMn+(a) + yNO3-(a)
Mw(NO3)y • mR3P=O(O)
Ke = [Mw(NO3)y•mR3P=O](O) / [R3P=O]m(O) [Mn+]w(a) [NO3-]y(a)
有机相中TBP的总浓度: CTBP(O) = [TBP](O) + ∑[TBP•jHNO3](O)
= [TBP](O) + ∑Βj[TBP](O) [HNO3]j(a)
= [TBP](O) (1 + ∑Βj[HNO3]j (a))
有机相中HNO3的总浓度 CHNO3(O) = [HNO3](O) + ∑j[TBP•jHNO3](O) = [HNO3](O) + ∑jΒj[TBP](O) [HNO3]j(a) = [HNO3](O) + [TBP](O)∑jΒj [HNO3]j (a)
实验思路如下:
i) 设计TBP的起始浓度为:0.1M、0.3M、0.5M、1M、2M、3M、纯 TBP;
ii) 设计HNO3的起始浓度为:0.1M、0.5M、1.05M、2.0M、3.0M、 4.0M、5.0M、…………….10M、12M;
iii) 让不同起始浓度TBP与不同起始浓度的HNO3混合、震荡、分相之后, 可以测得一系列平衡时水相中硝酸总浓度CHNO3(a),以及相应的有机相中
HNO3对TBP的平均配位数ñ为
ñ = CHNO3(O)-[HNO3](O) / CTBP(O) = ∑jΒj[HNO3]j(a) / (1 + ∑Βj[HNO3]j(a))
第四章萃取分离法详解

萃余率:
原 萃始 余料 液液 中中 溶 1溶 质 0% 0质 总 E总 1量 1量 10% 0
理论收率:
111 10 % 0E 10 %0
E1
E1
例如:
洁霉素在20℃和pH10.0时表观分配系数〔丁 醇/水〕为18。用等量的丁醇萃取料液中的 洁霉素,计算可得理论收率
1 1810% 09.4 7%
第四章萃取分离法详解
根底知识
• 萃取又称溶剂萃取,亦称抽提〔通用于石 油炼制工业〕,是一种用液态的萃取剂处 理与之不互溶的双组分或多组分溶液,实 现组分别离的传质别离过程,是一种广泛 应用的单元操作。
• 将溴水和苯在分液漏斗里混合后振荡、静 置〔静置后液体分层,Br2被溶解到苯里 ,苯与水互不相溶,苯比水轻在上层,因 溶有Br2呈橙红色,水在下层为无色〕、 分液即完成萃取
1 81
假理设论改收用率1:1/3体 积丁6醇1 萃0 取% 0 ,E8 1.57% 811/3 6
61
注:当分配系数一样而萃取剂用量减少时, 其萃取率下降。
〔二〕多级错流萃取
萃余率:
nE11E2 11 En110 % 0
理论收率
n
1
E1n
10% 0
1 n 1E 11 n 1% 0 0 E E 1 1 n n1 1% 00
• ①多级错流萃取。料液和各级萃余液都与新颖的萃 取剂接触,可达较高萃取率。但萃取剂用量大,萃 取液平均浓度低。
• ②多级逆流萃取。料液与萃取剂分别从级联〔或板 式塔〕的两端参加,在级间作逆向流动,最后成为 萃余液和萃取液,各自从另一端离去。料液和萃取 剂各自经过屡次萃取,因此萃取率较高,萃取液中 被萃组分的浓度也较高,这是工业萃取常用的流程 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
③ 鉮盐萃取:
• 四苯基鉮氯(C6H5)4As+Cl-能溶于水,与 某些较大的阴离子生成不溶于水的盐, 其中一部分被氯仿萃取。
ReO4 MnO4 TeO4 HgCl4
BF4 ZnCl4
SnCl6 CdCl4
• ④ 鏻盐萃取:四苯基鏻氯(C6H5)4P+Cl-与 ReO4-能形成被氯仿萃取的化合物。 • ⑤ 锑盐萃取:四苯基锑的阳离子与F-形成 的离子缔合物可被氯萃取。 • ⑥ 锍盐萃取:硫醇在强酸性溶液中可萃取 某些金属离子。 • 錪盐、锡盐、铅盐和(钅炭)盐等阴离子 萃取。
•
② 铵盐萃取:
• 萃取剂为伯胺、仲胺、叔胺等,它们在酸 性溶液中分别生成有机铵离子。 • 比如在H2SO4中,生成了RNH3+· HSO4-、 R2NH2+· HSO4-、 R3NH+· HSO4-。 • 萃取剂也可以是季铵盐R4N+Cl-,由于它已 经形成了阳离子,不需再与H+结合,所以 可以在中性、酸性或碱性溶液中萃取。 • 可以列入此类萃取的萃取剂还有吡啶、罗 丹明B、胍以及它的取代物等。
• 例如: • 用CCl4从水中萃取OsO4,也属于 简单分子萃取 • OsO4 ⁄H2O/CCl4
• OsO4在有机相中能聚合为( OsO4)4。 • OsO4在水相中有两性的电离平衡:
• 简单分子萃取又可按照被萃取性质的不同 分为: • (1)单质萃取; • (2)难电离无机化合物的萃取; • (3)有机化合物萃取。
(2)Morrison和Freiser的萃取体系分类法
编号 1 2
类
别
例
子
离子缔合体系 (1) (2) 螯合物体系
三辛胺在硫酸溶液中萃取六价铀 TBP从硝酸溶液中萃取硝酸铀酰
与第一种分类法中的丧失亲水性的萃 取相当
(3)Irving的萃取体系分类法
编号 1 2 类 别 例 子 氯仿从水溶液中萃取碘 以共价化合物 (1) 的形式萃取 (2) 四氯化碳从水溶液中萃取OsO4 以螯合物的形 大致与第1种分类法中的丧失水性萃取 式萃取 或与第2种分类法中的螯合体系相当, 但包括TBP萃取硝酸铀酰在内。
1.4 萃取体系分类法
• 经过几十年的发展,萃取化学积累了大量 的实验经验和文献。 • 萃取体系的范围非常广:被萃取元素从周 期表的IA族到VIIIB族,萃取剂的种类已达 几百种,水相介质的种类也很多。
• 萃取体系种类繁多 • 共性和个性
• 早期国外文献资料所用的萃取体系分类法 很不统一,主要有以下三种。
6. 高温液-液萃取体系
(1) 熔融盐萃取
• 如,以铀铋合金为核燃料元件,经照射后熔融, 其中所含的各种裂变产物,可用熔融的MgCl2来 萃取
(2) 熔融金属萃取
• 如,用熔融的金属镁与照射过的熔融的金属铀棒 接触,鈈便溶于金属镁中,而与铀分离。
(3) 高温有机溶剂萃取
• 如,用TBP的多联苯溶液,在150℃,从 LiNO3-KNO3低共熔混合物(熔点130 ℃ ) 中可以萃取Eu、Nd、Am、Cm、Np(V)、 Np(VI)、U(VI)等硝酸盐。
• 按照底物不同划分:硝酸底液萃取,其它 强酸底液萃取,混合酸底液萃取,弱酸底 液萃取,中性和碱性底液萃取。
• 萃取体系比较合理的分类法:既要考虑萃 取剂的性质,又要考虑被萃取金属元素的 特征和底液性质。 • 即根据萃取机理或萃取过程中生成的萃合 物的性质来划分。 • 1962年徐光宪提出的分类法。
(2)含氮螯合剂
• 只含有C、H、O、N,不含P、S的螯合剂。 • 如: • 8-羟基喹啉及其类似物,
• • • • 二甲基乙二肟、二苯基乙二肟等乙二肟类化合物, 水杨醛肟、二苯乙醇酮肟等单肟类化合物, 铜铁试剂、新铜铁试剂等羟胺类化合物, α -亚硝基-β -萘酚、 β -亚硝基- α -萘酚等亚硝基羟 基类化合物, • 偶氮吡啶萘酚、硝基偶氮萘酚等偶氮酚类化合物
(4)酸性磷萃取剂
• 只含C、H、O、P,不含N、S的螯合剂。 • 如: • 磷酸二烷基酯、磷酸一烷基酯、焦磷酸 二烷基酯等
焦磷酸二(2-乙基己基)酯:
4. 离子缔合萃取体系
它的特点是:金属以络合阴离子或 络合阳离子的形式进入有机相
(1)阴离子萃取
• 金属形成络合阴离子,萃取剂与H+结合成 阳离子,两者构成离子缔合体系进入有机 相。 • 按萃取剂成盐原子,可分为O、N、P、As、 Sb、S等多种类型。
UO2 NO3 2 g4H2OgnS n 4
(3)中性含氮溶剂
• 例如吡淀萃取Cu(SCN)2,生成的萃合物组成为 Cu(SCN)2· (Py)2,其结构式:
(4)中性含硫萃取剂
• 二甲基亚砜(CH3)2SO、二苯基亚砜 (C6H5)2SO等亚砜类化合物属于这类萃取剂。
3. 螯合萃取体系
• ④生成的中性螯合物不含有亲水基团,因 而难溶于水相而易溶于有机溶剂,所以被 萃取。 • ⑤螯合萃取的反应式为:
螯合萃取可按萃取剂性质 的不同分为以下5种类型:
⑴含氧螯合剂
• 即只含C、H、O,不含P、N、S的螯合剂。 • 如β —双酮类、羟基庚三烯酮等一些烯酮类化合 物,水杨醛类、对醌二酚茜素等化合物。
• 又如乙醚萃取硝酸铀酰,是通过氢键形成“二 次溶剂化”, UO2 NO3 2 g H2O4 g4 C2H6 2 O
中性络合萃取的萃取剂主要有以下4类:
• (1)中性含磷萃取剂
• ①磷酸酯(RO)3PO、膦酸酯R(RO)2PO、次膦酸酯 R2(RO)PO和膦氧化物R3PO。 • ②焦磷酸酯R4P2O7及类似物,如
(2)阳离子萃取
• 金属阳离子与中性螯合剂(如联吡啶、邻 二氮菲及联喹啉膦氧化物等)结合成螯合 阳离子,然后联合水相中存在的较大阴离 子(如ClO3-),组成离子缔合体系而溶于 有机相中。 • 联吡啶的氯仿溶液可以水相中萃取氯酸铁:
萃合物结构为:
5. 协同萃取体系
• 1956年,在研究二(2-乙基己基)磷酸从硫 酸溶液中萃取铀的各种破乳剂时,发现了 协同效应。 • 有些中性磷化合物如TBP,在硫酸溶液中对 铀几乎不萃取,但把它添加到P204的煤油 溶液中,它不但能防止反萃时生成第三相, 还可使萃取铀的分配系数增加若干倍。
3
4
以无机酸及其 大致与第1种分类法的第1类相当 盐类或络合金 属酸萃取 [ReO4]大型阴离子或 氯仿萃取[(C6H5)4As]+· 阳离子萃取
萃取体系的其它分类法:
• 按萃取剂种类划分:P型(或磷型)萃取体 系;N型(或胺型)萃取体系,C型(或螯 合型)萃取体系,O型(或鎓盐型)萃取体 系。 • 按被萃取金属离子的外层电子构型来划分: 如5f区元素(即锕系元素)的萃取,4f区元 素(即镧系元素)的萃取,d区元素(即过 渡金属元素)的萃取,p区元素(即第Ⅲ至 Ⅷ主族元素)的萃取,s区元素(即碱金属 和碱土金属元素)的萃取。
O O RO P X P OR OR OR
X代表O、CH2、CH2—CH2
• ③膦(PH3)的有机衍生物(RO)3P • 例如:三苯氧基膦是一价铜的特效萃取 剂,萃取体系 • CuCl2 / H2O-KCl / 10%(C6H6O)3P-CCl4 • ④磷硫酰类化合物(RO)3PS、R3PS • 例如:三丁基膦硫化物(C4H9)3PS、三辛 基膦硫化物(C8H17)3PS
• 它的特点是: • ①萃取剂是一弱酸HA或H2A,它既溶于有 机相也溶于水相,在两相之间有一定的分 配系数,但依赖于水相的组成,特别是水 相的pH值。 • ②在水相中金属离子以阳离子Mn+的形式, 或以能离解成Mn+的络离子的形式存在。 • ③在水相中Mn+与HA或H2A生成中性螯合物 MAn或M(HA)n等形式。
1. 简单分子萃取体系
• 特点: • 被萃物在水相和有机相中都以中性分子 的形式存在,溶剂与被萃物之间没有化学 结合,也不外加入萃取溶剂。 • 例如: • 萃取溶剂分子本身在水相和有机相中的分配
• • TBP⁄H2O ⁄煤油 HTTA ⁄ H2O ⁄ C6H6
• 在此类萃取过程中,并非不允许有任 何化学反应存在,如HTTA在水溶液中 就存在电离平衡:
(1)К у э н е л о в 的萃取体系分类法
编号 类 别 例 子
1
2 3
乙醚在盐酸溶液中萃取三价铁 作为某种盐的 (1) 形式被萃取 (2) 三辛胺在硫酸溶液中萃取六价铀
根据丧失亲水 8-羟基喹啉、铜铁试剂、β-双酮类螯合 性的萃取 剂等对金属离子的萃取 氯仿从水溶液中萃取碘 根据物理分配 (1) 元素萃取 (2) TBP从硝酸溶液中萃取硝酸铀酰
UO2 NO3 g4S UO2 NO3 gH 2Og3S UO2 NO3 g2H 2Og2S UO2 NO3 g3H 2OgS
②二次溶剂化:
• 萃取剂分子不是直接与金属离子结合,而是通过 氢键与第一配位层的分子相结合,则称为二次溶 剂化。 • 如,硝酸铀酰通过二次溶剂化生成的萃合物组成 为:
(2)中性含氧萃取剂
• 这类萃取剂包括酮、醚、醇、酯、醛等, 它们在硝酸或弱酸性溶液中萃取金属盐, 属于中性络合萃取类型。 • 按金属盐与萃取剂结合的方式,可分为一 次溶剂化和二次溶剂化两类。
①一次溶剂化:
• 当金属离子与萃取剂分子直接以配价键相结合时, 称为一次溶剂化。 • 如,乙醚等与硝酸铀酰的结合有以下四种组成:
• 几类含氮螯合剂已广泛地应用到铜、镍、 钴等有色金属冶金中,主要有: • ①某些脂肪族α 羟肟,如 LIX-63
• ②某些邻位羟基二苯甲酮肟衍生物。 • 如LIX-64:
• ③某些取代8-羟基喹啉类 • 如Kelex 100
(3)含硫螯合剂
• 打萨宗HDz及其类似物; • N-二乙基氨基硫代甲酸盐等氨基硫代甲酸 盐化合物; • 黄原酸盐以及甲基-3,4-二硫酚等二硫酚类 化合物。
