不饱和烃:烯烃和炔烃
不饱和烃命名

不饱和烃命名不饱和烃是指分子中含有C=C双键或C≡C三键的有机分子,因其分子内含有不饱和键而具有较强的化学活性,是有机化学中的重要分子类别之一。
不饱和烃包括烯烃和炔烃两大类。
烯烃是指分子中含有一个或多个C=C双键的有机分子。
烯烃按照双键数目可以分为单烯、二烯、三烯等。
对于不同种类的烯烃,其分子结构和性质也各不相同。
单烯是最简单的烯烃,最常见的单烯是乙烯(C2H4),有着较小的极性和较强的活性,因此在有机合成和化工生产中应用广泛。
二烯较少见,比较有代表性的是丁二烯(C4H6),通常用于合成丁基橡胶。
三烯非常少见,通常是一些天然化合物的组成部分。
炔烃是指分子中含有一个或多个C≡C三键的有机分子。
炔烃也有不同的种类,包括单炔、双炔、三炔等。
比较有代表性的炔烃是乙炔(C2H2),其是工业化学中非常重要的原料。
命名不饱和烃时,首先要确定分子的主链,并找出每个双键或三键的存在。
主链的选取原则是要求主链包含多数碳原子,并使取代基数目最小。
对于不饱和键,需要在主链上标记,使用体系名称,标记方法如下:对于烯烃,可以将双键所在的碳原子编号,并在前面加上ene后缀,如乙烯为ethene,但是对于分子中存在多个双键时,应使用二烯、三烯等前缀,如丁二烯为buta-1,3-diene。
对于炔烃,可以将第一个三键所在的碳原子编号,并在前面加上yne后缀,如乙炔为ethyne,但是对于分子中存在多个三键时,应使用二炔、三炔等前缀,如丙二炔为prop-1,2-diyne。
此外,对于分子中存在双键和三键的混合物,需要在前缀中同时包含ene和yne,如苯乙烯为phenylethene,但是对于存在双键和三键都有的复合烃,可以使用diene、triene、diyne、triyne等前缀表示。
总之,不饱和烃是有机化学中重要的一类分子,它分为烯烃和炔烃两大类,根据烯烃和炔烃分子中不饱和键的数目,可以分为不同种类的单烯、二烯、三烯、单炔、双炔、三炔等。
《烯烃炔烃》课件

详细描述
炔烃可以被酸性高锰酸钾 溶液、重铬酸钾溶液等氧 化剂氧化,生成酮、羧酸 或二氧化碳等物质。
举例
乙炔在酸性高锰酸钾溶液 中氧化得到二氧化碳和锰 离子。
炔烃的聚合反应
总结词
炔烃可以发生聚合反应, 生成高分子化合物。
详细描述
在催化剂的作用下,炔烃 可以发生聚合反应,生成 高分子链,如合成橡胶、 合成纤维等。
总结词
烯烃的氧化反应是指烯烃在一定条件下被氧化生成更复杂的有机物。
详细描述
烯烃的氧化反应可以通过多种方式进行,如空气氧化、臭氧氧化、过氧化氢氧 化等。在氧化过程中,烯烃的碳碳双键被氧化成羧基或酮基等含氧官能团,生 成相应的醛、酮、酸等化合物。
烯烃的聚合反应
总结词
烯烃的聚合反应是指多个烯烃分子相互结合形成高分 子化合物的过程。
《烯烃炔烃》ppt课件
目 录
• 烯烃炔烃的简介 • 烯烃的性质 • 炔烃的性质 • 烯烃与炔烃的鉴别 • 烯烃炔烃的应用 • 烯烃炔烃的未来发展
01
烯烃炔烃的简介
烯烃的定义与结构
烯烃的定义
烯烃是一种不饱和烃,其分子中 含有碳碳双键。
烯烃的结构
烯烃的分子结构由一个碳碳双键 和两个碳氢单键组成。
炔烃的定义与结构
炔烃的应用前景展望
炔烃作为一种重要的有机化合物,在合成高 分子材料、药物、农药等领域具有广泛的应 用前景。未来,炔烃有望在生物医用材料、 环保型农药等领域发挥重要作用,为解决人 类社会面临的资源、能源和环境问题提供新 的解决方案。
THANKS
感谢观看
烯烃炔烃在许多化学反应中用作反应剂和催 化剂,如烷基化反应、聚合反应等。
在生物医学领域中作为药 物和生物活性分子
烯烃和炔烃结构及命名

一个sp 一个 杂化轨道
二个sp 二个 杂化轨道
未参与杂化的两个p轨道的对称轴互相垂直且都垂直 未参与杂化的两个 轨道的对称轴互相垂直且都垂直 杂化轨道对称轴所在直线。 于sp杂化轨道对称轴所在直线。 杂化轨道对称轴所在直线
乙炔分子的结构: 乙炔分子的结构:
H C C H
乙炔分子的σ键 乙炔分子的 键
一、 烯烃和炔烃的结构
主要指碳碳双键和碳碳三键的结构。 主要指碳碳双键和碳碳三键的结构。
C C
键能 / kJ mol · 键长 / nm
-1
C C
611 0.134
C C
837 0.120
347 0.154
以上数据表明:碳碳双键和碳碳三键都不是由两个或三个 加 以上数据表明:碳碳双键和碳碳三键都不是由两个或三个σ加 和而成的。 和而成的。
烯烃和炔烃
不饱和烃:含有碳碳重键( 不饱和烃:含有碳碳重键(碳碳双键和碳碳三 的烃。 键)的烃。 烯烃:含有碳碳双键的烃。通式:CnH2n。 烯烃:含有碳碳双键的烃。通式: 炔烃:含有碳碳三键的烃。通式: 2n炔烃:含有碳碳三键的烃。通式:CnH2n-2。 烯炔:同时含有碳碳双键和碳碳三键的烃。 烯炔:同时含有碳碳双键和碳碳三键的烃。
二、 烯烃和炔烃的同分异构
含有四个或四个以上碳原子的烯烃和炔烃不仅 存在碳架异构还存在官能团位置异构 碳架异构还存在官能团位置异构。 存在碳架异构还存在官能团位置异构。
CH3CH2CH CH2
1-丁烯 丁烯
CH3
CH3 C CH2
CH3CH CHCH3
2-丁烯 丁烯
2-甲基丙烯 甲基丙烯 (异丙烯 异丙烯) 异丙烯
存在
原子轨道头碰头交盖成; 成键情况 原子轨道头碰头交盖成; 头碰头交盖成 交盖程度大; 交盖程度大; 轨道对键轴呈圆柱形 圆柱形对称 轨道对键轴呈圆柱形对称 分布 性质 键能较大; 键能较大;可沿键轴自由 旋转; 旋转;键的极化性较小
第六讲 第三章 不饱和烃:烯烃和炔烃(2)
C C
+
H-X
-X -
C=C H
+
+X快
C=C X H
乙烯基碳正离子
由于卤素的吸电子作用, 阶段。 几 1 由于卤素的吸电子作用,反应能控制在加一分子 HX 阶段。 加成, 加成 常用汞盐和铜盐做催化剂。 点 2 与HCl加成,常用汞盐和铜盐做催化剂。 讨 3 与卤化氢的加成,在相应卤离子(如:(CH3 )4N+Cl-)存在下, 与卤化氢的加成,在相应卤离子( 存在下, 论 通常进行反式加成。例如: 通常进行反式加成。例如:
*1. Markovnikov规则 不对称烯烃与氯化氢等极性试剂进行加成反应时, 规则 不对称烯烃与氯化氢等极性试剂进行加成反应时, 氢原子总是加到含氢较多的双键碳原子上, 氢原子总是加到含氢较多的双键碳原子上,氯原子或其它原子或基团则加 到含氢较少的或不含氢的双键碳原子上。这条经验规则简称马氏规则。 到含氢较少的或不含氢的双键碳原子上。这条经验规则简称马氏规则。 例如
CH3CH2CH=CH2 + HBr HAc 80% (CH3)2C=CH2 + HCl CH3CH2CH2CH2Br
~100%
(CH3)2C CH3 Cl
第 六 讲 (6)
*2. 不对称炔烃与卤化氢等极性试剂进行加成反应时,也符合马氏规则。 不对称炔烃与卤化氢等极性试剂进行加成反应时,也符合马氏规则。 Br 例如 (CH3)2CHC CH HBr (CH3)2CHC=CH2 HBr (CH3)2CH C CH3
NaCl CH2=CH2 + Br2 水溶液
Br H2C CH2 Br 1,2-二溴乙烷 二溴乙烷
Cl H2C CH2 Br 1-氯-2-溴乙烷 氯 溴乙烷
有机化学-第三章不饱和烃:烯烃和炔烃

a
18
分子的结构包括分子的构造、构型和构象。
同分异构
构造异构
碳架异构 官能团位次异构 官能团异构
互变异构
立体异构
构型异构
顺反异构 对映异构
构象异构
a
19
当两个双键碳原子均连接不同的原子或基团时,即产 生顺反异构现象。如下列三种形式的烯烃都有顺反异构 体,而其它形式的烯烃则没有顺反异构体。
a
20
3.3 烯烃和炔烃的命名
构 型 异 构 体 : ( I) 和 ( Ⅱ ) 是 由 于 构 型 不 同 而 产 生 的 异 构 体 , 称 为 构 型 异 构 体 (configurational isomers)。构型异构体具有不同的物理性质。
a
17
顺反异构体:像(I)和(Ⅱ)这种构型异构体通常用顺、反 来区别,称为顺反异构体(cis and trans ismers),也称几 何异构体(geometric ismers)。
对于碳原子数相同的烯烃顺反异构体,顺式异构 体的沸点比反式异构体略高,而熔点则是反式异构体 比顺式异构体略高。
a
44
与烷烃相似,折射率也可用于液态烯烃和炔烃的鉴 定和纯度的检验。在分子体系中,由于电子越容易极化, 折射率越高,因此,烯烃和炔烃的折射率一般比烷烃大。
a
45
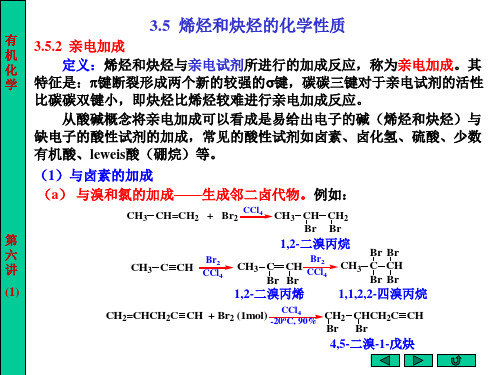
3.5 烯烃和炔烃的化学性质
不饱和链烃分子中同时含有碳碳双键和三键的化合物 称为烯炔。在系统命名法中,选择含有双键和三键在内的 最长碳链作为主链,一般称为“某烯炔”(“烯”在前、 “炔”在后),碳链的编号遵循“最低系列”原则,使双 键、三键具有尽可能低的位次号,其它与烯烃和炔烃命名 法相似。
a
37
但主链编号若双键、三键处于相同的位次供选择时,优 先给双键以最低编号。例如:
有机化学3--- 烯烃和炔烃

3.4 烯烃和炔烃的化学性质
◇ 反应机理和烯烃与卤素的加成相似: 第一步:
第二步:
H X 慢 C C H X
C C
H
X
快
C C
H X
不同的是: 第一步进攻的是H+, 且不生成鎓离子; 第二步X- 的进攻也不一定是反式加成。 ◇ 烯、炔与HX等的加成反应以用于工业生产:
CH2 CH2 HCl AlCl3 130~250℃ CH3CH2Cl
C
Br
速度控制步骤
溴鎓离子
C Br
C
Br
快 Br
Br C C
反式加成产物
3.4 烯烃和炔烃的化学性质
◇ 反应经历溴鎓离子、反式加成。
Br
H C CH 3 C CH3 H Br 2 H3 C H C
+ -
Br H CH 3 H Br
-
H 3C C C
H
C Br
CH 3 CH 3 H C Br C
Br
H2
H
H
C2 H4
H
H
CH2=CH2
H-CH2-CH2-H
3.4 烯烃和炔烃的化学性质
R-C C-R' H2 Pd
R C C
R'
H2 Pd
H
H
RCH2CH2R'
常用催化剂:Pt , Pd , Ni,一般难控制在烯烃阶段。 林德拉(Lindlar)催化剂,一种部分毒化的Pd催化剂,能降 低活性,选择性氢化炔键而不影响烯键,且得顺式烯烃。
同碳数烯烃顺反异构体,因几何形状(结构)不同,物理 性质不同。
CH3 C
H
CH3
H C C
H
不饱和烃的概念

不饱和烃的概念
不饱和烃是一类具有碳—碳双键或三键的有机化合物,其化学结构中存在着不饱和键。
不饱和烃可以分为两大类:烯烃和炔烃。
烯烃是一种具有一条碳—碳双键的不饱和烃,而炔烃则具有一条碳—碳三键。
由于双键和三键的不稳定性,不饱和烃具有较强的化学活性。
它们可以通过加成反应,如氢化、卤代反应等,与其他化合物发生化学反应。
此外,不饱和烃还可以参与自由基反应,如自由基取代反应、自由基加成反应等。
不饱和烃在化学工业、生物学、医学等领域都有广泛的应用。
例如,烯烃被用作合成塑料、橡胶、溶剂等化学品的原料,而炔烃则用于生产气体焊接和切割等工业应用。
虽然不饱和烃在许多方面都有很多应用,但是它们也有一些潜在的危险。
不饱和烃在空气中可以很容易地被氧化,从而产生有毒的化合物,例如臭氧。
此外,不饱和烃也具有较强的致癌性和毒性,因此必须谨慎处理和储存。
- 1 -。
有机化学 第三章讲解

CH 2 =CH 2
+ HO Cl
Cl-CH 2 -CH 2 -OH
-氯乙醇
实际操作时,常用氯和水直接反应。例:
Cl CH 2 =CH 2
Cl 2 -Cl
-
CH 2 Cl
+
CH 2
H 2O -H
+
CH 2
CH 2 (主) OH
Cl -
Cl CH 2
-氯乙醇
CH 2 (副) Cl
33
b a CH 3 -CH=CH
CH 3 CH 3 -C CH-CH 3
30
3 碳正离子
。
H
Cl H
重 排 产 物 (主 )
(d) 过氧化物效应
但有过氧化物存在时:
CH 3 -CH=CH
2
+ HBr
hor
过氧化物
CH 3 CH 2 CH 2 Br (反马)
只能是HBr (HCl、HI都不反马)
31
(丙) 与硫酸加成
烯烃与H2SO4的加成反应也是亲电加成反应,加成方向 遵循马氏规则。例:
2
+ HCl
CH 3 -CH-CH Cl
2-氯丙烷 主要产物
乙酸 80%
3
+ CH 3 CH 2 CH 2 Cl
1-氯丙烷 次要产物
CH 3 CH 2 CH=CH
2
+ HBr
CH 3 CH 2 CH CH Br
HBr
2
H
2-溴丁烷
Br
CH 3 CH 2 CH 2 C CH
HBr
CH 3 CH 2 CH 2 C=CH 2 Br
2
(一) 烯烃和炔烃的结构
知识总结——不饱和烃

知识总结——不饱和烃知识总结,不饱和烃不饱和烃是指分子结构中含有双键或三键的碳氢化合物。
不饱和烃可以进一步分为烯烃和炔烃两大类。
烯烃是指分子中含有一个或多个碳碳双键的碳氢化合物。
烯烃的通式为CnH2n,其中n为双键的个数。
烯烃可以进一步分为直链烯烃和支链烯烃两种。
直链烯烃的双键是连接两个相邻的碳原子,而支链烯烃的双键是连接非相邻的碳原子。
常见的直链烯烃有乙烯(C2H4)和丙烯(C3H6),而异戊二烯(C5H8)是一个常见的支链烯烃。
炔烃是指分子中含有一个或多个碳碳三键的碳氢化合物。
炔烃的通式为CnH2n-2,其中n为三键的个数。
炔烃可以进一步分为直链炔烃和支链炔烃两种。
直链炔烃的三键是连接两个相邻的碳原子,而支链炔烃的三键是连接非相邻的碳原子。
乙炔(C2H2)是一个常见的直链炔烃,而苯(C6H6)是一个常见的支链炔烃。
不饱和烃具有一些特殊的化学性质和应用。
首先,不饱和烃在化学反应中比饱和烃更加活泼。
由于双键或三键的存在,不饱和烃容易发生加成反应、氧化反应、和聚合反应等。
其次,不饱和烃可以通过催化加氢反应转化为饱和烃。
这是一种重要的工业反应,用于生产石化产品和燃料,同时也可以用于制备一些特殊的化学品。
此外,不饱和烃还常被用于制备高分子材料,如聚烯烃和聚炔烃。
不饱和脂肪酸是一种重要的不饱和烃。
它是由长链脂肪酸通过去氢反应或通过叠氮盐还原反应得到的。
不饱和脂肪酸与饱和脂肪酸相比,具有更低的熔点和较强的润滑性。
它是一种重要的工业原料,广泛用于生产润滑油、油墨和塑料等。
在生活中,不饱和烃也有许多应用。
例如,乙烯被用作合成塑料的原料,丙烯被用作合成纤维的原料。
此外,不饱和脂肪酸还被广泛用于食品加工和保健品中,因其对人体有益和具有抗氧化的作用。
总结起来,不饱和烃是一类具有特殊化学性质和广泛应用的碳氢化合物。
它有烯烃和炔烃两大类,具有活泼的化学反应性,可以通过催化加氢反应转化为饱和烃,被广泛应用于石化工业、高分子材料制备和生活中。
第三章 不饱和烃:烯烃和炔烃(7学时)

CH3CH CH C CH
CH C CH2CH CH2
3 –戊烯–1–炔
1–戊烯–4–炔
CH3C C CH CH2CH CH2 CH2CH3
4 –乙基–1–庚烯–5–炔
CH C CH CH2 1–丁烯–3–炔
CH3C C CH CH2CH CHCH3 CH CH2
5 –乙烯基–2–辛烯–6–炔
37
3.5 烯烃和炔烃的化学性质
44
nickel borides
②. P-2(硼化镍)催化剂
CH3CH2C
P2
CCH2CH3 H2
CH3CH2
CH2CH3
CC
H
H
98%
cis-addition
特点:使反应停留在烯烃阶段,得顺式加成产物。
45
炔烃的化学还原
chemical reduction
①. 在液氨中用碱金属(Li、Na、K)还原生成反式烯烃
-杂化-
sp 杂化轨道形成过程示意图
13
14
15
π bond
3.1.3 π 键特性
1)π 键是较弱的共价键,键能比σ键低,易断裂;
2)不能自由旋转。 3)π键的极化度大,具有较大的流动性及反应活性。
一个 sp3 杂化轨道 ¼ s 轨道 ¾ p 轨道
16
3.2 烯烃和炔烃的同分异构
isomerism
不饱和度 ∆
number of double bonds ring numbers
number of triple bond
∆=双键数+环数+2×三键数
∆=C+1-H/2-X/2+N/2
双键数+环数+2×三键数=C+1-H/2-X/2+N/2
有机化学 第三章 不饱和烃

同分异构现象
1.碳链异构:和烷烃一样,
2.官能团位置异构:由于双键或三键位置不同所产生的异构,如:
3. 立体异构:由于双键不能绕σ键键轴旋转,导致相连基团在空间的不同排列方式 产生的异构现象。
顺反异构—— 相同基团在双键同侧为顺式,不同侧为反式
CH3
CH3
CC
H
H
顺式(cis)
本章学习内容
1.烯烃、炔烃等不饱和烃的命名(掌握) 2.烯烃、炔烃及共轭二烯烃的结构特征(理解) 3.烯烃、炔烃、共轭二烯烃的物理、化学性质(重点难点掌握)
3.1 分类
烯烃(alkene):C=C 不饱和烃
单烯烃:含一个双键
多烯烃 :含两个及以上个双键, 含两个双键叫二烯烃
炔烃(alkyne):
H3C CH3CH2
CH2CH2CH3 CH2CH3
Br Cl
Cl
H
顺-3-甲基-4-乙基-3-庚烯 (E)-3-甲基-4-乙基-3-庚烯
反-1,2-二氯-1-溴乙烯 (Z) -1,2-二氯-1-溴乙烯
课堂练习:命名下列化合物
CH3CH2 H
Cl CH3
H3C CH3CH2
CH3 CHCH3 CH2CH2CH3
氯加在含氢多的碳原子上,合成卤代醇的方法。
+ H2C CH2 H O Cl
H2C Cl
CH2 OH
+ H3C CH CH2
H O Cl
H3C
CH OH
CH2 Cl
4. 与卤化氢加成(亲电加成)——碳正离子中间体机理 反应历程:H+首先与双键中的p电子对结合使另一碳原子形成 碳正离子,碳正离子再与X- 结合成卤代烷。
《不饱和烃》 导学案

《不饱和烃》导学案一、学习目标1、了解不饱和烃的概念,包括烯烃、炔烃和芳香烃。
2、掌握不饱和烃的结构特点,能够准确书写其结构式和结构简式。
3、理解不饱和烃的化学性质,如加成反应、氧化反应等。
4、学会鉴别不饱和烃和饱和烃的方法。
二、知识梳理(一)不饱和烃的概念不饱和烃是指分子中含有碳碳双键或碳碳三键的烃类化合物。
常见的不饱和烃有烯烃、炔烃和芳香烃。
(二)烯烃1、定义:含有碳碳双键的烃称为烯烃。
2、通式:CnH2n(n≥2)3、结构特点碳碳双键:由一个σ键和一个π键组成,π键不稳定,容易发生加成反应。
双键碳原子为sp2 杂化,平面结构。
4、物理性质常温下,C2-C4 的烯烃为气体,C5-C18 的烯烃为液体,C19 以上的烯烃为固体。
随着碳原子数的增加,烯烃的沸点和密度逐渐增大。
烯烃难溶于水,易溶于有机溶剂。
5、化学性质加成反应与氢气:CH2=CH2 +H2 → CH3CH3与卤素单质:CH2=CH2 +Br2 → CH2BrCH2Br与卤化氢:CH2=CH2 +HCl → CH3CH2Cl氧化反应燃烧:CnH2n +3n/2 O2 → nCO2 + nH2O使酸性高锰酸钾溶液褪色(三)炔烃1、定义:含有碳碳三键的烃称为炔烃。
2、通式:CnH2n-2(n≥2)3、结构特点碳碳三键:由一个σ键和两个π键组成,三键比双键更不稳定。
三键碳原子为 sp 杂化,直线结构。
4、物理性质常温下,C2-C4 的炔烃为气体,C5 以上的炔烃为液体或固体。
炔烃的沸点和密度随着碳原子数的增加而增大。
炔烃难溶于水,易溶于有机溶剂。
5、化学性质加成反应与氢气:CH≡CH +2H2 → CH3CH3与卤素单质:CH≡CH +2Br2 → CHBr2CHBr2与卤化氢:CH≡CH +HCl → CH2=CHCl氧化反应燃烧:CnH2n-2 +(3n 1)/2 O2 → nCO2 +(n 1)H2O使酸性高锰酸钾溶液褪色(四)芳香烃1、定义:含有苯环结构的烃称为芳香烃。
不饱和烃:烯烃和炔烃

a b C C
(Ⅰ)
a b
a b C
(Ⅱ)
C
d b
a b C
(Ⅲ)
C
d e
(Ⅰ)和(Ⅱ)构型异构体通常用顺、反来区别,成为 顺反异构体。(Ⅲ)用Z,E标记构型。
12
环烯烃,碳原子数少于七个时,由于组成环的碳原子 跨越双键具有很大张力,没有反式异构体。
H
H H
顺-环辛烷
H H H (CH2)6
反-环辛烷
乙
烯
10
3.2 烯烃和炔烃的同分异构
碳架异构 CH2
CHCH2CH3
CH3 CH3 C CH2
烯烃的异构
官能团位次位置异构
H3C
CH3CH
CHCH3
CH2
H
CHCH2CH3
顺反异构
H C H 3
C
C
CH3 H
(Ⅰ)
H
H C H3C C
(Ⅱ)
11
CH3
顺反异构是构型异构,属立体异构现象 当两个双键原子均连接不同的原子或基团时,即产生 顺反异构现象。
第三章 不饱和烃:烯烃和炔烃
3.1 3.2 3.3 3.4 3.5 3.6 烯烃和炔烃的结构 烯烃和炔烃的同分异构 烯烃和炔烃的命名 烯烃和炔烃的物理性质 烯烃和炔烃的化学性质 烯烃和炔烃的工业来源和制法
1
概述
不饱和烯烃:含有碳碳双键或碳碳叁键的烃
烯烃:含有碳碳双键的烃
炔烃:含有碳碳叁键的烃 烯炔:同时含有碳碳双键和碳碳叁键的烃 烯烃的通式:CnH2n 炔烃的通式:CnH2n-2
ΔH= -173kJ· mol-1
Cl
Cl
加成反应往往为放热反应
碳碳三键的化学性质
第3章 不饱和烃:烯烃和炔烃

第三章不饱和烃:烯烃和炔烃♦烯烃/炔烃的结构、同分异构和命名;烯烃炔烃的化学性质;♦/♦烯烃亲电加成反应的历程和马氏规则;♦乙烯氢和烯丙氢的含义和反应特点;♦掌握烯烃的自由基加成反应。
♦烯烃的系统命名法;♦烯烃的亲电加成反应和马氏规则、氧化反应。
3.1 烯烃和炔烃的结构3.1.1碳碳双键的组成 3.1.1 碳碳双键的组成含有碳碳双键的不饱和烃叫做烯烃,单烯烃分子中只有一个双键;碳碳双键叫做烯键, 是烯烃的官能团。
单烯烃的通式是C n H 2n ;H H CC 最简单的烯烃是乙烯:HH C C)一) 乙烯的结构H 1170.108nm H H 0.133nm 物理方法证明: 1. 所有碳原子和氢原子共平面;键角接2. 键角接近120°;3.双键键长0.133nm 比单键键长0.154nm 短;4. 双键键能611kJ/mol 小于单键键能两倍347×2=694 kJ/mol347264kJ/l611-347 =264 kJ/mol二)碳原子的SP 2C 2p 2p激发2s 2s2p 2p sp 2杂化sp 2 C = C sp 2-sp 2 σ键2p 2p 2p-2p π键{2>C 3电负性:C sp C sp二) 双键的结构π键不同于σ键, π键具有以下特点:1.π键无轴对称, 不能自由旋转;2. π键键能比σ键能小;611-347=264kJ/mol 3. π电子云具有流动性;C=C 键能C-C 键能破坏π键的能量π电子云位于成键原子的上下两层, 原子核对π电子云的束缚能力弱, 因此, π键易被试CC 剂进攻发生反应, π键比σ键更活泼。
3.1.2 碳碳三键的组成炔烃的结构乙炔是最简单的炔烃, 为线型分子。
H C C H炔烃的官能团是碳碳三键, 碳原子是sp杂化, 两个sp轨道在同一条直线上。
碳碳三键的特点:①炔烃的亲电加成活性不如烯烃。
原因:两个碳原子之间电子云密度大;C-C 键长短, 使π键的重叠程度大;②碳碳三键上的氢炔-H 有一定的酸性。
《烯烃炔烃》炔烃的结构与性质

《烯烃炔烃》炔烃的结构与性质在有机化学的世界里,烯烃和炔烃是两类非常重要的不饱和烃。
今天,咱们就专门来聊聊炔烃的结构与性质,一起揭开它神秘的面纱。
先来说说炔烃的结构。
炔烃的分子中含有碳碳三键(C≡C),这是它最显著的结构特征。
以最简单的炔烃——乙炔(C₂H₂)为例,两个碳原子之间通过一个三键相连,每个碳原子还分别与一个氢原子结合。
碳碳三键是由一个σ 键和两个π 键组成的。
这σ 键比较“坚强”,键能较大,而两个π 键则相对“脆弱”一些。
由于三键的存在,炔烃分子中的碳原子采取 sp 杂化。
这种杂化方式使得碳原子的两个 sp 杂化轨道在同一直线上,分别与氢原子或其他原子形成σ 键,而未参与杂化的两个p 轨道则相互垂直,与另一个碳原子的两个p 轨道“肩并肩”重叠,形成两个π 键。
接下来看看炔烃的物理性质。
通常情况下,随着碳原子数的增加,炔烃的沸点和熔点逐渐升高。
不过,总体来说,炔烃的沸点和熔点比相同碳原子数的烷烃和烯烃要低一些。
在常温常压下,含四个碳原子以下的炔烃大多是气态,从五个碳原子开始逐渐变为液态和固态。
再来说说炔烃的化学性质。
由于碳碳三键的存在,炔烃具有一些独特的化学反应。
首先是加成反应。
这就像是炔烃的“好客”特性,它很愿意与其他物质结合。
比如,与氢气发生加成反应,可以生成相应的烯烃或烷烃。
如果是和卤素(如氯气、溴气)加成,会分步进行,先加成一个卤素原子,形成二卤代烯烃,然后再继续加成,得到四卤代烷烃。
和卤化氢的加成也类似,遵循马氏规则。
其次是氧化反应。
炔烃在一定条件下可以被氧化,比如在高锰酸钾等强氧化剂的作用下。
不过,炔烃的氧化反应比烯烃要复杂一些,产物会因反应条件的不同而有所差异。
然后是聚合反应。
就像小伙伴们手拉手组成一个团队一样,炔烃分子也可以相互连接起来,形成高分子化合物。
比如,乙炔在特定条件下可以聚合成聚乙炔。
还有金属炔化物的生成。
这是炔烃的一个有趣的性质。
比如,乙炔与银氨溶液或亚铜氨溶液反应,可以生成白色的乙炔银沉淀或红棕色的乙炔亚铜沉淀。
不饱和烃 烯烃和炔烃

?比较下列反应产物:
CH2CH=CH 2
H+ H2O
1) BH3 2)H 2O 2/OH -
CH2CHCH3
2o
OH
CH2CH2CH2OH
1o
应用:不对称的末端烯烃经硼氢化 —氧化反应可以得
到相应的伯醇,是 制备伯醇 的一个很好的方法 . ?
氢硼烷通常情况下是易燃、剧毒的气体,必须
现用现制备,如上反应式用稳定的常规试剂硼
氢化钠(NaBH4)与三氟化硼(BF3)的乙醚 溶液(Et2O)混合后即可缓慢放出,用管道直接 通到反应瓶里即可。
但两者并不完全等同,有时矛盾。如:
H3C
CH2CH2CH3
Br
Cl
CH2 CH3
CH2CH3
(E)- 或 (顺)-
Cl
H
(Z)- 或(反)-
请用E/Z命名体系命名化合物:
i-Pr
Cl
s-Bu
Et
试判断下列化合物有无顺反异构,如果有则写出其构 型和名称。
1、异丁烯
CH 3
无顺反异构。 H2C C
CH3
π键固定了σ键 使其不能自由旋转! 造就了6个原子共处一 个平面,顺反异构!
碳原子上尚有一个未参加杂化的 p轨道,它们的对称轴 垂直于乙烯分子所在的平面, p轨道相互平行以侧面相 互交盖而形成? 键。
碳碳单键和双键电子云分布的比较
C-C ? 键
C-C ? 键
电子云集中 在两核之间,
不易与外界 试剂接近
此烯烃命名的关键是双键的构型。 比较:左端:3号碳上连接,即第1级:CHH,而丙基的第1级也是:CHH。 不分胜负。再进行第二级比较:2号碳上的元素是:CCH。 而丙基的第2碳上是CHH,所以,划掉相同部分,就知道异丁基大于 正丙基。 右端:黑字部分:第1级(6号碳):CHH, 红字部分第1级(红6号碳): 也是CHH。比较不出胜负。再进行第2级比较:黑7号碳连接了:CHH。 红7号碳,也是CHH。不分胜负。继续向下进行:黑8号碳:是ClCH 而黑8号碳连得是:CCH。显然,划掉相同部分,Cl的原子序数>C 所以:黑字部分优于红字部分。如此:此烯烃的构型是Z式!
第二节烯烃和炔烃一、不饱和链烃的结构

4. 生成金属炔化物的反应
凡是具有-C≡CH结构的炔烃,叁键碳上的氢原子较为活 泼,可被金属原子取代生成金属炔化物。
CH≡CH + 2[Ag(NH3)2]NO3 → AgC≡CAg↓+2NH3+ NH4NO3
硝酸银氨
乙炔银(白色)
CH≡CH + 2[Cu(NH3)2]Cl → CuC≡CCu↓+2NH3+ NH4Cl
CH3C ≡ CCHCH3 CH2CH2CH3
4-甲基-2-庚炔
பைடு நூலகம்
三、不饱和链烃的化学性质
(一)物理性质 (二)化学性质
π键不稳定,易发生加成、氧化、聚合等反应。
1. 加成反应:π键断开,双键碳原子分别与其它的原子或原 子团结合的反应。
(1)催化加氢 RCH=CH2 + H2 Pt RCH2CH3
RC≡ CH
H2 Pt
RCH=CH2
H2 Pt
RCH2CH3
(2)加卤素
RCH=CH2 + Cl2 CCl4 RCHCH2 Cl Cl
RC≡
CH
CCl4 Br 2
RC=CH CCl4 Br 2
RCBr2CBr2
Br Br 溴的红棕色消失
可用溴水鉴别 不饱和链烃
(3)与卤化氢加成
Ø 烯烃的通式为CnH2n。
3.烯烃的同分异构现象 (1)碳链异构和位置异构
CH2=CHCH2CH3
CH3CH=CHCH3
1丁烯
2丁烯
CH3C=CH2 CH 3
2甲基1丙烯
(2)顺反异构
H3C
CH3
C=C
H
《烯烃炔烃》炔烃的稳定性探讨

《烯烃炔烃》炔烃的稳定性探讨《烯烃炔烃——炔烃的稳定性探讨》在有机化学的广袤领域中,烯烃和炔烃是两类非常重要的不饱和烃。
它们具有独特的结构和性质,而其中炔烃的稳定性一直是研究的焦点之一。
要探讨炔烃的稳定性,首先得了解炔烃的结构。
炔烃分子中含有碳碳三键,这是其最为显著的结构特征。
碳碳三键由一个σ 键和两个π键组成。
相比于烯烃中的碳碳双键(一个σ 键和一个π 键),炔烃中的π 键更强,电子云密度更大。
然而,这种更强的π 键并不意味着炔烃就一定更稳定。
实际上,在很多情况下,烯烃比炔烃更稳定。
这是为什么呢?从电子因素来看,炔烃中的π 电子云呈圆柱形对称分布,其重叠程度相对较小,导致π 键的稳定性不如烯烃中的π 键。
而且,由于炔烃的电子云密度较大,容易受到亲电试剂的进攻,这在一定程度上降低了其稳定性。
从空间因素考虑,炔烃中的碳碳三键使得分子的空间位阻较大。
相比之下,烯烃中的碳碳双键所带来的空间位阻较小,分子的构象更加灵活,有利于能量的分散,从而增强了稳定性。
再来看取代基对炔烃稳定性的影响。
当炔烃分子中存在给电子取代基时,能够向三键提供电子,增加分子的电子密度,从而提高其稳定性。
但这种影响相对较小,因为炔烃本身的电子云分布特点限制了给电子取代基的作用效果。
相反,当存在吸电子取代基时,会削弱炔烃的稳定性。
在化学反应中,炔烃的稳定性也有所体现。
例如,在加氢反应中,炔烃需要更高的条件才能被完全加氢转化为烷烃,这说明炔烃相对于烯烃更难发生加成反应,从侧面反映出其稳定性较差。
另外,与其他物质的反应活性也能反映炔烃的稳定性。
炔烃在与卤素等试剂的反应中,通常比烯烃反应活性低,这也是因为其稳定性相对较弱。
然而,我们也不能一概而论地说炔烃总是比烯烃不稳定。
在某些特定的环境和条件下,炔烃也可能表现出相对较高的稳定性。
比如,在一些具有特殊空间结构的分子中,炔烃的结构可能更有利于分子的稳定存在。
总之,炔烃的稳定性是一个相对复杂的问题,受到多种因素的综合影响。
第三章不饱和烃烯烃和炔烃

同理,B 氧化后生成丙酮和 CO2, (CH3)2C 和 CH2 ,把二者连接起来,即得到 B 的构
造异构式为 (CH3)2C=CH2 。C 氧化后仅生成乙酸,说明它未氧化前具有 CH3CH ,而它和
化合物 A、B 为同分异构体,都是含四个碳原子的烯烃说明它具有对称结构,把两个
CH3CH 连接起来,即得到 C 的构造式CH3CH=CHCH3 。
CH3
CH CH3
H3C CH C CH CH3
4,4-二甲基-2-戊烯
3-甲基-1-丁炔
通常将碳碳双键处于端位的烯烃,统称α-烯烃。碳碳三键处于端位的炔烃,一般称为端
位炔烃。
2、烯烃顺反异构体的命名
顺反命名法:
两个相同原子或基团处于双键碳原子同一侧的称为顺式,反之称为反式。但当两个双键
碳原子所连接的四个原子或基团都不相同时,则难用顺反命名法命名。
2)在满足最低系列原则下,优先考虑双键,使其具有较小编号;
3)书写:称某碳“烯”某“炔”;
4)若双键和三键处于相同的位次供选择时,优先给双键较低编号。
HC C CH2 CH2 CH CH2
1-己烯-5-炔
二、结构与性质
1、结构: 烯烃为 sp2 杂化,余下一个未参与杂化的 p 轨道,垂直与三个杂化轨道对称轴所在的平
臭氧化: 生成醛和/或酮。根据生成醛和酮的结构,就可推断烯烃的结构。炔烃与臭氧反应生成羧 酸。 臭氧除和碳碳三键以及双键外,其他官能团很少反应,分子的碳架也很少发生重排,故 此反应可根据产物的结构测定重键的位置和原化合物的结构。 环氧化反应: 烯烃与过氧酸(简称过酸)反应生成 1,2-环氧化物,常用的过氧酸有过氧甲酸、过氧 乙酸、过氧苯甲酸、过氧间氯苯甲酸、过氧三氟乙酸等。 3)α-氢原子的反应
