人教版九年级上册化学:第五单元-全单元课件
合集下载
九年级化学人教版第五单元课件

例:在化学反应A+B2=AB2中,A与B2反应的质 量关系如图所示。将5gA与8gB2充分反应,则 生成AB2的质量是( A)
A.10g B.13g C.16g D.18g
解题关键:从坐标图判断参加反应的反应物的质量 关系为1∶1,则5gA与8gB2反应,只能反应掉5gB2。
活动与探究一:
方案一:白磷燃烧前后质量的测定
方案二:铁与硫酸铜溶液反应前后 质量的测定
提出问题:
化学反应中反应前各反应物的质量总和与反应 后各生成物的质量总和之间可能有哪几种关系呢?
作出假设: 大于
生成物的质量总和 等于 反应物的质量总和
小于
实验方案 方案一
方案二
白磷燃烧,产生 铁钉表面覆盖一层
2、参加化学反应的各物质的质量总和并 不是各物质的任意质量之和,不参加反 应的物质的质量不能计算在内。
3、质量守恒定律适用于一切化学变化
电解水的微观过程
守恒原因:化学反应前后原子的种类、数 目和质量没有改变。
为什么化学变化前后物质的总质量不变?
宏观
微观
元素种类 不 元素质量 变
原子种类 原子数目 原子质量
实验现象 大量白烟;气球 红色物质,溶液由
先膨胀后缩小 蓝色变成浅绿色
反应前后
各物质质
相等
相等
量总和
分析
P+O2点燃 P2O5 Fe+CuSO4 Cu+FeSO4
质量总和 质量总和 质量总和 质量总和
质量守恒定律:
参加化学反应的各 物质的 质量总和等于反应后生成的各 物质的质量总和。
注意
1、“总和”意味着把各种状态的反应物 和生成物都算在内。 如沉淀、肉眼看不到的气体
A.10g B.13g C.16g D.18g
解题关键:从坐标图判断参加反应的反应物的质量 关系为1∶1,则5gA与8gB2反应,只能反应掉5gB2。
活动与探究一:
方案一:白磷燃烧前后质量的测定
方案二:铁与硫酸铜溶液反应前后 质量的测定
提出问题:
化学反应中反应前各反应物的质量总和与反应 后各生成物的质量总和之间可能有哪几种关系呢?
作出假设: 大于
生成物的质量总和 等于 反应物的质量总和
小于
实验方案 方案一
方案二
白磷燃烧,产生 铁钉表面覆盖一层
2、参加化学反应的各物质的质量总和并 不是各物质的任意质量之和,不参加反 应的物质的质量不能计算在内。
3、质量守恒定律适用于一切化学变化
电解水的微观过程
守恒原因:化学反应前后原子的种类、数 目和质量没有改变。
为什么化学变化前后物质的总质量不变?
宏观
微观
元素种类 不 元素质量 变
原子种类 原子数目 原子质量
实验现象 大量白烟;气球 红色物质,溶液由
先膨胀后缩小 蓝色变成浅绿色
反应前后
各物质质
相等
相等
量总和
分析
P+O2点燃 P2O5 Fe+CuSO4 Cu+FeSO4
质量总和 质量总和 质量总和 质量总和
质量守恒定律:
参加化学反应的各 物质的 质量总和等于反应后生成的各 物质的质量总和。
注意
1、“总和”意味着把各种状态的反应物 和生成物都算在内。 如沉淀、肉眼看不到的气体
人教版九年级上册化学第五单元全部课件

化学反应的微观实质:分子分成原子,原子重 新组合成新分子。
宏观
化学反应前后变化
不变
改变
可能改变
元素种类 元素质量 物质的种类 元素的化合价
微观
原子种类 原子数目 分子的种类 原子质量
分子数目
知识点 3 化学方程式
点燃
C+O2==CO2
定义:用化学式来表示化学反应的式子。
化学方程式的意义
1 表示反应物、生成物、反应条件
探究实验 3 盐酸和碳酸钠溶液反应前后质量的测定
现象:产生大量气泡 ,天平示数
点
减小
击
图 片
结论:生成物的质量小于反应物的
播
质量
放
文字表达式:
碳酸钠+盐酸→氯化钠+水+二氧化碳
探究实验 4 镁带燃烧前后质量的测定
现象:剧烈燃烧,发出耀眼白光,
点
生成白色固体物质
击 图
结论:生成物的质量大于反应物
片
A.56g
B.62g
C.52g
D.60g
6. 将25g氯酸钾和6g二氧化锰的混合物加热一段 时间后,得到残余固体的质量为22 g,则产生氧气 __9__g。
能力提升题
1.甲、乙、丙、丁四种物质混合后,在一定的条件下充分
反应,测得反应前后各物质的质量分数如下表所示。下列说
法正确的是( B )
甲乙丙 丁
烟,最终反应前后示数相等
片
结论:磷在燃烧前后质量没有
播 放
发生变化
文字表达式:
磷+氧气→五氧化二磷
【思考】为什么磷在燃烧前后质量没有发生变化呢?
反应前物质(或物体) 反应后物质(或物体)
宏观
化学反应前后变化
不变
改变
可能改变
元素种类 元素质量 物质的种类 元素的化合价
微观
原子种类 原子数目 分子的种类 原子质量
分子数目
知识点 3 化学方程式
点燃
C+O2==CO2
定义:用化学式来表示化学反应的式子。
化学方程式的意义
1 表示反应物、生成物、反应条件
探究实验 3 盐酸和碳酸钠溶液反应前后质量的测定
现象:产生大量气泡 ,天平示数
点
减小
击
图 片
结论:生成物的质量小于反应物的
播
质量
放
文字表达式:
碳酸钠+盐酸→氯化钠+水+二氧化碳
探究实验 4 镁带燃烧前后质量的测定
现象:剧烈燃烧,发出耀眼白光,
点
生成白色固体物质
击 图
结论:生成物的质量大于反应物
片
A.56g
B.62g
C.52g
D.60g
6. 将25g氯酸钾和6g二氧化锰的混合物加热一段 时间后,得到残余固体的质量为22 g,则产生氧气 __9__g。
能力提升题
1.甲、乙、丙、丁四种物质混合后,在一定的条件下充分
反应,测得反应前后各物质的质量分数如下表所示。下列说
法正确的是( B )
甲乙丙 丁
烟,最终反应前后示数相等
片
结论:磷在燃烧前后质量没有
播 放
发生变化
文字表达式:
磷+氧气→五氧化二磷
【思考】为什么磷在燃烧前后质量没有发生变化呢?
反应前物质(或物体) 反应后物质(或物体)
人教版九年级化学上册 第五单元 化学方程式(3个课题)PPT课件(共61张PPT)

(1)发生反应的NaOH的质量。
(2)空气中SO2的质量分数(计算结果精确到0.01%)
小结:
根据化学方程式计算要求: 化学方程式要配平 需将纯量代方程 关系式对关系量 计算单位不能忘 关系量间成比例 解设比答要牢记
酸钙多少吨?
解:设制取10吨氧化钙需要碳酸钙的质量为X
高温
CaCO3 100
CaO + CO2↑ 56
X
10t
100
56
100×10t
=
X=
X
10t
56
答:略。
=17.9t
讨论练习
氢气在氯气中燃烧生成氯化氢气体,燃烧100g氢气 需要氯气多少克?生成氯化氢气体多少克?
解:设燃烧100g氢气需要氯气的质量为X,生成氯化氢气
方案三
将稀盐 酸倒入 烧杯中
想一想
碳酸钠+盐酸→ 氯化钠+水+二氧化碳
再想想
向澄清 石灰水 中吹气
氢氧化钙+二氧化碳→ 碳酸钙+水
铁丝燃烧
木材的燃烧
蜡烛燃烧后什么 也没有留下,难道物 质从世上消失了吗?
蜡烛燃烧时生成了水和二氧化碳,
讨论质量守
根据质量守恒定律,参加反应的 恒定律时,
蜡烛和氧气的质量总和一定等于
1、根据实验事实写出反应物和生成物的化学式
P + O2 —— P2O5 2、配平化学方程式(使反应前后各原子数目相 等)
4P + 5O2 —— 2P2O5
3、注明:反应条件(点燃、加热“△”、高温、通
电、催化剂)、生成物状态(气体↑或沉淀↓)
点燃
4P + 5O2 ==== 2P2O5
4. 改横线为等号
3、表示反应物中磷原子、氧分子和生成物中五 氧化二磷分子的个数比为4∶5∶2。
(2)空气中SO2的质量分数(计算结果精确到0.01%)
小结:
根据化学方程式计算要求: 化学方程式要配平 需将纯量代方程 关系式对关系量 计算单位不能忘 关系量间成比例 解设比答要牢记
酸钙多少吨?
解:设制取10吨氧化钙需要碳酸钙的质量为X
高温
CaCO3 100
CaO + CO2↑ 56
X
10t
100
56
100×10t
=
X=
X
10t
56
答:略。
=17.9t
讨论练习
氢气在氯气中燃烧生成氯化氢气体,燃烧100g氢气 需要氯气多少克?生成氯化氢气体多少克?
解:设燃烧100g氢气需要氯气的质量为X,生成氯化氢气
方案三
将稀盐 酸倒入 烧杯中
想一想
碳酸钠+盐酸→ 氯化钠+水+二氧化碳
再想想
向澄清 石灰水 中吹气
氢氧化钙+二氧化碳→ 碳酸钙+水
铁丝燃烧
木材的燃烧
蜡烛燃烧后什么 也没有留下,难道物 质从世上消失了吗?
蜡烛燃烧时生成了水和二氧化碳,
讨论质量守
根据质量守恒定律,参加反应的 恒定律时,
蜡烛和氧气的质量总和一定等于
1、根据实验事实写出反应物和生成物的化学式
P + O2 —— P2O5 2、配平化学方程式(使反应前后各原子数目相 等)
4P + 5O2 —— 2P2O5
3、注明:反应条件(点燃、加热“△”、高温、通
电、催化剂)、生成物状态(气体↑或沉淀↓)
点燃
4P + 5O2 ==== 2P2O5
4. 改横线为等号
3、表示反应物中磷原子、氧分子和生成物中五 氧化二磷分子的个数比为4∶5∶2。
人教版九年级化学上册课件全册课件-2024鲜版

2024/3/27
12
空气
空气的组成
空气主要由氮气、氧气、稀有气 体、二氧化碳等组成。
2024/3/27
空气的性质
空气无色无味,具有一定的密度和 压强,是一种混合物。
空气的作用
空气是人类和动植物生存的必要条 件,参与生物圈的物质循环和能量 流动。
13
氧气
氧气的物理性质
氧气是一种无色、无味、不易溶 于水的气体,密度比空气略大。
计算中的注意事项
正确书写化学方程式并配平;准确找出已知量与未知量的比例关系;注意单位换算和计算 结果的准确性。
28
07 第六单元 碳和碳 的氧化物
2024/3/27
29
金刚石、石墨和C
金刚石
自然界中最硬的物质,具有高热导率、高硬度等特点,用于切割、 磨削、钻探等领域。
石墨
具有润滑性、耐高温、导电导热等特性,被广泛应用于铅笔芯、润 滑剂、电极等领域。
探究水污染的原因和危害
探讨保护水资源的措施
分析水污染的主要来源,如工业废水、生 活污水等,以及水污染对生态环境和人类 健康的影响。
2024/3/27
提出节约用水、防治水污染、保护水环境等 具体措施,以及国家和个人在保护水资源方 面的责任和义务。
21
水的净化
2024/3/27
了解水的净化方法和原理
介绍沉淀、过滤、吸附、蒸馏等常用 的水净化方法,以及它们的原理和应 用范围。
2024/3/27
26
如何正确书写化学方程式
01
书写化学方程式的步骤
写出反应物和生成物的化学式;配平化学方程式;注明反应条件和生成
物的状态。
02
书写化学方程式的注意事项
初中化学人教九年级上册第五单元 化学方程式 第五单元课题质量守恒定律PPT

质量守恒定律概念要点:
参加化学反应的各物质的质量总和,等 于反应后生成的各物质的质量总和。
1、“总和”意味着把各种状态的反应物和生成物都算在
内。如沉淀、肉眼看不见的气体也应考虑。
2、参加化学反应的各物质的质量总和并不是各物质
的任意质量之和,不参加反应的物质的质量不能计算 在内。
3、质量守恒定律的“守恒”,是指质量守恒,而不是
1 :1 : 1
3、化学方程式的读法:
C + O2点燃 CO2
1.宏观的方面:碳和氧气在点燃条件下反应生成二氧化碳。
2微观方面:1个碳原子和1个氧分子反应生成1个二 氧化碳分子。 3.量的方面:每12份质量的碳和32份质量的氧气完全 反应生成44份质量的二氧化碳。
课本P97讨论
化学方程式提供的信息: 1.那些物质参加了反应(反应物)
元素的化合价
可 能
改
变
分子数目
小结:
内定容义
质
量
守
原因
恒
定 律
应用
参加化学反应的各物质 的质量总和等于反应后 生成的各物质的质量总和
原子种类没有改变 原子数目没有增减 原子质量没有变化
进行有关的计算 推测一些物质的组成 解释一些实验事实
质量守恒定律的简单应用. 1、6g的碳在充足的氧气中燃烧,生成二氧 化碳22 g ,则有__1_6_g 的氧气参加反应。
2、 将25 g氯酸钾和1g二氧化锰的混合物加 热至完全分解,得到残余固体质量为14 g, 则产生氧气_1_2__g。
3、已知石蜡是蜡烛的主要成分,蜡烛在 空气中完全燃烧后的产物是CO2和H2O, 判断石蜡中一定含有__C、__H___元素,可 能含有__O_元素。
人教部编版九年级化学上册《第5单元 化学方程式【全单元】》精品PPT优质课件

(2) H2 + O2
H2O
点燃
(3)2H2 + O2
2H2O
导入新课
认知与了解
学习目标
1.了解化学方程式的书写原则。 2.掌握化学方程式书写的步骤。(重点) 3.能正确书写并配平简单的化学方程式。(难点)
讲授新课
一 化学方程式的书写
观察与思考
1.化学方程式的书写原则 (1)必须以客观事实为基础。 (2)必须遵守质量守恒定律。
讲授新课
实验与探究
讲授新课
实验与探究
方案二: 【实验原理】 铁+硫酸铜 【实验步骤】
铜+硫酸亚铁
在锥形瓶中倒入适量的CuSO4溶液,塞好 橡皮塞,几根铁钉(用砂纸打磨光亮),将
其放入天平上称量,记录数据m1;将铁丝 伸入CuSO4溶液中,过一会,观察现象? 再将其放在天平上称量,记录数据m2。
讲授新课
讲授新课
观察与思考
水通电分解的微观展示
讲授新课
交流与讨论
化学变化的实质是: 化学反应的过程,就是参加反应的各物质(反应物)的原 子重新组合而生成其他物质(生成物)的过程,由分子构 成的物质在化学反应中的变化过程可表为:
分子 分解为 原子 重组 新分子
讲授新课
交流与讨论 化学反应前后
宏观
微观
元素种类 元素质量
说出该方程式所表达的含义
点燃
S+O2
SO2
(1)硫和氧气在点燃的条件下反应生成二氧化硫; (2)每32份质量的硫与32份质量的氧气恰好完全反应生成64
份质量的二氧化硫; (3)该反应中微粒的个数比为1∶1∶1。
导入新课
观察与思考
判断下列方程式的正误,并说明原因。
人教版九年级上册化学 第五单元 化学方程式复习课件(共43张PPT)
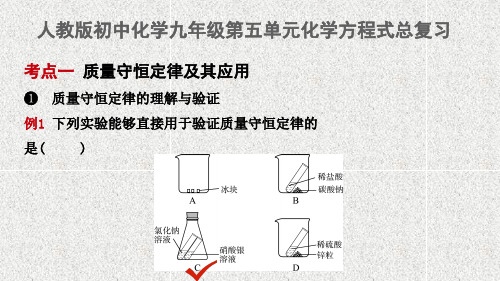
人教版初中化学九年级第五单元化学方程式总复习
考点一 质量守恒定律及其应用
❶ 质量守恒定律的理解与验证
例1 下列实验能够直接用于验证质量守恒定律的
是(
)
【思路解析】 首先质量守恒定律的适用范围是化学反应,其次在设计有 气体参加或生成的实验时需要在密闭容器中进行。
❷ 运用质量守恒定律推断物质化学式
例2 钛和钛合金被认为是21世纪的重要金属材料,在冶炼金属钛时会发生
【思路解析】 先明确坐标曲线中横纵坐标代表的量,其次明确曲线的三 点——起点、拐点、终点,以及平台所代表的意义。结合由题干以及坐标 曲线获得的信息,根据化学方程式中的质量关系解答。
随堂练习
6.某化学课外活动小组测定长期放置的铁粉中铁单质的百分含量。他们 准确称量两份质量各为10.0 g的铁粉样品,分别进行如图操作:
【思路解析】 通过某反应的化学方程式可得到的信息有反应条件,反应 物、生成物各物质间的质量关系,反应体系中微观粒子的数量关系,反应 类型,元素化合价的变化;无法获得的信息有反应速率,反应过程中的能 量变化。
❷ 化学方程式的书写
例6 下列化学方程式书写正确的是( )
A.2NaOH+CuSO4===Cu(OH)2↓+NaSO4
考点二 化学方程式
❶ 化学方程式的意义
例5 镁条在氧气中燃烧的化学反应可用“2Mg+O2 2MgO”来表示。以下信息:①反应条件 ②反应速率 ③反应物、生成物
各物质间的质量关系 ④反应的微观过程 ⑤反应过程中的能量变化 ⑥
反应体系中微观粒子的数量关系。能从上述化学方程式中获得的是(
)
A.①③④ B.②③⑤ C.①③⑥ D.②④⑥
原子。
(1)该化学反应中,发生变化的是 反应的两种分子的个数比为 。
考点一 质量守恒定律及其应用
❶ 质量守恒定律的理解与验证
例1 下列实验能够直接用于验证质量守恒定律的
是(
)
【思路解析】 首先质量守恒定律的适用范围是化学反应,其次在设计有 气体参加或生成的实验时需要在密闭容器中进行。
❷ 运用质量守恒定律推断物质化学式
例2 钛和钛合金被认为是21世纪的重要金属材料,在冶炼金属钛时会发生
【思路解析】 先明确坐标曲线中横纵坐标代表的量,其次明确曲线的三 点——起点、拐点、终点,以及平台所代表的意义。结合由题干以及坐标 曲线获得的信息,根据化学方程式中的质量关系解答。
随堂练习
6.某化学课外活动小组测定长期放置的铁粉中铁单质的百分含量。他们 准确称量两份质量各为10.0 g的铁粉样品,分别进行如图操作:
【思路解析】 通过某反应的化学方程式可得到的信息有反应条件,反应 物、生成物各物质间的质量关系,反应体系中微观粒子的数量关系,反应 类型,元素化合价的变化;无法获得的信息有反应速率,反应过程中的能 量变化。
❷ 化学方程式的书写
例6 下列化学方程式书写正确的是( )
A.2NaOH+CuSO4===Cu(OH)2↓+NaSO4
考点二 化学方程式
❶ 化学方程式的意义
例5 镁条在氧气中燃烧的化学反应可用“2Mg+O2 2MgO”来表示。以下信息:①反应条件 ②反应速率 ③反应物、生成物
各物质间的质量关系 ④反应的微观过程 ⑤反应过程中的能量变化 ⑥
反应体系中微观粒子的数量关系。能从上述化学方程式中获得的是(
)
A.①③④ B.②③⑤ C.①③⑥ D.②④⑥
原子。
(1)该化学反应中,发生变化的是 反应的两种分子的个数比为 。
九年级化学全册(人教版)课件:第五单元单元总结

一个“可能变”
写:左写反应物的化学式,右写生成物的化学式,中 间连“短线”
配平化学方程式的依据——质量守恒定律
化 书写 配 配平化学方程式的方法——观察法、奇数配偶法、
学 步骤
最小公倍数法等
方
注:注明反应条件和生成物状态( “点燃” “△”
程 式
“催化剂” “↑”“↓”等)
改:将短线改为等号,检查原子个数是否对应相等
应用
表示化学反应 根据化学方程式进行计算的习题类型
计算题格式 的规范化
设:根据题意设未知数 写:正确写出反应的化学方程式 标:标明相关物质的相对分子质量以及
已知量和未知量 解:列出比例式并求解 答:简明地写出答案
考纲要求
1. 质量守恒定律。(认识) 2. 说明化学反应中的质量关系。(理解) 3. 正确书写简单的化学方程式 。(理解) 4. 根据反应化学方程式进行简单的计算。(理解) 5. 定量研究对化学科学发展的重大作用。(认识)
A. C2H4
B. CH3OH
C. C2H5OH
D. C2H6
4. (2015西藏)化学上常用燃烧法测定有机物的组
成。现取2.3 g某有机物在氧气中充分燃烧生成4.4 g
CO2和2.7 g H2O,下列说法正确的是 A. 该有机物中只含有碳、氢两种元素
( B)
B. 实验中消耗氧气的质量为4.8 g
C. 该有机物中碳、氢元素的质量比为6∶1
真题演练
1.(2015湘潭)古代“银针验毒”的原理是:4Ag+
2H2S+O2 2X+2H2O,X的化学式为
( C)
A. AgS
B. Ag2O
C. Ag2S
D. Ag2O2
人教版化学九年级上册第五单元《化学方程式》教学课件

D. 该反应是分解反应
易错提醒:质量守恒的表格题中一般给出的数据是反 应前质量和反应后质量,但能代入质量守恒定律等式 计算的是参加反应的物质质量和反应生成的物质质量, 质量前后减少了的是反应物,质量前后增加了的是生 成物。 正解:根据反应前后质量的变化来判断反应物还是生 成物,甲反应前是3 g,反应后是10 g,质量增加了 7 g,是生成物;丙反应前是20 g,反应后是8 g,质 量减少了12 g,是反应物;而乙的质量反应前后都不 变,不是反应物也不是生成物,根据质量守恒定律,
人教版化学九年级
上册
教材分析
元素符号、化学式、化学方程式是九年级化学入门的三种重要化学 用语,只有掌握了它们,才能为我们今后更好地学化学打下坚实的基 础。
从本单元起,学生对化学的学习将由生成何种物质向生成多少物质 方面展开,本单元有三个课题。课题1通过一系列实验探究,引导学生 能够从量的方面去研究并得出化学反应的客观规律,为化学方程式的 教学做好理论准备,这是学好本单元的基础,课题2介绍了书写化学方 程式的原则、方法和步骤,说明化学方程式所表示的意义。课题3从量 的方面研究物质化学变化的过程,是化学方程式的具体应用。
可判断丁是生成物,且生成的质量为12 g-7 g=5 g,
故丁的待测质量为7 g+5 g=12 g,故A正确;乙只是反
应前后质量不变,并不知道它是否改变了反应速率以
及反应前后化学性质是否改变,所以不一定是催化剂,
故B错误;根据A中的分析可知,反应中甲、丙、丁的
质量比为7∶12∶5,故C正确;根据前面的分析,反应
意义
宏观
表示_______、_______和__________ 表示各物质的________
微观:表示各物质的________________
人教版九年级化学上册课件:第五单元复习(共24张PPT)
电解水的化学方程式如下: 通电 2H2O ═2H2↑+O2↑ 你能从中获得哪些信息?
1、在通电条件下,水能分解成氢气和氧气; 2、每2个水分子可以分解成2个氢分子和一个 氧分子; 3、在通电条件下,每36份质量的水可生成4 份质量和氢气和32份质量的氧气。
2、书写化学方程式的原则:
(1):以客观事实为基础 (2):遵守质量守恒定律
用质量守恒定律解释:
①铁丝燃烧后质量增加了。 根据质量守恒定律,参加反应的铁与氧气的质量总 和等于生成的四氧化三铁的质量,所以铁丝燃烧后 质量增加了。 ②过氧化氢受热分解后,剩余液体的质量比原来反应物 质量轻。 根据质量守恒定律,参加反应的过氧化氢的质量等于 生成的水和氧气的质量总和,过氧化氢分解后氧气逸 出,所以剩余液体的质量比原来反应物质量轻。 ③点石能成金吗?水能变成汽油吗?为什么? 根据质量守恒定律,反应前后元素的种类不变,石头中 没有金元素,所以点石不能成金。汽油中含碳元素,而 水中不含碳元素,所以水不能变成汽油。
质量守恒定律 如何正确书写化学方程式 利用化学方程式的简单计算
第 五 单 元
参加化学反应的各物质的质量总和等 内容 于反应后生成的各物质的质量总和
质 化学反应 不 改 变
解释
原子种类 化学反应实质 原子数目 原子质量
应用
推断反应物或生成物的元素组成 推断化学反应类型 解释实际问题
4.下列现象能用质量守恒定律解释的是( C ) A、mg水受热形成mg水蒸气 B、湿衣服晾干后,质量变小 C、煤燃烧留下的煤灰比原煤质量少 D、10g食盐溶于70g水中得到80g食盐。 5.葡萄糖与氧气作用是构成生物呼吸的主要反应, 其中X的数值为( B ) C6H12OX+6O2=6CO2+6H2O A、 3 B、6 C、 9 D、12
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、磷和氧气在点燃条件下生成五氧化二磷。
2、每124份质量的磷与160份质量的氧气完全 反应生成284份质量的五氧化二磷。
3、每4个磷原子和5个氧分子反应生成2个五 氧化二磷分子。
R+3O2=点=燃2CO2+2H2O,R的
化学式为
点燃
M + O2 == CO2
+
C2.H
H2O4,M的
化学式为
.
CH2O
1、细铁丝在氧气中燃烧后,生成物的质量比细 铁丝的质量大。 因为细铁丝与氧气的质量和才等于生成的四氧化三 铁的质量,所以生成物比细铁丝的质量大。
2、加热氯酸钾与二氧化锰的混合物,剩余的固 体质量减少了。
因为剩余的固体与生成的氧气质量和才等于反应 前的质量,而氧气是气体跑掉,所以剩余的固体 质量减少了。
一、书写化学方程式的原则
1.以客观事实为基础 必须是真实存在的反应,必须正确书写化学式 2.遵循质量守恒定律 配平化学方程式,使左右两边各种元素的 原子个数均相等
碳+氧气 点燃 二氧化碳
点燃
点燃
2Mg+O2〓 2MgO C+O2 〓 CO2
一、质量守恒定律
在化学反应前后各物质的质量总和相等
定义:参加化学反应的各物质的质量 总和,等于反应后生成的各物质的质量 总和。这个规律就叫做质量守恒定律。
水的电解
原子是化学变化中的最小粒子,那么 由相同原子构成的反应物与生成物在 质量上有什么内在联系呢?
个一定不变
宏观
反应物和生成物的总质量 元素的种类 原子的种类
化学 反应 过程
微观 原子的数目
2个一定变
原子的质量
宏观:物质的种类
微观:分子的种类
1个可能变: 分子总数
例如
C原子个数 O原子个数 原子总个数
木炭在氧气中燃烧生成 二氧化碳的化学方程式
点燃
C + O2
CO2
1
1
2
2
3
3
化学反应前后
物质 的总 质量 呢?
经典例题
【例】(黄冈中考)下列有关对质量守恒定律的理解,正确的是( ) .将 铁和 铜混合加热后,物质的总质量为10 g,遵守质量守恒
定律 .化学反应前后分子的总数一定不会发生变化
C. 硫和 氧气完全反应后,生成物质量为10 g .镁条燃烧后质量增加,不遵守质量守恒定律
【思路点拨】A.铁和铜不能发生化学反应,所以虽然混合加热后质量 不变,但是不能用质量守恒定律来解释;B.根据化学变化的实质可以知 道,在化学变化中是分子破裂成原子,原子重新组合成新的分子,在原 子重新组合的过程中,分子的总数可能发生改变;C.根据硫和氧气反应 可以知道:硫和氧气在反应中的质量比为1∶1,所以 硫和 氧气完 全反应后,生成物质量为10 g;D.镁条燃烧是和空气中的氧气发生了反 应,所以反应后生成物的质量应该等于镁和氧气的质量之和,所以遵守 质量守恒定律。
CO2
12+16×2
12 : 32
:
44
2.每12份质量的碳与32份质量的氧气在点燃的 条件下完全反应生成44份质量的二氧化碳。
想 点燃
一 根据化学方程式4P+O2
2P2O5
回答下列问题:
想
1. 这个化学反应有哪些物质参加反应(反应物); 2. 通过什么条件反应; 3. 反应生成了哪些物质(生成物); 4. 参加反应的各物质的质量比是多少; 5. 参加反应的各粒子的相对数量。 6. 这个化学方程式有几种读法,怎么读?
【答案】C
质量守恒定律的使用范围是什么? 学了该定律,对我们有什么用?
质量守恒定律适用于一切化学反应
可运用定律 1. 进行有关的计算 2. 推测一些物质的组成 3. 解释一些实验事实
质量守恒定律的应用
小结结
参加化学反应的各物质
内容 的质量总和等于反应后
质
生成的各物质的质量总和
量
原子种类没有改变
守
“和”
“反应条件”
“生成”
碳 + 氧气
点燃
二氧化碳
反应物
写起来很麻烦 怎么办
生成物
这是什么式子 它可以提供 哪些信息 它怎么读呢
OO
O
O
点燃
C + O2
12 : 16×2 :
12 : 32
:
CO2
12+16×2 44
怎么读呢
1.碳与氧气在点燃的 条件下生成二氧化碳
OO
O
O
点燃
C + O2
12 : 16×2 :
宏观
参
微观
不变
加化学反应前后
元素种类 六 原子种类
元素质量
原子数目
分
物质的总质量
原子质量
子 个
数
可
能
物质的种类 改变 分子的种类
发 生
改
变
下列事实是否违背质量守恒定律??
纸在空气中燃烧后化为灰烬,灰烬 的质量比纸的质量小
高锰酸钾受热分解后,固体的质量 变小
蜡烛燃烧后消失
你能用质量守恒定律解释吗?
点燃
1. S+O2 = SO2
△ 3. CuO+H2 = Cu+H2O
2. Fe+CuSO4 = Cu+FeSO4
小练习
再见
多看、多学、多试。如 果有成果,绝不炫耀。一个 人如果怕费时、费事,则将 一事无成。
——拉姆赛
如何正确书写 化学方程式
4P + 5O2 点燃2P2O5
124 160
284
原因
原子数目没有增减
恒
原子质量应用 推测一些物质的组成
解释一些实验事实
二.化学方程式
1. 定义:
这种用化学式表示化学反应的式子,叫做化学方程式
2.表示意义 表示了化学反应中的反应物和生成物 表明该化学反应进行的条件 表示了各物质之间的质量关系
木炭在氧气中燃烧生成二氧化碳的反应可以用文字表示为
第五单元 化学方程式
课题1 质量守恒定律
思考问题:
物质发生化学反应后,生成了新的物 质,那么,物质的总质量是否也发生 了变化呢?
在化学反应前后各物质的质量总和 是否相等?
本节来研究这个问题
实验事实1:
玻璃管
红磷
红磷+氧气 点燃 五氧化二磷
实验事实2:
铁+硫酸铜
铜+硫酸亚铁
Fe+CuSO4〓Cu+FeSO4
实验事实3:
大理石与稀盐酸反应前后质量比较
大理石+稀盐酸
氯化钙+二氧化碳+水
CaCO3+2HCl 〓 CaCl2+CO2↑+H2O
实验事实4:
碳酸钠与稀盐酸反应前后质量比较
碳酸钠+稀盐酸 氯化钠+二氧化碳+水
Na2CO3+2HCl 〓 2NaCl+CO2↑+H2O
实验事实5:
实验事实6:
点燃
镁+氧气 氧化镁
守恒原因:化学反应前后原子的种类、数目和质量 没有改变。
2.化学反应的实质:
分裂
重新组合
分子
原子
新分子
聚合成 新物质
从分子和原子观点来看
在一切化学反应中,反应前后原子的 种类没有改变,原子的数目没有增减, 原子的质量也没有变化。所以反应前 后各物质的质量总和必然相等。
3.化学反应过程归纳:
个一定不变,2个一定变,1个可能变
