制剂与辅料相容性问题
制剂的名词解释

制剂的名词解释在药学领域,制剂是指将药物和其他辅料按照一定比例混合,并经过一系列工艺加工制成的用于治疗、预防疾病或维持健康的药品。
制剂是将药物从其原有形态转换为适合患者使用的形式,以便于服用、吸收或外用。
制剂的制备过程包括药物选择、药物预处理、药物混合和加工成型等环节。
首先,药物选择是根据疾病的类型、病程和患者的特殊情况进行的,选择合适的药物进行制剂制备。
其次,药物预处理是指对药物进行清洁、研磨或者研磨等工艺处理,以提高后续混合和加工的效果。
然后,药物混合是将药物与其他辅料进行混合,辅料可能包括填充物、赋形剂或其他辅助成分,以改善药物的口感、吸收性或稳定性。
最后,加工成型阶段是将混合的药物根据具体的制剂要求,通过压片、制丸、制胶囊、磨散剂等工艺加工成制剂的最终形态。
制剂主要分为固体制剂、液体制剂和半固体制剂三大类。
其中,固体制剂包括片剂、胶囊剂、丸剂、颗粒剂、糖衣片等,可供口服或外用。
液体制剂包括滴剂、口服液、油剂等,便于患者直接服用。
而半固体制剂主要是外用制剂,包括膏剂、软膏等,通常用于皮肤病治疗。
制剂的选择和应用需要考虑到多个方面的因素,如药效、剂型、患者特点、药物相容性等。
药效是指制剂对于治疗结果的影响,例如快速释放的制剂通常能快速产生疗效,而延时释放的制剂能持续维持药物浓度。
剂型对于患者的接受性和便携性有重要影响,例如一些儿童或老年患者可能更适合使用液体或片剂,而有些患者可能无法吞咽固体制剂,需要使用液体剂型。
患者特点包括患者的年龄、体质、疾病状态和使用药物的目的等,需要根据患者的具体情况选用适合的制剂。
药物相容性是指制剂中药物与辅料之间的相互作用,例如如果某一药物对某一辅料具有不良反应则需要避免使用。
制剂的研发和生产需要严格的质量控制,以确保药物的有效性、安全性和稳定性。
在制剂的设计和研发阶段,需要进行药物的理化性质测试、药效评价以及制剂的稳定性研究。
在生产和销售阶段,制剂需要符合药典中的质量标准,并通过药物监管部门的审批和监管。
口服固体制剂原辅料相容性研究进展

口服固体制剂原辅料相容性研究进展摘要:口服固体制剂是治疗和预防疾病的常用药物形式。
然而,原辅料之间的相互作用可能会对制剂的质量和有效性产生不利影响。
因此,在口服固体制剂的研发和生产过程中,需要对原辅料之间的相容性进行评估和研究。
本文通过对口服固体制剂原辅料相容性的深入研究,可以为制剂的开发和生产提供指导和依据,并提高制剂的质量和安全性。
关键词:口服固体制剂原辅料相容性研究进展引言在药物制备过程中,需要选择性能良好的辅料,辅料的物理性质、化学性质等的不同都会极大的影响药物成品的制剂参数,例如溶解度、保质期等等。
一、价格评估口服固体制剂原辅料相容性价格评估是一个很重要的研究领域,它涉及到制药企业的财务成本和生产效率。
1. 原辅料成本分析针对制作口服固体制剂的原辅料进行成本分析,将影响成本的因素进行拆解和透析,并探讨各因素对原辅料相容性价格的影响。
这种方法适用于市场前景不确定或其他不确定因素对原料和辅料成本产生影响的情况。
2. 生产效率评估通过研究制药企业的工艺流程和设备管理情况,可以评估口服固体制剂原辅料相容性价格。
生产效率评估需要收集制药企业的各项成本记录,例如人工成本,机器成本,直接材料成本,制备过程评估,以及品质控制记录。
通过全面的数据分析找出生产效率低的环节和成本高的领域,并寻找改进措施。
3. 市场统计分析通过针对口服固体制剂原辅料市场的统计数据分析(如市场增长率、参与方或企业数量、价格变化趋势等),评估价格趋势,预测口服固体制剂原辅料价格的变化,找出价格波动的主因以及寻找应对之策,从而对企业未来的财务预算和保障做好充分的准备。
二、技术性评估1、安全性口服固体制剂原辅料相容性技术评估需要涉及到一定的安全性问题。
因为一些不相容的原辅料可能会导致制剂的不稳定性,进而影响药物的安全性和疗效。
选择符合规定的原辅料生产企业,确保原辅料的质量安全和稳定性。
生产企业要有较为先进的生产设备和技术,完善的生产质量管理体系和规范的操作制度,确保不相容的原辅料不会加入到药品的生产中,保证制剂安全性。
药物制剂中药物与辅料相互作用的研究进展

药物制剂中药物与辅料相互作用的研究进展摘要:在药品制备中,药品和辅料之间的作用对药品的水解度,稳定性和生物利用程度产生了不同的影响。
因此,在药物开发中研究药物与辅料之间的相互作用是必不可少的。
为此,该文从相关性研究方法出发,系统分析了各种制剂中药品和辅料之间的相互作用,为现代药物制剂研发中的处方筛选与药物设计,提出了研究基本思路。
关键词:药物制剂;药物与辅料;相互作用;研究进展药物制剂是由活性药物成分和辅料组成,因此选择到正确的辅料能够有效的提高药物的质量。
药剂师在设计药物的时候,选择辅料的时候不仅要考虑剂型的因素和辅料本身的性质,还要考虑药物与辅料之间的相互作用。
现如今,有关的研究人员不仅考虑其内涵的新相互作用,还在考虑辅料剂与辅料之间的相互作用。
并且也在加大研究力度,最大化程度的减少其产生的副作用的程度上,还能提高其相互之间的溶解性。
一、制剂中的研究方法1.1热分析法热分析方法包括DSC方法,DTA方法和TG分析方法。
该方法不需要长时间的样品制备,并且可以在短时间内筛查许多辅料。
其中,DSC方法被普遍采用,是因为它能够通过特征性熔解峰的移动,来确定药物和赋形剂之间的兼容性问题。
不过,由于热分析方法往往使试样暴露于与实际产品要求相悖的高热条件下,并且因为这些有机化合物之间存在着相对相似的热解特性,所以在加热过程中会出现同样或类似的加热过程,从而使得试样的热分布峰重叠,因此无法区别它们。
最近的研究成果也证明,虽然FA方法能够重新处理所有通过DSC方法和TG方式所得到的原始数据,只是很难分类并利用它们来提取清晰的兼容性信号。
FA方法可以通过对可观测变量间的关联关系进行分析和获取潜在变量,来降低对原始数据收集的多维性。
1.2光谱分析法傅里叶转换红外线光谱(FT-IR)法、拉曼光谱法等,当中以FT-IR法的使用更普遍。
运用对主要原料药和辅助品混合物的FT-IR研究,再根据知识图谱中特性吸引峰的消失、新峰的产生以及峰值强度的改变等,可确定原物质官能基的结构改变情况和新物质的形成状况,进而发现新物质的作用机理,同时还可监测到药品的脱盐、天然气水合物藏的产生等状况。
药物制剂中的药物相容性与配伍性改进方法研究

药物制剂中的药物相容性与配伍性改进方法研究药物相容性与配伍性是药物制剂中一个重要的研究方向,它关乎药物的安全性和有效性。
为了提高药物制剂的质量,科研人员们一直在探索改进相容性与配伍性的方法。
本文将介绍一些目前研究中使用的药物相容性与配伍性改进方法。
一、药物相容性的控制与改进方法1. 药物选择和用量调整在药物制剂设计阶段,选择相容性较好的药物成分是十分重要的。
通过合理的药物选择,可以降低反应的发生几率。
另外,在药物配方时,需要对药物用量进行调整,避免药物之间的相互作用。
2. 添加相容性助剂一种常见的改进相容性的方法是添加相容性助剂。
这些助剂可以改变药物之间的相互作用,从而降低相容性问题的发生。
例如,添加pH调节剂、络合剂、表面活性剂等,在一定程度上可以提高药物的相容性。
3. 改变制剂工艺条件制剂工艺条件也可以对药物相容性进行改进。
调整制剂的溶剂选择、药物溶解度、溶剂中的pH值等参数,可以影响药物的相容性。
同时,优化制剂的加工过程,如溶解时间、搅拌速度、温度控制等,也可以降低相容性问题的发生。
二、药物配伍性的控制与改进方法1. 药物配伍规则药物配伍规则是医学中一个重要的概念,它指导了医师在药物配伍中的选择。
遵循药物配伍规则,可以减少药物之间的相互作用,降低不良反应的发生。
例如,酸性药物和碱性药物不宜联合使用,某些药物对光线敏感等。
2. 配伍指南和数据库在医疗领域,也有一些常用的配伍指南和数据库可供参考。
这些指南和数据库详细记录了各种药物的相互作用信息,包括相容性、不良反应等。
医师可以根据这些指南和数据库,参考药物的搭配规则,提高药物配伍的准确性。
3. 先进的技术手段随着科学技术的发展,一些先进的技术手段也被应用到药物配伍性的研究中。
例如,高效液相色谱仪(HPLC)和质谱仪等仪器的使用,可以快速准确地检测药物之间的相互作用,帮助改进药物的配伍性。
总结:药物相容性与配伍性改进是药物制剂领域中的一个重要研究方向。
药物与辅料相容性研究进展

Vol.4 No.1Feb. 2018生物化工Biological Chemical Engineering第 4 卷 第 1 期2018 年 2 月药物与辅料相容性研究进展张卉(南京艾德凯腾生物医药有限责任公司,江苏南京211100)摘 要:随着医学的不断发展,药物质量越来越受到人们的重视。
在药物生产过程中,辅料扮演着不可替代的角色。
在辅料的设计过程中,如果不考虑辅料和活性成分的配比禁忌等因素,没有进行实时测定分析,就可能影响药物质量,从而对用药者产生潜在的风险。
本文从辅料和有效成分之间的相互作用进行分析,从而提高药物与辅料的相容性。
关键词:药物-辅料相互作用;相容性;热分析法;光谱法;色谱法中图分类号:R943 文献标志码:AAdvances in Study on Compatibility of Drugs and ExcipientsZhang Hui(Nanjing Kaiteng Ed Biological Medicine Co., Ltd, Jiangsu Nanjing 211100)Abstract: With the continuous development of medicine, people pay more and more attention to the quality of drugs. In the process of drug production, the excipient plays an irreplaceable role. In the process of excipient design, if we do not consider the factors such as the ratio of accessories and active ingredients, taboo and other factors, no real-time determination and analysis will affect the quality of the drugs, and thus have potential risks to the users. In this paper, the interaction between the excipients and the effective components is analyzed to improve the compatibility between the drugs and the excipients.Keywords: Drug excipient interaction; Compatibility; Thermal analysis; Spectrometry; Chromatography在药物研究开发过程中,经常会使用辅料来保证药物的有效性和增加病人的顺应性。
原辅料相容性作用机制及研究方法分析
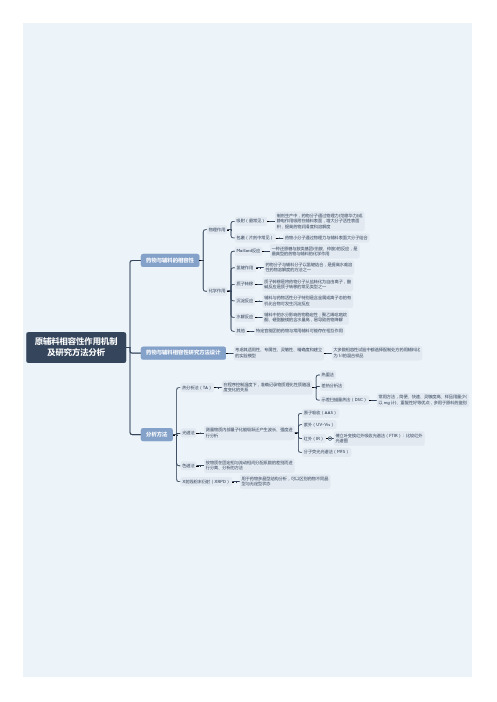
氢键作用
药物分子与辅料分子以氢键结合,是提高水难溶 性药物溶解度的方法之一
质子转移
质子转移是将药物分子从盐转化为自由离子,酸 碱反应是质子转移的常见类型之一
沉淀反应
辅料与药物活性分子特别是含金属或离子态的有 机化合物可发生沉淀反应
水解反应
辅料中的水分影响药物稳定性;聚乙烯吡咯烷 酮、硬脂酸镁的含水量高,易导致药物降解
常用方法,简便、快速、灵敏度高、样品用量少( 以 mg 计)、重复性好等优点,多用于原料药鉴别
原子吸收(AAS)
光谱法
测量物质内部量子化能级跃迁产生波长、强度进 行分析
紫外(UV-Vis)
红外(IR)
傅立叶变换红外吸收光谱法(FTIR):比较红外 光谱图
分子荧光光谱法(MFS)
色谱法
按物质在固定相与流动相间分配系数的差别而进 行分离、分析的方法
X射线粉末衍射(XRPD)其他
特定官能团的药物与常用辅料可能存在相互作用
药物与辅料相容性研究方法设计
考虑其适用性、专属性、灵敏性、精确度和建立 的实验模型
大多数相容性试验中都选择配制处方药用辅料比 为 1:1的混合样品
分析方法
热分析法(TA)
在程序控制温度下,准确记录物质理化性质随温 度变化的关系
热重法 差热分析法 示差扫描量热法(DSC)
原辅料相容性作用机制 及研究方法分析
药物与辅料的相容性
物理作用 化学作用
吸附(最常见)
制剂生产中,药物分子通过物理力(范德华力)或 静电作用吸附在辅料表面,增大分子活性表面 积,提高药物润滑度和溶解度
包裹(片剂中常见)
药物小分子通过物理力与辅料表面大分子结合
Maillard反应
注射用冻干制剂新药申报中的药学常见问题和基本考虑

注射用冻干制剂新药申报中的药学常见问题和基本考虑在注射用冻干制剂新药申报的过程中,药学方面常见的问题和基本考虑是非常重要的。
药学作为新药研发的重要环节之一,其在新药申报过程中起着至关重要的作用。
本文将基于这一主题,从深度和广度上进行全面评估,并撰写一篇有价值的文章,以便更好地理解药学在新药申报中的重要性。
一、注射用冻干制剂新药申报中的药学常见问题在注射用冻干制剂新药申报过程中,药学面临的常见问题主要集中在以下几个方面:1. 药物成分的选择和配比:在新药研发过程中,药学需要考虑药物的组成成分,包括活性药物和辅料的选择和配比。
这一环节需要充分考虑药物的稳定性、溶解度、吸收性等因素,以确保制剂的质量和安全性。
2. 制剂工艺的优化:针对注射用冻干制剂,药学需要优化制剂工艺,包括冻干工艺、干燥工艺等,以确保药物的稳定性和长期保存性。
药学还需要考虑制剂的配方优化和工艺流程的合理性,以确保制剂的质量和稳定性。
量控制标准和品质管理体系,包括对原材料的严格筛选、生产工艺的严格管控、成品药品的质量评价等,以确保制剂的质量和稳定性。
4. 药物的安全性和有效性评价:药学需要进行药物的安全性和有效性评价,包括药物的毒理学评价、临床试验的设计与实施等,以确保药物的安全性和有效性符合标准要求。
5. 注射用冻干制剂的新技术和新方法:随着科学技术的不断发展,药学需要不断引入新技术和新方法,以推动新药的研发和创新。
纳米技术、微球技术等新技术的应用,可以提高药物的稳定性和生物利用度。
二、注射用冻干制剂新药申报中的药学基本考虑在新药申报过程中,药学需要从以下几个方面进行基本考虑:1. 药物的作用机制和药效学特点:药学需要充分了解药物的作用机制和药效学特点,在此基础上进行药物的合理设计和制剂工艺的优化。
2. 制剂的稳定性和保存性:药学需要考虑制剂的稳定性和保存性,包括药物与辅料的相容性、热稳定性、湿稳定性等因素,以确保制剂的质量和稳定性。
注射剂药品与包装材料相容性试验之二

评价方法
塑料材料的重点考察项目:
双向穿透性(溶剂,水分、气体及挥发性药物的渗入与透出等) 溶出性(塑料添加剂的溶出;有害金属元素的释放) 吸附性(塑料对药物的吸附、转移) 化学反应性(与溶剂的作用及加工时分解物对药物的影响) 微粒(塑料容器制备不良产生) 密封性
应关注相容性试验:
聚合物添加剂 单体、起始物质、降解产物 药品接触材料中物质残留量的数据 样品化学组成、物理组成 方法的检测限、精密度、回收率与试验结果.
评价方法
3.建立新的试验方法
例2:注射用粉液双室袋药物稳定性试验 方法的建立
除符合一般的考察原则及方法条件外 注意本包装内液体与固体药物的分别考察条件 双室袋虚焊开通前药物各时间点的全项考察数据 虚焊开通混合后不同时间点相关项目的考察数据 注意虚焊用黏合剂的安全性考察
稳定性试验
定义: 为考察药物在温度、湿度、光线的影响 下随时间变化的规律而进行的试验。
这个试验为药品的生产、包装、贮存、 运输条件及有效期的建立提科学的依据。
稳定性试验
目的: 为保证药物的安全有效,选择适合药品剂 型、处方、生产、包装、贮存、运输条件 与有效期。
稳定性试验
原则:
(基本要求)
对包装在半透性容器中的药物
ICH
( ℃/RH% )
时间周期: 12个月 25±2℃/40±5% 或 30±2℃/35±5% 由申请者决定
说明: 采用前者为长期试验条件时,中间试验条件为 30±2℃/65±5% (时间周期: 6个月)
特别要求试验(相容性)
液体制剂原辅料相容性试验原则

液体制剂原辅料相容性试验原则药包材与药品相容性试验的目的药包材对保证药品的稳定性起着重要作用,因而药用包装材料将直接影响用药的安全性。
直接接触药品的包装材料、容器是药品的一部分,尤其是药物制剂中,一些剂型本身就是依附包装而存在的(如气雾剂等)。
由于药品包装材料、容器组成配方、所选择的原辅料及生产工艺的不同,导致不恰当的材料引起活性成分的迁移,吸附甚至发生化学反应,使药物失效,有的还会产生严重的副作用。
这就要求在为药品选择包装容器(材料)之前,必须检验证实其是否适用于预期用途,必须充分评价其对药物稳定性的影响,评定其在长期的贮存过程中,在不同环境条件下(如温度、湿度、光线等),在运输使用过程中(如与药物接触反应,对药物的吸附等)、容器(材料)对药物的保护效果和本身物理、化学、生物惰性,所以在使用药包材之前需做相容性试验。
药包材与药品相容性试验的原则(一)、药物在选择药包材材料、容器时,应首先考虑其保护功能,然后考虑材料、容器的特点和性能,包括化学、物理学、生物学、形态学等性能。
(二)、药包材应具有良好的化学稳定性、较低的迁移性、阻氧、阻水、抗冲击、无生物意义上的活性、微生物数在控制范围内、与其它包装物有良好的配合性、适合于自动化包装设备等。
(三)、在评价之前药包材与药物应符合有关标准。
(四)、药包材与药物相容性试验应考虑以下几个方面:1、形成包装单元时,各包装物应有良好的配合性。
2、包装单元形成时,能适合特定的包装设备。
3、包装中的药物,能通过药物稳定性试验的所有项目。
4、药包材根据生产工艺要求耐受特殊处理的能力(如钻60消毒等)5、同一包装单元中首次至末次使用保证药物的一致性。
6、对恶劣运输、不同贮存环境的抵抗能力。
(五)、所有试验都应根据具体的包装形式和药物,设计试验方案并按《药品非临床研究质量管理规范》(GLP)进行实验。
(六)、所有样品均为上市包装。
(七)、所有试验均应至少取3个不同的批号。
药品研发中的原辅料相容性实验

在药品设计过程中,辅料的选择至关重要。
对于辅料及其在处方中的用量选择,不仅基于它们的功能性,更重要的是要考虑药物与辅料之间的相容性。
所谓的不相容性,可以定义为药物与处方中一种或多种辅料发生不良相互作用,从而导致制剂在物理、化学、微生物学或治疗性质方面的改变。
因此,辅料相容性的研究主要是用于预测药物在最终剂型中可能潜在的不相容性,同时为申报注册法规文件所需的处方中辅料及其用量的选择提供合理依据。
辅料相容性的研究通常被认为是很普通并且繁琐的。
但是,这些研究恰恰是药物研发过程中非常重要的工作,原因在于:包括处方的选择、药物稳定性的评估,降解产物的鉴定,以及对于相互作用机制的了解,都可以从辅料相容性研究所获得的知识中得到有益指导。
如果发现药物稳定性不能尽如人意,就要采取对策以提高其稳定性。
因此,在药品开发的后阶段进行系统的,周详计划和执行的相容性研究,可以有效地节省由于稳定性问题而浪费的资源和拖延的时间;同时,如果当药物产品进入后期开发的阶段,辅料相容性的研究对于引起稳定性问题的原因推测也非常有帮助。
而且随时间的推移,监管的期望对此有了显著的增加。
正如一直都在提倡的质量源于设计(QbD)的倡议那样,这种趋势将会一直延续。
在进入申请的开发报告中,需要药物与辅料的相容性数据以证明对处方成分选择的正确性。
基于辅料对药品和生产工艺的影响,相关法规已经越来越多地关注其关键质量特性(critical quality attributesCQA)和控制策略。
从药物开发过程的角度而言,通常是在对药品(药物活性成分,API)液体和固体稳定性有一定的了解之后开展这些研究,但应在处方开发之前。
剂型中不相容导致的变化可以归纳为以下几点①颜色或外观的变化;②机械性能的损失(如片剂硬度);③溶出行为的变化;④物理晶型的转变,⑤升华导致的损失;⑥药效降低;⑦降解产物的增加。
2.药物与辅料之间的化学作用在药物制剂中能观察到最普遍的反应为水解作用、脱水作用、同分异构化作用、消除作用、成环作用、氧化作用,光降解作用,以及与处方成分(辅料及其杂质)之间的特殊反应。
药物研究原辅料相容性的4大分析方法

药物研究原辅料相容性的4大分析方法在药物研究开发过程中,经常会使用辅料来保证药物的有效性和增加病人的顺应性。
辅料一般认为是非活性且无毒害的,能够有效地改良药物外观以及顺应性。
但辅料一般是通过和药物有效成分发生物理、化学反应,相互作用之后实现其功效。
在制剂的研究开发过程中,部分活性成分通常难溶于水,可以通过加入崩解剂或者将原料微粉化来加强其溶解度,同时加入一些其他辅料来保证药物的稳定性等其它属性。
辅料多由有机物和无机物的混合组成的,如果施用不当很有可能产生副作用甚至影响药物安全性和稳定性。
文章从辅料和药物有效成分反应入手,阐述其反应机制并对目前药物和辅料相容性研究进行综合阐述。
1.药物和辅料的相容性辅料自身并不具备相容性,在制剂中起到固定作用,通常是通过调节环境因素来确保药物理化性质的稳定。
在一些特殊药物的设计中,应充分考虑有效成分和辅料的相容性。
有时辅料会导致有效成分分子发生异构化,晶型转化等不良反应。
1.1物理作用有效成分和辅料发生的最常见的相互作用是物理作用,主要包括吸附作用和包埋作用。
1.1.1吸附作用在药物生产过程中,药物分子和辅料分子常常会通过范德华力或者静电作用相互吸附,这一过程可以有效提高药物溶解度和润滑程度,提高药物质量。
但当该反应过度进行导致吸附力过强时,解吸附力就相对较弱,药物进入体内难以扩散,导致药物利用率降低,甚至影响药物质量。
1.1.2包埋作用包埋作用通常发生在片剂中。
片剂中,常常通过加入辅料使药物小分子和辅料表面大分子结合从而得到均一、稳定的制剂。
但是当包埋作用过度时,就会影响药物的释放,降低药物的生物利用度。
一般在将羟丙基甲基纤维素等类粘合剂加入亲脂性药物时常常会出现这种现象。
1.1.3物理作用的影响物理作用的失衡可能带来的影响不仅体现在药物利用率低,还可能干扰到制剂稳定。
当吸附包埋过度时,药物难以释放,药物不能充分溶解到溶剂中,导致含量测定以及质量分析等出现一定偏差,影响质量控制。
原辅料相容性试验法规要求和影响因素浅谈

原辅料相容性试验法规要求和影响因素浅谈各国对原辅料相容性试验要求中国对原辅料相容性,在化学药物制剂研究基本技术指导原则中的“四、处方研究”,“(二)辅料”“2、相容性研究”部分药物与辅料相容性研究为处方中辅料的选择提供了有益的信息和参考。
药品申请人可以通过前期调研,了解辅料与辅料间、辅料与药物间相互作用情况,以避免处方设计时选择不宜的辅料。
对于缺乏相关研究数据的,可考虑进行相容性研究。
例如口服固体制剂,可选若干种辅料,若辅料用量较大的(如稀释剂等),可按主药:辅料=1:5的比例混合,若用量较小的(如润滑剂等),可按主药:辅料=20:1的比例混合,取一定量,参照药物稳定性指导原则中影响因素的试验方法或其他适宜的试验方法,重点考察性状、含量、有关物质等等,必要时,可用原料药和辅料分别做平行对照试验,以判别是原料药本身的变化还是辅料的影响。
”如处方中使用了与药物有相互作用的辅料,需要用试验数据证明处方的合理性。
ICH 指导原则Q8(R2)PHARMACEUTICAL DEVELOPMENT中的“2.1.1”章节中要求在制剂研发开始阶段进行原辅料相容性试验。
应该评估在3.2.P.1所列赋形剂的药物和辅料的相容性,对于多个原料药,还应该讨论各原料药之间的相容性。
在FDA发布的“Chemistry Review of Question-based Review (QbR)Submi ssions”原辅料相容性也有要求。
ATTACHMENT2: QbR QUESTIONS - DRUG PRODUCT (CHEMISTRY)部分,第9条:9. What evidence supports excipient-drug substance compatibility andif applicable,excipient-excipient compatibility?FDA发布的仿制药案例(QbD)里面也有提及“Quality byDesign for ANDAs: An Ex ample for Immediate-Release Dosage Forms ”原辅料相容数据如表1和表2。
药物制剂中药物与辅料相互作用的研究

药物制剂中药物与辅料相互作用的研究发布时间:2021-07-07T15:50:28.193Z 来源:《医师在线》2021年3期作者:马亚新[导读]马亚新(杭州中美华东制药江东有限公司;浙江杭州310000)摘要:在药物制剂中,药物与辅料之间的相互作用对药物的溶解度,稳定性和生物利用度具有不同的影响。
因此,在药物开发中研究药物与辅料之间的相互作用是必不可少的。
因此,本文从相关研究方法入手,分析了各种制剂中药物与辅料之间的相互作用,为药物制剂研究中的处方筛选和制剂设计提供了研究思路。
关键词:药物制剂;药物;辅料;相互作用药物制剂由活性药物成分和辅料组成,合适的辅料对药物的最终质量非常重要。
当设计药物制剂时,辅料的筛选不仅应考虑剂型因素和辅料本身的功能,还应考虑药物与辅料之间的相互作用。
近年来,随着研究的不断深入,除了在通用制剂相容性研究中发现药物与赋形剂之间的新相互作用外,研究人员还关注辅料剂与辅料之间的相互作用[1]。
辅料与药物之间或药物与载体之间相互作用的优缺点增加了药物的溶解度和生物利用度,减少了药物的副作用,但同时可能产生负面影响,并导致降解或离解,从而会降低临床疗效并增加安全风险。
因此,在药物制剂开发过程中进行充分可靠的相互作用研究,不仅可以为制剂筛选和制剂设计提供依据,而且可以为药物升级提供研究思路。
一、药物制剂中的研究方法(一)热分析法热分析方法包括DSC方法,DTA方法和TG分析方法。
该方法不需要长时间的样品制备,并且可以在短时间内筛查许多辅料。
其中,DSC方法被广泛使用,因为它可以根据特征性熔解峰的移动来判断药物与赋形剂之间的相容性问题。
但是,热分析方法通常将样品暴露在与实际生产条件不符的高温条件下,另外由于大多数有机物质具有相对相似的热解性质,因此在加热过程中会发生相同或相似的热过程,导致样品的热分布峰重叠,从而难以区分它们。
最近的研究表明,FA方法可以重新处理通过DSC和TG方法获得的数据,但是很难区分和使用它来提供清晰的兼容性信息。
原辅料相容性试验的标准操作规程

原辅料相容性试验的标准操作规程公司标准化编码 [QQX96QT-XQQB89Q8-NQQJ6Q8-MQM9N]1.目的保证制剂的稳定性。
2.范围固体制剂。
3.责任研发制剂实验人员负责此程序的实施。
4.程序原辅料相容性试验-针对国内申报项目若辅料用量较大的(如稀释剂等),可按主药:辅料=1:5 的比例混合,若用量较小的(如润滑剂等),可按主药:辅料=20:1的比例混合或根据实际情况设定混合比例,取一定量,参照药物稳定性指导原则中影响因素的实验方法或其他适宜的实验方法,重点考察性状、含量、有关物质等等,必要时,可用原料药和辅料分别做平行对照实验,以判别是原料药本身的变化还是辅料的影响。
影响因素试验一般包括高温、高湿、光照试验。
一般将原料药供试品置适宜的容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤10mm厚的薄层进行试验。
高温试验供试品置密封洁净容器中,在60℃条件下放置 10 天,于第5 天和第10天取样,检测有关指标。
如供试品发生显着变化,则在40℃下同法进行试验。
如60℃无显着变化,则不必进行40℃试验。
高湿试验供试品置恒湿密闭容器中,于25℃、RH90%±5%条件下放置 10 天,在第5 天和第10天取样检测。
检测项目应包括吸湿增重项。
若吸湿增重5%以上,则应在25℃、RH 75±5%下同法进行试验;若吸湿增重5%以下,且其他考察项目符合要求,则不再进行此项试验。
液体制剂可不进行此项试验。
恒湿条件可采用恒温恒湿箱或通过在密闭容器下部放置饱和盐溶液来实现。
根据不同的湿度要求,选择NaCl饱和溶液( 60 ℃,RH 75%±14%)或KNO饱和溶液3 (25℃,RH %)。
光照试验供试品置光照箱或其它适宜的光照容器内,于照度4500Lx±500Lx 条件下放置10 天,在第5 天和第10 天取样检测。
以上为影响因素稳定性研究的一般要求。
原辅料相容性试验指导原则

原辅料相容性试验指导原则概述在药品生产中,药品的原辅料选择和相容性试验是非常重要的环节。
原辅料的选择和相容性试验的合理性直接关系到药品的质量和安全性。
本文将介绍原辅料相容性试验的指导原则,以帮助药品生产企业正确进行原辅料选择和相容性试验。
一、原辅料选择的原则在选择原辅料时,应考虑以下几个原则:1.符合药典规定:原辅料应符合国家药典或相关药典的规定。
药典中对于原辅料的质量标准和使用要求都有明确规定,药品生产企业应严格按照这些规定进行选择。
2.药品特性要求:在选择原辅料时,应充分考虑药品的特性要求。
不同的药品有不同的特性,如溶解度、稳定性、生物利用度等。
根据药品的特性要求,选择适合的原辅料。
3.供应商的信誉度:在选择原辅料供应商时,应了解供应商的信誉度。
供应商的信誉度直接影响到原辅料的质量和稳定性。
药品生产企业应选择有信誉的供应商,确保原辅料的质量可靠。
4.价格和成本:在选择原辅料时,价格和成本也是需要考虑的因素。
虽然药品的质量和安全性是最重要的,但成本控制也是企业需要考虑的因素。
在满足质量要求的前提下,尽量选择价格适中的原辅料。
二、相容性试验的原则相容性试验是指药品配方中的不同原辅料在一定条件下进行混合试验,评价其相容性和稳定性。
在进行相容性试验时,应遵循以下原则:1.全面考虑:相容性试验应全面考虑药品中各原辅料的相互作用。
不同原辅料的相互作用可能导致药品的不稳定性,因此,需要对所有原辅料进行试验。
2.条件选择:相容性试验时应选择适当的条件。
条件包括温度、湿度、光照等。
这些条件可以影响原辅料的相容性和稳定性。
根据药品的特性和使用条件,选择适当的条件进行试验。
3.时间控制:相容性试验的时间应根据药品的使用寿命和储存条件来确定。
不同的药品有不同的使用寿命,试验的时间应覆盖到药品的使用期限。
4.试验方法:相容性试验的方法应科学合理。
试验方法应能够真实模拟药品的使用条件,确保试验结果的可靠性和准确性。
常用的试验方法包括物理观察、化学分析等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、辅料相容性相关
1、化学药物制剂研究指导原则,page 8 “
2、相容性实验”
2、辅料相容性试验中,如果制剂处方中含有多种辅料,可以将辅料混合在一起进行相容性试验吗?
答:辅料相容性试验一般原则和方法可以按照《化学药物制剂研究基本技术指导原则》进行。
对于仿制制剂而言,国外已上市药品说明书中记载的处方的辅料组成是重要的参考信息;对于已上市药品说明书记载的处方未使用的辅料,建议进行辅料相容性试验,宜将每种需要考察的辅料与药物单独混合后进行相容性试验,以便发现药物-辅料存在的相互作用,考察指标除观察外观性状外,一般还应有色谱方法的指标。
3、辅料与主药相容性研究中,具体试验方法是什么?如主辅料比例为多少?稳定性影响因素试验的具体要求?这部分试验的过程及数据必须列入工艺申报资料中吗?
答:主药与辅料相容性研究是处方前研究工作中的一项重要内容。
相容性研究的具体试验方法应根据制剂品种的具体情况确定。
例如对于口服固体制剂,可选若干种辅料,如辅料用量较大的(如填充剂等),可用主药:辅料=1:5的比例混合,若用量较小的(如润滑剂等),则用主药:辅料=20:1的比例混合,取一定量,按稳定性影响因素试验方法,分别在强光(4500±500Lux)、高温(60℃)、高湿(相对湿度90±5%)的条件下放置10天,用HPLC或其他适宜的方法检查
含量及有关物质放置前后有无变化,同时观察外观、色泽等药物性状的变化。
必要时,可用原料药和辅料分别做平行对照实验,以判别是原料药本身的变化还是辅料的影响。
稳定性影响因素试验的具体要求在稳定性研究技术指导原则中有详细介绍。
主药与辅料相容性研究是药物制剂处方工艺研究工作的重要内容,其试验的过程及数据是处方工艺研究资料的重要组成部分。
4、材料解读
“根据《化学药物制剂研究基本技术指导原则》:对于口服固体制剂,可选若干种辅料,如辅料用量较大的(如填充剂等),可用主药:辅料=1:5的比例混合,若用量较小的(如润滑剂等),则用主药:辅料=20:1的比例混合,取一定量,照药物稳定性指导原则中影响因素的实验方法,分别在强光(4500±500Lux)、高温(60℃)、高湿(相对湿度90±5%)的条件下放置10天,用HPLC或其他适宜的方法检查含量及有关物质放置前后有无变化,同时观察外观、色泽等药物性状的变化。
必要时,可用原料药和辅料分别做平行对照实验,以判别是原料药本身的变化还是辅料的影响。
”
(1)、“可选若干种辅料”,具体如何选择,是否有文献报道及已有处方信息公布的辅料可以不做,例如仿制药?
(2)、本段话中提到的比例值是否为举例,没有约束力。
填充剂参考1:5,润滑剂参考20:1。
只是参考而已,针对具体处方可以调整,如主药含量很小的情况(尤其是主药价格比较贵),例如崩解剂是否换成1:1或者其他比例?
(3)、放样条件,是否一定要按照强光(4500±500Lux)、高温(60℃)、高湿(相对湿度90±5%)德条件。
尤其是高湿,很多主药在此条件下吸水很严重,75%如何?5天数据是否可以省略?
(4)、含量有关物质放置前后有无变化如何把握,需要参考标准吗?
解答一:
我做一个仿制品种,换了辅料的处方做得的制剂影响因素试验是合格的,但是补做原辅料相容性试验发现变化很明显,有一种辅料放置前后颜色有变化但有关物质数据很好。
不知为何?
(1)、我觉得即使有文献报道,也应该做相容性试验,因为即使完全相同的辅料,由于来源不同,存在的杂质可能也不一样,影响原料稳定性的因素除辅料外,辅料中的杂质也可能有影响,故应该全面考虑,文献的真实性也是一问题。
(2)可以调整。
(3)如果吸湿严重,可以折算后计算含量,如果不能耐受,可换为75%条件考察。
(4)不太清楚。
其他适宜的方法可以用热分析法(DTA,DSC),漫反射光谱法,薄层色谱色谱法同步研究,原辅料相容性是处方前研究的部分,只能筛除对主药有明显影响的辅料,如果完成没有影响那只有不加任何辅料;最终还是以制剂的加速和长期试验稳定性数据为依据。
解答二:
(1)、我一般都是先拟定一个初步的处方,然后根据该处方,选择试验用辅料。
如填充剂、崩解剂、润滑剂、助流剂等等。
每种选择有代表性的,如填充剂,淀粉类就选择预胶化淀粉或淀粉,微晶类就选PH101或102,糖类就选蔗糖或乳糖等等,不一定要全,但一定要有代表性,有针对性。
比如说主药酸性,就要选择一些碱性的辅料;
(2)、我觉得该比例就是个推荐比例。
实际设计试验方案的时候应根据具体处方而定。
比如说如果初步拟定的处方中“主药:崩解剂=5:1”,那设计的时候可以用“主药:崩解剂=1:1”,相当于放大了“5倍”。
放大倍数也不一定,一般说,可能有配伍禁忌的不妨把放大倍数搞大点。
这样,如果主药和辅料有配伍禁忌,问题可以尽早暴露。
(3)、放样条件基本就是这样。
毕竟,辅料相容性试验就是用比较苛刻的条件,使原辅料可能出现的配伍禁忌方面的问题尽早暴露出来,以利于进一步的处方工艺筛选。
所以,只要不给检验带来太大的麻烦,建议还是按照“95%”的湿度设计。
至于5天的数据,我们一般没测:我们觉得有10天数据足够了。
也许我们的工作做的不够细;
(4)、含量有关物质需要和“0天样品”作比较;。
