2017-2018学年度人教版化学选修3高二暑假作业:价层电子对互斥理论(含答案)
人教版高中化学选修三课件:第二章 第二节 第一课时 价层电子对互斥理论(26张PPT)

•1、所有高尚教育的课程表里都不能没有各种形式的跳舞:用脚跳舞,用思想跳舞,用言语跳舞,不用说,还需用笔跳舞。 •2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 •3、教育始于母亲膝下,孩童耳听一言一语,均影响其性格的形成。 •4、好的教师是让学生发现真理,而不只是传授知识。 •5、数学教学要“淡化形式,注重实质.
实例
2
0
2
3
0
3
2
1
直线形
直线形
HgCl2、 BeCl2、
CO2
三角形
平面三角形 V形
BF3、 BCl3 SnBr2、 PbCl2
σ键电 孤电子 价层电 电子对的 VSEP 分子或离子 实例
子对数 对数 子对数 排列方式 R模型 的立体构型
4
0
3
1
4
四面 体形
正四面体形 三角锥形
CH4、 CCl4 NH3、 NF3
VSEPR模型 的立体构型 体构型名称
NH3
_三__角__锥__形
HCN
_直__线__形
H3O+
_三__角__锥__形
SO2
_V_形
[特别提醒] VSEPR模型与分子的立体构型不一定一致,分子的 立体构型指的是成键电子对的立体构型,不包括孤电子 对(未用于形成共价键的电子对)。两者是否一致取决于 中心原子上有无孤电子对,当中心原子上无孤电子对 时,两者的构型一致;当中心原子上有孤电子对时,两 者的构型不一致。
2
2
V形
H2O
1.用价层电子对互斥理论判断SO3的分子构型为 ( )
A.正四面体形 B.V形
C.三角锥形
D.平面三角形
解析:SO3中S原子的价层电子对数为3,其全部用于形
高中化学 选修3 第二章 分子结构与性质第2节分子的立体构型第1课时价层电子对互斥理论学生使用

选修3 第一章原子结构与性质第2节分子的立体构型第1课时价层电子对互斥理论学习目标:1.认识共价分子结构的多样性和复杂性。
2.理解价层电子对互斥理论的含义。
3.能根据有关理论判断简单分子或离子的构型。
教学难点:1、理解价层电子对互斥理论的含义2、能根据有关理论判断简单分子或离子的构型教学重点:1、理解价层电子对互斥理论的含义2、能根据有关理论判断简单分子或离子的构型教学过程:知识回顾:1.分析下列化学式中画有横线的元素,选出符合要求的物质并填空。
A.NH3B.H2O C.HCl D.CH4E.C2H6F.N2(1)所有的价电子都参与形成共价键的是______;(2)只有一个价电子参与形成共价键的是______;(3)最外层有未参与成键的电子对的是______;(4)既有σ键,又有π键的是______;(5)既有极性键又有非极性键的是__________;(6)分子构型为正四面体的是____________。
【解析】A.NH3中N原子与3个H原子形成3个σ键,还有一对不成键电子;B.H2O中O原子与2个H原子形成2个σ键,还有两对不成键电子;C.HCl中Cl原子与1个H原子形成1个σ键,还有三对不成键电子;D.CH4中C原子与4个H原子形成4个σ键,所有价电子都参与成键,其分子构型为正四面体形;E.C2H6中C原子分别与3个H原子及另1个C原子形成4个σ键,所有价电子都参与成键;C—H为极性键,C—C为非极性键;F.N2中N原子与另1个N原子形成1个σ键,2个π键,还有一对不成键电子。
答案(1)DE (2)C (3)ABCF (4)F (5)E (6)D2.常见分子的立体构型通常有两种表示方法,一是比例模型,二是球棍模型。
请你用短线将下列几种分子的比例模型、球棍模型连接起来。
【解析】 本题主要考查常见分子的立体构型。
H 2O 分子为三原子分子呈V 形,应选E—c ;NH 3分子为四原子分子呈三角锥形,应选B—d ; CCl 4分子为五原子分子呈正四面体形,应选C—a ; CO 2分子为三原子分子呈直线形,应选A—b 。
2.2.1《形形色色的分子 价层电子对互斥理论》课时训练试题(原卷版)人教版高二化学选修3

(人教版选修3)2.2.1《形形色色的分子价层电子对互斥理论》课时训练试题(时间:40分钟满分:100分)一、单项选择题:本题包括12小题,每小题5分,共60分。
1.下列分子的空间构型为平面三角形的是( )A.CO2 B.H2OC.CH2O D.NH32.下列分子或离子的中心原子,带有一对孤电子对的是( )A.H2O B.BeCl2C.CH4 D.PCl33.用价层电子对互斥理论判断SO3的分子构型为( )A.正四面体形 B.V形C.三角锥形 D.平面三角形4.下列物质中,分子的立体构型与水分子相似的是( )A.CO2 B.H2SC.PCl3 D.SiCl45.下列分子构型与分子中共价键键角对应一定正确的是( )A.直线形分子:180° B.平面正三角形:120°C.三角锥形:109°28′ D.正四面体形:109°28′6.下列分子或离子中,VSEPR模型名称与分子或离子的立体构型名称不一致的是( ) A.CO2 B.H2OC.CO2-3 D.CCl47.下列分子中,键角最大的是( )A.H2S B.H2OC.CCl4 D.NH38.下列有关描述正确的是()A.NO-3为V形微粒B.ClO-3的立体构型为平面三角形C.NO-3的VSEPR模型、立体构型均为平面三角形D.ClO-3的VSEPR模型、立体构型相同9.据报道,大气中存在一种潜在的温室气体SF5—CF3,虽然其数量有限,但它是已知气体中吸热最高的气体。
关于SF5—CF3的说法正确的是()A.分子中有σ键也有π键B.所有原子在同一平面内C.CF4与CH4都是正四面体结构D.0.1mol SF5—CF3分子中电子数为8mol10.用VSEPR模型预测下列分子的立体构型与H2O相似,都为V形的是( )①H2S ②SO3③SO2④CO2A.①②B.②③C.①③D.②④11.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的立体构型,有时也能用来推测键角大小,下列判断错误的是( )A.SO2、CS2、HI都是直线形的分子B.BF3键角为120°C.BF3、SO3都是平面三角形的分子D.PCl3、NH3都是三角锥形的分子12二、非选择题:本体包括4小题,共40分。
人教版化学选修3作业课件:2-2-1 形形色色的分子 价层电子对互斥理论

第二节 分子的立体构型
课时作业1——形形色色的分子 价层电子对互斥理论
课
课
课
前
堂
后
预
练
作
习
习
业
课基前础预训习练
一、形形色色的分子
【问题探究 1】 五原子分子都是正四面体结构吗?
提示:不是,如 CH3Cl、CH2Cl2、CHCl3 等,虽为四面体结 构,但由于碳原子所连的四个原子不相同,四个原子电子云的排斥 力不同,使四个键的键角不全相等,所以并不是正四面体结构。
A.若 n=2,则分子的立体构型为 V 形 B.若 n=3,则分子的立体构型为三角锥形 C.若 n=4,则分子的立体构型为正四面体形 D.以上说法都不正确
解析:若中心原子 A 上没有未用于形成共价键的孤电子对,则根 据斥力最小的原则,当 n=2 时,分子的立体构型为直线形;n=3 时, 分子的立体构型为平面三角形;当 n=4 时,分子的立体构型为正四 面体形。
C.孤电子对与成键电子对间的斥力等于成键电子对与成键电 子对间的斥力
D.题干中的数据不能说明孤电子对与成键电子对间的斥力与 成键电子对与成键电子对间的斥力之间的大小关系
解析:由中心原子上孤电子对数的计算公式可知,CH4 中碳原子 上无孤电子对,NH3 中的氮原子上有 1 对孤电子对,H2O 中的氧原子 上有 2 对孤电子对。根据题意知 CH4 中 C—H 键间的键角为 109°28′, 若孤电子对与成键电子对间的斥力等于成键电子对与成键电子对间 的斥力,则 NH3 中 N—H 键间的键角和 H2O 中 O—H 键间的键角均 应为 109°28′,故 C 不正确;若孤电子对与成键电子对间的斥力小 于成键电子对与成键电子对间的斥力,则 NH3 中 N—H 键间的键角和 H2O 中 O—H 键间的键角均应大于 109°28′,现它们的键角均小于 109°28′,故 B 不正确;若孤电子对与成键电子对间的斥力大于成键 电子对与成键电子对间的斥力,将成键电子对压得更近一点,使其键 角变小,D 错误,A 正确。
选修三 价电子对互斥理论

二、价层电子对互斥理论(VSEPR theory)
1、价层电子对互斥理论:
要点:对ABn型的分子或离子,中心原子A上价层电 子对之间存在排斥力,将使分子中的原子处于尽可 能远的相对位置上,以使彼此之间斥力最小,分子 体系能量最低。
1)分子的立体结构是 “价层电子对”相互排斥的结 。 2)价层电子对指 分子中的中心原子上的电子对 , 包括 σ键电子对和中心原子上的孤电子对 。 3) σ键电子对数怎样确定?
1)先确定中心原子的价层电子对数 价层电子对数= σ键电子对数+中心原子上的孤电子对数 中心原子上的孤电子对数=1 (a-xb) 2 2)确定含孤电子对的VSEPR模型的立体结构 价层电子对数 n与VSEPR模型的立体结构的关系 n=2 n=3 n=4 n=5 n=6 直线型 平面三角形 四面体 三角双锥体 八面体
C60
C20
C40
C70
分子世界如此形形色色,异彩纷呈, 美不胜收,常使人流连忘返。
那么分子结构又是怎么测定的呢
科学视野—分子的立体结构是怎样测定的?
(指导阅读P37)
早年的科学家主要靠对物质的宏观性质进行系统总结得 出规律后进行推测,如今,科学家已经创造了许许多多测 定分子结构的现代仪器,红外光谱就是其中的一种。 分子中的原子不是固定不动的,而是不断地振动着的。 所谓分子立体结构其实只是分子中的原子处于平衡位置时 的模型。当一束红外线透过分子时,分子会吸收跟它的某 些化学键的振动频率相同的红外线,再记录到图谱上呈现 吸收峰。通过计算机模拟,可以得知各吸收峰是由哪一个 化学键、哪种振动方式引起的,综合这些信息,可分析出 分子的立体结构。
人教版选修3 物质结构与性质
第二章 分子结构与性质
人教版高中化学选修3讲义价层电子对互斥理论
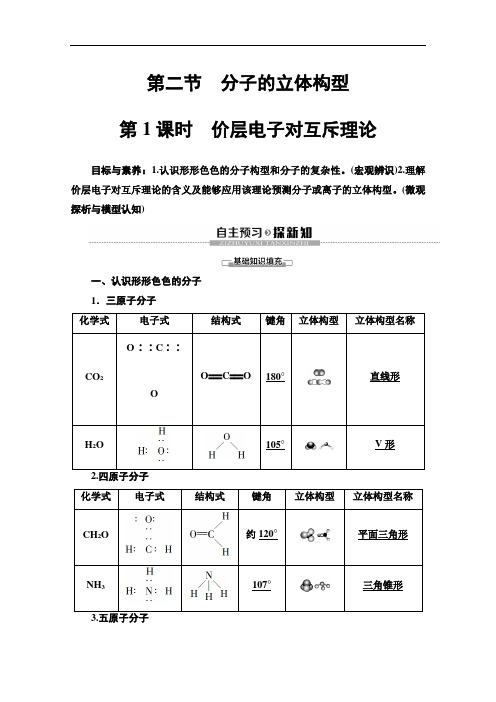
第二节分子的立体构型第1课时价层电子对互斥理论目标与素养:1.认识形形色色的分子构型和分子的复杂性。
(宏观辨识)2.理解价层电子对互斥理论的含义及能够应用该理论预测分子或离子的立体构型。
(微观探析与模型认知)一、认识形形色色的分子1.三原子分子化学式电子式结构式键角立体构型立体构型名称O∶∶C∶∶O===C===O 180°直线形CO2OH2O 105°V形2.四原子分子化学式电子式结构式键角立体构型立体构型名称CH2O 约120°平面三角形NH3107°三角锥形化学式电子式结构式键角立体构型立体构型名称CH4109°28′正四面体形CCl4109°28′正四面体形二、价层电子对互斥理论1.价层电子对互斥理论分子中的价层电子对包括σ键电子对和中心原子上的孤电子对,由于电子对的排斥作用,而趋向尽可能彼此远离,分子尽可能采取对称的立体构型,以减小斥力。
2.价层电子对的确定方法(1)a表示中心原子的价电子数对主族元素:a=最外层电子数;对于阳离子:a=价电子数-离子电荷数;对于阴离子:a=价电子数+离子电荷数。
(2)x表示与中心原子结合的原子数。
(3)b表示与中心原子结合的原子最多接受的电子数。
氢为1,其他原子=8-该原子的价电子数。
3.价层电子对互斥模型与分子(离子)的立体构型(1)中心原子价电子全部参与形成共价键的分子AB n n=2 n=3 n=4价层电子对数 2 3 4成键电子对数 2 3 4电子对立体构型(VSEPR模型)直线形平面三角形正四面体形分子立体构型直线形平面三角形正四面体形实例CO2、BeCl2BF3、BCl3、BBr3CH4、CCl4、SiF4(2)中心原子上有孤电子对的分子:对于中心原子上有孤电子对(未用于形成共价键的电子对)的分子,中心原子上的孤电子对也要占据中心原子周围的空间,并互相排斥使分子呈现不同的立体构型。
高二化学选修3_《分子空间结构与价层电子对互斥理论》课后作业

第二节分子的立体构型第一课时形形色色的分子、价层电子对互斥理论一、选择题(本题包括10小题,每小题5分,共50分)1.2015·试题调研下列分子或离子中,不含孤电子对的是()A.H2O B.H3O+C.NH3D.NH+42.2015·大连高二检测在以下的分子或离子中,空间结构的几何形状不是三角锥形的是()A.NF3B.CH-3C.CO2D.H3O+3.下列分子呈平面三角形的是()A.HgCl2B.BF3C.TeCl4D.SF64.2015·经典习题选萃用价层电子对互斥理论预测H2S和BF3的立体构型,两个结论都正确的是()A.直线形三角锥形B.V形三角锥形C.直线形平面三角形D.V形平面三角形5.(双选)2015·试题调研六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起强温室效应。
下列有关六氟化硫的推测正确的是()A.六氟化硫易燃烧生成二氧化硫B.六氟化硫中各原子均达到8电子稳定结构C.六氟化硫分子中的S—F键都是σ键,且键长、键能都相等D.六氟化硫分子中只含极性键6.2015·山西高二检测用VSEPR模型预测下列分子或离子的立体结构,其中正确的是()A.NH+4为正四面体形B.CS2为V形C.HCN为V形D.PCl3为平面三角形7.2015·经典习题选萃若AB n的中心原子A上没有孤电子对,运用价层电子对互斥模型,下列说法正确的是()A.若n=2,则分子的立体构型为V形B.若n=3,则分子的立体构型为三角锥形C.若n=4,则分子的立体构型为正四面体形D.以上说法都不正确8.下列说法中,正确的是()A.由分子构成的物质中一定含有共价键B.形成共价键的元素不一定是非金属元素C.正四面体结构的分子中的键角一定是109°28′D.CO2和SO2都是直线形分子9.2015·河南高二检测下列说法中正确的是()A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构B.P4和CH4都是正四面体分子且键角都为109°28′C.NH+4的电子式为,离子呈平面正方形结构D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强10.下列说法中,正确的是()A.由分子构成的物质中一定含有共价键B.形成共价键的元素一定是非金属元素C.正四面体结构的分子中的键角一定是109°28′D.不同的原子的化学性质可能相同二、非选择题(本题包括5小题,共50分)11.(6分)2015·试题调研硫化氢(H2S)分子中,两个H—S键夹角接近90°,说明H2S分子的空间构型为________;二氧化碳(CO2)分子中,两个C===O键夹角是180°,说明CO2分子的空间构型为________;甲烷(CH4)分子中,任意两个C—H键的夹角都是109°28′,说明CH4分子的空间构型为________。
高中化学 形形色色的分子与价层电子对互斥理论达标作业选修3

现吨市安达阳光实验学校【成才之路】高中化学 2-2-1形形色色的分子与价层电子对互斥理论达标作业 3一、选择题1.用价层电子对互斥理论判断SO 3的分子构型为( ) A .正四面体形 B .V 形C .三角锥形D .平面三角形答案:D:SO 3中心原子S 的孤电子对数=12(6-3×2)=0,没有孤对电子,只有3对σ键电子对,故其分子构型为平面三角形。
2.下列分子中,各原子均处于同一平面上的是( ) A .NH 3 B .CCl 4 C .PCl 3 D .CH 2O答案:D:由价层电子对互斥理论可知:A 、C 为三角锥形,B 为正四面体形,D 为平面三角形。
3.下列分子或离子中中心原子未用来成键的电子对最多的是( ) A .NH +4 B .NH 3 C .H 2OD .BCl 3答案:C:NH +4中各原子的最外层电子参与成键,NH 3中N 原子的最外层上有1对电子未参与成键,H 2O 中O 原子上有2对电子未参与成键,BCl 3的中心原子为B 原子,其外层电子参与成键。
4.(双选)下列分子的VSEPR 理想模型与分子的立体结构模型相同的是( )A .CCl 4B .CO 2C .NH 3D .H 2O答案:AB:NH 3和H 2O 的中心原子的最外层上有未参与成键的孤电子对,使其分子空间构型分别为三角锥形、V 形,不是四面体形(理想模型)。
5.下列分子的立体结构,其中属于直线形分子的是( ) A .H 2O B .NH 3 C .CO 2 D .P 4 答案:C:水分子是V 形结构,CO 2是直线形结构,NH 3是三角锥形,P 4是正四面体形。
6.下列物质中,分子的立体结构与氨分子相似的是( ) A .CO 2B .H 2SC.PCl3D.SiCl4答案:C:氨分子是三角锥形,H2S分子是V形,CO2是直线结构,PCl3是三角锥形,SiCl4是正四面体形。
7.下列分子的结构中,原子的最外层电子不都满足8电子稳结构的是( )A.CO2B.PCl3C.CCl4D.BF3答案:D:由各种物质的电子式:8.三氯化氮(NCl3)常温下是一种淡黄色液体,其分子结构呈三角锥形,以下关于NCl3说法中正确的是( )A.分子中N—Cl键是非极性键B.分子中不存在孤对电子C.它的沸点比PCl3沸点低D.因N—Cl键键能大,所以NCl3的沸点高答案:C:NCl3分子中中心原子N和氯原子间形成三个σ极性键,N原子的周围仍然存在一对孤对电子;共价化合物的熔沸点是由分子间作用力决的,而分子间作用力的大小又由相对分子质量决,所以NCl3的熔沸点较低。
2.2.2价层电子对互斥理论(学案)高二化学人教版选择性必修2(1)

2.2.2 价层电子对互斥理论【课程目标】一、新课导入【问题情境】为什么甲烷分子的空间结构是正四面体形而不是正方形?二、学生讨论(对照学案分组讨论、同步板书)三、聚焦展示学习目标一、用“气球空间互斥”类比“电子对互斥”并展示成果【思考交流】三原子分子CO2和H2O、四原子分子NH3和CH2O,为什么它们的空间结构不同?【学生活动】写出分子的电子式,再对照其球棍模型,运用分类、对比的方法,分析结构不同的原因。
解释:由于中心原子的对占有一定空间,对其他成键电子对存在,影响其分子的空间结构。
分子的空间结构除了和中心原子与结合原子间的对有关,还和中心原子的有关,两者合称为。
学习目标二、价层电子互斥理论【思考交流】实验测得NH3的键角为107°,H2O的键角为105°,为什么NH3和H2O的键角均小于109°28′?解释:相较成键电子对,孤电子对有较大的排斥力1、理论要点价层电子对互斥理论认为,分子的空间结构是中心原子周围“ ”相互排斥的结果。
价层电子对是指分子中的上与结合原子间的电子对,包括和中心原子上的。
多重键只计其中的σ键电子对,不计。
2、根据VSEPR预测分子的空间结构。
①中心原子无孤电子对的分子:VSEPR理想模型就是其分子的空间结构。
①中心原子有孤电子对的分子:先判断VSEPR理想模型,后略去,便可得到分子的空间结构【展示】思路:价层电子对→互相排斥→尽可能远离→能量最低最稳定1.中心原子不含孤电子对及名称直线形直线形平面三角形平面三角形CH 4 0正四面体形 正四面体形2【针对练习】判断题(正确选A错误选B ) 1.价层电子对互斥理论中,π键电子对数不计入中心原子的价层电子对数( )2.NH 3分子中中心原子上有一个未成键的孤电子对,它对成键电子对的排斥作用较强( )3.N H 4+的电子式为 ,离子呈平面正方形结构( )4.CH 4中C —H 间的键角为109°28',NH 3中N —H 间的键角为107°,H 2O 中O —H 间的键角为105°,说明孤电子对与成键电子对间的斥力大于成键电子对与成键电子对间的斥力( ) 【思考交流】如何计算价层电子对数? 学习目标三、价层电子对数的计算(1)σ键电子对数的计算σ键电子对数可由分子式确定,中心原子有几个σ键,就有几对σ键电子对。
高中化学第二章分子结构与性质第2节第1课时价层电子对互斥模型讲义+精练含解析新人教版选修3

第1课时 价层电子对互斥模型[知 识 梳 理]一、形形色色的分子1.三原子分子立体构型⎩⎪⎨⎪⎧直形线,如CO 2分子V 形,如H 2O 分子2.四原子分子立体构型⎩⎪⎨⎪⎧平面三角形,如甲醛分子三角锥形,如氨分子3.五原子分子立体构型:最常见的是正四面体,如CH 4,键角为109°28′。
【自主思考】下列分子根据其分子立体构型连线。
分子A :H 2O B :CO 2C :NH 3D :CH 2OE :CH 4分子的立体构型①直线形②V形③平面三角形④三角锥形⑤正四面体形答案 A —② B —① C —④ D —③ E —⑤二、价层电子对互斥理论 1.价层电子对互斥理论分子的立体构型是“价层电子对”相互排斥的结果。
2.价层电子对互斥模型(VSEPR模型)与分子(离子)的立体结构【自主思考】如何确定AB n型分子空间构型?答案(1)确定中心原子(A)的价层电子对数。
(2)根据计算结果找出理想的VSEPR模型。
(3)略去孤电子对在价层电子对互斥模型中占有的空间,剩下的便是分子的立体构型。
[效果自测]1.判断正误,正确的打“√”;错误的打“×”。
(1)所有的三原子分子都是直线形结构。
()(2)所有的四原子分子都是平面三角形结构。
()(3)五原子分子的空间构型都是正四面体。
()(4)P4和CH4都是正四面体分子且键角都为109°28′。
()(5)NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强。
()(6)VSEPR模型和分子的立体构型,二者可能是不同的。
()答案(1)×(2)×(3)×(4)×(5)√(6)√2.H2O的中心原子上有对孤电子对,与中心原子上的键电子对相加等于,它们相互排斥形成形VSEPR模型。
略去VSEPR模型中的中心原子上的孤电子对,因而H2O分子呈形。
答案 2 σ 4 四面体V3.用价层电子对互斥模型预测下列粒子的立体结构。
高中化学第二章分子结构与性质第二节第1课时价层电子对互斥理论课时作业课件新人教版选修3

答案
解析 若中心原子 A 上没有未用于形成共价键的孤电子对,则不存在 σ 键电子对与孤电子对之间的相互排斥。当 n=2 时,分子的立体构型为直线 形;n=3 时,分子的立体构型为平面三角形;n=4 时,分子的立体构型为 正四面体形。
休息时间到啦
同学们,下课休息十分钟。现在是休息时间,你们休息一 下眼睛,
答案
解析
6.下列分子的 VSEPR 模型与分子的立体构型相同的是( )
A.CCl4
B.SO23-
C.NH3
D.H2O
答案 A
解析 分子中心原子上无孤电子对时 VSEPR 模型与分子立体构型相 同。
答案
解析
7.下列描述中正确的是( ) A.CS2 为 V 形的极性分子 B.ClO-3 的空间构型为平面三角形 C.SF6 中有 6 对完全相同的成键电子对 D.SiF4 和 SO23-的中心原子均无孤电子对
答案 (1)正四面体形 平面三角形 平面三角形
(2)CH
+
3
CH-3
(3)BF3
NF3
CF4
答案
解析 PO34-是 AB4 型,成键电子对数是 4,为正四面体形。CO23-和 AlBr3 是 AB3 型,成键电子对是 3,孤电子对数为 0,是平面三角形。AB3 型,中心 原子无孤电子对的呈平面三角形,有一对孤电子对的呈三角锥形,所以分别 是 CH+ 3 、CH- 3 。第 2 周期非金属元素构成的中性分子的化学式,呈三角锥形 的是 NF3,呈平面三角形的是 BF3,呈四面体形的是 CF4。
看看远处,要保护好眼睛哦~站起来动一动,久坐对身体 不好哦~
11.下列分子或离子中,价层电子对互斥模型为四面体形,但分子或离
子的立体构型为 V 形的是( )
2017-2018学年度人教版化学选修3高二暑假作业:共价键的主要类型及其运用(含答案)

2017-2018学年度人教版化学选修3高二暑假作业共价键的主要类型及其运用一、单选题1.下列说法正确的是( )A.干冰升华会破坏共价键B.H2O分子很稳定是由于H2O分子之间能形成氢键C.N2H4分子中既含极性键又含非极性键D.由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI2.下列说法正确的是( )A.含有非极性键的分子一定是非极性分子B.非极性分子中一定含有非极性键C.由极性键形成的双原子分子一定是极性分子D.键的极性与分子的极性无关3.共价键具有饱和性和方向性,下列关于共价键这两个特征的叙述中,不正确的是( )A.共价键的饱和性是由成键原子的未成对电子数决定的B.共价键的方向性是由成键原子的轨道的方向性决定的C.共价键的饱和性决定了分子内部的原子的数量关系D.共价键的饱和性与原子轨道的重叠程度有关4.下列物质中σ键和π键数目比为1:2的是( )A.O2B.HCNC.CO2D.N25.下列化合物只含有极性键的是( )A.H 2B.KOHC.H 2OD.Na 2SO 46.下列化学式及结构式中成键情况不合理的是( ) A. 3CH N :B. 2CH SeO :C. 4CH S :D. 4CH Si :7.下列说法正确的是( )A.若把2H O 分子写成3H O 分子,违背了共价键的饱和性B.氯化氢溶于水能电离出H +、Cl -,所以氯化氢是离子化合物C.所有共价键都有方向性D.两个原子轨道发生重叠后,两核间的电子仅存在于两核之间 8.下列关于σ键和π键的理解不正确的是( ) A. σ键能单独形成,而π键一定不能单独形成 B. σ键可以绕键轴旋转, π键一定不能绕键轴旋转C.双键中一定有一个σ键,一个π键,叁键中一定有一个σ键,两个π键D.气体单质中一定存在σ键,可能存在π键 9.下列含有极性键的非极性分子是( )①CCl 4 ②NH 3 ③CH 4 ④CO 2 ⑤N 2 ⑥H 2O ⑦HF A.②③④⑤ B.①③④⑤ C.①③④ D.以上均不对10.下列物质分子中既有σ键,又有π键的( ) ①HCl ②H 2O ③N 2 ④H 2O 2 ⑤C 2H 4 ⑥C 2H 2A.①②③B.④⑤⑥C.①③⑥D.③⑤⑥11.如图为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述中不正确的是( )A.A、C两元素形成的化合物都为共价化合物B.AD2的电子式为C.B、C形成的化合物BC中所含化学键为非极性共价键D.B2的结构式为N≡N12.三硫化四磷(P4S3)用于制造火柴即火柴盒摩擦面,分子结构如图所示。
高中化学 第二章第二节 第1课时 价层电子对互斥理论教案 新人教版选修3
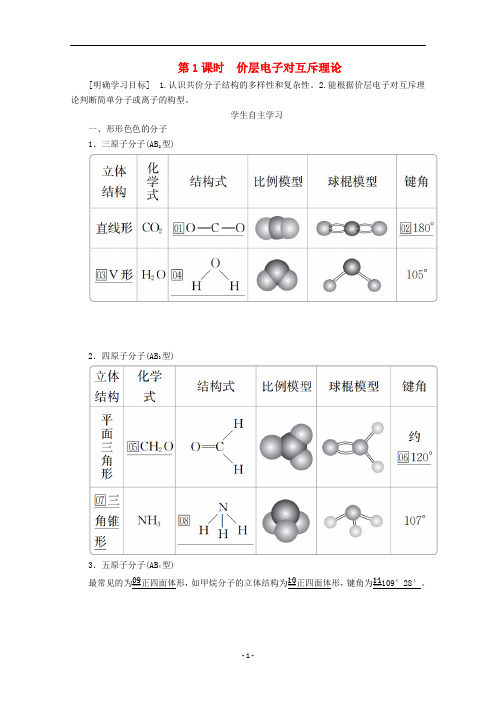
第1课时价层电子对互斥理论[明确学习目标] 1.认识共价分子结构的多样性和复杂性。
2.能根据价层电子对互斥理论判断简单分子或离子的构型。
学生自主学习一、形形色色的分子1.三原子分子(AB2型)2.四原子分子(AB3型)3.五原子分子(AB4型)最常见的为□09正四面体形,如甲烷分子的立体结构为□10正四面体形,键角为□11109°28′。
二、价层电子对互斥理论1.价层电子对互斥理论(VSEPR)01σ键电子对和中心原子上的□02孤电子对)由于□03相互排斥而分子中的价层电子对(包括□趋向尽可能彼此远离,分子尽可能采取对称的立体构型,以减小斥力。
2.价层电子对的确定方法σ键电子对数可由分子式确定。
a表示中心原子的价电子数,对于主族元素来说,a=原子的□04最外层电子数;对于阳离子来说,a=中心原子的□05价电子数-离子电荷数;对于阴离子来说,a=中心原子的□06价电子数+|离子电荷数|。
x表示与中心原子结合的□07原子数。
b表示与中心原子结合的原子□08最多能接受的电子数,氢为1,其他原子=□098-该原子的价电子数。
3.VSEPR模型预测分子或离子的立体构型(1)中心原子上的价电子都用于形成共价键的分子(2)中心原子上有孤电子对的分子对于中心原子上有孤电子对(未用于形成共价键的电子对)的分子,中心原子上的孤电子对也要占据中心原子周围的空间,并互相排斥使分子呈现不同的立体构型。
1.五原子的分子空间构型都是正四面体吗?提示:不是,只有中心原子所连四个键的键长相等时才为正四面体。
如CH 3Cl 因C —H 键和C —Cl 键键长不相等,故CH 3Cl 分子的四面体不再是正四面体。
2.VSEPR 模型和分子的立体构型二者相同吗?提示:不一定相同。
(1)VSEPR 模型指的是包括σ键电子对和孤电子对在内的空间构型;分子的立体构型指的是组成分子的所有原子(只考虑分子内的σ键)所形成的空间构型。
(2)若分子中没有孤电子对,VSEPR 模型和分子立体构型一致;若分子中有孤电子对,VSEPR 模型和分子立体构型不一致。
高中化学第二章分子结构与性质2_1形形色色的分子价层电子对互斥理论课时作业含解析新人教版选修3

形形色色的分子 价层电子对互斥理论一、选择题(每小题4分,共48分)1.下列说法正确的是( D )A .所有的分子都是由两个或两个以上的原子构成B .所有的三原子分子都是直线形结构C .所有的四原子分子都是平面三角形结构D .五原子分子不一定是正四面体形结构解析:稀有气体为单原子分子,H 2O 为V 形,SO 3是平面三角形,NH 3是三角锥形,CH 3Cl 、CH 2Cl 2、CHCl 3等都是四面体形,但不是正四面体形结构。
2.下列分子中键角最大的是( B )A .H 2OB .CO 2C .BF 3D .CH 4解析:四个选项中键角最大的为直线形的CO 2分子,键角为180°,其次为平面三角形分子BF 3,键角为120°,再次为正四面体形分子CH 4,键角为109°28′,最小的是V 形分子H 2O ,由于水分子中存在2对孤电子对,其对成键电子对的排斥作用较强,键角被压缩到104.5°。
3.下列物质的立体构型与NH 3分子相同的是( A )A .H 3O +B .H 2OC .CH 4D .CO 2解析:氨气分子中N 原子的价层电子对数=3+12×(5-3×1)=4,含有一对孤电子对,故氨气分子为三角锥形结构。
H 3O +中氧原子的价层电子对数=3+12×(6-3×1-1)=4,含有一对孤电子对,所以它为三角锥形结构,A 项正确;H 2O 中氧原子的价层电子对数=2+12×(6-2×1)=4,含有2对孤电子对,所以水分子为V 形结构,B 项错误;同理可确定CH 4是正四面体形结构,CO 2为直线形结构,C 、D 项错误。
4.用价层电子对互斥理论预测H 2S 和PCl 3的立体构型,两个结论都正确的是( B )A .直线形,三角锥形B .V 形,三角锥形C .直线形,平面三角形D .V 形,平面三角形解析:H 2S 中S 原子的价层电子对数=2+12×(6-2×1)=4,含有2对孤电子对,所以其立体构型为V 形;PCl 3中P 原子的价层电子对数=3+12×(5-3×1)=4,含有1对孤电子对,所以其立体构型为三角锥形,故选B 。
高中化学选修三 价层电子对互斥理论共32页

1、纪律是管理关系的形式。——阿法 纳西耶 夫 2、改革如果不讲纪律,就难以成功。
3、道德行为训练,不是通过语言影响 ,而是 让儿童 练习良 好道德 行为, 克服懒 惰、轻 率、不 守纪律 、颓废 等不良 行为。 4、学校没有纪律便如磨房里没有水。 ——夸 美纽斯
5、教导儿童服从真理、服从集体,养 成儿童 自觉的 纪律性 ,这是 儿童道 德教育 最重要 的部分 。—— 陈鹤琴
45、自己的饭量自己知道。——苏联
41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2017-2018学年度人教版化学选修3高二暑假作业价层电子对互斥理论一、单选题1.短周期元素Y 的p 轨道上有3个未成对电子,则该元素的最高价氧化物的水化物的化学式可能是( ) A. 34H YO B. 44H YO C. 2HYO D. 24H YO2.若n AB 的中心原子A 上没有孤对电子,运用价层电子对互斥模型,下列说法正确的是( )A.若2n =,则分子的立体结构为V 形B.若3n =,则分子的立体结构为三角锥形C.若4n =,则分子的立体结构为正四面体形D.以上说法都不正确3.下列有关价层电子对互斥理论的说法不正确的是( )A.该理论把分子分成两类,一类是中心原子上的价电子都用于形成共价键,一类是中心原子上有孤电子对B.BF 3和NF 3都是四个原子的分子,BF 3的中心原子是FC.NF 3的中心原子是ND.BF 3分子的立体构型是平面三角形,而NF 3分子的立体构型是三角锥形4. 多核离子所带电荷可以认为是中心原子得到或失去电子导致,根据VSEPR 模型,下列离子中所有原子都在同一平面的一组是( )A .NO -2 和NH -2B .H 3O +和ClO -3 C .NO -3 和CH -3 D .PO 3-4 和SO 2-45.下列分子或离子中,含有孤对电子的是( ) A.H 2O B.CH 4 C.SiH 4 D.NH 4+6.下列微粒中,最外层未成对电子数最多的是( ) A.O B.P C.Si D.Fe 3+7.用价层电子对互斥理论预测2H S 和3BF 的立体结构,两个结论都正确的是( ) A.直线形;三角锥形 B. V 形;三角锥形 C.直线形;平面三角形 D. V 形;平面三角形8.3PH 是一种无色剧毒气体。
下列判断错误的是( ) A. 3PH 分子是非极性分子 B. 3PH 分子中有一对电子孤对 C. 3PH 分子VSEPR 模型的名称是四面体 D. 3PH 分子稳定性低于3NH 分子9.用价层电子对互斥理论(VSEPR )可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( ) A. 2SO 、2CS 、HI 都是直线形的分子 B. 3BF 键角为120°, 2SnBr 键角大于120°C. 2CH O 、3BF 、3SO 都是平面三角形的分子D. 3PCl 、3NH 、5PCl 都是三角锥形的分子10.P 4O 6的分子结构中仅含有单键,每个原子都达到8电子稳定结构,则所有原子的孤电子对数共为( ) A.4 B.10 C.12 D.1611.下列分子或离子中,中心原子含有2对孤对电子的是( ) A.SO 2 B.CH 3- C.H 2S D.NH 4+12.用价层电子对互斥理论预测PO 43-和CS 2的立体结构,两个结论都正确的是( ) A.正四面体形;V 形 B.正四面体形;直线形 C.V 形;直线形 D.V 形;平面三角形 二、多选题13.下列描述中正确的是( ) A. 2CS 为V 形的极性分子 B. 3ClO -的空间构型为平面三角形 C. 6SF 中有6对完全相同的成键电子对 D. 4SiF 和23SO -的中心原子均为3sp 杂化14. 下列分子和离子中,中心原子价层电子对的几何构型为四面体且分子或离子的空间构型为三角锥形的是( )A .NHB .PH 3C .H 3O +D .OF 215、用VSEPR 模型预测,下列分子构型与H 2O 相似,都为V 形的是( )A .OF 2B .BeCl 2C .SO 2D .CO 2 三、填空题16、用价层电子对互斥模型推测下列分子或离子的立体构型: (1)H 2Se________;(2)NH-2________;(3)BBr 3________;(4)CHCl 3________;(5)SiF 4________。
17、(1)利用VSEPR 推断分子或离子的空间构型。
ClO -4________;CS 2________;AlBr 3(共价分子)________。
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。
请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:______________;______________。
(3)按要求写出第二周期非金属元素的原子构成的中性分子的化学式。
平面形分子________,三角锥形分子________,四面体形分子________。
18、20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR 模型),用于预测简单分子立体结构。
其要点可以概括为:Ⅰ.用AX n E m表示只含一个中心原子的分子组成,A为中心原子,X 为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤电子对),(n+m)称为价层电子对数。
分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间:Ⅱ.分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤电子对;Ⅲ.分子中价层电子对之间的斥力主要顺序为:ⅰ.孤电子对之间的斥力>孤电子对与共用电子对之间的斥力>共用电子对之间的斥力;ⅱ.双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;ⅲ.X原子得电子能力越弱,A—X形成的共用电子对之间的斥力越强;ⅳ.其他。
请仔细阅读上述材料,回答下列问题:(1)根据要点Ⅰ可以画出AX n E m的VSEPR理想模型,请填写下表:n+m 2VSEPR理想模型正四面体形价层电子对之间的理109°28′想键角(2)请用VSEPR模型解释CO2为直线形分子的原因_________________________;(3)H2O分子的立体构型为____________________。
请你预测水分子中∠H-O-H的大小范围并解释原因___________________________;(4)SO2Cl2和SO2F2都属AX4E0型分子,S===O之间以双键结合,S—Cl、S—F之间以单键结合。
请你预测SO2Cl2和SO2F2分子的立体构型:________________,SO2Cl2分子中∠ClSCl________________(选填“<”“>”或“=”)SO2F2分子中∠FSF。
19、D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大。
它们的最简氢化物分子的立体构型依次是正四面体、三角锥形、正四面体、V形、直线形。
回答下列问题:(1)Y的最高价氧化物的化学式为________。
(2)上述五种元素中,能形成酸性最强的含氧酸的元素是________,写出该元素的任意三种含氧酸的化学式:________________。
(3)D和Y形成的化合物,其分子的空间构型为________。
(4)D和X形成的化合物,其化学键类型属________。
(5)金属镁和E的单质在高温下反应得到的产物是________,此产物与水反应生成两种碱,该反应的化学方程式是_____________________________________________________。
参考答案一、单选题1.答案:A解析:短周期元素Y的p轨道上有3个未成对电子,则Y的价电子排布式为23ns np,即Y为ⅤA族元素N或P,最高正化合价为+5.2.答案:C解析:若中心原子A上没有未成键的孤电子对,则根据斥力最小的原则,A项中当2n=时,分子的立体构型为直线形,所以错误;B项中3n=时,分子的立体构型为平面三角形,所以错误;C项中当4n=时,分子的立体构型为正四面体形,所以正确;因为C项正确,所以D项错误。
3.答案:B解析:BF3和NF3都是四个原子的分子。
BF3的中心原子是 B,B原子上的价层电子对数为3,孤电子对数为0,故BF3的分子构型为平面三角形。
NF3分子中N原子上的孤电子对数为1,价层电子对数为4,故NF3的分子构型为三角锥形。
4. 答案:A解析:根据三点共面,A项正确;根据价电子互斥理论,B项H3O +中的氧原子上有一孤对电子,故H+为三角锥形;C项中CH-3中C3O原子上有一孤电子对,CH-3亦为三角锥形;D项中的PO3-4、SO2-4均为正四面体型。
5.答案:A6.答案:D解析:铁原子失去3个电子后形成Fe 3+,最外层3d 有5个未成对电子,故此题选择D 。
考点:考查核外电子排布式书写 7.答案:D解析:据价电子对互斥理论可知, 2H S 分子中S 原子采用不等性3sp 杂化,除两对孤对电子外,另外的两个杂化轨道分别与一个H 原子的各一个1s 轨道重叠成键,呈V 形结构; 3BF 分子中B 原子采用2sp 杂化,三个2sp 杂化轨道分别与三个F 原子的各一个2p 轨道重叠成键,呈平面三角形结构。
8.答案:A 9.答案:C 10.答案:D 11.答案:C 12.答案:B 二、多选题 13.答案:CD解析:类比2CO 可知2CS 是直线形分子; 3ClO -的空间构型不是平面三角形而是四面体形; 6SF 中S 的外围电子全部成键,故分子中S F -键的成键电子对完全相同; 4SiF 是由中心原子Si 采取3sp 杂化形成的正四面体形结构, 23SO -的中心原子也是3sp 杂化,其中一个杂化轨道有未成键的孤电子对,另外三个杂化与O 形成共价键。
14.答案:BC解析:所给分子中中心原子价层电子对数A 项4+12(5-1-4×1)=4,B 项3+12(5-3×1)=4,C 项3+12(6-1-3×1)=4,D 项2+12(6-2×1)=4,所以价层电子对的几何构型均为四面体,若分子或离子构型为三角锥形,则中心原子需结合三个原子,即存在一个孤电子对,B 、C 项符合。
15、答案:AC解析:OF 2中价层电子对数为2+12(6-2×1)=4,其VSEPR 模型为四面体形,因含2对孤电子对,故分子构型为V 形;SO 2价层电子对数为2+12(6-2×2)=3,其VSEPR 为平面三角形,含有一对孤对电子,分子构型为V 形;BeCl 2、CO 2中,中心原子价电子全部成键,是直线形。
三、非选择题16、解析:根据原子的最外层电子排布,可以判断出本题分子的中心原子含有的孤电子对数和结合的原子数为:化学式 H 2Se NH -2BBr 3 CHCl 3 SiF 4中心原子 含有的孤 电子对数 2 2 0 0 0中心原子 的σ键数 2 2 3 4 4中心原子 的价层电 子对数4 4 3 4 4H 2Se 、NH -2 分子略去两对孤电子对,分子构型为V 形,BBr 3为平面三角形,CHCl 3分子中由于H 原子和Cl 原子不同,不能形成正四面体形,SiF 4为正四面体形。
