硼族元素教学内容
硼族元素.ppt
N a 2 B 4 O 7 1 0 H 2 O 8 7 8 ℃ B 2 O 3 + 2 N a B O 2 + 1 0 H 2 O
硼砂
• 硼砂珠试验——鉴定金属离子
硼砂与B2O3、B(OH)3一样,与一些金属氧化物共熔 →带特征颜色的偏硼酸盐。
Na2B4O7+CoO=2NaBO2.Co(BO2)2 蓝宝石色
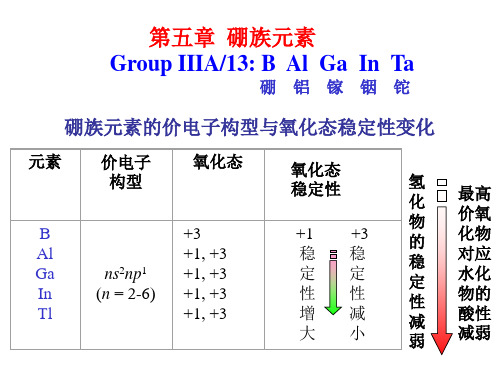
2.04
Al 3s23p1
+3 118 1.61
Ga In Tl 4s24p1 5s25p1 6s26p1 +3(+1) +3,+1 +1(+3) 126 144 148
1.81 1.78 1.8
硼族元素基本性质
◆ 价电子构型:ns2np1
◆ 缺电子元素:价电子数<价层轨道数
◆ 缺电子化合物:成键电子对数<价层轨道数
2Cr(BO2)3·6NaBO2 Cu(BO2)2 CuBO2 Fe(BO2)2 Fe(BO2)3 Ni(BO2)2 MnO2·2B2O3
绿色 蓝色 红色 绿色 棕色 黄棕 紫色
三氧化二铝 2. 铝的含氧化合物
多种变体, -Al2O3 , -Al2O3 (I) -Al2O3 自然界存在刚玉:熔点高,硬度大 (II) -Al2O3 吸附剂和催化剂 天然宝石: 透明氧化铝晶体含不同杂质而呈现鲜明颜色
本章主要内容
● (一) 硼、铝单质、氢化物、卤化物、含 氧化合物的结构和性质
● (二) 了解硼、铝化合物的缺电子性 ● (三) 硼族元素性质递变规律
§16.1 硼族元素通性
● 硼(B) 铝(Al) 镓(Ga) 铟(In) 铊(Tl)
B
价电子结构 2s22p1
硼族元素教案

硼族元素教案教案标题:硼族元素教案教案目标:1. 理解硼族元素的基本特性和周期表中的位置。
2. 掌握硼族元素的常见化合物及其用途。
3. 能够解释硼族元素在生活和工业中的重要性。
教案步骤:引入活动:1. 向学生介绍周期表中的硼族元素,包括硼、铝、镓、铟和锑。
解释它们在周期表中的位置和一些基本特性。
知识讲解:2. 讲解硼族元素的电子结构和原子半径的特点。
强调硼族元素的电子外层结构为ns²np¹。
3. 解释硼族元素的离子半径变化趋势,即离子半径随着周期数增加而增大,但在同一周期内,离子半径随着原子序数增加而减小。
4. 介绍硼族元素的常见化合物,如硼酸、三氧化二硼、氢化铝等,并讨论它们的用途和重要性。
实验活动:5. 进行一个简单的实验,演示硼酸和氢氧化钠溶液的中和反应,观察生成的产物。
6. 引导学生观察实验现象,并引导他们进行讨论,解释产物的形成原理。
应用拓展:7. 引导学生思考硼族元素在生活和工业中的应用。
例如,硼酸在玻璃制造中的应用,氢化铝在铝制品生产中的应用等。
8. 鼓励学生进行小组讨论,分享他们对硼族元素应用的了解,并展示给全班。
总结活动:9. 概括硼族元素的基本特性和周期表中的位置。
10. 强调硼族元素在生活和工业中的重要性,并鼓励学生继续深入学习和探索该主题。
教学资源:1. 周期表2. 实验材料:硼酸、氢氧化钠溶液等3. 图片或视频资料,展示硼族元素的应用领域评估方法:1. 学生参与课堂讨论和实验的积极程度。
2. 学生对硼族元素基本特性和应用的理解程度,可以通过小组讨论和展示来评估。
备注:根据具体教学时间和学生能力,可以对教案中的步骤和活动进行适当调整和修改。
《硼族元素教学》课件

结语
在《硼族元素教学》的PPT课件中,我们通过介绍硼族元素的共性与特性、 物理性质、化学性质及应用领域,希望增加大家对硼族元素的了解和兴趣。 感谢您的参与与探索!
硼族元素在自然界中的分布
硼族元素在地壳中广泛存在,并在矿物、土壤和化石中得以发现。
硼族元素的共性与特性
1 电子结构和周期表
位置
2 原子半径和离子半径 3 电负性和金属性
硼族元素的原子半径较
硼族元素的电负性较低,
硼族元素的电子结构决
小,并且与离子半径、
而金属性较强,具有一
定了它们的化学性质,
电荷密度有关。
硼族元素的化学性质
1
化合价和化合物类型
硼族元素的化合价各不相同,形成了多种不同类型的化合物,如氧化物、氢化物 等。
2
饱和度和极性
硼族元素的饱和度和极性影响了它们的化学反应和与其他元素的相互作用。
3
化学反应和反应机理ห้องสมุดไป่ตู้
硼族元素在化学反应中表现出特定的反应机理和行为,为化学合成和反应设计提 供了重要基础。
《硼族元素教学》PPT课 件
欢迎来到《硼族元素教学》课件!在这个课程中,我们将深入了解硼族元素 的共性与特性、物理性质、化学性质以及应用领域。让我们开始探索吧!
介绍
硼族元素的定义
从化学角度来看,硼族元素是周期表中第13族元素,具有特定的电子结构和化学性质。
硼族元素的历史和发现
硼族元素的发现与历史悠久,包括对硼,铝和镓等元素的研究与探索。
应用与展望
硼族元素在材料科学中 的应用
硼族元素及其化合物在材料科 学领域中有着广泛的应用,如 硼氮化物在高温材料和涂层中 的应用。
硼族元素在生命科学中 的应用
无机化学教学课件 13章 硼族元素

1273 K 以上得蒸气.
O 136 pm B O
无定形B2O3 蒸气分子
90-125°
B 120 pm O
B2O3 主要显酸性,有时又像碱性氧化物: B2O3 + CoO==Co(BO2)2 B2O3 + P2O5==2BPO2 B2O3 溶于水生成硼酸,但在热的水蒸气中生成可挥发的偏硼酸: B2O3 + 3H2O==H3BO3
氢
结合力的类型 键 能
键
氢
桥
主要是静电作用 小(与分子间力相近)
共价键(三中心二电子键) 较大(小于正常共价键)
H 连接的原子
电负性大,半径小的原子, 缺电子原子,主要是B 主要是F、O、N
与H相连的原子的对称性
不对称(除对称氢键外)
对
称
Question 2
为什么硼的最简单氢化物是 B2H6 而不是 BH3 ?但硼的卤化物能以BX3形式存在?
(阴极) (阳极)
金属铝的生产车间
金属铝电解池
● 硅 (Silicon):冶金级硅(纯度 98.5%~99.7%)全世界年产量约 5×105 t. 大部分以各种品级的硅铁进入市场,年产量 5×108 t.
>2000℃
SiO2 + 2 C
Si + 2 CO
硼元素和铝元素在原子半径、电离能、电负性、单质的熔点等性 质上有比较大的差异。 硼族元素的价层电子组态为 ns2np1,一般形成氧化值为 +3 的化合 物。随着原子序数增加,硼族元素形成较低正氧化值(+1)化合物的趋势 逐渐增大。硼的原子半径较小,电负性较大,所以硼的化合物都是共 价型化合物。而其他硼族元素与活泼非金属可形成离子型化合物,但 由于 M3+ 具有较强的极化作用,这些化合物中的化学键也表现出一定 的共价性。在硼族元素的化合物中,形成共价键的趋势自上而下依次 减弱。 硼族元素原子有四个价层轨道和三个价电子。这种价电子数小于价 层轨道数的原子称为缺电子原子,它们所形成的化合物为缺电子化合物。 在缺电子化合物中,由于有空的价层轨道存在,所以它们具有很强的接 受电子对的能力,容易形成聚合分子和配合物。 在硼的化合物中,B 的最高配位数为 4,而在硼族其他元素的化合 物中,中心原子的配位数可以是 6。
无机化学下册:第十六章硼族

22
I. 结构
分子间通过氢键形成接近六角形的对称层状结构,层与层 之间借助微弱的范德华力联在一起因此硼酸晶体为鳞片状
23
II. 酸性
B(OH)3+H2O==[(OH)3B←OH]-+H+ Ka==5.810-10
硼酸是一元路易斯酸,它的酸性不是电离出H+,而是从水中夺取
∧
‖
∨
价层电子轨道数
特点
有空轨道
有孤对电子
举例
B、Al
C、Si N、O、7X
Ga的半径较小,电负性比Al大,
所以铝的金属性要比镓的强。
IIIA
硼(B) 铝(Al) 镓(Ga) 铟(In) 铊(Tl)
原子序数 价层电子构型
5
13
31
49 81
2s22p1 3s23p1 4s24p1 5s25p1 6s26p1
Cr2O3--绿色(Cr(BO2)3) MnO--紫色(Mn(BO2)3)
用途:用做制B的其他化合物的原料。
H+
多硼酸盐 OH- H3BO3
H+
加热
Na2B4O7·10H2O
H3BO3
B2O3
B和Si有很多相似之处,同学们可以自己将他们比较一下。 28
第三节 铝族元素
一、单质概述 1. 成键特征
共价特点
△
B2O3+3Mg====3MgO+2B
晶态硼可用氢还原卤化硼得到
2BBr3+3H2==1=3=7=T3-a=1=丝57=3=K===2B+6HBr
硼烷或碘化硼可以直接热分解得到硼。
2BI3=====2B+3I2
第14章硼族元素

第14章硼族元素1、教学要求:掌握本族元素的单质、氢化物、氧化物的结构和性质.2、掌握本族元素的缺电子性及其对化合物的影响.3、掌握硼烷结构的五大成键要素,并能分析硼烷结构.4、掌握硼酸盐的结构特点.5、了解本族元素性质的变化规律特点,并与氮族和碳族进行比较.6、进一步熟悉等电子体原理及其应用.14.1硼族元素的通性一、硼族元素大都性质出现规律性变化,但也有异常:1、异常一、电子亲和能异常变化:B的电子亲和能异常的小,这是由于第二周期元素原子半径太小所致。
2、异常二:Tl第一电离能和电负性异常大的原因是其6s1的惰性电子对效应较大。
3、异常三:对比Al和K单质沸点和第一电离能十分相近而与第五周期中的In相差较大。
原因是钪系收缩:分析由Sc至Zn十种元素,电子排满4s层后,由于能级交错开始在3d 亚层排布,由于d电子云分布弥散,屏蔽作用较弱,因而由电子增加相随的质子数的增加起主导作用,从而有效核电荷增加,对外层电子束缚增强,原子半径不断减小,致使最后与Al半径相近。
二、硼族元素价电子数少于价电子轨道数,像这样的被成为缺电子原子。
这些元素的电负性较大,失去价电子层上的一个p电子成为正离子较困难,因而倾向于sp2杂化,所以B常见氧化态为3.另外本族氧化数变化规律是:从B到Tl高氧化态(Ⅲ)稳定性由大到小,而低氧化数(Ⅰ)稳定性由小到大。
★14.1.2硼族元素成键特点1、我们已经知道B族元素为缺电子原子,由缺电子原子与其他原子形成的化合物,通常价电子数不足(未达到稳定结构)这些化合物称为缺电子化合物。
缺电子化合物通常具有特殊的化学性质,是典型的路易斯酸。
2 、另外缺电子原子在形成共价键时,往往通过形成多中心的桥式键,如硼烷。
再举一些例子进行解释……BF3很容易与具有孤电子对的氨形成配合物;两个气态AlCl3分子借“氯桥”形成二聚合分子。
具体:AlCl3的二聚与缺电子性AlCl3在气相、熔融状态或在有机溶剂中都存在二聚体(AlCl3)2。
硼族元素 PPT教程 【优秀课件】元素化学 大学化学化工专业资料

元 素 符
价电子 层结构
主要 氧化
值
号
共 价 半 径
/pm
硬度 (金刚
石
=10)
熔点 ℃
沸点 /℃
第一 电离
能
/kJ·m ol-1
第一电 子亲合
能
/kJ·mol-
1
电 负 性
晶体类型
B 2s22p1 +3
88 9.5 2180 3650 801
23 2.0 原子晶体
Al 3s23p1 +3 125 2.9 660 2467 578
2H3BO3
B2 O3 + 3H2O
性质:水蒸气中形成偏硼酸,在水中形成硼酸 B2O3(s) + H2O(g) = 2HBO2(g) B2O3(s) + 3H2O(1) = 2H3BO3(aq)
熔融状态的B2O3可溶解许多金属氧化物,制得有色硼玻璃。
3 硼的化合物
◇硼酸 H3BO3
H3BO3 ,或写为B(OH)3,是白色片状晶体。
3 硼的化合物
②与多羟基化合物加合
硼酸是典型的路易斯(Lewis)酸,在其溶液中加入甘油和甘露醇等
R
R
R-
H C OH H3BO3 2 H C OH
HCO OCH
H
C
B OO
C
H H 3H2O
R'
R'
R
R' R
H C O H HO
OH H O C H
B
H C O H HO
HOCH
③ 受热易分解
铝粉和铁的氧化物混合可制成铝热剂。 8Al + 3Fe3O4 = 4A12O3 + 9Fe ∆rHmΘ= -3329 kJ/mol 若这个反应在小容器中进行,可达很高温度(约3500℃)
无机化学教学13章硼族元素PPT课件

镓的氧化物包括Ga₂O₃和GaO,它们具有高熔点和稳定性,可用于制备其他镓的化合物。镓的氧化物可以 由金属镓与氧气反应得到。
镓的硫化物和硒化物
镓的硫化物
镓的硫化物包括Ga₂S₃和GaS,它们具有较高的硬度、熔点和导电性。镓的硫化物可以 由金属镓与硫反应得到。
镓的硒化物
镓的硒化物包括Ga₂Se₃和GaSe,它们具有与硫化物类似的性质,如高熔点和导电性。 镓的硒化物可以由金属镓与硒反应得到。
有机镓化合物
有机镓酸酯
有机镓酸酯是一类重要的有机化合物, 它们可以通过酯交换反应制备。有机镓 酸酯在聚合反应中用作催化剂和添加剂 。
VS
其他有机镓化合物
除了有机镓酸酯外,还有许多其他有机镓 化合物,如有机镓醇、有机镓酸盐等。这 些化合物在医药、材料科学和催化等领域 有广泛的应用。
06 铟的化合物
铟的卤化物和氧化物
铟的卤化物
铟与卤素(如氟、氯、溴、碘)反应,生成 相应的卤化物。这些卤化物具有较高的熔点 和沸点,在常温下多为固态。
铟的氧化物
铟与氧气反应,可以生成多种氧化物,如 In2O3和In2O。这些氧化物具有不同的性 质和应用,例如In2O3是一种半导体材料, 可用于制备透明导电膜。
铟的硫化物和硒化物
无机化学的重要性
无机化学在化学学科中占据重要地位 ,是学习其他化学课程的基础。
无机化学在工业生产和科学研究中具 有广泛的应用,如制药、农业、能源 等领域。
02 硼族元素概述
硼族元素的定义
硼族元素
指周期表中第13族(ⅢA族)的元 素,包括硼(B)、铝(Al)、镓 (Ga)、铟(In)、铊(Tl)等元 素。
硼氢化合物和有机硼化合物
硼氢化合物
教学课件第16章硼族元素

共价键B:2s22p1受到激发→2S12Px12Py12Pz0
硼单质是由B12二十面体对称体为结构单元, B-B相互间如果只形成3个传统的共价键, 达不到稳定的电子结构;缺少电子,不 稳定。折中的办法形成了,三中心2电子 的特殊的键。
P772反应: 无定型硼:B+O2→ B+Cl2→ B+N2→
赤热 B+6H2O(g)→2B(OH)3+3H2↑ 热 B+3HNO6(浓)→B(OH)3+NO2↑ 碱中 B+NaOH+3KNO3→NaBO2+KNO2+H2O
NiO+B2O3→Ni(BO2)2
16-3惰性电子对效应
斜对角线规则
Li-Mg Be-Al B-Si 碳酸及其盐热分解 易 H2CO3>HCO3-->NaCO3- 难 Li2CO3>Na2CO3>K2CO3 MgCO3>CaCO3>BaCO3
Li2CO3~MgCO3 Na2CO)3++H2O→B(OH)4-+H+ P780卤化物 B2O3+HF→BF3(g)
BF3+AlCl3→AlF3+BCl3(g) BF3+H2O→H3O++BF4-+B(OH)3 P783氧化物 B2O3+H2O(g)→HBO2(g) B2O3+H2O(l)→H3BO3 硼珠试验:CuO+B2O3→Cu(BO2)2 兰
C2H6+O2→CO2+H2O ΔH=-1559KJ•mol-1 除硼以外,均为金属
硼族元素单质
自 然 界 存 在 : Na2B4O7•10H2O,Al2O3 铝 矾 土
《硼族元素教学》PPT课件

36
⑵ 硼珠实验
熔融态的B2O3溶解金属氧化物 得到有特征 颜色的偏硼酸盐玻璃。
B2O3+CuO=Cu(BO2)(蓝色) B2O3+NiO=Ni(BO2)(绿色) ⑶ 与NH3反应
1/2xB2O3+XNH3→(BN)x+H2O(873K)
B
B
N
N
N
B
B
B
N
N
氮化硼,结构 与石墨相同 37
38
补充:无机苯(环硼氮烷)
3NH4CI+3LiBH4=B3N3H6+3LiCI+9H2
环硼氮烷的电子结构式和几何形状都与苯相似,化学
性质也相似,但更活泼,易加成、取代。
H
H CI
H N B N H HCI
HBH HN N H
H B BH N
CI B B H
HN
CI 39
H
HH
硼酸H3BO3
偏硼酸 (正)硼酸 多硼酸 HBO2 H3BO3 xB2O3·yH2O
蒸气的单分子构型
O 136pm
B
B 120pm
O
90-125°
O
35
制法
2H3BO3 △ B2O3+3H2O
4B(s)+3O2(g) 高温 2B2O3(s)
性质
⑴ 易溶于水
B2O3(晶状)+H2O(g)→2HBO2(g)(易挥发)
B2O3(无定形)+3H2O(l)→2HBO3(aq)
白色粉末状B2O3可用作吸水剂。
CI
AI
AI
CI
CI
CI
32
氯桥
AICI3:路易士酸,有机催化剂。易水解放 热,潮湿空气中冒烟。干法制。
硼族元素PPT

§16-2 硼族元素的单质及其化合物
• ☞ 自然界中的分布 B: 各种硼酸盐形式,如: 硼砂Na2B4O7· 2O 10H 方硼石2Mg3B8O15•MgCl2 白硼钙石Ca2B6O11 · 2O 3H • Al: 铝矾土矿 • Ga: 存在于铝矾土和煤中 • In, Tl:存在于闪锌矿中
☞ 硼族元素的单质
☞命名:同碳烷
若原子数目相同,而H原子数目不同:
B5H9 B5H11 戊硼烷-9 戊硼烷-11
☞毒性大
空气中允许的最高浓度10-6(ppm) COCl2 光气 1 HCN 氰化氢 10 B2H6 0.1
☞硼烷的合成:须间接合成 • 以乙硼烷的合成为例: • ☞质子置换法: 2BMn + 6H+ = B2H6 + 2Mn3+ • ☞氢化法:2BCl3 + 6H2 = B2H6 + 6HCl • ☞氢负离子置换法:(乙醚,无水无氧) 3LiAlH4 + 4BF3 = 2B2H6 + 3LiF + 3AlF3 3NaBH4 + 4BF3 = 2B2H6 + 3NaBF4
第五ቤተ መጻሕፍቲ ባይዱ 硼族元素
(IIIA族)
B硼 Al 铝 Ga 镓 In 铟 Tl 铊
学习要求:
☎ 了解硼族元素的通性,单质硼 的结构和性质 ☏ 熟悉硼的缺电子性和缺电子化 合物 ☎ 掌握硼的氧化物、含氧酸及其 盐的结构和性质 ☏了解铝族化合物的性质
§16-1 通性
• 价电子构型:ns2np1随z,+1价 稳定 • +3价化合物有较强的共价性 • 形成缺电子化合物:典型的 Lewis酸 • 易形成配位化合物
☞Al:略(P772-773)铝热反应 ☞Ga:银白色,软,m.p.302.78K, b.p.2343K,熔沸 点相差在所有金属中最大,用于高温温度计,凝 固时体积膨胀,硬度与铅相近In、Tl同Ga MX3 (Cl, Br常 B < Al > Ga > In >Tl 温;I加热) M2O3/ X2 ☞ Ga+、In+具还原性 M2S3 灼热S, O2 Ga,In无 ☞ Ga(OH)3两性,酸 Ga 性稍强于Al(OH)3 干燥空气中 变化Tl OH In 常温 有氧化 (III) 的强氧化性: ☞ Tl Tl 热稀HCl 膜生成 -+H 热稀HNO3 [Ga(OH) ]
大学化学课件硼族元素
价电子数 < 价轨道数,B是缺电子原子 → 缺电子化 合物BX3、B(OH)3等,Lewis酸。
3. 形成多中心缺电子键,形成多面体-结构复杂: 硼晶体中有B-B-B, 硼烷中有B-B-B,或B-H-B 3c - 2e键 (3c-2e bond)
(1) 价轨道数:46 +110 = 34 6B 10H
(2)价电子数 3×6 + 1×10 = 28 6B 10H
6个 B-H 2c-2e: 2e×6 =12 e 4个 B-H-B 3c-2e: 2e×4 = 8 e
B
2个3c-2e:
2e×2 = 4 e
B
B
2个B-B 2c-2e:2e×2 = 4 e
例:TlCl3 ═══ TlCl + Cl2↑ 室温TlBr3分解;无Tl(III)I3,但 Tl+I3- 存在。
§5-3 硼烷
一、组成
BnHn+4 和BnHn+6 , 共20多种。
二、命名:同碳烷
BnHn+4
B2H6 B5H9 戊硼烷-9 B16H20
BnHn+6
B5H11 戊硼烷-11
乙硼烷 B1~B10 甲、乙、…… 辛、壬、癸)
(B-B 203 pm),共用去:
键(B-B 171 nm),共用去:
6 × 2/3 e = 4 e
6 × 2/2 e = 6 e
➢与外部B12 成键共用去4 e + 6 e = 10 e
(2) B12 单元内部成键 : 由“多面体顶角规则”确定:
硼族元素教学要求1了解硼的缺电子特性2了解氧化硼

第 16 章硼族元素[教学要求] 1. 了解硼的缺电子特性。
2. 了解氧化硼、硼酸、硼砂的性质和用途。
3. 了解 Al(OH)3 的两性,铝的卤化物的结构和性质,铝的结构和用途。
[教学难点] 硼的多中心少电子键 [教学重点] 硼的单质、氢化物、含氧化合物和卤化物的制备、性质和用途。
[教学时数] 3 学时 [教学内容] 1. 硼单质 2. 硼烷 3. 硼的含氧化合物 4. 铝单质及其化合物 5. 镓铟铊 16-1 硼 16-1-1 单质硼 单质硼有多种同素异形体,无定形硼为棕色粉末,晶体硼呈灰黑色。
单质硼的硬度近似 于金刚石,有很高的电阻,但它的导电率却随着温度的升高而增大。
1. 单质硼的结构 晶态单质硼有多种变体,它们都以 B12 正二十面体为基本的结构单元。
这个二十面体由 12 个 B 原子组成,20 个接近等边三角形的棱面相交成 30 条棱边和 12 个角顶,每个角顶为 一个 B 原子所占据。
由于 B12 二十面体的连接方式不同,键也不同,形成的硼晶体类型也 不同。
其中最普通的一种是 α 一菱形硼。
α 一菱形硼是由 B12 单元组成的层状结构,α 一菱形硼晶体中既有普通的 σ 键,又有三 中心两电子键。
许多 B 原子的成键电子在相当大的程度上是离域的,这样的晶体属于原子 晶体,因此晶态单质硼的硬度大,熔点高,化学性质也不活泼。
2. 单质硼的性质 晶态硼较惰性,无定形硼则比较活泼。
(1) 与非金属作用 高温下 B 能与 N2 、O 2 、X 2 等单质反应 , 例如它能在空气中燃烧生成 B2O 3 和少量 BN, 在室温下即能与 F 2 发生反应,但它不与 H 2 作用。
(2)B 能从许多稳定的氧化物(如 SiO2、P 2O5、H 2O 等)中夺取氧而用作还原剂。
例如在赤热下, B 与水蒸气作用生成硼酸和氢气:2B + 6H 2 O(g) == 2B(OH) 3 + 3H 2 ↑ (3) 与酸作用 B 不与盐酸作用,但与热浓 H 2 SO 4 ,热浓 HNO 3 作用生成硼酸: 2B + 3H 2 SO 4 ( 浓 ) == 2B(OH) 3 + 3SO 2 ↑ (4) 与强碱作用 在氧化剂存在下,硼和强碱共熔得到偏硼酸盐: 2B + 2NaOH + 3KNO 2 == 2NaBO 2 + 3KNO 2 + H 2 O (5) 与金属作用 高温下硼几乎能与所有的金属反应生成金属硼化物。
无机化学课件硼族元素

oxidation number
ⅢA —— ns2np1
0、+1、+3
其中铝是地壳中蕴藏最丰富的金属元素主要以铝矾 土矿(Al2O3·xH2O)存在铝是银白色、有光泽的轻金属 具有良好的导电性和延展性广泛用来作导线、结构材料 和器皿铝合金质轻又硬,用于飞机制造。
所以硼族元素有时称为土族元素,其中Al2O3为黏 土的主要成分,既难溶又难熔
第十三章 p区元素(一)
一. 硼族元素
二. 碳族元素
§13.1 硼族元素
(The Boron Family Elements)
本节要求:
1. 了解硼族元素的通性、硼单质的性质; 2. 掌握缺电子原子及其化合物的结构特点和性质; 3. 熟悉硼的典型化合物(硼酸、硼砂)的性质和硼砂 珠试验; 4. 熟悉铝的化合物的性质特点。
B2O3 + 3Mg
2B + 3MgO
KBF4 + 3Na
3NaF + KF + B
(2)工业上:从硼镁矿 → 单质硼 → 精制硼
Mg2B2O5·5H2O + 2NaOH
2NaBO2 + 2Mg(OH)2 + 4H2O
4NaBO2 + CO2 + 10H2O
Na2B4O7·10H2O + Na2CO3
硼的主要化合物有硼酸、硼砂、卤化硼
(一)、硼酸H3BO3 —— 分子结构如下:
B:sp2杂化;存在分子间氢键形成接近六角形的对称层 状结构;层与层之间的分子作用力结合——与石墨相似
能溶于水,为典型的Lewis一元弱酸,由sp2 →sp3:
B(OH)3 + H2O
[B(OH)4] - + H +
无机化学(4)硼族元素

三、硼的重要化合物 1. 乙硼烷 2H6) 乙硼烷(B 硼氢化合物称为硼烷(与碳氢化合物称为烷烃 与碳氢化合物称为烷烃, 硼氢化合物称为硼烷 与碳氢化合物称为烷烃 硅氢 化合物称为硅烷类似), 已合成出20多种硼烷 多种硼烷, 化合物称为硅烷类似 已合成出 多种硼烷 最简单的 是乙硼烷(B2H6)。 是乙硼烷 。 (1) B2H6的结构 根据气体密度实验证明, 根据气体密度实验证明 最简单的硼烷是乙硼烷 (B2H6), 不存在 3。为什么呢 不存在BH 为什么呢? • 这是由硼原子的缺电子特征所决定的 这是由硼原子的缺电子特征所决定的: • 乙硼烷中每个硼原子采取 3杂化,形成4个不等 乙硼烷中每个硼原子采取sp 杂化,形成 个不等 硼原子采取 杂化轨道。每个B原子中的 原子中的2个 杂化轨道与2个 性sp3杂化轨道。每个 原子中的 个sp3杂化轨道与 个 氢原子s轨道形成 个正常的σ键 轨道形成2个正常的 氢原子 轨道形成 个正常的 键;而一个硼原子含电子 杂化轨道与另一个硼原子不含电子的sp 的sp3杂化轨道与另一个硼原子不含电子的 3杂化轨道 同时与氢原子1s轨道重叠 形成三中心两电子键 轨道重叠, 三中心两电子键。 同时与氢原子 轨道重叠,形成三中心两电子键。
Al
Ga
In
Tl
└(稀散元素 稀散元素)┘ 稀散元素 1. 价层电子构型: 价层电子构型: ns2np1 2. 存在惰性电子对效应 存在惰性电子对效应: B ─→ Tl +1氧化态稳定性 ; 氧化态稳定性↑; 氧化态稳定性 +3 氧化态稳定性↓ 氧化态稳定性 B Al Be C Si H NPOSX 缺电子原子 等电子原子 多电子原子 价电子数 < 价层轨道数 价电子数 = 价层轨道数 价电子数 > 价层轨道数
第十六章 硼族元素..

BnHn+m硼烷半拓扑图中键型与键数的确定(P779)
通式为BnHn+m硼烷分子的参数 m、n、s、t、y、x 的 联立方程: x = m s
t = ns
2 y = s x
B6H10
styx=4220
此外,还有6个 外向B—H键。
B5H11、 B5H9的三中心键及半拓扑图式
H H H H B H
§16-2 硼及其化合物
2-1 硼在自然界的存在
——以硼酸盐的形式存在
主要矿有:
硼砂—— Na2B4O7· 10H2O 方硼矿—— 2Mg3B8O15 · MgCl2 白硼钙石——Ca2B6O11· 3H2O 等
我国西部地区的内陆盐湖和吉林、辽宁等省有硼矿。
2-2 硼的成键特征
(硼的化学主要表现在缺电子性质上)
(1) 基态B的价层结构
B是缺电子原子
B
2s2
2p1
(2) 硼化合物中激发态B的价层电子分布
B可采取sp2、sp3 杂化轨道成键
B
2s1
2p2
(3) 硼原子成键的三大特征
① 共价性——B以形成共价化合物为特征
B的原子半径小,I1、I2、I3 大,B在形成化合物时: 可以采取sp2杂化成键,例如:BX3、B(OH)3 也可以采取sp3杂化成键,例如:BF4-、 BH4-、 B(OH)4-
Si-F 565
Si-Si 222
C-F 485
C-C 346
而C 的自相 成键能力最 强
键能(kJ· mol-1)
铝热反应:4Al + 3O2 == 2Al2O3 rHm = -3339 kJ· mol-1 冰晶石矿Na3[AlF6]的存在,说明Al也是亲O、F的元素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
● α-菱形硼-----层状结构
1
3
4
2
5
6
9
8
10
7
11
12
化学性质
晶体硼惰性,无定形硼稍活泼,高温下显还原性
① 易在氧气中燃烧 (B亲O) B在炼钢中作脱氧剂 4B + 3O2 ═9═73═K 2B2O3
硼族元素
§16.1 硼族元素通性
● 硼(B) 铝(Al) 镓(Ga) 铟(In) 铊(Tl)
B
价电子结构 2s22p1
主要氧化态 +3
共价半径/pm 82
电负性
2.04
Al 3s23p1
+3 118 1.61
Ga In Tl 4s24p1 5s25p1 6s26p1 +3(+1) +3,+1 +1(+3) 126 144 148
➢B2H6中B -H -B键的性质
a
B sp 3
n b H 1s
➢ 硼烷成键5种类型
1.末端 B-H: 2.正常 B-B 键
3.氢桥键
4.桥式(开放式)
正常键
H BB
B
BB
B
2c-2e bond; 2c-2e bond;
3c-2e bond;
3c-2e bond;
5.封闭式
BB
3c-2e bond。
◆ 加合反应
2LiH B2H6 2LiB 4 H万能还原剂
2NaB H2H6 2Na4BH
16.2.3 硼族元素的含氧化物
1. 硼的含氧化合物
B2O3(s)
(I) 硼酸酐
白色固体 (晶态 无定形体) 两种晶态(BO4单元、 BO3单元)
B 2O 3(晶 状 )+H 2O (g) 2H B O 2 B 2O 3(无 定 形 )+3H 2O (l) 2H 3B O 3
比较:白磷,硅,硫磺,硼与强碱反应不同
铝单质
● 铝为银白色,质软,轻而有延展性的金属 ● 空气中水中,生成致密氧化膜,稳定 ① 与非金属反应 2Al +3/2O2 ══Al2O3(s) △rH298 = -1669.7 kJ·mol-1 可从金属氧化物夺取氧(冶金还原剂) 2Al + 3X2 = 2 AlX3 2Al +N2 = 2AlN ② 与酸或碱均反应 ∴Al是“两性元素” (Zn也是)
① 易形成配位化合物HBF4
HF BF3 ② 易形成双聚物Al2Cl6
Cl Cl
Cl
Al
Al
Cl Cl
Cl
§16.2 单质和化合物 16.2.1 硼族元素的单质
硼
铝
B
非金属
Al,Ga,In,Tl 金属
镓 铟
硼单质
● 同素异形体: 无定形硼, 晶形硼 棕色粉末, 黑灰色 化学活性高, 硬度大 熔点,沸点都很高
④ 无定形B被热的浓H2SO4或浓HNO3氧化 2B(s) + 3H2SO4(浓) ═══ 2H3BO3 + 3SO2(g) B(s) + 3HNO3(浓) ═══ H3BO3 + 3NO2(g)
⑤ 无定形硼与浓的强碱溶液反应,有氧化剂存在 并强热时与强碱共熔
2 B + 2 N a O H + 2 H 2 O Δ 2 N a B O 2 3 H 2 2 B + 2 K O H + 3 K N O 3 Δ 2 K B O 2 3 K N O 2 + H 2 O
(II) 与金属氧化物共熔
B2O3(s)+
M2O M2O3
共熔
硼酸盐(特征颜色) 硼玻璃
氮化硼
B 2 O 3 + 2 N H 3 8 7 3 K B N + 3 H 2 O
BN具有石墨型晶体结构------白石墨
● (BN)x为绝缘体,而石墨为导体 ● m.p.≈3000℃(加压)
高熔点、高硬度 可作耐高温材料 (火箭喷嘴、绝缘材料)
硼烷的化学性质
◆ 易燃,且放热 高能燃料, 剧毒 B2H6+ 3O2 ══ 2 B2O3 + 3H2O
◆ 强还原性 B2H6 + 6 Cl2 ══ 2 BCl3 + 6 HCl
◆ 水解放出氢气(放热) 水下火箭燃料 B2H6+ 6H2O ══ 2 H3BO3 + 6H2
◆ 不稳定性,加热分解,产物复杂
一系列硼的氢化物, 20多种-----硼烷
◆ 组成 BnHn+4 类(稳定) BnHn+6 类
例: B2H6 乙硼烷
B4H10 丁硼烷
◆ 毒性大
空气中允许的最高浓度10-6(ppm)
COCl2 光气
1
HCN 氰化氢
10
B2H6
0.10
硼烷的结构
困扰化学界几十年,1960年代初由 Lipscomb解决, 乙硼烷B2H6
1.81 1.78 1.8
硼族元素基本性质
◆ 价电子构型:ns2np1
◆ 缺电子元素:价电子数<价层轨道数
◆ 缺电子化合物:成键电子对数<价层轨道数
BF3,H3BO3
氧化态
B,Al,Ga:(+3) In:(+1,+3) Tl:(+1)
最大配位数
B:4 其它:6
HBF4 Na3AlF6
缺电子化合物特点
镓铟铊
均为银白色, 质软, 轻而有延展性的金属, 有毒 Tl(III)的强氧化性
40OC
TlCl3 ═══ TlCl + Cl2↑ 室温TlBr3分解;无Tl(III)I3,但 Tl+I3- 存在。
Ga: 熔点(303 K) ~ 沸点(2523 K) 液态范围在金属中最大,用在高温温度计
16.2.2 硼族元素的氢化物
2Al + 6H+ = 2Al3+ + 3H2↑ 2Al + 2OH- + 6H2O = 2Al(OH)4 - + 3H2 ↑ 2Al + 6H2SO4 (热浓) = Al2(SO4)3 + 3SO2↑+ 6H2O
Al在冷浓H2SO4 、浓HNO3中“钝化”
③ 铝的冶炼
2A l2O 3 N 电 a3A 解 lF 6 4A l+ 3O 2
B:利用sp3杂化轨道,与氢形成三中心两电子键。(氢桥) NhomakorabeaHH
H
记作
BB
HHH
● 要点:B的杂化方式 三中心两电子键、氢桥
① B2H6分子抗磁性 ② 2个B与4个H共平面
B4H10分子结构
119pm
H
H HBH H
B
B
H HBH H
H
(a)
。
122
171pm
143pm
110pm
H
(b)
137pm
H B
空气中还可生成少量BN 2B+N2 2BN
② 与非金属作用 加热与氯气,溴单质等反应 2B+ F2 ═室══温 2BF3
2 B + 3 X 2 Δ 2 B X 3 ( X = C l,B r ,I )
③ 无定形B在赤热下同水蒸汽作用 2B + 6H2O ═══ 2H3BO3 + 3H2
