冶金动力学基础.ppt
冶金过程热力学基础PPT课件

第一章 冶金过程热力学基础
T
通常: H T H 298 298 C p dT
其中: H 298 可根据热力学数据表求出,而
C p 是温度的函数。
C p a bT cT 2 , C p a b cT 2
§1.1.4 化学反应自由能的变化
一、化学反应的等温方程式: 化学反应的自由能变化
利用化学热力学原理,分析计算冶金反应过程的热力学函数变化,判断反应 的可能性、方向性及最大限度。
⑵ 冶金过程动力学研究的主要任务: 利用化学动力学原理,分析计算冶金反应进行的途径、机理及速度。
第四页,共106页。
第一章 冶金过程热力学基础
§1.1 化学反应的热效应及自由能变化 §1.1.1 热力学函数(体系的状态函数
=
527400 336.56T
J mol
G 0 RT ln K 19.147T lg K
G 0
527400 336.56T 27545
lg K
17.58
19.147T
19.147T
T
第二十页,共106页。
J mol
第一章 冶金过程热力学基础
2、由实验测定的化学反应平衡常数K求反应的 G 0 :
f , b :固体相变温度,熔点,沸点 ;
C C C C ps1 ,
ps2 , pl ,
:固体1,固体2,液体,气体等压热容; pg
第十页,共106页。
第一章 冶金过程热力学基础
二、化学反应热效应计算
定义:
⑴ 热效应:化学反应过程伴随着热量的吸收和放出,在等容等压下进行的化 学反应,当反应物与生成物温度相同时,放出或吸收的热量称为化学反应的热 效应。
第二十一页,共106页。
(整理)冶金过程动力学基础

第十二章冶金动力学概述一、热力学的研究对象和局限性∙研究化学(冶金)反应的方向,∙反应能达到的最大限度,∙外界条件对反应平衡的影响。
→热力学只能预测反应的可能性。
∙无法预料反应能否发生,无法确定反应的速率,∙无法了解反应的机理。
∙∙热力学只能判断:这三个反应都能发生。
∙热力学无法回答:如何使它发生?二、动力学的研究对象∙化学(冶金)反应的速率∙化学(冶金)反应的机理(历程)∙温度、压力、催化剂、溶剂及其它外界因素对反应速率的影响→热力学的反应可能性变为现实性。
∙H2(g) + 1/2O2(g) = H2O(l)点火,加温或催化剂C + O2 = CO2(g)点火,加温三、动力学的分类∙宏观(唯象)动力学研究各种宏观因素(如T, P, C, 催化剂等)对反应速率的影响∙微观(分子)动力学研究反应机理和结构与反应性能间的关系∙介观动力学四、冶金反应的类型∙均相反应参与反应的各物质均处于同一个相内进行化学反应。
∙非均相反应参与反应的各物质处于不同的相内进行化学反应。
∙五、反应速率(定容反应速率)∙六、反应阻力∙冶金反应通常由一系列步骤组成。
∙每一步骤都有一定的阻力。
∙对于传质步骤,传质系数的倒数1/kd相当于这一步骤的阻力。
∙对于界面化学反应步骤,反应速率常数的倒数l/k,相当于化学反应步骤的阻力。
∙对于任意一个复杂反应过程,若是由前后相接的步骤串联组成的串联反应,则总阻力等于各步骤阻力之和。
∙若任意一个复杂反应包括两个或多个平行的途径组成的步骤,则这一步骤阻力的倒数等于两个平行反应阻力倒数之和。
七、反应速率的限制性环节∙在串联反应中,如某一步骤的阻力比其他步骤的阻力大得多,则整个反应的速率就基本上由这一步骤决定——反应速率的控速环节和限制性环节或步骤。
∙在平行反应中,若某一途径的阻力比其他途径小得多,反应将优先以这一途径进行。
八、稳态或准稳态处理方法∙对不存在或找不出唯一的限制性环节的反应过程,常用准稳态处理方法。
[课件]第7章冶金动力学基础-补充PPT
![[课件]第7章冶金动力学基础-补充PPT](https://img.taocdn.com/s3/m/091910d9fab069dc5022019f.png)
1 dn JA ( A ) V dt S
nA0 nA XA nA0
(7-8)
n ( 1 X ) 所以 A A 0 A 即n
d ( n / V ) d ( n ( 1 X ) / V )n d X d X A 0 A 0 A 0 A 0 A A J C (7-9) A A 0 dt dt V d t dt 0
J A ( ) dt S dt
dC d [% C ] C J C dt dt
安徽工业大学 Anhui University of Technology
⑤在气固反应中,有时也以固体物质的单位体积为基础来表示浓 度,这时有 (7-7) 在气相反应中,反应前后气体物质的量不相等,体积变化很大, 这时不能准确测得初始体积 C0 。在这种情况下,最好用反应物的转 化率 fA来代表浓度。如开始时体积 V0中有 A 物质 nA0(mol) ,当反应进 行到t时刻时,剩下的A物质为nA(mol),其转化速率为
安徽工业大学 Anhui University of Technology
7.2.确定限制性环节的方法
1. 活化能法 根据Arrhenius公式
E1 ln kln A RT
可以由 lnk 对 1/T 作图,直线的斜率即为活化能,进而可由活化能确定 多相反应的限制性环节。 2. 浓度差法
冶金动力学第一章化学反应速率基础知识

希望后续课程能增加实验课程的比重,通过实验来验证和巩固理论 知识,提高实践能力和创新能力。
拓展应用领域知识
建议课程适当拓展冶金动力学在其他领域的应用知识,如材料科学、 环境科学等,拓宽学员的知识视野和应用能力。
THANK YOU
感谢聆听
掌握了实验技能
通过实验课程的学习,我掌握了测量化学反应速 率的实验技能,包括实验设计、实验操作和数据 处理等方面。
激发了学习兴趣
本次课程的内容丰富、生动有趣,让我对冶金动 力学产生了浓厚的兴趣,期待后续课程的学习。
对未来学习建议和期望
加强理论知识学习
建议后续课程继续加强理论知识的学习,包括反应机理、反应动力 学方程等方面的内容,为后续实验和工程应用提供理论支持。
反应速率的表示方法
反应速率可以用微分法或积分法表示。微分法是通过测量反应过程中某一时刻的反应速率 来表示整个过程的反应速率;积分法则是通过测量反应开始到某一时刻的反应物或生成物 的浓度变化来表示整个过程的反应速率。
学员心得体会分享
1 2 3
加深了对化学反应速率的理解
通过本次课程的学习,我对化学反应速率的定义、 影响因素和表示方法有了更深入的理解,对后续 学习打下了坚实的基础。
温度对催化剂活性的影响
温度不仅直接影响反应速率,还会影响催化剂的活性。对于某些催化剂,存在最佳的反应温度范围,超出此范围 催化剂活性降低。
催化剂对反应速率影响
催化剂降低活化能
催化剂通过提供新的反应路径,使反应 的活化能降低,从而加快反应速率。
VS
催化剂的选择性
不同的催化剂对同一反应可能具有不同的 选择性,即可能促进不同的反应步骤或生 成不同的产物。因此,选择合适的催化剂 对于优化反应过程至关重要。
冶金过程动力学
p静=lgh
2 cos rmax gh
l
14
气液相部分主体思路
2[N] N2 2[H] H2 2[O] O2 [C]+[O] CO
N2 H2 O2 CO 钢液
气泡
[N] [O] [C] [H]
钢液边界层内扩 散是控制环节
(1)氧、碳等穿过钢液边界层扩 散到气泡表面,即
[O][O]s, [C][C]s, [H][H]s, [N][N]s等
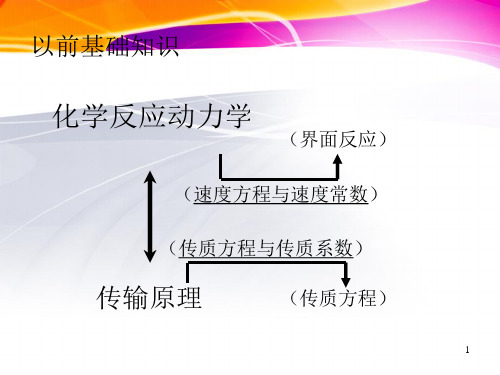
以前基础知识
化学反应动力学
(界面反应)
(速度方程与速度常数)
(传质方程与传质系数)
传输原理
(传质方程)
1
基本概念
化学反应: AA BB YY ZZ
反应物 i 0 ;生成物 i 0 。
反应进度:
ni nio i
反应速率:
•
d
dt
1
i
dni dt
or
v 1 • dci
i dt
• (1)[A] 由金属液内穿过金属液一侧边界层 向金属液-熔渣界面迁移;
• (2)(Bz+)由渣相内穿过渣相一侧边界层向熔 渣-金属液界面的迁移;
• (3)在界面上发生化学反应 ; • (4)(Az+)*由熔渣-金属液界面穿过渣相边界
层向渣相内迁移;
• (5)[B]* 由金属液/熔渣界面穿过金属液边界 层向金属液内部迁移。
C+O2=CO2
氧化物还原 反应
CO CO2
反 气层 生 应 体成界 边物面 界 层
MO+CO=M+CO2
10
抽象化--未反应核模型
(1)反应物致密的 ,产物层 多孔; (2) 扩散速度 << 化学反应速度。
第2章:冶金动力学基础1

如果反应过程中物质体积变化较小,可视为恒容过程。在恒容 条件下,则有(体积摩尔浓度的变化率) •
dC B 1 dn B v = = V dt dt
mol⋅m-3⋅s-1
对于如下反应: a A + b B= c C + d D 如果没有副反应,则各物质的反应速率与化学计量系数之间 成正比关系:
注意:
化学(冶金)反应的速率 化学(冶金)反应的机理(历程) 温度、压力、催化剂、溶剂及其它外界因素对反应速率的影响
ΔG < 0
H 2 + 1 2O 2 = H 2 O (g)
C + O2 = CO2(g)
点火,加温或催化剂 点火,加温
Î 热力学和动力学构成了冶金反应的基础。 要全面理解冶金反应过程,就必须同时研究反应的热力学和动 力学,创造条件,使热力学的可能性变为现实。
2.3.2 分子扩散 1)概念
分子扩散,简称扩散。扩散是体系中物质由于热运动而自动 迁移、浓度均匀化的过程。 z 自扩散(本征扩散):纯物质体系中同位素浓度不同; z 互扩散(化学扩散):溶液体系中浓度不同。 一般情况下,组元浓度较高的部位,其化学势亦高。 严格地说,化学势的不同是产生扩散的根本原因。它促使组 元从化学势高的部位向化学势低的部位迁移。扩散驱动力是体 系内存在的化学势梯度。
order),简称反应级数(不一定为基元反应)。反应级数 表示反应物的浓度对反应速率影响的特性。 n=0时,称零级反应; n=1时,称一级反应; n=2时,称二级反应。
注意: ¾ ¾ ¾ 任何级数的反应都可能是非基元反应; 正整数级才可能是基元反应; n为负数、分数或反应为无级数时必定是非基元反应。
2 冶金动力学基础
2 冶金动力学基础
2. 1 概述
8 冶金动力学基础.

kM >> k, k∑≈ k,
过程为界面化学 反应控制
图8-6.反应界面附近的浓度分布
8.3.1.确定多相反应的限制环节
(1)活化能法 此法是基于温度对多相反应速率的影响来预测过程 的限制环节
界面化学反应活化能大于 气相中组元的扩散活化能 150~400kJ/mol 4~13kJ/mol 17~85 kJ/mol 170~400kJ/mol
(2) 在界面处发生化学反应,通常伴有吸 附、脱附和新相生成;
(3) 生成物离开反应界面。
以界面一级反应为例
设物质A由相的内部扩散到相界面处,并发生化学反应。
化学反应速率:
单位时间通过单位截面的物质A量
当过程以稳态进行时,
经整理后,
反应的总阻力=截面反应阻力+传质阻力
k>>kM, k∑≈ kM,
d CB d CA J B JA dt
dt
J AB
d C AB dt
其中, CA,CB,CAB --- 分别表示反应物A, B 和产物AB 的浓度
例题
例如 反应:
2C+ O2 = 2 CO
生成2 mol CO, 需要消耗2mol C 和1 mol O2, 显然C的消耗率是O2,的两倍。
动力学
化学反应动力学 从微观角度研究化学 反应速率和机理,称 之为微观动力学 在微观动力学的基础上,结 合流体流动形式、传热、传质及 反应器形状研究反应速率及机理, 称之为宏观动力学
冶金过程动力学属于宏观动力学范畴
探讨冶金反应速率、阐明反应机理, 确定反应速率的限制环节,导出动力学方程。
在实际冶金生产过程中需要考虑热力学问题和动力学问题
冶金物理化学-冶金动力学基础

①.边界层
当粘性流体沿固体壁面(如平板)流动时,在靠近壁面的流
体薄层内,产生很大的速度梯度。把靠近壁面的流体薄层称
为边界层(或速度边界层)。
粘滞阻力主要集中在边
界层内,边界层以外,
速度梯度为零,可视为
理想流体。
26
10.冶金动力学基础
②.有效边界层
为处理方便,将对流扩散 折算成稳态分子扩散。
率所决定,界面化学反应为限制环节。
1.综合控制; 2.反应过程中限制环节发生改变;
14
10.冶金动力学基础
15
10.冶金动力学基础
4 确定限制性环节的方法
(1)活化能法
基于温度对多相反应速率的影响来预测; 一般情况下,界面化学反应活化能大于150~400kJ/mol;气相中
组元的扩散活化能为4~13 kJ/mol;铁液中组元的扩散活化能为 17~85 kJ/mol;熔渣中组元的扩散活化能为170~ 400kJ/mol。
参与反应的各物质均处于同一个相内进行化 学反应。 ◆ 非均相反应 参与反应的各物质处于不同的相内进行化学 反应。
4
10.冶金动力学基础
§2 化学反应动力学基础
化学反应动力学:反应速率和反应机理。
以单位时间内反应物或生成物浓度的变化来表示。
如反应
A+B→AB 的速率
JA
dCA dt
JB
dCB dt
反应界面,并在界面处发生化学反应,生成物要从界面处离开。
反应总速率取决于各个环节中最慢的 环节,这一环节称为限制环节。 首先必须找出反应的限制环节,然后 再导出动力学方程。
11
10.冶金动力学基础
3 限制性环节
以一级反应为例,设物质A由相的内部扩散到相界面处,并在界 面上发生化学反应,其速率:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目前,除了用动力学的理论和实验方法研究冶金过程的速率和 机理外,还进一步向冶金反应工程学领域发展。 使得某些复杂 的冶炼过程有可能进行多因素分析和计算机自动控制
2.1 化学反应的速率
化学反应的速率式
对于大多数化学反应,根据反应的质量作用定律,速率可
表示为:
反应级数(要经过实验测定)
物质的扩散通量:单位时间内,通过单位截面积的物质的量(mol)亦称为物
质流或称传质速率,其单位是 mol m2 s,1 单位时间通过某截面积的物质
的量则称为扩散流,mol/s。
2.2 分子扩散及对流传质
2.2.1 分子扩散
菲克定律
c x
常量 稳定态的扩散,称为菲克第一定律。扩散通量表达式:
2.3.2 化学反应成为限制环节的速率式
因气体吸附发生的化学反应是由反应气体分子的吸附、吸
附物的界面化学反应及气体产物的脱附三个环节所组成:
H2 FeO(s) FeO H2(吸) FeO H2(吸) Fe H2O(g)(吸)
吸附 化学反应
Fe H2O(g)(吸) Fe(s) H2O(g) 脱附
作图法:分别用c,1nc,1/c等对t作图,呈直线关系的,即 为所求反应的级数
2.1 化学反应的速率
反应速率常数
k与T、Ea的关系: 对于k0有相近值的不同反应,活化能愈小,则在一定温
度时的k就愈大,即反应趋向于沿着活化能较小的途径进行。 活化能愈大,k受温度的影响就愈强烈
2.1 化学反应的速率
现任意选择a,b,c三个变数,则由上3个方程可得出其余未知 数d、e、f的值:
2.2.2 对流扩散
C1
C2
umber):它即上述导出c2的准数, 它表征流体运动特征:
Re<20-30是层流流动, Re>20-30,则是紊流流动, 这时L是被环流的物体的直径。对于管内的流动,Re的临界值 为2100-2300。
2.2 分子扩散及对流传质
扩散系数
扩散系数D是浓度梯度
的扩散通量,它是体系局部状
态的函数,和T、p及体系的局部成分有关。
根据爱因斯坦公式
式中 —原子的平均平方移动距离,它是原子单位跳跃 的长度;t—原子两次移动的平均时间。
2.2 分子扩散及对流传质
原子间平均移动距离 Δ2=r2,代入爱因斯坦公式:
气体在固体表面的吸附 物理吸附:范德华引力 化学吸附:化学键力,化学吸附主要发生在固体
表面的所谓活性点上。固体表面的微观凸出部分的 原子或离子的价键未被邻近原子饱和。具有较高的 表面能,常是化学吸附的活性点
2.3.1 朗格缪尔吸附等温式
当分压为 (Pa)的气体A在固体表面进行吸附时, 可用下述吸附反应式表示:
2.2 分子扩散及对流传质
有效扩散系数De:
孔隙度
迷宫系数,氢还原赤铁矿
0.04 0.238
当气体分子的平均自由程比孔隙直径大一个数量级时,可认 为克努生扩散在起主要作用,压力能显著地提高介质内气体 的扩散速率。当分子平均自由程远小于孔隙直径时,加大压 力的作用则不显著
2.2.2 对流扩散
传质系数:
在有对流运动的体系中,如果气(流)体在凝聚相的表面附 近流动,流体的某组分向此相的表面扩散(或凝聚相表面的物质 向流体中扩散),流体中扩散物的浓度是c,而其在凝聚相表面 的浓度(界面浓度)是c*,则该组分的扩散通量与浓度成正比可 表示为:
J (c c)
传质系数
2.2.2 对流扩散
化学反应成为限制环节
v
k
H
2
H
即v
2
kH2 KH2 1 KH2
pH 2 pH 2
dx RT dx
低浓度区内迁移。 自扩散:纯物质体系中的扩散。是因同位素的浓度不同,发生了熵变 互扩散或化学扩散:当溶液中有浓度梯度存在时,发生的扩散。它是一种 原子在其他种作为基体的原子中的相对扩散。原子的这种迁移导致体系的 组成均匀。
上述两种扩散均属于分子扩散,发生于静止的体系中。
对流传质或紊流湍动传质:在流动体系中出现的扩散。它是由分子扩散和 流体的分子集团的整体运动(即对流运动),使其内的物质发生迁移。
化学反应速率常数 k f (T , p)
反应的速率的表示:一般用速率常数来表示,把它视为
反应物浓度为1单位的反应速率。
2.1 化学反应的速率
反应级数的确定
尝试法:将实验测定的各时间反应物的浓度代入速率的各 积分式中,试探其中哪个积分式求出的k是不随时间而变化, 则该式的级数就是所求反应的级数。适用于不太复杂的反 应特别是冶金中的反应
)
x0
c c
J (c c)
(有效边界层)
D/
临界流速:使边界层的厚度趋近于零时的流速。
2.2.2 对流扩散
在相界面处(X=0),流体的流速为零,而且 c / t 0
应用菲克第一定律:
2.2.2 对流扩散
在高温下,界面反应速率远比扩散速率为快,因而界面浓 度c*是反应的平衡浓度,可用c平表示:
(1)反应物对流扩散到反应界面上; (2)在反应界面上进行化学反应; (3)反应产物离开反应界面向相内扩散。
A
B
2 冶金动力学
多相反应过程速率的限制性环节:
反应过程是由物质的扩散和界面化学反应诸环节 组成的串连过程,其中速率最慢或阻力最大,对总反 应速率影响很大的环节是反应过程速率的限制性环节
扩散控制:传质过程慢于界面化学反应过程,此时 界面化学反应达到或接近化学平衡态
单位面积上被A分子占据的面积分数为:
单位面积上,未被分子A占据的面积分数为:
2.3.1 朗格缪尔吸附等温式
当吸附达平衡时,吸附反应的平衡常数
从而
朗格缪尔吸附等温式
吸附反应的速率正比例于被 吸附的A所占的面积分数
吸附反应速率常数
反应的级数跟pA或aA的大小有关。 当K A pA 1时,是零级; 当K A pA 1时,是1级。
J D c D c D c c0
x
x
x
一维
变量 非稳定态 的扩散,称为菲 克第二定律。扩 散通量表达式:
三维
扩散层有化 学反应
2.2 分子扩散及对流传质
在选定的初始条件和边界条件(即体系和环境之间物质和能 量的交换条件)下,解菲克第二定律微分方程,可得出
f (t, x,c) 0 的数学表达式:
te l / u
2.2.2 对流扩散
(3)量纲分析法
对于有紊流运动的高温流体,可采用以相似理论为基础的 模型法。
当气体环流特性尺寸为L的固体物时,传质系数可表示为 下列函数关系式:
根据π定理,上式可写成 代入各物理量的单位
2.2.2 对流扩散
π是量纲一的量,其指数为零,因此对于m、s、kg的幂指数有:
2.1 化学反应的速率
多相化学反应的速率式
由于在体系内相界面上进行,所以在其速率式中要引人相 界面的面积(A,m2)这一因素。对于多相反应,当反应为一级 反应,有:
2.2 分子扩散及对流传质
什么是扩散? 扩散是体系中物质自动迁移、浓度变均匀的过程。它的驱动力是体系内存 在的浓度梯度或化学势梯度( dc c dc )促使组分从高浓度区向
2.2.2 对流扩散
2)谢伍德准数(Sherword number):表征流体的传质特性, 是上述c1,c3的组合,即
它对无流动的外扩散及层流层的内扩散有恒定值,与被环 流的物体形状有关,对于球形物的扩散,其值为2。
3)施密特准数(Schmidt number):表征流体物理化学性质 的准数,是上述c3的倒数1/c3。
Ea的求解: a活化能不随温度改变时,以不同温度下得出的lnk对1/T作 图,斜率为-Ea/R,截距为k0
b活化能随温度改变时,则1nk与1/T的关系是曲线。可从曲 线上的温度点作切线,由切线的斜率得出该温度的活化能
2.1 化学反应的速率
可逆反应的速率式
对于可逆反应 净反应速率为 当反应达到平衡时
界面化学反应:界面化学反应过程慢于传质过程
2 冶金动力学
研究冶金反应动力学的目的
a了解反应在各种条件下的组成环节(机理)及其速率表达式; b导出总反应的速率方程,确定反应过程的限制环节; c讨论反应机理及各种因素对速率的影响; d选择合适的反应条件,控制反应的进行达到强化冶炼过程, 缩短冶炼时间及提高反应器生产率的目的。
对于理想气体,Sc=1。
2.2.2 对流扩散
诸准数间的关系
气体Sc=1,而上式可写成
上式两边取对数:lnSh=1nK十alnRe, 以测定的1nSh对lnRe作图,由直线的参数 可得到常数K、a。直线上的折点相当于层 流转变为紊流流动时,Re准数的临界值。
对于环流固体表面的气体,由实验得出 Sh=0.54Re1/2代入Sh及Re准数的参数, 经简化:
当t=0时,c=c0.而I=ln(c0-c平)
(流体内物质扩散速率的积分式)
通过实验测得各时间的浓度c,以
对时间t作图,
由直线斜率
求出传质系数β与有效边界厚度δ
2.2.2 对流扩散
(2)表面更新理论
对于半无限非稳定态 的一维扩散,菲克第 二定律的解:
在x=0处,对x微分
2.2.2 对流扩散
体积元与相界面接触时间te内,平均扩散通量为
2.2.3 小结
物质的扩散
分子扩散 (静止体系)
c 常量,菲克第一定律 t
c 常量,菲克第二定律 t
(一维)
对流扩散 (对流体系)
(三维) (模型法)
2.2.3 小结
扩散的驱动力
分子扩散:浓度梯度 对流扩散:相内浓度与界面浓度之差
