初中化学相对分子质量
化学相对分子质量表

氢氧化钾
?KOH
56
氯化钙
CaCl2
111
硫酸钙
CaSO4
136
碳酸钙
CaCO3
100
氯化铁
FeCl3??????
氯化亚铁
FeCl2
127
硫酸亚铁
FeSO4??
152
氯化钠
NaCl?
硫酸钠
Na2SO4
142
碳酸钠
Na2CO3
106
氯化钾
KCl
氯化铜
CuCl2
135
硫酸铜
CuSO4
160
氯化锌
ZnCl2?
136
硫酸锌
ZnSO4
161
硝酸铵
NH4NO3
80
高锰酸钾
KMnO4?? ?
158
氯酸钾
KClO3
甲? 烷
CH4
16
尿? 素
CO(NH2)2
60
甲? 醇
CH3OH
32
乙? 醇
C2H5OH
46
乙? 炔
C2H2
26
过氧化氢
H2O2
34
过氧化钠
Na2O2
78
氧化铜
CuO
80
氧化镁
MgO
40
氯化铵
NH4Cl
102
五氧化二磷
P2O5
142
水
H2O
18
硝? 酸??
HNO3??????
63
硫酸
H2SO4??????
98
亚硫酸
H2SO3??
82
磷? 酸
H3PO4
98
乙酸
CH3COOH
初中化学_有关相对分子质量的计算精品PPT课件

3)计算物质中某元素的质量分数 相对原子质量:N=14 H=1 O=16
例:(1)求硝酸N铵 H4NO3中氮元素
的质量分数。
解:
在NH4NO3中
N% 2N 100% 28 100%
NH4NO3
80
35%
答:硝酸铵中氮元素的质量分数是35%。
练习 相对原子质量: O=16 N=14 H=1
片,1日2次
小结:
谢谢 各谢位谢亲临指导!
各位亲临指导!
1、最灵繁的人也看不见自己的背脊。——非洲 2、最困难的事情就是认识自己。——希腊 3、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇 4、与肝胆人共事,无字句处读书。——周恩来 5、一个人即使已登上顶峰,也仍要自强不息。——罗素·贝克 6、一切节省,归根到底都归结为时间的节省。——马克思 7、自知之明是最难得的知识。——西班牙 8、勇气通往天堂,怯懦通往地狱。——塞内加 9、有时候读书是一种巧妙地避开思考的方法。——赫尔普斯 10、阅读一切好书如同和过去最杰出的人谈话。——笛卡儿 11、有勇气承担命运这才是英雄好汉。——黑塞 12、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰 13、知人者智,自知者明。胜人者有力,自胜者强。——老子 14、意志坚强的人能把世界放在手中像泥块一样任意揉捏。——歌德
维生素D 100IU
H=1 O=16)
(1)维生素D2种类较多,其中维生 素D2化学式为C28H44O,则一个
维生素D2分子共有73 个原子;
一个分子维生素D2的相对分子
质量为 396 ;
(2)维生素D2中碳、氢、氧三种
元素的质量比为 84:11:4 。
[食用方法]每日1次、 (3)计算钙片中碳酸钙的质量
化学相对分子质量表

化学式
相对分子质量
物质
化学式
相对分子质量
物质
化学式
相对分子质量
氨? 气
NH3????????
17
二氧化碳
CO2
44
二氧化硫
SO2
64
一氧化碳
CO??????
28
三氧化硫
SO3
80
氧化钙
CaO
56
四氧化三铁
Fe3O4
232
三氧化二铁
Fe2O3??????
160
氧化亚铁
FeO
72
氧化铝
Al2O3
102
160
氯化锌
ZnCl2?
136
硫酸锌
ZnSO4
161
硝酸铵
NH4NO3
80
高锰酸钾
KMnO4?? ?
158
氯酸钾
KClO3
122.5
甲?ห้องสมุดไป่ตู้烷
CH4
16
尿? 素
CO(NH2)2
60
甲? 醇
CH3OH
32
乙? 醇
C2H5OH
46
乙? 炔
C2H2
26
过氧化氢
H2O2
34
过氧化钠
Na2O2
78
氧化铜
CuO
80
氧化镁
MgO
40
氯化铵
NH4Cl
53.5
氢氧化镁
Mg(OH)2
58
初中化学常见化合物相对分子质量
氢氧化钾
?KOH
56
氯化钙
CaCl2
111
硫酸钙
CaSO4
136
初中化学人教九年级上册第四单元 自然界的水 有关相对分子质量的计算-峨眉二中 徐小琴PPT

=14+1× 5 + 12+ 16 × 3= 79
2.2H2O2的总相对分子质量= 2 ×1 ×2+16 ×2 = 36
改: (
) ×结果为 68
谈谈你的收获:
化学式的意义 有关相对分子质量的计算
相对原子质量:Mg-24 H-1 O-16
1.2H2O的总相对分子质量 = 2 ×(1 ×2+16)=36
2.2Mg(OH)2的总相对分子质量 = 2 ×[24+(16+1) ×2]=116
注意: 化学式前的数字是表示分子的个数,计算时应把
个数×(一个分子的相对分子质量)
2、计算物质组成元素的质量比
2.遇到化学式中有多个同种原子团 怎么处理?还有没有其他的方法?
注意: 1)书写化学式要__正__确____.
2)元素符号之间用 __“_+_”_号,元素符号与数字之
间用 _“_×__”_号。
3)化学式中有多个同种原子团时则把 (原子团的相对原子质量__总__和___)×__原__子__团__个_数
化学式的意义
找出元素的种类
方法二
合并同种元素的原子个数
相对原子质量:H-1 C-12 O-16 N-14
原子个数
(NH4)2CO3的相对分子质量
2N
8H
=14×2+1×8+12+ 16 ×3
C
=96
3O
注意:找原子个数时,括号内的角标和括号外的角标是
相乘的ห้องสมุดไป่ตู้系。
练一练:
化学相对分子质量表

63
硫酸
H2SO4
98
亚硫酸
H2SO3
82
磷 酸
H3PO4
98
乙酸
CH3COOH
60
碳 酸
H2CO3
62
盐酸
HCl
36.5
氢氧化钠
NaOH
40
氢氧化铜
Cu(OH)2
98
氢氧化钙
Ca(OH)2
74
氢氧化钾
KOH
56
氯化钙
CaCl2
111
硫酸钙
CaSO4
136
碳酸钙
CaCO3
100
氯化铁
FeCl3
甲 烷
CH4
16
尿 素
CO(NH2)2
60
甲 醇
CH3OH
32
乙 醇
C2H5OH
46
乙 炔
C2H2
26
过氧化氢
H2O2
34
过氧化钠
Na2O2
78
氧化铜
氯化铵
NH4Cl
53.5
氢氧化镁
Mg(OH)2
58
初中化学常见化合物相对分子质量
如有侵权请联系告知删除,感谢你们的配合!
162.5
氯化亚铁
FeCl2
127
硫酸亚铁
FeSO4
152
氯化钠
NaCl
58.5
硫酸钠
Na2SO4
142
碳酸钠
Na2CO3
106
氯化钾
KCl
74.5
氯化铜
CuCl2
135
硫酸铜
CuSO4
160
氯化锌
初中化学常见化合物相对分子质量

106
氯化钾
KCl
74.5
氯化铜
CuCl2
135
硫酸铜
CuSO4
160
氯化锌
ZnCl2
136
硫酸锌
ZnSO4
161
硝酸铵
NH4NO3
80
高锰酸钾
KMnO4158氯酸钾KClO3122.5
甲 烷
CH4
16
尿 素
CO(NH2)2
60
甲 醇
CH3OH
32
乙 醇
C2H5OH
46
乙 炔
C2H2
26
过氧化氢
H2O2
34
过氧化钠
Na2O2
78
氧化铜
CuO
80
氧化镁
MgO
40
氯化铵
NH4Cl
53.5
氢氧化镁
Mg(OH)2
58
如有侵权请联系告知删除,感谢你们的配合!
h221401 5399厙19977 4E09三25951 655F敟23996 5DBC嶼$23103 5A3F娿38730 974A靊23272 5AE8嫨37306 91BA醺35605 8B15謕C
62
盐酸
HCl
36.5
氢氧化钠
NaOH
40
氢氧化铜
Cu(OH)2
98
氢氧化钙
Ca(OH)2
74
氢氧化钾
KOH
56
氯化钙
CaCl2
111
硫酸钙
CaSO4
136
碳酸钙
CaCO3
100
氯化铁
FeCl3
162.5
氯化亚铁
初中化学常见化合物相对分子质量

初中化学常见化合物相对分子质量初中化学常见化合物的相对分子质量如下:1.氨气:NH3,相对分子质量为17.2.一氧化碳:CO,相对分子质量为28.3.四氧化三铁:Fe3O4,相对分子质量为232.4.氧化铝:Al2O3,相对分子质量为102.5.硝酸:HNO3,相对分子质量为63.6.磷酸:H3PO4,相对分子质量为98.7.盐酸:HCl,相对分子质量为36.5.8.氢氧化钙:Ca(OH)2,相对分子质量为74.9.硫酸钙:CaSO4,相对分子质量为136.10.氯化亚铁:FeCl2,相对分子质量为127.11.硫酸钠:Na2SO4,相对分子质量为142.12.氯化铜:CuCl2,相对分子质量为135.13.硫酸锌:ZnSO4,相对分子质量为161.14.氯酸钾:KClO3,相对分子质量为122.5.15.甲醇:CH3OH,相对分子质量为32.16.氧化镁:MgO,相对分子质量为40.除此之外,还有:1.二氧化碳:CO2,相对分子质量为44.2.三氧化硫:SO3,相对分子质量为80.3.三氧化二铁:Fe2O3,相对分子质量为160.4.五氧化二磷:P2O5,相对分子质量为142.5.硫酸:H2SO4,相对分子质量为98.6.乙酸:CH3COOH,相对分子质量为60.7.氢氧化钠:NaOH,相对分子质量为40.8.氢氧化钾:KOH,相对分子质量为56.9.碳酸钙:CaCO3,相对分子质量为100.10.碳酸钠:Na2CO3,相对分子质量为106.11.硫酸铜:CuSO4,相对分子质量为160.12.硝酸铵:NH4NO3,相对分子质量为80.13.甲烷:CH4,相对分子质量为16.14.硫酸亚铁:FeSO4,相对分子质量为78.15.氢氧化铜:Cu(OH)2,相对分子质量为97.5.16.氯化钙:CaCl2,相对分子质量为111.17.氯化铁:FeCl3,相对分子质量为162.5.18.氯化钠:NaCl,相对分子质量为58.5.19.氯化钾:KCl,相对分子质量为74.5.20.氯化锌:ZnCl2,相对分子质量为136.21.尿素:CO(NH2)2,相对分子质量为60.22.乙炔:C2H2,相对分子质量为26.23.氧化铜:CuO,相对分子质量为80.24.过氧化氢:H2O2,相对分子质量为34.25.氧化镁:MgO,相对分子质量为40.26.高锰酸钾:KMnO4,相对分子质量为158.27.尿素:CO(NH2)2,相对分子质量为60.。
化学计算公式大全总结初中

化学计算公式大全总结初中一、有关化学式的计算。
1. 相对分子质量(Mr)- 定义:化学式中各原子的相对原子质量的总和。
- 计算公式:- 对于单质,如O_2,Mr = 16×2 = 32;- 对于化合物,如H_2O,Mr=(1×2 + 16)=18。
2. 元素质量比。
- 计算公式:在化合物AxBy中,A、B元素的质量比=(A元素的相对原子质量× x):(B元素的相对原子质量× y)。
- 例如,在CO_2中,碳、氧元素的质量比=(12×1):(16×2)=12:32 = 3:8。
3. 元素的质量分数。
- 计算公式:ω(A)=(A元素的相对原子质量×原子个数)/(相对分子质量)×100%- 例如,在NH_4NO_3中,氮元素的质量分数ω(N)=(14×2)/(14×2 +1×4+16×3)×100%=(28)/(80)×100% = 35%二、有关化学方程式的计算。
1. 根据化学方程式计算的依据。
- 化学方程式中各物质之间的质量比等于相对分子质量(或相对原子质量)与化学计量数的乘积之比。
- 例如:2H_2+O_2{点燃}{===}2H_2O,H_2、O_2、H_2O的质量比为(2×2):32:(2×18)=4:32:36 = 1:8:9。
2. 计算步骤(以加热分解15.8g高锰酸钾制取氧气为例)- 设未知量:设可制取氧气的质量为x。
- 写出反应的化学方程式:2KMnO_4{}{===}K_2MnO_4+MnO_2 + O_2↑。
- 找出相关物质的相对分子质量和已知量、未知量:- KMnO_4的相对分子质量=39 + 55+16×4 = 158,O_2的相对分子质量=32。
- 已知KMnO_4的质量为15.8g。
- 列比例式求解:- 根据化学方程式中KMnO_4与O_2的质量比(2×158):32,可列出比例式(2×158)/(32)=(15.8g)/(x),解得x = 1.6g。
初中化学常见化合物相对分子质量

硝 酸 NH4NO3 80 铵
氯 酸 KClO3 122.5 甲
CH4
16
钾
烷
甲
CH3OH 32
醇
乙
C2H5OH 46
醇
过 氧 H2O2
34
过 氧 Na2O2
78
化氢
化钠
氧 化 MgO
40
镁
氯 化 NH4Cl
53.5
铵
氯化 钙 氯化 铁 氯化 钠 氯化 钾 氯化 锌 高锰 酸钾 尿 素 乙 炔 氧化 铜 氢氧 化镁
二 氧 CO2
44
化碳
三 氧 SO3
80
化硫
三 氧 Fe2O3
160
化二
铁
五 氧 P2O5
142
化二
磷
硫酸 H2SO4
98
乙酸 CH3COOH 60
氢 氧 NaOH
40
化钠
二 氧 SO2
64
化硫
氧 化 CaO
56
钙
氧 化 FeO
72
亚铁
水
H2O
18
亚 硫 H2SO3
82
酸
碳
H2CO3
62
酸
氢 氧 Cu(OH)2 98 化铜
CaCl2 FeCl3 NaCl KCl ZnCl2 KMnO4 CO(NH2)2 C2H2 CuO Mg(OH)2
111 162.5 58.5 74.5 136 158 60 26 80 58
创作者(人): 轻秘张
日 期:
贰零贰贰 年 1 月 8 日
氢 氧 Ca(OH)2 74
氢 氧 KOH
56
化钙
化钾
硫 酸 CaSO4 136
初中化学计算题(带答案)

初中化学计算题一、根据化学式的计算1、计算相对分子质量相对分子质量=化学式中各原子的相对原子质量的总和。
点拨:①计算物质的相对分子质量时,同种元素的相对原子质量与其原子个数是相乘的关系,不同种元素相对质量是相加的关系。
②计算结晶水合物的相对分子质量时,化学式中的“·”表示相加,而不表示相乘。
③化学式中原子团(或根)右下角的数字表示的是原子团(或根)的个数。
计算时先求一个原子团或根的总相对原子质量,再乘以原子团(或根)的个数,即得出几个原子团的总相对原子质量。
2、计算物质中各元素的质量比组成化合物的各元素的质量比=化合物中各元素的相对原子质量总和(即相对原子质量与原子个数乘积)之比。
点拨:①计算时一定要写清楚各元素质量比顺序,因顺序不同,比值也不同。
②计算时的结果约成最简整数比。
3、计算物质中某元素的质量分数化合物中某元素的质量×100%4、已知某化合物的质量,求某元素的质量化合物里某元素的质量=化合物的质量×化合物中某元素的质量分数化合物的质量=化合物中已知元素的质量÷化合物中已知元素的质量分数5、求化学式点拨:求物质化学式的主要类型:①由元素的相对原子质量和化合物的相对分子质量,确定化学式。
②根据化合物中某元素质量分数确定化合物的化学式。
③已知化合物中元素的质量比和相对原子质量,确定化学式。
原子个数比=元素的质量比:相对原子质量比④根据质量守恒定律确定化学式。
6、计算不纯物中某元素(或某纯净物)的质量分数计算公式:①某纯净物的质量分数= ×100%②不纯物中某元素的质量分数=不纯物中纯净物的质量分数×该纯净物中某元素的质量分数。
③某纯净物的质量分数=实际上某元素的质量分数÷化学式中该元素的质量分数×100%二、根据化学方程式的计算根据化学方程式的计算就是从量的方面来研究物质变化的一种重要的方法,其计算步骤和方法,一般分为以下几步: ①设未知量,未知量不带单位,常用X 表示.②根据题意确定反应物与生成物,写出并配平反应的化学方程式. ③在有关物质化学式下面写出相对分子质量并代入已知量和所设未知量. ④列比例式求解,写出答案.在初中阶段,根据化学方程式的计算,主要有以下几种基本类型.(1)根据化学方程式计算反应物、生成物间的质量比反应物、生成物间的质量比,就是各反应物、生成物相对分子质量×计量数之比. (2)根据化学方程式计算反应物或生成物的质量反应物或生成物质量的计算,一般是根据化学方程式中各反应物、生成物间的质量比来求算的,对某些反应,可直接依据质量守恒定律进行计算.(3)根据化学方程式进行含有一定且杂质的反应物或生成物的计算根据化学方程式的计算,其反应物或生成物的质量必须是纯物质的质量.含有一定量杂质的反应物或生成物的质量,必须换算成纯物质的质量,才能按根据化学方程式的计算步骤和方法进行计算.纯物质质量=含有一定量杂质的物质质量×该物质质量分数三、有要溶液组成的计算1.用溶质所占溶液的质量分数表示溶液的组成,其关系如下:溶质的质量分数= 溶质质量溶质+溶剂 × 100%=溶液质量溶质质量 × 100%在饱和溶液中: 溶质的质量分数=+溶解度溶解度g 100 × 100%2、有关溶液加水稀释的计算在溶液加水稀释过程中,溶质的质量分数将随溶液的稀释而改变,溶质质量分数一定的溶液加水稀释,稀释前后溶质的总质量不会发生改变.溶液加水稀释的计算,根据的就是这个道理.M 浓溶液×浓溶液的溶质质量分数=M 稀溶液×稀溶液的溶质质量分数 =(M 浓溶液+M 水)×稀溶液的溶质质量分数 3、溶质的质量分数在化学方程式的应用反应后溶液的质量=反应物的总质量(包含溶液的质量)-生成气体或沉淀的质量四、综合计算题分类解析从近几年全国各地的中考化学试题来看,化学计算已经走出了“为计算而计算”的考查误区,考题所涉及的内容更加注重与日常生活、工农业生产的联系;更加注重对同学们图表、数据、信息、实验综合分析能力的考查。
化学相对分子质量表

74
氢氧化钾
?KOH
56
氯化钙
CaCl2
111
硫酸钙
CaSO4
136
碳酸钙
CaCO3
100
氯化铁
FeCl3??????
162.5
氯化亚铁
FeCl2
127
硫酸亚铁
FeSO4??
152
氯化钠
NaCl?
58.5
硫酸钠
Na2SO4
142
碳酸钠
Na2CO3
106
氯化钾
KCl
74.5
氯化铜
CuCl2
135
硫酸铜
CuSO4
160
氯化锌
ZnCl2?
136
硫酸锌
ZnSO4
161
硝酸铵
NH4NO3
80
高锰酸钾
KMnO4?? ?
158
氯酸钾
KClO3
122.5
甲? 烷
CH4
16
尿? 素
CO(NH2)2
60
甲? 醇
CH3OH
32
乙? 醇
C2H5OH
46
乙? 炔
C2H2
26
过氧化氢
H2O2
34
过氧化钠
Na2O2
化学相对分子质量表
物质
化学式
相对分子质量
物质
化学式
相对分子质量
物质
化学式
相对分子质量
氨? 气
NH3????????
17
二氧化碳
CO2
44
二氧化硫
SO2
64
一氧化碳
CO??????
28
初中常用相对分子质量及计算公式
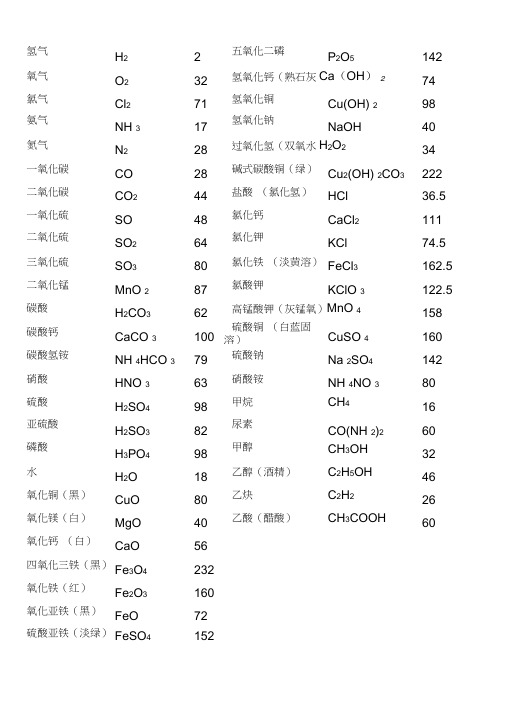
氢气 H 2 2 五氧化二磷P 2O 5 142 氧气 O 2 32 氢氧化钙(熟石灰Ca (OH ) 2 74 氯气 Cl 2 71 氢氧化铜 Cu(OH) 2 98 氨气 NH 3 17 氢氧化钠NaOH40 氮气 N 2 28 过氧化氢(双氧水H 2O 2 34 一氧化碳 CO 28 碱式碳酸铜(绿) Cu 2(OH) 2CO 3 222 二氧化碳 CO 2 44 盐酸 (氯化氢) HCl 36.5 一氧化硫 SO 48 氯化钙 CaCl 2 111 二氧化硫 SO 2 64 氯化钾KCl 74.5 三氧化硫 SO 3 80 氯化铁 (淡黄溶) FeCl 3162.5 二氧化锰 MnO 2 87 氯酸钾KClO 3122.5 碳酸 H 2CO 3 62高锰酸钾(灰锰氧)MnO 4158 碳酸钙 CaCO 3 100 硫酸铜 (白蓝固溶)CuSO 4 160 碳酸氢铵 NH 4HCO 3 79 硫酸钠Na 2SO 4 142 硝酸 HNO 3 63 硝酸铵 NH 4NO 3 80 硫酸 H 2SO 4 98 甲烷 CH 416 亚硫酸 H 2SO 3 82 尿素 CO(NH 2)2 60 磷酸 H 3PO 4 98 甲醇 CH 3OH 32 水H 2O 18 乙醇(酒精) C 2H 5OH 46 氧化铜(黑) CuO 80 乙炔 C 2H 226 氧化镁(白) MgO 40乙酸(醋酸)CH 3COOH60氧化钙 (白) CaO 56四氧化三铁(黑) Fe 3O 4 232氧化铁(红) Fe 2O 3 160氧化亚铁(黑)FeO72硫酸亚铁(淡绿) FeSO 4152硫酸锌(白/无)ZnSO 4 161初中化学常用计算公式一. 常用计算公式:(1 )相对原子质量= 某元素一个原子的质量/ 一个碳原子质量的1/12(2 )设某化合物化学式为AmBn①它的相对分子质量= A的相对原子质量×m + B的相对原子质量×n②A元素与B元素的质量比=A的相对原子质量×m : B的相对原子质量×n③A元素的质量分数ω=A的相对原子质量×m /AmBn的相对分子质量(3)混合物中含某物质的质量分数(纯度)=纯物质的质量/混合物的总质量×100%(4)标准状况下气体密度(g/L)=气体质量(g)/气体体积(L)(5)纯度=纯物质的质量/混合物的总质量×100% = 纯物质的质量/(纯物质的质量+杂质的质量)×100%=1- 杂质的质量分数(6)溶质的质量分数=溶质质量/溶液质量量/×100% = 溶质质(溶质质量+溶剂质量)×100%(7 )溶液的稀释与浓缩M浓×a%浓=M稀×b%稀=(M浓+增加的溶剂质量)×b% 稀(8)相对溶质不同质量分数的两种溶液混合M浓×a%浓+M稀×b%稀=(M浓+M稀)×%(9)溶液中溶质的质量=溶液的质量×容液中溶质的质量分数=溶液的体积×溶液的密度。
最新人教版初中化学《有关相对分子质量的计算》课件

练习:SO2中氧元素的质量分数; Mg(OH)2 中氧元素的质量分数:
相对原子质量×原子个数 元素的质量分数= × 100% 相对分子质量
1.(吉林中考)下面是小刚计算硝酸铵 (NH4NO3)中氮元素质量分数的解题过程。 解:NH4NO3中氮元素质量分数=
相对分子质量=相对原子质量×原子个数之和
探究二:元素质量比 (一).自学展示:
◆计算二氧化碳(CO2)中碳元素和氧元素 的质量比: m (C):m(O)=12:(16×2)=3:8
练习:计算SO2 Na2O 元素的质量比: NH4NO3 Mg(OH)2 中各
元素质量比=相对原子质量×原子个数之比
探究三:元素的质量分数
知识回顾——展示
1.相对原子质量的概念与注意事项:
2.水(H2O)中氢、氧原子的个数比:
小明的烦恼
他梦到氢元素和氧元素在争辩谁在“H2O” 中的质量更大?争辩十分激烈,拉着让小明来 裁判,小明不知道怎么算,一着急醒了。
课题4 化学式与化合价
三、有关相对分子质量的计算
探究一:相对分子质量
(一).概念:
各原子的相对原子质量的总和 1.化学式中___________________________ ,就 是相对分子质量; 2.相对分子质量的符号和单位;
(二)动手实践:
◆计算CO2 的相对分子质量(C-12 O-16 ) Mr(CO2)=12+(16×2)=44 ◆练习:计算下列物质的相对分子质量 H2 HCl NH4NO3 Mg(OH)2
N-14
H-1
探究三:物质中元素的质量分数
尿素中氮元素的质量分数
初中化学常见化合物相对分子质量38582

一氧化碳
CO
28
三氧化硫
SO3
80
氧化钙
CaO
56
四氧化三铁
Fe3O4
232
三氧化二铁
Fe2O3
160
氧化亚铁
FeO
72
氧化铝
Al2O3
102
五氧化二磷
P2O5
142
水
H2O
18
硝 酸
HNO3
63
硫酸
H2SO4
98
亚硫酸ห้องสมุดไป่ตู้
H2SO3
82
磷 酸
H3PO4
98
乙酸
CH3COOH
60
碳 酸
H2CO3
62
CuO
80
氧化镁
MgO
40
氯化铵
NH4Cl
氢氧化镁
Mg(OH)2
58
水18、碳酸钙100,硫酸98 盐酸氢氧化钠40.
钠23、镁24、铝27、铁56、锌65、钙40、铜64、钾39、硫32、碳12、氢气2、氮气28、氧气32、
初中化学常见化合物相对分子质量
物质
化学式
相对分子质量
物质
化学式
相对分子质量
物质
化学式
相对分子质量
氨 气
NH3
17
二氧化碳
CO2
44
二氧化硫
SO2
盐酸
HCl
氢氧化钠
NaOH
40
氢氧化铜
Cu(OH)2
98
氢氧化钙
Ca(OH)2
74
氢氧化钾
KOH
56
氯化钙
CaCl2
111
硫酸钙
人教版初中化学九年级上册第四单元相对分子质量的有关计算

挑战自我: 2N2的相对分子质量如何计算? 【相对原子质量:N-14 】
新课讲解
【思考 】
1个CO2分子中碳、氧原子的个数比? 1:2 2个CO2分子中碳、氧原子的个数比? 1:2 n个(大量的)CO2分子中碳、氧原子的个数比? 1:2
新课讲解
【变式训练】计算CO2、Ca(OH)2的相对分子质量。
解:CO2的相对分子质量=12+16×2=44 Ca(OH)2的相对分子质量=40+(16+1)×2=74
新课讲解
【应用实例】苏丹红一号的相对分子质量为248,其化学式为 CxH12N2O,其中x=_1_6___
【分析】利用相对分子质量的定义,设未知数,列方程式, 求算即可。
新课讲解
二、化合物中各元素的质量比
【思考 】
1个CO2分子中碳、氧原子的质量比?
12:(16×2)=3:8
2个CO2分子中碳、氧原子的质量比?
12:(16×2)=3:8
n个(大量的)CO2分子中碳、氧原子的质量比?12:(16×2)=3:8
二氧化碳(CO2)中碳、氧元素的质量比? 12:(16×2)=3:8
=NH4NO3的质量×NH4NO3中氮元素的质量分数
=60Kg×
14×2 80
×100%
=21Kg
答:60KgNH4NO3中含氮元素21Kg
归纳小结
1、相对分子质量=化学式中各原子的相对原子质量的总和; 2、元素质量比=(相对原子质量×个数)之比; 3、物质中某元素质量分数= 元素的相对原子质量×原子个数 ;
某元素的质量分数=
该元素相对原子质量×原子个数 化合物的相对分子质量
初中化学中考复习专题4 相对原子质量 相对分子质量

专题4 相对原子质量相对分子质量一、中考复习要求12、熟练掌握有关化学式的计算(相对分子质量的计算、计算纯净物中各元素的质量二、基础知识回顾1、相对原子质量:以一个碳-12(质子数和中子数均为6的碳原子)原子质量的作为标准,某原子的质量跟它相所得的数值,即是该种原子的相对原子质量,计算某原子的相对原子质量的公式,相对原子质量是一个比值,它的国际单位制单位为符号为(书写时一般省略不写)。
2、相对分子质量:表示物质的化学式里所有原子的总和。
相对分子质量也是以一个碳-12原子的质量的1/12作为标准进行比较而得到的相对质量,它也是一个比值,国际单位制单位为“-”符号为“1”三、重点疑点讨论1、怎样理解相对分子质量也是以一个碳-12原子的质量的1/12作为标准进行比较而2、硫酸(H2SO4)的相对分子质量是98克,对吗?3、为什么质子数和中子数的和近似等于相对原子质量?4、如何计算胆矾(CuSO4·5H2O) 相对分子质量?5、能否根据物质中某元素的质量分数来判断该物质是否为纯净物?如碳元素质量分数为12%的石灰石是纯净物吗?判断某物质是否纯净物的标准是什么?四、解题方法指导例题1、已知一个碳-12原子的质量为1.993×10-26千克,镁的相对原子质量为24,例题2、铁的某种氧化物中铁元素与氧元素的质量比为21:8,则该氧化物的相对分子质量为( )A、 72B、 160C、 232D、 256思考:先由铁元素与氧元素的质量比推断铁的某种氧化物的化学式,然后计算相对分子质量。
本题求化学式的方法有两种,请同学们自己推出。
例题3 一种含氧化铁的铁矿石,经测定含铁49%。
求矿石中氧化铁的质量分数。
思考:求矿石中氧化铁的质量分数,就是求不纯的含Fe2O3的矿石中纯的Fe2O3质量分数。
矿石中含铁元素的质量等于矿石中Fe2O3含有的铁元素质量。
矿石的质量×矿石中含铁的质量分数 = Fe2O3的质量× Fe2O3中含铁的质量分数五、知识能力训练巩固知识1、已知一个碳-12原子的质量为 1.993×10-26Kg,一个铁原子的质量为9.288×10-26Kg,则铁的相对原子质量为;氧原子的相对原子质量是16,则1个氧原子的质量是 Kg;银的相对原子质量是碳的相对原子质量的9倍,则银的相对原子质量是。
化学相对分子质量表

物质
化学式
相对分子质量
物质
化学式
相对分子质量
物质
化学式
相对分子质量
氨 气
NH3
17
二氧化碳
CO2
44
二氧化硫
SO2
64
一氧化碳
CO
28
三氧化硫
SO3
80
氧化钙
CaO
56
四氧化三铁
Fe3O4
232
三氧化二铁
Fe2O3
160
氧化亚铁
FeO
72
氧化铝
Al2O3
102
五氧化二磷
P2O5
142
水
H2O
18
硝 酸
HNO3
63
硫酸
H2SO4
98
亚硫酸
H2SO3
82
磷 酸
H3PO4
98
乙酸
CH3COOH
60
碳 酸
H2CO3
62
盐酸
HCl
36.5
氢氧化钠
NaOH
40
氢氧化铜
Cu(OH)2
பைடு நூலகம்98
氢氧化钙
Ca(OH)2
74
氢氧化钾
KOH
56
氯化钙
CaCl2
111
硫酸钙
CaSO4
136
碳酸钙
CaCO3
100
氯化铁
FeCl3
162.5
氯化亚铁
FeCl2
127
硫酸亚铁
FeSO4
152
氯化钠
NaCl
58.5
硫酸钠
Na2SO4
142
初中常用相对分子质量及常用化学计算公式

初中常见分子量总结(根据颜色和可溶性,可以组合分离和除杂题自测)氢气(无无)H2 2 硝酸HNO363氧气(无无)O232 硝酸根离子团NO3—62氨气(刺透)NH317 硝酸铵(白/无)NH4NO380硝酸银Ag NO3170水H2O 18 盐酸(氯化氢)HCl 36。
5 二氧化碳(无无)CO244 两个氯化氢分子 2 HCl73氧化钙(生石灰)白CaO 56 氯离子Cl1—35。
5 一氧化碳(无无)CO 28 氯化钠(食盐)白NaCl 58.5 氧化镁(白)MgO 40 氯化铁(淡黄溶)FeCl3162。
5 氧化铁(红)Fe2O3160 氯化钙(白/无)CaCl2111氧化铜(黑)CuO 80 氯化钡(白/无)BaCl2208四氧化三铁(黑) Fe3O4232 氯化银AgCl 143.5 氧化亚铁(黑)FeO 72二氧化锰(黑)MnO287二氧化硫(刺透)SO264硫酸H2SO498硫酸根离子团SO42—96碳酸H2CO362 硫酸铜(白固蓝溶)CuSO4160碳酸根CO32—60 硫酸钠(白/无)Na2SO4142碳酸钙(白沉酸溶)CaCO3100 硫酸钡(白不溶沉)BaSO4233碳酸钠(白/无)Na2CO3106 硫酸镁(白/无)MgSO4120碳酸钡(白沉酸溶) BaCO3197 硫酸亚铁(淡绿)FeSO4152碳酸氢铵(白/无)NH4HCO379 硫酸锌(白/无)ZnSO4161碱式碳酸铜(绿)Cu2(OH)2CO3222 五水硫酸铜(蓝固蓝溶)Cu SO45H2O 250•氯酸钾KClO3122.5 氢氧化钠NaOH 40 高锰酸钾(灰锰氧)KMnO4158氢氧化钙(熟石灰微溶)Ca(OH)274 甲烷CH416氢氧根17 尿素CO(NH2)260氢氧化镁(白/无)Mg(OH)258 乙醇(酒精)C2H5OH 46氢氧化铜(蓝沉酸溶)Cu(OH)298 乙酸(醋酸)CH3COOH 60氨水NH3H2O35 蔗糖C6H12O6180•初中化学常用计算公式(1)相对原子质量=== 某元素一个原子的质量 / 一个碳原子质量的1/12(2)设某化合物化学式为A m B n①它的相对分子质量==A的相对原子质量×m+B的相对原子质量×n②A元素与B元素的质量比==A的相对原子质量×m:B的相对原子质量×n③A元素的质量分数ω===A的相对原子质量×m /A m B n的相对分子质量(3)混合物中含某物质的质量分数(纯度)===纯物质的质量/混合物的总质量 ×100%(4)标准状况下气体密度(g/L)===气体质量(g)/气体体积(L)(5)纯度===纯物质的质量/混合物的总质量 × 100%===纯物质的质量/(纯物质的质量+杂质的质量)×100%===1- 杂质的质量分数(6)溶质的质量分数===溶质质量/溶液质量 × 100%===溶质质量/(溶质质量+溶剂质量) × 100%(7)溶液的稀释与浓缩M浓 × a%浓===M稀 × b%稀=== (M浓+增加的溶剂质量) × b%稀(8)相对溶质不同质量分数的两种溶液混合M浓 × a%浓+M稀 × b%稀=== (M浓+M稀) × c%(9)溶液中溶质的质量==溶液的质量×溶液中溶质的质量分数==溶液的体积×溶液的密度钾、钠、铵、硝个个溶,钾、钠、钡、钙四碱溶,红铁蓝铜白镁锌,“白铝治酸"沉水中。
初中化学公式汇总

初中化学公式汇总初中化学常见的公式如下:1.摩尔质量公式:M=m/n其中,M表示摩尔质量,m表示物质的质量,n表示摩尔数。
2.摩尔数公式:n=N/N₀其中,n表示摩尔数,N表示分子数,N₀表示阿伏伽德罗常数。
3.相对分子质量公式:Mr=M/M₀其中,Mr表示相对分子质量,M表示分子质量,M₀表示碳-12同位素的质量。
4.相对原子质量公式:Ar=M/M₀其中,Ar表示相对原子质量,M表示原子质量,M₀表示碳-12同位素的质量。
5.溶液的浓度公式:C=n/V其中,C表示溶液的浓度,n表示溶质的摩尔数,V表示溶液的体积。
6.摩尔浓度公式:c=C/V其中,c表示溶液的摩尔浓度,C表示溶液中溶质的摩尔数,V表示溶液的体积。
7.摩尔体积公式:Vm=V/n其中,Vm表示摩尔体积,V表示气体体积,n表示气体的摩尔数。
8.气体状态方程(理想气体):PV=nRT其中,P表示气体的压强,V表示气体的体积,n表示气体的摩尔数,R为气体常量,T表示气体的温度。
9.化学反应速率公式:v=ΔC/Δt其中,v表示反应速率,ΔC表示物质浓度的变化量,Δt表示时间的变化量。
10.电解质浓度公式:E=n/FV其中,E表示电解质的浓度,n表示溶质的摩尔数,F为法拉第常数,V表示溶液的体积。
11.电量公式:Q=m·Z·F其中,Q表示电量,m表示物质的质量,Z为电离度,F为法拉第常数。
12.平均原子质量公式:M = Σ(Mi·xi)其中,M表示平均原子质量,Mi表示各个同位素的原子质量,xi为每个同位素的百分比。
13.摩尔解吸热公式:∆H=q/n其中,∆H表示摩尔解吸热,q表示吸热或放热的热量,n表示物质的摩尔数。
14.摩尔焓变公式:∆H=m·C·∆T其中,∆H表示摩尔焓变,m表示物质的质量,C表示物质的比热容,∆T表示温度的变化量。
15.定量分析物质的质量公式:m=M·V其中,m表示物质的质量,M表示物质的摩尔质量,V表示溶液的体积。
