第十二章-药物制剂分析
药物制剂稳定性实验方法

医学ppt
5
药物降解公式:
dC dt
= KCn
K:反应速度常数 C:反应物浓度
n:反应级数
t:反应时间
n可以等于0,1,2……称为零级、一级、二 级……反应
医学ppt
6
级第数一节微概分述式
0
dC dt
=K
积分式 C=-Kt+C0
1
dC dt
= KC
lgC=
---- 临界相对湿度(CRH)
医学ppt
27
(五)金属离子
催化氧化反应速度; 0.0002M的Cu2+可使维生素C氧化反 应加快10000倍。
避免生产过程、原辅中带入, 加螯合剂:
依地酸盐(EDTA)、枸橼酸、酒石酸等
医学ppt
28
(六)包装材料
隔绝热、光、水、氧,不与药物反应, (1)玻璃,棕色玻璃 (2)塑料:透湿、透气、吸着性 (3)金属 (4)橡胶----塞子、垫圈等 “装样试验”,
医学ppt
29
三、固体药物制剂稳定性的特点 自学
医学ppt
30
四、药物制剂稳定性的其它方法
改进剂型及生产工艺 制成固体制剂(青霉素----粉针) 制成微囊或包合物(维生素A----微囊; 薄荷油----包合物) 直接压片或包衣
医学ppt
31
四、药物制剂稳定性的其它方法
制成难溶性盐 青霉素G钾盐--普鲁卡因青霉素G (1:250)
阳光下10分钟分解13.5%, 室内光线下,半衰期为4小时。
医学ppt
23
(三)空气(氧气)
溶液中、容器中(氧化药物) (1)排除氧气 溶液中:煮沸(100℃水中不含氧气),
河北科技大学物理药剂学12药物制剂的稳定性

易氧化物
固体药物稳定性
各种产品
(一)温度的影响
Van’t Hoff规则:一般来说,温度升高,反 应速度加快。温度每升高 10C ,反应速度约 增加2~4倍。 • 不同反应增加的倍数可能不同,上述规则只是 一个粗略的估计。 Arrhenius 方程:定量地描述了温度与反应 速度之间的关系,是药物稳定性预测的主要理 论依据。
• pH调节要同时考虑稳定性、溶解度和疗效三个方面。 • 如大部分生物碱在偏酸性溶液中比较稳定,故注射剂常 调节在偏酸范围。但制成滴眼剂,就应调节在偏中性范 围,以减少刺激性,提高疗效。
尽量采用与药物本身具有相同离子的酸或碱进行调节
(二)广义酸碱催化的影响
• 按照Bronsted-Lowry酸碱理论,给出质子 的物质叫广义的酸,接受质子的物质叫广义的 碱。 • 有些药物也可被广义的酸碱催化水解。这种催 化作用叫广义的酸碱催化(一般酸碱催化)。 • 许多药物处方中,往往需要加入缓冲剂。 • 缓冲剂对某些药物的水解有催化作用 (如醋酸盐、磷酸盐、枸橼酸盐、硼酸盐)
普鲁卡因盐酸盐
第四节
影响药物制剂降解的因素及 稳定化方法
一、处方因素
• 制备任何一种制剂,由于处方的组成对制剂稳 定性影响很大,因此,首先要进行处方设计。 • pH、广义的酸碱催化、溶剂、离子强度、表 面活性剂、某些辅料等因素
(一)pH的影响
专属酸碱催化(或特殊酸碱催化) : H+ 或 OH-
• 氧化过程一般都比较复杂,有时一个药物,氧化、 光化分解、水解等过程同时存在。
1.酚类药物
• 这类药物分子中具有酚羟基,如肾上腺素、左 旋多巴、吗啡、去水吗啡、水杨酸钠等。
肾上腺素
药剂学第十二章 缓释、控释制剂

第十二章缓释、控释制剂第一节概述一、基本概念1.缓释制剂:系指用药后能在较长时间内持续释放药物以达到延长药效目的的制剂。
一般应在规定的释放介质中,按要求缓慢地非恒速释放药物,缓释制剂中药物的释放主要是一级速度过程。
2.控释制剂:系指药物能在设定的时间内自动以设定速度释放药物的制剂。
一般在规定的介质中,按要求恒速或接近恒速释放药物。
控释制剂中药物的释放主要是零级速度过程。
3.缓释、控释制剂的特点(1)减少服药次数,使用方便,提高患者服药的顺应性(2)使血药浓度平稳,避免或减少峰谷现象,降低毒副作用。
(3)减少用药总剂量,可用最小剂量达到最大药效。
二、缓释、控释制剂的处方设计(一)影响口服缓释、控释制剂设计的因素1.药物的理化因素(1)剂量大小:口服单剂量在0.5~1.0g对缓释制剂仍适用,治疗指数窄的药物设计成缓释制剂应注意剂量与毒副作用。
(2)pKa、解离度和水溶性:非解离型、脂溶性大的药物易通过脂质生物膜,应注意消化道pH对药物释放的影响。
溶解度<0.01mg/ml,本身具有缓释作用。
设计缓释制剂时药物溶解度<0.1mg/ml不适宜。
(3)药物的油、水分配系数:药物的油、水分配系数大的,在机体内滞留时间长。
油、水分配系数小时,不易透过脂质膜,故油、水分配系数应适中。
(4)稳定性:不稳定药物制成固体制剂较好2.生物因素(1)生物半衰期:24h<t1/2<1h不宜制成缓释制剂,t1/2>24h的药物本身就具有缓释作用。
(2)吸收:吸收的半衰期应控制3~4h的药物,否则不利于吸收。
(3)代谢:吸收前有代谢的药物,不适宜制成缓释制剂,如要制成缓释制剂,需加入代谢的抑制剂。
(二)缓释、控释制剂的设计1.药物选择(1)t1/2=2~8h适宜;12h<t1/2<1h,不适宜制成该类制剂。
(2)剂量很大、药效很激烈、溶解吸收很差、剂量需精密调节的药物不宜制成缓释、控释制剂。
2.设计要求(1)生物利用度:缓控制剂的相对生物利用度应为普通制剂的80~120%(2)峰谷浓度比:稳定时,峰、谷浓度应小于或等于普通制剂。
第十二章药物制剂的稳定性

有人在研究杆菌肽的热分解实验中,存在平衡。 维生素A胶丸和维生素E片剂存在平衡现象
采用45℃ 、55℃ 、70℃ 、85℃四个温度进行 实验,测定各个温度下产物和反应物的平衡浓度, 然后求出平衡常数K。按Van’t Hoff方程:
H ln K RT
H:反应热;:常数。以lgK对1/T作图,得一
避免金属离子的影响,应选用纯度较高的原辅料, 不使用金属器具,加入螯合剂。
7
(五)湿度和水分的影响
湿度与水分对固体药物制剂稳定性的影响较大 无论是水解反应,还是氧化反应,微量 的水均能加速一些药物(氨苄青霉素钠、对 氨基水杨酸钠、乙酰水杨酸、青霉素G钠盐) 的分解。
药物是否容易吸湿,取决其临界相对湿度 (CRH%)的大小。 临界相对湿度(critical relative humidity):
14
2.
药物分子相对固定,不均匀性;一些易氧化的 药物,氧化作用往往限于固体表面,以致表里变化 不一。
固体剂型的特点: ①系统不均匀性;②多相系统,包括气相、液相 和固相,当进行实验时,这些相的组成和状态能 够发生变化。特别是水分的存在,对实验造成很 大的困难,因水分对稳定性影响很大,由于这些 特点,研究固体药物剂型稳定性,是一件十分复 杂的工作。
13
例如青霉素钾盐,可制成溶解度小的普鲁卡因青
霉素G,稳定性显着提高。青霉素还可与N, N-双
苄乙二胺生成苄星青霉素G(长效西林),其溶解
度进一步减小,稳定性增强,可以口服。
第五节 固体药物制剂稳定性的特点 及降解动力学
一、固体药物制剂稳定性的特点
(一)固体药物与固体剂型稳定性的一般特点
第十二章 药物制剂的稳定性 经典恒温法
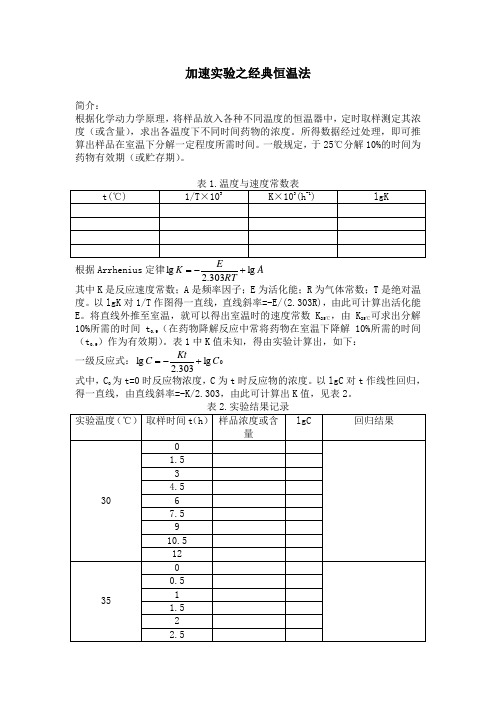
加速实验之经典恒温法简介:根据化学动力学原理,将样品放入各种不同温度的恒温器中,定时取样测定其浓度(或含量),求出各温度下不同时间药物的浓度。
所得数据经过处理,即可推算出样品在室温下分解一定程度所需时间。
一般规定,于25℃分解10%的时间为药物有效期(或贮存期)。
根据Arrhenius 定律A RTK lg 303.2lg +-= 其中K 是反应速度常数;A 是频率因子;E 为活化能;R 为气体常数;T 是绝对温度。
以lgK 对1/T 作图得一直线,直线斜率=-E/(2.303R),由此可计算出活化能E 。
将直线外推至室温,就可以得出室温时的速度常数K 25℃,由K 25℃可求出分解10%所需的时间t 0.9(在药物降解反应中常将药物在室温下降解10%所需的时间(t 0.9)作为有效期)。
表1中K 值未知,得由实验计算出,如下:一级反应式:0lg 303.2lg C Kt C +-= 式中,C 0为t=0时反应物浓度,C 为t 时反应物的浓度。
以lgC 对t 作线性回归,得一直线,由直线斜率=-K/2.303,由此可计算出K 值,见表2。
度高,则间隔时间短,反之亦然。
)的取样测定。
此法较准确,但分析测定工作量大。
例子:银黄注射液稳定性预测黄芩苷测定数据处理方法:在每一实验温度内,将lgC对t作线性回归,结果如表3。
再将实验温度有摄氏温度改换为热力学温度T,调整如表5:lgIK=-64031/T+16.02将室温25℃(T=298K)代入直线方程,得室温反应速度常数K25℃=3.4075×10-6/h,代入公式t0.9=0.1045/K25℃=30660h=3.5年,即黄芩苷于25℃的有效期为3.5年。
药剂学-第十二章-固体制剂-2(第8版)

3.糊精
淀粉水解的中间产物,在热水中易溶,不溶于乙醇。 粘结性较强,易造成片剂的麻点和水印。 糊精用量要少,并与糖粉合用为宜。 影响崩解度和主药含测。
4.乳糖
由等分子葡萄糖及半乳糖组成。白色结晶粉末,略带甜味,易溶于水,微溶于乙醇。 化学性质稳定,无吸湿性,适用于具有引湿性的药物; 可压性好; 乳糖是一种优良稀释剂,制成的片剂光洁明亮美观,对主药含量测定无影响; 非结晶性乳糖可供粉末直接压片。
3.聚维酮
( PVP)
⑴本品为黄色高分子聚集合物, 化学性质稳定, 既溶于水,又溶于乙醇。可用于水溶性或水 不溶性物料以及对水敏感性药物的制粒,还可用做直接压片的干粘合剂。
⑵常用于泡腾片及咀嚼片的制粒中。最大缺点是吸湿性强。
4.明胶(gelatin)
⑴溶于水形成胶桨,其粘度较大,制粒时明胶溶液应保持较高温度,以防止胶凝,缺点是制粒物随 防置时间变硬。
1.口服用片剂
分散片:遇水可迅速崩解并均匀分散的片剂。加水中分散后饮用,也可咀嚼或含服。 如罗红霉 素分散片、阿司匹林分散片。
缓释片或控释片:能够延长药物作用时间或控制药物释放速度的片剂。有血药浓度平稳、服药 次数少、治疗作用时间长优点。
1.口服用片剂
多层片:指由两层或多层构成的片剂,一般由两次或多次加压而制成,每层含有不同的药 物或辅料,这样可以避免复方制剂中不同药物之间的配伍变化,或者达到缓释、控释的效 果。 如:胃仙-U片
(4)羧甲基纤维素钠(CMC-Na)
粘合剂
本品为纤维素的半合成品,为白色粉末, 易溶于水,不溶于乙醇,粘性很强,是一种新型粘 合剂,常用浓度为 l% ~2%。
与主药混合均匀后,便可干法直接压片,如维生素C片, 即是用此种办法制成。
药剂学:第十二章 固体制剂

溶胶
蘸胶(制坯)
干燥
整理
切割
拔壳
第五节 胶囊剂
一、硬胶囊剂的制备
(二) 药物的填充与封口
类型 普通型、锁口型
空胶囊的选用
规格 8种,常用的为0-5号
药物的填充
根据药物的填充量来 选择空胶囊的规格。
封口
1.螺旋钻压进物料 2.用柱塞上下往复压进物料 3.自由流入物料 4.将物料压成单位量药粉块, 再填充于胶囊中。
第二节 散剂
分类
药典一部分为:内服和外用散剂 药典二部分为:口服散剂和局部用 散剂。
第二节 散剂
一、散剂的制备
工艺流程
粉碎 药物
筛分
混合
分剂量
质量检查
包装
辅料
散剂
第二节 散剂
一、散剂的制备
分剂量
➢ 目测法 ➢ 容量法 ➢ 重量法
第二节 散剂
一、散剂的制备
包装与 贮存
目的:延缓散剂吸湿。 包装材料:包装用纸有包装纸、蜡纸和玻璃纸,塑料
挤压式制粒机
第三节 颗粒剂
一、颗粒剂的制备
制粒 设备
本机是一种将潮 湿粉末状混合物, 在旋转滚筒的正、 反旋转作用下, 强制性通过筛网 而制成颗粒的专 用设备。
摇摆式制粒机
第三节 颗粒剂
一、颗粒剂的制备
制粒 设备
本机用于制药、食 品、冲剂、化工、 固体饮料等行业, 将搅拌好的物料制 成所需颗粒,特别 适用对粘性较高的 物料。
第五节 胶囊剂
二、软胶囊的制备
(一)影响软胶囊成型的因素
囊壁组成的影响
囊壁具有可塑性与弹性是软胶囊的 特点,它由明胶、增塑剂、水三者 所构成,比例:1:(0.4~0.6) :1。
12-药剂学-药物制剂的稳定性

将上述数据(lgk对1/T)进行一元线性回 归,得回归方程: lg k=-4765.98/T+10.64 求25℃时的k lgk=-4765.98/298+10.64 k25=4.434×10-6h-1 t0.9=
0.1054 0.1054 = = 2.71 −6 k 25 4.434 × 10
年
前面提到药物的氧化降解常为自动氧化,在制剂 中只要有少量氧存在,就能引起这类反应,因此还必 须加入抗氧剂(antioxidants)。 一些抗氧剂本身为强还原剂,它首先被氧化而保护 主药免遭氧化,在此过程中抗氧剂逐渐被消耗(如亚 硫酸盐类)。 另一些抗氧剂是链反应的阻化剂,能与游离基结 合,中断链反应的进行,在此过程中其本身不被消 耗。 抗氧剂可分为水溶性抗氧剂与油溶性抗氧剂两大 类,这些抗氧剂的名称、分子式和用量见表11-5,其 中油溶性抗氧剂具有阻化剂的作用。
实验时,首先设计实验温度与取样时间。计 划好后,将样品放入各种不同温度的恒温水浴 中,定时取样测定其浓度(或含量),求出各 温度下不同时间药物的浓度变化。 以药物浓度或浓度的其它函数对时间作 图,以判断反应级数。若以lg C对t作图得一直 线,则为一级反应。再由直线斜率求出各温度 的速度常数,然后按前述方法求出活化能和 t0.9。
− E / RT
A-频率因子;E-活化能;R-气体常数
−E lg k = + lg A 2.303RT k2 1 1 −E lg = ( − ) k1 2.303RT T2 T1
(二)药物稳定性预测
药物稳定性预测有多种方法,但基本的方法 仍是经典恒温法,根据Arrhenius方程以lg k对 1/T作图得一直线,此图称Arrhenius图,直线斜 率=-E/(2.303R),由此可计算出活化能E。 若将直线外推至室温,就可求出室温时的速度 常数(k25)。由k25 可求出分解10%所需的时间 (即t0.9)或室温贮藏若干时间以后残余的药物的 浓度。
第十二章药物制剂分析

第十二章药物制剂分析基本要求掌握片剂、注射剂、胶囊剂、颗粒剂和软膏剂的一般检查项目和特殊检查项目;制剂含量测定结果的表示方法和计算方法。
熟悉常用附加剂对含量测定的干扰和排除方法。
了解复方制剂的分析。
第一节药物制剂分析的特点1.方法:制剂分析是利用物理、化学、物理化学、甚至微生物测定方法,对不同剂型的药物制剂进行分析,以检验被检测的制剂是否符合质量标准规定的要求。
2.区别:制剂除含主药外,还含有赋形剂、稀释剂和附加剂(包括稳定剂、抗氧剂、防腐剂和着色剂等),这些附加成分的存在,常常会影响主药的测定,致使制剂分析复杂化。
3.检查:通常是符合药物规定要求的各种原料,按照一定的生产工艺制备而成的。
因此,在制剂分析中对所有原料所做过的检查项目,不必重复。
制剂中如需进行杂质检查,主要来源于制剂中原料药物的化学变化和制剂的制备过程。
4.制剂特殊检查:除对某些不稳定的药物制剂需增加必要的检查项目外,一般对小剂量片剂(或胶囊)等需检查均匀度;对具有某种物理特性的片剂(或胶囊)需检查溶出度;对某些特殊制剂(缓释、控释剂肠溶制剂)需检查释放度等等,以保证药物的有效、合理及安全。
5.与原料药含量测定方法的区别:专属性和灵敏度要求更高。
(考虑性质、含量以及赋形剂、附加剂的影响;同时考虑复方制剂中其他成分的影响)。
6.计算:按标示量计算的百分含量表示,而不采用原料药的百分含量的表示方法。
1)采用滴定分析时,含量测定结果用下式进行计算:(1)片剂:相当于标示量的百分含量=W测×W/n//W样×S标×100%式中,W测为采用某种滴定方法测得的量(g);Wn/n为平均片(胶囊)重(g/片),W样为称取样品量(g);n为所称取片(胶囊)的个数;S标为标示量(g/片)(2)注射剂含量测定结果的计算:相当于标示量的百分含量= W测/V×S×100%式中V准确量取样品的体积(ml);W测为采用某种滴定方法测得V(ml)样品中被测组分的量(mg);S为标示量(mg/ml)。
大学《药物分析》章节试题及答案(五)

大学《药物分析》章节试题及答案第十二章药物制剂分析一、选择题1.下列说法不正确的是( B )(A)凡规定检查溶解度的制剂,不再进行崩解时限检查(B)凡规定检查释放度的制剂,不再进行崩解时限检查(C)凡规定检查融变时限的制剂,不再进行崩解时限检查(D)凡规定检查重量差异的制剂,不再进行崩解时限检查(E)凡规定检查含量均匀度的制剂,不再进行重量差异时限检查2.对于平均片重在0.30g以下片剂,我国药典规定其重量差异限度为( C )(A)±3% (B)±5%(C)±7.5% (D)±10% (E)以上均不对3.片剂重量差异限度检查法中应取药片( D )片。
(A)6片 (B)10片 (C)15片(D)20片 (E)2片4.含量均匀度检查主要针对( A )(A)小剂量的片剂 (B)大剂量的片剂 (C)所有片剂(D)难溶性药物片剂 (E)以上均不对5.下列关于溶解度的叙述错误的是( E )(A)溶解度检查主要适用于难溶性药物 (B)溶解度检查法分为转蓝法和浆法(C)溶解度检查法规定的温度为37℃ (D)凡检查溶解度的片剂,不再进行崩解时限检查(E)溶解度与体内的生物利用度直接相关6.注射剂中加入抗氧剂有许多,下列答案不属于抗氧剂的为( D )(A)亚硫酸钠 (B)焦亚硫酸钠 (C)硫代硫酸钠 (D)连四硫酸钠 (E)亚硫酸氢钠7.药典规定,采用碘量法测定维生素C注射液的含量时,加入( B )为掩蔽剂,消除抗氧剂的干扰(A)氯仿 (B)丙酮 (C)乙醇 (D)甲酸 (E)以上均不对8.中国药典规定,硫酸亚铁片的含量测定采用( B )法以消除糖类赋形剂的干扰。
(A)高锰酸钾法 (B)铈量法 (C)碘量法 (D)溴量法 (E)络合滴定法9.复方阿司匹林片中咖啡因的含量测定方法为( B )(A)滴定法 (B)剩余碘量法 (C)配合滴定法 (D)银量法 (E)以上都不是10.为了防止阿司匹林的水解,在制备复方阿司匹林片时,常加入( B )为稳定剂。
药物制剂分析

第十二章药物制剂分析第一节概述为了防治与诊断疾病的需要,更好地发挥药物的分析,降低毒性,减少副作用,便于患者服用,便于储藏与运输,根据药典、部标准或其他法定处方,需将原料药和辅料等经过加工制成各种制剂。
常用的剂型有:片剂、注射剂、酊剂、栓剂、胶囊剂等根据制剂中含有有效成分的种类,又可将制剂分为单方制剂和复方制剂。
一、制剂分析的特点制剂分析:是对各种制剂,应用物理、化学或生物测定的方法进行分析,检验其是否符合质量标准规定。
特点:1、消除辅料的干扰稀释剂、赋形剂、附加剂会影响鉴别、检查和含量测定,所以首先要消除这些干扰。
如:维生素C中稳定剂,焦亚硫酸钠→干扰碘量法阿司匹林片剂中酒石酸、枸橼酸,影响酸碱滴定→两步滴定法2、消除共存药物的干扰复方制剂、特别是含量测定3、根据制剂生产中可能引入的杂质确定检查项目和限度要求制剂的杂质检查,主要是检验制剂在制备过程中或贮存过程中所产生的杂质。
原料药不再检验,因为投料前已检验合格。
4、含量限度比原料药宽如:原料药磺胺嘧啶含量不得少于99.0%,磺胺嘧啶片应为标示量95.0~105.0%,允许±5.0%。
二、制剂分析的指导原则1、鉴别A、为消除共存药物和辅料的干扰,应通过溶剂溶解而分离;B、多采用紫外分光光度法鉴别(规定吸收波长或不同波长吸收度的比值);C、当主药含量低微时,可采用灵敏度高、专属性强的方法,如薄层层析、高效液相色谱法;D、必要时可增加与同类药物相区别的鉴别试验(如磺胺类测定提取物的熔点)。
2、杂质检查A、制剂的杂质检查一般首选薄层色谱法,如不能解决,再选用高效液相色谱法;B、除检查生产工艺中可能带入的有关杂质外,主要控制降解产物;C、当紫外分光光度法用于杂质检查时,应选用主药无吸收的波长或杂质有吸收的波长处规定吸收值限量,用以控制杂质的限量。
3、含量测定A、可能时应选用与原料药相同的测定方法;B、共存药物、辅料、附加剂有干扰时,可考虑增加预处理或改进方法,排除干扰后用原料药的测定方法;C、降解产物有干扰时,可选用专属性较高的方法;D、主药含量很小的制剂可选用灵敏度较高的方法,常用紫外分光光度法。
药物分析试题库

药物分析试题库.药物分析试题库第一章绪论第二章药物的杂质检查第三章药物定量分析与分析方法验证第四章巴比妥类药物的分析第五章芳酸及其酯类药物的分析第六章胺类药物的分析第七章杂环类药物的分析第八章生物碱类药物的分析第九章维生素类药物的分析第十章甾体激素类药物的分析第十一章抗生素类药物的分析第十二章药物制剂分析第十三章生化药物与基因工程药物分析概论第十四章中药及其制剂分析概论第十五章药品质量标准的制订第十六章药品质量控制中的现代分析方法与技术第一章绪论一、填空题1.我国药品质量标准分为和二者均属于国家药品质量标准,具有等同的法律效力。
2.中国药典的主要内容由、、部分组成。
.v.3.目前公认的全面控制药品质量的法规有、、、。
4.“精密称定”系指称取重量应准确至所取重量的;“称定”系指称取重量应准确至所取重量的;取用量为“约”若干时,系指取用量不得超过规定量的。
5.药物分析主要是采用或等方法和技术,研究化学合成药物和结构已知的天然药物及其制剂的组成、理化性质、真伪鉴别、纯度检查以及有效成分的含量测定等。
所以,药物分析是一门的方法性学科。
二、问答题1.药品的概念.对药品的进行质量控制的意义.2.药物分析在药品的质量控制中担任着主要的任务是什么.3.常见的药品标准主要有哪些,各有何特点.4.中国药典(2010年版)是怎样编排的.5.什么叫恒重,什么叫空白试验,什么叫标准品、对照品.6.常用的药物分析方法有哪些.7.药品检验工作的基本程序是什么"8.中国药典和国外常用药典的现行版本及英文缩写分别是什么.第二章药物的杂质检查一、选择题:1.药物中的重金属是指()APb2+B影响药物安全性和稳定性的金属离子C原子量大的金属离子.v.D在规定条件下与硫代乙酰胺或硫化钠作用显色的金属杂质2.古蔡氏检砷法测砷时,砷化氢气体与以下那种物资感化天生砷斑()A氯化汞B溴化汞C碘化汞D硫化汞3.搜检某药品杂质限量时,称取供试品W(g),量取标准溶液V(ml),其浓度为C(g/ml),则该药的杂质限量(%)是()AVWC100%BCWVCWV100%CW100%DCV100%4.用古蔡氏法测定砷盐限量,比较管中插手标准砷溶液为()A1mlB2mlC依限量大小决定D依样品取量及限量计算决定5.药品杂质限量是指()A药物中所含杂质的最小容许量B药物中所含杂质的最大容许量C药物中所含杂质的最佳容许量D药物的杂质含量6.氯化物搜检中插手硝酸的目的是()A加速氯化银的形成B加速氧化银的形成C除去CO2+2-2-3-3、SO4、C2O4、PO4的滋扰D改良氯化银的匀称度7.关于药物中杂质及杂质限量的叙述正确的是()A杂质限量指药物中所含杂质的最大容许量B杂质限量通常只用百万分之几表示D搜检杂质,必须用标准溶液举行比对8.砷盐搜检法中,在检砷装置导气管中塞入醋酸铅棉花的感化是()A吸收砷化氢B吸收溴化氢C吸收硫化氢D吸收氯化氢9.中国药典规定的一般杂质检查中不包括的项目().v.A硫酸盐检查B氯化物检查C溶出度检查D重金属检查10.重金属检查中,加入硫代乙酰胺时溶液控制最佳的pH值是()A1.5B3.5C7.5D11.5二、多选题:1.用对照法进行药物的一般杂质检查时,操作中应注意()A供试管与对照管应同步操作B称取1g以上供试品时,不超过规定量的±1%C仪器应配对D溶剂应是去离子水E对照品必须与待检杂质为同一物质2.关于药物中氯化物的检查,正确的是()A氯化物检查在一定程度上可“指示”生产、储存是否正常B氯化物检查可反应Ag+的多少C氯化物搜检是在酸性条件下举行的D供试品的取量可任意E标准NaCl液的取量由限量及供试品取量而定3.检查重金属的方法有()A古蔡氏法B硫代乙酰胺C硫化钠法D微孔滤膜法E硫氰酸盐法4.关于古蔡氏法的叙述,错误的有()A反应天生的砷化氢遇溴化汞,产生黄色至棕色的砷斑B加碘化钾可使五价砷还原为三价砷C金属新与碱感化可天生重生态的氢D加酸性氯化亚锡可防止碘还原为碘离子.v.E在反应中氯化亚锡不会铜锌发生作用5.关于硫代乙酰胺法错误的叙述是()A是搜检氯化物的方法B是搜检重金属的方法C反应结果是以玄色为背景D在弱酸性条件下水解,产生硫化氢E反应时pH应为7-86.下列不属于一般杂质的是()A氯化物B重金属C氰化物D2-甲基-5-硝基咪唑E硫酸盐7.药品杂质限量的基本请求包孕()A不影响疗效和不发生毒性B保证药品格量C便于生产D便于储存E便于制剂生产A药品的生产过程中B药品的储藏过程中C药品的使用过程中D药品的运输过程中E药品的研制过程中9.药品的杂质会影响()A危害安康B影响药物的疗效C影响药物的生物利用度D影响药物的稳定性E影响药物的均一性三、填空题:1.药典中规定的杂质检查项目,是指该药品在___________和____________可能含有并需要控制的杂质。
《药理学》第12章

一、常用抗癫痫药物
卡马西平
卡马西平(carbamazepine,酰胺咪嗪)口服吸收不规则,一般2~6 h血药浓度达峰值,个体差 异较大,与血浆蛋白质结合率为70%~80%。在体内主要代谢为环氧化物,仍有抗癫痫作用。因有肝 药酶诱导作用,可加速自身代谢,多次用药后血浆半衰期缩短。
本药具有广谱抗癫痫作用,对精神运动性发作效果最好,对大发作也有效,为首选药物之一;对癫 痫并发的精神症状(躁狂抑郁症)亦有效。此外,本药还有抗神经痛作用,对三叉神经引起的疼痛冲 动有抑制作用,可用于治疗外周神经痛。
一、常用抗癫痫药物
丙戊酸钠
丙戊酸钠(sodium valproate)为广谱抗癫痫药,对各型癫痫均有效。对大发作的疗效不及苯妥 英钠和苯巴比妥,但对后两药无效者,用本药仍有效;对小发作的疗效优于乙琥胺,因有肝毒性,一 般不作首选用药;对精神运动性发作,疗效与卡马西平相似。临床作为混合型癫痫治疗的首选药,亦 可用于肌阵挛发作。丙戊酸钠不良反应较轻,常见恶心、呕吐、食欲减退;中枢神经系统反应少,主 要表现为嗜睡、共济失调、乏力、震颤等;约30%的患者在服药几个月内出现肝毒性。
3.抗心律失常 对强心苷中毒所致室性心律失常疗效较好(详见第十九章抗心律失常药)。
一、常用抗癫痫药物
【不良反应】
1.局部刺激本药呈强碱性,口服可引起胃肠道反应,如恶心、呕吐、食欲缺乏等,宜饭后服用。 静脉注射可引起静脉炎,不可与其他药品混合,推注速度宜慢,应防止药液外溢。
2.牙龈增生 与部分药物经唾液排出,刺激胶原组织增生有关。应注意口腔卫生,防止牙龈炎, 经常按摩牙龈可减轻症状。一般停药3~6个月可自行消退。
3.神经系统反应 口服过量引起急性中毒时主要影响小脑―前庭功能,表现为眩晕、共济失调和眼 球震颤等,严重者可出现语言障碍、精神错乱或昏迷等。
药物分析各章节习题

《药物分析》习题目录第一章药典概况第二章药物的杂质鉴别第三章药物的杂质检查第四章药物定量分析与分析方法验证第五章巴比妥类药物分析第六章芳酸及其酯类药物分析第七章芳香胺类药物分析第八章杂环类药物的分析第九章维生素类药物分析第十章甾体激素类药物的分析第十一章抗生素类药物的分析第十二章药物制剂分析第十三章药品质量标准的制订第十四章综合性试题第一章药典概况一、练习思考题1、什么是药品质量标准?我国目前有哪些法定的药品质量标准?2、药典的内容分哪几部分?正文部分包括哪些项目?3、在药物分析工作中可参考的主要外国药典有哪些?在内容编排上与中国药典有什么不同(举2~3例)?4、药物分析的主要目的是什么?5、试述药品检验程序及各项检验的意义?6、药品质量标准中的物理常数测定项目有哪些?他们的意义分别是什么?7、中国药典附录包括哪些内容?8、常用的含量测定方法有哪些?它们各有哪些特点?9、制订药品质量标准的原则是什么?10、如何确定药品质量标准中杂质检查项目及限度?11、在制订药品质量标准中怎样选择鉴别方法?12、在制订药物含量限度时应综合考虑哪几方面的情况?13、新药质量标准的起草说明应包括哪些主要方面?14、全面控制药品质量的科学管理条例包括哪些方面?15、什么叫标准品?什么叫对照品?16、0.1mol/L氢氧化钠溶液与氢氧化钠滴定液(0.1mol/L)有何区别?17、溶液的百分比用“%”符号表示,单位是什么?18、“某溶液(1→10)”指多少浓度的溶液?19、药品质量标准中“精密称取某药物若干”,系指允许的取用量范围是多少?20、什么叫空白实验?剩余滴定法中的空白试验与直接滴定法中的空白试验有何不同?二、选择题(一)最佳选择题1、我国现行药品质量标准有(E)A、国家药典和地方标准B、国家药典、部颁标准和国家药监局标准C、国家药典、国家药监局标准(部标准)和地方标准D、国家药监局标准和地方标准E、国家药典和国家药品标准(国家药监局标准)2、药品质量的全面控制是(A)A、药品研究、生产、供应、临床使用和有关技术的管理规范、条例的制度和实践B、药品生产和供应的质量标准C、真正做到把准确、可靠的药品检验数据作为产品质量评价、科研成果坚定的基础和依据D、帮助药品检验机构提高工作质量和信誉E、树立全国自上而下的药品检验机构的技术权威性和合法地位。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十二章药物制剂分析第一节概述为了防治与诊断疾病的需要,更好地发挥药物的分析,降低毒性,减少副作用,便于患者服用,便于储藏与运输,根据药典、部标准或其他法定处方,需将原料药和辅料等经过加工制成各种制剂。
常用的剂型有:片剂、注射剂、酊剂、栓剂、胶囊剂等根据制剂中含有有效成分的种类,又可将制剂分为单方制剂和复方制剂。
一、制剂分析的特点制剂分析:是对各种制剂,应用物理、化学或生物测定的方法进行分析,检验其是否符合质量标准规定。
特点:1、消除辅料的干扰稀释剂、赋形剂、附加剂会影响鉴别、检查和含量测定,所以首先要消除这些干扰。
如:维生素C中稳定剂,焦亚硫酸钠→干扰碘量法阿司匹林片剂中酒石酸、枸橼酸,影响酸碱滴定→两步滴定法2、消除共存药物的干扰复方制剂、特别是含量测定3、根据制剂生产中可能引入的杂质确定检查项目和限度要求制剂的杂质检查,主要是检验制剂在制备过程中或贮存过程中所产生的杂质。
原料药不再检验,因为投料前已检验合格。
4、含量限度比原料药宽如:原料药磺胺嘧啶含量不得少于99.0%,磺胺嘧啶片应为标示量95.0~105.0%,允许±5.0%。
二、制剂分析的指导原则1、鉴别A、为消除共存药物和辅料的干扰,应通过溶剂溶解而分离;B、多采用紫外分光光度法鉴别(规定吸收波长或不同波长吸收度的比值);C、当主药含量低微时,可采用灵敏度高、专属性强的方法,如薄层层析、高效液相色谱法;D、必要时可增加与同类药物相区别的鉴别试验(如磺胺类测定提取物的熔点)。
2、杂质检查A、制剂的杂质检查一般首选薄层色谱法,如不能解决,再选用高效液相色谱法;B、除检查生产工艺中可能带入的有关杂质外,主要控制降解产物;C、当紫外分光光度法用于杂质检查时,应选用主药无吸收的波长或杂质有吸收的波长处规定吸收值限量,用以控制杂质的限量。
3、含量测定A、可能时应选用与原料药相同的测定方法;B、共存药物、辅料、附加剂有干扰时,可考虑增加预处理或改进方法,排除干扰后用原料药的测定方法;C、降解产物有干扰时,可选用专属性较高的方法;D、主药含量很小的制剂可选用灵敏度较高的方法,常用紫外分光光度法。
但应注意避免溶剂或降解产物的干扰,选用的波长应具有合适的峰形和吸收,E1%在100以上,应尽量减少使用有机溶剂,尤其避免使用有毒作用的溶剂;E、含量测定法应能适用于含量均匀度和溶出度的共同应用,三种测定尽可能用相同的溶剂;F、复方制剂的含量测定,若不能直接采用吸收系数法,而又无其它适宜方法时,也可用合适的计算分光光度法,对于含三个或三个以上组分的制品不宜选用此法;G、对于所含杂质或赋形剂干扰含量测定,需先经繁杂的分离才能测定,或各成分间互相干扰的制剂或复方制剂,可选用高效液相色谱法。
第二节片剂分析片剂系指药物与适宜的辅料通过制剂技术制成片状或异性片状的制剂,主要供口服应用。
一、片剂组成片剂除主要成分之外,还有一些辅料(赋形剂)。
一般是淀粉、糖粉、碳酸钙、硫酸钙以及少量的硬脂酸镁、滑石粉等。
由于辅料存在,常干扰主药的含量测定,但主要含量大时,可以采用直接测定法,因它不受辅料影响,或影响可以忽略不计。
例如:药典中,中和法测定阿司匹林、谷氨酸,碘量法测定安乃近片,亚硝酸钠测定磺胺类药物的片剂,都不需要分离辅料,而直接进行滴定。
二、片剂的分析步骤1、外观观察:包括外观色泽、臭、味等物理性状;2、鉴别:鉴别药品的真伪;3、检查:检查片剂在生产过程和贮藏过程中的杂质检查、常规片剂剂型检查(如硬度等)、微生物检查(如细菌、霉菌数及活螨检查)。
1、含量测定:判断是否符合药品质量标准三、鉴别片剂的鉴别是已知物的确证试验。
一般选用专属性强、附加成分无干扰或易于消除干扰的化学鉴别试验。
利用化学反应的外部特征(溶液颜色的改变,沉淀的生成或溶解,产生气体或荧光等)做鉴别试验。
片剂鉴别一般不采用红外吸收图谱法,是因为片剂中提纯主药比较复杂。
但也有例外,棕榈酸氯霉素、螺内酯片等。
1、附加成分无干扰,直接鉴别;2、将片剂中的不溶性辅料虑过或离心沉淀,取滤液或上清夜进行鉴别;3、用有机溶剂提取主药后进行鉴别;四、检查(一)、片剂的常规检查片剂的常规检查包括重量差异试验、崩解时限试验、片剂的厚度与直径均匀度试验、硬度试验、含量均匀度试验和溶出度检查1、重量差异检查法:重量差异定义:系指以称重法测定每片的片重与平均片重之间的差异程度。
片剂重量差异的限度,应符合下列有关规定:平均重量重量差异限度0.30g以下±7.5%0.30g或0.30g以上±5.0%检查方法:取药片20片,精密称定总重量,求平均片重,再分别称定各片的重量,每片重量与平均片重相比较(凡无含量测定的片剂,每片重量与标示片重比较),超出重量差异限度的药片不得多于2片,并不得有1片超出限度的1倍。
操作注意事项:(1)、操作时,应戴手套或指套,勿用手直接接触供试品,应用平头镊子拿取片剂;(2)、易吸潮的供试品须放置在密闭的称量瓶,尽快称量;(3)、凡规定检查含量均匀度的片剂,可不进行重量差异的检查。
2、崩解时限检查法崩解定义:系指固体制剂在检查时限内全部崩解溶散或成碎粒,除不溶性包衣材料或破碎的胶囊壳外,应通过筛网。
测定时应使固体制剂在液体介质中,随着崩解仪器吊篮上下移动,发生崩解,以供试品通过筛网的时间来控制。
检查装置:崩解仪检查法:温度:37±1℃调节水位高度使吊篮上升时筛网在水面下25mm,下降时筛网距烧杯底部25mm,速度:30~32次/分钟除另外规定,一般取药品6片,按规定检查,应在15分钟内全部崩解,如有1片崩解不完全,应另取6片复试。
3、片剂的溶出度和含量均匀度检查(二)、杂质检查根据附加成分有无干扰,可分为1、直接检查2、消除干扰后检查:溶解过滤取滤液,离心沉淀取上清夜,用有机溶剂提取等。
五、含量测定(一)、取样方法一般取片剂20片,精密称定重量,除以骗数,计算平均片重(可用于片重差异限度检查),再将20片研细,精密称定适量,按规定方法测定含量(二)、含量测定方法1、直接测定赋形剂在片剂中的存在,对主药无影响,或主药含量较大,影响因素很小,可以忽略不计,则可采用直接测定方法。
如:碘量法测定安乃近2、赋形剂的干扰及排除赋形剂的存在对主药测定有干扰时,应根据它们的性质和特点设法排除。
(1)、糖类的干扰及排除赋形剂中如含有淀粉、糊精、蔗糖、乳糖,它们经水解后均能产生葡萄糖,葡萄糖为醛糖,可以被氧化剂氧化成葡萄糖酸。
CHOC C C C 2OH H OHHO HH OHH OHCOOH C C C C CH 2OH H OH HO H H OH H OH葡萄糖 葡萄糖酸为了排除强氧化剂(如高锰酸钾)在测定主药含量时的干扰,一般采用氧化性较低的氧化剂(如硫酸铈)作滴定剂。
如硫酸亚铁片、富马酸亚铁片含量测定。
(2)、硬脂酸镁的干扰及排除硬脂酸镁的镁离子对络合滴定有干扰,在非水滴定中,一般影响较小,但当主药含量较少时,而硬脂酸的量较多时,就会消耗高氯酸滴定液,使测定结果偏高。
消除方法:A 、经有机溶剂提取后排除干扰。
B 、添加掩蔽剂排除干扰,一般常用掩蔽剂:草酸、硼酸和酒石酸,其中尤以酒石酸最佳。
(3)、滑石粉、淀粉的干扰及排除赋形剂中如含有滑石粉、淀粉,因在水中不易溶解,而使溶液混浊,所以对比色法、比浊法、比旋度法都有影响,采用溶解滤除法或提取容量法除去干扰。
(4)、硫酸钙、碳酸钙的干扰及排除由于钙离子的存在,在络合滴定测定含量时会有干扰,采用方法一般加入掩蔽剂或分离除去,或改用其他方法。
六、含量测定结果计算一般多以“按标示量计算的百分含量”按标示量计算的百分含量=每片含量/标示量×100%按 按按按按按按按按按按=A/E×1%×按 按按按按100ml/10ml按×按按 按 按按100ml按×按按按按按按按按×按按按×100%按 按按按按按按按按按按=按按按按×按按按×100%TFV×按按按按第三节注射剂分析一、注射剂分析的基本步骤首先观察注射剂的色泽和澄明度,然后进行鉴别试验、PH值检查、注射剂常规检查、含量测定二、鉴别分为直接鉴别和消除干扰后鉴别,基本同片剂。
三、注射剂的常规检查(一)、一般检查:注射液的澄明度检查;注射液的装量限度检查;注射液的热原试验;注射液的无菌试验。
(二)、特殊检查1、注射液中不溶性微粒的检查:用以检查静脉注射液中(装量100ml以上)中的不溶性微粒。
除另有规定外,每1ml中含10um以上的微粒不得超过20粒,含25um以上的微粒不得超过2粒。
2、少数以植物油为溶剂的注射液,还要检查植物油的碘值,酸值及皂化值。
四、含量测定(一)、直接测定法1、重量法,测定沉淀物的重量2、旋光度法,如葡萄糖注射液含量测定(二)、附加成分的干扰及排除1、酸或碱如用盐酸调节酸度,则不能用银量法2、等渗溶液一般以氯化钠调节渗透压,氯化钠存在,干扰测定3、助溶剂注射液中常添加助溶剂,帮助主药溶解。
4、水份水份影响非水滴定5、抗氧剂常用抗氧剂:亚硫酸钠、亚硫酸氢钠、焦亚硫酸钠和硫代硫酸钠加入丙酮或甲醛消除五、注射液含量测定计算计算公式基本同片剂第四节复方制剂的含量分析复方制剂的分析比原料药和单方制剂复杂,不仅要考虑辅料对主药的干扰,还要考虑主药之间的干扰。
复方制剂的含量测定,一般采用以下几种方法:1、不经分离分别测定各成分:如主药之一有旋光性,可用旋光度测定,主药之一有紫外吸收,可用紫外方法测定,又如葡萄糖氯化钠注射液。
2、经分离后分别测定含量3、只测定主药成分特别是中药复方制剂中,测定其中一味或几味主药成分4、不测定含量一般较少。
