第九章 常见金属元素及其化合物
金属元素及其化合物PPT教学课件

(2) 4FeS2+11O2 高温 2Fe2O3+8SO2
2Fe3++Fe=3Fe2+ (3) 生成的沉淀由白色变成灰绿色最终变 成红褐色。
【在线探究】
1. Fe3O4可以写出Fe2O3·FeO,若把Fe3O4 看成是一种盐,又可写成Fe(FeO2)2。根据 化合价规律和化学式书写方法,把Pb3O4用上 述氧化物形成表示,其化学式为________;若 看成是一种盐,化学式为____________。又知, 高价Fe不能把HCl氧化,而高价Pb能把HCl氧 化成Cl2。试分别写出Fe3O4、Pb3O4与盐酸反 应的化学方程式。
2. 抓住重点,编织网络 (1) 碱金属元素及其化合物知识网络图如下:
(2) 镁及其重要化合物的知识网络图如下:
(3) 铝及其化合物的知识网络如下:
(4) Fe(II)和Fe(III)的转化
【实弹演练】
[课堂反馈]
1.1998年中国十大科技成果之一是合成
一维纳米氮化镓。已知镓是第ⅢA族元素,
2. 某溶液中有NH4+、Mg2+、Fe2+、Al3+离 子,向其中加入过量的NaOH溶液,微热并搅拌, 再加入过量的盐酸,溶液中大量减少的阳离子 是______N__H_4_+_和__F_e,2+ 写出有关反应的离子方程 式:
溶液中加入过量的NaOH溶液时:
NH4++OH-====NH3↑+H2O Mg2++2OH-=Mg(OH)2 Fe2++2OH-=Fe(OH)2 4Fe(OH)2+2H2O+O2=4Fe(OH)3 Al3++4OH-=AlO2-+2H2O 再加入过量盐酸时:
常见金属元素及其化合物

常见金属元素及其化合物金属元素是指具有金属性质的化学元素,通常具有良好的电导性、热导性、延展性和可塑性。
金属元素被广泛应用于各个领域,例如建筑、电子、冶金、汽车等。
下面将为您介绍一些常见金属元素及其化合物。
铁(Fe)是一种常见的金属元素,其化合物主要有氧化铁、硫化铁、碳酸铁等。
氧化铁是一种红棕色的固体物质,在建筑和石材制作中常用作颜料。
硫化铁是一种黑色的矿石,常用于制备铁和钢。
碳酸铁是一种白色的结晶物质,常见于自然界中的石灰岩和大理石。
铜(Cu)是另一种常见的金属元素,其化合物主要有氧化铜、硫化铜、碳酸铜等。
氧化铜是一种黑色的固体物质,在电子和电器制造中常用作导电材料。
硫化铜是一种蓝色的矿石,常用于制备铜和铜合金。
碳酸铜是一种绿色的结晶物质,常见于自然界中的矿石和矿山。
铝(Al)是一种轻便耐腐蚀的金属元素,其化合物主要有氧化铝、氯化铝、硫酸铝等。
氧化铝是一种白色的固体物质,在建筑和电子制造中常用作绝缘材料和搅拌器。
氯化铝是一种无色的液体,常用于制备有机化合物。
硫酸铝是一种无色的液体,常用于制备矾石和其他铝盐。
锌(Zn)是一种重要的金属元素,其化合物主要有氧化锌、硫化锌、氯化锌等。
氧化锌是一种白色的固体物质,常见于生活用品和化妆品中。
硫化锌是一种白色的矿石,常用于制备锌和锌合金。
氯化锌是一种无色的固体,常用作催化剂和腐蚀抑制剂。
钠(Na)是一种常见的金属元素,其化合物主要有氯化钠、碳酸钠、亚硝酸钠等。
氯化钠是一种无色的晶体,是普通食盐的主要成分。
碳酸钠是一种白色的晶体,常用于制备碱性溶液和中和酸性物质。
亚硝酸钠是一种无色的晶体,常用于食品加工和防腐剂。
钢是一种由铁和碳组成的合金,常用于建筑和制造业。
除了碳,钢中还可以含有其他金属元素,如锰、铬、钼等。
这些金属元素能够提高钢的强度、硬度和耐腐蚀性。
总结起来,常见的金属元素及其化合物有铁(氧化铁、硫化铁、碳酸铁)、铜(氧化铜、硫化铜、碳酸铜)、铝(氧化铝、氯化铝、硫酸铝)、锌(氧化锌、硫化锌、氯化锌)、钠(氯化钠、碳酸钠、亚硝酸钠)等。
常见金属元素单质及其重要化合物PPT

• (3)Na2S溶液中离子浓度由大到小的顺序 为________,向该溶液中加入少量固体 CuSO4,溶液pH______(填“增大”“减 小”或“不变”),Na2S溶液长期放置有 硫析出,原因为 _________________________________ ________ __ __ ___________________________(用离子 方程式表示)。
(3)Na2S在溶液中完全电离,其电离方程式为: Na2S===2Na++S2-,该溶液存在的水解和电离平衡 有:S2-+H2O===HS-+OH-,HS-+H2O H2 O H2S+OH-,
H++OH-,由于S2-的水解是微弱的且OH-的来源
有三部分,因此,c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。 加入CuSO4后,由于发生反应:CuSO4+ Na2S===CuS↓+Na2SO4使得溶液中S2-的浓度减小,尽管 其水解程度增大了,但溶液中的c(OH-)减小,故pH减小。
•第1讲 常见金属元素单质 •及其重要化合物
• 考纲解读 • 1.了解常见金属的活动顺序。 • 2.了解常见金属(钠、镁、铝、铁、铜等) 及其重要化合物的主要性质及其应用。 • 3.了解合金的概念及其重要应用。 • 4.了解金属的通性,金属的冶炼原理。
• 考情探究 • 近五年来,在新课标地区的高考试题中,对金 属性质及应用的考查共出现21次,其中,2011 年出现5次,例如:2011全国理综27题,2011 年山东理综29题。对金属及其化合物的实验题 的考查共出现9次,其中,2011年出现3次,例 如:2011年福建理综24题。金属性质及应用的 考查题型以选择题的形式出现14次,分值一般 为4~6分。综合推断题的形式出现7次,分值一 般为8~15分。 • 高考试题对本专题内容能力点的考查以知识的 识记、物质性质的探究及应用为主,试题一般 以容易或中档题为主。
完整版)高中化学知识点总结:金属元素及其化合物

完整版)高中化学知识点总结:金属元素及其化合物高中化学知识点总结:金属元素及其化合物一、金属元素概述1.金属元素在周期表中的位置及原子结构特征金属元素分布在周期表的左下方,目前已知的112种元素中有90种金属元素。
金属元素最外层电子数一般小于4个,仅有Ge、Sn、Pb有4个,Sb、Bi有5个,Po有6个。
金属原子半径较同周期非金属原子半径大。
金属元素形成的金属单质固态时全是金属晶体。
2.金属的分类1)按冶金工业上的颜色分:黑色金属有Fe、Cr、Mn (其主要氧化物呈黑色),有色金属则是除Cr、Mn以外的所有金属。
2)按密度分:轻金属密度小于4.5g/cm³,如Na、Mg、Al;重金属密度大于4.5g/cm³,如Fe、Cu、W。
3)按存在丰度分:常见金属如Fe(4.75%)、Al(7.73%)、Ca(3.45%)等;稀有金属如锆、铪、铌等。
3.金属的物理性质1)状态:除汞外,其他金属通常为固态。
2)金属光泽:多数金属具有金属光泽。
3)易导电和导热:由于金属晶体中自由电子的运动,使金属易导电、导热。
4)延展性:金属可以压成薄片,也可以抽成细丝。
5)熔点及硬度:金属晶体中金属离子和自由电子的作用强弱决定其熔点和硬度,最高的是钨(3413℃),最低的是汞(-39℃)。
4.金属的化学性质1)与非金属单质作用。
2)与H2O作用。
3)与酸作用。
4)与碱作用,只有Al、Zn可以。
5)与盐的作用。
6)与某些氧化物的作用。
5.金属的冶炼1)热分解法(适用于不活泼金属):2HgO=2Hg+O²,2Ag2O=4Ag+O²。
2)热还原法(常用还原剂CO、H2、C活泼金属等):Fe2O3+3CO=2Fe+3CO2,Cr2O3+2Al=2Cr+Al2O3.3)电解法(适用于非常活泼的金属):2Al2O3=4Al+3O2,2NaCl=2Na+Cl2.二、碱金属元素1.钠及其化合物1)钠的物理性质:钠是一种柔软、银白色,有金属光泽的金属,具有良好的导电、导热性,密度比水小,比煤油大,熔点较低。
金属元素及其化合物精品PPT课件

NH4+ + H2O
NH3·H2O + H+
Mg + 2H+ NH4+ + Mg
Mg2+
+ H2 ↑
NH3 ↑ + Mg2+ + H2 ↑
4.金属的重要化合物 ①氧化物 举例常见的碱性氧化物、两性氧化物、酸性氧化物、过氧化物。 过氧化物是金属阳离子与过氧根离子结合成的化合物。 ②氢氧化物 金属对应的氢氧化物通常是碱,极少数为两性。 极活泼金属的氢氧化物能溶于水,性质稳定,很难分解,如氢氧化钠、
氢气。 ⑶Al、Fe遇浓硝酸、浓硫酸,在常温下发生钝化。 ⑷Cu→Ag和氧化性酸发生氧化还原反应,但不生成氢气。 ⑸Pt→Au只能和强氧化性混酸(王水)发生氧化还原反应。
第二节 钠及其化合物
1.钠单质 ①物理性质 银白色金属光泽;质软;熔沸点低;密度为0.97g/cm3,比煤油大,比
水小;导电导热性能良好。
在金属活动性顺序中位于氢前的金属与非氧化性酸(如盐酸、稀硫酸) 作用,发生置换反应,生成盐和氢气;与氧化性酸(如硝酸、浓硫酸)
反应不放出氢气。大多数金属在加热条件下能与浓硫酸发生反应,如:
Δ
Cu + 2H2SO4(浓)
CuSO4 + SO2 ↑ + 2H2O
除个别金属如Au、Pt外的几乎所有金属在常温下都能与硝酸反应,例如:
NaOH溶液浓度增大,并放出氢气;溶液中NaOH的质量分数不变,有氢 气放出;溶液的总质量减少,有氢气放出;钠浮于液面,到处游动, 发出嘶嘶的响声。
⑶与酸反应 钠与酸反应,实质上是与酸电离出的H+反应,所以比与水反应更剧烈。
点最高的是钨(3413℃),最低的是汞(-39℃ ) ②化学通性 ⑴与非金属单质反应 a.大多数金属都能与大多数非金属在常温或加热的条件下直接化合形
常见金属元素及其化合物专题

专题复习常见金属元素及其化合物[高考关键词]单质——氧化物(碱性氧化物)——氢氧化物(碱)——盐(阳离子)。
1•钠:活泼、还原性(保存);过氧化钠:结构特点、与水及C02反应特点;烧碱。
2•铝:还原性、与强碱反应、合金;氧化铝、氢氧化铝:两性; AI3+ :水解、净水、离子共存、铝三角转化。
3•铁: 腐蚀、变价;Fe2+ :还原性、离子共存、保存、检验;Fe3+ :氧化性、水解、离子共存、检验;Fe2+、Fe3+的相互转化。
4•铜:不活泼、冶炼;氧化物、Cu2+:颜色。
丁核心考点回扣---------------------------------------------------------------- 1.熟记几种物质的颜色Na2O2 是__________ ; Fe2°3 是 ______ ;AI(OH) 3、Fe(OH) 2 均是____________________ ;Fe(OH)3是__________; CuSO4是__________ ;FeCl3 ________ 。
答案淡黄色红棕色白色红褐色白色棕黄色2.熟悉4类特殊反应(1)Fe在CI2中燃烧,无论CI2是否过量,产物均为___________ 。
(2)Na在氧气中燃烧,无论 O2是否过量,产物均为___________ 。
(3)与水接触产生气体单质的物质有 _________ 。
(4)与水接触产生气体化合物的物质有 _________ 。
答案 (1)FeCI3⑵Na2O2⑶Na、K、Na2O2等⑷Al 2S3、Mg 3N 2、CaC23.典型元素及其化合物的特征性质(1)Na、AI、Fe、Cu四种元素的单质中:①能与水剧烈反应的是_____________ ,反应的离子方程式:___________________________ ;②能与 NaOH溶液反应的是_________ ,反应的离子方程式:____________________________ , 其中作氧化剂的是_______________________________________________________________ ;③Cu在潮湿的空气中被腐蚀的化学方程式:______________________④与氧气反应条件不同,反应产物不同的是(2)上述四种金属的氧化物中:①_______________________ 能用作供氧剂的是,写出一个化学方程式:②___________________________________________________________ 既能溶于酸溶液又能溶于强碱溶液的是______________________________________________________ ,离子方程式分别为_________________________________________________________③_________________________________________________________ 常温下为黑色固体的是_________________________________________________________________ 。
常见金属元素及其化合物—配位化合物稳定性及变化

[Fe(CO)5] CO
常见的配体
阴离子:X-、OH-、CN中性分子:NH3、H2O、CO、RNH2(胺)
配位原子——配体中提供孤电子对与形成 体形成配位键的原子。
常见的配位原子:N、O、S、C、卤素原子
如
[Cu(NH3)4]2+
配体
NH3
配位原子
N
[Fe(CO)5] CO C
配体:根据一个配体中所含配位原子个数 分为单齿配体和多齿配体。
配合物
2.配位化合物的组成
[ Cu (NH3)4 ] SO4
中心原子 配体 内界
外界
配合物
注意 ●内层:是配合物的特征部分,在书写化学式时,需用方括
号括起来;
●内、外层之间以离子键结合,在水溶液中完全解离。
●配位分子没有外层。
[Cu(NH3)4]SO4
┌──┴──┐
内界
外界
[Cu(NH3)4]2+ SO42- ┌──┴──┐ 中心离子 配体
氯化二氯·四氨和钴(Ⅲ)。 四氯合金(Ⅲ)酸
五羰基合铁(0) 四氯·二氨合铂(Ⅳ)
类型
化学式
配位酸
H[BF4]
H3[AlF6]
配位碱 [Zn(NH3)4](OH)2
[Cr(OH)(H2O)5](OH)2
配
K[Al(OH)4]
位
盐
[Co(NH3)5(H2O)]Cl3
[Pt(NH3)6][PtCl4]
CH2 CH2
CO CH2 CH2
O
CO
同一中心原子形成的螯合个体的稳定性, 一般比组成和结构相近的非螯合配位个体的稳 定性高,这种现象称为螯合效应。
螯合个体的稳定性与中心原子和配体所形 成的螯环的大小和数目有关。含五元环和六元 环的螯合个体是稳定的,而小于五元环或大于 六元环的螯合个体是不稳定的。
常见金属元素及其化合物

常见金属元素及其化合物金属元素是指具有金属性质的化学元素,常见金属元素包括铁、铜、铝、锌、镁、钙、锡等。
这些金属元素具有良好的导电性、导热性、延展性、韧性等特点,被广泛应用于工业、建筑、电子、汽车等领域。
以下将对常见金属元素及其化合物进行介绍。
铁是最常见的金属元素之一,它在地壳中含量很丰富。
铁具有良好的韧性和可塑性,广泛应用于钢铁制造、建筑、机械加工、电子设备等领域。
铁的化合物有很多,常见的有氧化铁(Fe2O3)和硫化铁(FeS2)等。
氧化铁是一种重要的无机颜料,用于制造红、橙、黄等颜色的油漆、颜料和陶瓷;硫化铁常用于制造火柴的火头。
铜是另一种常见的金属元素,具有良好的导电性和导热性。
铜广泛应用于电子设备、电线、管道等领域。
铜的化合物有氧化铜(CuO)、硫化铜(CuS)等。
氧化铜常用作无机颜料、催化剂和电池材料;硫化铜可用于制备农药和矿石浮选剂。
铝是一种轻质金属元素,密度低、延展性好。
铝广泛用于飞机、汽车、建筑等领域。
铝的主要化合物有氧化铝(Al2O3)和硫化铝(Al2S3)等。
氧化铝是一种重要的工业原料,广泛用于制造陶瓷、搪瓷、耐火材料等;硫化铝用于制备染料和催化剂。
锌是一种重要的工业金属,具有抗腐蚀性好、导电性能优良等特点。
锌广泛应用于电镀、电池制造、建筑材料等领域。
锌的主要化合物有氧化锌(ZnO)和硫化锌(ZnS)等。
氧化锌常用于生产橡胶、涂料、油漆、化妆品等;硫化锌是一种重要的矿石,在锌冶炼过程中起着重要的作用。
镁是一种轻质金属元素,密度低、质轻。
镁广泛应用于轻金属合金、烟火制造、航空航天等领域。
镁的主要化合物有氧化镁(MgO)和硫化镁(MgS)等。
氧化镁是一种重要的耐火材料,广泛用于高温炉窑、电解槽等;硫化镁可用于制备染料和防腐剂。
钙是一种重要的金属元素,广泛存在于生物体内。
钙广泛应用于建筑材料、电子材料、钢铁冶炼等领域。
钙的主要化合物有氧化钙(CaO)和氯化钙(CaCl2)等。
氧化钙是一种重要的建筑材料,用于制备水泥、石灰等;氯化钙常用于融雪剂、防止水泥凝固等。
2014届高考化学二轮专题复习专题9:常见金属元素及其重要化合物

自建
自查· 自悟· 自建
考点· 方法· 技能
实验· 思想· 建模
必考点一 金属及其化合物的主要性质和转化关系
[突破 核心考点] 1 . 既 能 与 酸 反 应 又 能 与 碱 反 应 的 物 质 有 : Al 、 Al2O3 、 Al(OH)3、弱酸的铵盐、弱酸的酸式盐等。 2.既能与强酸溶液反应放出气体,又能与强碱溶液反应放出气
AgNO3 溶液等。
自查· 自悟· 自建
考点· 方法· 技能
实验· 思想· 建模
【真题1】
(2013·山东理综,9)足量下列物质与相同质量的铝反应,放 出氢气且消耗溶质物质的量最少的是 A.氢氧化钠溶液 C.盐酸
+
(
)。
4.在空气中,FeCl2与NaOH溶液反应的现象是什么?
提示 色。 5.如何检验出某含Fe3+的溶液中含有Fe2+? 提示 向溶液中滴加少量酸性 KMnO4 溶液,溶液褪色,说 生成的白色絮状沉淀迅速变为灰绿色,最后变为红褐
明含有Fe2+。
自查· 自悟· 自建 考点· 方法· 技能 实验· 思想· 建模
其他 反应
与CO2反应 生成Na2CO3
自查· 自悟· 自建
考点· 方法· 技能
实验· 思想· 建模
3.金属氢氧化物的性质比较
化学式
颜色 状态
NaOH
白
Mg(OH)2
Al(OH)3
白 色胶 状沉淀
Fe(OH)3
红褐 色 沉淀
Fe(OH)2 Cu(OH)2
白 色沉 蓝 色沉 淀 淀
色固体 白 色固体
自查· 自悟· 自建
点燃条件下生成 氯化铜 (CuCl2)
实验· 思想· 建模
考点· 方法· 技能
常见金属元素及其重要化合物
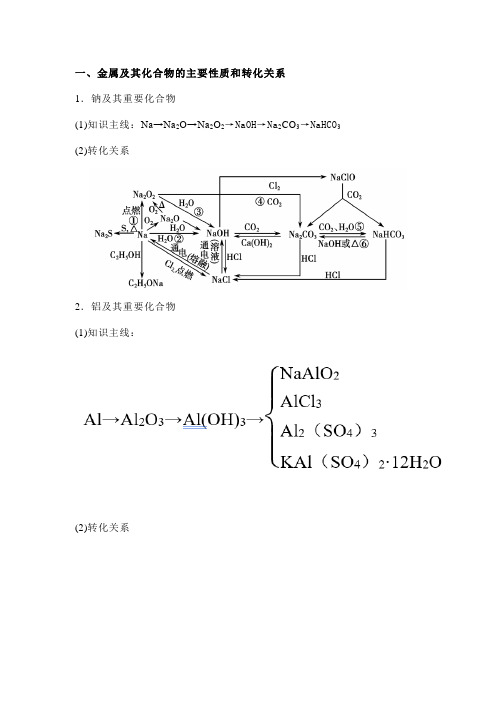
一、金属及其化合物的主要性质和转化关系1.钠及其重要化合物(1)知识主线:Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3(2)转化关系2.铝及其重要化合物(1)知识主线:(2)转化关系3.铁及其重要化合物(1)知识主线(2)转化关系4.铜及其重要化合物(1)知识主线:(2)转化关系:二、常见阳离子的检验与判断常见阳离子的检验1.用NaOH溶液检验Cu2+产生蓝色沉淀Fe3+产生红褐色沉淀Fe2+产生白色沉淀,迅速变成灰绿色,最后变成红褐色Al3+产生白色沉淀,继续加入NaOH溶液,白色沉淀溶解NH4+共热生成能使湿润的红色石蕊试纸变蓝的气体2.特殊检验法Fe3+加入KSCN溶液呈红色,加苯酚溶液呈紫色Fe2+加入KSCN溶液无现象,滴加新制氯水或双氧,水后溶液呈红色3.焰色反应用焰色反应可检验出溶液中的K+和Na+K+火焰呈紫色(透过蓝色钴玻璃观察)Na+火焰呈黄色三、金属元素单质及其化合物1.无机化工流程题常见设问方向(1)反应速率与平衡理论的运用;(2)氧化还原反应的判断、化学方程式或离子方程式的书写;(3)利用控制pH分离除杂;(4)化学反应的能量变化;(5)实验基本操作:除杂、分离、检验、洗涤、干燥等;(6)流程中的物质转化和循环,资源的回收和利用;(7)环境保护与绿色化学评价。
2.无机化工流程题的审题技能化工生产流程题中经常会出现一些表述性词语,这些表述性词语就是隐性信息,它可以暗示我们审题所应考虑的角度。
常见的有:(1)“控制较低温度”——常考虑物质的挥发,物质的不稳定性和物质的转化等。
(2)“加过量试剂”——常考虑反应完全或增大转化率、产率等。
(3)“能否加其他物质”——常考虑会不会引入杂质或是否影响产品的纯度。
(4)“在空气中或在其他气体中”——主要考虑O2、H2O、CO2或其他气体是否参与反应或达到防氧化、防水解、防潮解等目的。
(5)“判断沉淀是否洗净”——常取少量最后一次洗涤液于试管中,向其中滴加某试剂,以检验其中的某种离子。
重要元素及其化合物

上一页 下一页
第一节 非金属元素
置换出Br2再纯化。化学反应式为:
I2可从藻类植物中提取。因为I-还原性强,所以许多氧化剂可将其氧 化。例如
④卤素的用途。 氟与其他元素化合时,可放出大量的热量,因此液态氟是航天工
业中所用的高能燃料的氧化剂。含ZrF4、BaF2、NaF的氟化物玻璃 可用作光导纤维材料。氟对于维持正常的生长是必需的。
上一页 下一页
第一节 非金属元素
(3)无分子结构物质。一些非金属物质例如金刚石、晶体硅、晶体硼 等,其原子间通过共价键连成整体,而形成原子晶体,且熔、沸点都 很高。还有一些非金属物质例如石墨是混合型晶体,其也由原子间通 过不同键型形成,且熔、沸点都很高。
3.非金属元素的化学性质 在非金属元素中,F、Cl, Br, I, O,S、P较活泼,且易与金属元 素化合; N, B,C、Si在常温下不活泼。非金属元素之间也可形成共价化合物。 绝大多数非金属氧化物是酸性氧化物,能与碱反应。准金属氧化物是 两性氧化物,既能与强酸反应,又能与强碱反应。
所有卤素单质均有毒,并具有刺激性气味,强烈地刺激眼、鼻、
气管等豁膜。吸入较多的蒸气会严重中毒,甚至死亡。它们的毒性从
F2到I2依次减轻。
上一页 下一页
第一节 非金属元素
吸入Cl2时,会发生窒息,必须立即到空气新鲜处,可吸入适量酒精和 乙醚混合蒸气或氨气解毒。Br2蒸气有催泪作用。液嗅会深度灼伤皮肤, 并造成难以治愈的创伤。Br2若不慎溅到皮肤上,应立即用大量水冲洗, 再用25%的氨水、松节油、95%酒精的混合液(体积比为1:1:10) 涂抹。我国规定在企业排放的废气中,Cl2含量不得超过1 mg/m3。
第九章常见金属元素及其化合物

第九章常见金属元素及其化合物第九章常见金属元素及其化合物[引题]:金属在自然界的分布很广,无论在矿物、动植物中,还是在自然界的水域中,都有金属元素。
由于各种金属的化学性质不同,它们存在的形式各异,少数化学性质不活泼的金属(金、银、铂等),在自然界中能以单质的形式存在,化学性质活泼的金属则以化合物形式存在。
金属与医学密切相关,如Ca、K、Na、Mg、Fe等多种金属元素都是人体的必需元素,也称为生命金属。
它们对人体的生长和发育起着重要作用。
金属元素不仅与生命过程密切相关,而且也是极为重要的应用材料。
在口腔医学上,金属材料的应用历史悠久,远在古代就已用金属修复缺牙。
目前金属材料仍然是口腔矫形修复的基本材料,在口腔医学中,金属占有十分重要的地位。
第一节金属概论[引题]:在已知的112种元素中,金属元素就有90余种,约占全部元素的五分之四。
它们分别属于s区、d区、f区,还有部分金属元素属于p区。
在元素周期表里,金属元素位于每个周期的前部,除周期表中右上角及氢等22种非金属元素外,其余均为金属元素。
[讲解]:一、金属的分类及概况金属一般是指由金属元素组成的单质。
金属元素在自然界中分布很广。
其存在形式主要取决于它们的化学活泼性。
活泼金属通常以稳定化合物的形式存在,常见的化合物有氧化物、碳酸盐、硅酸盐、硫酸盐、氯化物和硫化物等。
少数化学性质不活泼的金属以单质的形式存在。
金属通常可分为两大类:黑色金属和有色金属。
(一)黑色金属黑色金属是指铁(Fe)、锰(Mn)、铬(Cr)以及它们的合金。
(二)有色金属有色金属是指除黑色金属以外的所有金属。
有色金属一般按其密度、价格、在地壳中的储量和分布情况、被人们发现以及使用的早晚等分为五大类。
1. 轻金属通常把密度小于4.5g.cm-3的金属称为轻金属。
如Na、Mg、Ca等。
一般轻金属的化学性质较活泼。
2. 重金属通常把密度大于4.5g.cm-3的金属称为重金属。
如Cu、Zn、Sb、Bi、Pb等。
常见金属元素及其化合物—电极电势的产生及应用

(2)那些氧化态能发生岐化?
解:(1)
4 (ClO3 / HClO )
21.21 21.64
(ClO3 / HClO )
1.43V
5 (ClO3 / Cl2 )
2 1.21
21.64 11.63
(ClO3 / Cl2 )
1.47V
浓
电池电动势:E
(2)标准电极电势 :标准条件下的电极电势。
电极电势的绝对值还无法测定,故选一电极 作为相对比较标准,而得到电极电势的相对值。 目前采用的参比标准为标准氢电极。
① 标准氢电极
构成:在铂片上镀一层疏松的铂黑,浸 入 H+ 浓 度 为 1mol·L-1 的 H2SO4 中 , 在 指 定 温 度 下 , 不 断 通 入 压 力 为 100 kPa的纯氢气。
实验测得电池的电动势为0.763V, 即
0.763 V = 0 V- θ(Zn2+/Zn) θ(Zn2+/Zn) = -0.763 V
用类似的方法可测出其它电对的电极电势, 详细的见书后附录。
298 K时酸性水溶液中一些常用的标准电极电势
半反应
θ(Ox/Red)
半反应
θ(Ox/Red)
几点说明:
2Cr3+ + 7H2O,
c(Cr2O72-) = c(Cr3+) = 1 mol·L-1,
pH=6,c(H+) = 1×10-6 mol·L-1, n = 6
所以
(Cr2O72- / Cr3 )
θ
(Cr2O72-
/
Cr 3
)
0.0592V 6
lg
主族金属元素铝-锡-铅-砷-锑-铋

114 116 118
镧系 锕系
57 La 58 Ce 59 Pr 60 Nd 61 Pm 62 Sm 63 Eu 64 Gd 65 Tb 66 Dy 67 Ho 68 Er 69Tm 70 Yb 71 Lu
镧铈 镨 钕 钷 钐 铕 钆 铽镝 钬 铒铥 镱镥
酸,也能溶于强碱,并放出H2气。其氧 化物及氢氧化物都具有两性。
2Al + 6H+ → 2Al3+ + 3H2↑ 2Al+2OH-+6H2O → 2[Al(OH)4]- + 3H2↑
2.铝的冶炼
① 从铝钒土中提取Al2O3
无机化学 jycjgb@
Al2O3+ 2NaOH + 3H2O → 2Na[Al(OH)4](NaAlO2)
6 55 Cs 56 Ba 57-71 72 Hf 73 Ta 74 W 75Re 76 Os 77 Ir 78 Pt 79 Au 80 Hg 81 Tl 82 Pb 83 Bi 84 Po 85 At 86 Rn
铯 钡 La-Lu 铪 钽 钨 铼 锇 铱 铂 金 汞 铊 铅 铋 钋 砹 氡
7 87 Fr 88 Ra 89-103 104 Rf 105 Db 106Sg 107Bh 108 Hs 109 Mt 110 111 112
3.掌握锡(Ⅱ)的还原性和锡(Ⅳ)氧 化性;
4.掌握铋、(Ⅴ)的氧化性。
第一节 p区金属元素概述
无机化学 jycjgb@
IA
p区
1
1H
氢
IIA
2 He
IIIA IVA VA VIA VIIA 氦
9 主族金属元素(二) 铝锡铅砷锑铋

(2) 锡、铅化合物的氧化还原性 Sn(Ⅱ) 是典型的还原剂,在碱性介质中的还原性更 强,因此用于鉴定Sn 2+,Hg 2+和Bi(Ⅲ)。
Pb(Ⅳ)
是强氧化剂,在酸性溶液中使用,效果显
著。它能把Mn(Ⅱ)氧化成Mn(Ⅶ);
2 锡的化合物 (1)氯化物 氯化亚锡 (SnCl2· 2H2O) 氯化亚锡为无色晶体,熔点仅37.7℃。 在熔化的同时,被自身的结晶水所水解,生成碱 式盐和盐酸。在空气中逐渐被氧化成不溶性的氯 氧化物。
SnCl2溶于水并随即水解: SnCl2+H2O ==Sn(OH)Cl↓(白色)+HCl 在配制其溶液时,须加盐酸以抑止水解, 还需要加入少量金属锡粒,以防氧化。 SnCl2是有机合成中重要的还原剂,也是常 用的分析试剂。
四氯化锡(SnCl4) 无水四氯化锡(又名氯化高锡)为无色液体, 在潮湿空气中因水解产生锡酸,并释出HCl而呈 现白烟。无水四氯化锡有毒并有腐蚀性,工业上 用作媒染剂和有机合成的氯化催化剂。
主要用途:
制作铅玻璃、铅围裙和放射源容器等防护用
品;在化学工业中常用铅作反应器的衬里;
铅大量用于制造合金:焊锡、保险丝;
铅字:Pb,Sb,Sn合金组成,
青铜:Cu,Sn合金;
蓄电池的极板:Pb,Sb合金等。
值得注意! 铅及铅的化合物都是有毒物质,并且进入 人体后不易排出而导致积累性中毒,所以食具、
Al(OH)3在不同pH的碱性溶液中的溶解度是不同的
Al(OH)3(s)+3H+ =Al 3+ +3H2O Al(OH)3(s)+OH- =Al (OH)4-
pH=4.7~8.9
Al(OH)3的溶解度s-pH图
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节 碱金属和碱土金属
一、碱金属和碱土金属的概述 二、碱金属和碱土金属的性质与用途 三、碱金属和碱土金属的氧化物、氢氧 化物及盐类
一、碱金属和碱土金属的概述
价层电子构型:IA、IIA,ns 、ns
1 2
电 离 能 、 电 负 性 减 小
金 属 性 、 还 原 性 增 强
原 子 半 径 增 大
• • • • • •
与水作用
2M + 2H2O → 2MOH + H2(g)
2、氧化数:分别为+1和+2,一般无变价 3、化合物键型:以离子键为主,其中Li+ 、 Be2+由于半径小,其化合物有一定的共价性, 如BeCl2等。 4、特性:碱金属和碱土金属可溶于液氨,形 成深蓝色溶液。(较高导电性和与金属相同的 还原性)
金属的分类: 1、按单质密度分(5g/cm3):
重金属( Fe、Cr、Ba等)与轻金属(碱金属、Mg、Al等)
2、按冶金工业分: 黑色金属(Fe、Cr、Mn)与有色金属 3、按地壳中存在情况分: 常见金属与稀有金属(含量少、存在分散) 4、按化学活泼性: 活泼金属与不活泼金属
(一)、金属键
金属是由金属阳离子和自由电子组成,
其中自由电子并不属于某个固定的金属阳离 子,而可以在整个金属中自由移动。
(二)金属的物理性质: ①常温下,单质都是固体,汞(Hg)除外;
②大多数金属呈银白色,有金属光泽,但
黄 红 微红 金(Au)——色,铜(Cu)——色,铋(Bi)—— 色, 蓝白 铅(Pb) 色。
③不同金属熔点、硬度差别较大;
④良好的导电性,分析原因:
IA Li Na K Rb Cs
IIA Be Mg Ca Sr Ba
原子半径减小 金属性、还原性减弱
电离能、电负性增大
元素的存在 均以矿物形式存在: 钠长石: NaAlSi 3O8 钾长石: KAlSi 3O8 光卤石:
KCl MgCl 2 6H2 O
绿柱石:Be3 Al2 (SiO 3 ) 6
金属中存在着大量的可自由移动的电子。 ⑤良好的导热性,分析原因: 通过自由电子和金属阳离子的相互碰撞传 递热量。 铂 ⑥良好的延展性。 金
⑦金属单质在化学反应中只作还原剂, 在化合物中金属元素只显正价。
(二)、金属的物理性质
合金:
– 概念:
• 两种或两种以上的金属(或金属与非金属)熔合 而成的具有金属特性的物质。
三、碱金属和碱土金属的氧化物、氢氧化物及盐类 (一)、氧化物 正常氧化物(O2-) 过氧化物(O22-) 超氧化物(O2-)
多种类型:
稳定性: O2- > O2- > O22-
三、碱金属和碱土金属的氧化物、氢氧化物及盐类 (一)、氧化物 1、 正常氧化物 多数为白色固体,K2O(淡黄)、Rb
菱镁矿: MgCO3
石膏: CaSO 4 2H2 O
大理石: CaCO3 萤石 CaF2 天青石: SrSO 4
明矾石: K(AlO)3 (SO 4 ) 2 3H2 O 锂辉石:LiAl(SiO3 ) 2
重晶石: BaSO 4
二、碱金属和碱土金属的性质与用途
Gc2-704-18.8
Li
Na
氢化物(除Be、Mg外)
ⅠA ⅡA 金属活泼,可与氢形成离子性氢化物 1. 均为白色晶体, 热稳定性差 2. 还原性强 Θ(H /H -) = - 2 . 23 V) (E 2
2LiH T iO2 T i 2LiOH 4NaH TiCl4 Ti 4NaCl 2H2
差 异 性
熔点不同
硬度不同
续表
金 属 元 素
原 子 结 构
相 同 点
最外层 电子数 较少 原子半 径较大
与非金属单质
都具有 还原性 共 性
与H+(水、酸) 与其它氧化剂
核电荷数不同 不 同 点 原子半径不同
金 属 活 泼 性 不 同
差 异 氢氧化物碱性强弱 性 相互置换反应 (原电池正负极)
与水或酸反应的 难易
常温迅速 成膜Hale Waihona Puke 热加热能反应不反应
(2)与H2O反应 K Ca Na Mg Al
条件:冷水剧烈 热水缓慢 产物: 氢氧化物和氢气
Zn Fe Sn Pb ……
水蒸气高温 不反应 氧化物和氢气
(3)与酸反应 K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au 常温下与非氧化性酸反应 氧化性酸 王水 (4)置换反应 (5)特例:2Al+2NaOH+2H2O=2NaAlO2+3H2
金属活动性顺序的应用
K Ca Na Mg Al Mn Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au • 判断金属的活动性顺序。 • 判断金属与酸溶液反应的激烈程度等情况。 • 判断金属单质还原性强弱。 • 判断金属低价阳离子的氧化性强弱。 • 判断金属金属性的强弱顺序。 • 判断原电池的正负极。 • 判断和水、氧气反应条件以及产物。 • 判断相同浓度相同阴离子溶液的酸碱性强弱顺序。 • 判断电解时阳离子和金属电极的放电顺序。 • 判断金属单质的制备方法。
– 性质:
• 具备金属特性(光泽、热电良导体、延展性等)。 熔沸点一般低于组分单质; 硬度一般比组分单质大。
(三)、金属的化学性质
• 金属原子易失去价电子成为阳离子,因而表 现出较强的还原性。由于不同的金属原子结 构、原子半径的不同,表现的还原性也有强 弱不同。 (1)与O2反应
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
K Rb Cs
图片 Gc2-711-18.14
Be
Mg
Ca
Sr
Ba
1、金属性和非金属性 金属元素:外层电子少,原子半径 性质:金属键不牢固,单质熔、沸点很低, 硬度较小,其中IIA>IA。 金属性:IA>IIA 碱金属中Cs、Rb金属性质最强,失电子倾向 最大,所以可作光电管,如Cs光电管制成的 自动报警器可报告远处火警;制成的天文仪 器可以测定与地球距离 Ba: 电子工业中除去真空管中痕量氮气和氧 气
第九章 金属元素
第一节 金属的通性 第二节 碱金属和碱土金属
第三节 水的净化
第四节 人体中的化学元素
第一节 金属的通性
位置 金属区 金属光泽
金 属 元 素 晶
相 金属阳离子 同 点 自由电子
共同物 理性质
导电传热
延展性
体 核电荷数 结 不 构 同 价电子数 点
原子半径
金属阳离子与 自由电子的作 用强弱不同
