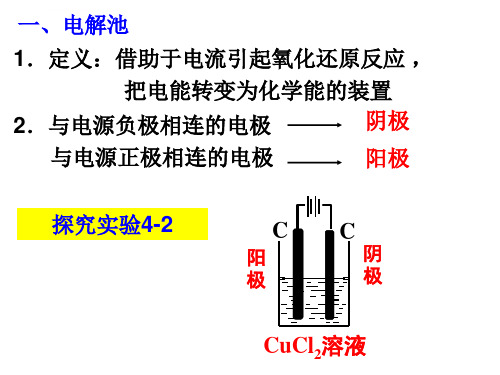
电解池PPT教学课件
合集下载
电解池课件ppt.ppt
二、电解原理的应用
1.电解饱和NaCl溶液
C
C
阳极:2Cl-+2e阴极:2H++2e-
= =
Cl2↑ H2↑
总反应式 氯碱工业
电解
饱和 NaCl溶液
2NaCl+2H2O H2↑+ Cl2↑+2NaOH
实验现象:
阳极:有刺激性气味气体生成,可使湿润的淀粉
KI试纸变蓝
阴极:有无色无味气体生成,若向阴极区滴加酚酞试
CuCl2溶液
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
操作步骤: 1.在烧杯中注入CuCl2溶液 2.连接电极,将两根石墨棒插入溶液中 3.接通直流电源,在烧杯上方放一个湿润的
淀粉KI试纸,观察阴极和阳极的实验现象 并记录。
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
阳离子向阴极移动,阴离子向阳极移动
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
注意: 1.在实验过程中,两电极要始终放在溶液中,
且两电极不能接触; 2.电压要调至6V; 3.实验结束,关闭电源,将导线从电源上取下。
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
实验现象:
CC
阳
阴 阴极: 有红色物质析出
液,溶液变红
1.电解饱和NaCl溶液
C
C
阳极:2Cl-+2e阴极:2H++2e-
= =
Cl2↑ H2↑
总反应式 氯碱工业
电解
饱和 NaCl溶液
2NaCl+2H2O H2↑+ Cl2↑+2NaOH
实验现象:
阳极:有刺激性气味气体生成,可使湿润的淀粉
KI试纸变蓝
阴极:有无色无味气体生成,若向阴极区滴加酚酞试
CuCl2溶液
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
操作步骤: 1.在烧杯中注入CuCl2溶液 2.连接电极,将两根石墨棒插入溶液中 3.接通直流电源,在烧杯上方放一个湿润的
淀粉KI试纸,观察阴极和阳极的实验现象 并记录。
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
阳离子向阴极移动,阴离子向阳极移动
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
注意: 1.在实验过程中,两电极要始终放在溶液中,
且两电极不能接触; 2.电压要调至6V; 3.实验结束,关闭电源,将导线从电源上取下。
寒假来临,不少的高中毕业生和大学 在校生 都选择 去打工 。准备 过一个 充实而 有意义 的寒假 。但是 ,目前 社会上 寒假招 工的陷 阱很多
实验现象:
CC
阳
阴 阴极: 有红色物质析出
液,溶液变红
电解池课件

先看电极:两极为导体且活泼性不同 再看溶液:两极插入电解质溶液中 后看回路:形成闭合回路或两极接触 若有外接电源,两极插入电解质溶液中, 则可能是电解池或电镀池。当阳极金属与电解质 溶液中的金属阳离子相同,则为电镀池,其余情 况为电解池。
讨论:比较电解池和原电池的异同~~~~~~
装置
原电池
实例
铜锌原电池
①活泼性不同的两电极 ①两电极接直流电源
形成 ②电解质溶液 条件 ③形成闭合回路
②电解质溶液 ③形成闭合回路
电解池与原电池有哪些异同(续)
装置 电极 名称
电极 反应
原电池
负极:较活泼金属 正极:较不活泼金属 (或能导电的非金属)
负极:氧化反应,金属 失电子 正极:还原反应,溶液 中的阳离子得电子
电解池
写电极反应 【方法小结】
▪ 1.分析溶液中存在的所有离子(包括水的电 离)、并分成阳离子组和阴离子组。
▪ 2.根据放电规律,阳离子在阴极发生还原反应, 而阴离子在阳极发生氧化反应,完成电极反 应式。(注意得失电子守恒)
▪ 3.由阴阳两电极反应式,合并得总反应式。 (弱电解质的须保持分子形式)
[例]以石墨碳棒为电极,请写出电解下列溶液时,在阴、 阳两极上发生的电极反应式及总的化学方程式。
反应方程式: Cl2 +2 NaOH =NaCl + NaClO + H2O .
(2)避免生成物H2和Cl2混合,
因为: 混合遇火或遇强光爆炸
.
解决方法:使用离子交换膜
第二个问题:精制食盐水
提示:
1、用什么方法除去泥沙? 2、用什么试剂除去Ca2+ 、Mg2+、 Fe3+ 、SO42— 3、所有试剂只有过量才能除尽,你能设计一个 合理的顺序逐一除杂吗?
讨论:比较电解池和原电池的异同~~~~~~
装置
原电池
实例
铜锌原电池
①活泼性不同的两电极 ①两电极接直流电源
形成 ②电解质溶液 条件 ③形成闭合回路
②电解质溶液 ③形成闭合回路
电解池与原电池有哪些异同(续)
装置 电极 名称
电极 反应
原电池
负极:较活泼金属 正极:较不活泼金属 (或能导电的非金属)
负极:氧化反应,金属 失电子 正极:还原反应,溶液 中的阳离子得电子
电解池
写电极反应 【方法小结】
▪ 1.分析溶液中存在的所有离子(包括水的电 离)、并分成阳离子组和阴离子组。
▪ 2.根据放电规律,阳离子在阴极发生还原反应, 而阴离子在阳极发生氧化反应,完成电极反 应式。(注意得失电子守恒)
▪ 3.由阴阳两电极反应式,合并得总反应式。 (弱电解质的须保持分子形式)
[例]以石墨碳棒为电极,请写出电解下列溶液时,在阴、 阳两极上发生的电极反应式及总的化学方程式。
反应方程式: Cl2 +2 NaOH =NaCl + NaClO + H2O .
(2)避免生成物H2和Cl2混合,
因为: 混合遇火或遇强光爆炸
.
解决方法:使用离子交换膜
第二个问题:精制食盐水
提示:
1、用什么方法除去泥沙? 2、用什么试剂除去Ca2+ 、Mg2+、 Fe3+ 、SO42— 3、所有试剂只有过量才能除尽,你能设计一个 合理的顺序逐一除杂吗?
《电解池》PPT课件

得电子能力(氧化性) 得电子能力(氧化性)强的阳离子先放电
2、阳极: 阳极:
(1)若阳极材料为金属电极(除Pt 、Au、外), )若阳极材料为金属电极( 、 则阳极电极反应为金属失电子
金属 - ne-
=
金属阳离子
(2)若阳极材料为惰性电极 、Au、石墨 ,则 )若阳极材料为惰性电极(Pt、 、石墨), 阳极电极反应为溶液中 溶液中阴 阳极电极反应为溶液中阴离子放电 阴离子放电顺序
请你思考?
在电解过程中电子的移动方向? 在电解过程中电子的移动方向? 电子的移动方向
e-
+
Cl2
阴极
e-
阳极
(氧化反应) 氧化反应)
(还原反应) 还原反应)
Cl2
电离与电解的比较 电离与电解的比较
电 离 电 解 条件 电解质溶于水或熔融电解质 电解质电离后再通直流电 电解质电离成为自由移 阴阳离子定向移动,在两 阴阳离子定向移动, 动的离子 极上得失电子成为原子或 过程 分子 CuCl2 = Cu2+ + 2Cl电解 CuCl2 == Cu+Cl2↑
( 生成了新物质
电解必须建立在电离的基础上
电解池与原电池有哪些异同 电解池与原电池有哪些异同?
装置 装置 实例
将化学能 定义 转变成电能的装置 将电能 转变成化学能的装置
原电池
电解池
①活泼性不同的两电极 形成 ②电解质溶液 条件 ③形成闭合回路 ④自发的氧化还原反应
电解池、电解精炼池、 电解池、电解精炼池、电镀池的比较
电解池 定义 电解精炼池 电镀池
应用电解原理在某些 金属表面镀上一层其 它金属的装置。 它金属的装置。
将电能转变成化学能 应用电解原理将不纯 的金属提纯的装置。 的金属提纯的装置。 的装置。 的装置。
《化学电解池》课件

电解池的环境影响与可持续发展
能耗与碳排放
电解池的能耗较高,会产生一定的碳排放。为了实现可持续发展,需要优化电解池的能 效,降低能耗和碳排放。
废弃物处理
电解池在使用过程中会产生废水和废料,需要建立有效的废弃物处理和回收机制,以减 少对环境的负面影响。
THANKS
感谢观看
REPORTING
电解池的应用
REPORTING
电解水制氢
总结词
通过电解水的方法制取氢气,是一种 绿色、可持续的能源生产方式。
详细描述
利用电解水技术,将水分子在直流电 的作用下分解为氢气和氧气。电解过 程中,阳极产生氧气,阴极产生氢气 ,可以用于生产氢气作为燃料或化工 原料。
电解冶炼金属
总结词
通过电解熔融盐的方法提取金属,是一种高效、环保的金属冶炼技术。
电解池的工作原理
总结词
电解池的工作原理是利用外部电源提供能量,使电解质溶液中的离子在阳极和阴 极上发生氧化还原反应,从而将电能转化为化学能。
详细描述
当外部电源施加电压时,电解质溶液中的离子开始定向移动。阳离子向阴极移动 ,阴离子向阳极移动。在阳极上,阴离子失去电子发生氧化反应;在阴极上,阳 离子得到电子发生还原反应。通过这些反应,电能被转化为化学能。
PART 02
电解池的类型
REPORTING
电解液类型
01
02
03
酸性电解液
通常采用硫酸或盐酸作为 电解液,具有较高的导电 性能和较低的成本。
碱性电解液
主要采用氢氧化钠或氢氧 化钾作为电解液,适用于 电解铝、锌等金属。
熔融盐电解液
采用熔融状态的盐作为电 解液,如氯化钠、氯化钾 等,适用于电解制取金属 钠、镁等。
《原电池与电解池》课件

02
电解池基本概念
电解池定义
总结词
电解池是一种通过外加电流使电解质 溶液中的阴阳离子发生定向移动,从 而在电极上发生氧化还原反应的装置 。
详细描述
电解池由电源、电极和电解质溶液组 成。当电源通电后,阳离子向阴极移 动,阴离子向阳极移动,在电极上发 生氧化还原反应,生成相应的产物。
电解池工作原理
C. 阳极材料得电子 简答题:写出电解池的电极反应式,并解释其原理。
THANKS
感谢您的观看
《原电池与电解池》 ppt课件
目录
CONTENTS
• 原电池基本概念 • 电解池基本概念 • 原电池与电解池的区别与联系 • 原电池的应用 • 电解池的应用 • 习题与思考
01
原电池基本概念
原电池定义
总结词
原电池是一种将化学能转化为电 能的装置。
详细描述
原电池由两个电极(正极和负极 )和电解质溶液组成。在原电池 中,化学反应在电极之间产生电 位差,从而产生电流。
电解池的组成
总结词
电解池的组成包括电源、电极和电解质溶液。电极分为阴阳两极,电解质溶液中包含阴 阳离子。
详细描述
电解池的核心部分是电极和电解质溶液。电极分为阳极和阴极,通常由惰性材料制成, 如石墨或金属铂。电解质溶液包含阴阳离子,这些离子在通电后发生定向移动并在电极 上发生氧化还原反应。此外,还需要一个外部电源提供直流电,以驱动电解池的正常工
电解法制备物质是一种通过电解反应合成新物质的化学 过程。在电解过程中,电流通过电解质溶液,在电极上 发生氧化还原反应,生成所需的物质。这种方法可以用 于制备金属单质、无机非金属材料、有机化合物等,广 泛应用于化学工业和实验室研究。
06
人教版高二化学选修4教学课件:第四章4.3 电解池(共50张PPT)

第2课时 电解原理的 2 应用
• 1. 氯碱工业
• (1)概念 • 用电解饱和食盐水的方法来制取Cl2、NaOH、H2,并
以它们为原料生产一系列化工产品的工业,称为氯碱工业。
• 1. 氯碱工业
• (2)原理
• ①通电前,NaCl溶液中含有的离子是___________。
• 通电时,移向阴极的离子是______,移向Na阳+极C的l− 离H+子O是H−
Fe2+>Zn2+>H+(水)>
•
Al3+、Mg2+、Na+、Ca2+、K+
• 2. 电解产物的判断 • (3)电极产物的判断
离子 S2− 产物 S
SO32− SO42−
I− Br− Cl− OH−
I2
Br2 Cl2 O2
离子 Ag+ Hg2+ Fe3+ Cu2+ H+ 产物 Ag Hg Fe2+ Cu H2
借助于电流,反应进行是 不自发的氧化还原反应。
• 2. 构成条件
直流电源 两个电极 电解质溶液(或熔融电解质) 闭合回路
阴极
阳极
• 3. 工作原理
e-
e-
二、电解原理
• 1. 电解
• 使(直流)电流通过电解质溶液(或熔融电解质)而在阴、 阳两极引起氧化还原反应的过程叫做电解。
电离与电解的比较
合金的方法。 • (2)电解槽构成 • 阴极——待镀金属 • 阳极——镀层金属 • 电镀液——含有镀层金属离子 • (3)特点 • ①阳极参与电极反应 • ②电镀液浓度保持不变
• 3. 电解精炼铜
• (1)电解槽构成 • 阳极:粗铜 (含Zn、Fe、Ni、Au、Ag等杂质) • 阴极:纯铜 • 电解液:CuSO4溶液
电解池ppt课件

遇火或强光会爆炸
解决方法:使用离子交换膜 生产设备:阳离子交换膜电解槽
离子交换膜法电解饱和食盐水
淡盐水
阳极
Cl2 +
Cl—
H2 -
H+ Na+
NaOH溶液
阴极
OH—
精制饱和 NaCl溶液
阳离子交换膜
H2O(含少量NaOH)
如何在金属器件表面 镀上一层其他金属?
按下图装置电解硫酸铜溶液,预测实验结果:
镀层金属
② 阴极:待镀金属
镀件
③ 电解液:含镀层金属离子的溶液
4、电镀的特点 一多: 阴极上镀层金属沉积 一少: 阳极上镀层金属溶解 一不变:电解质溶液的浓度不变
含镀层金属离子的溶液
粗铜
精铜
三、电解精炼铜
1、粗铜中含有的杂质: Zn、Fe、Ni、Ag、Au 等
2、粗铜精炼装置: 阳极 ─ 粗铜 阴极 ─ 精铜 电解液 ─ CuSO4溶液
Mn+ + ne- = M
2Al2O3(熔融)
电解 冰晶石
4Al + 3O2↑
工业制铝为什么不电解氯化铝而是氧化铝?冰晶石的作用是什么?
AlCl3是共价化合物,熔融时不能导电,不能电解。 Al2O3是离子化合物;熔点2054℃,冰晶石可作助熔剂,降低熔点。
正误辨析
× 1.在镀件上电镀铜时,镀件应连接电源的正极( ) × 2.根据得失电子守恒可知电解精炼铜时,阳极减少的质量和阴极增加的质量相等( ) × 3.电镀铜和电解精炼铜时,电解质溶液中c(Cu2+)均保持不变( ) × 4.电解冶炼镁、铝通常电解熔融的 MgCl2和Al2O3,也可以电解熔融的 MgO和AlCl3 ( )
1、如图为电解饱和食盐水的装置,下列有关说法不正确的是( B ) A.左侧电极上发生氧化反应 B.右侧生成的气体能使湿润的碘化钾淀粉试纸变蓝 C.电解一段时间后,B口排出NaOH溶液 D.离子方程式:
解决方法:使用离子交换膜 生产设备:阳离子交换膜电解槽
离子交换膜法电解饱和食盐水
淡盐水
阳极
Cl2 +
Cl—
H2 -
H+ Na+
NaOH溶液
阴极
OH—
精制饱和 NaCl溶液
阳离子交换膜
H2O(含少量NaOH)
如何在金属器件表面 镀上一层其他金属?
按下图装置电解硫酸铜溶液,预测实验结果:
镀层金属
② 阴极:待镀金属
镀件
③ 电解液:含镀层金属离子的溶液
4、电镀的特点 一多: 阴极上镀层金属沉积 一少: 阳极上镀层金属溶解 一不变:电解质溶液的浓度不变
含镀层金属离子的溶液
粗铜
精铜
三、电解精炼铜
1、粗铜中含有的杂质: Zn、Fe、Ni、Ag、Au 等
2、粗铜精炼装置: 阳极 ─ 粗铜 阴极 ─ 精铜 电解液 ─ CuSO4溶液
Mn+ + ne- = M
2Al2O3(熔融)
电解 冰晶石
4Al + 3O2↑
工业制铝为什么不电解氯化铝而是氧化铝?冰晶石的作用是什么?
AlCl3是共价化合物,熔融时不能导电,不能电解。 Al2O3是离子化合物;熔点2054℃,冰晶石可作助熔剂,降低熔点。
正误辨析
× 1.在镀件上电镀铜时,镀件应连接电源的正极( ) × 2.根据得失电子守恒可知电解精炼铜时,阳极减少的质量和阴极增加的质量相等( ) × 3.电镀铜和电解精炼铜时,电解质溶液中c(Cu2+)均保持不变( ) × 4.电解冶炼镁、铝通常电解熔融的 MgCl2和Al2O3,也可以电解熔融的 MgO和AlCl3 ( )
1、如图为电解饱和食盐水的装置,下列有关说法不正确的是( B ) A.左侧电极上发生氧化反应 B.右侧生成的气体能使湿润的碘化钾淀粉试纸变蓝 C.电解一段时间后,B口排出NaOH溶液 D.离子方程式:
电解池的工作原理及应用-PPT课件

电子从电解池阳极流向_______极,电极反应为__________,发生_______反应。
总反应为_______________________。
阴 阳
2Na++ 2e- == 2Na
无规则自由
负极 正极
电解池阴 还原
2Cl --2e-==Cl2↑
通电
2NaCl
电源正 氧化
2Na +Cl2↑
2
回顾:什么是电解池(电解槽)? ❖电解池(电解槽): 把电能转化为化学能的装置。 回顾:什么是电解? 电解:在直流电的作用下,在两电 极上分别发生氧化反应和还原反应 的过程。
实验:将两根石墨棒分别跟直流电源的正极和负
极连接,浸入U型管的CuCl2溶液中 ,再接通12V
直流电,观察现象。约3~5min后切断电源。
现象 阴极--- 有红色的固体 Cu
阳极--- 有气泡产生
O2?
电极反应和总反应
解释 阴极--- Cu2++2e-=Cu
Cl2?
总反应式阳:极2-C--l-+2CCul2-通+-=2电eC-l=2 C↑ +l2C↑u
7
8
大家学习辛苦了,还是要坚持
继续保持安静
9
思考:
为何当一个电极存在多种可能的 放电离子时,是大家共同放电,还是只 有一种离子放电?放电能力与什么因素 有关?
(离子在电解池的阴、阳两极发生反应的 过程叫放电。)
10
阴极: ___电子,发生____反应,离子 ______越强,反应越容易。
常见阳离子放电顺序:
3
ห้องสมุดไป่ตู้
一、电解池
1、定义:把电能转化为化学能的装置 2、电解池的构成条件 (1)外接直流电源 (2)与电源相连的两个电极
电解池ppt优秀课件人教版

D
当堂检测
3.如图所示是电解氯化铜溶液的装置,其中c、d为石墨电极,下列有关判断正确的是( ) A a为负极,b为正极 B a为阳极,b为阴极 C 电解过程中,d电极质量增加 D 电解过程中,氯离子的浓度不变
C
当堂检测
原电池与电解池比较
课堂小结
原电池
电解池
一个概念
将化学能转变为电能的装置
操作步骤:
阳极
阴极
现象
判断产物
反应方程式
氯气
铜
产生使湿润的碘化钾淀粉试纸变蓝的气体
有红色物质出现
实验现象及结论
CuCl2 == Cu + Cl2↑
通电
实验探究
C
CuCl2溶液
+
-
C
交流研讨二
1.通电前,CuCl2溶液中存在哪些离子?它们在溶液中如何运动?通电后,离子在溶液中的运动如何变化? 2.标出电路中电子流向?分析流入阴极的电子到哪里去了?流出阳极的电子从哪里来? 3.写出两极的电极反应式,判断反应类型。
(2)NaCl溶液:
阳极:
阴极:
2NaCl+2H2O H2↑+ Cl2↑
电解
2Cl- - 2e- = Cl2↑
2H+ + 2e- = H2↑
+ 2NaOH
(OH-)
2Cl-+2H2O H2↑+ Cl2↑+ 2OH-
电解
总反应式:
2.两极极板上都有气体产生,如何检验两种气体?
交流研讨四
阴极:收集纯净气体,点燃,并在上方罩一个干冷的烧杯,产生淡蓝色火焰,且烧杯壁上有水珠出现。
NaOH H2SO4 Na2SO4
当堂检测
3.如图所示是电解氯化铜溶液的装置,其中c、d为石墨电极,下列有关判断正确的是( ) A a为负极,b为正极 B a为阳极,b为阴极 C 电解过程中,d电极质量增加 D 电解过程中,氯离子的浓度不变
C
当堂检测
原电池与电解池比较
课堂小结
原电池
电解池
一个概念
将化学能转变为电能的装置
操作步骤:
阳极
阴极
现象
判断产物
反应方程式
氯气
铜
产生使湿润的碘化钾淀粉试纸变蓝的气体
有红色物质出现
实验现象及结论
CuCl2 == Cu + Cl2↑
通电
实验探究
C
CuCl2溶液
+
-
C
交流研讨二
1.通电前,CuCl2溶液中存在哪些离子?它们在溶液中如何运动?通电后,离子在溶液中的运动如何变化? 2.标出电路中电子流向?分析流入阴极的电子到哪里去了?流出阳极的电子从哪里来? 3.写出两极的电极反应式,判断反应类型。
(2)NaCl溶液:
阳极:
阴极:
2NaCl+2H2O H2↑+ Cl2↑
电解
2Cl- - 2e- = Cl2↑
2H+ + 2e- = H2↑
+ 2NaOH
(OH-)
2Cl-+2H2O H2↑+ Cl2↑+ 2OH-
电解
总反应式:
2.两极极板上都有气体产生,如何检验两种气体?
交流研讨四
阴极:收集纯净气体,点燃,并在上方罩一个干冷的烧杯,产生淡蓝色火焰,且烧杯壁上有水珠出现。
NaOH H2SO4 Na2SO4
《电解池》课件 (共36张PPT)

二、电解原理的应用 (4)电冶金
电解是最强有力的氧化还原手段 冶炼Na、Ca、Mg、Al这样活泼的金属
钠的冶炼 阳极:2Cl--2e-=Cl2↑ 阴极:2Na++2e-=2Na 总反应:
2NaCl(熔融)=2Na+Cl2↑
C
C
熔融NaCl
二、电解原理的应用——电冶金
铝的冶炼
阴极:
烟罩
4Al3++12e-=4Al 阳极:
6O2--12e-=3O2↑ 钢导电棒 总反应:
2Al2O3(熔融)=4Al+3O2↑
阳极C 熔C融态铝
Fe钢壳
阴极C
耐火材料
熔融Al2O3
三、计算
例1:用石墨电极电解2L饱和NaCl溶液,当 电源供给0.2mol电子时,所得溶液pH为多 少?两极各收集到标准状况下的气体多少 升?(溶液体积变化忽略不计)
阳极:必须是镀层金属 阴极:镀件
阳极:氧化反应,金属 电极失电子 阴极:还原反应,溶液 中的阳离子得电子
电解池
阳极:与电源正极相连 阴极:与电源负极相连
阳极:氧化反应,溶液 中的阴离子失电子或电 极金属失电子 阴极:还原反应,溶液 中的阳离子得电子
电子 同电解池 流向
电源负极→电解池阴极 电解池阳极→电源正极
Ⅲ
Ⅳ
Ⅰ与Ⅲ区:电解本身型 如CuCl2 、HCl
Ⅰ与Ⅳ区:放氢生碱型 如NaCl
Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3 Ⅱ与Ⅳ区:电解水型 如Na2SO4、H2SO4 、NaOH
小结:
2、电离与电解的比较
电离
电解
条件
电解质溶于水或受热融 化状态
电解质电离后再通直流电
《电解池》PPT授课-课件【人教版】

(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式: Ni2+ + 2e— = Ni
B.电解过程中,阳极质量的减少与阴极质量的增加 相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和 Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
通电 2NaCl+2H2O === 2NaOH + Cl2↑ + H2 ↑ 工业上利用这一反应,制取烧碱、氯气和氢气。
程式A.l3+~3Cl-~3e-~3OH-~Al(OH)3
A:2H++2e-→H2↑
依据电路中转 移电子相等
3H2 ~ 6e- ~ 2Al(OH)3 ~热量 H2(g)+1/2O2(g)=H2O(l);
3mol
2×78g QKJ △H=-285.8KJ/mol1.56g 8.574KJ
《电解池》PPT授课-课件【人教版】 优秀课 件(实 用教材 )
活泼性在铜之后的银、金等:
还原性比铜差的,不能失去电子,它们以单 质的形式留在溶液中,成为阳极泥。
阴极: Cu2++ 2e- → Cu
电解质溶液硫酸铜的浓度略有减小。
(05天津高考12 )金属镍有广泛的用途。粗镍中含 有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯
度的镍,下列叙述正确的是( D )
点 的离子
生成了新物质
联系
电解必须建立在电离的基础上
小结2 原电池和电解池知识总结比较表
内容
原电池
电极 较活泼金属做负极 规定
电极 反应
负极发生氧化反应
电子移 动方向
负极流向正极
A.阳极发生还原反应,其电极反应式: Ni2+ + 2e— = Ni
B.电解过程中,阳极质量的减少与阴极质量的增加 相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和 Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
通电 2NaCl+2H2O === 2NaOH + Cl2↑ + H2 ↑ 工业上利用这一反应,制取烧碱、氯气和氢气。
程式A.l3+~3Cl-~3e-~3OH-~Al(OH)3
A:2H++2e-→H2↑
依据电路中转 移电子相等
3H2 ~ 6e- ~ 2Al(OH)3 ~热量 H2(g)+1/2O2(g)=H2O(l);
3mol
2×78g QKJ △H=-285.8KJ/mol1.56g 8.574KJ
《电解池》PPT授课-课件【人教版】 优秀课 件(实 用教材 )
活泼性在铜之后的银、金等:
还原性比铜差的,不能失去电子,它们以单 质的形式留在溶液中,成为阳极泥。
阴极: Cu2++ 2e- → Cu
电解质溶液硫酸铜的浓度略有减小。
(05天津高考12 )金属镍有广泛的用途。粗镍中含 有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯
度的镍,下列叙述正确的是( D )
点 的离子
生成了新物质
联系
电解必须建立在电离的基础上
小结2 原电池和电解池知识总结比较表
内容
原电池
电极 较活泼金属做负极 规定
电极 反应
负极发生氧化反应
电子移 动方向
负极流向正极
电解池课件.ppt

8
实验三:电解CuSO4溶液
CuSO4溶液
9
CuSO4 == Cu2+ + SO42-
H2O
H + + OH -
阳极:4OH- ─ 4e- = 2H2O + O2↑ 阴极:2Cu2+ + 4e- = 2Cu
2CuSO4+ 2H2O
电解 2Cu + O2↑+ 2H2SO4
10
4、解决电解问题的步骤:
6
实验二:电解NaCl溶液
7
3、离子的放电顺序 金属活动性顺序:
K Ca Na Mg Al Zn Fe(H)Cu Ag 逐渐减弱
(1)在阴极,阳离子得电子的能力:
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ H+ Cu2+ Ag+
逐渐增强
(2)在阳极,阴离子失电子的能力: I- > Br- > Cl- > OH- > 含氧酸根离子
第四章 电化学基础 第三节 电解池
点燃
Cu + Cl2===CuCl2
?
CuCl2 ===Cu + Cl2↑
2
实验一、电解CuCl2溶液
CuCl2溶液
3
4
1、电解的定义: 使电流通过电解质溶液而在阴阳两 极引起氧化还原反应的过程叫电解。
5
2、电解池的组成:
电极材料 电解质溶液 闭合回路 电源 导线
(1)分析溶液中的离子 (2)在阴极,根据阳离子得电子能力判断产物, 写出电极反应式 (3)在阳极,根据阴离子失电子能力判断产物, 写出电极反应式
(4)写出总反应方程式
11
5、讨论:
实验三:电解CuSO4溶液
CuSO4溶液
9
CuSO4 == Cu2+ + SO42-
H2O
H + + OH -
阳极:4OH- ─ 4e- = 2H2O + O2↑ 阴极:2Cu2+ + 4e- = 2Cu
2CuSO4+ 2H2O
电解 2Cu + O2↑+ 2H2SO4
10
4、解决电解问题的步骤:
6
实验二:电解NaCl溶液
7
3、离子的放电顺序 金属活动性顺序:
K Ca Na Mg Al Zn Fe(H)Cu Ag 逐渐减弱
(1)在阴极,阳离子得电子的能力:
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ H+ Cu2+ Ag+
逐渐增强
(2)在阳极,阴离子失电子的能力: I- > Br- > Cl- > OH- > 含氧酸根离子
第四章 电化学基础 第三节 电解池
点燃
Cu + Cl2===CuCl2
?
CuCl2 ===Cu + Cl2↑
2
实验一、电解CuCl2溶液
CuCl2溶液
3
4
1、电解的定义: 使电流通过电解质溶液而在阴阳两 极引起氧化还原反应的过程叫电解。
5
2、电解池的组成:
电极材料 电解质溶液 闭合回路 电源 导线
(1)分析溶液中的离子 (2)在阴极,根据阳离子得电子能力判断产物, 写出电极反应式 (3)在阳极,根据阴离子失电子能力判断产物, 写出电极反应式
(4)写出总反应方程式
11
5、讨论:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、主要植物: 常绿植物。在lOkm2的热带雨林中就含
有l500种开花植物和750种树木。
3、主要动物:
猴类、长臂猿、黑猩猩和大猩猩、鹦鹉 科鸟类等。
鹦鹉科鸟类和猿猴,是热带雨林的特有动物。
长臂猿
黑猩猩
大猩猩
4、特点:
热带雨林中的生物种类约占地球已知 种类的一半,是地球上最丰富的生物基因 库。
二、草原
(二)、温带落叶阔叶林
1、气候特点: 温和
2、主要植物: 槭、山毛榉、栎、椴和柳等,林下灌林和
阔叶草本植物。
槭
山毛榉
栎
椴
3、主要动物:
田鼠、金花鼠、林猫、红狐、山雀、旋 木雀和啄木鸟。
田鼠
金花鼠
林猫
红狐
山雀
旋木雀
啄木鸟
4、特点: 植物发育良好,种类也很丰富。
(三)、热带雨林
1、气候特点: 温度和湿度很高
草长得高大,但生长期很短,从春季 到秋季便会完成一个生命世代。
三、荒漠(沙漠)
1、气候特点: 每年降雨量不足150mm,水分蒸发
量是降水量的7~50倍。
2、主要植物: 蒿属植物、藜属灌林、肉质旱生植物
和各种仙人掌。
3、主要动物:
沙漠动物(狐、更格芦鼠、沙漠兔、袋 鼠、沙漠蝗等),少数鸟类、蜥蜴。
化学能→ 电能 设计电池、金属防腐
阳极:2 CI- - 2e- = CI2 ↑(氧化反应) 阴极: Cu2+ + 2e- = Cu (还原反应)
电能→化学能 氯碱工业、电镀、电冶、金属精炼
二、电解原理的应用
1、电解饱和食盐水以制造烧碱、氯气和氢气。
电极反应式
阳极: 2Cl - -2e- == Cl2↑
D.NaCl
4.下列关于铜电极的叙述,正确的是( )。
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时,铜作阳极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时,铜作阳极
作业:P83 3、4、5、6
第四节 群落的主要类型
地球各地因气候、地形和其他环境条件 的不同而分布着不同类型的生物群落。
阳极(粗铜): Cu - 2e- = Cu2+ (氧化反应)
Zn - 2e- = Zn2+ Ni-2e- = Ni2+
阳极泥: 相对不活泼的金属以单质的形式沉积在电解 槽底,形成阳极泥
3、电冶金
制取金属钠
电解熔融状态的氯化钠。
阳极:2Cl - -2e- == Cl2↑ 阴极: 2Na+ + 2e- == 2Na 总反应: 2NaCl(熔融) 通电
2.100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应
速率,又不影响生成氢气的总量,可采用的方法是( )。
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水
D.加入适量的氯化钠溶液
3.用石墨作电极,电解1mol/L下列物质的溶液,溶液的PH值保
持不变的是( )。
A.HCl B.NaOH C.Na2SO4
电极反应式
阳极:2 CI- - 2e- = CI2 (氧化反应) 阴极: Cu2+ + 2e- = Cu (还原反应) 总反应:CuCI2 电解 Cu +CI2↑
1、电解:使电流通过电解质溶液而在阴、阳两极引起
氧化还原反应的过程叫做电解。
2、电解池(电解槽):把电能转化为化学能的装置。
思考???
在溶液中存在Cu2+ 、CI-、H+、OH-四种离子,为何 发生氧化还原反应的是Cu2+ 、CI- ?
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还 原反应
一、电解原理
演示试验
实验微观解释
结论:电解质通电前在水溶液中自由移动的阴、阳离
子作_____自__由_______运动;在外电源的作用下(直流 电),改作___定_向_____移动而导电。在导电的同时,在
阳、阴两极发生氧化—还原反应,即被电解,电离是 ___电_解______的前题。
旅鼠 白熊
驯鹿 雪鹀
北极狐 贼鸥
4、地理位置: 位于环北冰洋地带(北方针叶林以北)。
1、气候特点: 年降雨量在250~800mm之间
2、主要植物: 几乎完全由禾本科植物和阔叶草本植
物(主要是豆科和菊科)组成。
3、主要动物:
野驴、黄羊、黄鼠和鼠兔等。以及是非洲 草原的鸵鸟、美洲鸵和澳洲草原的鸸鹋等失去 飞翔能力的鸟类。
野驴
黄羊
黄鼠
鼠兔
鸵鸟
美洲鸵
鸸鹋
4、特点:
草原约占地球陆地表面的12%。
练习
• 分析下图,哪个是原电池,哪个是电解池。
1.下列说法或实验现象的描述不正确的是( )。
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把铜片插入氯化铁溶液中,在铜片表面出现一层铁
C.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡
放出速度加快
D.与电源负极相连的是电解槽的阴极
主要的陆地生物群落是森林、草原、荒 漠和苔原。
一、森林
(一)、北方针叶林
1、气候特点: 寒冷
2、主要植物: 主要由常绿针叶树种组成,如红松、云杉和冷杉。
红松
云杉
冷杉
3、主要动物: 驼鹿、雪兔、松鼠、黑熊、雷鸟和榛鸡等
驼鹿 黑熊
雪兔 雷鸟
松鼠 榛鸡
4、面积:
是地球上最大的森林带,约覆盖整个地球 表面的11%。
阴极: 总反应: 2、电镀
2H+ + 2e- == H2 ↑
通电
2NaCl+2H2O
阳极:镀层金属
2NaOH +Cl2↑+H2 ↑
电镀液:含有镀层金
铜片
属的电解质
阴极:待镀金属制品
硫酸铜溶 液
电镀铜原理
待镀件
电镀应用于铜的电解精练
电解铜原理演示
电极反应式
阴极(纯铜): Cu2+ + 2e- = Cu (还原反应)
电解质在水溶液中放电规律 例如:电解硫酸钠溶液
讨论:比较电解池和原电池的异同~~~~~~
装置
原电池
实例
铜锌原电池
电解池
电解氯化铜
原理
发生氧化还原反应,从而形成电流 电流通过引起氧化还原反应
形成条 电极名称
电子流向
两个电极、电解质溶液或熔融态电解质、形 成闭合回路、自发发生氧化还原反应
由电极本身决定
2Na + Cl2 ↑
电 解 熔 融 氯 化 钠 制 钠
思考交流
试比较电解饱和食盐水与电解熔融氯化钠的异同
(提示:比较电解质、电解装置、电极反应、电解产物)
小结
1、电源、电极、电极反应关系
与电源正极相连
阴离子移向 阳离子移向
阳极 阴极
发生氧化反应 发生还原反应
与电源负极相连
2、电解原理的应用:氯碱工业、电镀、电冶金
沙漠狐更格芦鼠来自沙漠袋鼠沙漠蝗蜥蜴
4、特点: 约占地球陆地表面的26%;
植株间隔和根系分布能最大限度地减 少竞争和充分利用水分。
四、苔原(冻原或冻土带)
1、气候特点: 气候严寒
2、主要植物: 羊胡子草、苔草、矮石楠、矮柳、苔藓和地衣等。
羊胡子草
苔草
苔藓和地衣
3、主要动物:
旅鼠、雪兔、驯鹿、北极狐、狼和白熊, 雪鹀、贼鸥和各种水鸟。
正极:流入电子 负极:流出电 子 (外电路)负极 → 正极
电源、电极(惰性或非惰性)、电 解质(水溶液或熔融态)
由外电源决定 阳极:连电源正极 阴极:连电源负 电极源负极→阴极→阳极→电源正极
电流方向
(外电路)正极→负极
电源正极→阳极→阴极→电源负极
电极反应 能量转化
应用
负极:Zn - 2e- =Zn2+(氧化反应) 正极:2H+ + 2e- =H2↑(还原原应)
思考回忆
1、电解质是指在__水_溶_液_或_熔_融_状_态__下__能够导电的化 合物。 2、电离是指电解质在___水_溶_液________或 _____熔_融____状态下离解成___自_由_移_动_离_子____的过 程。 3、原电池是___把_化_学_能_转_化_为_电_能__ 的装置 。 4、构成原电池的条件是
有l500种开花植物和750种树木。
3、主要动物:
猴类、长臂猿、黑猩猩和大猩猩、鹦鹉 科鸟类等。
鹦鹉科鸟类和猿猴,是热带雨林的特有动物。
长臂猿
黑猩猩
大猩猩
4、特点:
热带雨林中的生物种类约占地球已知 种类的一半,是地球上最丰富的生物基因 库。
二、草原
(二)、温带落叶阔叶林
1、气候特点: 温和
2、主要植物: 槭、山毛榉、栎、椴和柳等,林下灌林和
阔叶草本植物。
槭
山毛榉
栎
椴
3、主要动物:
田鼠、金花鼠、林猫、红狐、山雀、旋 木雀和啄木鸟。
田鼠
金花鼠
林猫
红狐
山雀
旋木雀
啄木鸟
4、特点: 植物发育良好,种类也很丰富。
(三)、热带雨林
1、气候特点: 温度和湿度很高
草长得高大,但生长期很短,从春季 到秋季便会完成一个生命世代。
三、荒漠(沙漠)
1、气候特点: 每年降雨量不足150mm,水分蒸发
量是降水量的7~50倍。
2、主要植物: 蒿属植物、藜属灌林、肉质旱生植物
和各种仙人掌。
3、主要动物:
沙漠动物(狐、更格芦鼠、沙漠兔、袋 鼠、沙漠蝗等),少数鸟类、蜥蜴。
化学能→ 电能 设计电池、金属防腐
阳极:2 CI- - 2e- = CI2 ↑(氧化反应) 阴极: Cu2+ + 2e- = Cu (还原反应)
电能→化学能 氯碱工业、电镀、电冶、金属精炼
二、电解原理的应用
1、电解饱和食盐水以制造烧碱、氯气和氢气。
电极反应式
阳极: 2Cl - -2e- == Cl2↑
D.NaCl
4.下列关于铜电极的叙述,正确的是( )。
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时,铜作阳极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时,铜作阳极
作业:P83 3、4、5、6
第四节 群落的主要类型
地球各地因气候、地形和其他环境条件 的不同而分布着不同类型的生物群落。
阳极(粗铜): Cu - 2e- = Cu2+ (氧化反应)
Zn - 2e- = Zn2+ Ni-2e- = Ni2+
阳极泥: 相对不活泼的金属以单质的形式沉积在电解 槽底,形成阳极泥
3、电冶金
制取金属钠
电解熔融状态的氯化钠。
阳极:2Cl - -2e- == Cl2↑ 阴极: 2Na+ + 2e- == 2Na 总反应: 2NaCl(熔融) 通电
2.100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应
速率,又不影响生成氢气的总量,可采用的方法是( )。
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水
D.加入适量的氯化钠溶液
3.用石墨作电极,电解1mol/L下列物质的溶液,溶液的PH值保
持不变的是( )。
A.HCl B.NaOH C.Na2SO4
电极反应式
阳极:2 CI- - 2e- = CI2 (氧化反应) 阴极: Cu2+ + 2e- = Cu (还原反应) 总反应:CuCI2 电解 Cu +CI2↑
1、电解:使电流通过电解质溶液而在阴、阳两极引起
氧化还原反应的过程叫做电解。
2、电解池(电解槽):把电能转化为化学能的装置。
思考???
在溶液中存在Cu2+ 、CI-、H+、OH-四种离子,为何 发生氧化还原反应的是Cu2+ 、CI- ?
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还 原反应
一、电解原理
演示试验
实验微观解释
结论:电解质通电前在水溶液中自由移动的阴、阳离
子作_____自__由_______运动;在外电源的作用下(直流 电),改作___定_向_____移动而导电。在导电的同时,在
阳、阴两极发生氧化—还原反应,即被电解,电离是 ___电_解______的前题。
旅鼠 白熊
驯鹿 雪鹀
北极狐 贼鸥
4、地理位置: 位于环北冰洋地带(北方针叶林以北)。
1、气候特点: 年降雨量在250~800mm之间
2、主要植物: 几乎完全由禾本科植物和阔叶草本植
物(主要是豆科和菊科)组成。
3、主要动物:
野驴、黄羊、黄鼠和鼠兔等。以及是非洲 草原的鸵鸟、美洲鸵和澳洲草原的鸸鹋等失去 飞翔能力的鸟类。
野驴
黄羊
黄鼠
鼠兔
鸵鸟
美洲鸵
鸸鹋
4、特点:
草原约占地球陆地表面的12%。
练习
• 分析下图,哪个是原电池,哪个是电解池。
1.下列说法或实验现象的描述不正确的是( )。
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把铜片插入氯化铁溶液中,在铜片表面出现一层铁
C.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡
放出速度加快
D.与电源负极相连的是电解槽的阴极
主要的陆地生物群落是森林、草原、荒 漠和苔原。
一、森林
(一)、北方针叶林
1、气候特点: 寒冷
2、主要植物: 主要由常绿针叶树种组成,如红松、云杉和冷杉。
红松
云杉
冷杉
3、主要动物: 驼鹿、雪兔、松鼠、黑熊、雷鸟和榛鸡等
驼鹿 黑熊
雪兔 雷鸟
松鼠 榛鸡
4、面积:
是地球上最大的森林带,约覆盖整个地球 表面的11%。
阴极: 总反应: 2、电镀
2H+ + 2e- == H2 ↑
通电
2NaCl+2H2O
阳极:镀层金属
2NaOH +Cl2↑+H2 ↑
电镀液:含有镀层金
铜片
属的电解质
阴极:待镀金属制品
硫酸铜溶 液
电镀铜原理
待镀件
电镀应用于铜的电解精练
电解铜原理演示
电极反应式
阴极(纯铜): Cu2+ + 2e- = Cu (还原反应)
电解质在水溶液中放电规律 例如:电解硫酸钠溶液
讨论:比较电解池和原电池的异同~~~~~~
装置
原电池
实例
铜锌原电池
电解池
电解氯化铜
原理
发生氧化还原反应,从而形成电流 电流通过引起氧化还原反应
形成条 电极名称
电子流向
两个电极、电解质溶液或熔融态电解质、形 成闭合回路、自发发生氧化还原反应
由电极本身决定
2Na + Cl2 ↑
电 解 熔 融 氯 化 钠 制 钠
思考交流
试比较电解饱和食盐水与电解熔融氯化钠的异同
(提示:比较电解质、电解装置、电极反应、电解产物)
小结
1、电源、电极、电极反应关系
与电源正极相连
阴离子移向 阳离子移向
阳极 阴极
发生氧化反应 发生还原反应
与电源负极相连
2、电解原理的应用:氯碱工业、电镀、电冶金
沙漠狐更格芦鼠来自沙漠袋鼠沙漠蝗蜥蜴
4、特点: 约占地球陆地表面的26%;
植株间隔和根系分布能最大限度地减 少竞争和充分利用水分。
四、苔原(冻原或冻土带)
1、气候特点: 气候严寒
2、主要植物: 羊胡子草、苔草、矮石楠、矮柳、苔藓和地衣等。
羊胡子草
苔草
苔藓和地衣
3、主要动物:
旅鼠、雪兔、驯鹿、北极狐、狼和白熊, 雪鹀、贼鸥和各种水鸟。
正极:流入电子 负极:流出电 子 (外电路)负极 → 正极
电源、电极(惰性或非惰性)、电 解质(水溶液或熔融态)
由外电源决定 阳极:连电源正极 阴极:连电源负 电极源负极→阴极→阳极→电源正极
电流方向
(外电路)正极→负极
电源正极→阳极→阴极→电源负极
电极反应 能量转化
应用
负极:Zn - 2e- =Zn2+(氧化反应) 正极:2H+ + 2e- =H2↑(还原原应)
思考回忆
1、电解质是指在__水_溶_液_或_熔_融_状_态__下__能够导电的化 合物。 2、电离是指电解质在___水_溶_液________或 _____熔_融____状态下离解成___自_由_移_动_离_子____的过 程。 3、原电池是___把_化_学_能_转_化_为_电_能__ 的装置 。 4、构成原电池的条件是
