晚期及复发乳腺癌解救性全身治疗临床指南
2011中国抗癌协会乳腺癌诊治指南与规范(2011版)

《中国癌症杂志》2011年第21卷第5期 CHINA ONCOLOGY 2011 Vol.21 No.5367一 乳腺癌筛查指南1 乳腺癌筛查的定义、目的以及分类 ⑴肿瘤筛查,或称作普查,是针对无症状人群的一种人群防癌措施,而针对有症状人群的医学检查称作诊断。
⑵乳腺癌筛查是通过有效、简便、经济的乳腺检查措施,对无症状妇女开展筛查,以期早期发现、早期诊断以及早期治疗。
其最终目的是要降低人群乳腺癌的死亡率。
⑶筛查分为机会性筛查(o pp o r t u n i s t i c screening)和群体普查(mass screening)2种。
机会性筛查是妇女个体主动或自愿到提供乳腺筛查的医疗机构进行相关检查;群体普查是社区或单位实体有组织地为适龄妇女提供乳腺筛查。
2 妇女参加乳腺癌筛查的起始年龄 ⑴机会性筛查一般建议40周岁开始,但对于一些乳腺癌高危人群可将筛查起始年龄提前到20周岁。
⑵群体普查推荐年龄为50~69周岁。
3 用于乳腺癌筛查的措施3.1 乳腺X线检查 ⑴乳腺X线检查对降低40岁以上妇女乳腺癌死亡率的作用已经得到了国内外大多数学者的认可。
⑵建议每侧乳房常规应摄2个体位,即头足轴(CC)位和侧斜(MLO)位。
⑶乳腺X线影像应经过≥2位专业放射科医师独立阅片。
⑷乳腺X线筛查40岁以上亚洲妇女准确性高。
但乳腺X线对年轻致密乳腺组织穿透力差,故一般不建议对40岁以下、无明确乳腺癌高危因素或临床体检未发现异常的妇女进行乳腺X线检查。
⑸常规乳腺X线检查的射线剂量低,不会危害妇女健康。
3.2 乳腺临床体检 ⑴单独作为乳腺癌筛查的方法效果不佳,尚无证据显示该方法可以提高乳腺癌早期诊断率和降低死亡率。
⑵一般建议作为乳腺X线筛查的联合检查措施,可能弥补乳腺X线筛查的遗漏。
3.3 乳腺自我检查 ⑴不能提高乳腺癌早期诊断检出率和降低中国抗癌协会乳腺癌诊治指南与规范(2011版)一 乳腺癌筛查指南二 常规乳腺X线检查和报告规范三 乳腺超声检查和报告规范四 常规乳腺MRI检查和报告规范五 影像引导下的乳腺组织学活检指南六 乳腺癌术后病理诊断报告规范七 浸润性乳腺癌保乳治疗临床指南八 乳腺癌前哨淋巴结活检临床指南九 乳腺癌全乳切除术后放射治疗临床指南十 乳腺癌全身治疗指南十一 乳腺癌患者康复治疗共识十二 乳房重建与整形临床指南十三 乳腺导管原位(内)癌治疗指南十四 Her-2阳性乳腺癌临床诊疗专家共识十五 乳腺癌局部和区域淋巴结复发诊治指南十六 乳腺癌骨转移的临床诊疗指南附 录368中国抗癌协会乳腺癌诊治指南与规范(2011版)死亡率。
乳腺癌解救化疗

主要研究者: Kathy Albain, MD
治疗方案
健择 1250 mg/m2 ,第1, 8天
随
紫杉醇 175 mg/m2 ,第1天
机
分
组
紫杉醇 175 mg/m2 ,第 1天
•每21天一周期,直至疾病进 展
16 Proc Am Soc Clin Oncol. 2004;23 (Abstract 510). Als•o每a p8le周nary对se所ssio有n pr部esen位tati的on.病灶进行 一次评估
中性粒细胞减少
31% 17%
贫血 血小板减少
6% 1% 5% <1%
白细胞减少
Hale Waihona Puke 10%发热性中性粒细胞减少
NCI-CTC=国立癌症研究所常见毒性反应分级标准
1% 5%
紫杉醇组 (N=259)
3级
4级
4% 3% <1%
2%
7% <1%
<1% 0%
1.2%
15 GEMZAR PI.
同时进行的治疗
健择/紫杉醇组 (N=267)
35% 30% 25% 20% 15% 10%
5% 0%
33.2% 33.8% 28.2%
任何内脏器官转移 肺转移 肝转移
19.9% 20.9% 16.7%
健择/紫杉醇组
紫杉醇组
(N=196)
(N=191)
本图表为回顾性亚组分析。所显示的亚组中并未达到统计学显著性。 注:肺转移包括胸腔积液、胸膜转移
注:在基线时有内脏器官转移的病人也可能有非内脏器官转移。 图表为回顾性亚组分析的结果。所显示的亚组分析中并未达到统计学显著性。
乳腺癌中文版NCCN指南(v.2版)

• 病理检查
初次活检为 手术活检
降低风险措施 监测
小叶原位癌 不伴其他癌
导管原位癌 (DCIS)
降低乳腺癌风 险的咨询,见 NCCN乳腺癌 降低风险指南
根据 • NCCN乳腺癌降低
风险指南 以及 • NCCN乳腺癌筛查
和诊断指南进行 监测
见NCCN DCIS指南 (DCIS-1)
浸润性 乳腺癌
检查
• 病史和体检 • 全血细胞计数,血小板计数 • 肝功能检查和碱性磷酸酶 • 双侧乳房X线摄片,乳腺超声检查 • 病理检查 • 明确肿瘤ER、PR及HER-2状况 • 遗传性乳腺癌高危患者进行遗传学咨询 • 乳腺MRI (可选),特别对于经X线摄片查出的隐匿性肿瘤 • 必要时进行生育咨询 • 心理评估(见NCCN 忧伤管理指南)
IIIC期: 任何T、N3、M0
IV期: 任何T、任何N、 M1
M0:无远处转移的临床或影像学证据 M1:通过传统临床和影像学方法发现的远处转移和/或组织学证实超过0.2cm的转移灶
NCCN对证据和共识的分类
1类
基于高水平证据(如随机对照试验)提出的建议,专家组一致同意。
2A类 基于低水平证据提出的建议,专家组一致同意。 2类
关于导管原位癌中阴性病理切缘的定义还存在很大分歧。分歧的产生有以下几个原因:疾病存在异质性、难以区分增生的 不同状况、切缘位置的解剖考虑,以及缺乏有关导管原位癌预后资料的前瞻性资料。
• 专家普遍认为,大于10 mm的切缘属阴性(但此切缘宽度也许过大,而且可能影响美观) • 小于1 mm的切缘被认为不足够 • 对于范围在1~10 mm之间的切缘,一般切缘越宽,局部复发率越低。但是对于位于乳腺纤维-腺分界部
原发肿瘤≤0.5 cm或 原发肿瘤微浸润
乳腺癌术后辅助全身治疗临床指南

乳腺癌术后辅助全身治疗临床指南乳腺癌术后辅助全身治疗的选择*●乳腺癌术后复发风险的分组(表-1)●乳腺癌术后全身辅助治疗的选择(表-2)b:瘤周脉管侵犯存在争议,它只影响腋淋巴结阴性的患者的危险度分级;但并不影响淋巴结阳性者的分级。
c:Her-2的测定必须是经由严格质量把关的免疫组化或FISH法。
* 基本参照2005 St. Gallen 会议指南乳腺癌术后辅助化疗临床指南禁忌征:●妊娠妇女。
●年老体衰且伴有严重内脏器质性病变患者。
治疗前谈话:●辅助化疗的目的是降低肿瘤复发,提高总生存率。
●化疗的不良反应。
●70岁以上患者进行化疗可能会有获益可能,但应评估化疗带来的风险。
治疗前准备:●首次化疗前应检测血常规、肝肾功能、心电图。
以后每次化疗前后应常规检测血常规。
心脏或肝肾功能异常者需监测血常规、心电图、LVEF或肝肾功能●育龄妇女应妊娠试验阴性并嘱避孕。
●签署化疗知情同意书。
化疗方案与注意事项(化疗详细方案参见附录I)●选择联合化疗方案,常用的有:1.基于蒽环类的方案,例如CAF、AC、CE120F、FE100C方案(C环磷酰胺、A阿霉素、E表阿霉素、F氟脲嘧啶)2.蒽环类与紫杉类联合方案,例如TAC(T多西紫杉醇)3.蒽环类与紫杉类序贯方案,例如AC→T/P(P紫杉醇)或FEC→T4.不含蒽环类的联合化疗方案,适用于老年、低风险、蒽环类禁忌或不能耐受的患者,常用的有CMF方案(C环磷酰胺、M氨甲喋呤、F氟脲嘧啶)。
●若无特殊情况,一般不建议减少化疗的周期数●根据患者的具体情况和初始治疗后的不良反应情况,可以适当调整化疗药物的剂量强度,但一般不得低于推荐剂量的85%。
●辅助化疗一般不与内分泌治疗或放疗同时进行。
化疗结束后再开始进行内分泌治疗。
放疗与内分泌治疗可先后或同时进行。
●化疗时应注意化疗药物的给药顺序,输注时间和剂量强度,严格按照药品说明和配伍禁忌使用。
乳腺癌术后辅助内分泌治疗临床指南适应征:●激素受体(ER和/或PgR)阳性的乳腺癌。
中国抗癌协会:乳腺癌全身治疗指南(系列十)

中国抗癌协会:乳腺癌全身治疗指南(系列十)10 乳腺癌全身治疗指南(附录Ⅵ、Ⅶ、Ⅷ)10.1 乳腺癌术后辅助全身治疗临床指南10.1.1 乳腺癌术后辅助全身治疗的选择乳腺癌术后辅助全身治疗的选择应基于复发风险个体化评估与肿瘤病理学上的分子分型及对不同治疗方案的反应性。
乳腺癌术后复发风险的分组见表2。
该表可用于全面评估患者手术以后的复发风险的高低,是制定全身辅助治疗方案的重要依据。
乳腺癌分子分型的判定见表3。
乳腺癌术后辅助全身治疗的选择见表4。
医师应根据治疗的反应性并同时参考患者的术后复发风险选择相应治疗。
表2 乳腺癌术后复发风险的分组低度:转移淋巴结阴性,同时具备以下6条:标本中病灶大小(pT)≤2cm;分级Ⅰ级【a】;瘤周脉管未见肿瘤侵犯【b】;ER和(或)PR表达;HER2基因没有过度表达或扩增【c】;年龄≥35岁中度:转移淋巴结阴性,以下6条至少具备1条:标本中病灶大小(pT)>2cm;分级Ⅱ~Ⅲ级;有瘤周脉管肿瘤侵犯;ER和PR缺失;HER2基因过度表达或扩增;年龄<35岁中度:转移淋巴结1~3枚阳性,未见HER2基因过度表达和扩增且ER和(或)PR表达高度:转移淋巴结1~3枚阳性,HER2基因过度表达或扩增或ER和PR缺失高度:转移淋巴结≥4枚阳性a.组织学分级/核分级;b.c.瘤周脉管侵犯存在争议,它只影响腋淋巴结阴性的患者的危险度分级,但并不影响淋巴结阳性者的分级;d.e.HER2的检测必须采用有严格质量把关的免疫组织化学或荧光原位杂交法(FISH)、色素原位杂交法(CISH)f.表3 乳腺癌分子分型的标志物检测和判定•管腔A型:管腔A样,ER/PR阳性且PR高表达HER2阴性、Ki-67增殖指数低。
备注:ER、PR 表达及Ki-67增殖指数的判定值建议采用报告阳性细胞的百分比。
Ki-67增殖指数的判定值在不同病理实验中心可能不同,可采用20%~30%作为判断Ki-67高低的界值;同时,以20%作为PR 表达高低的判定界值【*】,可进一步区分管腔A样和管腔B样(HER2阴性)••管腔B型:管腔B样HER2阴性,ER/PR阳性、HER2阴性且Ki-67增殖指数高或PR低表达。
2019 CSCO 乳腺癌指南解读

2019 CSCO 乳腺癌指南解读2019年,CSCO乳腺癌指南更新,这份指南意味着临床医生可以更好地指导患者,帮助乳腺癌患者获得更好的治疗和生存率。
下面我们来系统解读这份指南。
一、乳腺癌治疗原则乳腺癌治疗的原则是综合治疗,即结合局部治疗和全身治疗。
对于早期乳腺癌患者,以根治治疗为优先,包括手术、放疗、内分泌治疗和化疗。
而对于晚期乳腺癌患者,应强化全身治疗,化疗和内分泌治疗在治疗中占据重要地位。
同时,放疗可以有效地缩小肿瘤,降低患者术后复发率。
二、早期乳腺癌治疗策略1. 早期乳腺癌根治治疗方法对于早期乳腺癌患者,手术是常见的治疗方法。
根据指南,根治手术的原则是尽可能保留乳房外形,且达到治疗目的,常见的方法包括乳腺保留手术和乳腺切除手术。
同时,在乳腺保留手术术后,应根据患者具体情况进行放疗和内分泌治疗,进一步降低复发和死亡率。
对于乳腺切除手术患者,则需进一步做乳房重建手术,帮助患者维持较好的身体形态。
2. 早期乳腺癌化疗策略对于早期乳腺癌患者,化疗不是强制要求的治疗方法。
但是指南强调,对于以下患者,化疗是必要的:(1)ER、PR均为阴性的患者,包括node-negative、node-positive和HER2-negative患者;(2)HER2阳性患者;(3)node-positive、ER阳性或PR阳性的患者,特别是有其他不利预后因素的患者。
在化疗药物上,文献强调,AC、CMF为常规方案,但是,对于HER2阴性患者,可采用TC或DC方案;对于HER2阳性患者,需加用靶向药物。
3、早期乳腺癌内分泌治疗策略对于ER和PR阳性的早期乳腺癌患者,指南推荐在手术后进行内分泌治疗。
内分泌治疗药物包括tamoxifen和AIs等,单药或联合用药均可。
同时,长期内分泌治疗可以有效降低乳腺癌术后复发率和死亡率。
三、进展性乳腺癌治疗策略1. 进展性乳腺癌全身治疗策略对于进展性乳腺癌患者,全身治疗是重中之重。
指南中,化疗和内分泌治疗仍然是主要治疗手段。
CSCO乳腺癌诊疗指南更新完整版

CSCO乳腺癌诊疗指南更新完整版《CSCO乳腺癌诊疗指南2024》更新要点总结HER2阳性晚期乳腺癌:“德曲妥珠单抗(T-DXd)”取代“恩美曲妥珠单抗(T-DM1)”成为曲妥珠单抗治疗失败后唯一I级推荐的ADC药物(1A)。
三阴性晚期乳腺癌:原解救治疗推荐表格调整为解救化疗和解救免疫治疗两个表格,将免疫联合方案进行单独推荐。
HR阳性晚期乳腺癌:新增“AKT抑制剂(AKTi)+内分泌”作为CDK4/6抑制剂(CDK4/6i)治疗失败患者的III级治疗推荐。
新增HER2低表达晚期乳腺癌章节:对于HR阳性/HER2低表达晚期乳腺癌,“T-DXd”作为CDK4/6i 经治患者的首选II级推荐方案(1A)。
对于HR阴性/HER2低表达晚期乳腺癌,一线治疗失败后应首选ADC药物治疗,可以选择“戈沙妥珠单抗”或“T-DXd”。
T-DXd是HER2阳性晚期乳腺癌二线治疗唯一I级推荐的ADC药物图1. HER2阳性晚期乳腺癌的解救治疗方案在曲妥珠单抗治疗敏感的患者中,曲帕双靶联合紫杉类(THP)、曲妥珠单抗联合吡咯替尼及紫杉类(TH+吡咯替尼)仍是I级推荐方案,证据类别均调整为1A。
在曲妥珠单抗治疗失败的患者中,T-DXd是唯一I级推荐的ADC药物(1A),而T-DM1从I级推荐调整为II级推荐。
在TKI治疗失败的患者中,T-DXd仍然作为II级推荐,但证据类别提升至1A。
新增曲妥珠单抗、帕妥珠单抗皮下制剂。
注释3:新增(7)“T-DXd治疗失败后,可考虑应用既往获益的抗HER2靶向治疗或未使用过的同类药物,也需考虑局部治疗的可行性以兼顾生活质量。
”T-DXd作为HER2阳性晚期乳腺癌二线治疗的I级推荐是基于DESTINY-Breast03研究的突破性获益。
截至2022年7月25日,T-DXd 组BICR评估的中位PFS长达28.8个月,是T-DM1组6.8个月的4.2倍。
尽管两组的中位OS均未达到,但T-DXd组与T-DM1组之间差异已具有统计学显著性(HR=0.64,P=0.0037)。
乳腺癌解救化疗

乳腺癌解救化疗乳腺癌解救化疗一、背景简介乳腺癌是女性常见的恶性肿瘤之一,也可影响男性。
乳腺癌的化疗是一种重要的治疗方法,可以帮助患者摆脱肿瘤对身体的侵害。
本文档旨在提供乳腺癌解救化疗的详细信息,以指导患者和医护人员的实践操作。
二、术语定义1、乳腺癌:指乳房内发生的恶性肿瘤。
2、化疗:通过使用化学药物来杀死癌细胞或阻止其生长和分裂的治疗方法。
3、解救化疗:是指对乳腺癌患者进行化疗,旨在阻断疾病进展、缓解症状和延长患者生存期的一种治疗策略。
三、准备工作1、术前评估:进行详细的病史收集和体格检查,并进行相关的实验室检查和影像学检查,以评估乳腺癌的分期和患者的一般健康状况。
2、患者教育:向患者和家属提供相关的教育材料,包括化疗的效果和副作用,以及应注意的事项。
3、营养支持:建议患者在化疗过程中注意合理饮食,避免食用刺激性食物,同时可以考虑适当的营养补充。
四、化疗方案根据患者的具体情况和肿瘤特点,选择适当的化疗方案。
常用的化疗药物包括:1、白蛋白结合型紫杉醇(Abraxane):通过干扰癌细胞分裂和生长,发挥抗肿瘤作用。
2、环磷酰胺(Cyclophosphamide):干扰癌细胞DNA的复制和修复,防止癌细胞生长和分裂。
3、氟尿嘧啶(Fluorouracil):干扰癌细胞DNA的合成,抑制癌细胞的生长。
4、顺铂(Cisplatin):通过与癌细胞DNA结合,阻碍其复制和分裂,从而起到抗肿瘤的作用。
五、化疗周期化疗通常以周期为单位进行,每个周期通常持续3-4周。
化疗周期和用药剂量的具体安排需根据患者的情况进行调整,以达到最佳的治疗效果。
六、副作用管理化疗可能会引起一系列的副作用,包括但不限于:1、恶心和呕吐:可通过使用抗恶心药物来缓解。
2、脱发:建议患者在开始化疗前剪短头发,并在化疗期间避免使用热风吹干头发。
3、免疫系统受损:提醒患者注意避免感染,保持良好的个人卫生习惯。
4、疲劳:鼓励患者进行适当的锻炼,但避免过度疲劳。
NCCN指南 晚期及复发性乳腺癌应对

NCCN指南| 晚期及复发性乳腺癌应对本文要点一览:晚期及复发性乳腺癌的检查策略1. 讨论治疗目标,采取共同决策,并记录治疗过程。
2. 体格检查:结合患者病史进行首次。
3. 组织活检:首次复发应进行活检。
4. 实验室检查:1)全血细胞数;2)综合性的代谢功能检查包括肝功能测试和碱性磷酸酶。
5. 影像学检查:1)胸部CT及对照;2)腹部±盆腔诊断CT/MRI及对照;3)疑中枢神经系统症状:脑部MRI对照;4)脊柱MRI检查,如有背部疼痛或脊髓受压症状;5)骨扫描(可以骨转移)或氟化钠PET/CT (2B类);6)FDG PET/CT(备选)。
6.基因检测及遗传咨询:1)肿瘤转移灶的ER/PR和HER2状态的测定;2)对于考虑化疗的Her2阴性肿瘤患者,强烈考虑进行BRCA1/2检测;3)对于三阴性乳腺癌(TNBC),建议评估肿瘤浸润免疫细胞的PD-L1生物分子状态,以确定最有可能受益于白蛋白紫杉醇+Atezolizumab的患者;4)如果患者患遗传性乳腺癌的风险很大,则进行遗传咨询。
晚期及复发性乳腺癌局部或区域性复发的治疗策略晚期及复发性乳腺癌辅助内分泌治疗策略辅助内分泌治疗这一块,需要考虑患者的月经情况,在乳腺癌治疗中的绝经定义。
用于确定绝经的合理标准包括下列任意一条:注:对于不符合上述标准,且正在接受促黄体激素释放激素(LHRH)激动剂或拮抗剂治疗及在辅助化的女性绝经的判断需要引起注意。
这两类患者用药时月经可停止来潮,但在停药后卵巢功能仍可能完整或恢复。
因此,如果考虑采用芳香化酶抑制剂作为内分泌治疗的一部分,则需要通过卵巢切除术或者连续测定卵泡刺激素(FSH)和/或雌二醇水平来确认绝经后状态。
1.患者诊断时处于绝经期状态2.患者诊断时处于未绝经状态注:对于有芳香化酶抑制剂使用禁忌证、拒绝接受芳香化酶抑制剂治疗或无法耐受治疗的患者可使用他莫昔芬治疗5 年(1 类)或考虑他莫昔芬治疗至多10年晚期及复发性乳腺癌的术前辅助化疗方案1.HER-2阴性的患者AC:阿霉素+环磷酰胺;TC:多西他赛+环磷酰胺;CMF:环磷酰胺+甲氨蝶呤+氟尿嘧啶;EC:表柔比星+环磷酰胺;TAC:多西他赛+阿霉素+环磷酰胺2.HER-2阳性的患者TCH:多西他赛+卡铂+曲妥珠单抗晚期及复发性乳腺癌患者的全身治疗策略1.ER和/或PR阳性、HER2阴性患者全身治疗推荐方案:注:对于存在骨转移患者在以下推荐方案的基础上,加用地诺单抗、唑来膦酸、或帕米膦酸二钠2. ER和/或PR阳性、HER2阳性患者全身治疗推荐方案注:对于存在骨转移患者在以下推荐方案的基础上,加用地诺单抗、唑来膦酸、或帕米膦酸二钠。
NCCN+临床实践指南关于Ⅳ期转移复发乳腺癌部分解读(共32张PPT)

手术应在保证肿瘤局部完全获得清除,而其他转移灶不会立即威胁生命的情况下进行。 新版指南建议对于激素受体阴性而仅限于局部骨或软组织转移,或无症状内脏转移的病人,无论其HER-2 受体状态; 新版指南指出Ⅳ期、转移复发乳腺癌的综合治疗可以延长生存期,提高生存质量,但不可治愈。 新版指南指出Ⅳ期、转移复发乳腺癌的综合治疗可以延长生存期,提高生存质量,但不可治愈。 既往行保乳手术的局部复发的病人应该实施乳房切除术加Ⅰ、Ⅱ水平的腋窝淋巴结清扫术(如果以前没有实施腋窝清扫)。 既往行乳房切除术的病人:应进行局部复发病灶手术切除(如果可以在非高创伤的状况下完成手术)和区域胸壁及锁骨上区的放射治疗(
• 对于既往曾接受保乳手术和前哨淋巴结活检,有限的数据支持 80%可进行再次前哨淋巴结活检。然而,专家组的共识是:既 往保乳治疗和前哨淋巴结活检的局部复发的大多数病人首选的 手术方法是乳房切除术和Ⅰ、Ⅱ水平的腋窝淋巴结清扫术,但可 以考虑行再次前哨淋巴结活检术代替腋窝清扫术。
1.3远处转移病灶的局部处理: 新版指南建议如果出现下列临床状况如脑转移、软脑膜及脉络膜转移、胸腔积液、心包积液
双膦酸盐类药物、地诺塞麦与颌骨坏死(osteonecrosisof the jaw,ONJ)的发生有关。 同时处理高钙血症等骨骼相关事件。
• 既往行保乳手术的局部复发的病人应该实施乳房 (2)含曲妥珠单抗治疗而进展的HER-2 阳性病人,卡培他滨联合拉帕替尼治疗也是一个选择。
Ⅳ期、转移复发乳腺癌是晚期乳腺癌,属于不可治愈的疾病。 既往行单纯乳房切除术 共有808 例病人参加了这项试验。
不良的口腔卫生习惯以及牙周病和牙脓肿。
2.2 内分泌治疗: 新版指南建议雌激素受体(ER)或孕激素受体
(PR)阳性病人是初始内分泌治疗的适宜人群; 二线内分泌治疗后,没有高水平的证据来帮助选 择内分泌治疗的最佳顺序。
中国临床肿瘤学会(CSCO)乳腺癌诊疗指南 2024版PPT课件

根据治疗目标和患者病情,选择 适合的治疗手段,如手术、放疗 、化疗、分子靶向治疗等。
04
手术技巧与术后康复管理
各类手术适应症和禁忌症分析
适应症
包括早期乳腺癌、局部晚期乳腺癌、炎性乳腺癌等各 类乳腺癌的手术治疗适应症,以及患者身体状况和手 术耐受性的评估。
禁忌症
详细列出不适合进行手术治疗的情况,如远处转移、 严重心肺功能不全、凝血功能障碍等,以确保手术安 全。
05
放射治疗和化疗方案优化
放射治疗原理及设备介绍
放射治疗原理
放射治疗利用高能放射线,如X射线、电子线、质子束等,通过直接损伤DNA 或间接产生自由基等方式杀灭癌细胞。
设备介绍
现代放射治疗设备包括直线加速器、钴-60治疗机、后装治疗机、伽马刀、质子 重离子治疗系统等,这些设备能够精确控制放射线的剂量和分布,提高治疗效 果并减少副作用。
免疫检查点抑制剂作用机制
通过解除肿瘤细胞对免疫细胞的抑制作用,激 活患者自身的免疫系统来杀伤肿瘤细胞。
应用前景
在乳腺癌治疗中展现出良好的疗效和安全性, 未来有望成为乳腺癌免疫治疗的重要手段。临床试验结果解源自和实际应用价值临床试验结果解读
多项临床试验证实,靶向治疗和免疫 治疗在乳腺癌患者中具有显著的临床 获益,且总生存期和无进展生存期均 有所延长。
联合放化疗时机把握和效果评估
联合放化疗通常用于局部晚期或转移性乳腺癌的治疗。在制定治疗方案时,需要综合考虑患者的病 情、身体状况和治疗目标等因素,确定合适的放化疗时机和顺序。
时机把握
效果评估
通过影像学检查、肿瘤标志物检测等手段,定期评估联合放化疗的效果。同时,密切关注患者的症 状变化和不良反应情况,及时调整治疗方案。
晚期乳腺癌的解救治疗

HER-2阴性晚期乳腺癌的解救化疗
4、CBCSG 006、等研究提示,铂类在三阴性乳腺癌中具有较高的有效率,含铂方案可作为三阴性乳腺癌解 救化疗的选择之一,特别是有BRCA2突变的患者。 5、 Impassion130研究显示,PDL1抗体联合白蛋白紫杉醇一线治疗转移性或不可切除局部晚期三阴性乳腺 癌,可显著提高PFS,特别是在PDL1表达阳性的人群中,取得了Os的获益,因此专家组鼓励,三阴性晚期乳腺癌 患者积极参与免疫检查点抑制剂相关的临床研究。 6、 OlympIAD研究显示,对于存在 BRCA I/2胚系突变的HER2阴性晚期乳腺癌患者,奥拉帕利相较于化疗 可显著延长PS(7个月vs4.2个月),因此专家组普遍同意存在BRCA2胚系突变的患者可以接受奥拉帕利的治疗, 或积 极入组临床研究。 7、304研究显示,对于蔥环类和紫杉类治疗失败的晚期乳腺癌患者,艾立布林较长春瑞滨可明显延长PFs和 ORR 且不良事件发生率相似,成为环类和紫杉类失败的晚期乳腺癌新的治疗选择; 8、BG01-1312L研究显示,对于蒽环类和紫杉类治疗失败的晚期乳腺癌,优替德隆联合卡培他滨对比卡培他 滨单药 可明显延长PFS和OS,为蒽环类和紫杉类失败的晚期乳腺癌提供了新的治疗机会。 9、多柔比星脂质体在使用时,应充分了解患者既往蒽环类药物的使用剂量、疗效、疗程以及患者可能出现 的不良反应, 尤其是2、曲妥珠单抗+帕托珠 单抗+其他化疗
吡咯替尼+卡培他滨
1、T-DM1
1、吡咯替尼单药
2、拉帕替尼+卡培他滨 2、TKI联合化疗
3、曲妥珠单抗联合其
他化疗
(二)HER-2阳性晚期乳腺癌的治疗
1、应充分告知所有HER2阳性复发转移乳腺癌患者,及时接受HER2靶向治疗的获益及必要性 2、未用曲妥珠单抗 1)治疗的首选应该是曲买珠单抗为基础的治疗,根据患者激素受体情况、既往(新)辅助治疗用药情况,选择合理 的联合的疗方案 2)H0648g和M7001研究证实,在紫杉类基础上联合曲妥珠单抗治疗,能够显著提高PFS和Os,确立了曲妥珠单 抗联合紫杉类在一线标准治疗的地位。CHAT研究证实,对于能够耐受双药化疗的患者,曲妥珠单抗联合 多西他赛加卡培他滨,比曲妥珠单抗联合多西他赛效果更好,尤其适用于考虑维持治疗的患者。 HERNAIA 研究证实曲妥珠单抗联合长春瑞滨也能取得相似疗效。紫杉类药物治疗失败的患者,曲妥珠单抗还可以联 卡培他滨。曲妥珠单抗联合紫杉醇加卡铂,疗效优于曲妥珠单抗联合紫杉醇 3) CLEOPAIRA研究”证实,多西他赛联合帕妥珠单抗、曲妥珠单抗双靶向治疗较多西他赛联合曲妥珠单抗单 靶治疗,可明是延长PFS和OS,成为HER2阳性既往曲妥珠单抗和紫杉类治疗未失败患者的首选治疗方案 3、曲妥珠单抗的再使用人群为:1新铺助治疗失败:2辅助治疗结束1年后复发3、解救治疗有效后停药; 曲妥珠单抗治疗失败 1)曲妥珠单抗治疗进展后,持续抑制HR2通路能够持续带来生存获益,因此一线曲妥珠单抗病情进展后,推荐 二线续使用抗HER2治疗; 2)PHND研究结果量示,在紫杉类和曲珠单抗治疗失败的患者,咯替尼联合卡培他滨,较单用卡培他滨可提高
中国乳腺癌诊治指南主要内容

中国乳腺癌诊治指南主要内容乳腺癌筛查1. 筛查年龄:机会性筛查一般建议40 岁开始,但对于一些乳腺癌高危人群,可将筛查起始年龄提前到40 岁以前。
乳腺癌高危人群:有明显的乳腺癌遗传倾向者;既往有乳腺导管或小叶不典型增生或小叶原位癌的患者;既往行胸部放疗。
2. 筛查方法:X 线检查、乳腺超声检查、MRI 检查。
浸润性乳腺癌保乳治疗1. 外科手术适应证:临床I 期、II 期的早期乳腺癌和III 期非炎性乳腺癌。
绝对禁忌证:(1)妊娠期间放疗;(2)病变广泛或弥漫分布的恶性特征钙化灶,且难以达到切缘阴性或理想外形;(3)肿瘤经局部广泛切除后切缘阳性,再次切除后仍不能保证病理切缘阴性者;(4)患者拒绝行保留乳房手术;(5)炎性乳腺癌。
2. 术后放疗(1)放疗剂量:全乳照射剂量45~50 Gy,1.8~2.0 Gy/ 次,5 次/ 周。
在无淋巴引流区照射的情况下也可考虑大分割方案治疗,即2.66 Gy×16 次,总剂量42.5 Gy。
在全乳照射基础上可通过瘤床加量进一步提高局部控制率,剂量为(10~16) Gy/(1~1.5) 周,共5~8 次。
(2)与全身治疗的时序配合:无辅助化疗指征的患者放疗建议在术后4~8 周内进行;接受辅助化疗的患者应在末次化疗后2~4 周内开始。
乳腺癌前哨淋巴结活检(SLNB)SLNB 是早期浸润性乳腺癌的标准腋窝分期手段。
适应证:早期浸润性乳腺癌;临床腋窝淋巴结阴性;单灶或多中心性病变;导管内癌接受乳房切除术;临床腋窝淋巴结阴性新辅助治疗后。
禁忌证:炎性乳腺癌;腋窝淋巴结穿刺证实为转移且未接受新辅助治疗;腋窝淋巴结阳性新辅助治疗后仍为阳性。
乳腺癌全乳切除术后放疗1. 适应证:(1)原发肿瘤最大直径大于等于5 cm,或肿瘤侵及乳腺皮肤、胸壁;(2)腋窝淋巴结转移大于等于4 枚;(3)淋巴结转移1~3 枚的T1-2;(4)T1-2 乳腺单纯切除术,如SLN 阳性,当不考虑后续腋窝清扫时,推荐术后放疗;如不考虑放疗,则推荐进一步腋窝清扫。
乳腺癌术后辅助全身治疗临床指南
乳腺癌术后辅助全身治疗临床指南1乳腺癌术后辅助全身治疗的选择乳腺癌术后辅助全身治疗的选择应基于复发风险个体化评估与肿瘤病理分子分型及对不同治疗方案的反应性。
乳腺癌术后复发风险的分组见表1。
该表可供全面评估患者手术以后的复发风险的高低,是制定全身辅助治疗方案的重要依据。
乳腺癌病理分子分型的判定见表2。
乳腺癌术后辅助全身治疗的选择见表3,医生根据治疗的反应性并同时参考患者的术后复发风险选择相应治疗。
2乳腺癌术后辅助化疗的临床指南2.1适应证⑴肿瘤>2 cm。
⑵淋巴结阳性。
⑶激素受体阴性。
⑷HER-2阳性(对T1a以下患者目前无明确证据推荐使用辅助化疗)。
⑸组织学分级为3级。
辅助化疗方案的制定应综合考虑肿瘤的临床病理学特征、患者方面的因素和患者的意愿以及化疗可能的获益和由之带来的不良反应等。
免疫组化检测应该常规包括ER、PR、HER-2和Ki-67。
2.2禁忌证⑴妊娠期:妊娠早、中期患者,应慎重选择化疗。
⑵年老体弱且伴有严重内脏器质性病变患者。
2.3治疗前谈话⑴辅助化疗的目的是降低肿瘤复发率,提高总生存率。
⑵化疗的不良反应。
⑶年龄>70岁的患者接受化疗可能会有获益,但应慎重权衡化疗带来的利弊。
2.4治疗前准备⑴首次化疗前应充分评估患者的脏器功能,检测方法包括血常规、肝肾功能、心电图等。
以后每次化疗前应常规检测血常规和肝肾功能;使用心脏毒性药物前应常规做心电图和(或)左室射血分数(left ventricular ejectionfraction,LVEF)测定;其他检查应根据患者的具体情况和所使用的化疗方案等决定。
⑵育龄妇女应妊娠试验阴性并嘱避孕。
⑶签署化疗知情同意书。
2.5辅助化疗方案与注意事项(化疗详细方案参见附录Ⅵ、Ⅶ)⑴选择联合化疗方案,常用的有:①以蒽环类为主的方案,如CAF、A (E)C、FE100C方案(C:环磷酰胺,A:多柔比星,E:表柔比星,F:氟尿嘧啶)。
虽然吡柔比星(THP)在欧美少有大组的循证医学资料,但在我国日常临床实践中,用吡柔比星代替多柔比星也是可行的。
乳腺癌的常规治疗方案

一、引言乳腺癌是女性常见的恶性肿瘤之一,其发病率和死亡率在全球范围内呈上升趋势。
乳腺癌的治疗方案主要包括手术、放疗、化疗、内分泌治疗和靶向治疗等。
本文将详细介绍乳腺癌的常规治疗方案。
二、手术治疗1. 乳腺癌手术方式(1)保乳手术:适用于早期乳腺癌患者,切除肿瘤及周围部分乳腺组织,保留大部分乳腺组织,术后进行放疗。
(2)乳腺癌根治术:切除整个乳腺、胸大肌、胸小肌、腋窝淋巴结等,适用于肿瘤较大、侵犯胸壁的患者。
(3)乳腺癌改良根治术:切除乳腺、胸大肌、胸小肌,保留胸壁,适用于肿瘤较大、侵犯胸壁的患者。
2. 乳腺癌手术适应症(1)早期乳腺癌:肿瘤较小,无远处转移。
(2)肿瘤位于乳腺中央区,切除难度较大。
(3)患者对美观要求较高。
3. 乳腺癌手术禁忌症(1)肿瘤侵犯胸壁、皮肤、肋骨等。
(2)肿瘤伴有远处转移。
(3)患者全身状况较差,无法耐受手术。
三、放疗治疗1. 乳腺癌放疗方式(1)外照射放疗:适用于术后辅助放疗、局部晚期乳腺癌、复发乳腺癌等。
(2)近距离放疗:适用于局部晚期乳腺癌、复发乳腺癌等。
2. 乳腺癌放疗适应症(1)保乳手术后辅助放疗。
(2)乳腺癌根治术后辅助放疗。
(3)局部晚期乳腺癌、复发乳腺癌等。
3. 乳腺癌放疗禁忌症(1)放疗区域皮肤有感染。
(2)放疗区域有活动性出血。
(3)放疗区域有严重水肿。
四、化疗治疗1. 乳腺癌化疗方式(1)全身化疗:适用于晚期乳腺癌、复发乳腺癌等。
(2)局部化疗:适用于局部晚期乳腺癌、复发乳腺癌等。
2. 乳腺癌化疗适应症(1)晚期乳腺癌。
(2)复发乳腺癌。
(3)肿瘤较大、侵犯胸壁、皮肤等。
3. 乳腺癌化疗禁忌症(1)严重肝肾功能不全。
(2)骨髓抑制严重。
(3)全身状况较差,无法耐受化疗。
五、内分泌治疗1. 乳腺癌内分泌治疗方式(1)抗雌激素治疗:如他莫昔芬、托瑞米芬等。
(2)抗孕激素治疗:如米非司酮、阿那曲唑等。
2. 乳腺癌内分泌治疗适应症(1)雌激素受体(ER)阳性的乳腺癌。
乳腺癌全身治疗指南(2021年版)

乳腺癌全身治疗指南(2021年版)
无
【期刊名称】《浙江实用医学》
【年(卷),期】2021(26)6
【摘要】1乳腺癌术后辅助全身治疗临床指南1.1乳腺癌术后辅助全身治疗的选
择乳腺癌术后辅助全身治疗的选择应基于复发风险的个体化评估、肿瘤病理学的分子分型以及对不同治疗方案预期的反应性。
乳腺癌术后复发风险的分组见表2。
该表可用于全面评估患者手术以后复发风险的高低,是制定全身辅助治疗方案的重要
依据。
乳腺癌分子分型的判定见表3。
医师应根据患者的分子分型及复发风险选择相应的化疗、内分泌治疗、抗HER2治疗,以及选择是否进行和采纳何种强化治疗。
【总页数】16页(P520-535)
【作者】无
【作者单位】中国抗癌协会乳腺癌专业委员会
【正文语种】中文
【中图分类】R73
【相关文献】
1.外阴恶性肿瘤诊断和治疗指南(2021年版)
2.阴道恶性肿瘤诊断与治疗指南(2021年版)
3.中国抗癌协会乳腺癌诊治指南与规范(2021年版)
4.乳腺癌术后上肢淋巴水
肿诊治指南与规范(2021年版)5.中成药治疗乳腺增生症临床应用指南(2021年版)因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
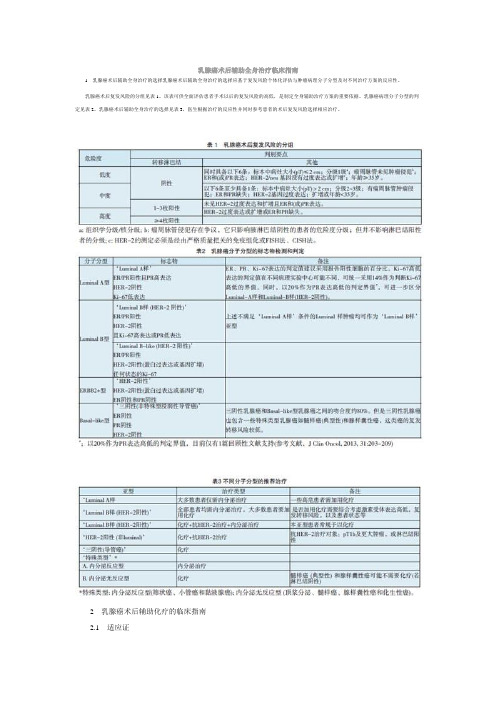
晚期及复发乳腺癌解救性全身治疗临床指南
晚期乳腺癌包括复发和转移性乳腺癌,是不可治愈的疾病。
治疗的主要目的是缓解症状、提高生活质量和延长患者生存期。
应尽可能在决定治疗方案前对复发或转移部位进行活检,尤其是孤立性病灶,以明确诊断和重新评估肿瘤的ER、PR和HER-2状态。
局部治疗,如手术和放疗在初治为Ⅳ期乳腺癌中的价值还不明确。
只有当全身药物治疗取得很好的疗效时,才可考虑姑息性的局部治疗,以巩固全身治疗的效果。
1晚期乳腺癌内分泌治疗指南
1.1适应证
⑴E R 和( 或) PR阳性的复发或转移性乳腺癌。
⑵转移灶仅局限于骨或软组织。
⑶无症状的内脏转移。
⑷复发距手术时间较长,一般>2年。
⑸原则上内分泌治疗适合于激素受体阳性的患者,但是如果是受体不明或受体为阴性的患者,只要其临床病程发展缓慢,也可以试用内分泌治疗。
1.2治疗前谈话
⑴复发或Ⅳ期乳腺癌的全身治疗主要以延长无进展生存期及生存期、提高生活质量为目的,而非治愈性。
因此,应优先选择毒性尽可能小的治疗方案。
只要情况允许,毒性较小的内分泌治疗优于细胞毒治疗。
⑵内分泌治疗的不良反应。
1.3内分泌药物
⑴绝经后患者的内分泌治疗包括:芳香化酶抑制剂包括非甾体类(阿那曲唑和来曲唑)和甾体类(依西美坦)、雌激素受体调变剂(他莫昔芬和托瑞米芬)、雌激素受体下调剂(氟维司群)、孕酮类药物(甲地孕酮)、雄激素(氟甲睾酮)、大剂量雌激素(乙炔基雌二醇)。
⑵绝经前患者的内分泌治疗包括:他莫昔芬、LHRH类似物(戈舍瑞林和luprolide)、外科手术去势、孕酮类药物(甲地孕酮)、雄激素(氟甲睾酮)和大剂量雌激素(乙炔基雌二醇)。
1.4内分泌一线治疗的选择和注意事项
⑴没有接受过抗雌激素治疗或无复发时间较长的绝经后复发患者,他莫昔芬、芳香化酶抑制剂或氟维司群都是合理的选择。
⑵他莫昔芬辅助治疗失败的绝经后患者可选芳香化酶抑制剂或氟维司群。
⑶既往接受过抗雌激素治疗并且距抗雌激素治疗1年内复发转移的绝经后患者,芳香化酶抑制剂是首选的一线治疗。
⑷未接受抗雌激素治疗的绝经前患者,可选择治疗为他莫昔芬、卵巢去势、卵巢去势加他莫昔芬或芳香化酶抑制剂。
1.5内分泌解救治疗的选择及注意事项
⑴尽量不重复使用辅助治疗或一线治疗用过的药物。
⑵他莫昔芬治疗失败的绝经后患者可选芳香化酶抑制剂或氟维司群。
⑶一类芳香化酶抑制剂治疗失败患者可选另外一类芳香化酶抑制剂(加或不加依维莫司)或氟维司群(500 mg 或250 mg);若未证实有他莫昔芬抵抗,也可选用他莫昔芬。
⑷ER阳性的绝经前患者可采取卵巢手术切除或其他有效的卵巢功能抑制治疗,随后遵循绝经后妇女内分泌治疗指南。
⑸二线内分泌治疗之后的内分泌治疗有效选择,尚缺乏高水平的证据供参考。
2晚期乳腺癌化疗的临床指南
2.1适应证(具备以下1个因素即可考虑首选化疗)
⑴激素受体阴性。
⑵有症状的内脏转移。
⑶激素受体阳性但对内分泌治疗耐药的患者。
⑷年龄<35岁。
2.2治疗前谈话
⑴化疗的目的是改善生活质量,延长无进展生存期及生存期。
⑵化疗的不良反应。
2.3治疗前准备
⑴首次化疗前应检测血常规、肝肾功能、心电图。
以后每次化疗前后应常规检测血常规,使用蒽环类药物者还须检查心电图或LVEF。
心脏或肝肾功能异常者需监测血常规、心电图、LVEF或肝肾功能。
⑵育龄妇女应妊娠试验阴性并嘱避孕。
⑶签署化疗知情同意书。
2 . 4化疗方案和注意事项(具体方案见附件Ⅵ、Ⅶ)
⑴推荐的首选化疗方案包括单药序贯化疗或联合化疗。
与单药化疗相比,联合化疗通常有更好的客观缓解率和疾病至进展时间,然而联合化疗的毒性较大且生存获益有限。
此外,序贯使用单药能降低患者需要减小剂量的可能性。
需要使肿瘤迅速缩小或症状迅速缓解的患者选择联合化疗,耐受性和生活质量作为优先考虑因素的患者选择单药序贯化疗。
⑵常用单药包括:蒽环类,如多柔比星、表柔比星、吡柔比星、聚乙二醇化脂质体多柔比星;紫杉类,如紫杉醇、多西他赛、白蛋白结合紫杉醇;抗代谢药,如卡培他滨和吉西他滨;以及非紫杉类微管形成抑制剂,如长春瑞滨、艾日布林。
⑶常用的联合化疗方案包括:环磷酰胺、多柔比星和氟尿嘧啶(FAC/CAF);氟尿嘧啶、表柔比星和环磷酰胺(FEC);环磷酰胺、吡柔比星和氟尿嘧啶(CTF);多柔比星、环磷酰胺(AC);表柔比星、环磷酰胺(EC);多柔比星联合多西他赛或紫杉醇(AT);环磷酰胺、氨甲喋呤和氟尿嘧啶(CMF);多西他赛联合卡培他滨;吉西他滨联合紫杉醇。
⑷其他有效的单药还包括环磷酰胺、顺铂、口服依托泊苷、长春花碱、米托蒽醌和氟尿嘧啶持续静脉给药方案。
⑸标准的药物治疗为应用一个治疗方案直至疾病进展换药,但由于缺乏总生存期方面的差异,应该采用长期化疗还是短期化疗后停药或维持治疗需权衡疗效、药物不良反应和患者生活质量。
⑹蒽环类药物有心脏不良反应,使用时须评估LVEF,至少每3个月1次。
如果患者使用蒽环类药物期间发生有临床症状的心脏毒性、或无症状但LVEF<45%或较基线下降>15%,首先停药,充分评估患者的心脏功能,后续治疗应该慎重。
尽管早期有临床试验提示同时使用右丙亚胺和蒽环类药物可能会降低化疗的客观有效率,但是荟萃分析显示右丙亚胺会引起较重的粒细胞减少,但是并未降低化疗的疗效,且可使心力衰竭的发生率降低约70%。
3HER-2阳性的晚期乳腺癌治疗的临床指南
3.1适应证
HER-2/neu阳性的复发或转移性乳腺癌。
H E R - 2 的规范化检测和阳性的判定应参照ASCO/CAP指南或中国相关的指南。
⑴H E R - 2 / n e u 阳性是指免疫组化检测为(+++),或荧光原位杂交法(FISH)或者色素原位杂交法(CISH)显示HER-2基因扩增。
⑵免疫组化检测HER-2为(++)的患者,应该进一步行FISH或CISH检测明确是否有基因扩增。
3.2相对禁忌证
⑴治疗前LVEF<50%。
⑵同时进行蒽环类化疗。
⑶治疗过程中,LVEF较基线下降≥15%。
3.3治疗前谈话
⑴在常规化疗的基础上加用曲妥珠单抗不但可以提高客观有效率和中位PFS,而且可延长患者的总生存期。
⑵曲妥珠单抗是一种生物靶向制剂,经10 年以上的临床应用总体安全性良好,但有可能影响心脏射血功能和增加充血性心力衰竭的机会。
⑶曲妥珠单抗价格贵,HER-2/neu状态确认的重要性及其检测费用。
⑷如果解救阶段停用分子靶向治疗,可能会导致肿瘤反弹。
在经济支付能力方面应与患者充分沟通。
3.4治疗前准备
⑴准确的HER-2/neu检测。
有条件尽量行转移灶的再次活检,以证实转移灶的HER-2状态是否有转变。
并可将原手术组织的标本和转移灶标本(蜡块或白片)送往国内有条件的病理科进行复查。
⑵心功能检查(心脏超声或同位素扫描,以前者应用更为普遍)。
⑶签署治疗知情同意书。
3.5一线治疗方案的选择和注意事项
⑴曲妥珠单抗可联合的化疗药物和方案有紫杉醇联合或不联合卡铂、多西他赛、长春瑞滨和卡培他滨,以及联合多西他赛+帕妥珠单抗。
⑵HER-2和激素受体同时阳性的晚期乳腺癌患者中,对病情发展较慢或不适合化疗的患者,可以选择曲妥珠单抗联合内分泌治疗。
⑶使用期间,每3个月检查1次LVEF。
3.6二线治疗方案的选择和注意事项
在含曲妥珠单抗方案治疗后发生疾病进展的HER-2阳性转移乳腺癌患者中,后续治疗应继续阻滞HER-2通路。
⑴可保留曲妥珠单抗,而更换其他化疗药物,如卡培他滨。
⑵也可换用拉帕替尼加用其他化疗药物,如卡培他滨。
⑶也可停细胞毒药物,而使用两种靶向治疗药物的联合,如拉帕替尼联合曲妥珠单抗,或帕妥珠单抗联合曲妥珠单抗(目前尚未在国内进行临床试验) ⑷也可考虑使用TDM-1。
