promega 双荧光素酶报告基因检测系统 快速Protocol
双荧光素酶系统实验操作步骤及方法_ ppt课件

6. 测量完毕后,请将最后检测的EP管取出后,关闭仪器。 7. 实验结果的处理与分析:采用双样本等方差t检验进行处
理,P<0.05为差异显著,P<0.01为差异极显著。
双荧光素酶系统实验操作步骤及方 法_ቤተ መጻሕፍቲ ባይዱ
四、注意事项
➢ 由于温度对酶反应有影响,所以测定时样品和试剂均需达 到室温后再进行测定。
➢ Renilla荧光素酶检测工作液后需配制后立即使用,不可配 制成工作液后长期保存。
5. 记录读数: 每个样品会有3个数值:RLU1——萤火虫荧光 素酶反应强度, RLU2——内参海肾荧光素酶反应强度, Ratio——RLU1/ RLU2。一般记录Ratio 值即可,但RLU1 和RLU2为实际荧光强度值,可以反映细胞的转染效率, 也可根据实际荧光强度来调整报告质粒与内参的比例。
双荧光素酶系统实验操作步骤及方 法_
双荧光素酶系统实验操作步骤及方法 _
双荧光素酶报告系统
双荧光素酶系统实验操作步骤及方法_
一、概述
➢ 报告基因 (reporter gene):是一种编码可被检测的
蛋白质或酶的基因,也就是说,是一个其表达产物非常容 易被鉴定的基因。 一般的,把报告基因的编码序列和基因表达调节序列相融 合形成嵌合基因,或与其它目的基因相融合,从而利用它
的表达产物来标定目的基因的表达调控。
在动物基因表达调控的研究中,报告基因被广泛应用。如 绿色荧光蛋白(GFP)和荧光素酶。
双荧光素酶系统实验操作步骤及方 法_
➢ 荧光素酶(Luciferase):是能够催化不同底物氧化
发光的一类酶的统称,哺乳细胞无内源性荧光素酶。
➢ 荧光素酶报告基因的优点
蛋白不需要翻译后加工,所以一旦翻译立即产生报告活性。 在所有的化学发光反应中,它的光产物具有最高的量子效
dual-luciferase

双荧光素酶报告系统作者:windyrain 2008-05-29 21:54:33标签:杂谈双荧光素酶报告基因测试∶结合萤火虫和海洋腔肠荧光素酶先进的共报告基因测试技术在用萤火虫荧光素酶定量基因表达时,通常采用第二个报告基因来减少实验的变化因素。
但传统的共报告基因(比如CAT,β-Gal,GUS)不够便利,因为各自的测试化学,处理要求,检测特点存在差异。
Promega提供一种先进的双报告基因技术,结合了萤火虫荧光素酶测试和海洋腔肠荧光素酶测试。
双荧光素酶报告基因测试系统,结合pRL载体系统,表达第二个报告基因海洋腔肠荧光素酶,在单管中进行双荧光素酶报告基因测试,快速,灵敏,简便。
系统还提供PLB裂解液,用来裂解在多孔板中培养的哺乳细胞,不需操作单个样品。
对于正在使用萤火虫荧光素酶报告基因载体的研究人员。
双荧光素酶报告基因测试系统将使他们立即体会到该系统的便利。
介绍有内参照双报告基因用于实验系统中作相关的或成比例的检测, 通常一个报告基因作为内对照, 使另一个报告基因的检测均一化。
检测基因表达时双报告基因通常用来瞬时转染培养细胞,带有实验报告基因的载体共转染带有不同的报告基因作为对照的第二个载体。
通常实验报告基因偶联到调控的启动子, 研究调控基因的结构和生理基础。
报告基因表达活力的相对改变与偶联调控启动子转录活力的改变相关,偶联到组成型启动子的第二个报告基因,提供转录活力的内对照, 使测试不被实验条件变化所干扰。
通过这种方法, 可减少内在的变化因素所削弱的实验准确性, 比如, 培养细胞的数目和活力的差别, 细胞转染和裂解的效率。
使用萤火虫荧光素酶,结合氯霉素乙酰转移酶(CAT), β-半乳糖苷酶(β-Gal), 或葡萄醛酸糖苷酶(GUS)的双报告基因,近几年已普遍使用。
但这些双报告基因组合削弱了荧光素酶操作的优势, 比如荧光素酶测试和定量可在几秒钟内进行, 但CAT, β-Gal和GUS测试法, 则在定量前需要长时间的保温。
双荧光素酶报告基因实验步骤

双荧光素酶报告基因实验步骤实验目的:本实验采用双荧光素酶(Dual-Luciferase)报告系统,探究基因调控机制。
通过构建表达报告基因的质粒,研究不同因素对基因转录的影响。
实验材料:1. 双荧光素酶检测试剂盒(Promega)2. 293T细胞系3. Lipofectamine 2000转染试剂4. 培养基(DMEM + 10% FBS)实验步骤:1. 构建表达报告基因的质粒。
选择含有目标基因启动子区域的DNA片段,与质粒载体pGL3-基因报告载体连接,形成表达质粒pGL3-目标启动子-火萤酶(Luciferase)。
2. 细胞培养。
将293T细胞接种于6孔板中,培养至70-80%的稳定生长。
注意,细胞仅用到2×105个,否则检测结果会受内源性酶的影响。
3. 细胞转染。
将转染试剂与质粒混合,加入到细胞培养皿中。
注意,Lipofectamine 2000转染试剂与质粒的比例应按照转染试剂说明书进行调整。
4. 点亮荧光素酶(Luciferase)。
在细胞转染后48小时,加入荧光素酶检测试剂和积木酶抑制剂,使细胞产生发光,并通过微量板阅读器记录荧光值。
5. 关闭荧光素酶(Luciferase)。
在荧光素酶检测试剂作用后加入积木酶检测剂,称为“阻滞液”,使细胞发出的光信号被阻断。
加入Renilla荧光素酶检测试剂,使细胞重新产生新的发光信号,并通过微量板阅读器记录荧光值。
6. 数据统计。
按照公式计算相邻荧光信号的比值(荧光素酶/Renilla荧光素酶),以此作为表达目标启动子的相对活性。
(注意,双荧光素酶检测试剂盒中已包含此项标准)实验结果:通过双荧光素酶报告系统,研究了不同生物因素对基因转录的影响。
在细胞实验中,通过记录不同重复单元(replicate)的相对活性,为科研人员提供基因调控机制的新思路。
(数据统计请参照附表)结论:本实验采用双荧光素酶报告系统,通过构建表达报告基因的质粒,检测对基因转录的影响。
双荧光素酶报告基因检测系统——更亮、更快、更准

双荧光素酶报告基因检测系统——更亮、更快、更准产品背景双荧光素酶报告基因常用于启动子对基因表达影响的研究。
将所研究目的基因的调控序列克隆到含有报告基因的表达质粒中,然后将重组质粒导入适当的细胞系,通过测定报告基因表达的水平来间接评价在调控序列指导下启动子对基因表达的诱导作用。
荧光素酶是理想的报告基因,因为哺乳动物细胞中不含内源性荧光素酶,转录后无需修饰即具有报告基因的功能。
产品原理萤火虫荧光素酶(Firefly luciferase)大小为61KDa,单亚基蛋白,能够催化荧光素(luciferin)氧化,生成氧化荧光素oxyluciferin;海肾荧光素酶(Renilla luciferase)为36 KDa的单亚基蛋白,能够催化腔肠素(coelenterazine)氧化形成coelenteramide。
二者在翻译后均无需修饰即可发挥作用。
通常情况下,海肾荧光素酶作为内肾,用以减少内在因素的某些变化对实验所造成的影响。
该试剂盒先对转染后的细胞进行裂解,然后以荧光素为底物检测萤火虫荧光素酶的活性,之后在淬灭该荧光反应的同时,以腔肠素为底物检测海肾荧光素酶报告基因的活性;具有检测信号强、线性范围广、无内源活性干扰等特点。
产品特点裂解能力更强:能够彻底裂解绝大部分种类细胞。
信号更强:能够精准检测弱启动子的表达。
灵敏度更高:可检测低至10‐20摩尔荧光素酶分子。
线性范围更广:线性检测范围超过酶浓度的8个数量级。
操作流程加入海肾荧光素酶反应液的作用1:淬灭萤火虫荧光素酶的发光 2:加入海肾荧光素酶的底物腔肠素产品数据检测试剂和荧光素酶相互作用,可获得最佳的发光强度,加入海肾荧光素酶底物后,萤火虫荧光素发光淬灭情况:基本能够完全淬灭。
产品价格产品订购FAQQ1:双荧光素酶报告基因最适反应温度?A:室温(20-22℃)。
反应时各个组分(细胞裂解产物,底物工作液等)都需要调整到室温。
此两种荧光素酶的反应速率是受温度影响的,为了保证实验的一致性,我们推荐此两种工作液在检测时都孵育至室温。
美谷分子酶标仪:如何用注射器卡盒在酶标仪上进行双荧光素酶报告基因实验(DLR)

美谷分子酶标仪:如何用注射器卡盒在酶标仪上进行双荧光素酶报告基因实验(DLR)简介报告基因实验一般用来研究真核生物的基因表达。
在双报告基因实验中,细胞都转染了两种质粒,一种含有的目的基因调控的启动子,另一种包含一个质控基因的组成型启动子。
将目的报告基因与质控报告基因共转染,最小程度减少实验误差。
生物发光报告系统广泛联合使用萤火虫和海肾荧光素酶,因为它们都很容易操作且极其灵敏。
Promega公司的双报告基因实验(DLR)系统允许使用者在一个微孔板孔中分别检测萤火虫和海肾荧光素酶活性,其中萤火虫作为实验报告,海肾作为质控基因。
Figure 1展示了两个酶促反应,按顺序发生在相同的实验孔中。
萤火虫荧光素酶催化的荧光素的氧化会伴随着光的释放。
反应需要ATP, Mg2+ 和O2。
海肾荧光素酶催化氧气依赖型腔肠动物荧光素,但是不需要ATP或Mg2+。
酶有着不同的底物要求,所以它们可以在一个反应体系中完成。
双报告基因实验需求两种不同的试剂含有不同的底物,每次都需要进行化学发光读数。
这种实验流程可以轻松在SpectraMax i3x多功能酶标仪的注射器卡盒上进行,这套体系已通过DLReady体系认证。
我们在这篇应用文章中向大家展示了重组萤火虫荧光素酶和海肾荧光素酶的6个数量级的线性范围检测,同时进行了每孔195到25000个被转染细胞的线性检测。
Figure 1. Reactions catalyzed by firefly and Renilla luciferases. Firefly and Renillaluciferasehave different substrate requirements.优势•6数量级线性范围的高灵敏度荧光素酶定量检测•利用SoftMax Pro软件自动分析和计算数据,实现报告基因规范化检测•智能加样技术优化试剂混匀结果材料双报告基因实验系统(Promega cat.#E1960),包括:•荧光素酶检测试剂II•荧光素酶检测底物•Stop & Glo 缓冲液•Stop & Glo 底物•5X Passive 裂解缓冲液纯化重组荧光素酶:•萤火虫荧光素酶: QuantiLum® Recombinant Luciferase (Promega cat. #E1701)•海肾荧光素酶: Recombinant Renilla Luciferase (RayBiotech cat. # RB-15-0003P-10) CHO-K1 细胞(ATCC cat.#CCL-61)质控荧光素酶质粒:•pGL4.13[luc2/SV40] 萤火虫荧光素酶质粒(Promega cat. #E6681)•pGL4.74[hRluc/TK] 海肾萤火虫酶质粒(Promega cat. #E6921)Fugene高效转染试剂(Promega cat.#E2311)6孔组织培养板(Corning cat. #3516)96孔平底底透白色TC处理板(Corning cat. #3610)光学放大的封膜(Genesee cat.#12-639)白色96和384孔微孔板(Greiner cat.#655075 and #781075)SpectraMax i3x 多功能微孔板读板机SpectraMax 注射器卡盒方法酶标准曲线制备萤火虫荧光素酶贮存液,用含有1mg/mL BSA的1X Passive 裂解缓冲液(PLB,一种双荧光素报告实验系统)将贮存液从12.4mg/ml稀释到1mg/ml。
Dual-Luciferase 双荧光素酶报告基因检测系统
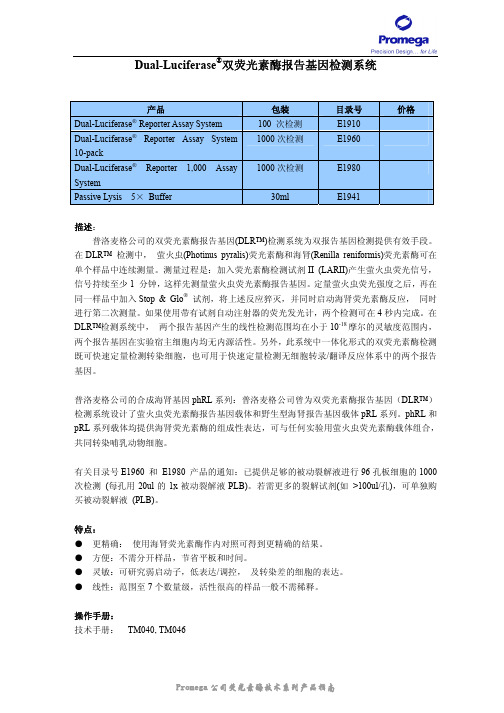
Dual-Luciferase®双荧光素酶报告基因检测系统产品包装目录号价格Dual-Luciferase® Reporter Assay System 100 次检测E19101000次检测E1960Dual-Luciferase® Reporter Assay System10-pack1000次检测E1980Dual-Luciferase® Reporter 1,000 AssaySystemPassive Lysis 5× Buffer 30ml E1941描述:普洛麦格公司的双荧光素酶报告基因(DLR™)检测系统为双报告基因检测提供有效手段。
在DLR™ 检测中,萤火虫(Photinus pyralis)荧光素酶和海肾(Renilla reniformis)荧光素酶可在单个样品中连续测量。
测量过程是:加入荧光素酶检测试剂II (LARII)产生萤火虫荧光信号,信号持续至少1 分钟,这样先测量萤火虫荧光素酶报告基因。
定量萤火虫荧光强度之后,再在同一样品中加入Stop & Glo®试剂,将上述反应猝灭,并同时启动海肾荧光素酶反应,同时进行第二次测量。
如果使用带有试剂自动注射器的荧光发光计,两个检测可在4秒内完成。
在DLR™检测系统中,两个报告基因产生的线性检测范围均在小于10-18摩尔的灵敏度范围内,两个报告基因在实验宿主细胞内均无内源活性。
另外,此系统中一体化形式的双荧光素酶检测既可快速定量检测转染细胞,也可用于快速定量检测无细胞转录/翻译反应体系中的两个报告基因。
普洛麦格公司的合成海肾基因phRL系列:普洛麦格公司曾为双荧光素酶报告基因(DLR™)检测系统设计了萤火虫荧光素酶报告基因载体和野生型海肾报告基因载体pRL系列。
phRL和pRL系列载体均提供海肾荧光素酶的组成性表达,可与任何实验用萤火虫荧光素酶载体组合,共同转染哺乳动物细胞。
pmirGLO双萤光素酶报告基因载体说明书

Promega Corporation2800 Woods Hollow Road Madison, WI 53711-5399USA Telephone 608-274-4330Toll Free 800-356-9526Fax 608-277-2516Internet PRODUCT USE LIMITATIONS, WARRANTY, DISCLAIMER Promega manufactures products for a number of intended uses. Please refer to the product label for the intended use statements for specific products.Promega products contain chemicals which may be harmful if misused. Due care should be exercised with all Promega products to prevent direct human contact.Each Promega product is shipped with documentation stating specifications and other technical information.Promega products are warranted to meet or exceed the stated specifications. Promega's sole obligation and the customer's sole remedy is limited to replace-ment of products free of charge in the event products fail to perform as warranted. Promega makes no other warranty of any kind whatsoever, and SPECIFICALLY DISCLAIMS AND EXCLUDES ALL OTHER WAR-RANTIES OF ANY KIND OR NATURE WHATSOEVER,DIRECTLY OR INDIRECTLY, EXPRESS OR IMPLIED,INCLUDING, WITHOUT LIMITATION, AS TO THESUITABILITY, PRODUCTIVITY, DURABILITY, FITNESS FOR A PARTICULAR PURPOSE OR USE, MER-CHANTABILITY, CONDITION, OR ANY OTHER MAT-TER WITH RESPECT TO PROMEGA PRODUCTS. In no event shall Promega be liable for claims for any other damages, whether direct, incidental, foresee-able, consequential, or special (including but not lim-ited to loss of use, revenue or profit), whether based upon warranty, contract, tort (including negligence) or strict liability arising in connection with the sale or the failure of Promega products to perform in accordance with the stated specifications.Part# 9PIE133Revised 6/13Part# 9PIE133Printed in USA Revised 6/13pmirGLO Dual-Luciferase miRNA Target Expression Vector:Cat.#Size E133020µgCat.# E1330 contains:Part E133A pmirGLO Vector 20µg C838A Oligo Annealing Buffer1mlDescription: The pmirGLO Dual-Luciferase miRNA Target Expression Vector (a–d)is designed to quantitatively evaluate microRNA (miRNA) activity by the insertion of miRNA target sites 3´ of the firefly luciferase gene (luc2). These target sites can be introduced by cloning putative miRNA binding sites alone, or the 3´ untranslated region (UTR) of a gene of interest, to study the influence of these sites on transcript stability and activity. Firefly luciferase is the primary reporter gene;reduced firefly luciferase expression indicates the binding of endogenous or introduced miRNAs to the cloned miRNA target sequence. This vector is based on Promega dual-luciferase technology, with firefly luciferase (luc2) used as the primary reporter to monitor mRNA regulation and Renilla luciferase (hRluc-neo ) acting as a control reporter for normalization and selection. This vector contains the following features:•Human phosphoglycerate kinase (PGK) promoter provides low translational expression, which is advantageous when reduction of signal is the desired response. The PGK promoter is a nonviral universal promoter, which functions across cell lines (yeast, rat, mouse and human).•Firefly luciferase reporter gene (luc2) inversely reports miRNA activity in mammalian cells.•Multiple cloning site (MCS) is located 3´ of the firefly luciferase reporter gene (luc2).•Humanized Renilla luciferase-neomycin resistance cassette (hRluc -neo) is used as a control reporter for normalization of gene expression and stable cell line selection.•Amp r gene allows bacterial selection for vector amplification.•SV40 late poly(A) signal sequence is positioned downstream of luc2to provide efficient transcription termination and mRNA polyadenylation.•Synthetic poly(A) signal/transcription stop site.Concentration: 1µg/µl in 10mM Tris-HCl, 1mM EDTA; final pH 7.4.GenBank ®Accession Number:FJ376737.Storage Conditions:See the storage temperature and expiration date on the Product Information Label.Quality Control AssaysFunctional AssaysIdentity Assay: The vector has been sequenced completely and has 100% identity with the published sequence availableat: /vectors/Restriction Digestion:The functional purity of this vector DNA is verified by complete digestion with restriction enzymes at the optimal temperature for 1 hour. Samples are examined by agarose gel electrophoresis, comparing cut and uncut vector DNA with marker DNA.Contaminant AssaysContaminating Nucleic Acids: RNA, single-stranded DNA and chromosomal DNA are not evident in specified quantities of this vector as determined by agarose gel electrophoresis.Nuclease Assay: Following incubation of 1µg of this vector in Restriction Enzyme Buffer at 37°C for 16–24 hours, no evidence of nuclease activity is detected by agarose gel electrophoresis.Physical Purity:A 260/A 280≥1.80, A 260/A 250≥1.05.© 2008–2013 Promega Corporation. All Rights Reserved.Dual-Glo is a registered trademark of Promega Corporation. GeneClip and PureYield are trademarks of Promega Corporation.GenBank is a registered trademark of US Department of Health and Human Services.Products may be covered by pending or issued patents or may have certain limitations. Please visit our Web site for more information.All specifications are subject to change without prior notice.Product claims are subject to change. Please contact Promega Technical Services or access the Promega online catalog for the most up-to-dateinformation on Promega products.(a)BY USE OF THIS PRODUCT, RESEARCHER AGREES TO BE BOUND BY THE TERMS OF THIS LIMITED USE LABEL LICENSE.Researchers shall have no right to modify or otherwise create variations of the nucleotide sequence of the luciferase gene except that researchers may (1) create fused gene sequences, and (2) insert and remove nucleic acid sequences in splicing research. No other use or transfer of this product or derivatives is authorized. Researchers must either (1) use luminescent assay reagents purchased from Promega for all determinations of luminescence activity of this product and its derivatives; or (2) contact Promega to obtain a license for use of the product. For any uses outside this label license, contact Promega for supply and licensing information. This product is for research use only; no commercial use is allowed. For a full copy of this label license, including the definition of “commercial use,” go to:/LULL (b)U.S. Pat. No. 5,670,356.(c)U.S. Pat. No. 8,008,006 and European Pat. No. 1341808.(d)The method of recombinant expression of Coleoptera luciferase is covered by U.S. Pat. Nos. 5,583,024, 5,674,713 and 5,700,673. A license (from Promega for research reagent products and from The Regents of the University of California for all other fields) is needed for any commercial sale of nucleic acid contained within or derived from this product.Certificate of AnalysisSigned by:J. Stevens, Quality AssurancePromega Corporation2800 Woods Hollow Road·Madison, WI 53711-5399 U.S.A. Toll Free in the USA 800-356-9526 Telephone 608-274-4330 Features List and Map for the pmirGLO VectorSV40 late poly(A) signal106–327SV40 early enhancer/promotor426–844hRluc -neo fusion protein coding region 889–2664Synthetic polyadenylation signal 2728–2776β-lactamase (Amp r ) coding region3037–3897Col E1-derived plasmid origin of replication 4052–4088Human phosphoglycerate kinase promoter 5094–5609luc2reporter gene5645–7297Multiple cloning site (MCS, Figure 1)7306–73501.Sample Protocol1.A. Vector Cloning1.Design oligonucleotides: Order oligonucleotide pairs that contain the desired miRNAtarget region and, when annealed and ligated into the pmirGLO Vector, result in the miRNA target region in the correct 5´ to 3´ orientation. Insure that the overhangs created by oligonucleotide annealing are complementary to those generated by restric-tion enzyme digestion of the pmirGLO Vector in Step 2. Add an internal restriction site to your oligonucleotides for clone confirmation (e.g., NotI in Figure 3 creates a ~125bp insert when digested with NotI because of a NotI site at position 93 in the vector).2.Digest vector: Linearize the pmirGLO Vector with the appropriate restriction enzymes togenerate overhangs that are complementary to the annealed oligonucleotide overhangs.3.Anneal oligonucleotides: Dilute both oligonucleotides (supplied by user) to 1µg/µl.Combine 2µl of each oligonucleotide with 46µl of Oligo Annealing Buffer. Heat at 90°C for 3 minutes, then transfer to a 37°C water bath for 15 minutes. Use the annealed oligonucleotides immediately, or store at –20°C.1.B. Ligation and Transformation1.Dilute annealed oligonucleotides 1:10 in nuclease-free water to a final concentrationof 4ng/µl per oligonucleotide. Ligate 4ng of annealed oligonucleotides and 50ng of linearized vector using a standard ligation protocol. Transform ligated pmirGLO Vector using high-efficiency JM109 competent cells (e.g., Cat.# L2001).2.Select clones on ampicillin-containing plates, then select clones containing theoligonucleotides by digesting miniprep-purified DNA (e.g., purified using thePureYield™ Plasmid Miniprep System, Cat.# A1221) using the unique restriction site in the oligonucleotide pair. The purified plasmid DNA can be transfected directly or expanded to generate more DNA.Additional information about annealing, ligation, transformation and oligonucleotide design can be found in the GeneClip ™ U1 Hairpin Cloning Systems Technical Manual , 1.C. An Example of Detecting mi-R21 Activity Using the pmirGLOVector:miR-21 ConstructAn overview describing the use of the pmirGLO Vector to interrogate endogenous mi-R21microRNA is shown in Figure 2.The presence of broadly endogenous microRNA mi-R21 was monitored in HeLa cells.Constructs contained either an exact match to the 21bp mi-R21 target sequence or a mismatched version of that target site (1) as well as PmeI, XbaI and NotI restriction sites (Figure 3; mismatched sequence is in bold italics). Twenty-four hours after transfection with the mi-R21 pmirGLO Vector constructs, cells were analyzed for luciferase activity using the Dual-Glo ®Luciferase Assay System (Cat.# E2920) and a MicroLumatPlus LB96V luminometer (Berthold). Normalized firefly luciferase activity (firefly luciferase activity/Renilla luciferase activity) for each construct was compared to that of the pmirGLO Vector no-insert control. For each transfection, luciferase activity was averaged from six replicates.2.Reference1.Zeng, Y. and Cullen, B.R. (2003) Sequence requirements for micro RNA processing 7841M A-neo SV40 late PGK 7824M A...GCAAG ATCGC CGTGT AATTC TAGTT GTTTA AACGA GCTCG CTAGCCTCGA GTCTA GAGTC GACCT GCAGG...PmeI DraI 5´EcoICRI Sac INheIXhoISalI AccIXbaI3´Figure 1. pmirGLO Vector multiple cloning site.7825MAgene firefly luciferase translation In absence of miR-21activity.proteinmRNA destablized;Figure 2. Mechanism of action of the pmirGLO Vector.7826M Bmi-R21 mismatch se n se,PmeI a nd XbaImi-R21 a n tise n se, PmeI a nd XbaImi-R21 se n se, PmeI a nd XbaI mi-R21 mismatch a n tise n se,PmeI a nd XbaIXbaI5´ AAAC TA GCGGCCGC TAGT TCAACATCAG TCT GATAAGCTA T 3´PmeI NotI i n te rn al sitemi-R21 ta r get seq u e n ce XbaI5´ AAAC TA GCGGCCGC TAGT TCAACATCAG AA GATAAGCTA T 3´3´ TTTG AT CGCCGGCG ATCA AGTTGTAGTC TT CTATTCGAT AGATC 5´3´ TTTG AT CGCCGGCG ATCA AGTTGTAGTC AGA CTATTCGAT AGATC 5´PmeI NotI i n te rn al site mi-R21 tar get seq u e n ce Figure 3. Sample oligonucleotides for mi-R21.7827M AmismatchP e r c e n t f i r e f l y :R e n i l l a l u c i f e r a s e a c t i v i t y c o m p a r e d t o n o -i n s e r t c o n t r o lFigure 4. Normalized luciferase activity using the pmirGLO Vector with an mi-R21 target sequence.。
双荧光素酶报告系统检测

一,裂解细胞1,5×CLB从-20度取出,化开,用ddH2O配成1×PLB(-4度保存可以放一个月),现用现配2,裂解时细胞<95%汇合度,保证裂解效率,吸去培养基,每孔加500ulPBS,洗涤后去除PBS3,24孔板每孔加100ulPLB,室温摇床上裂解15min,将裂解液吸入1.5EP中4,12000rpm,离心30s二,准备检测试剂1,裂解期间,取出LARII液体和stop&Glo液体(如果新领的话用10mlLARII液体重悬substrate,分装1ml/EP,-20度可以保存一个月,-70度可以保存1年),化至室温混匀,溶液为绿色2,1V的stop&Glo底物溶于50V的buffer中(现用现配,-20度可以保存15天,-70度可保存较长时间),溶液为黄色3,一般每次检测,每个样品各需LARII液和stop&Glo 25ul,准备时每个液体再多准备1ml上柱用,将准备好的液体装入干净的5mlEP管子中,并标记好三,准备冷光仪1,检测前半小时,打开电压器和冷光仪电源,预热20-30min2,清洗注液通道:更换青瓶中水为MillQ水,menu→others→operate function→reagent→others→wash→Inj1(可洗涤1-12次中任何次数)→放入废液收集管→检查收集管中是否有气泡,如有则repeat一次,如无,则exit→Inj2同样操作→exit3,清空注液通道:menu→others→operate function→reagent→others→manual→unload→Inj1(3-4遍)→Inj2(3-4遍)(废液及时倒出)4,通道注入检测试剂:将注液通道插入相应的检测试剂中,前面的通道注入LARII,后面的注入stop&Glo→menu→others→operate function→reagent→prime→Inj1→插入收集管→start→收集管中液体可倒回5mlEP中→同理操作Inj2四,检测1,程序设置:menu→protocol→change→3enter(HDD)→change protocol→选择No →enter→检查各参数,如无问题一路按enter不用改变参数→enter 2,检测:menu→protocol→3enter→取一个检测管,在底部加入5ul样品,插入机器→start→继续下个样品的操作,并及时丢弃废管3,注意,刚开始的几个数字变化较大,可以重复测定几次,待稳定后再往下测,并及时可用笔标记(打印开关开)五,回收试剂和清理仪器1,menu→others→operate function→reagent→others→manual→unload→Inj1(3-4遍)→插入管子收集→Inj2(3-4遍)→插入管子收集2,清洗注液通道:更换青瓶中水为MillQ水,menu→others→operate function→reagent→others→wash→Inj1(可洗涤1-12次中任何次数)→放入废液收集管→检查收集管中是否有气泡,如有则repeat一次,如无,则exit→Inj2同样操作→exit3,清空注液通道:menu→others→operate function→reagent→others→manual→unload→Inj1(3-4遍)→Inj2(3-4遍)(废液及时倒出)4,关仪器,关电压器电源,盖上防尘布。
Promega--双萤光素酶报告基因演示教学

1.98
处理A
1
5,1376 4,467
2
40,712 3,574
3
88,787 7,654
4
6,0292 5,232
5
处理B
1
587,635 5,144
2
988,347 8,832
3
3
409,881 3,564
661,954 5,847
113.21
第二天 对照
1 2 •
处理C
1
2 3
处理D
1
2 3 4
荧光 - Fluorescence
Fire
萤光 - Luminescence
Worm
萤光 (Bioluminescence)
荧光 (Fluorescence)
是化学发光(Chemilumi- nescence) 吸收来自光源的光,再发射
的一种,激发能量来自化学反应
另一光子
萤光发光计(Luminometer)
载体 - 萤火虫萤光素酶载体
•pGL3 家族
✓pGL3-Basic ✓pGL3-Control ✓pGL3-Enhancer ✓pGL3-Promoter
pGL3-Basic Map
pGL3-Control Map
pGL3-Enhancer Map
pGL3-Promoter Map
内对照载体可能存在的问题
GloMax ™ 96 luminometer
White microplates for luminescence
Promega公司出品的双报告基因实验产品
• 质粒
– 萤火虫萤光素酶质粒 – 海肾萤光素酶质粒 – 叩头虫萤光素酶质粒
promega双荧光素酶说明书

promega双荧光素酶说明书
Promega双荧光素酶说明书
一、简介
Promega双荧光素酶系统是一种灵敏的报告基因检测工具,用于检测细胞
或组织中荧光素酶的表达水平。
该系统包括荧光素酶基因报告质粒、荧光素酶活性检测试剂和荧光检测仪。
通过将荧光素酶基因报告质粒转染到细胞中,可以监测荧光素酶的表达水平,从而了解基因的表达情况。
二、主要特点
1. 高灵敏度:可检测低至 pg荧光素酶的活性。
2. 快速:可在短时间内完成检测。
3. 简便:无需特殊设备,只需一台荧光检测仪即可完成检测。
4. 稳定:荧光素酶基因报告质粒可在细胞内稳定表达,提供可靠的检测结果。
三、使用方法
1. 转染荧光素酶基因报告质粒:将荧光素酶基因报告质粒转染到细胞中,按照说明书操作。
2. 培养细胞:在适宜条件下培养细胞,使荧光素酶表达。
3. 收集细胞:离心收集细胞,并洗涤去除培养基中的荧光素酶抑制剂。
4. 检测荧光素酶活性:将细胞悬浮在检测缓冲液中,加入荧光素酶活性检测试剂,充分混匀后进行荧光检测。
5. 数据分析:通过荧光检测仪获取数据,并使用相关软件进行数据分析。
四、注意事项
1. 请在专业人员的指导下操作。
2. 避免直接接触试剂,以免对皮肤和眼睛造成刺激。
3. 试剂应存放在阴凉干燥处,避免阳光直射和高温。
4. 转染荧光素酶基因报告质粒时,应遵循无菌操作原则,避免交叉污染。
双荧光素酶报告基因检测系统-promega

Dual—Luciferase® Reporter Assay试剂准备Luciferase Assay Buffer II 10mlLuciferase Assay Substrate 1vialStop &Glo® Buffer 10mlStop &Glo® Substrate,50X 200ulPassive Lysis Buffer (PLB),5X 30ml1.1X PLB:加1体积的5X Passive Lysis Buffer (PLB)到4体积的dH20中,40C保存(一个月)。
R II:将Luciferase Assay Substrate重悬于10ml Luciferase AssayBuffer II 中(—200C保存1个月,-700C保存1年)。
3.1X Stop &Glo 试剂:1体积50X Stop &Glo® Substrate加入49体积的Stop & Glo® Buffer中(-200C保存15天)。
(每次试验需要100ul)细胞处理1. 吸除细胞培养液2. 1X PBS轻柔的冲洗细胞3. 加入1X PLB(推荐用量)4.细胞溶解室温条件下,轻摇细胞15min,瞬时转染和报告基因实验采用脂质体介导技术转染。
重组质粒分别为p-629/+100,p—401/+100,p—238/+100,p-80/+100,p—25/+100。
pGL3- basic为阴性对照;同时以转染phRL-tk(海肾荧光素酶)作内对照。
具体转染方法参照转染(Polifectamine Reaent)说明书进行。
1。
将质粒DNA(3。
2µg)与phRL-tk (0。
8µg)按1:4混合后为A液,混匀30s,PolyFect(QIAGEN)与无血清无抗生素的DMEM按1:50混匀后为B 液,混匀30s;2。
A+B混匀(B加入A)15s,室温下孵育5—10 min;3. 吸出六孔板中的培养液,用无血清无抗生素的DMEM洗3遍,然后加入AB混合液,每孔0。
双荧光素酶报告基因分析promega

双荧光素酶报告基因分析1. 介绍荧光素酶报告基因表达的转录调控常被用来研究培养细胞的生物学特性。
荧光素酶是理想的报告基因,因为哺乳动物细胞中不含内源性荧光素酶,一旦转录完成立刻就生成功能性的荧光素酶。
Dual-Luciferase®双荧光素酶报告基因检测系统中含有在同一细胞中同时表达的两种荧光素酶。
通常,报告基因实验中往往会受到各种实验条件的影响,共转染的“对照”报告基因会作为内对照,为试验提供一基准线。
实验报告基因经过内参照的处理可以减小细胞活性和转染效率对实验的影响,因此双报告系统减少了外部干扰,使得实验数据更可信。
实验中报告基因和对照基因的酶没有种源同源性,萤火虫荧光素酶和海肾荧光素酶对应不同的反应底物,反应中没有任何的交叉干扰。
萤火虫荧光素酶底物和海肾荧光素酶底物分别与检测试剂反应可以使灵敏度最大化。
由于超强的光信号和超高的信噪比,本系统被广泛用于制药和生物技术产业中。
双荧光素酶报告基因检测系统适配于各种培养哺乳细胞的培养基,如1640,MEM,DMEM,F12等。
这些试剂与被动裂解液所附带的试剂盒,可以从Promega试剂盒中分开,单独使用。
具有超高灵敏度和超宽线性范围的Veritas™微孔板发光检测仪特别适合DLR 报告基因检测系统,Veritas™软件中预装了DLR 的检测程序使得安装更为方便,内置自动加样器使得应用更为简单。
Veritas™微孔板发光检测仪使用荧光素酶检测试剂II (LAR II)最低可以检测到1X10-19 mol 荧光素酶分子,使用Stop & Glo®试剂可以检测到1X10-18 mol 海肾荧光素酶分子,检测线性范围分别为8 和6 个数量级。
所有的检测均采用纯化的重组萤火虫荧光素酶(E1701)和纯化的重组海肾荧光素酶。
图1-3 使用Promega 公司Dual-Luciferase®双荧光素酶报告基因检测系统,萤火虫荧光素酶(1x10-19 到1x10-11 mol)和海肾荧光素酶(1x10-14 mol)在Modulus™仪上测量结果。
双荧光素酶报告基因检测系统原理

双荧光素酶报告基因检测系统原理下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!双荧光素酶报告基因检测系统的原理与应用一、引言在生命科学研究中,报告基因检测系统是一种广泛使用的工具,用于研究基因表达调控、蛋白质互作以及信号转导通路等生物学过程。
双荧光素酶报告基因检测系统的开发

Dual-luciferase reporter assay kit(1) Promega公司双荧光素酶报告基因(DLR TM)检测系统试剂盒组分:Promega的DLR TM检测试剂盒专利给出了Luciferase assay bufferII和Stop & Glo® buffer的相关组分和浓度范围,没有具体的数值。
我在专利和文献中也没有找到针对DLR TM检测试剂盒中的passive lysis buffer的成分。
Assay protocol:(2) 文献中用到的几种非商业性双荧光素报告基因检测系统细胞裂解液(cell lysis buffer)配方:(a)源自promega公司的单荧光素酶报告试剂盒:T ris-phosphate(PH7.8)25mMEGTA or EDTA2mMDTT2mMBSA1mg/mlTriton X-1001%Glycerol10%(b) Make the following stock solutions.1M HEPES pH 8 (室温RT)1M DTT (4℃)100mM MgCl2 (RT)裂解液第二种配方(100ml体系):来自/cgi-bin/prot/view_cache.cgi?ID=250710ml 1M HEPES PH80.5ml 1M DTT2ml 100mM MgCl22ml Triton X10085ml distilled water反应缓冲液:Firefly Luciferase Assay;Renilla Luciferase Assay Reagent。
a>“A noncommercial dual luciferase enzyme assay system for reporter gene analysis”文献作者给出了2种荧光素酶活性检测的反应试剂配方,并与promega公司试剂盒进行了效果比较,检测效率和灵敏度都很高,不逊于promega产品。
双荧光素酶报告基因检测系统-promega

Dual-Luciferase® Reporter Assay试剂准备Luciferase Assay Buffer II 10mlLuciferase Assay Substrate 1vialStop & Glo® Buffer 10mlStop & Glo® Substrate, 50X 200ulPassive Lysis Buffer (PLB), 5X 30ml1.1X PLB: 加1体积的5X Passive Lysis Buffer (PLB)到4体积的dH0中,40C2保存(一个月)。
R II:将Luciferase Assay Substrate重悬于10ml Luciferase Assay BufferII 中(-200C保存1个月,-700C保存1年)。
3.1X Stop & Glo 试剂:1体积50X Stop & Glo® Substrate加入49体积的Stop& Glo® Buffer中(-200C保存15天)。
(每次试验需要100ul)细胞处理1. 吸除细胞培养液2. 1X PBS轻柔的冲洗细胞3. 加入1X PLB(推荐用量)4.细胞溶解室温条件下,轻摇细胞15min,瞬时转染和报告基因实验采用脂质体介导技术转染。
重组质粒分别为p-629/+100,p-401/+100,p-238/+100,p-80/+100,p-25/+100。
pGL3- basic为阴性对照;同时以转染phRL-tk(海肾荧光素酶)作内对照。
具体转染方法参照转染(Polifectamine Reaent)说明书进行。
1. 将质粒DNA(3.2µg)与phRL-tk (0.8µg)按1:4混合后为A液,混匀30s,PolyFect(QIAGEN)与无血清无抗生素的DMEM按1:50混匀后为B液,混匀30s;2. A+B混匀(B加入A)15s,室温下孵育5-10 min;3. 吸出六孔板中的培养液,用无血清无抗生素的DMEM洗3遍,然后加入AB混合液,每孔0.8mL;4. 6h后,加入2mL完全DMEM;5. 24h后,倒出旧培养液,换为完全DMEM;6. 100µg H2O2或B(a)P处理lh或24h;(200 µM MMS,24h-溶解于Me2SO, Sigma);(H2O2不引起OGG1升高)7. 采用Promega公司的双报告基因检测试剂盒检测荧光素酶活性,检测仪器为化学发光仪(30IOC化学发光测定仪),所有实验严格平行操作。
双荧光素酶系统实验操作步骤及方法

启动子-Luc
转染细胞
刺激物处理 未处理对照
LUC
细胞内目的基因 的转录被激活
启动子
测得的荧光值
启动子-Luc的 启动子被激活
Luc的转录 Luc表达量
➢ 同时,为了减少内在的变化因素(如:培养细胞的数目 和活力的差别,细胞转染和裂解的效率等)对实验准确 性的影响,将带有海肾荧光素酶基因(Rinilla luciferase )的质粒(phRL-TK)作为对照质粒与报告基因质粒共 转染细胞,提供转录活力的内对照,使测试结果不受实 验条件变化的干扰。
Protocols Run Promega Protocol DLR-O-INJ OK 3.将50μl LAR II加入1.5ml EP管中(专用的进口EP管),取
10μl 细胞裂解液加入装有LAR II的1.5ml EP管中,吹打2-3 次混匀(尽量不要吹出气泡),置于检测仪,点击 “Measure” 开始读数(为萤火虫荧光素酶反应强度)。( 使用前LAR II要混匀,并平衡到室温)
4. 测量结束后,取出EP管,再加入50μl Stop & Glo® Reagent ,吹打2-3次混匀(尽量不要吹出气泡),再次置于检测 仪,点击“Measure” 开始读数(为内参海肾荧光素酶反应 强度)。(Stop & Glo® Reagent 现配现用,不能保存)
5. 记录读数: 每个样品会有3个数值:RLU1——萤火虫荧光 素酶反应强度, RLU2——内参海肾荧光素酶反应强度, Ratio——RLU1/ RLU2。一ห้องสมุดไป่ตู้记录Ratio 值即可,但RLU1 和RLU2为实际荧光强度值,可以反映细胞的转染效率, 也可根据实际荧光强度来调整报告质粒与内参的比例。
双荧光素酶报告基因检测

双荧光素酶报告基因检测: 一种结合萤火虫和海肾荧光素酶检测的先进辅助报告基因技术(原文在Promega notes 57第2页)摘要在用萤火虫荧光素酶定量基因表达时,通常采用第二个报告基因来减少实验误差。
但是,传统的辅助报告基因(例如,CAT,β-Gal或GUS)却不够便利,因为各自的检测化学,操作要求,测量特点有很多不同之处。
普洛麦格公司提供一种先进的双报告基因技术,是萤火虫荧光素酶检测和海肾荧光素酶检测的组合。
使用双荧光素酶报告基因检测系统,再结合一套pRL(或phRL、phRG)载体系统,即表达第二个报告基因海肾荧光素酶的载体系统,就可以在单管中进行双荧光素酶报告基因的检测,极为快速、灵敏、简便。
系统还提供被动裂解液(PLB),用来裂解在多孔板中培养的哺乳动物细胞并定量溶解两种荧光素酶,不必要对每一个样品分别进行单独操作。
对于正在使用萤火虫荧光素酶报告基因载体的研究人员,双荧光素酶报告基因检测系统将使他们立即体会到该系统的便利。
介绍两个报告基因用在一个实验系统中,是为了进行相互测量,或称为比率测量。
通常一个报告基因作为内对照, 使另一个报告基因的测量结果正态化。
在测量基因表达时,双报告基因通常用于培养细胞的瞬时转染,即:一个含有实验用报告基因的载体与第二个作内对照的,含不同报告基因的载体共同转染培养细胞。
一般是将实验用报告基因与调控启动子偶联在一起,研究被调控基因表达的结构或生理基础。
报告基因表达活性的相对改变与偶联的调控启动子的转录活性的改变相关。
为了提供一个转录活性的内对照, 第二个报告基因与一个组成型启动子偶联,这个启动子不受各种实验条件变化的干扰。
通过这种方法, 有可能把可能削弱实验准确性的内在因素的变化降到最小, 这些内在因素包括:培养细胞的数目和健康状况的差别, 细胞转染和裂解效率的差别等。
使用萤火虫荧光素酶, 结合氯霉素乙酰转移酶(CAT), β-半乳糖苷酶(β-Gal), 或葡萄醛酸糖苷酶(GUS)的双报告基因, 近几年已普遍使用。
promega双荧光素酶说明书

promega双荧光素酶说明书摘要:I.引言- 介绍Promega 双荧光素酶报告基因检测系统- 说明该系统的应用领域和实验流程II.实验原理- 介绍荧光素酶报告基因检测技术的基本原理- 阐述Promega 双荧光素酶报告基因检测系统的技术优势III.实验操作- 详细介绍实验操作步骤,包括实验材料、实验方法等- 强调实验过程中需要注意的事项IV.实验结果分析- 介绍实验结果的检测方法和分析流程- 阐述实验结果的可靠性和准确性V.应用案例- 分享几个Promega 双荧光素酶报告基因检测系统在实际应用中的成功案例- 说明这些案例证明了该系统在研究中的重要性和可靠性VI.结论- 总结Promega 双荧光素酶报告基因检测系统的优点和应用价值- 展望该系统在未来的发展和应用前景正文:Promega 双荧光素酶报告基因检测系统是一种广泛应用于生物学、医学等领域的检测工具,它可以帮助研究人员快速、准确地检测基因表达和调控。
该系统采用了荧光素酶报告基因技术,通过荧光信号的强度来反映基因表达的水平,从而实现对基因表达的定量分析。
该系统的应用领域非常广泛,可以用于检测基因表达、基因调控、药物筛选、生物学通路研究等。
在实验流程上,首先需要将待检测的基因与荧光素酶报告基因构建成报告基因质粒,然后将质粒转染到目标细胞中,最后通过检测荧光信号的强度来定量分析基因表达水平。
Promega 双荧光素酶报告基因检测系统的技术优势在于,它采用了两种荧光素酶,可以同时检测两个基因的表达水平,从而提高了检测的准确性和可靠性。
此外,该系统还具有灵敏度高、检测速度快、操作简单等优点,深受广大研究人员的青睐。
在实验操作过程中,需要注意的事项包括:正确选择实验材料、准确设置实验条件、严格控制实验操作等。
只有做好这些细节,才能保证实验结果的可靠性和准确性。
实验结果的分析是整个实验的重要环节。
通过荧光信号的检测和分析,可以得到基因表达水平的数据,这些数据可以用于进一步的研究和分析。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•••••••••••••••••••
ORDERING /TECHNICAL INFORMATION:
Reagent Preparation
1.1X P L B :Add 1 volume of 55X P a s s i v e L y s i s B u f f e r (P P L B ) to 4 volumes of distilled water. Mix well. Store at 4°C (≤1 month).
2.L A R I I : Resuspend the lyophilized L
L u c i f e r a s e A s s a y S u b s t r a t e in L L u c i f e r a s e A s s a y B u f f e r I I (10ml for Cat.# E1910, E1960; 105ml for Cat.# E1980). Store at –20°C (≤1 month) or –70°C (≤1 year).3.S t o p & G l o ®R e a g e n t :
a.Add 2.1ml of 50X S
S t o p & G l o ®S u b s t r a t e to 105ml of S S t o p & G l o ®B u f f e r in the amber S S t o p & G l o ® R e a g e n t bottle provided. Vortex 10 seconds. Store at –20°C for 15 days.
b.For a smaller amount of 1
1X S t o p & G l o ® R e a g e n t :To the required amount of S S t o p & G l o ®B u f f e r , add 50X S t o p & G l o ®S u b s t r a t e to a final 1X concentration. (For example, add 0.2ml of 50X S
S t o p & G l o ®S u b s t r a t e to 10ml of S
S t o p & G l o ®B u f f e r to make a 1X solution of S S t o p & G l o ® R e a g e n t .)Cell Lysis
1.Remove growth media from cultured cells.
2.Rinse cultured cells in 1X PBS. Remove all rinse solution.
3.Dispense the recommended volume (below) of 1
1X P L B into each culture vessel.
Volumes of 1X PLB to Use in Step 3.Passive Lysis Active Lysis Plate Size 1X PLB Dish/Plate Size 1X PLB 6-well 500µl 100 × 200mm 1ml 12-well 250µl 60 × 15mm 400µl 24-well 100µl 35 × 12mm 200µl 48-well 65µl 6-well 250µl 96-well 20µl 12-well 100µl 4.Passive Lysis :Gently rock/shake the culture vessel for 15 minutes at room temperature. Transfer lysate to a tube or vial.**For automated applications, the DLR™ Assay is performed directly in the multiwell plate.
Additional protocol information is available in Technical Manual #TM040 or #TM046, available online at:
Cell Lysis
Remove growth media from cells.Rinse with 1X PBS.Add 1
1X P L B .Perform lysis.
Transfer to a new tube or vial.*
2866M A 02_0A
•••••••••••••••••••
ORDERING /TECHNICAL INFORMATION:
Dual-Luciferase ®and Dual-Luciferase ® 1000 Assay Protocols
Additional protocol information is available in Technical Manual #TM040 or #TM046, available online at:
Plate with ≤20µl of PLB Lysate/well.Dispense 100µl of L A R I I .Measure firefly luciferase activity.Dispense 100µl of S t o p & G l o ®R e a g e n t .Measure Renilla luciferase activity.
Assay with Manual or Single-Injector Luminometer
Predispense
100µl of L
L A R I I into luminometer tube.Program luminometer.
Transfer 20µl of PLB Lysate. Mix.Measure firefly luciferase activity.
Dispense 100µl of S t o p & G l o ®R e a g e n t .
Measure Renilla luciferase activity.
Assay with 96-Well Plate
Before you begin:
Set injectors 1 and 2 to dispense 100µl of L A R I I and S S t o p & G l o ®R e a g e n t , respectively.For measurements, use a 1- to 2-second delay and a 5- to 10-second read time.
(inside luminometer)
Repeat cycle for remaining wells in plate.
2864M A 02_0A
2865M A 02_0A。
